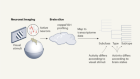
在世界范围内,有3600万人总视力丧失1。他们不能看到的形状甚至的光源。对大多数人来说,他们的失明源于可矫正的问题,如白内障——他们只是缺乏适当的卫生保健。然而,剩下的数百万盲的条件,目前没有有效的治疗方法。

自然的一部分前景:眼睛
“盲最改变生活的条件之一是一个人可以经历,”William Hauswirth认为说,在盖恩斯维尔的弗洛里达大学的眼科医生。以及流动性困难的原因在就业,视力损害与一系列健康问题,包括失眠、焦虑和抑郁,甚至自杀的风险。“恢复有用视力会让一个几乎难以想象的生活质量,改善“Hauswirth认为说。
在高收入国家,可预防视力损害的原因通常解决,失明的主要原因是视网膜变性。发现的眼睛,这个组织包含专门的细胞反应和处理视觉信号,因此视力的关键。感光细胞-神经元通常被称为视杆细胞和视锥细胞光罢工视网膜转化为电化学信号。这些信号然后过滤其他神经元的复杂网络,包括双极细胞、无长突细胞和水平细胞,神经元之前被称为视网膜神经节细胞。的长期预测,或轴突,这些细胞形成视神经,沿着从视网膜进行信号到大脑的视觉皮层,解释为图像的地方。
视网膜疾病通常包括感光细胞的损失,使得眼睛对光线的敏感度。在某些视网膜疾病,包括年龄相关性黄斑变性(AMD),这损失的结果失败的上皮细胞形成一层视网膜后面称为视网膜色素上皮(RPE)。RPE使感光细胞健康的清理与光反应过程中产生有毒副产品,以及通过提供营养。视网膜疾病中感光细胞保持良好,失明的主要原因是视网膜神经节细胞的退化。
在视力损害的原因使它更难以找到解决方案。但是一些领域的进步是提高希望几乎所有形式的视网膜疾病可能成为治疗。
一种方法是增加或绕过受损的眼睛功能的假肢。这种仿生眼目前可以恢复视力有限,但研究人员继续推进设备的功能。另一个选择是基因疗法。已经提供给人们与特定的基因突变,研究人员正在将这种方法扩展到更多的人,条件。一些科学家也追求治疗基于相关的被称为光遗传学技术,包括基因改变细胞恢复对视网膜光敏感度。这项工作还处于早期阶段,但研究人员希望这种方法最终将能够帮助各种各样的人,因为它是不可知论者视网膜变性的原因。和努力取代视网膜丢失或受损细胞,原位或通过细胞移植,甚至暗示晚期视网膜疾病可能最终成为可治的。
这些研究大多是处于起步阶段。但Hauswirth认为是乐观的,已经取得进展。十年前,他说,他经常不得不告诉病人,他可以为他们做什么。“许多此类疾病,完全改变了。”
仿生眼
近30年前,马克Humayun,南加州大学的生物医学工程师在洛杉矶,开始电刺激视网膜的失明。与同事合作第二视力公司医疗产品,医疗技术公司在这起案件中,加利福尼亚,他的实验表明,这种刺激可以诱发的视觉感知点的光称为光幻视。经过十年的工作在动物建立的电流可以应用安全,和带着大大增加知识的数量和类型细胞存在于人类视网膜退化,Humayun的团队准备开始和人打交道。从2002年到2004年,研究人员植入一种仿生眼的六人全部或几乎全部在一只眼睛失明——第一次审判。接受者的装置,称为Argus我报道能够感知光幻视,定向运动,甚至形状2。大约有300人现在通过设备经验世界的继任者,阿尔戈斯二号,2011年在欧洲监管机构批准用于患有色素性视网膜炎——一组罕见的遗传病,导致感光细胞退化。美国食品和药物管理局(FDA)两年后紧随其后。
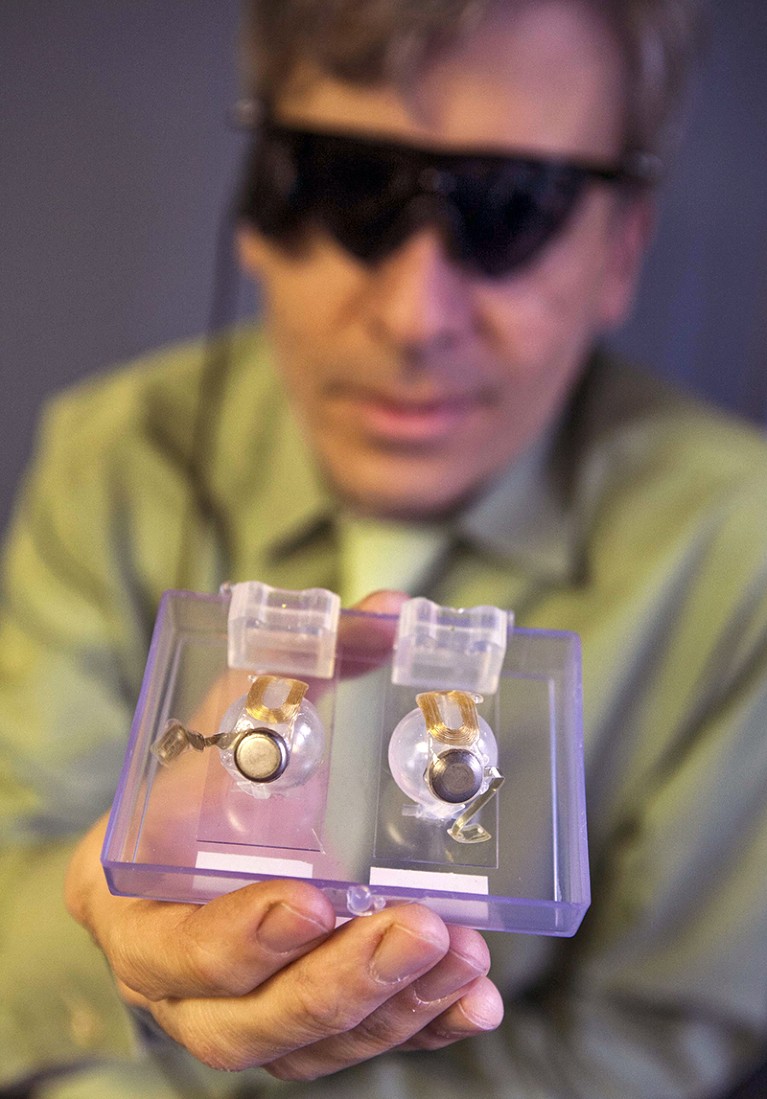
阿尔戈斯二号植入由一个电极阵列是附加到视网膜的表面。信贷:赵林格/祖马除
配备一个Argus II,病人接受手术将包含一个电极阵列芯片连接到视网膜的表面。“看到”的设备,一个微型摄像机安装在一副眼镜继电器信号处理单元,由收件人穿。处理器将信号转换成无线传输到植入设备的指令。然后电极刺激视网膜神经节细胞在视网膜前面。使用假体是一个学习的过程。接受者必须训练他们的大脑解读新类型的信息接收。因为摄像机不跟踪眼睛的运动,他们还必须学会移动头部将他们的目光。
该设备只提供了有限的视野。用户可以与高对比度探测光源和物体边缘,如门或窗户,和一些可以破译大字母。出现这些限制的部分原因在于设备的60个电极提供非常低的分辨率与数以百万计的感光细胞在一个健康的眼睛。但即使这最小的增强可以大大改善人们的生活。
而阿尔戈斯二号是一个外层表面植入——这意味着它是视网膜——其他设备开发设计被放置在视网膜。这些视网膜下植入物可以刺激细胞通常更接近那些介绍信号视网膜感光细胞。通过刺激细胞更高的视觉途径,研究人员希望保留更多的信号处理是由健康的视网膜。
视网膜植入城市罗伊特罗根的生物技术公司,德国,已经建立了一个视网膜下植入由二极管(半导体设备将光转化成电流)直接感觉光线进入眼睛。这消除了需要一个外部摄像机,自然让用户将他们的目光。权力是由手持单元,通过线圈,耳朵上方的皮肤下植入。αAMS,当前版本的系统,得到了监管机构的批准在欧洲用于患有色素性视网膜炎。
Pixium愿景在巴黎正在测试一种光伏视网膜下植入所谓的。系统项目信号从一个摄像机安装在眼镜使用近红外光线进入眼睛,波长的最佳驱动二极管在设备刺激视网膜细胞。投影图像以这种方式给用户一些控制他们的目光的方向,因为他们可以探索现场通过移动他们的眼睛。权力也提供的近红外光线,使手术植入无线和适合它那么复杂。”病人正在学习如何更快恢复视力,决议似乎更好,”说Jose-Alain萨赫勒地区,眼科医生在匹兹堡大学,宾夕法尼亚州,是谁在十人进行安全试验的装置与AMD。“这是早期,但是这是非常有前途。”
所有这些设备的工作只有当功能细胞保持在视网膜上。在常见的眼部条件下影响主要是感光细胞,包括色素性视网膜炎和AMD,通常有一些细胞刺激。但太多的视网膜神经节细胞死亡时,发生在先进的糖尿病性视网膜病变、青光眼等植入物不能帮助。没有任何剩余的人视网膜功能,是否由于疾病或损伤,另一种仿生的方法可能更相关。
Humayun和他的同事正在研究一个系统,绕过了眼睛直接向大脑发送信号。这不是一个新想法:在1970年代,美国生物医学工程师威廉Dobelle表明,直接刺激引发的视觉皮层的感知光幻视3。但现在仿生眼技术只是迎头赶上。第二视力公司开发了猎户座,系统,据Humayun说,“基本修改Argus二世”。类似于原始的,它使用一个视频摄像头和无线通信的信号处理器植入,但芯片放置在视觉皮层的表面而不是视网膜。正在测试的设备是在五人有限或没有光线感知由于眼部伤害或损害视网膜和视神经。“到目前为止,结果是好的,”他说。“我们没有任何惊讶。”
考虑到的一些技术已经尝试和测试人,Humayun相信该系统可以在几年内获得监管部门的批准。“很明显,脑部手术有不同程度的风险,但过程很简单,和猎户座可以帮助更多的病人,”他说。然而,更知道刺激大脑提供有用的视力。“我们知道很多关于视网膜但对大脑皮层,”罗斯卡说,神经生物学研究所的分子和临床眼科在瑞士巴塞尔。“但是我们永远不会知道足够的如果我们不试一试,”他说。
基因治疗
眼睛是基因治疗的理想目标。因为它是相对独立的,所使用的病毒携带基因进入细胞的视网膜不应该能够到身体的其他部位。因为眼睛是immunoprivileged站点,免疫系统不太可能发动防御针对这种病毒。
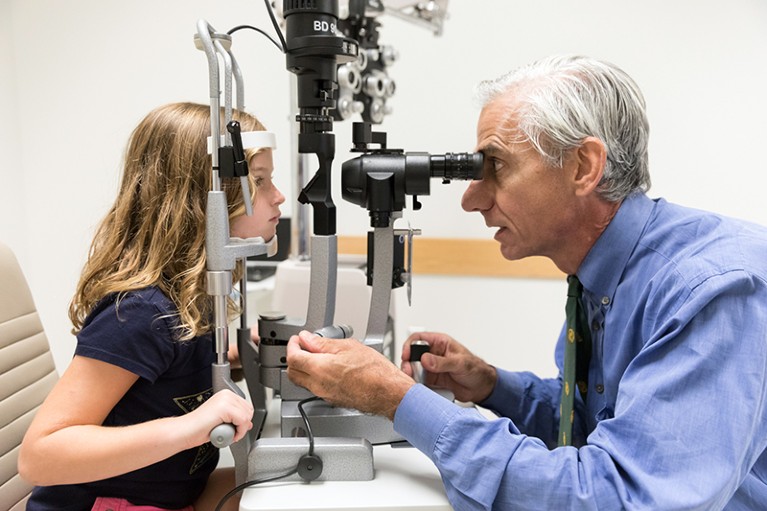
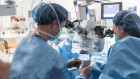
眼科医生艾伯特·马奎尔检查眼睛的女孩雷伯氏先天性黑内障的视线恢复了基因疗法voretigene neparvovec (Luxturna)。来源:费城儿童医院的
在第一个示范解决基因治疗的潜力失明,三个团队的研究人员利用该技术成功地治疗患有雷伯氏先天性黑内障(LCA)。这种继承的条件会导致严重的视力损害和开始在生命的头几年,经常体现为夜盲症发展到广泛的视力丧失,开始前在视野的边缘。它影响了约40000名婴儿。
研究人员着手解决一个特定形式的条件称为LCA 2。这是由突变引起的RPE65RPE所表达的基因。变异的基因RPE功能造成不利影响,进而损害感光细胞。2008年,三个团队,包括一个由Hauswirth认为,每个显示在早期临床试验提供健康的副本RPE65视网膜是安全的,并导致有限的改善视力4,5,6。III期临床试验由阿尔伯特·马奎尔,眼科医生在费城宾夕法尼亚大学,显示2017年8月,LCA 2接受治疗的人能更好地在各级障碍课程比那些没有照明7。2017年12月,美国食品药品管理局批准治疗,voretigene neparvovec (Luxturna),使其成为第一个基因疗法对于任何条件获得批准临床使用。
可以以这种方式对待LCA 2,因为涉及显示隐性基因突变的遗传模式。这意味着,一个人的份RPE65必须携带相关基因突变导致疾病。提供一个单一的、不突变版本因此修复这个问题。条件是由主遗传突变,然而,只需要一个变异的基因复制到清单。在大多数的这些,只需添加一个正常基因的副本不会帮助;相反,必须灭活突变基因。一种选择是沉默它通过添加特定的RNA分子,拦截的突变基因的指示错误的蛋白质,然后提供一个正常基因的副本接管其职责——一个方法称为抑制和替代。另一种方法是正确使用基因编辑技术CRISPR-Cas9突变。摩德纳大学的研究人员和Reggio Emilia在摩德纳,意大利,证明这种方法在视网膜色素变性的小鼠模型8在2016年。第二年,一个团队在美国用它来纠正某些基因发生突变,导致一种青光眼在老鼠和人类细胞培养9。
基因治疗进展的一个重要驱动力的腺相关病毒(AAV)提供替代基因细胞。装甲防护已被证明是安全的,在某种程度上,因为他们倾向于不整合到宿主细胞的基因组中,细胞癌变的风险减少到最低限度。和他们的小尺寸使他们分散广泛通过眼睛,因此感染大量的细胞。但装甲防护提供基因的能力限制:某些基因携带太大,装甲防护,包括ABCA4突变,从而导致黄斑变性疾病,黄斑变性的一种遗传形式。两个工作区被追求。第一个使用病毒更大的承载能力,如慢病毒,提供替代基因。这种方法的安全性和有效性是未知的,但临床试验正在进行中。第二个策略是打破两个和运输的替代基因一半分别进入细胞,一起将它们结合起来的一种手段。“这是在至少一个动物模型现在,“Hauswirth认为说。
不管方法,基因治疗有相当大的局限性。超过250个基因与失明,因为每个可以受到众多类型的突变的影响,潜在治疗靶点的数量是巨大的。例如,超过100的突变基因ρ导致色素性视网膜炎,最常见的遗传性视网膜疾病居多。开发每一个变异的基因治疗是不实际的,Hauswirth认为说。
研究人员正致力于一个潜在的解决方案,使一个转折suppression-and-replacement方法。而不是针对的副本ρ包含一个特定的突变,都用沉默RNA抑制基因的表达,是否ρ是否突变,而交付替代免疫沉默RNA的复制。领导的研究小组简法勒,三一学院遗传学家,都柏林,显示这一战略的承诺在2011年显性视网膜色素变性的小鼠模型10。Hauswirth认为,2018年和他的同事们检测狗色素性视网膜炎的方法11。他们表明,变性的视网膜的感光细胞在治疗区域可以停止——一项改进,持续至少八个月。这种策略解决所有的突变会导致主在一个治疗遗传性视网膜色素变性,因此扩展了基因疗法从隐性居多的遗传条件“相当简单的方式”,Hauswirth认为说。他打算研究如何得到治疗狗可以导航一个迷宫,并收集所需的安全数据开始临床试验。
光遗传学
基因治疗只适用于那些失明是由基因突变引起的。也不适合解决晚期视网膜疾病,一个细胞的数量不足有待修复。但是一个相关的方法基于一种光遗传学技术障碍不可知论者,可能会导致治疗的不同阶段变性。在光遗传学,基因使细胞产生光敏蛋白质被称为视蛋白是由一种病毒。介绍视蛋白可以恢复一些感光性受损细胞,甚至让其他视网膜细胞,包括视网膜双极细胞和神经节细胞,对光线很敏感。
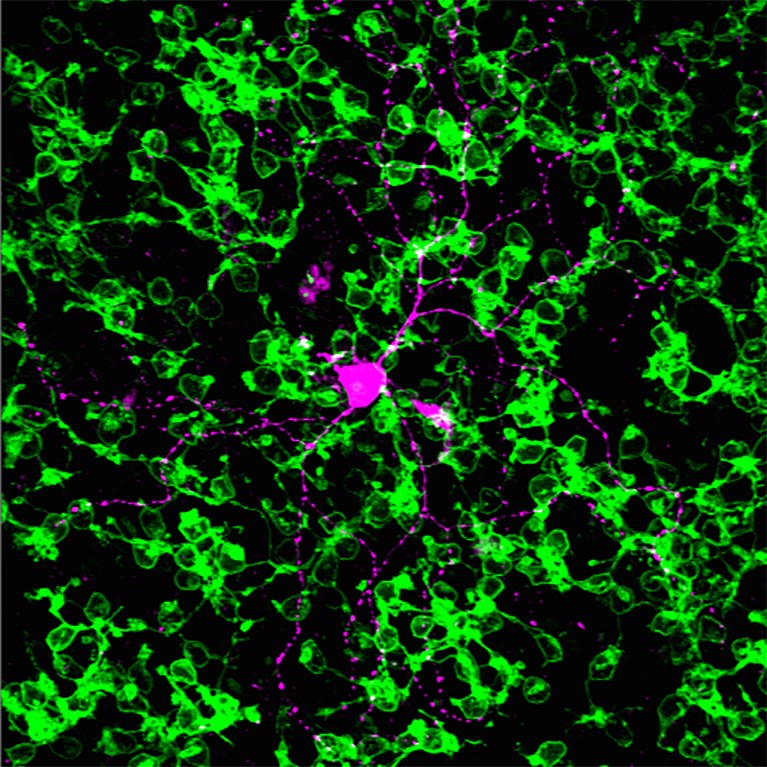
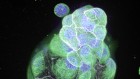
光遗传学被用来恢复光敏感视锥细胞(绿色)小鼠模型的色素性视网膜炎;这项技术的成功是评估通过测量视网膜神经节细胞的活动(红色),由锥刺激的反应。信贷:IOB.ch
问题是,然而,而感光细胞的眼睛可以应付各种各样的光强度,工作在明亮的阳光下和暮光之城——视蛋白都有一个有限的范围,通常在高光照强度的性能好。一个潜在的解决方案是使用一种有效的设置类似于Pixium视觉的仿生眼系统,配备接受者的眼镜,将摄像头捕捉用户的视图和一个投影仪,点到他们的眼睛。与表面上一样,好处是,光线进入眼睛的性质可以根据视网膜的修改;然而,在这种情况下,强度和波长选择的是那些最好的驱动新引入的视蛋白而不是植入光敏二极管。
GenSight生物制剂,在巴黎的一家生物技术公司,它的创建者,荒漠草原和博通已经测试这样一个系统。它的目标是提供一个视网膜神经节细胞的视蛋白,但有一个潜在的障碍:视网膜神经节细胞天生敏感。他们表达黑视素,蛋白质参与瞳孔光反射,眼睛的瞳孔收缩的亮光。为了避免触发,GenSight研究人员使用的是一个视蛋白,对红色的波长的光,因为视网膜优先响应光光谱的蓝端。该公司2018年10月开始早期临床试验在先进的色素性视网膜炎患者最小剩余的景象。审判将涉及军团从英国、法国和美国,初步结果预计将在2020年底。
“这是一个简单的方法,我们必须看看将会上涨,“博通说。“然后,我们可以搬到更多和更复杂的方法。“的一个问题是,许多optogenetic技术可以治疗的疾病包括视网膜变性的特定部分,保留有用的愿景是在其他领域。驱动视蛋白是可见的光,剩下的自然视觉干扰。在未来,视蛋白,对近红外光线可能会使光遗传学治疗配合自然视觉残留。
细胞再生
干细胞疗法可以治愈失明甚至在疾病的晚期。因为干细胞可以被诱导成任何类型的细胞,它们可以用来种植新鲜视网膜细胞移植到眼睛来取代那些已经失去了。然而,在动物身上的研究表明只有一小部分移植神经元能够正确地集成到视网膜的复杂的神经回路。这是一个相当大的障碍,旨在取代视网膜神经元干细胞治疗。
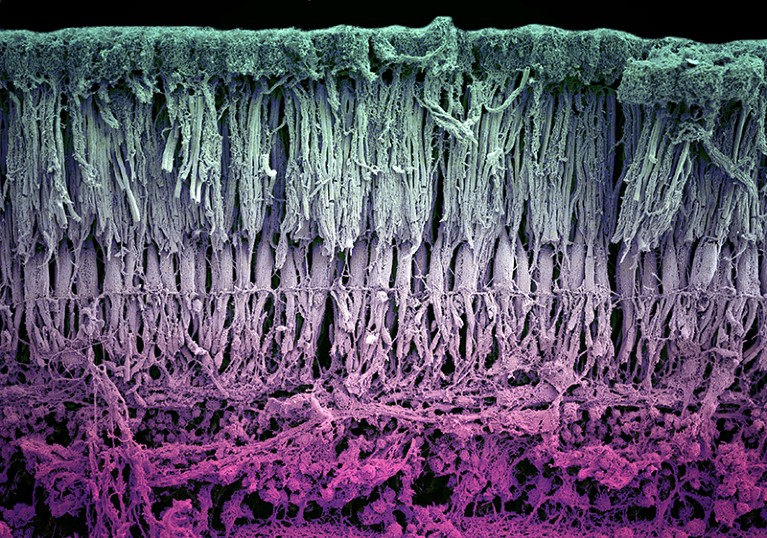
视网膜的细胞结构包括层次复杂的光感受器(绿色)和血管和神经(红色)。信贷:路易斯·休斯/ SPL
构成视网膜色素上皮细胞,另一方面,坐在外面视网膜的电路。干细胞为基础的治疗前景因此持有大多数条件,如AMD和色素性视网膜炎,导致RPE细胞退化。“光感受器来连接电路,但视网膜色素上皮不“博通说。“这就是人们最亲密的进步。”一开始,研究人员尝试注入视网膜与stem-cell-derived RPE细胞悬浮,但很少在他们需要的地方。一些球队现在认为更好的方法是RPE细胞移植到眼睛的表,然后在位置可以使支架的生物相容性。“脚手架的方法是一个巨大的进步,与悬架相比,RPE细胞,“萨赫勒说。
2018年3月,伦敦大学学院合作项目治愈失明——伦敦,在伦敦眼科医院——宣布第一阶段试验的结果是一张RPE细胞植入两个湿性AMD患者的视网膜(一种罕见的、严重形式的AMD涉及异常生长和血管渗漏)。两人容忍的过程,能够读字母读图21比治疗前12。次月,Humayun领导的研究小组报告了类似的阶段我和干AMD导致5人,更常见的情况13。这些初步的结果充满了希望。“这使得很多兴奋,“Humayun说。但研究结果需要确认更多的III期试验参与者,和Humayun警告说,治疗可能多年远离使用在诊所,因为没有干细胞治疗视网膜疾病还没有通过审批流程。
一个相关的方法,还在基础研究的早期阶段,可能实现的希望取代丢失的神经元,打开门来治疗各种眼疾。在人类中,成熟的神经元不分裂,因此不能再生,使恢复视力特别困难。但相同的所有的动物都是不正确的。爬行动物和某些鱼类可以再生视网膜神经元,鸟类也表现出一些再生能力。托马斯盐土,西雅图华盛顿大学的神经学家,试图解开人类的这种能力。但与其移植细胞在实验室里,盐土旨在诱导细胞在视网膜上已经分化成新的神经元。
2001年,盐土建议穆勒视网膜神经胶细胞-细胞提供结构和支持它的功能,是新神经元的源头,已经观测到的鱼和鸟14。然后他和他的团队着手找出穆勒神经胶质是否可以用于生成新的神经元在老鼠身上。2015年,他们工程小鼠Ascl1,一种蛋白质,这种蛋白质是重要的生产中神经元鱼,然后破坏动物的视网膜15。他们希望Ascl1穆勒将会引发神经胶质转变成神经元。
实验未能在成年小鼠产生新的神经元,但成功的年轻老鼠。派遣Jorstad,生物化学家和博士生盐土的团队,提出化学修改染色质(复杂的DNA、RNA和蛋白质)在细胞核成熟细胞基因的发展可能会屏蔽使穆勒神经胶质转变成神经元。2017年8月,盐土的团队表明,通过引入一种酶,这种酶逆转这样的修改,他们可以诱使Muller神经胶细胞分化16。“第一次,我们可以再生神经元在成年小鼠,“盐土说。“这些年来我很激动。“尽管他们不是真正的感光细胞,看起来更像是双极细胞,神经元连接到现有的电路,并对光线很敏感。“我很惊讶他们连接以及他们所做的,”盐土说。

更多的从自然前景
虽然远非准备治疗视网膜疾病的人,工作有巨大的潜力。下一步将是重复研究动物的眼睛,更类似于人类。盐土的团队已经开始和非人类的灵长类动物的视网膜细胞培养。研究人员还需要解决如何直接分化过程产生特定的细胞类型,如视杆细胞和视锥细胞。“现在我们已经有了我们的脚neuron-making业务,锥就太好了,”盐土说。
如果成功,可以广泛适用的方法。“最终,这将是所有这些眼病治疗,“盐土预测。“这是很有意义的。你不必担心被移植。你的细胞是正确的,你需要他们。”
Humayun也鼓励工作。“我鼓励任何人用一个新的好主意,”他说。“这是很早的,高风险,但永不说永不。这就是我所学到的。”


 打破了近视的神话
打破了近视的神话 哺乳动物的眼睛露出一个黑暗的过去
哺乳动物的眼睛露出一个黑暗的过去 一个聪明的解决视力问题
一个聪明的解决视力问题 人工智能是如何帮助预防失明
人工智能是如何帮助预防失明 机诊断
机诊断 照明设计更好的健康和福祉
照明设计更好的健康和福祉 眼睛暗示隐藏的心理健康状况
眼睛暗示隐藏的心理健康状况