帕金森氏症患者经常接受各种类型的治疗来改善他们的运动功能。图片来源:Amelie-Benoist/BSIP/科学图片库
最近的有争议的批准美国食品和药物管理局(FDA)对阿尔茨海默病药物aducanumab的最新研究表明,该机构现在可能更愿意对一系列神经退行性疾病进行快速治疗,这些疾病迄今为止一直困扰着药物开发人员。但一个独立的顾问小组强烈质疑这种新药的有效性,研究人员对aducanumab铺平的潜在更顺利的批准道路是否真的能为患有肌萎缩性侧索硬化症(ALS)、亨廷顿舞蹈症和帕金森病的人提供有用的治疗方法存在分歧。
近年来,包括位于加州千橡市的安进(Amgen)和总部位于纽约的辉瑞(Pfizer)在内的药物开发公司都关闭了它们的神经科学项目,原因是很难找到治疗脑部疾病的成功疗法。因此,印第安纳州Zionsville的药物开发顾问Eric Siemers认为,aducanumab的批准可能会带来新的投资和创新。
阿尔茨海默氏症标志性药物批准令研究界困惑
根据他与投资者和客户的交谈,他表示,潮流已经开始转向。“现在人们对神经退行性疾病的研究有了更多的兴趣,”锡默斯说,他也是位于弗吉尼亚州夏洛茨维尔的阿尔茨海默氏病公司Acumen Pharmaceuticals的首席医疗官。在aducanumab获批几天后,Acumen提交了首次公开募股(ipo)的文件。
一些倡导组织也受到鼓励,代表那些几乎没有或没有治疗选择的绝望患者。ALS协会的首席任务官尼尔·塔库尔说:“如果FDA能找到一种对阿尔茨海默氏症灵活的方法,也许他们也能找到一种对ALS灵活的方法。”
但许多研究人员担心,这一监管先例将虚假的希望置于坚实的临床科学之上,并在此过程中伤害患者。“考虑这种方法的人应该深呼吸,洗个冷水澡,”加州大学伯克利分校创新基因组学研究所科学主任费奥多尔·乌尔诺夫(Fyodor Urnov)说,他曾是加州布里斯班Sangamo Therapeutics公司的药物研究人员。
“我不希望未来我们有多种处方药。我希望未来我们有多种有效的处方药。”
言外之意
Aducanumab是由马萨诸塞州剑桥市的生物科技公司Biogen开发的,它通过了一条不同寻常的途径获得批准。2019年3月,在中期分析显示该药物不太可能改善轻度阿尔茨海默氏症患者的认知能力后,Biogen停止了该候选药物的两项III期试验。但当Biogen重新评估数据,发现其中一项试验中的一部分人可能受益时,它改变了方向;该公司于2020年提交了aducanumab申请批准。
大脑中的“误伤”会引发阿尔茨海默病吗?
FDA最终决定无视其咨询委员会的建议并批准该药物,它说,是基于aducanumab降低大脑中淀粉样斑块水平的能力——一些科学家认为导致阿尔茨海默氏症的蛋白质团块。
FDA没有授予该药物标准审批,而是选择了“加速审批”途径。标准审批通常只授予那些在大型III期临床试验中证明对患者有益的药物。这是针对那些“合理可能”但不确定能帮助患者的治疗方法。
该机构已经在癌症中采用了这一途径,利用小型II期试验的结果,为少数晚期疾病患者的药物开绿灯。对于aducanumab, fda已经表明它愿意将这种模式推广到更广泛的人群。这一决定受到批评的一个原因是,淀粉样斑块水平的降低是一种未经验证且有争议的药物活性标志。
在其他阿尔茨海默氏症候选药物的大型试验中,降低淀粉样蛋白并没有带来认知方面的好处,这成为了研究人员的一个棘手问题。
关于可传播阿尔茨海默氏症的激烈争论
现在,百健每年可以向美国600万处于不同疾病阶段的阿尔茨海默氏症患者销售这种价值5.6万美元的药物。作为加速批准的条件,该公司必须在2030年之前报告“上市后”试验的结果,以证明该药物对认知的益处。
内部备忘录FDA上周发布的解释一下这个决定。临床审稿人认为aducanumab可能提供认知益处,而统计审稿人表示数据不支持批准。
问自然在详细说明对帕金森病、亨廷顿病和渐冻症的影响时,FDA的一位发言人回答说:“FDA随时准备与研究界和药物开发商合作,研究更多针对阿尔茨海默病和其他神经退行性疾病的治疗方法。”
FDA高级官员Patrizia Cavazzoni对aducanumab的广泛影响表示认可。她在一次新闻发布会上说:“加速批准途径在肿瘤学领域是一个非常有用的工具。”“我们认为这是一个模型,我们希望可以在神经退行性疾病中复制。”
一线希望?
一种神经退行性疾病的治疗可能受益于aducanumab的批准,这是帕金森病,在美国约有100万人受其影响。虽然已批准的药物有助于缓解这种疾病的症状,但这些药物都不能减缓其发展。对于德克萨斯州休斯顿贝勒医学院的神经学家约瑟夫·扬科维奇(Joseph Jankovic)来说,更灵活的药物开发方法可以加快进展。
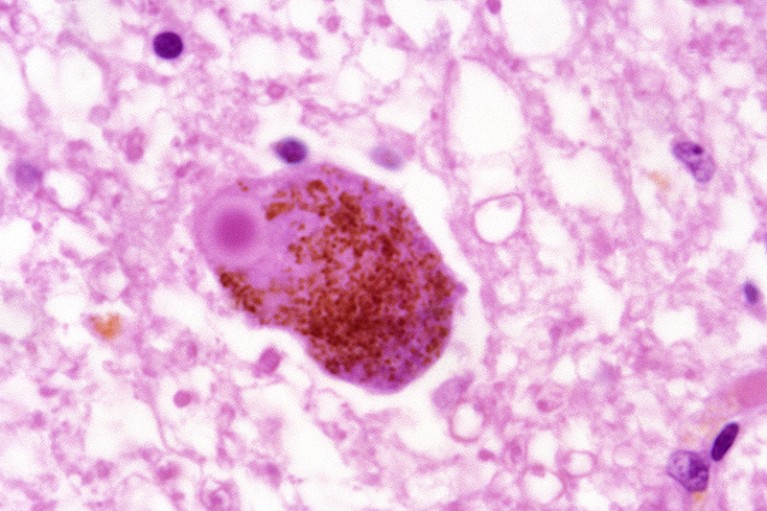
蛋白质α-突触核蛋白在帕金森氏症患者的大脑中形成了这样的沉积物。图源:J. J.豪,ISM/科学图片库
扬科维奇说,批准aducanumab“是FDA有史以来做出的最糟糕的决定之一”,他不相信这种药物的好处大于风险。但他认为,加速批准确实对提供更好疗效暗示的药物有价值。“我总是在看半杯水。我希望这能让FDA在审查其他疾病的药物时软化态度。”
他关注的是能够清除α-突触核蛋白的候选药物,α-突触核蛋白是帕金森患者大脑中积累的一种蛋白质。
Jankovic解释说,最近一项名为prasinezumab的α-synuclein靶向抗体的II期试验未能全面缓解帕金森病的症状,但它延缓了患者颤抖、僵硬和行动迟缓的恶化。此后,位于瑞士巴塞尔的药物开发合作伙伴罗氏(Roche)和位于都柏林的Prothena已经启动了一项更大规模的II期试验,以观察候选药物对运动功能的益处。
预计结果将在2023年公布,届时该项目可能会测试FDA在神经退行性疾病方面的决心。“在我看来,如果II期研究是积极的,FDA应该认真考虑批准这种药物,”Jankovic说,他是抗体试验的调查员和Prothena的顾问。
监管门柱
亨廷顿舞蹈病是一种遗传性神经退行性疾病,会导致美国3万人不自主地抽搐和痴呆,这是另一种值得关注的疾病。患有这种疾病的人携带一种名为亨廷顿蛋白(HTT)的突变有毒蛋白质,因此研究人员开发了候选药物来降低其水平。
其中最先进的是由罗氏和Ionis制药公司开发的tominersen,它能将脑脊液中的突变HTT降低44%。Tominersen于2018年进入III期试验。今年3月,在患者病情恶化后,罗氏公司提前停止了这项试验。
感染是否是阿尔茨海默病的种子?
然而,降低http的药物还没有被淘汰。以其他形式的HTT为目标的候选药物仍可能减缓疾病。如果罗氏对tominersen数据的持续分析发现了任何积极的趋势,该公司将不得不决定如何继续——以及aducanumab是否提供了一个可以复制的模型。
但对乌尔诺夫来说,tominersen的失败是FDA不应该批准使用淀粉样斑块或HTT等监管目标的药物的一个主要例子。
乌尔诺夫说:“这将损害安全、有效、被批准的治疗神经退行性疾病药物的前景。”“我们的领域不应该这样运作。这不是我们当初签约时想做的事。”

 阿尔茨海默氏症标志性药物批准令研究界困惑
阿尔茨海默氏症标志性药物批准令研究界困惑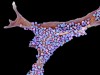 感染是否是阿尔茨海默病的种子?
感染是否是阿尔茨海默病的种子? 关于可传播阿尔茨海默氏症的激烈争论
关于可传播阿尔茨海默氏症的激烈争论 大脑中的“误伤”会引发阿尔茨海默病吗?
大脑中的“误伤”会引发阿尔茨海默病吗?