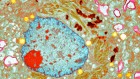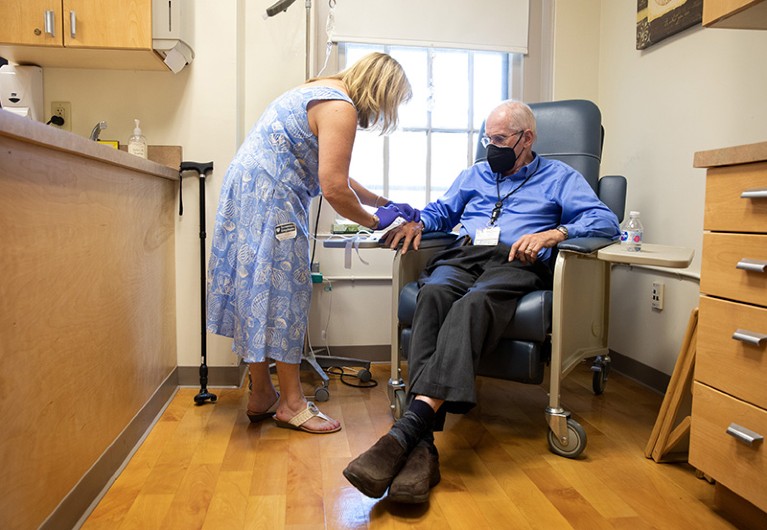
2021年5月,一名临床试验参与者接受输注Biogen的aducanumab。图源:Kayana Szymczak/纽约时报/Redux/eyevine
今年6月,美国食品和药物管理局(FDA)批准了生物技术公司百健(Biogen)用于治疗阿尔茨海默病的药物,监管机构希望借此开启治疗这种神经退行性疾病的新时代。但这一决定是在一个独立咨询委员会几乎一致投票否决这种名为aducanumab的药物之后做出的相反,它分裂了社区.一些研究人员认为,批准将促进治疗脑部疾病药物的开发,但另一些人则认为这是FDA诚信的一个污点,是进步的障碍。
位于印第安纳波利斯的礼来制药公司希望其与aducanumab原理相似的抗体donanemab能够获得更好的接受度。该公司计划在未来几个月内完成向FDA提交候选药物的审批,为2022年下半年的决定铺平道路。与此同时,总部位于马萨诸塞州剑桥市的Biogen公司和总部位于东京的Eisai公司正在加紧完成另一个竞争对手lecanemab的数据提交。这些有望治疗的药物的监管命运可能预示着阿尔茨海默病的未来制定神经退行性药物开发计划好多年了。
上周在波士顿举行的阿尔茨海默病临床试验(CTAD)会议上,研究人员讨论了候选药物,自然回顾每个人问的问题。
降低淀粉样蛋白的药物对患者有帮助吗?
根据阿尔茨海默病的“淀粉样蛋白假说”,一种叫做淀粉样蛋白β的蛋白质在大脑中的积聚会导致神经退行性变。Aducanumab和它的潜在竞争对手清除大脑中的淀粉样蛋白-β团块。但临床试验并没有有意义地证明这些疗法可以减缓记忆丧失或认知能力下降。这是aducanumab的一个特别的争论点,aducanumab是一种抗体药物,目前在市场上的价格约为每年5.6万美元,尽管过早停止了III期试验,并且提交批准的数据集混乱。
阿尔茨海默氏症标志性药物批准令研究界困惑
一些人希望礼来的donanemab试验最终能提供益处的证据。第一个是一项为期18个月的II期试验,名为Trailblazer-Alz,共招募了257人。它显示1接受抗体的人的认知能力比接受安慰剂的人下降得更慢。平均差距为3.20分(总分144分)。
对于礼来神经科学研发高级副总裁马克•明顿(Mark Mintun)来说,这个信号很有希望。他说,在研究过程中,接受治疗的患者避免了大约6个月的认知能力下降。他推测,随着donanemab使用时间的延长,参与者可能受益更多。
然而,伦敦大学学院的精神病学家罗布·霍华德(Rob Howard)并不这么认为。他说,观察到的3.20个百分点的差异是“微不足道的”。aducanumab和lecanemab数据的最佳情况解释表明相似的边际效应。他补充说,仿制的多奈哌齐(donepezil)比抗体的效果更好,多奈哌齐是一种已有25年历史的阿尔茨海默病药物,它治疗的是症状,而不是疾病的根本原因。
加州斯坦福大学负责神经科学临床试验的神经学家莎伦·沙(Sharon Sha)说,需要更多的数据来评估这些药物的临床效用。“我们真的需要确保(这些抗体)正在改变患者的日常生活或保持他们的稳定,”沙说,他是这三种疗法试验的研究人员。
什么时候能有可靠的数据证明这些疗法是否能改善认知?
FDA批准aducanumab的条件之一是,Biogen必须进行“验证性试验”,以确保这种抗体确实能帮助人们。这家生物技术公司还没有启动这项试验,FDA给了它9年的时间来收集结果——这么长的时间导致了对该药物批准的喧嚣。
对于费城宾夕法尼亚大学的生物伦理学家Ezekiel Emanuel来说,这些数据需要尽早得到。他在《美国医学会杂志》(JAMA)上写道,应该更新加速审批途径,要求更快地收集高质量的确认性数据2.

有争议的阿尔茨海默病药物批准可能会影响其他疾病
假设FDA使用相同的加速审批途径批准donanemab,礼来也必须确认其抗体的益处。该制药公司正在对1500名患者进行一项名为多纳单抗开拓者- alz2的III期试验,用于早期阿尔茨海默氏症患者。结果将于2023年上半年公布——在抗体可能获得批准之后——并可能提供所需的数据。另一项III期试验正在招募3300名有阿尔茨海默氏症风险的患者,以测试早期使用抗体是否能延缓痴呆症的发生。该试验将持续到2027年。
这些研究的结果可能有助于修复一个分裂的领域。“(aducanumab的批准)能做得更好吗?我想每个人都同意,这本来可以更有效地展开,”Mintun说。“但随着数据的积累,人们会越来越信服,我认为,分歧将会消失。”
FDA会批准抗淀粉样抗体吗?
aducanumab的加速批准为其他药物树立了先例。FDA可以批准阿尔茨海默氏症药物,因为它们能够从大脑中去除淀粉样蛋白β,而没有明确的认知益处的证据。因此,制药观察人士认为,除非在疗效、安全性或制造方面存在未披露的问题,否则donanemab可能会得到加速批准。
“他们当然会批准,”霍华德说。“很难想象他们怎么会批准了aducanumab,却不批准donanemab。”
Donanemab降低淀粉样蛋白的能力是没有争议的。在开拓者-阿尔兹,它平均降低了近80%的淀粉样蛋白β水平。这些数据表明它在清除淀粉样蛋白方面优于aducanumab。礼来已经建立了donanemab和aducanumab的正面试验,以直接比较它们降低淀粉样蛋白的能力。
FDA是否会再次召集外部专家进行审批?
批准aducanumab的一个导火索是FDA决定无视其咨询委员会对该抗体的担忧。
fda在一年前召集了这个专家小组,讨论Biogen复杂的数据集。2019年,在对两项III期试验进行中期分析后,该公司停止了aducanumab的开发。几个月后,该公司改变了方针,表示将根据对数据的新分析寻求批准,这些数据暗示了认知益处。
大脑中的“误伤”会引发阿尔茨海默病吗?
一位小组成员表示,Biogen对其数据的统计解释类似于“向谷仓开枪,然后在弹孔周围画一个目标”。十名小组成员投了反对票,一人弃权。
在FDA批准aducanumab后,三个成员该委员会有一名委员辞职以示抗议。
FDA高级官员在知名期刊上为自己的立场辩护3.,4而且报纸但影响还在继续。FDA和Biogen之间的非正式会议可能促成了批准,统计新闻报道6月。美国卫生与公众服务部的联邦监管机构目前正在审查导致批准的步骤,并将于2023年发布一份报告。美国众议院的两个国会委员会也在调查这一决定。
如果得到美国参议院的确认,罗伯特·卡利夫,美国总统乔·拜登的提名最近被选为食品药品监督管理局局长美国将不得不处理这一决定的任何影响,并决定如何推进加速审批。但随着监管先例的建立,没有明确要求成立独立咨询委员会来审查donanemab。
对于马里兰州巴尔的摩市约翰霍普金斯大学布隆伯格公共卫生学院的内科医生和流行病学家Caleb Alexander来说,他们需要的是声誉。亚历山大表示:“不幸的是,FDA在管理aducanumab方面的信誉受到了重大打击。”亚历山大是建议FDA不要批准该药物的委员会成员之一。“如果他们想挽回自己的信誉,他们需要确保这个新产品得到一个咨询委员会的审查。”
FDA会限制哪些人可以使用这些疗法吗?
FDA最初批准aducanumab用于任何阿尔茨海默氏症患者,这种疾病影响着美国600多万人。但百健公司只在这些患者中的一部分进行了抗体测试。
在遭到强烈反对后,fda将标准范围缩小到“轻度认知障碍或轻度痴呆阶段”的人群,以更好地匹配Biogen试验中测试的人群。但该药物的标签规定了谁应该使用它,并没有规定人们必须有大脑中淀粉样蛋白堆积的证据——这是纳入阿尔茨海默病试验的关键要求。

沮丧的阿尔茨海默氏症研究人员寻找更好的实验小鼠
一个担忧是,FDA的指导方针将人们置于潜在致命副作用的风险中,而获益的机会很少或根本没有。Aducanumab会导致脑肿胀。大多数患者不会因为这种肿胀而出现任何症状,但他们需要定期进行脑部扫描——这既繁重又昂贵——以避免可能的并发症。
礼来公司测试了同样会导致脑肿胀的donanemab,用于该疾病早期阶段的患者。它测量了淀粉样蛋白β,以及另一种称为tau的疾病蛋白质标志物的水平,以限制试验登记到最有可能受益的患者。民吞拒绝就礼来对治疗资格的看法置评。他说:“这是我很乐意与FDA进行的对话。”
霍华德希望FDA再次广泛批准。他说:“惩罚礼来,区别对待百健,这没有任何意义。”然后,医生的责任就落在了如何以及何时安全使用抗体的问题上。
但伊曼纽尔认为,FDA应该缩小所有抗淀粉样蛋白疗法的适用范围,并确保任何在加速批准下批准的药物的实际使用与临床试验设计密切一致。“如果法院开创了一个糟糕的先例,你就不能让这个坏先例继续下去。你要修改先例,”他说。

 有争议的阿尔茨海默病药物批准可能会影响其他疾病
有争议的阿尔茨海默病药物批准可能会影响其他疾病 阿尔茨海默氏症标志性药物批准令研究界困惑
阿尔茨海默氏症标志性药物批准令研究界困惑 大脑中的“误伤”会引发阿尔茨海默病吗?
大脑中的“误伤”会引发阿尔茨海默病吗? 沮丧的阿尔茨海默氏症研究人员寻找更好的实验小鼠
沮丧的阿尔茨海默氏症研究人员寻找更好的实验小鼠