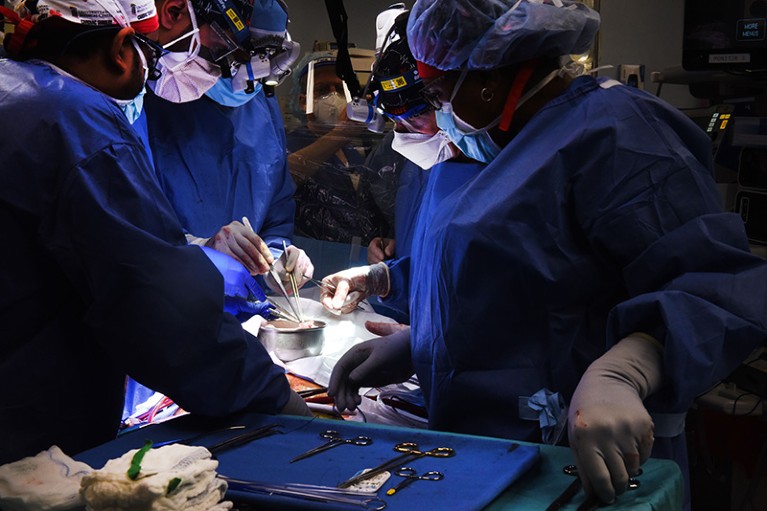
马里兰大学医学中心的一个团队于2022年1月首次将猪心脏移植到活人体内。资料来源:马里兰大学医学院/ZUMA
大卫·贝内特的心脏正在衰竭。这位来自马里兰州的57岁杂工只有几周的生命了,由于他有不遵守治疗指导的历史,他没有资格接受移植手术。
至少不是人类的。
今年1月,贝内特的医生向他提供了接受猪心脏移植的机会。他接过了。“我知道这是瞎猜,但这是我最后的选择,”他在接受治疗的巴尔的摩马里兰大学医学中心的新闻发布会上说。1月7日,医生移植了这颗经过基因改造的心脏,使人体能够耐受。
班尼特的新心脏在他的身体停止运转之前存活了8周。在他死后,研究小组了解到移植的器官感染了一种猪疱疹病毒,这种病毒在测试中没有被检测出来1.
但对于将动物器官移植到人体内,也就是所谓的异种移植来说,即使是几周的时间也很长。鉴于人体免疫系统在几分钟内就开始攻击非转基因猪器官,其他异种移植研究人员对这项实验印象深刻。“病人居然活了两个月,这实际上超出了我的预期,”生物工程师、中国杭州齐汉生物科技公司(Qihan Biotech)首席执行官杨鲁汉(Luhan Yang)说。“我认为这是该领域的胜利。”
这只是今年新闻报道的几例异种器官移植中的一例。班尼特手术几个月后,两个研究小组2,3.据独立报道,首次将猪肾移植到三个因缺乏脑功能而被宣布合法死亡的人体内。试验发现,这些器官产生尿液,即使在手术后两到三天,也不会被人体免疫系统排斥。6月和7月,外科医生在脑死亡患者身上又进行了两次猪心脏移植手术。
猪到人器官移植的临床试验越来越近
许多研究人员预计,这些早期的努力将很快导致在重症患者身上进行异种移植的小型临床试验激增。支持者说,如果成功的话,这样的努力可以大大减少成千上万需要器官移植的人的名单(仅在美国就有超过10万人),其中许多人将在等待中死亡。目前,研究人员表示,他们正在等待美国食品和药物管理局(FDA)等监管机构对已提交的几份申请进行评估。FDA发言人表示,该机构不评论申请的状态或存在。
今年6月,该机构召开了一次会议以解决越来越多的美国研究团队希望开始涉及异种移植的正式临床试验的问题。科学家们收集了数百只狒狒的数据,这些狒狒在接受猪器官或细胞(主要是心脏、肾脏和产生胰岛素的胰岛细胞)后存活了长达三年之久。科学家们试图说服机构官员,异种移植已经为人类使用做好了准备。
研究人员认为,需要进行临床试验来回答一些问题,比如使用哪种猪最好,以及如何确保动物不携带感染病毒。澳大利亚悉尼大学的移植外科医生韦恩·霍桑(Wayne Hawthorne)说:“我认为我们需要向前迈出这一步,进入诊所。”
贝内特的移植手术和随后的死亡让公众对这个话题产生了前所未有的关注,但也暴露了风险。研究人员认为有必要谨慎行事。霍桑说:“如果出现问题,你可能会让整个领域倒退。
动物来源
异种移植一直是移植外科医生的梦想,他们面临着合适器官的严重短缺。在20世纪60年代,研究人员开始在人类身上测试黑猩猩和狒狒的器官,但成功有限,但饲养足够多的动物用于移植是不切实际的。
猪可以提供更合理的器官来源,因为它们在大小和解剖结构上更接近人类,而且已经为农业大量生产。猪的器官甚至可能比人类的器官有一些优势。手术可以提前安排,器官也可以使用新鲜的器官,而不需要在基因匹配的捐赠者去世时,患者和手术团队随时待命。
此外,外科医生可能不知道人类捐赠者的病史或遗传倾向。波士顿麻省总医院的传染病专家杰伊·菲什曼说:“当我们筛选捐赠者时,我们只做一个小时,因为我们没有更长的时间了。”他说,在猪身上,“我们有机会进行我们在人类身上没有做过的筛查”。
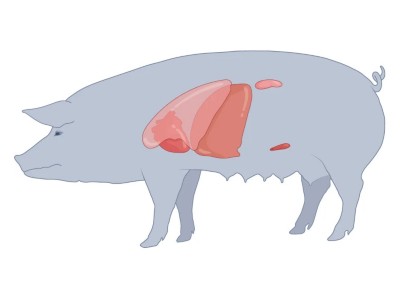
猪器官异种移植到人体内的下一步
直到20世纪90年代初,猪的器官都有一个大问题:人类免疫系统会排斥它们。马萨诸塞州总医院的移植外科医生大卫·库珀发现了一个解决办法4人类和其他灵长类动物的免疫系统主要对猪细胞表面的一种叫做α-Gal的糖分子产生反应。使编码一种有助于制造糖的蛋白质的猪基因发生突变,可以阻止细胞产生α-Gal,从而使这些转基因动物移植的器官在非人类灵长类动物体内存活更长的时间。
基因编辑技术CRISPR-Cas9在2010年代的出现为该领域提供了催化剂,使其更容易修改不仅涉及α-Gal生产的基因,而且可能有助于人体耐受猪器官的许多其他基因。几家公司正在开发不同改造的猪器官;迄今为止,除了已经完成的有限试验之外,还没有一种异种移植被批准。
贝内特移植用的猪是由弗吉尼亚州布莱克斯堡的Revivicor公司生产的,它们有10种基因改造。该公司修改了有助于猪器官生长到适合人体大小的4种猪基因,并添加了抑制免疫反应的4种基因和防止炎症导致血液凝固的2种基因等6种人类基因。
其他团队使用了略有不同的方法。例如,总部位于佛罗里达州迈阿密的Makana Therapeutics只对猪的三个基因进行了修改。公司创始人乔·泰克特(Joe Tector)说,这些基因的变化都能阻止人类抗体攻击器官,它们在改善非人类灵长类动物器官存活方面表现得最为明显。他说:“随着基因工程的进步,添加DNA或交换DNA的讨论将更加直接和可行。”
德国慕尼黑大学的分子生物学家Eckhard Wolf对此表示赞同。他说:“我们的总体策略是尽量保持简单。”他的团队对一种来自新西兰的野生迷你猪进行了五种基因改造,第一窝小猪于9月出生。这些迷你猪不需要修改来限制它们的生长,因为它们的器官在大小上与人类的相似。沃尔夫说,如果他的团队将迷你猪心脏移植到狒狒体内一切顺利,负责监管药物和医疗产品的欧洲药品管理局(European Medicines Agency)可能会在三年内批准心脏的小型人体试验。
试验计划
由于对人类的研究才刚刚开始,每一种基因修饰都是专门在非人类灵长类动物身上进行测试和优化的,而且由于未知的原因,一些物种倾向于产生比人类更多的针对猪器官的抗体。目前尚不清楚,如果有的话,哪些修改将被证明对移植到人体至关重要。
尽管存在差异,一些研究团队表示,FDA要求他们提供更多关于猪器官在非人类灵长类动物中的表现的数据。库珀说:“这就像说一种药物在人类身上可以达到我们想要的效果,但在猴子身上却不行——但让我们仍然在猴子身上进行测试。”“这样做完全不合逻辑。”FDA没有就具体病例需要多少灵长类动物数据发表评论,但已经发布了指导意见他说,灵长类动物模型不足以证明猪器官对人类是安全的。
向脑死亡患者移植可以提供一个中间步骤。纽约大学的外科医生罗伯特·蒙哥马利(Robert Montgomery)今年领导了一个移植肾脏的团队3.该公司计划在申请活人临床试验之前,在脑死亡患者身上进行更多的移植手术。在他的实验中使用的Revivicor猪只有一种基因修饰,涉及α-Gal;FDA批准了这种改变的猪用于人体消费和移植以外的一些医疗用途。蒙哥马利担心,复杂的修改组合可能会产生不可预测的相互作用。
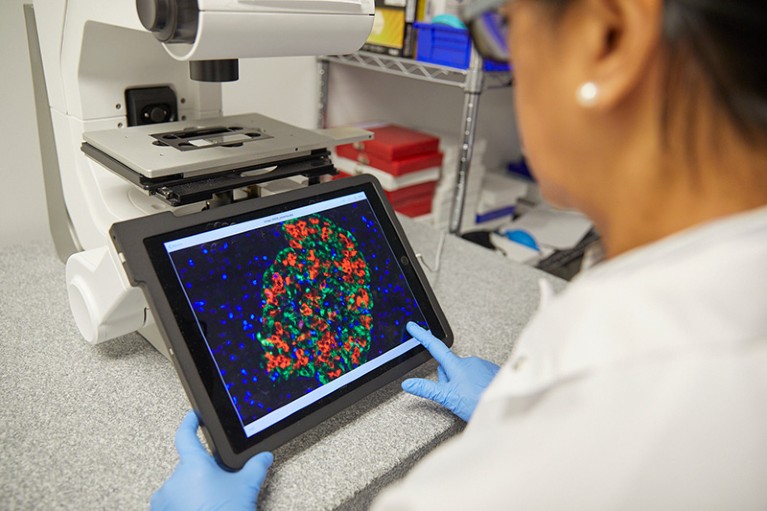
生物技术公司eGenesis已经设计出可以移植到人体的动物胰岛细胞。来源:Ken Richardson for eGenesis
其他研究人员认为,在活人身上进行试验将是确定器官移植几个月后身体是否会产生排斥反应的最佳方法。阿拉巴马大学伯明翰分校(University of Alabama at Birmingham)的移植外科医生杰米·洛克(Jayme Locke)说,让脑死亡患者维持生命这么长时间可能被认为是不道德的。他今年领导了另一个团队,将一个肾脏移植到一个脑死亡患者体内2.Locke正努力向FDA申请允许开始临床试验,使用与Bennett心脏相同的Revivicor猪的肾脏。她的团队已经在联邦登记处登记了一项这样的试验,尽管该试验尚未获得批准,也尚未开始招募将接受肾脏移植的20名患者。
霍桑说,其他组织,如产生胰岛素的胰岛细胞,可能根本不会引发太多的免疫反应,一组更简单的基因修饰可能就足够了。他的团队已经设计了一种猪胰岛细胞生产系,缺乏α-Gal,含有两个额外的基因,抑制人类的免疫反应。他的团队在6月报告说5移植的胰岛治愈了5只狒狒的糖尿病,它们在不需要胰岛素或免疫抑制药物的情况下活了近两年。
霍桑目前正计划在患有严重的1型糖尿病(导致血糖急剧下降)的人身上进行猪胰岛细胞的临床试验。他说,如果他的团队能找到资金,如果获得批准,试验可能在一年内开始。其他研究小组此前发现,猪胰岛细胞在人体内似乎是安全的6.
抗病猪
监管机构对该技术最大的担忧之一是猪中存在的传染性疾病。目前还不清楚这会造成多大的问题,但感染会通过几种方式引起问题。
影响猪的疾病可以从移植的器官跳到人类身上。这种担忧导致齐汉生物科技在今年早些时候中国爆发非洲猪瘟后停止了异种移植工作。这促使杨和她的同事对猪进行基因工程改造,使其能够抵抗这种疾病。描述他们工作的手稿目前正在审阅中。
然后是猪内源性逆转录病毒(PERVs),嵌入在猪基因组中的病毒元件。这些不是从环境中提取的,而是遗传的病毒DNA片段。它们对猪无害,但关于它们是否能从器官跳到人类细胞,以及它们是否对人或猪的器官有害,研究存在分歧。杨说:“现在判断这是一个真正的担忧还是一个假设还为时过早。”
尽管如此,为了看看是否有可能使这些病毒元件失活,马萨诸塞州波士顿哈佛医学院的杨和乔治·彻奇(George Church)使用CRISPR打乱了猪基因组中所有已知的PERVs:在猪肾细胞系中总共有62个修饰,这是基因编辑的记录7.
马萨诸塞州剑桥市生物技术公司eGenesis的首席执行官迈克尔·柯蒂斯(Michael Curtis)说:“人们难以置信,你可以做这么多编辑,并产生可行的捐赠者。”丘奇和杨创立了eGenesis,将CRISPR技术商业化用于异种移植,其中一只猕猴的肾脏移植自一只带有数十个PERV敲除基因的猪,它已经存活了近一年。该公司现在正在使用这项技术制造猪心脏、肾脏和肝脏,根据器官的预期用途,总共进行了多达80次编辑。
菲什曼说,即使摆脱了perv并预防已知病原体,也不能防止陌生病毒造成严重破坏。“仍然有未知的病原体可能来自猪,”他说。例如,一个人进行了异种肺移植,可能会感染一种只感染猪的呼吸道病毒。
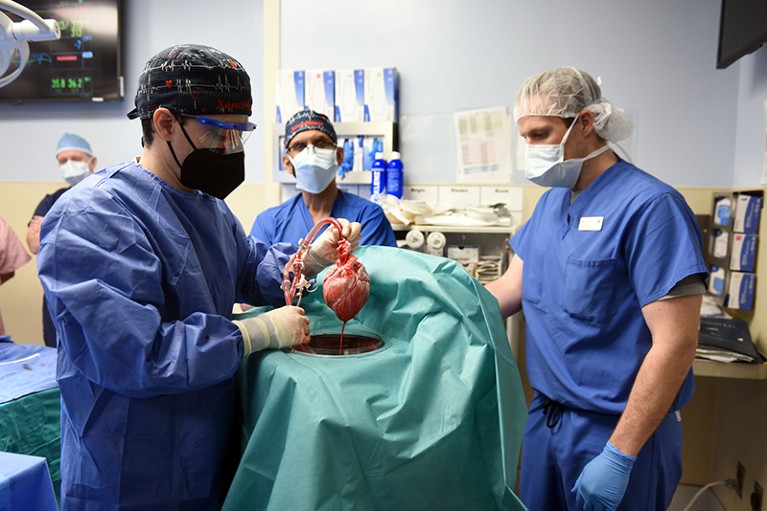
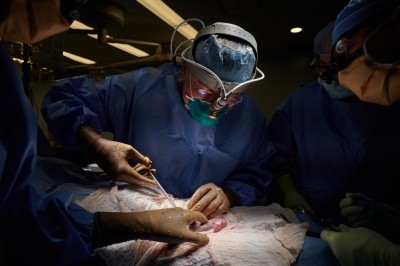
马里兰大学大卫·班尼特外科团队的成员正在为移植猪心脏做准备。资料来源:马里兰大学医学院/ZUMA
尽管菲什曼说这不太可能,但感染这两个物种的病毒可能会在人体内重组,产生一种新的病原体,就像流感病毒在鸟类、蝙蝠和猪身上所做的那样。
FDA建议,为了最大限度地降低公共健康风险,猪器官只能移植给那些没有其他选择的人,而且他们的生活质量可以通过手术得到显著改善。该机构表示,他们有长期监测病人的政策,并禁止有猪器官的人献血,因为有疾病传播的风险。
贝内特的心脏被发现含有猪巨细胞病毒(CMV),这是疱疹病毒家族的一种,通常会感染猪,但目前尚不清楚该病毒是否杀死了贝内特。马里兰大学医学中心的研究员Muhammad Mohiuddin领导了报道Bennett手术的研究1他说,没有证据表明病毒损害了心脏,他确信病毒没有扩散到贝内特身体的其他部位。他怀疑病人的器官已经被他的疾病或移植后发生的并发症(与猪病毒无关)损坏了。
不过,莫希丁不能排除病毒在其中发挥了作用。Revivicor对猪进行了CMV RNA和其他病原体的检测,并证明它们是干净的。Mohiuddin和其他人怀疑这种病毒潜伏在器官中,只有通过检测动物的抗体才能检测到。Revivicor表示,他们已经开发出了更敏感的CMV检测方法,但拒绝透露该公司筛查了多少种病原体。
Mohiuddin的团队获得了FDA的紧急许可来进行班尼特的移植手术,一旦他确定未来的猪是无病毒的,他计划进行更多这样的手术。他说,医疗中心不断向他提供很好的候选人,愿意接受猪移植的病人,但他拒绝了他们。“在我们让别人满意之前,我必须先让自己满意,”他说。
试验类型
泰克托说,尽管心脏异种移植吸引了很多关注,但第一个进入临床试验的实体器官很可能是肾脏,因为它比许多其他器官更简单。
对于更复杂的器官,eGenesis正在计划一个过渡步骤。该公司希望在12到18个月内开始在类似透析的装置中测试猪肝脏。三到六名濒临死亡的参与者将分别暂时连接到一个单独的猪肝上;他们的血液将流经器官,以清除肝衰竭期间积聚的有毒废物。柯蒂斯说,该公司还在研究青少年猪心脏,这种心脏同样可以作为患有心脏问题的儿童的桥梁,直到他们可以接受人类心脏移植。
在6月份的会议上,FDA官员列出了一份关于异种移植产品的担忧清单,包括器官的质量以及如何确保它们不含病原体。
泰克多说:“我们有很多问题要回答。但是,他说,Makana的狒狒中60% - 70%的狒狒可以在拥有正常功能的猪肾的情况下存活一年以上,所以该公司觉得已经准备好开始临床试验了。今年早些时候,该公司向FDA提交了申请。
菲什曼说,当试验开始时,最重要的是从每个参与者那里收集尽可能多的数据。“这是我们对病人的亏欠,也是对社会的亏欠。”

 首例猪对人心脏移植:科学家们能学到什么?
首例猪对人心脏移植:科学家们能学到什么? 猪到人器官移植的临床试验越来越近
猪到人器官移植的临床试验越来越近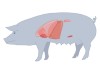 猪器官异种移植到人体内的下一步
猪器官异种移植到人体内的下一步