摘要
核糖开关是一种结构RNA元件,通常位于信使RNA的5 '非翻译区。在基因表达调控过程中,配体结合到核糖开关的适体结构域,触发向下游表达平台的信号1,2,3..要完全理解这一机制的结构基础,就需要有研究结构随时间变化的能力4.本文采用飞秒x射线自由电子激光(XFEL)脉冲5,6从如此小的晶体中获得结构测量,使配体的扩散可以在衍射之前被定时启动反应。我们通过在反应过程中确定腺嘌呤核糖开关适体结构域的四种结构来证明这种方法,包括两个未结合的载脂蛋白结构,一个配体结合的中间体,以及最终的配体结合构象。这些结构支持至少有四种状态的反应机制模型,并说明了信号传输的结构基础。两个载脂蛋白构象体的三向结和P1开关螺旋与配体结合构象明显不同。我们用10秒延迟的时间分辨晶体学测量捕捉到了中间体的结构,以及适应配体的结合袋的变化。经过至少10分钟的延迟,RNA分子完全转化为配体结合状态,在这种状态下,大量的构象变化导致空间基团的转化。如此显著的变化在crystallo强调微观和纳米晶体在这些和类似的时间分辨衍射研究中可能提供的重要机会。总之,这些结果证明了“混合-注入”时间分辨系列晶体学在研究生物大分子和配体之间的重要生物化学相互作用方面的潜力,包括那些涉及大构象变化的相互作用。
这是订阅内容的预览,通过你所在的机构访问
相关的文章
引用本文的开放获取文章。
金属离子诱导的双态变构对添加腺嘌呤核糖开关调控机制的潜在影响
通信生物学开放获取2022年10月22日
在欧洲XFEL收集的数百万张连续飞秒晶体学数据集
科学数据开放获取2022年4月12日
一种小的RNA,在一个口袋中合作感知两个堆积的代谢物以进行基因控制
自然通讯开放获取2022年1月11日
访问选项
订阅期刊
获得1年的完整期刊访问权限
199.00美元
每期仅需3.90美元
所有价格均为净价格。
增值税稍后将在结帐时添加。
税务计算将在结账时完成。
买条
在ReadCube上获得时间限制或全文访问。
32.00美元
所有价格均为净价格。
参考文献
Mandal, M., Boese, B., Barrick, J. E., Winkler, W. C. & Breaker, R. R.枯草芽孢杆菌还有其他细菌。细胞113, 577-586 (2003)
Nahvi, A.等人。由代谢物结合mRNA的遗传控制。化学。医学杂志。9, 1043 (2002)
断路器,r。r。核糖开关和RNA世界。冷泉港。教谕。医学杂志。4, a003566 (2012)
Hajdu, J.等。从四个维度分析蛋白质功能。Nat。结构。医学杂志。7, 1006-1012 (2000)
布特,S.等人。序列飞秒晶体学测定高分辨率蛋白质结构。科学337, 362-364 (2012)
查普曼,H. N.等。飞秒x射线蛋白质纳米晶体学。自然470, 73-77 (2011)
塞尔加诺夫,A.等人。腺嘌呤和鸟嘌呤传感mrna对基因表达的鉴别调控的结构基础。化学。医学杂志。11, 1729-1741 (2004)
温克勒,W. C. & Breaker, R. R.代谢物结合核糖开关的遗传控制。ChemBioChem4, 1024-1032 (2003)
嘌呤结合核糖开关的结构和机制。Q.生物物理学。45, 345-381 (2012)
Di Palma, F., Colizzi, F. & Bussi, G.配体诱导的加腺嘌呤核糖体开关中适体末端螺旋的稳定。核糖核酸19, 1517-1524 (2013)
Lemay, J. F. & Lafontaine, D. a .[腺嘌呤核糖开关:一种新的基因调控机制]。医学科学。(巴黎)22, 1053-1059 (2006)
Batey, r.t., Gilbert, s.d. & Montange, r.k.一种天然鸟嘌呤反应核糖开关复合物与代谢物次黄嘌呤的结构。自然432, 411-415 (2004)
张杰,& Ferré-D 'Amaré, a.r.通过阳离子置换和脱水显著改善大分子rna的晶体。结构22, 1363-1371 (2014)
Rieder, R., Lang, K., Graber, D. & Micura, R.配体诱导的腺苷脱氨酶a -核糖开关折叠及其在核糖开关翻译控制中的意义。ChemBioChem8, 896-902 (2007)
吉尔伯特,S. D.,斯托达德,C. D., Wise, S. J.和Batey, R. T.配体结合到嘌呤核糖开关适体域的热力学和动力学特征。J. Mol.生物学。359, 754-768 (2006)
Delfosse, V.等。核糖开关结构:一种模仿嘌呤配体的内部残基。核酸测定。38, 2057-2068 (2010)
詹金斯,J. L., Krucinska, J., McCarty, R. M., Bandarian, V. & Wedekind, J. E.代谢结合和自由状态下的preQ1核糖开关适体的比较与基因调控的意义。生物。化学。286, 24626-24637 (2011)
潘德,K.等。飞秒结构动力学驱动反式/ cis光活性黄色蛋白的异构化。科学352, 725-729 (2016)
Tenboer, J.等人。时间分辨系列晶体学捕获光活性黄色蛋白的高分辨率中间产物。科学346, 1242-1246 (2014)
巴伦兹,T. R.等人。直接观察CO肌红蛋白在配体解离时的超快集体运动。科学350, 445-450 (2015)
Hajdu, J.等。毫秒x射线衍射和第一个电子密度图从劳埃照片的蛋白质晶体。自然329, 178-181 (1987)
王东东,魏尔斯托尔,吴,波拉克,L. & Spence, J.双聚焦混合射流用于XFEL化学动力学研究。J.同步辐射。21, 1364-1366 (2014)
混合和注入:时间分辨的丙烯分子晶体学的扩散反应引发。放置提供者。物理问题。2013, 167276 (2013)
沃尔夫-瓦茨,等人。热-中温酶对的动力学和催化之间的联系。Nat。结构。摩尔。杂志。11, 945-949 (2004)
Al-Hashimi, h.m. & Walter, n.g. RNA动力学:是时候了。咕咕叫。当今。结构体。医学杂志。18, 321-329 (2008)
坎贝尔,j.w.等。用Laue晶体学观察番茄浓密矮小病毒的钙结合位点。J. Mol.生物学。214, 627-632 (1990)
伯恩利,B. T., Afonine, P. V., Adams, P. D. & Gros, P.用集成细化建模蛋白质晶体结构的动力学。eLife1, e00311 (2012)
黄,L., Ishibe-Murakami, S., Patel, D. J. & Serganov, A.远程假结相互作用决定了四氢叶酸核糖开关的调节反应。国家科学院学报美国108, 14801-14806 (2011)
Haller, A, Altman, R. B, Soulière, M. F., Blanchard, S. C. & Micura, R.单分子分辨率下TPP核糖开关适体的折叠和配体识别。国家科学院学报美国110, 4188-4193 (2013)
斯宾塞,J. &拉特曼,e成像酶动力学在原子分辨率。IUCrJ3., 228-229 (2016)
刘,Y.等。具有位置选择性标记和镶嵌组成的rna的合成与应用。自然522, 368-372 (2015)
康拉德,c.e.等人。一种用于连续飞秒晶体学的新型惰性晶体传输介质。IUCrJ2, 421-430 (2015)
程A, Hummel, B.,邱H. &卡夫瑞M.一个简单的机械搅拌机小粘性含脂样品。化学。理论物理。脂质95, 11-21 (1998)
Weierstall, U.等人。脂质立方相注入器促进膜蛋白系列飞秒晶体学。Commun Nat。5, 3309 (2014)
巴蒂,A.等人。猎豹:用于串行飞秒x射线衍射数据的高通量还原和分析软件。j:。Crystallogr。47, 1118-1131 (2014)
怀特,t.a.等。CrystFEL:快照系列晶体学软件套件。j:。Crystallogr。45, 335-341 (2012)
Kirian, R. A.等。蛋白质纳米晶体飞秒微衍射模式的结构因子分析。Acta Crystallogr。一个67, 131-140 (2011)
怀特,t.a.等。自由电子激光源的晶体学数据处理。Acta Crystallogr。D69, 1231-1240 (2013)
卡加,P. A. & Diederichs, K.链接晶体学模型和数据质量。科学336, 1030-1033 (2012)
弗兰奇,G. S. &威尔逊,K. S.关于负强度观测的处理。Acta Crystallogr。一个34, 517-525 (1978)
麦考伊,A. J.等人。相位晶体学软件。j:。Crystallogr。40, 658-674 (2007)
亚当斯,P. D.等。PHENIX:构建自动化晶体结构测定的新软件。Acta Crystallogr。D58, 1948-1954 (2002)
Murshudov, G. N.等。REFMAC5用于大分子晶体结构的细化。Acta Crystallogr。D67, 355-367 (2011)
周凤春,史瑞普迪万,杜波夫,薛晓明,赫曼,陈晓明,等。利用枚举结构预测修正RNA晶体学中的普遍误差。Nat方法。10, 74-76 (2013)
埃姆斯利,P. &考坦,K.库特:分子图形模型构建工具。Acta Crystallogr。D60, 2126-2132 (2004)
PyMOL分子图形系统,版本1.7.6.4 Schrödinger, LLC
王,J.等。利用小角度x射线散射和核磁共振测量测定溶液中螺旋RNA整体结构的方法。J. Mol.生物学。393, 717-734 (2009)
Jacques, d.a., Guss, J. M. & Trewhella, J.溶液中生物分子小角度散射数据的可靠结构解释-质量控制和标准报告框架的重要性。BMC结构。医学杂志。12, 9 (2012)
左,等。分子动力学模拟定量评价溶液中DNA结构的x射线衍射“指纹”。国家科学院学报美国103, 3534-3539 (2006)
田德。M. Mardis . K. L. & Zuo。x射线散射结合基于坐标的分析在自然和人工光合作用中的应用。Photosynth。Res。102, 267-279 (2009)
左,等。全局分子结构和界面:精炼RNA:使用溶液x射线散射数据的RNA复合物结构。j。化学。Soc。130, 3292-3293 (2008)
Nadassy, K, Tomás-Oliveira, I., Alberts, I., Janin, J. & Wodak, S. J.双链DNA中的标准原子体积和蛋白质中的包装——DNA界面。核酸测定。29, 3362-3376 (2001)
Voss, N. R. & Gerstein, M. RNA标准原子体积的计算和与蛋白质的比较:RNA的排列更紧密。J. Mol.生物学。346, 477-492 (2005)
Schwieters, C. D., Kuszewski, J. J., Tjandra, N. & Clore, gm . Xplor-NIH NMR分子结构测定包。j .增效。的原因。160, 65-73 (2003)
方,等。HIV-1 Rev反应元件的不寻常拓扑结构。细胞155, 594-605 (2013)
Deshmukh, L.等人。HIV-1全长衣壳蛋白在溶液中的结构与动态。j。化学。Soc。135, 16133-16147 (2013)
确认
这项研究的一部分是在直线加速器相干光源进行的,这是斯坦福大学代表美国能源部基础能源科学办公室运营的国家用户设施。CXI仪器是由美国能源部基础能源科学办公室资助的LCLS超快科学仪器(LUSI)项目资助的。直线加速器相干光源(LCLS)的使用,SLAC国家加速器实验室,由美国能源部,科学办公室,基础能源科学办公室支持。de - ac02 - 76 sf00515。我们感谢J. Strathern和M. Dunne的支持和S. Wakatsuki的讨论。这项工作得到了NSF-STC“BioXFEL”(NSF-1231306), NCI, CIT, NHLBI的NIH内部研究计划,以及美国能源部,生物和环境研究办公室合同DE-AC02-06CH11357,欧洲研究委员会,“阿秒x射线科学前沿:成像和光谱学(AXSIS)”,ERC-2013-SyG 609920和BMBF通过项目05K16GU1的部分支持。
作者信息
作者及隶属关系
贡献
J.R.S.和y - x.w设计实验;Y.L.和P.Y.提供了RNA样本;J.R.S.和y.l将RNA结晶化;Y.L jr。,Y.R.B D.R.W, C.E.C, J.D.C, G.N,部件,N.A.Z, M.O.W,原产,j.k., T.D.G, M.S.H, mit获得,马丁和Y.-X.W.收集自解压数据;M.O.W, d.o., J.K.和H.N.C.设计了混合装置;Y.R.B jr。,D.R.W T.A.W, A.B。R.A.T, N.A.Z, X.J. T.D.G.处理和分析了自解压数据;j.r.s.、y.r.b.、m.s.、X.J.和y.x w解释了SFX数据;N.A.Z, a.b., m.s.h., s.b., m.l., u.w., p.f., H.N.C.和J.C.H.S.贡献了XFEL的专业知识和支持;y.r.b.、l.f.、X.Z、C.D.S.和y.y.x w收集、分析和解释SAXS数据;j.r.s.、c.e.c.、K.T.、y.x w表征样品; M.D. and Y.L. performed mass spectroscopy; S.G.T. and Y.L. performed ITC and fluorescence titration; S.P. and Y.L. collected and analysed binding data; X.Z. and S.A.W. modelled ligand binding kinetics; X.Z., S.P., S.A.W. and Y.-X.W. interpreted kinetic data; D.E.D., A.F.D. and J.Z. contributed discussions; J.R.S. and Y.-X.W. drafted the manuscript and all authors contributed to the revision.
相应的作者
道德声明
相互竞争的利益
作者声明没有相互竞争的经济利益。
额外的信息
审核人信息自然感谢J. Hajdu, R. Micura和其他匿名审稿人对本工作的同行评审所作的贡献。
扩展的数据图形和表格
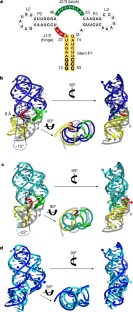
图1 RNA晶体的表征。
apo-rA71微晶体采用方法中所述的分批结晶方法生长。使用SONICC成像仪(Formulatrix)对每个样品(0.5-1.0 μl)进行了三种不同的成像方法:可见光(一个);UV-TPEF (b);手性晶体的二阶非线性成像(c).d,晶体样品在交叉偏振光下使用立体显微镜(蔡司)观察。e没有交叉极化,晶体几乎无法观测到。f,通过粉末x射线衍射(APS束线19-ID)测量晶体样品的相对质量,最大可观测分辨率约为6 Å。分辨率环(红色)对应6.8 Å。
图2小角度x射线散射对溶液中rA71的表征。
一个, apo态(黑色)和束缚态(红色)rA71溶液x射线散射曲线的Kratky图比较。b, apo1和apo2构象的小角度x射线散射(SAXS)剖面与rA71在apo(红色)状态下的溶液x射线散射曲线的反向计算图。c,实验SAXS曲线以红色表示,带有红色误差条,并与使用双元集成计算从128个结构反求的SAXS曲线叠加。两种构象(apo2:apo1)的比例约为0.9:0.1,与实验数据的拟合最好χ2数值范围大约在0.1到0.3之间。
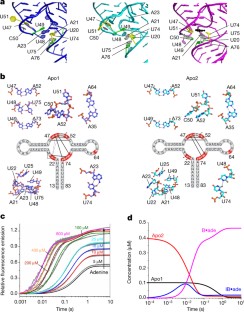
扩展数据图3为了容纳配体,三通结进行了显著的结构重排,压缩了主槽。
一个,在apo1(蓝色),apo2(青色,)和配体结合(品红,PDB代码4TZX)结构中观察到的三向结。几乎所有的三向结残基在配体结合时都发生了相当大的构象变化。最值得注意的是铰链(U22, A23)和闩锁(U48, U49, U51)区域的“摆动”残基,它们在载脂蛋白构象体中的原子位置相对于配体结合的构象体相差17 Å。b,在缺少配体的情况下,铰链(描述为白色表面和棒模型)和闩锁区域的一致运动导致螺旋P1和P3之间形成的主要沟槽显著变窄,分别为apo1、apo2和配体结合构象体9.4 Å、10.0 Å和16.6 Å。测量了U71和A19的磷原子之间的主要沟槽距离(或apo1的情况下的U20,由于寄存器的差异)。
图4 rA71核开关的多级配体结合动力学。
通过将U48替换为荧光碱基类似物2-氨基嘌呤(2AP;称为rA71-U482AP)。配体诱导的结合袋重组使2AP荧光发射强度增加。通过部分RNase酶切判断,2AP取代不会改变载脂蛋白rA71核糖开关的二级结构。一个, rA71-U482AP与腺嘌呤产率的平衡滴定法Kd= 5 μM(黑色)。一个类似的Kd数值由动力学过程曲线的端点(红色符号)和在线探测实验获得。这个值大约是腺嘌呤与未修饰的核糖开关结合的10倍,可能是因为2AP在载脂蛋白结构中形成了更稳定的碱基堆叠相互作用。误差条表示两个或多个独立试验的平均值的标准偏差。b配体结合动力学符合四态机制。0.5 - 1600 μM腺嘌呤与0.5 μM rA71-U482AP的结合通过止流荧光(1.8 ms死时间)测定,如方法所述。腺嘌呤相关的表观速率常数,λ快而且λ慢,由个体轨迹拟合得到双相速率方程∆F=一个快(1−exp(−λ快t)) + a慢(1−exp(−λ慢t)),其中A为腺嘌呤浓度。错误条如下一个.的非线性增长λ快(填充符号)腺嘌呤浓度超过配体浓度的整个范围表明结合机制中存在一种或中间产物。配体无关相,λ慢(开放符号),导致在50 μM腺嘌呤以上的双相轨迹,并解释为结合正常和结合不正常形式的核糖开关之间的缓慢交换。c,腺嘌呤结合的表观双分子速率常数比扩散慢,由λ快与[腺嘌呤]相比,在伪一级条件(0.5-25 μM腺嘌呤)下,配体与有效(开放)核糖开关的结合是限速的。10mm MgCl2(符号),k在= 1.9 × 105米−1年代−1而且k从= 1.7秒−1.1.25 mM MgCl2(开放的符号),k在= 5.2 × 104米−1年代−1而且k从= 2.1秒−1.误差条是一个与n3个独立试验。d,e,同一组简化的实验数据图2 c是否全局拟合于更简单的三态动力学机制,如补充讨论.这些模型不能描述溶液结合动力学在整个范围的配体浓度测试。因此,式(1)中的四态模型是能够描述数据的最简单机制。我们不排除这种可能性,即核糖开关对额外的载脂蛋白状态和中间复合物进行采样,这可能有助于开关机制的稳健性。d,只有一个载脂蛋白态的三态机制。拟合得到的参数为:k在= 0.28 μm−1年代−1,k从= 37秒−1,kf= 103秒−1,kr= 5.1秒−1,sc= 2.03。错(k,sc) = 0.053,其中sc是缩放值和速率常数(k)通过最小化卡方误差函数Err(k,sc),描述计算曲线与实验数据集之间的差异(补充讨论).e,具有两个载脂蛋白态和无结合中间体的三态机制。参数:k人事处= 2.5秒−1,kcl= 0.58 s−1,k在= 0.16 μm−1年代−1,k从= 0.79 s−1, sc = 2.44。错(k,sc) = 0.056。
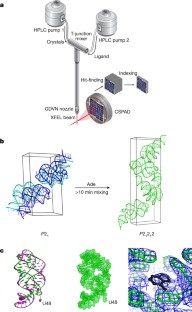
图5晶体中IB浓度的时间过程模拟及载脂蛋白、IB和束缚结构的单位细胞尺寸比较。
一个,模拟了晶体中IB积聚的时间过程以及配体、apo2和束缚态(B)浓度的变化。参见方法。b,c、载波态、IB态和束缚态晶体的空间群和单位细胞尺寸。在与腺嘌呤配体混合至少10分钟后,晶体中的结构从载脂蛋白转变为结合态。与配体混合10 s后,晶格保持不变。
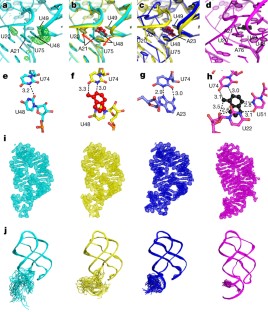
扩展数据图6确定IB构象的结构。
一个,为了首先验证IB状态相对于apo2是否有变化,针对10-s-mix数据对apo2结构进行了细化;2Fo−Fc(1σ,蓝色)及Fo−Fc(3σ(绿色)电子密度图。这两张地图都指出了U48和A21的替代位置。b, apo2状态的U48和A21的占有率设置为0.5,并以同样的方式进行细化。的Fo−Fc图(3σ(绿色)清楚地显示了U48的替代构象(IB),在原来的U48位置上有一团密度,与腺嘌呤配体相对应。A21的替代构象不太明显,与相邻的铰链残基(U22和A23)一起部分无序。c,保持A21的占用率为0.5,对结构进行细化,省略U48。的Fo−Fc图(3σ(绿色)再次支持U48、A21和腺嘌呤配体密度的可选构型。d,腺嘌呤配体的IB状态的最终细化结构(红色),以及在0.5占用时模拟的U48和A21的替代构象,如图2所示Fo−Fc电子密度图(1σ,蓝色)。
扩展数据图7Fo−Fc和2Fo−Fc电子密度图和10-s-mix数据的集成细化模型。
一个,加权Fo−Fc电子密度差图为绿色(3σ)和红色(−3 .σ),计算采用载脂蛋白结构(apo2,青色;Apo1,蓝色)和10-s-mix数据中的结构因子。孤立的峰很可能对应于骨干磷酸盐,表明构象态的混合,主要位于apo2结构的三向交界处及其周围。b, 2Fo−Fc电子密度图(1σ(左)和10-s-mix结构的“apo1样”分子的时间平均分子动力学集成优化模型(右)。c, apo1(蓝色)与10-s-mix结构的apo1样分子(橙色)的叠加,表明apo1与配体混合10 s后结构没有变化。
补充信息
补充讨论
此文件包含补充讨论和补充参考。(PDF 356 kb)
权利和权限
关于本文
引用本文
斯塔格诺,J,刘勇,班达里,Y。et al。用混合-注入XFEL系列晶体学研究核糖开关RNA反应态的结构。自然541, 242-246(2017)。https://doi.org/10.1038/nature20599
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/nature20599
这篇文章被引用
在欧洲XFEL收集的数百万张连续飞秒晶体学数据集
科学数据(2022)
连续飞秒晶体学
自然评论方法引物(2022)
荧光适体Squash广泛地重新利用腺嘌呤核糖开关折叠
自然化学生物学(2022)
一种小的RNA,在一个口袋中合作感知两个堆积的代谢物以进行基因控制
自然通讯(2022)
金属离子诱导的双态变构对添加腺嘌呤核糖开关调控机制的潜在影响
通信生物学(2022)
