文摘gydF4y2Ba
地球上的生命依赖光合作用的太阳能转换成化学能。光合生物已经开发出各种聚光系统捕获阳光。最大的聚光复杂是藻胆体(PBS),主聚光天线在蓝藻和红藻。它由藻胆蛋白和链接器蛋白质的组装机制和能量传递路径PBS并不好理解。在这里,我们报告的结构16.8从红藻-megadalton PBS 3.5决议通过单粒子低温电子显微镜。我们模仿862蛋白质亚基,在核心包括4连接基团,16 rod-core连接器和52杆连接器和位于2048生色团。这个结构揭示了特定基团和藻胆蛋白之间的相互作用机制,和链接器骨架的形成。这些结果提供一个坚实的结构基础,对于我们理解复杂的装配在PBS和能量传递的机制。gydF4y2Ba
这是一个预览的订阅内容,gydF4y2Ba通过访问你的机构gydF4y2Ba
相关的文章gydF4y2Ba
开放获取文章引用这篇文章。gydF4y2Ba
低温电子显微镜和飞秒光谱研究提供机械的见解CpcL-phycobilisomes能量转移gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2023年7月05gydF4y2Ba
红藻适应弱光通过修改藻胆体成分保持高效的光收获gydF4y2Ba
BMC生物学gydF4y2Ba开放获取gydF4y2Ba2022年12月27日gydF4y2Ba
Allophycocyanin是二氧化碳受体在蓝藻藻胆体gydF4y2Ba
自然通讯gydF4y2Ba开放获取gydF4y2Ba2022年9月08gydF4y2Ba
访问选项gydF4y2Ba
访问其他自然组合期刊性质和54gydF4y2Ba
得到自然+,请求书在线访问订阅gydF4y2Ba
29.99美元gydF4y2Ba/ 30天gydF4y2Ba
取消任何时候gydF4y2Ba
订阅本杂志gydF4y2Ba
收到51印刷问题和网络访问gydF4y2Ba
每年199.00美元gydF4y2Ba
只有3.90美元的问题gydF4y2Ba
本文租或购买gydF4y2Ba
价格不同的文章类型gydF4y2Ba
从gydF4y2Ba1.95美元gydF4y2Ba
来gydF4y2Ba39.95美元gydF4y2Ba
价格可能受当地税收计算在结帐gydF4y2Ba




加入代码gydF4y2Ba
主要登记入册gydF4y2Ba
EMBL /基因库/ DDBJgydF4y2Ba
电子显微镜数据银行gydF4y2Ba
蛋白质数据银行gydF4y2Ba
引用gydF4y2Ba
西德勒,w . agydF4y2Ba蓝细菌的分子生物学gydF4y2Ba(ed。科比,d . a .)139 - 216(提供参考,1994)gydF4y2Ba
Adir:说明藻胆体的分子结构的组件:重建一个巨人。gydF4y2BaPhotosynth。Res。gydF4y2Ba85年gydF4y2Ba15-32 (2005)gydF4y2Ba
渡边,m & Ikeuchi m .藻胆体:聚光supercomplex的架构。gydF4y2BaPhotosynth。Res。gydF4y2Ba116年gydF4y2Ba265 - 276 (2013)gydF4y2Ba
Croce, r & van Amerongen h .自然光合作用的光收获策略。gydF4y2BaNat,化学。医学杂志。gydF4y2Ba10gydF4y2Ba492 - 501 (2014)gydF4y2Ba
Schirmer, t . et al .晶体结构分析和细化的2.5 hexameric C-phycocyanin藻青菌gydF4y2BaAgmenellum quadruplicatumgydF4y2Ba。对聚光分子模型和它的影响。gydF4y2Baj·摩尔,杂志。gydF4y2Ba188年gydF4y2Ba651 - 676 (1986)gydF4y2Ba
de Marsac n t & Cohen-bazire g分子蓝藻藻胆体组成。gydF4y2BaProc。《科学。美国gydF4y2Ba74年gydF4y2Ba1635 - 1639 (1977)gydF4y2Ba
Arteni, A。,Ajlani, G. & Boekema, E. J. Structural organisation of phycobilisomes from集胞藻属gydF4y2Basp.应变PCC6803及其与膜的交互。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1787年gydF4y2Ba272 - 279 (2009)gydF4y2Ba
Arteni, a . a . et al .藻胆体的结构和组织细胞膜的红色海藻gydF4y2Ba紫球藻属cruentumgydF4y2Ba。gydF4y2BaPhotosynth。Res。gydF4y2Ba95年gydF4y2Ba169 - 174 (2008)gydF4y2Ba
甘特,主任,c a e . &利浦舒尔茨说道藻胆体的结构和藻胆蛋白成分gydF4y2BaGriffithsia帕西菲卡gydF4y2Ba(红藻科)。gydF4y2Baj . Phycol。gydF4y2Ba16gydF4y2Ba394 - 398 (1980)gydF4y2Ba
囊内,G。,Cohen-Bazire, G. & Bryant, D. A. The structure ofGloeobacter violaceusgydF4y2Ba藻胆蛋白体。gydF4y2Ba拱门。Microbiol。gydF4y2Ba129年gydF4y2Ba181 - 189 (1981)gydF4y2Ba
威廉姆斯,r . C。,Gingrich, J. C. & Glazer, A. N. Cyanobacterial phycobilisomes. Particles from集胞藻属gydF4y2Ba6701年,两个色素突变体。gydF4y2Baj .细胞杂志。gydF4y2Ba85年gydF4y2Ba558 - 566 (1980)gydF4y2Ba
Ducret,。,Sidler, W., Wehrli, E., Frank, G. & Zuber, H. Isolation, characterization and electron microscopy analysis of a hemidiscoidal phycobilisome type from the cyanobacterium淡水藻类的一种gydF4y2BaPCC 7120 sp。gydF4y2Ba2月gydF4y2Ba236年gydF4y2Ba1010 - 1024 (1996)gydF4y2Ba
MacColl, r . Allophycocyanin和能量转移。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1657年gydF4y2Ba73 - 81 (2004)gydF4y2Ba
高,x等。分子见解蓝藻藻胆体的终端能源受体。gydF4y2Ba摩尔。Microbiol。gydF4y2Ba85年gydF4y2Ba907 - 915 (2012)gydF4y2Ba
Lundell d J。,山中,G。&Glazer, A. N. A terminal energy acceptor of the phycobilisome: the 75,000-dalton polypeptide of聚球藻属gydF4y2Ba6301 phycobilisomes-a新的胆蛋白质。gydF4y2Baj .细胞杂志。gydF4y2Ba91年gydF4y2Ba315 - 319 (1981)gydF4y2Ba
唐、k . et al .终端藻胆体排放国,中国大陆:一个光敏色素的光色素发色团。gydF4y2BaProc。《科学。美国gydF4y2Ba112年gydF4y2Ba15880 - 15885 (2015)gydF4y2Ba
格雷泽,a . n . &科比,d . a . Allophycocyanin B(λmax 671、618 nm):一个新的蓝藻藻胆蛋白。gydF4y2Ba拱门。Microbiol。gydF4y2Ba104年gydF4y2Ba第15 - 22 (1975)gydF4y2Ba
彭,p . p . et al . allophycocyanin B的结构gydF4y2Ba集胞藻属gydF4y2BaPCC 6803揭示了结构基础极端终端发射器藻胆体的红移。gydF4y2BaActa Crystallogr。D杂志。Crystallogr。gydF4y2Ba70年gydF4y2Ba2558 - 2569 (2014)gydF4y2Ba
甘特,大肠藻胆体的结构和功能:光吸收色素复合物在红色和蓝绿藻。gydF4y2Ba启Cytol Int。gydF4y2Ba66年gydF4y2Ba45 - 80 (1980)gydF4y2Ba
Adir N,进餐,M, Klartag, M,麦格雷戈,a . & Melamed-Frank MgydF4y2Ba在原核生物复杂的细胞内结构gydF4y2Ba(ed Schwender, j .)日至31日(植物代谢网络,2009)gydF4y2Ba
盾,c . et al .成人是必要的有效的能量转移的藻胆体光系统I和藻青菌有助于防止光抑制gydF4y2Ba聚球藻属gydF4y2BaPCC 7002 sp。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1787年gydF4y2Ba1122 - 1128 (2009)gydF4y2Ba
阿什比,m . k . & Mullineaux c . w .成人的角色和ApcF藻胆体的能量转移PSI、PSII藻青菌。gydF4y2BaPhotosynth。Res。gydF4y2Ba61年gydF4y2Ba169 - 179 (1999)gydF4y2Ba
Chang l . et al。一个完整的藻胆体的组织结构及其与光系统II。gydF4y2Ba细胞Res。gydF4y2Ba25gydF4y2Ba726 - 737 (2015)gydF4y2Ba
山中,G。,我undell, D. J. & Glazer, A. N. Molecular architecture of a light-harvesting antenna. Isolation and characterization of phycobilisome subassembly particles.生物。化学。gydF4y2Ba257年gydF4y2Ba4077 - 4086 (1982)gydF4y2Ba
斯科尔斯,g D。Mirkovic, T。,Turner, D. B., Fassioli, F. & Buchleitner, A. Solar light harvesting by energy transfer: from ecology to coherence.能源环境。科学。gydF4y2Ba5gydF4y2Ba9374 - 9393 (2012)gydF4y2Ba
刘,L.-N。,Chen, X.-L., Zhang, Y.-Z. & Zhou, B.-C. Characterization, structure and function of linker polypeptides in phycobilisomes of cyanobacteria and red algae: an overview.Biochim。Biophys。学报gydF4y2Ba1708年gydF4y2Ba133 - 142 (2005)gydF4y2Ba
路透社,W。,Wiegand, G., Huber, R. & Than, M. E. Structural analysis at 2.2 Å of orthorhombic crystals presents the asymmetry of the allophycocyanin-linker complex, AP.LC7.8, from phycobilisomes ofMastigocladus laminosusgydF4y2Ba。gydF4y2BaProc。《科学。美国gydF4y2Ba96年gydF4y2Ba1363 - 1368 (1999)gydF4y2Ba
高,x et al .晶体结构的n端结构域的链接器L (R)和蓝藻藻胆体组装棒。gydF4y2Ba摩尔。Microbiol。gydF4y2Ba82年gydF4y2Ba698 - 705 (2011)gydF4y2Ba
影响力:J。,Tisi, D. & Hohenester, E. Novel fold revealed by the structure of a FAS1 domain pair from the insect cell adhesion molecule fasciclin I.结构gydF4y2Ba11gydF4y2Ba197 - 203 (2003)gydF4y2Ba
Klotz a . v . &格雷泽,a . n .表征R-phycoerythrin比邻附件网站。gydF4y2Ba生物。化学。gydF4y2Ba260年gydF4y2Ba4856 - 4863 (1985)gydF4y2Ba
Nagy, j . O。,B我shop, J. E., Klotz, A. V., Glazer, A. N. & Rapoport, H. Bilin attachment sites in the alpha, beta, and gamma subunits of R-phycoerythrin. Structural studies on singly and doubly linked phycourobilins.生物。化学。gydF4y2Ba260年gydF4y2Ba4864 - 4868 (1985)gydF4y2Ba
污点:et al . Phycourobilin从海洋蓝三色藻青蛋白形成你的藻红素lyase-isomerase。gydF4y2Ba生物。化学。gydF4y2Ba284年gydF4y2Ba9290 - 9298 (2009)gydF4y2Ba
Underhaug, j . et al .突变转化生长因子β诱导蛋白质与颗粒状角膜营养不良1型降低了蛋白水解敏感性通过当地结构稳定。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1834年gydF4y2Ba2812 - 2822 (2013)gydF4y2Ba
Gindt, y . M。周,J。,Bryant, D. A. & Sauer, K. Spectroscopic studies of phycobilisome subcore preparations lacking key core chromophores: assignment of excited state energies to the Lcm, beta 18 and alpha AP-B chromophores.Biochim。Biophys。学报gydF4y2Ba1186年gydF4y2Ba153 - 162 (1994)gydF4y2Ba
兰西,c &迈尔斯,j .荧光和氧进化gydF4y2Ba小球藻pyrenoidosagydF4y2Ba。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba189年gydF4y2Ba366 - 383 (1969)gydF4y2Ba
村田:激发移动在光合作用的控制。即光致叶绿素荧光的变化gydF4y2Ba紫球藻属cruentumgydF4y2Ba。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba172年gydF4y2Ba242 - 251 (1969)gydF4y2Ba
菅直人ˇ,r . et al .藻胆体流动及其在光的调节作用收获红色海藻。gydF4y2Ba植物杂志。gydF4y2Ba165年gydF4y2Ba1618 - 1631 (2014)gydF4y2Ba
刘,h . et al .藻胆体供给励磁的光在megacomplex蓝藻。gydF4y2Ba科学gydF4y2Ba342年gydF4y2Ba1104 - 1107 (2013)gydF4y2Ba
任,y . et al .澄清和说明电子能量传递路径hexameric和三聚物的聚合状态的蓝藻allophycocyanin福斯特理论的框架内。gydF4y2Baj .第一版。化学。gydF4y2Ba36gydF4y2Ba137 - 145 (2015)gydF4y2Ba
Contreras-Martel, c . et al .藻青蛋白的结构2的决议gydF4y2BaGracilaria chilensisgydF4y2Ba和能量传递网络PC-PC复杂。gydF4y2BaBiophys。化学。gydF4y2Ba125年gydF4y2Ba388 - 396 (2007)gydF4y2Ba
诺克斯,r . s .超短流程和生物学。gydF4y2Baj . Photochem。Photobiol。BgydF4y2Ba49gydF4y2Ba81 - 88 (1999)gydF4y2Ba
格雷泽,a . n .光指南。定向天线光合能量传递。gydF4y2Ba生物。化学。gydF4y2Ba264年gydF4y2Ba1 - 4 (1989)gydF4y2Ba
Nganou C。,D一个vid, L., Adir, N. & Mkandawire, M. Linker proteins enable ultrafast excitation energy transfer in the phycobilisome antenna system ofThermosynechococcus炎术gydF4y2Ba。gydF4y2BaPhotochem。Photobiol。科学。gydF4y2Ba15gydF4y2Ba31-44 (2016)gydF4y2Ba
哈斯,b . j . et al .新创文字记录序列重建RNA-seq使用三一平台生成和分析供参考。gydF4y2BaNat协议。gydF4y2Ba8gydF4y2Ba1494 - 1512 (2013)gydF4y2Ba
a . et al . Blast2GO Conesa:注释的万能工具,可视化和分析在功能基因组学研究。gydF4y2Ba生物信息学gydF4y2Ba21gydF4y2Ba3674 - 3676 (2005)gydF4y2Ba
Lomsadze,。,Ter-Hovhannisyan, V., Chernoff, Y. O. & Borodovsky, M. Gene identification in novel eukaryotic genomes by self-training algorithm.核酸Res。gydF4y2Ba33gydF4y2Ba6494 - 6506 (2005)gydF4y2Ba
Emsley p &卡谭,k .傻瓜:模型分子图形的工具。gydF4y2BaActa Crystallogr。D杂志。Crystallogr。gydF4y2Ba60gydF4y2Ba2126 - 2132 (2004)gydF4y2Ba
李x等。电子计数和beam-induced运动校正使near-atomic-resolution单粒子低温电子显微镜。gydF4y2BaNat方法。gydF4y2Ba10gydF4y2Ba584 - 590 (2013)gydF4y2Ba
唐,g . et al . EMAN2:一个可扩展为电子显微镜图像处理套件。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba157年gydF4y2Ba38-46 (2007)gydF4y2Ba
谢尔,s·h·w·RELION:实现贝叶斯方法低温电子显微镜结构的决心。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba180年gydF4y2Ba519 - 530 (2012)gydF4y2Ba
谢尔,s·h·w·贝叶斯对低温电子显微镜结构的决心。gydF4y2Baj·摩尔,杂志。gydF4y2Ba415年gydF4y2Ba406 - 418 (2012)gydF4y2Ba
《j . a & Grigorieff:准确确定当地的散焦和电镜标本的倾向。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba142年gydF4y2Ba334 - 347 (2003)gydF4y2Ba
佩特森工作室内由手工制作完成,e . f . et al . UCSF Chimera-a可视化系统进行探索性的研究和分析。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba1605 - 1612 (2004)gydF4y2Ba
Kucukelbir,。,Sigworth, F. J. & Tagare, H. D. Quantifying the local resolution of cryo-EM density maps.Nat方法。gydF4y2Ba11gydF4y2Ba63 - 65 (2014)gydF4y2Ba
Nield, J。,R我zkallah, P. J., Barber, J. & Chayen, N. E. The 1.45 Å three-dimensional structure of C-phycocyanin from the thermophilic cyanobacterium聚球藻属elongatusgydF4y2Ba。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba141年gydF4y2Ba149 - 155 (2003)gydF4y2Ba
亚当斯,p . d . et al .凤凰:大分子结构全面面向系统的解决方案。gydF4y2BaActa Crystallogr。D杂志。Crystallogr。gydF4y2Ba66年gydF4y2Ba213 - 221 (2010)gydF4y2Ba
Murshudov g . N。,Vagin, A. A. & Dodson, E. J. Refinement of macromolecular structures by the maximum-likelihood method.Acta Crystallogr。D杂志。Crystallogr。gydF4y2Ba53gydF4y2Ba240 - 255 (1997)gydF4y2Ba
Brown, a . et al .工具大分子模型建立和细化成电子cryo-microscopy重建。gydF4y2BaActa Crystallogr。gydF4y2BaDgydF4y2Ba71年gydF4y2Ba136 - 153 (2015)gydF4y2Ba
尼科尔斯,r。费舍尔,M。,McNicholas, S. & Murshudov, G. N. Conformation-independent structural comparison of macromolecules with ProSMART.Acta Crystallogr。DgydF4y2Ba70年gydF4y2Ba2487 - 2499 (2014)gydF4y2Ba
确认gydF4y2Ba
我们感谢j . Lei l . Cheng和清华大学的人员的国家蛋白质科学中心北京提供设备支持;j .王为模型建立、结构改进和模型验证;j·戴推荐RNA序列;l·李和朱t .转录组注释;p .孟和f·陈基因组DNA测序和数据挖掘;诉Ragunath, o . Kovalevskiy和g Murshudov分子生物学实验室(MRC)的结构优化;n为模型建立高;h·林l . Chang和y刘讨论;H.-W。小王和j·吴评论手稿; and the members of the Tsinghua National Laboratory for Information Science and Technology for providing the “Explorer 100” cluster system as a computational resource. S.-F.S. and J.Zhao were supported by the National Basic Research Program (2016YFA0501101, 2017YFA0504600 and 2015CB150100). S.-F.S. and S.S. were supported by the National Natural Science Foundation of China (31230016, 31370717 and 31670745 and 31400632 and 31670746). J. Zhao also received support from the CAS fund (QYZDY-SSW-SMC004).
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
S.-F.S.发起并监督项目;J。张和J.M.准备样品;J。张EM数据和执行他们收集的分析和模型构建;J.M.进行生物化学和生物物理分析;J。张和D.L.精制的结构;轮和S.-F.S.结构分析;S.Q.促成了样本选择; J.Zhao participated in the analysis of biochemical data; and S.S., J.Zhao and S.-F.S. wrote the manuscript with help from all authors.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争的经济利益。gydF4y2Ba
额外的信息gydF4y2Ba
审核人信息gydF4y2Ba自然gydF4y2Ba由于h . van Amerongen z刘和c . Mullineaux贡献的同行评审工作。gydF4y2Ba
出版商的注意:施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
扩展数据数据和表gydF4y2Ba
扩展数据图1 PBS的制备和表征gydF4y2BaGriffithsia帕西菲卡gydF4y2Ba范和低温电子显微镜分析使用Tecnai北极蛤属显微镜和猎鹰II直接电子探测器。gydF4y2Ba
一个gydF4y2Ba使用蔗糖密度梯度离心法、隔离的pbs。带1是pbs的样品用于单粒子分析在这项研究。带2是拆卸pbs就是明证所示的荧光光谱gydF4y2BacgydF4y2Ba。gydF4y2BabgydF4y2Ba吸收谱带的1。高峰在498 nm、620 nm和650 nm的phycourobilins LgydF4y2BaRgydF4y2Baγ蛋白,藻青素allophycocyanins藻青蛋白和藻青素,分别。高峰在540 nm和565 nm的藻红蛋白的藻红素。gydF4y2BacgydF4y2Ba、荧光发射光谱乐队乐队1和2。带1有一个发射峰在674 nm和乐队2有一个发射峰在580 nm,表明乐队1包含完整的pbs和乐队2包含拆卸pbs。gydF4y2BadgydF4y2Ba在PBS、sds - page分析蛋白质的组件从乐队1。这种凝胶与考马斯亮蓝染色。L的乐队gydF4y2Ba厘米gydF4y2Ba,我gydF4y2BaRgydF4y2Ba和LgydF4y2Ba钢筋混凝土gydF4y2Ba蛋白,是被分析女士表示。凝胶源数据,请参阅gydF4y2Ba补充图1gydF4y2Ba。gydF4y2BaegydF4y2Ba、蛋白质成分分析带1的sds - page沾ZnSOgydF4y2Ba4gydF4y2Ba检测bilin-containing Zn-enhanced紫外线的荧光蛋白。L的乐队gydF4y2BaRgydF4y2Baγ4-8和是被分析和女士表示。凝胶源数据,请参阅gydF4y2Ba补充图1gydF4y2Ba。gydF4y2BafgydF4y2Ba,分析纯化pbs女士。两个批次的样品进行分析。类似的结果证实了我们的净化方法的一致性。gydF4y2BaggydF4y2Ba代表motion-corrected pbs的电子显微图。酒吧,规模100海里。gydF4y2BahgydF4y2Ba,典型的好,reference-free 2 d类平均单粒子图像的pbs。规模的酒吧,20海里。gydF4y2Ba我gydF4y2Ba为对照,低温电子显微镜的傅里叶shell (FSC)的相关性曲线PBS地图有或没有C2对称。gydF4y2BajgydF4y2Ba欧拉角分布的粒子造成的最终重建PBS。每个气缸都代表一个视图和气缸的大小正比于这一观点的粒子数。gydF4y2BakgydF4y2Ba,3 d的工作流分类。gydF4y2BalgydF4y2Ba的晶体结构allophycocyanin (PDB 1 b33)可以安装与PBS的密度地图不同的看法。gydF4y2Ba
扩展数据图2低温电子显微镜分析使用Tecnai PBS的克里奥尔语显微镜和Gatan K2峰会直接电子探测器。gydF4y2Ba
一个gydF4y2Ba代表motion-corrected pbs的电子显微图。酒吧,规模100海里。gydF4y2BabgydF4y2Ba傅里叶功率谱的显微照片显示索恩环扩展到3。gydF4y2BacgydF4y2Ba,典型的好,从单粒子PBS reference-free 2 d类平均图像。酒吧,规模100海里。gydF4y2BadgydF4y2Ba为对照,FSC曲线最终低温电子显微镜的地图的分辨率值为0.143和3.5 FSC曲线之间的精确模型和最终映射值为0.5 4.0的一项决议。gydF4y2BaegydF4y2Ba,黄衫军的最后3 d重建当地PBS显示分辨率的不同的观点。gydF4y2BafgydF4y2Ba工作流的2 d和3 d为低温电子显微镜数据分类处理。gydF4y2BaggydF4y2Ba,屏蔽策略来处理PBS的灵活的地区。几个当地面具不同部分的应用,进一步,这面具被应用于一些特定的地区,导致改善分辨率和当地地图品质。gydF4y2Ba
扩展数据图3 PBS的总体结构。gydF4y2Ba
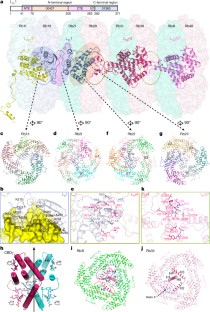
一个gydF4y2Ba,3 d低温电子显微镜密度PBS的地图。gydF4y2BabgydF4y2Ba顶视图的PBS的原子模型。gydF4y2BacgydF4y2Ba,原理图显示棒的组织从三个垂直气缸和核心观点。gydF4y2BadgydF4y2Ba,棒和核心的组织显示在表面表示。gydF4y2BaegydF4y2Ba,组织的关键结构元素的核心)(a - c棒和PBS显示在表面表示。蛋白质组件颜色如图所示。gydF4y2BafgydF4y2Ba,20好看链接器结构蛋白质。原子模型,这些链接器蛋白与分段叠加低温电子显微镜密度(透明灰色)。域的αgydF4y2Ba中国大陆gydF4y2BaPfam00427 (00427), Pfam01383 (01383), CBDγ,FAS1标签。gydF4y2BaggydF4y2Ba示意图,PBS子单元的结构元素。PBS子单元分为四组根据他们的位置和功能:藻胆蛋白(是),链接器的核心,杆连接器和rod-core连接器。不同的结构元素分别是彩色的。gydF4y2Ba
扩展数据图4杆链接器蛋白质的结构和约束力的合作伙伴。gydF4y2Ba
一个gydF4y2Ba、比较Pfam00427域的LgydF4y2BaRgydF4y2Ba1的晶体结构Pfam00427域从链接器L (PDB 3一组)gydF4y2BaRgydF4y2Ba30.gydF4y2Ba从gydF4y2Ba集胞藻属gydF4y2BaPCC 6803 sp。这两个结构几乎是相同的。gydF4y2BabgydF4y2Ba、比较Pfam01383域的LgydF4y2BaRgydF4y2Ba1的晶体结构Pfam01383 PBS的域(PDB 1 b33)gydF4y2BaMastigocladus laminosusgydF4y2Ba。长α-helix和三个β-strands标签。gydF4y2BacgydF4y2Ba,我gydF4y2BaRgydF4y2Ba2位于杆的内部六聚体Rg (Rg1)。它的C端扩展循环和一个小β-sheet由两个反平行的β-strands的C末端接触的外表面五个一Rb1而已。gydF4y2BadgydF4y2Ba,我gydF4y2BaRgydF4y2Ba3位于杆的内部六聚体射频(Rf1)及其C末端以长α-helix结束。的氨基端部分长螺旋插入五个一Rc1和Rf1之间的区域c端长螺旋卷曲螺旋结构形式的一部分(红色椭圆)与其对称LgydF4y2BaRgydF4y2Ba3′位于六聚体Rf1′。这些结构稳定杆对Rf射频′,相互关联,锚棒Rc和Rc′。gydF4y2BaegydF4y2Ba、结构叠加的LgydF4y2BaRgydF4y2Baγ4-8蛋白质,显示了几乎相同的CBDγCBDγ外的结构和不同的构象。gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,我gydF4y2BaRgydF4y2Baγ6-8 CBDγ域位于五个一高清,哈,Hb,分别。L c端循环的gydF4y2BaRgydF4y2Baγ6锚杆外一侧的内层的六聚体的Rc (Rc1) (gydF4y2BafgydF4y2Ba);L的C末端gydF4y2BaRgydF4y2Baγ7包含几个短α-helices和六聚体与表面的相互作用以Rd2和Rg1 (gydF4y2BaggydF4y2Ba);和一个α-helix N末端的LgydF4y2BaRgydF4y2Baγ8插入两个五个一红警2和Ra3中(之间的空间gydF4y2BahgydF4y2Ba)。gydF4y2Ba我gydF4y2BaL, n端结构域的结构叠加gydF4y2BaRgydF4y2Ba9和FAS1域(PDB 2 ltb)。gydF4y2BajgydF4y2Ba,我gydF4y2BaRgydF4y2Ba9位于棒之间Ra, Rb, Rd, Rg和与他们交互。FAS1域由一个红色的虚线圈。gydF4y2Ba
图5扩展数据广泛的杆杆链接器蛋白质之间的相互作用,是Rb。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba扩展视图之间的交互的CTR LgydF4y2BaRgydF4y2Ba1和三聚物Rb1II对应gydF4y2Ba图2 cgydF4y2Ba。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba扩展视图之间的交互的交织的《和CTE n端地区LgydF4y2BaRgydF4y2Ba1和三聚物Rb2I对应gydF4y2Ba图2 dgydF4y2Ba。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,扩大了L的Pfam00427域之间的相互作用的观点gydF4y2BaRgydF4y2Ba1和三聚物Rb2I对应gydF4y2Ba图2 fgydF4y2Ba。gydF4y2BahgydF4y2Ba,扩大了L的Pfam00427域之间的相互作用gydF4y2BaRgydF4y2Ba1和三聚物Rb2II对应gydF4y2Ba图2 ggydF4y2Ba。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba扩展视图之间的交互的CBDγLgydF4y2BaRgydF4y2Baγ4和三聚物Rb3I对应gydF4y2Ba图2我gydF4y2Ba。gydF4y2BalgydF4y2Ba,扩大了视图的CBDγL之间的交互gydF4y2BaRgydF4y2Baγ4和三聚物Rb3II对应gydF4y2Ba图2 jgydF4y2Ba。螺旋X是标签和突出显示。残留参与原子交互网站坚持表示所示。α、β和H表示α-subunit分别β-subunit和螺旋。gydF4y2Ba米gydF4y2Ba,CBDγ接触杆六聚体的内表面在一个对称的时尚。当第一个重复的CBDγLgydF4y2BaRgydF4y2Baγ4(左gydF4y2BaRgydF4y2Baγ4-CBDγ-1Rep)与第二个重复的CBDγLgydF4y2BaRgydF4y2Baγ4(左gydF4y2BaRgydF4y2Baγ4-CBDγ-2Rep),三(Rb3I和Rb3II),他们相互作用也一致。gydF4y2Ba
图6扩展数据序列比对的LgydF4y2BaRgydF4y2Baγ4-8和γ-subunits从不同的红藻物种和比邻杆b。gydF4y2Ba
一个gydF4y2Ba氨基酸序列比对。预测交通肽推断序列比对和CBDγ域基于结构标签。保守的半胱氨酸残基共价连接到生色团是用蓝色突出显示。注意,一个半胱氨酸残基的CBDγLgydF4y2BaRgydF4y2Baγ7被丝氨酸(用黄色突出显示),符合事实,只有四个发色团在LgydF4y2BaRgydF4y2Baγ7与其他CBDγ领域相比,五发色团。P34784、P92928γ-subunitsgydF4y2BaAglaothamnion neglectumgydF4y2Ba;R7Q9W8、R7QDA3γ-subunitsgydF4y2Ba陨石球粒管gydF4y2Ba;Q7XZS8、P83592γ-subunitsgydF4y2Ba最纯粹gydF4y2Ba。gydF4y2BabgydF4y2Ba,一些示威人群在Rb之间的距离。品红色,比邻的LgydF4y2BaRgydF4y2Baγ;橙色,比邻的β-subunits六聚体藻红蛋白;黄色,比邻的α-subunits六聚体藻红蛋白;深绿色叶,比邻的β-subunits藻青蛋白六聚物;青色,比邻的α-subunits藻青蛋白六聚物;粉色,比邻的藻青蛋白核心的六聚体。虚线显示附近的数字之间的距离(A)比邻在链接器是蛋白质和相邻的示威人群。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,低温电子显微镜密度(网格)的示威人群(棒)藻红蛋白三聚物Rb2II (gydF4y2BacgydF4y2Ba),藻青蛋白三聚物Rb1II (gydF4y2BadgydF4y2Ba),LgydF4y2BaRgydF4y2Baγ4蛋白(gydF4y2BaegydF4y2Ba)和LgydF4y2BaRgydF4y2Baγ5gydF4y2Ba一个gydF4y2Ba蛋白(gydF4y2BafgydF4y2Ba)。gydF4y2Ba
扩展数据图7 L之间的相互作用gydF4y2Ba钢筋混凝土gydF4y2Ba1 - 3和核心。gydF4y2Ba
一个gydF4y2Ba,α的叠加gydF4y2BaAPCgydF4y2Ba子单元和空间位置的交互LgydF4y2Ba钢筋混凝土gydF4y2Ba蛋白质。使用α执行的排列方式gydF4y2BaAPCgydF4y2Ba亚基作为参考。注意联系螺旋线的LgydF4y2Ba钢筋混凝土gydF4y2Ba蛋白(黑色箭头)也很一致。插图显示了螺旋槽形成αB和EgydF4y2BaAPCgydF4y2Ba亚基。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba之间的相互作用,αgydF4y2BaAPCgydF4y2Ba亚基的螺旋线LgydF4y2Ba钢筋混凝土gydF4y2Ba2 (gydF4y2BabgydF4y2Ba)和LgydF4y2Ba钢筋混凝土gydF4y2Ba3 (gydF4y2BacgydF4y2Ba)。所涉及的残留L之间的交互gydF4y2Ba钢筋混凝土gydF4y2Ba蛋白质是彩色的绿色和坚持所示表示。的αgydF4y2BaAPCgydF4y2Ba面所示表示,残留参与互动是红色的。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba序列比对的LgydF4y2Ba钢筋混凝土gydF4y2Ba1 - 3 (gydF4y2BadgydF4y2Ba)和αgydF4y2BaAPCgydF4y2Ba(gydF4y2BaegydF4y2Ba从不同的红藻和蓝藻种类)。残基参与交互由星号表示,黄色突出显示。gydF4y2Ba
图8扩展数据结构和组装的角色gydF4y2Ba钢筋混凝土gydF4y2Ba4、LgydF4y2Ba钢筋混凝土gydF4y2Ba5和LgydF4y2Ba钢筋混凝土gydF4y2Ba6。gydF4y2Ba
一个gydF4y2Ba,L的概述gydF4y2Ba钢筋混凝土gydF4y2Ba4和LgydF4y2Ba钢筋混凝土gydF4y2Ba5包装其靶蛋白成分。S1′和S2′是单一的α-和β-subunits,分别。gydF4y2BabgydF4y2Ba在中间,长α-helix LgydF4y2Ba钢筋混凝土gydF4y2Ba4′跨越核心三聚物B1α-subunit之一。gydF4y2BacgydF4y2Ba在中间,长α-helix LgydF4y2Ba钢筋混凝土gydF4y2Ba5跨越三聚物的一个α-subunit B2。gydF4y2BadgydF4y2Ba的氨基端扩展LgydF4y2Ba钢筋混凝土gydF4y2Ba4′蜿蜒在表面的三聚物Rb1′我和LgydF4y2Ba钢筋混凝土gydF4y2Ba1gydF4y2BabgydF4y2Ba′。gydF4y2BaegydF4y2BaL, c端延长gydF4y2Ba钢筋混凝土gydF4y2Ba5与核心层B2,杆三聚物Rb1′我和LgydF4y2Ba钢筋混凝土gydF4y2Ba1gydF4y2BabgydF4y2Ba′。gydF4y2BafgydF4y2Ba的氨基端扩展LgydF4y2Ba钢筋混凝土gydF4y2Ba5包装表面的三聚Rc1I B1,并联系我gydF4y2Ba钢筋混凝土gydF4y2Ba1gydF4y2BacgydF4y2Ba。gydF4y2BaggydF4y2Ba,结构的LgydF4y2Ba钢筋混凝土gydF4y2Ba6。gydF4y2BahgydF4y2Ba、结构叠加FAS1域的LgydF4y2Ba钢筋混凝土gydF4y2Ba6和已知FAS1域(PDB 2 ltb)。α-helices和β-strands贴上标签。gydF4y2Ba我gydF4y2Ba,我gydF4y2Ba钢筋混凝土gydF4y2Ba6′,像一个楔子,插入三之间的区域Rd1 3′′我和Re1I层核心,并使广泛接触与周围的蛋白质成分,包括3′,LgydF4y2Ba厘米gydF4y2BaL′,gydF4y2BaCgydF4y2BaL′,gydF4y2Ba钢筋混凝土gydF4y2Ba2′,Rd1′我和Re1I扩展循环两岸的FAS1域。gydF4y2Ba
图9扩展数据结构的核心。gydF4y2Ba
一个gydF4y2Ba,在四垂直结构的核心观点显示了组装和安排的核心层次。底部视图(一样的观点gydF4y2Ba图4摄氏度gydF4y2Ba)显示表面静电势分布的核心。表面的αgydF4y2Ba中国大陆gydF4y2Ba分子环绕。在PyMol表面静电势计算。红色,负静电势;蓝色,积极静电势;灰色,非极性。gydF4y2BabgydF4y2Ba的卡通模型的核心hemidiscoidal PBS(改编自ref。gydF4y2Ba1gydF4y2Ba)。注意,基底油缸有四个三。gydF4y2BacgydF4y2Bainter-cylinder交互的核心是对称的:三聚B1, A2和1′相互作用和三聚B2, 2′和A1相互作用。协会是由之间的交互三个α-subunits(红圈)和两双α−β亚基(黑圈)。gydF4y2BadgydF4y2Ba、比较三个区域的LgydF4y2Ba厘米gydF4y2Ba的晶体结构Pfam00427域。L的三个区域的结构gydF4y2Ba厘米gydF4y2Ba(左gydF4y2Ba厘米gydF4y2Ba-Reg1-3)显示为显示他们加上Pfam00427域的晶体结构(PDB 3正烷烃)是一致的。gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba特写视图三个PCB口袋β-subunits盒装的虚线gydF4y2Ba图4 dgydF4y2Ba:β1 (gydF4y2Ba一个gydF4y2Ba),β2 (gydF4y2BabgydF4y2Ba)和ApcF (gydF4y2BacgydF4y2Ba)。比邻及其周围残留所示ball-stick表示和坚持表示,分别。低温电子显微镜密度(网)与相应的原子模型叠加(棒)较低的面板所示。gydF4y2BahgydF4y2Ba、结构叠加ApcF和βgydF4y2BaAPCgydF4y2Ba表明ApcF扩展G-H螺旋发卡的尖端。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba低温电子显微镜密度(网)比邻的αgydF4y2Ba中国大陆gydF4y2Ba核心层的α3单元A2,和周围的残留物,对应gydF4y2Ba图4 fgydF4y2Ba与各自的原子模型,叠加(棒;彩色的gydF4y2Ba图4gydF4y2Ba)。gydF4y2Ba
扩展数据图10 APC子单元的识别。gydF4y2Ba
低温电子显微镜密度(网格)的代表地区的APC子单元,与各自的原子模型叠加(棒)。注意不同密度的残留物用红色标记。gydF4y2Ba
扩展数据图11个人六聚体和棒之间合理的能量转移;棒Rd和再保险之间的核心;和棒之间。gydF4y2Ba
一个gydF4y2Ba,示威人群之间的距离(A)接口的个人六聚体Ha和杆Rd(左),和Hb和Ra(右)。gydF4y2BabgydF4y2Ba从比邻,似是而非的能量传递路径Rd和再保险′的核心。嵌入面板显示两个相邻比邻之间的距离(A)。gydF4y2BacgydF4y2Ba之间,似是而非的能量传递路径对Rd和Rb比邻。嵌入面板显示两个相邻比邻之间的距离(A)。gydF4y2BadgydF4y2Ba,合理的能量传递从比邻Ra或Rc。嵌入面板显示两个相邻比邻之间的距离(A)。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
这个文件包含补充表1(总结藻胆体的模型建立),补充表2 (25 PBS蛋白质序列),和补充图1 (uncropped SDS PAGE凝胶的扩展数据图1 d, e)。(PDF 2285 kb)gydF4y2Ba
权利和权限gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
张,J。,妈,J。,我我u, D.et al。gydF4y2Ba从红藻藻胆体的结构gydF4y2BaGriffithsia帕西菲卡gydF4y2Ba。gydF4y2Ba自然gydF4y2Ba551年gydF4y2Ba57 - 63 (2017)。https://doi.org/10.1038/nature24278gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/nature24278gydF4y2Ba
本文引用的gydF4y2Ba
红藻的原位结构phycobilisome-PSII-PSI-LHC megacomplexgydF4y2Ba
自然gydF4y2Ba(2023)gydF4y2Ba
低温电子显微镜和飞秒光谱研究提供机械的见解CpcL-phycobilisomes能量转移gydF4y2Ba
自然通讯gydF4y2Ba(2023)gydF4y2Ba
诱变的分析bundle-shaped藻胆体从Gloeobacter violaceusgydF4y2Ba
光合作用研究gydF4y2Ba(2023)gydF4y2Ba
non-photochemical淬火效率和能量转移率之间的关系从藻胆体光系统IIgydF4y2Ba
光合作用研究gydF4y2Ba(2023)gydF4y2Ba
红藻适应弱光通过修改藻胆体成分保持高效的光收获gydF4y2Ba
BMC生物学gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba
