摘要
遗传性听力损失具有遗传异质性,临床表现多样。我们对1027名双侧听力损失患者和520名听力正常的健康志愿者进行了227个听力损失相关基因的靶向基因组测序,以全面确定中国大队列中遗传性听力损失的分子病因学。我们得到患者的诊断率为57.25%(588/1027),而4.67%(48/1027)的患者诊断不确定。在涉及的35个听力损失基因中,有3个常见基因,包括SLC26A4(278/588),GJB2(207/588),MT-RNR1(19/588),占诊断病例的85.54%(503/588),而32个罕见的听力损失基因,包括MYO15A,MITF,OTOF,POU3F4,PTPN11等占其余诊断率14.46%(85/588)。除Pendred综合征外,还发现了其他8种类型的综合征性听力损失。在患者中鉴定的64个不确定显著变异和244个致病/可能致病变异中,还检测到129个新变异。因此,分子病因表现出较高的异质性,主要病因为SLC26A4而且GJB2中国听力损失人群的基因。迫切需要建立民族匹配健康人群数据库,并开展功能研究,进一步对不确定显著变异进行分类。
简介
据了解,全球有超过5亿人受到听力损失的影响[1],预计到2050年,这一数字将达到约25亿(https://www.who.int).这种疾病已知会对受影响的个体造成各种不良影响[2,3.,4].HL的病因包括遗传原因、非遗传原因和这两种因素的结合[5,6].据估计,约60%的HL患者有遗传性听力损失[7],而基因原因在全球不同种族人群中差异巨大[8,9].
HHL在基因型和表型上均具有高度异质性。到目前为止,已鉴定出140多个HL基因,这些基因的遗传模式涉及常染色体隐性(AR)、常染色体显性(AD)、x连锁和线粒体遗传(http://hereditaryhearingloss.org).因此,HHL的临床表现是多样的。HL的各种类型包括感音神经性、传导性和混合性HL,而HL的严重程度包括轻度、中度、重度和重度,可发生在生命的任何年龄。除了单纯的HL外,遗传原因也可导致综合征性听力损失[6].此外,除单基因遗传外,HL患者的遗传也有报道[10,11,12].同时,仍有报道不支持HL的遗传遗传模式[13,14].
鉴于HL基因数量庞大,高通量测序技术的出现和发展使HL分子病因学的鉴定发生了革命性的变化[15,16].大规模并行测序已成为该领域一种高效的常规诊断和研究方法[17].随后,除了常见的HL基因外,更多的患者被发现与HL基因相关的阳性诊断,如GJB2,SLC26A4,MT-RNR1在中国人口中[18,19].
在本研究中,我们专注于HL的单基因遗传,旨在评估来自中国的大型队列中遗传因素对HL的贡献,并确定该队列中的基因谱。我们从中国招募了1577名受试者,包括1027名双侧HL患者和520名听力正常的健康志愿者,并对他们进行了靶向基因组富集和277个HL相关基因的多次并行测序。这些结果将增强我们对中国人群HL分子病因学的认识,有助于指导医疗保健,促进对患者及其家属的遗传咨询[20.].
材料与方法
主题
中国人民解放军总医院伦理委员会批准本研究(No.;S2016-120-01),与《赫尔辛基宣言》一致。所有参与者或未成年人的父母均获得书面知情同意。
在本研究中,除520名听力正常的健康志愿者外,还纳入了1027名双侧听力损失的非相关先证者,他们在2015-2017年期间被转介到耳聋基因检测中心,均进行了常见HL基因检测,包括GJB2,SLC26A4,MT-RNR1(m.A1555G, m.C1494T) Sanger测序。
采用纯音测听法进行听力学评价。对于不能进行纯音测听的受试者,进行听觉稳态反应或行为听觉测试或听觉脑干反应测试。听力水平由较好耳纯音测听、听觉稳态反应和行为听觉测试频率0.5、1、2和4千赫的平均阈值或听觉脑干反应的反应阈值确定。如有需要,建议使用其他听力测试技术,包括耳声发射、40 Hz听觉事件相关电位(40 Hz AERP)等。HL的严重程度分为轻度(26 ~ 40 dB)、中度(41 ~ 55 dB)、中度(56 ~ 70 dB)、重度(71 ~ 90 dB)、重度(> ~ 90 dB) [21].不对称听力被定义为两个耳朵在0.5、1、2和4千赫频率或三个相邻频率上的平均水平差异大于15分贝[22,23,24].
对颞骨进行高分辨率计算机断层扫描以评估内耳结构的畸形。对于综合征性HL患者,如有必要,建议进行其他体检。
对健康志愿者进行体检,包括体温、身高、体重、脉搏、血压、心电图、经腹超声、胸片、精神科检查、神经科检查、耳鼻喉科检查、光学检查。纯音测听法测定的双耳听力水平均小于25 dB。
采用标准方法从每个受试者及其家庭成员的外周血白细胞中提取DNA。
测序
本研究共纳入227个HL相关基因:AR非综合征HL相关基因60个,AD非综合征HL相关基因27个,X-link HL相关基因5个,综合征HL相关基因34个,以及人孟德尔遗传中记录的101个HL表型遗传性疾病相关基因。
安捷伦SureDesign在线工具(https://erray.chem.agilent.com/suredesign/)设计了针对所有外显子、内含子侧翼序列(±10 bp)和位于227个hl相关基因内含子中的已知致病变异的探针。因此,覆盖1.101 Mbp基因组的4544个区域被靶向。使用Ion Plus片段文库试剂盒(Agilent Technologies, Santa Clara, CA)进行文库准备,DNA片段长约170 bp。SureDesign杂交捕获技术(Agilent Technologies, Santa Clara, CA)按照制造商的说明进行应用。制备的DNA样品经京鑫生物电子seq 4000系统半导体测序仪(CFDA注册许可号:;20153400309)。
生物信息学分析
Torrent Suite Software v5.4 (Thermo Fisher Scientific, Waltham, MA)分析管道用于生成高质量的读取文件。在数量控制后,利用Torrent Mapping Alignment Program(3.6.40)将序列reads与人类参考序列基因组(hg19)进行比对。使用Picard(1.84)去除重复读取。Torrent Variant Caller软件v5.4-11用于检测单核苷酸变异(SNVs)和插入和删除(INDEL)变异。
变异的解释
将检测到的读深度< 5X的变量过滤掉。使用ANNOVAR(20170601)对变量进行标注。人群数据库中报道的等位基因频率较小的变异>0.05,包括dbSNP (http://www.ncbi.nlm.nih.gov/snp)(20170929),千人基因组计划(http://www.browser.1000genomes.org)(20150824),基因组聚合数据库(gnomAD;http://gnomad.broadinstitute.org)(20170311)被过滤掉。采用SIFT(20170221)、polyphen2(20170221)、MCAP(20170221)、REVEL(20161205)、MutationTaster(20170221)、provvian(20170221)对变异的损伤进行预测。
参照耳聋变异数据库(2020-07-30),结合对照组520名听力正常个体的等位基因频率,进一步解释检测到的候选变异(http://deafnessvariationdatabase.org), ClinVar (2020-07-30) (http://www.ncbi.nlm.nih.gov/clinvar),以及我们的内部数据库。由于在ClinVar和dbSNP等数据库中未见报道,因此确定了新的变异。本研究中发现的新变异被提交到CinVar数据库。此外,候选变异和受影响个体的表型之间的相关性是在患者的基础上考虑的。Sanger测序证实了家族中的变异。对于新生变异,采用短串联重复分型法进行基因型分析,验证父系和母系。最后,根据ACMG指南和HHL指南的规范对变异进行分类[25,26].
拼接试验
对于一些检测到的剪接变异,进行小基因分析以验证对剪接的影响[27,28].这对携带野生型序列或变异序列的小基因克隆分别转染HEK-293T细胞。
统计分析
采用SPSS Statistics 25进行卡方分析,比较各组之间的差异。统计学意义定义为P< 0.05。
结果
定向捕获测序
我们使用靶向基因组测序测试了1547名受试者。在HL相关的227个基因中,平均99%、98.7%、98%、97%的靶向碱基(表2)S1)分别覆盖1X、5X、10X、20X读数。
基因诊断
表格1介绍患者的临床资料。健康志愿者男性352名,女性168名,年龄18 ~ 58岁,平均年龄30.79±9.15岁。
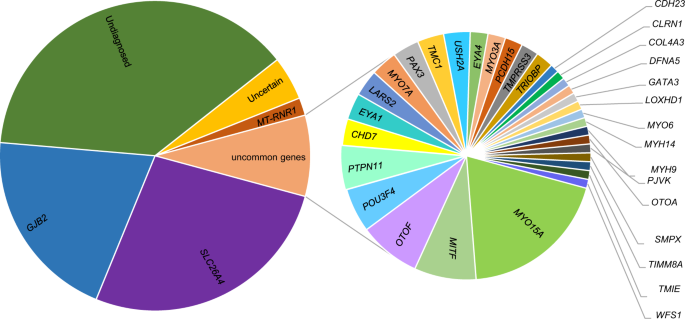
在1027例HL患者中,588例患者的遗传原因被确定,因为考虑了致病或可能致病的变异。其他48例(不确定意义,差异在POU4F3和致因变体GJB2在HL基因的一个等位基因中至少发现了一个不确定显著性变异(VUS),即使在AR基因的另一个等位基因中发现了致病/可能致病变异,也被确定为不确定。其余392例患者被归类为未诊断(图。1).
此外,在诊断的患者中涉及35个HL基因,两个先导基因是SLC26A4(278/588),GJB2(207/588),如先前报告[29].的致因变体MT-RNR1检出19例(m.A155G 18例,m.C1494T 1例)。这三个基因被认为是中国常见的HL基因[19,29].
然后,32个不常见基因占了其余86例诊断患者(致病变异SLC26A4而且COL3A4在一名患者中同时被发现)。在3名以上患者中检测到的基因包括MYO15A(17/86),MITF(7/86),OTOF(7/86),POU3F4(5/86),PTPN11(5/86),TMC1(3/86),LARS2(3/86),PAX3(3/86),EYA1(3/86),CHD7(3/86)。MYO7A(3/86),USH2A(3/86)。在86例患者亚组中,55例被诊断为非综合征性HL。其余27例患者被确定为综合征性HL(表2).其他四名患者有变异USH2A,CLRN1,未观察到眼部表型的Usher综合征的相关基因被归类为非综合征性HL (NSHL)拟态[30.].
变体识别
我们鉴定了20个致病/可能致病的变异GJB2(表S2)为遗传原因。两个主要致病变异为NM_004004.6: c.235delC和c.299-300del,分别在该患者亚组中检出84.06%(174/207)和32.37%(67/207)。
接下来,85个致病/可能致病变异SLC26A4(表S3)被确定为278例被诊断为Pendred综合征或单纯HL伴前庭导水管增大患者的潜在分子病因,其中26种变体此前未见报道。最常见的两种致因变体SLC26A4NM_000441.2: c.919-2 A > G和c.2168 G > A的检出率分别为21.22%(59/278)和76.26% (212/278)SLC26A4分别为相关患者。表格S4介绍由基因变异引起的患者的表型信息GJB2而且SLC26A4.
我们还在86例患者中鉴定了32个不常见HL基因中的117个致病/可能致病变异作为分子原因(表2)S5),其中在AD或x -连锁HL基因中检测到19个从头变异体。
此外,我们在48例患者的24个HL基因中鉴定出64个VUS,这些变异都是点变异。此外,在该患者亚组中还鉴定出20种致病/可能致病变异(表2)S6).
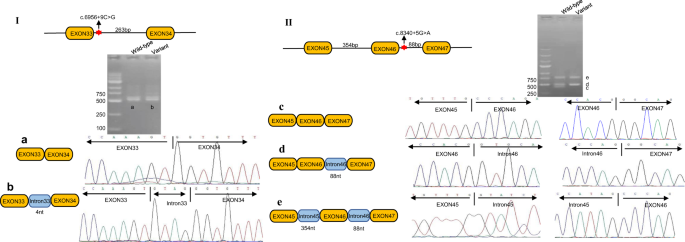
两个剪接变量的验证
微量基因分析结果显示NM_016239.4: C .6956 + 9 C > GMYO15Ac.8340 + 5 G > A捕获了intron33的4个核苷酸(nt),而c.8340 + 5 G > A捕获了intron45和intron46,这表明这两个剪接变体改变了该基因的表达模式(图)。2).
表型和诊断率
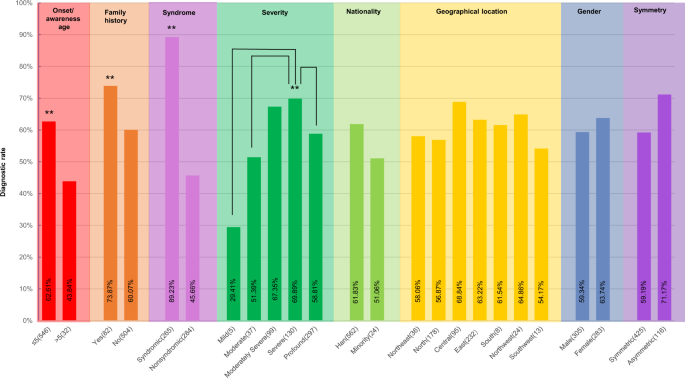
分析了临床表型对诊诊率的影响,包括性别、发病/意识年龄、家族史、HL的严重程度、患耳对称性、地理位置和国籍(图2)。3.、表S7).有家族史先证者的诊断率明显高于无家族史先证者(73.87% vs. 60.07%)。P< 0.01)。同样,发病/意识年龄在5岁以下的患者诊断率为62.69% (P< 0.01),综合征性HL患者为89.23% (P< 0.005)。这一结果表明,遗传原因在这三个亚组的病因学中起着重要作用。
轻度HL(29.41%)、中度HL(51.39%)、重度HL(58.51%)的诊断率明显低于重度HL (69.89%) (P< 0.005,P< 0.005,P分别< 0.01)。这种差异可能是由亚组患者的差异引起的SLC26A4:如果我们排除与。有关的病人SLC26A4从诊断组来看,不同HL水平的各亚组之间的诊断率无明显差异(P> 0.05)。
在577例可获得高分辨率计算机断层成像的患者中(不包括前庭导水管增大和不完全隔断III型患者,共297例,与SLC26A4而且POU3F431例诊断为内耳畸形(图2)。S1) [31].在这31例患者中,有28例未得到分子诊断S8),仅3例IV型耳蜗发育不全患者与耳蜗发育不全有关EYA1基因。这一结果提示有必要进一步研究这种分子未诊断的内耳畸形的病因[32,33].
讨论
病例对照研究
在种族匹配的健康人群中,变异的等位基因频率对于变异的分类非常有用[25,26].在此,为了探索来自中国的大型队列的分子病因学,进行了病例对照研究。对于检测到的变异,除了公开人群数据库中的等位基因频率外,还考虑了对照组中检测到的变异频率(表2)S2,S3,S5,S6).例如,NM_206933.4:c。8559-2 A > G inUSH2A,对照组等位基因频率为4/2054,患者组等位基因频率为4/1040。根据本研究的数据,该变异被鉴定为VUS,而在耳聋变异数据库中被归类为致病性。然而,我们仍然注意到对照组的数量相对于患者组的数量较少,这意味着建立种族匹配健康人群HL变异数据库以改进变异解释的紧迫性。
对于患者组,除了双侧HL外,没有其他排他性的标准,认为双侧HL比单侧HL更可能与遗传病因有关[30.].此外,所有患者都进行了常见HL基因的预筛选,包括GJB2,SLC26A4,MT-RNR1(m.A1555G, m.C1494T) Sanger测序。因此,HL的诊断由MT-RNR1均从第一代测序中获得。
病人的诊断
在这项研究中,三种常见基因,包括GJB2,SLC26A4,MT-RNR1,占诊断患者组的85.54%(分别为503/588、35.20%、47.28%、3.23%),32个不常见的hl相关基因占其余14.46%(85/588)的诊断产量。据报道,美国459例HL患者中有28%(128例)的基因检测呈阳性,其中5个主要涉及基因为GJB2,TMPRSS3,SLC26A4,MYO7A,MT-RNR1(分别为16%、10%、8%、7%、5%)[34].另一份报告显示,来自491个巴勒斯坦家庭的2198名HL患者中有56%是遗传的,涉及的前5个基因是GJB2,MYO15A,SLC26A4,MYO7A,CDH23(分别为22%,11%,8.9%,8.3%,5%),最常见的变异为c.35delGGJB2c.1001 G > T inSLC26A4c.7207 G > T inMYO15A[35].虽然在这些已发表的报道中,受试者的纳入标准各不相同,但我们仍然可以推测,这一中国患者队列的分子病因谱和频率与其他人群不同[36,37,38].
在这里,我们关注的序列变异主要位于227个hl相关基因的外显子。此外,还有其他的致病变异体没有在本小组中涵盖,包括(1)位于目标基因的其他非编码区域的变异体;(2)其他变异类型,如已证实涉及HL的拷贝数变异;(3)未知的新型HL基因[39,40].如果考虑上述本组未涵盖的变异类型和48例不确定诊断患者,HHL在该患者队列中的比例将大于57.25%(588/1027)。
表型对诊断率的影响
在分子诊断率的临床表型分析中,纳入诊断患者588例,未诊断患者370例,诊断率(%)=亚组诊断患者数/亚组诊断与未诊断患者总数× 100%(表2 - 2)S7).在诊断率的计算中,从未诊断患者组(392例)中剔除22例具有与HHL高度相关的特征性表型的未诊断患者,其中18例前庭导水管增大患者携带一种致病变异SLC26A43例诊断为Waardenburg综合征,1例IP-III内畸形。因此,在诊断率分析中考虑了370例未确诊患者。
在目前的研究中,我们注意到少数民族患者仅占患者组的5.16%。同样,东北、南方、西北、西南地区先证者均占14.51%,发病/意识年龄为>5岁的患者占整个患者组的7.40%,轻度和中度HL患者占9.05%(表1)1).这些数据表明,在未来的调查中,应该从这些亚组中纳入更多的受试者,以增强我们对这些人群中HHL的认识。
在AD和x连锁HL基因中发现了新生变异
在本研究中,由AD或x连锁HL基因变异引起的36例诊断患者中,有20例被确定为由7个基因的19个从头变异引起。例如,五种变体PTPN11基因和三种变体CHD7本研究检测到的基因均为新生突变。由于缺乏先证者和携带者身份,新生变异的产前筛查尚未在临床上得到。但在2019年,一项研究报道了使用循环无细胞胎儿DNA对一组常见显性单基因疾病的致病基因进行无创产前筛查[41].这种方法提供了足够的敏感性和特异性水平,可以转移到临床实践中筛查这种类型的变异。
结论
在本研究中,57.25%的患者组分子诊断阳性,涉及35个致病基因。在诊断患者中鉴定出的224个变异中,83.04%(186/224)与AR遗传有关,12.95%(29/224)与AD遗传有关,3.12%(7/224)与X-linked遗传有关,0.89%(2/224)与线粒体遗传有关。另有4.67%(48/1027)的患者诊断不确定,至少有一次VUS,这表明需要更多的策略来对VUS进行分类。
数据可用性
在合理的要求下,数据可从通讯作者处获得。
参考文献
Wilson BS, Tucci DL, Merson MH, O 'Donoghue GM.全球听力保健:新发现和新展望。《柳叶刀》杂志。2017;390:2503-15。
李敏敏,张旭,Hoffman HJ, Cotch MF, Themann CL, Wilson MR.美国成人听力障碍与抑郁症的相关性,2005-2010年国家健康与营养调查。美国耳鼻咽喉头颈外科杂志2014;140:293-302。
陈志伟,陈志伟,陈志伟。听力损伤与死亡率的相关性研究。美国耳鼻咽喉头颈外科杂志2015;141:946 - 46。
Stika CJ, Eisenberg LS, Johnson KC, Henning SC, Colson BG, Ganguly DH,等。12至18个月大时早期发现的重听儿童的发展结果。早期Hum Dev. 2015; 91:47-55。
Cunningham LL, Tucci DL。成人听力损失。中华医学杂志(英文版);
谢菲尔德AM,史密斯RJH。耳聋的流行病学。冷泉港展望。2019;9:a033258。
莫顿CC,南斯WE。新生儿听力筛查——一场无声的革命。中华医学杂志,2006;34:21 51 - 51。
Bademci G, Foster J 2nd, Mahdieh N, Bonyadi M, Duman D, Cengiz FB,等。通过外显子组测序的综合分析,在一个大型多种族队列中揭示了常染色体隐性非综合征性耳聋的遗传病因。Genet Med. 2016; 18:364-71。
Yan D, Tekin D, Bademci G, Foster J 2nd, Cengiz FB, Kannan-Sundhari A,等。来自多个大陆的非综合征性耳聋大队列的DNA变异谱。胡姆·热内。2016;135:953-61。
李敏,西尾,C Naruse, M Riddell, Sapski S, Katsuno T,等。Pendred综合征中EPHA2和SLC26A4突变的二基因遗传Nat Commun. 2020; 11:1343-57。
Schrauwen I, Chakchouk I, Acharya A, Liaqat K, Irfanullah。PCDH15和USH1G的新型二基因遗传是重度非综合征性听力损害的基础。BMC Med Genet 2018; 19:122-7。
Leone议员,Palumbo P, Ortore R, Castellana S, Palumbo O, Melchionda S,等。听力损失TMPRSS3/GJB2二基因遗传的靶向重测序检测Mol Cell Probes, 2017; 33:24-7。
ozydak M, Lechowicz U, Pollak A, ozizynbso D, skaryzynski H.医学遗传学高通量测序数据的过度解释:听力损失TMPRSS3/GJB2双基因遗传的第一个证据。《翻译医学》2019;17:269。
李志强,李志强,李志强,等。英国国家合作Usher研究中9个Usher综合征基因的综合序列分析。《中华医学杂志》2012;49:27-36。
Shearer AE, DeLuca AP, Hildebrand MS, Taylor KR, Gurrola J 2nd, Scherer S,等。利用大规模并行测序对遗传性听力损失进行综合基因检测。美国国家科学研究院。2010; 107:21104-9。
Sloan-Heggen CM, Smith RJ。听力损失患者的遗传诊断导航。Curr Opin儿科,2016;28:705-12。
希勒,埃,史密斯,j。听力损失基因诊断的大规模并行测序:新的护理标准。耳鼻咽喉头颈外科2015;153:175-82。
方Y,顾M,夏王C,锁F, G, Y GJB2以及SLC26A4基因突变是突出的原因先天性耳聋。生物化学学报。2015;73:41-4。
项一兵,唐世升,李兆辉,徐春春,秦川,徐一智,等。温州市506例非综合征性耳聋患者常见致聋基因突变分析中华儿科耳鼻咽喉杂志2019;122:185-90。
杨涛,郭玲,王玲,于旭。遗传性听力损失的诊断、干预与预防。Adv Exp医学生物学2019;1130:73-92。
Alford RL, Arnos KS, Fox M, Lin JW, Palmer CG, Pandya A,等。美国医学遗传学和基因组学学会听力损失的临床评估和病因诊断指南。Genet Med. 2014; 16:347-55。
Vila PM, Lieu JE。儿童不对称和单侧听力损失。细胞组织决议2015;361:271-8。
林福辉,胡佳杰,林永华,李海燕,吴春成,等。儿童发病单侧和不对称感音神经性听力损失患者的病因学和听力学特征。美国耳鼻咽喉头颈外科杂志2017;143:912-9。
巴罗娜R, Vizcaino JA, Krstulovic C, Barona L, Comeche C, Montalt J,等。不对称听力损失是否会影响在嘈杂环境中的理解能力?国际医学杂志,2019;15:267-71。
Richards S, Aziz N, Bale S, Bick D, Das S, Gastier-Foster J,等。序列变异解释的标准和指南:美国医学遗传学和基因组学学院和分子病理学协会的联合共识建议。Genet Med. 2015; 17:405-24。
Oza AM, DiStefano MT, Hemphill SE, Cushman BJ, Grant AR, Siegert RK,等。遗传性听力损失的ACMG/AMP变异解释指南的专家规范。胡姆穆特,2018;39:1593-1613。
张志刚,张志刚,张志刚,张志刚,等。以色列北部阿拉伯人口听力损失的遗传学研究。欧洲胡姆热内。2018;26:19 40 - 7。
陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,等。应用剪接报告微基因分析方法评价未分类基因突变的剪接效应。方法Mol生物学,2010;653:249-57。
陈松,董超,王强,钟忠,齐勇,柯旭,等。定向下一代测序成功检测中国遗传性听力损失患者的致病基因。Genet Test Mol Biomark, 2016; 20:660-5。
Sloan-Heggen CM, Bierer AO, Shearer AE, Kolbe DL,西村CJ, Frees KL,等。1119例听力损失患者的综合基因检测临床评价胡姆·热内,2016;135:441-50。
内耳畸形的分类和目前的治疗。Balk Med 2017; 34:397-411。
oak E, Duman D, Tekin M.内耳异常的遗传原因:来自土耳其内耳异常研究组的综述。Balk Med J. 2019; 36:206-11。
Kari E, laci L, Go JL, Naymik M, Knowles JA, Leal SM,等。罕见先天性内耳和耳蜗前庭神经畸形相关基因。2020; 41:983-9。
Seligman KL, Shearer AE, Frees K, Nishimura C, Kolbe D, Dunn C,等。大队列人工耳蜗植入患者听力损失的遗传原因。耳鼻喉头颈外科。2022;166:734-7。
Abu Rayyan A, Kamal L, Casadei S, Brownstein Z, Zahdeh F, Shahin H,等。巴勒斯坦人群遗传性听力损失的基因组分析。美国国家科学研究院。2020; 117:20070-6。
布德,马阿莉,马志强,张志强,Altmüller J,张志强,等。61个埃及遗传性非综合征性听力损失家族的综合分子分析。clinin Genet, 2020; 98:32-42。
韩俊杰,阮德昌,吴丹丹,韩俊华,金亚尔,金美美,等。阐明越南儿科人群严重听力损失的独特突变谱。科学通报2019;9:1604-22。
Safka Brozkova D, Poisson Marková S, Mészárosová AU, Jenčík J, Čejnová V, Čada Z,等。通过基因组NGS和全外显子组测序检测到捷克早期非综合征性听力损失患者的非GJB2基因突变谱和频率。clinin Genet, 2020; 98:548-54。
碗MR,布朗SDM。听觉功能障碍的遗传图谱。胡姆·摩尔·热内特。2018;27:R130-5。
遗传性听力丧失;关于已知的和未知的。听Res. 2019; 376:58-68。
张娟,李娟,Saucier JB,冯勇,蒋勇,Sinson J,等。使用循环无细胞胎儿DNA对多种孟德尔单基因疾病进行无创产前测序。中国医学杂志2019;25:43 - 47。
资金
国家重点研发计划项目(2016YFC1000700, 2016YFC1000704)转向PD;中国博士后研究基金项目(2018M633731)
作者信息
作者及隶属关系
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
吴俊,曹喆,苏勇。et al。通过靶向基因组测序对中国大量听力损失人群进行分子诊断。J Hum Genet67, 643-649(2022)。https://doi.org/10.1038/s10038-022-01066-5
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s10038-022-01066-5