摘要
牙周炎是最广泛的口腔疾病,与口腔微生物群密切相关。口腔微生物群受到一些药物治疗的不利影响。全身性抗生素被广泛用于感染性疾病,但会导致肠道生态失调,对人体产生负面影响。抗生素引起的系统性肠道生态失调是否会影响口腔微生物群甚至牙周炎尚未得到解决。在这项研究中,小鼠被暴露在含有四种抗生素鸡尾酒的饮用水中,以探索系统性抗生素如何影响微生物群致病性和口腔骨质流失。这一结果首次证明,长期使用抗生素引起的肠道生态失调会扰乱口腔菌群,加重牙周炎。牙周组织中Th17相关细胞因子表达增加,Treg相关转录因子和细胞因子表达减少。正常小鼠粪便移植粪便菌群可恢复肠道菌群和屏障,降低口腔菌群致病性,逆转牙周组织Th17/Treg失衡,缓解牙槽骨丢失。这项研究强调了长期系统性抗生素诱导的肠道生态失调对口腔微生物群和牙周炎的潜在不良影响。Th17/Treg失衡可能与这种关系有关。 Importantly, these results reveal that the periodontal condition of patients should be assessed regularly when using systemic antibiotics in clinical practice.
简介
牙周炎影响着全世界大约一半的成人人口,是一种广泛的口腔疾病,可导致牙周软硬组织的破坏。有几种全身性疾病与牙周炎有关,如肥胖、糖尿病、关节炎、心脏病和癌症。用药物治疗全身性疾病已被发现对牙周组织有不良影响,甚至可加重牙周炎。例如,长期使用苯妥英、环孢素或钙通道阻滞剂会导致药物性牙龈增生。1地塞米松,用于关节炎关节治疗,增加牙槽骨损失。2癌症化疗也会增加牙周炎的易感性。3.
全身抗生素治疗广泛应用于慢性骨髓炎、细菌性眼内炎、气道感染、痤疮等几种感染性疾病。然而,使用抗生素会导致肠道生态失调。4,5肠道菌群是人体中最多样化和最大的细菌种群,有助于生理发育、营养消化和抵御病原体定植。6长期使用全体性抗生素会通过降低肠道菌群多样性、改变代谢组、破坏肠道防御、引起抗生素耐药性等方式扰乱肠道菌群。4,7肠道生态失调导致肠道通透性增加,病原体和微生物产物引起内毒素血症,进而通过血行扩散影响远处器官。8抗生素引起的肠道生态失调与各种全身性疾病有关,其中一些疾病还与牙周炎有关。9,10,11,12因此,肠道菌群可能是一般健康和牙周炎之间的潜在联系。8然而,抗生素药物治疗引起的肠道生态失调是否会对牙周炎产生负面影响尚不清楚。
另一方面,全身抗生素治疗本身是牙周炎的一种辅助治疗。与局部抗生素治疗不同,全身抗生素治疗可以更好地将抗生素暴露于口腔中广泛分布的病原体,如舌背和扁桃体隐窝中的病原体。13与单独的拔牙和根规划相比,系统抗生素治疗联合拔牙和根规划提供了更好的临床结果,包括更多的探袋深度减少和临床附着增加。14然而,系统性抗生素对肠道菌群和许多其他疾病的不良影响不容忽视。肠道菌群通过消化道与口腔菌群相连,一些研究表明它们密切相关。异常的口腔微生物群导致口腔病原体转移到肠道,通过激活炎症小体引起结肠炎症。15与临床牙周参数相似但肠道健康的患者相比,肠道疾病患者牙龈下部位有更多的致病菌。16异常的口腔微生物群反过来激活宿主相应的免疫和炎症反应,并导致牙周炎。17因此,抗生素引起的肠道生态失调是否会改变口腔微生物群和宿主的反应,从而影响牙周炎,是非常值得探讨的。
一些研究发现Th17/Treg(辅助T细胞和调节性T细胞)失衡与牙周炎有关。Th17细胞可分泌白细胞介素(IL)-17A, IL -17A促进IL-6、RANKL等其他炎性细胞因子的产生,导致牙槽骨丢失。18,19相反,Treg细胞,CD4 + T淋巴细胞的一个亚群,在牙周炎中维持免疫稳态并保护组织免受炎症破坏。20.,21Foxp3是Treg细胞特异性表达的转录因子;它还产生抗炎细胞因子,如IL-10和TGF-β。18,22去卵巢(OVX)大鼠肠道菌群失调通过Th17/Treg失衡加重牙周炎,而益生菌或小檗碱可以改善肠道菌群,逆转Th17/Treg失衡,减少牙槽骨丢失。23这些研究表明,Th17/Treg失衡可能会加重牙周炎,并可能与微生物群有关。
在这项研究中,为了揭示全身抗生素如何影响口腔-肠道轴的微生物致病性,小鼠被暴露在含有四种抗生素鸡尾酒的饮用水中4周,以模拟长期使用全身抗生素。采用结扎所致小鼠牙周炎模型研究其对牙周炎的后续影响。此外,粪便菌群移植(FMT)用于恢复被抗生素干扰的肠道菌群。研究表明,抗生素引起的肠道生态失调破坏肠道屏障,扰乱口腔微生物群,通过Th17/Treg失衡加重牙周炎的牙槽骨丢失。这些发现强调了评估使用全身抗生素患者牙周状况的必要性。
结果
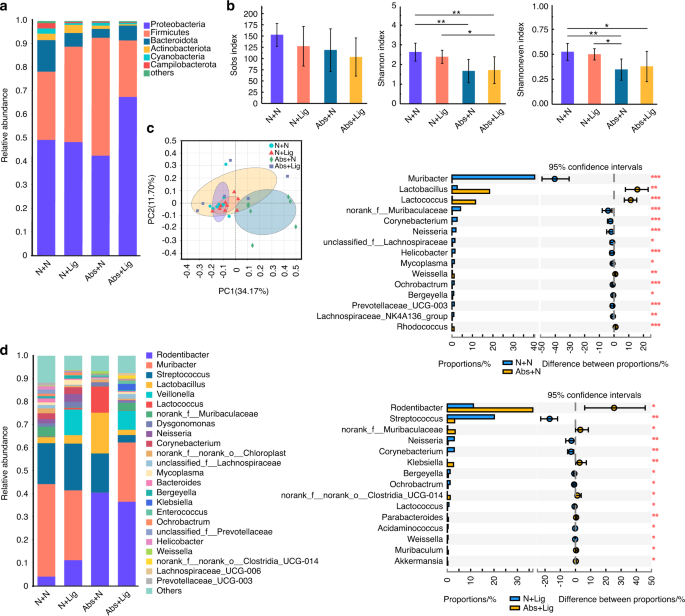
长期使用抗生素导致肠道生态失调,口腔微生物区系中牙周炎相关病原体增加
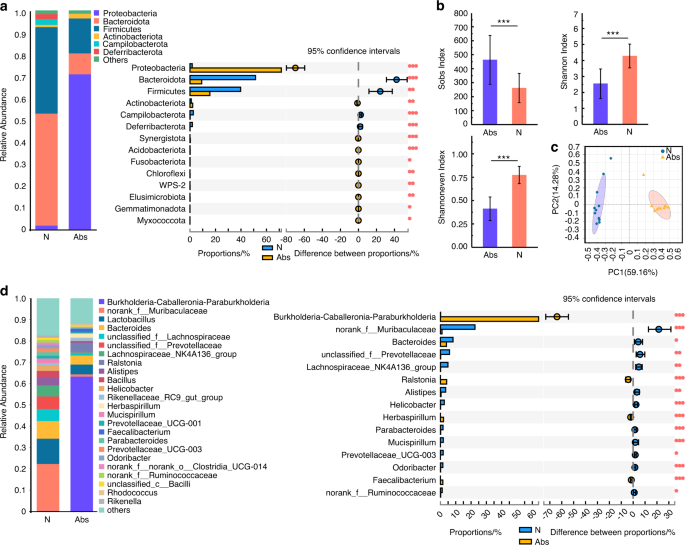
Abs组小鼠给予四种抗生素鸡尾酒(头孢西丁、庆大霉素、甲硝唑和万古霉素,剂量为1 mg·mL−1N组小鼠饮用正常饮用水;两种治疗均持续4周(图S1).结果显示,抗生素处理后,Abs组肠道菌群的群落均匀度和群落多样性均低于N组(图2)。1 b).在主坐标分析(PCoA)中,N组和Abs组在属水平上有显著差异,表明N组和Abs组在群落组成上存在差异(图2)。1 c).在门水平上,的丰度变形菌门这是肠道菌群失调和肠道疾病的潜在因素,24在Abs组中显著增加(图;1).在属水平上,是益生菌Lachnospiraceae_NK4A136_group而且Alistipes25在Abs组中降低(图;1 d,年代2 b).
与肠道菌群结果不同,抗生素增加了口腔菌群的群落均匀性和多样性(图2)。2 b).抗生素也改变了成分(图。2, c - d,年代2 c, d),增加了口腔微生物群的致病性。与牙周健康相关的细菌减少,包括链球菌,奈瑟氏菌属,棒状杆菌属26(无花果。二维).此外,与牙周炎相关的细菌增加,如肠球菌而且Dysgnomonas27(无花果。二维).这些结果表明,长期使用抗生素会导致肠道生态失调,增加牙周炎相关病原体,并减少口腔微生物群中与牙周相关的益生菌。
肠道菌群失调没有恢复,实验性牙周炎小鼠的口腔致病性在停用抗生素两周后增加
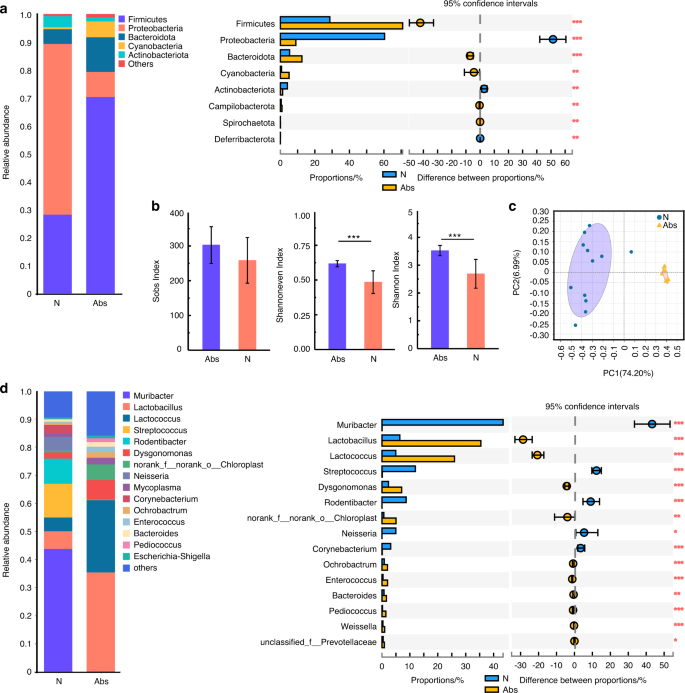
4周后,从Abs组中取出抗生素水,然后将N组和Abs组小鼠分别分为两组(n= 12): N +N组,N +Lig (Ligature)组,Abs+N组,Abs+Lig组。在N +Lig组和Abs+Lig组建立实验性牙周炎模型,使用丝线结扎两周(图S1).对于肠道菌群,Sobs指数显示,停用抗生素2周后,Abs+N组与N +N组相比,菌群物种丰富度急剧下降(图2)。3 b).以前抗生素(Abs+N和Abs+Lig组)导致的群落均匀度和群落多样性的下降没有恢复。值得一提的是,在结扎组(N +Lig和Abs+Lig)中,群落均匀度和群落多样性有所提高(图2)。3 b).抗生素和牙周炎都改变了群落的组成(图。3 c,年代3 a, b).在Abs+N组,变形菌门,一种潜在的肠道生态失调因素,仍然丰富,而丰度Actinobacteriota显著降低(图;3,年代4).Actinobacteriota在调节肠道渗透性、免疫系统、代谢和肠脑轴方面起着至关重要的作用。28在属水平上,致病菌显著增加,包括Blautia,Parasutterella,Moganella29(无花果。3 d,年代3 b).然而,肠道健康相关细菌的丰度norank_Muribaculaceae30.在Abs+N组降低(图;3 d,年代3 b).这些数据表明,在停用抗生素2周后,肠道菌群无法恢复。之前的一项研究还报告说,抗生素会扰乱肠道菌群,产生长期影响。31
在口腔菌群中,虽然不同组间的物种丰富度没有显著差异,但抗生素组(Abs+N和Abs+Lig)的群落均匀度和群落多样性明显低于不使用抗生素组(N +N, N +Lig)(图2)。4 b).在实验性牙周炎(N +Lig和Abs+Lig)组中,抗生素治疗增加了口腔微生物群的致病性。与N + Lig组相比,益生菌的丰度如链球菌,奈瑟氏菌属,Bergeyella,Lactococcus,Weissella均明显减少,且口腔病理菌的丰度如何克雷伯氏菌在Abs+Lig组增高14,26,32(无花果。4 d,年代3 d).以上结果表明,在牙周炎的情况下,抗生素治疗可增加口腔微生物群的致病性。
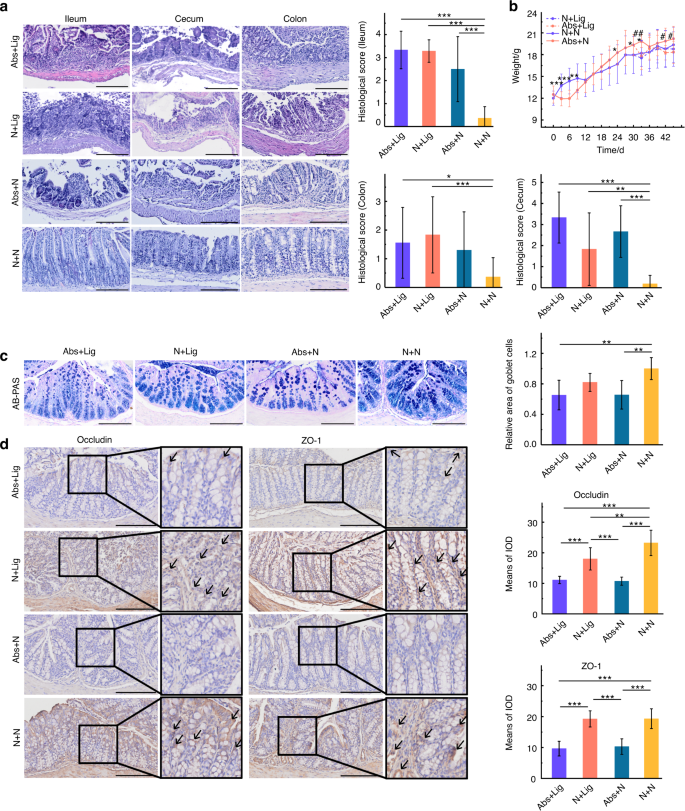
抗生素导致肠道损伤,加重牙槽骨丢失
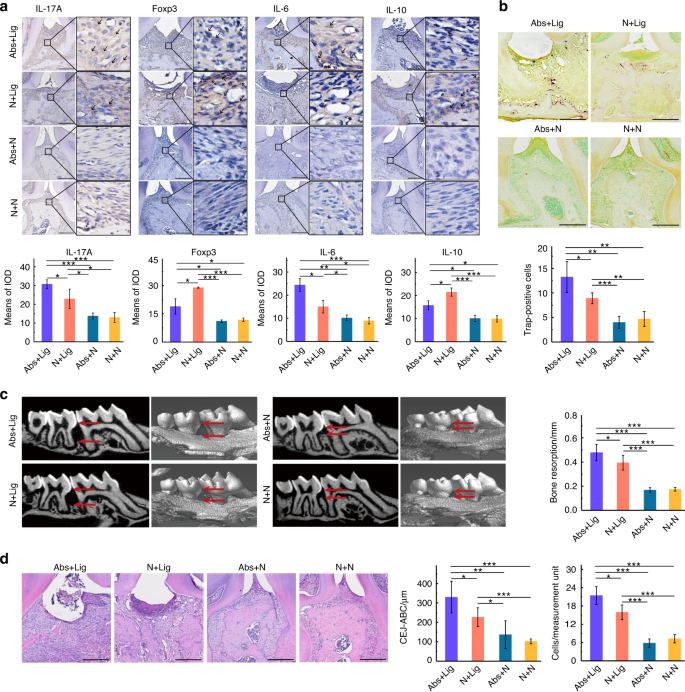
在整个实验过程中记录小鼠的体重。从D1到D9, Abs组体重明显下降。之后,这些小鼠的体重迅速增加,达到高于N组小鼠的水平。D30后,结扎(N +Lig, Abs+Lig)组小鼠体重明显下降,尤其是Abs+Lig组(图2)。5 b).经苏木精-伊红(HE)染色和组织学评分分析,抗生素组(Abs+N和Abs+Lig)观察到明显的肠道损伤,尤其是回肠和盲肠损伤明显(图2)。5).杯状细胞减少(图;5度)和紧密连接相关蛋白较少的阳性表达(图。5 d),与不使用抗生素的组相比,使用抗生素的组(Abs+N和Abs+Lig)有显著差异。此外,抗生素加重了结扎小鼠的牙周炎。根据micro-CT和HE染色分析,Abs+Lig组比N +Lig组有更大的牙槽骨损失和中性粒细胞浸润(图2)。6 c, d).此外,与N +Lig组相比,Abs+Lig组trap阳性破骨细胞增多,Th17细胞相关促炎细胞因子(IL-17A、IL-6)表达增多(图2)。6 a、b).与N +Lig组相比,Abs+Lig组抗生素也降低了Treg细胞相关促炎细胞因子(Foxp3和IL-10)的表达(图2)。6).
正常小鼠粪便FMT可改善抗生素引起的肠道菌群失调,但对口腔菌群无明显影响
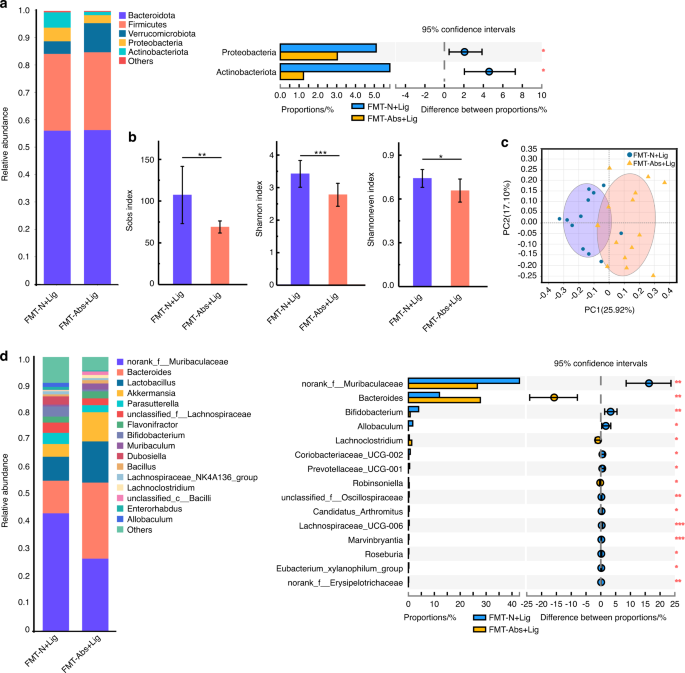
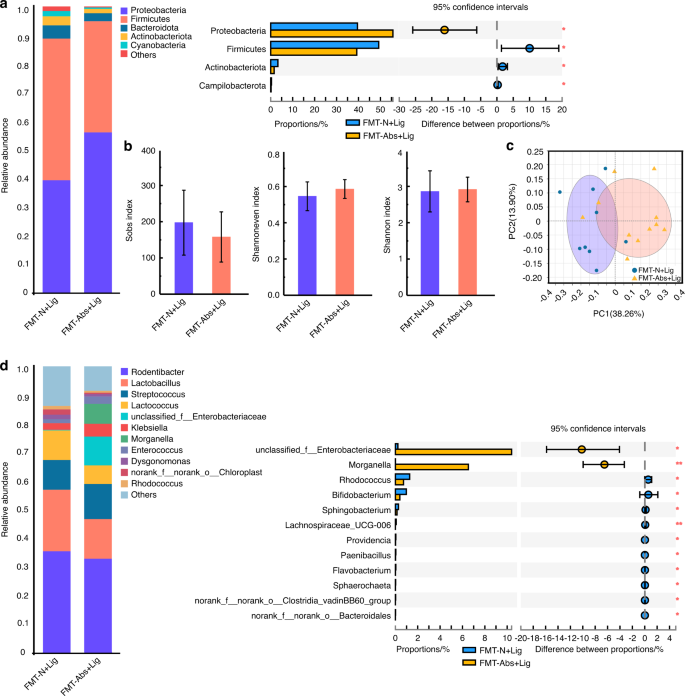
FMT是一种新的治疗形式,通过将健康供体的粪便微生物群移植到患病受体,重建正常肠道微生物群的物种组成和生理功能。另外30只小鼠在饮用水中提供四种抗生素鸡尾酒,为期四周,与上述Abs组相同。然后,将抗生素水换成普通饮用水,将小鼠分为FMT-N组和FMT-Abs组。N +N组和Abs+N组小鼠的粪便微生物群分别转移到FMT-N和FMT-Abs小鼠身上(图S1 b).FMT后两周,FMT- n组和FMT- abs组受体小鼠的肠道菌群明显不同(图S5。c, d,年代7 a、b).还有更多Bacteroidota而且Actinobacteriota和更少的厚壁菌门与FMT-Abs组相比,FMT-N组的肠道菌群(图S5).各组受体小鼠的肠道菌群与供体小鼠相似,这表明FMT的成功。虽然口腔微生物群的组成不同(图S6a c d,年代7 c, d), FMT-Abs组和FMT-N组之间的alpha和beta多样性没有统计学上的显著差异(图S6 b, c).这些结果表明,FMT没有直接改变口腔菌群,因为它改变了肠道菌群。
抗生素治疗的实验性牙周炎小鼠口腔微生物群的致病性与正常小鼠粪便的FMT降低
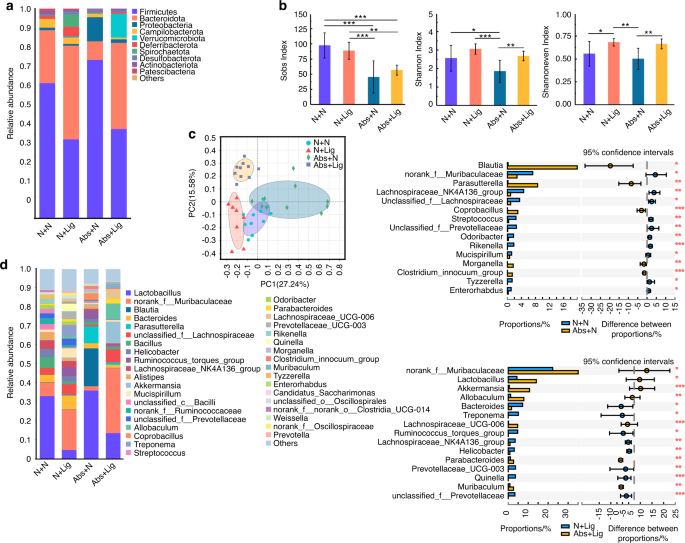
FMT后两周,所有小鼠(FMT- n +Lig组和FMT- abs +Lig组)均建立实验性牙周炎模型(图S1 b).在FMT-N +Lig组中,与FMT-Abs+Lig组小鼠相比,小鼠肠道微生物群显示出更高的α多样性,与更稳定和更健康的微生物群相关(图2)。7 b).益生菌的丰度,比如norank_Muribaculaceae而且prevotellaceae_ucg - 001,30.在FMT-N + Lig组中显著增高。7 d,年代8 b).口腔菌群方面,FMT-Abs+Lig组与FMT-N +Lig组α多样性差异不明显,但β多样性差异有统计学意义(图2)。8 b, c).在属水平上,口腔病理细菌丰度较低unclassified_Enterobacteriaceae15还有机会致病菌摩根氏菌属33FMT-N +Lig组与FMT-Abs+Lig组比较(图2)8 d,年代8 d).这些结果表明,当实验性牙周炎诱导时,正常小鼠粪便FMT小鼠形成了更健康的口腔微生物群组成。
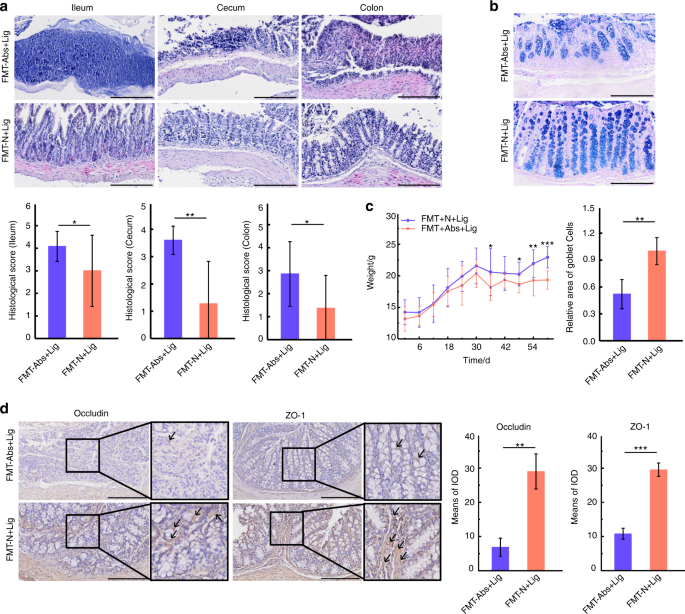
正常小鼠粪便FMT可减轻实验性牙周炎小鼠的肠道损伤和牙槽骨丢失
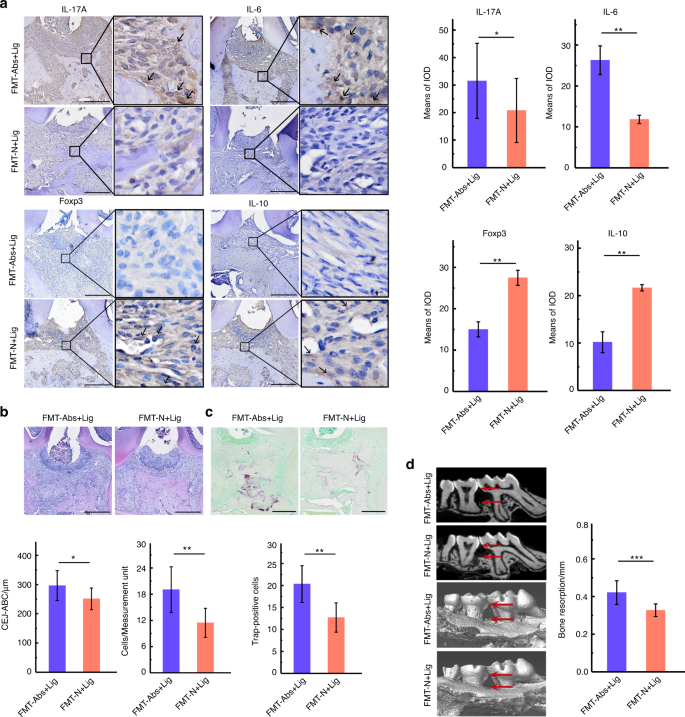
在整个实验过程中,小鼠的体重都被记录下来。D30后,FMT-N组小鼠比FMT-Abs组小鼠表现出更大的体重增加。结扎后,FMT-N +Lig组与FMT-Abs+Lig组的体重差异更大(图。9 c).在肠道损伤方面,与FMT-Abs+Lig组相比,FMT-N +Lig组的组织学评分较低,杯状细胞面积更大,紧密连接蛋白阳性表达更多(图2)。9a, b, d).这可能是因为正常小鼠粪便的FMT重建了被抗生素破坏的肠道微生物群,并降低了其致病性。即便如此,在肠道组织中仍然观察到病理性损伤,这可以解释为使用抗生素四周的不良反应。此外,FMT-N +Lig组的牙槽骨损失、中性粒细胞浸润和trap阳性破骨细胞明显低于FMT-Abs+Lig组(图2)。10个罪犯).免疫组化染色显示treg相关转录因子和细胞因子(Foxp3, IL-10)表达增加,th17相关细胞因子(IL-17A, IL-6)表达减少(图。10)与FMT-Abs+Lig组比较。这些结果表明,正常小鼠粪便FMT可减轻抗生素治疗小鼠的肠道损伤和牙周炎引起的牙槽骨丢失。
讨论
肠道菌群和口腔菌群是人体内最大和最多样化的两个细菌种群。牙周炎是一种常见的口腔炎症性疾病,与口腔微生物群的破坏有关。牙周炎相关的异常口腔菌群可影响肠道菌群和肠道疾病。34肠道菌群异常也可能影响口腔菌群,加重牙周炎。35在这项研究中,小鼠服用抗生素4周,抗生素导致肠道菌群多样性下降和明显的生态失调,与之前的报道一致。有趣的是,与N组相比,Abs组肠道微生物群的群落丰富度有所增加。这可能是因为在使用抗生素后,由于耐抗生素细菌的增殖,总微生物负荷可能会增加。36在诱发实验性牙周炎后,与未接受抗生素治疗的小鼠相比,服用抗生素的小鼠牙槽骨吸收加剧。虽然许多研究,包括动物实验和人体临床试验,都使用全身抗生素治疗作为牙周炎的辅助治疗,从而减少牙槽骨损失或增强治疗效果,14,17目前的研究重点是长期全身使用抗生素是否会导致菌群失调,从而对牙周炎产生不良影响。给小鼠饮用含有头孢西丁、庆大霉素、甲硝唑和万古霉素(各1毫克/毫升)的抗生素饮用水4周。抗生素的类型、剂量和持续时间与以前的研究不同。正常的肠道菌群在维持肠道屏障的结构完整性方面起着至关重要的作用。抗生素可以破坏正常肠道菌群,减少紧密连接蛋白的表达和肠上皮细胞的凋亡。这种破坏可能导致炎症或肠屏障损伤,包括上皮组织损伤和盲肠肿胀。37在目前的研究中,在使用抗生素的组中观察到肠道结构严重受损,紧密连接蛋白表达下降,这表明接触抗生素饮用水4周后破坏了肠道屏障。肠道屏障的破坏可能会增加肠道的渗透性,导致循环中的病原体和微生物产物增加,然后影响远处的组织,如牙周组织。相反,保护肠道屏障可能会改善抗生素引起的骨质流失。一项研究报告称,益生菌或MDY-1001(一种高分子量聚合物)可以通过改善肠道生态失调和保护肠道屏障免受破坏来防止抗生素后股骨再吸收。38我们的研究结果表明,牙槽骨损失的增加可能与抗生素诱导的肠道生态失调后肠屏障的破坏有关。
在实验性牙周炎后,给予抗生素治疗的小鼠口腔微生物群的致病性高于未给予抗生素治疗的小鼠。这说明在牙周炎状态下,抗生素引起的肠道菌群失调会影响口腔菌群。然而,当小鼠饮用抗生素水时,口腔不可避免地暴露在抗生素中,这可能在一定程度上影响了口腔微生物群。因此,我们进行FMT,在不接触口服微生物的情况下直接影响肠道菌群,以恢复服用抗生素的小鼠受到干扰的肠道菌群。当实验性牙周炎诱导时,接受FMT和正常小鼠粪便的小鼠显示出较低的口腔微生物群致病性和较少的牙槽骨损失。对这一发现的可能解释如下。首先,健康的肠道菌群可以刺激免疫系统抑制炎症,维持肠道稳态。抗生素引起的肠道生态失调可能会破坏肠道稳态,使细菌或其代谢物进入血液,进而引起全身炎症。39,40,41全身炎症进一步影响局部炎症环境,在Abs+Lig组观察到,牙周组织炎症因子表达增加,抗炎因子表达减少。炎症性牙周微环境促进了牙周炎相关细菌的繁殖,增加了牙周组织的破坏。42,43健康供体小鼠的FMT部分重建了抗生素引起的肠道菌群紊乱,并可能改善上述全身炎症和局部炎症性牙周微环境。
在牙周病变中,Th17细胞相关细胞因子(IL-17A、IL-6、IL-23和IL-21)和破骨介质(RANKL)显著增加。44Treg细胞是免疫抑制CD4 + T细胞的重要亚群;分泌抗炎细胞因子(IL-10、IL-4、TGF-β),下调RANKL表达,抑制牙周炎时牙槽骨吸收。45Th17细胞与Treg细胞对骨代谢具有相反的免疫调节功能。在本研究中,与仅结扎小鼠相比,结扎后抗生素引起肠道生态失调的小鼠表现出更大的牙槽骨吸收和更多的破骨细胞。牙周组织中IL-17A和IL-6表达增加,Foxp3和IL-10表达减少。正常小鼠粪便的FMT恢复了抗生素治疗小鼠的肠道菌群,并逆转了牙周组织中th17相关因子和treg相关因子的表达。这些结果表明,在牙周炎状态下,抗生素引起的肠道生态失调可能导致牙周组织Th17/Treg失衡,导致牙槽骨丢失。重建肠道菌群逆转了Th17/Treg失衡,缓解了牙周炎。此外,抗生素治疗可形成炎性牙周微环境,其中促炎因子和抗炎因子较多。牙周炎的特点是炎症反应和微生物群之间的双向不平衡。异常的微生物群还会导致宿主反应和无法控制的炎症。17我们的研究结果表明,抗生素的使用导致了牙周炎症微环境,并增加了口腔微生物群中与牙周炎相关的细菌的丰度,进一步加剧了牙槽骨损失。本研究采用免疫组化法检测牙周组织中th17相关细胞因子和treg相关细胞因子。为了更准确地探索免疫细胞的变化,建议在未来的研究中使用流式细胞术或高通量测序。
有趣的是,仅结扎的小鼠(N + Lig组)也比未进行任何处理的小鼠表现出更高的组织学评分。实验性牙周炎对全身炎症的影响可以解释牙周炎是如何引起这种肠道损伤的。据报道,实验性牙周炎导致血浆中炎性细胞因子水平升高,骨髓中单核细胞增多。46结扎诱导的牙周炎引起的全身炎症可能仅在牙周炎小鼠中引起进一步的肠道损伤。牙周致病菌从口腔向肠道的转移也可能是抗生素诱导牙周炎小鼠肠屏障损伤的原因之一。然而,关于口腔细菌是否能到达肠道并在肠道中定植,仍存在争议。健康的肠道菌群具有定殖抗性,可以防止外来细菌的入侵。24此外,研究人员还发现,健康成年人的口腔和肠道菌群完全不同。47然而,其他研究报告称,当存在不健康的肠道菌群时,定植抗性可能会被破坏,口腔到肠道的细菌定植可能会发生。例如,氨苄西林治疗可导致口服克雷伯氏菌的肠道定植。48同样,在炎症性肠病存在时,口腔致病菌克雷伯氏菌和肠杆菌异常增殖并在肠道定植,加重肠道炎症。15因此,我们假设实验性牙周炎引起的全身炎症和口腔微生物群的异位定植可能是牙周炎影响使用抗生素的小鼠肠道的一些机制。具体机制有待进一步研究。
另一方面,必须承认,我们研究中的抗生素治疗涉及接触复方广谱抗生素饮用水4周,这与人类临床治疗并不完全相同。此外,与本研究中使用的16S rRNA基因测序相比,鸟枪下一代测序宏基因组学具有几个优势,包括能够更全面地表征微生物组的复杂性,并在每个样本中识别更多的物种。49需要采用更好的动物模型和检测方法进行深入研究。此外,除了牙周组织的局部炎症变化外,未来还应探索全身性炎症反应。
总体而言,本研究证明,系统性抗生素可诱导肠道生态失调,导致牙周组织Th17/Treg失衡。研究结果强调了系统性抗生素对口腔微生物群和牙周炎的潜在不良影响。当临床使用全身性抗生素时,评估患者的牙周状况非常重要,特别是对于已经患有牙周炎的患者。
材料与方法
动物实验
4周龄雄性C57小鼠在重庆医科大学口腔医院重点实验室SPF级环境下饲养。他们被随机分为两组(n= 24): N和Abs组。Abs组小鼠给予含有头孢西丁、庆大霉素、甲硝唑、万古霉素(1 mg·mL)的抗生素饮用水−1每一个;Solarbio,中国)。相比之下,N组的老鼠则定期喝水。每两天记录每只小鼠的体重。四周后,除去抗生素饮用水。然后,从两组中提取粪便和口腔拭子来分析肠道和口腔微生物群。粪便样本立即储存在−80°C,口腔拭子样本储存在口腔拭子保存液中(生工生物技术,中国)。N组和Abs组小鼠分别分为2组(n= 12): N +N组,N +Lig组,Abs+N组,Abs+Lig组。N +Lig组和Abs+Lig组分别建立实验性牙周炎模型。丝线结扎(5-0;(美国)位于左上颌第一和第二磨牙之间。N +N组和Abs+N组小鼠无结扎。两周后,收集各组小鼠的粪便和口腔拭子,然后对所有小鼠实施安乐死,收集上颌和肠道(回肠、盲肠和结肠)组织。Abs+Lig、N +Lig、Abs+N和N +N组的最终样本量分别为11、9、11、11只小鼠。
与Abs组相同,另外30只小鼠也被提供了为期四周的抗生素饮用水。然后,将抗生素水换成普通饮用水,将小鼠分为两组:FMT-N和FMT-Abs。N +N组和Abs+N组小鼠粪便菌群分别转移到FMT-N组和FMT-Abs组。FMT后两周,收集两组小鼠的粪便和口腔拭子,并对所有小鼠进行结扎。又过了两周,再次收集粪便和口腔拭子,然后对所有小鼠实施安乐死,收集上颌和肠道(回肠、盲肠和结肠)组织。FMT-N +Lig组和FMT-Abs+Lig组的最终样本量分别为12和15只小鼠。
动物实验由中国重庆医科大学附属口腔医院伦理委员会批准(批准文号:CQHS-REC-2022 LSNo.003)。
粪便菌群移植
N +N组和Abs+N组小鼠粪便分别与半胱氨酸(Solarbio, China)和Na2S (Solarbio, China)在相应的离心管(粪便500 mg,半胱氨酸2.5 mg, Na 1 mg)中涡旋混合2S在3ml无菌PBS)。然后,将各组的混合物离心(500 r·min)−1, 1 min),收集上清液。FMT-N组和FMT-Abs组分别灌胃N +N组和Abs+N组的上清液(每只100 μL)。
16S rRNA基因序列及DNA分析
粪便样本和口腔拭子由上海迈约比奥生物制药科技有限公司(中国上海)处理。NanoDrop2000 (Thermo Scientific, America)用于评估浓度。用琼脂糖凝胶电泳法对DNA质量进行评价。引物338 F (5 ' - actcctacgggaggcagcagc -3 ')和806 R (5 ' -GGACTACHVGGGTWTCTAAT-3 ')扩增16S rRNA基因序列的V4-V5区。然后从琼脂糖凝胶中提取扩增子,纯化的扩增子以等摩尔量汇集,并在Illumina MiSeq平台上进行测序。
牙槽骨显微ct分析
各组上颌采用micro-CT扫描(Skyscan1172, Skyscan,比利时)。采用Amira软件(Amira 6.0.1,德国)进行三维重建和组织形态学分析。测量牙槽骨嵴(ABC)到牙槽牙釉质交界处(CEJ),分析牙槽骨吸收。
牙槽骨和肠组织的组织学分析
19% EDTA对小鼠上颌脱钙30天。然后制备6 μm的上颌骨和肠道组织切片,进行后续染色。用alcin-blue和周期性酸-希夫染色试剂盒(Bioss,中国)进行结肠切片。HE染色试剂盒(Solarbio, China)用于上颌骨和肠道切片检查牙槽骨丢失和肠道损伤。测量CEJ与ABC之间的距离(3次/片),分析牙槽骨丢失情况。根据袁等人的方案。50,从每张玻片牙间区选取6个感兴趣区域(ROI, 80 μm × 80 μm)计数中性粒细胞,记录总体平均数量。然后将结果报告为每个感兴趣区域的单元格。根据Ulrike Erben等人的研究评估肠道损伤。51使用TRAP染色试剂盒(南京建辰生物工程研究所,中国)检测破骨细胞。每张幻灯片被数了三次。免疫组化染色检测IL-17A、IL-6、Foxp3、IL-10。用10%的山羊血清堵塞上颌骨切片,并与抗IL-17A、IL-6、Foxp3或IL-10的一抗(1:400)(biiss,中国)在4℃下孵育过夜。二抗染色(Bioss,中国)。应用Image-Pro Plus 6.0软件对阳性表达进行半定量分析。结果以平均积分光密度表示。使用幻灯片扫描仪(VS200,奥林巴斯,日本)收集上述幻灯片的图像。
统计分析
本研究采用SPSS软件(SPSS 19.0,美国)对所有数据进行分析。数据采用单向方差分析和Student 's方差分析t测试。有显著差异的是P< 0.05。
数据可用性
如有合理要求,可从通讯作者处获得原始资料。
参考文献
西摩,R. A.托马森,J. M. &埃利斯,J. S.药物诱导的牙龈过度生长的发病机制。j .中国。Periodontol。23, 165-175(1996)。
蒙特罗-梅伦德斯等人。牙周病与炎症性关节炎之间的关系揭示了黑素皮质素受体3型的调节功能。点。j .分册。184, 2333-2341(2014)。
爱泼斯坦,J. B.等。口腔癌症并发症与癌症治疗:从癌症治疗到存活。CA Cancer J. Clin。62, 400-422(2012)。
Choo, J. M.等。粪便微生物群和代谢组之间的不同关系,在不同的抗生素诱导的破坏。mSphere2, e00005-17(2017)。
克莱因,E. Y.等。2000年至2015年期间抗生素消费的全球增长和地理趋同。Proc。国家的。学会科学。美国115, e3463-e3470(2018)。
吉尔伯特,J. A.等。目前对人类微生物群的了解。24, 392-400(2018)。
Gasbarrini, A.等人。在COVID-19大流行期间重组粪便微生物移植服务。肠道69, 1555-1563(2020)。
贾,x,等。肠骨轴:牙周炎的一个不可忽视的因素。前面。细胞。感染。Microbiol。11, 752708(2021)。
Mor, A.等。丹麦学童产前暴露于全身抗菌药物与超重和肥胖:一项流行病学研究。Int。j . ob。39, 1450-1455(2015)。
穆勒,N. T.等。产前抗生素暴露、剖宫产与儿童肥胖风险。Int。j . ob。39, 665-670(2015)。
帕克,A.等。年轻和老年小鼠之间的粪便微生物群转移逆转了衰老的肠道、眼睛和大脑的特征。微生物组10, 68(2022)。
摩萨德,O.等人。肠道菌群通过代谢产物N(6)-羧甲基赖氨酸驱动小胶质细胞中与年龄相关的氧化应激和线粒体损伤。Nat。>。25, 295-305(2022)。
Jepsen, K. & Jepsen, S.抗生素/抗菌素:治疗轻中度晚期牙周炎的全身和局部给药。牙周病学200071, 82-112(2016)。
Graziani, F., Karapetsa, D., Alonso, B. & Herrera, D.牙周炎的非手术和手术治疗:一种疾病有多少种选择?牙周病学200075, 152-188(2017)。
Kitamoto, S.等。共生菌驱动性结肠炎中口腔和肠道间的粘膜间连接。细胞182, 447 - 462。e414(2020)。
布里托,F.等。炎症性肠病患者未经治疗的牙周炎龈下菌群。欧元。j .杂志。乙醇。25, 239-245(2013)。
柯蒂斯,m.a.,迪亚兹,p.i.和范戴克,t.e.微生物群在牙周病中的作用。牙周病学200083, 14-25(2020)。
Tsukasaki, M.等。骨损伤T细胞对口腔微生物群的宿主防御。Commun Nat。9, 701(2018)。
王玲,王娟,金燕,高宏,林欣。全反式维甲酸通过调节Th17/Treg失衡抑制实验性牙周炎。j . Periodontol。85, 740-750(2014)。
阿尔瓦雷斯,C.等人。口腔颌面疾病的骨免疫学:基于生物学机制的转化应用。前面。Immunol。10, 1664(2019)。
阿尔瓦雷斯,C.等人。实验性牙周炎中调节性T细胞表型和抗破骨功能。科学。代表。10, 19018(2020)。
韩玉坤,金勇,苗玉斌,石涛,林晓萍。诱导牙周炎时CD8(+) Foxp3(+) T细胞通过调节Tregs/Th17影响牙槽骨稳态:过继转移实验。炎症41, 1791-1803(2018)。
贾,L.等。益生菌通过调节肠道菌群来改善牙槽骨损失。细胞Prolif。54, e13075(2021)。
Kim, S., Covington, A. & Pamer, e.g.肠道菌群:抗生素,定殖耐药性和肠道病原体。Immunol。牧师。279, 90-105(2017)。
Fernández, J.等。在动物模型中,以含有油酸的腌制橡子喂养的火腿为基础的饮食促进了抗炎肠道微生物群,并预防了溃疡性结肠炎。脂质健康19, 28(2020)。
格雷夫斯,D. T., Corrêa, J. D. &席尔瓦,T. A.口腔微生物群因全身性疾病而改变。j .凹痕。Res。98, 148-156(2019)。
肖,E.等。糖尿病会增强IL-17的表达,改变口腔微生物群,从而增加其致病性。细胞宿主微生物22, 120 - 128。e124(2017)。
宾达,C.等。放线菌:维持肠道内稳态的相关少数。消化性肝病。50, 421-428(2018)。
利珀特,K.等人。肠道菌群失调与老年人葡萄糖代谢紊乱和代谢综合征相关。Benef。微生物8, 545-556(2017)。
邹,J.等。理中汤通过调节肠道菌群及其代谢产物改善小鼠溃疡性结肠炎。达成。Microbiol。Biotechnol。104, 5999-6012(2020)。
李,B.等。综合宏基因组和转录组分析揭示了抗生素暴露对宿主代谢的依赖恢复。前面。细胞发育生物学。9, 680174(2021)。
拉迪克等人。菌素益生菌对口腔致病生物膜的调节作用。口腔微生物。12, 1809302(2020)。
刘浩,朱军,胡青,饶兴华,莫氏摩根菌,一种非过失性机会致病菌。Int。Soc。感染。说。50, 10-17(2016)。
黄,Y.等。非手术牙周治疗恢复了载脂蛋白E(-/-)小鼠的肠道菌群和肠道屏障。前面。细胞。感染。Microbiol。10, 498(2020)。
她,Y. Y.等人。牙周炎和炎症性肠病:一项荟萃分析。BMC口腔健康20., 67(2020)。
潘达,等。抗生素对人体肠道菌群的短期影响。《公共科学图书馆•综合》9, e95476(2014)。
段,H.等。抗生素引起的肠道生态失调和屏障破坏及潜在的保护策略。暴击。食品科学减轻.62, 1427-1452(2020)。
谢珀,J. D.等。罗伊氏乳杆菌益生菌通过减少肠道生态失调和防止屏障破坏来预防产后骨质流失。挖骨者。Res。34, 681-698(2019)。
Al Bander, Z., Nitert, m.d., Mousa, A. & Naderpoor, N.肠道微生物群和炎症:概述。Int。j .包围。公共卫生决议案17,https://doi.org/10.3390/ijerph17207618(2020)。
Brandsma, E.等人。促炎肠道菌群增加全身炎症,加速动脉粥样硬化。中国保监会,Res。124, 94-100(2019)。
李,L.等。在ApoE(-/-)小鼠中,牙周炎可能通过调节肠道菌群而损害全身骨骼的稳态。j .中国。Periodontol。https://doi.org/10.1111/jcpe.13708(2022)。
Cekici, A., Kantarci, A., Hasturk, H. & Van Dyke, T. E.牙周病发病机制中的炎症和免疫途径。牙周病学200064, 57-80(2014)。
牙周炎相关微生物群的炎性特征。摩尔。口语。Microbiol。29, 248-257(2014)。
阿拉姆,J. P.等。慢性牙周炎病变中il -17极化浸润以产生il -23的CD68(+)巨噬细胞样细胞为主。j .中国。Periodontol。38, 879-886(2011)。
恩斯特,C. W.等人。牙周病骨吸收损伤中叉头盒P3/CD25双阳性T调节细胞减少与核因子- kappab配体(RANKL+) T细胞增加相关中国。Exp Immunol。148, 271-280(2007)。
O 'Boyle, C.等人。结扎引起的牙周炎诱导全身炎症,但不改变小鼠中风后的急性结局。Int。j .中风15, 175-187(2020)。
Rashidi, A., Ebadi, M., Weisdorf, D. J., Costalonga, M. & Staley, C.没有证据表明口腔细菌在健康成人远端肠道定植。国家科学院学报美国118, e2114152118(2021)。
Atarashi, K.等。口腔细菌在肠道中的异位定殖驱动T(H)1细胞诱导和炎症。科学358, 359-365(2017)。
Laudadio, I.等。霰弹枪宏基因组学和16S rDNA扩增子测序在人类肠道微生物组研究中的定量评估。组学22, 248-254(2018)。
袁,H., Gupte, R., Zelkha, S. & Amar, S.核因子κ B配体拮抗剂受体激活剂抑制实验性牙周炎组织炎症和骨丢失。j .中国。Periodontol。38, 1029-1036(2011)。
Erben, U.等人。小鼠模型肠道炎症的组织形态学评价指南。Int。j .中国。实验病理学研究。7, 4557-4576(2014)。
确认
本研究由国家自然科学基金资助项目31971282,U22A20314(给J.S.), 82170968(给T.Z.)资助。本研究得到2019年重庆市研究生导师队伍建设项目dstd201903(给J.S.)和国家重点研发项目2022YFC2504200(给J.S.)的支持。
作者信息
作者及隶属关系
贡献
X.Y.参与了实验设计、数据分析、稿件撰写和修改;F.Z, h.w., X.X.对数据采集做出了贡献,并对手稿进行了批判性的修改;沈祥祥、常泽、杨泽、M.L.对数据分析有贡献;杨永章、M.Z、h.l.、x.z对数据解释有贡献;T.Z, J.S.参与了实验构想、实验设计、数据分析和手稿修改。所有作者同意对这项工作负责。
相应的作者
道德声明
相互竞争的利益
所有作者都声明没有竞争利益。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
袁,X,周,F,王,H。et al。全身抗生素可增加菌群致病性和口腔骨质流失。国际口腔科学15, 4(2023)。https://doi.org/10.1038/s41368-022-00212-1
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41368-022-00212-1