摘要
客观的
喂食管含有微生物污染物;迄今为止的研究还没有探索口胃(OG)和鼻胃(NG)管生物膜之间的差异。我们试图通过比较细菌定殖位置(OG vs NG)和评估可能影响试管细菌种群的临床因素来扩展先前的分析。
研究设计
采用下一代16s rRNA测序技术,在MiSeq平台上对41例婴儿(14 OG和27 NG)的咽段进行分析。
结果
在门水平上,变形菌门的OG管和NG管的相对丰度最高。在属/种水平上,9个类群在OG管和NG管之间存在显著差异。Alpha和beta多样性分析显示OG管和NG管之间存在显著差异,临床因素的影响相对较小。
结论
与评估的临床因素相比,喂食管插入路径(口服或鼻腔)对细菌定植的影响更大。
简介
在新生儿重症监护室(NICU),由于吸吮、吞咽和呼吸的协调不成熟或呼吸道、心血管、胃肠或神经系统疾病,通常使用肠内喂食管。然而,肠内喂养系统迅速形成微生物生物膜[1,2,3.].因此,喂食管可能成为病原体的储存库,引起婴儿感染或由医护人员在病人之间传播[4,5],新生儿重症监护室婴儿间共有的细菌菌株证明了这一点[4,6],这可能值得特别关注,因为从喂食管分离出的许多菌株对多种抗生素具有耐药性[3.].在喂食管中发现的许多种类的细菌是医院病原体,包括肠杆菌科的成员,肠球菌sp和凝固酶阴性葡萄球菌spp。1,3.]
食管由鼻胃(NG)路或经口胃(OG)路插入。鼻咽(位于鼻子后面的咽喉上部区域)由纤毛上皮和柱状上皮排列,口咽位于口腔后面,由非角化分层鳞状上皮排列。鼻咽和口咽在出生时迅速被高度多样化的“先驱”微生物群定殖,在生命的最初几天内,相邻解剖位之间出现了显著差异[7,8].鼻孔里藏着该属的细菌棒状杆菌属而且葡萄球菌(9,10,11],而口咽则藏有该属的种链球菌,嗜血杆菌,奈瑟氏菌属,在较小的程度上葡萄球菌以及各种厌氧菌[9,12].母亲的微生物群至少在一定程度上影响了婴儿的微生物群,而且婴儿上呼吸道微生物的进化与外部因素(例如阴道分娩与剖宫产、母乳喂养与配方奶喂养以及抗生素暴露)之间存在关联[7,13].新生儿肠道定植的短期和长期临床意义的发现仍处于婴儿期。需要更好地了解定殖微生物的组成和功能,以评估该群落的扰动对发育中的免疫系统的影响。
本研究旨在进一步了解住院婴儿鼻胃和口胃肠内喂养管细菌定植的差异。我们使用16种S rRNA基因测序技术来表征从NICU患者取出的喂食管中的细菌组成。此外,还分析了分娩方式、胎龄、喂养方式、抗生素给药等影响生物膜形成的临床因素。我们之前已经在婴儿喂食管的咽、食管和胃部分证明了抗微生物药物耐药性基因[14].在本研究中,我们将重点放在饲管的咽段,比较基于管插入部位(鼻腔和口腔)的定殖,并探讨临床因素如何影响定殖。
方法
样品收集
如前所述,在加州大学戴维斯医学中心NICU收集喂食管4个月(2015年8月至12月)[14].所有方案均由加州大学戴维斯分校机构审查委员会(文献编号753294-4)批准,所有研究入组者均获得父母或法定监护人的知情同意,研究按照《赫尔辛基宣言》进行。参与这项研究不影响患者的护理。在样本收集期间,所有在新生儿重症监护室(NICU)插管的婴儿都有资格参加这项研究。所有婴儿均未使用益生菌治疗。
在NICU工作人员按计划取出喂食管后,将喂食管放入无菌套管中,并在−40°C冷冻。在参与研究期间,研究人员每周记录每位受试者的营养类型。此外,研究人员还检查了入组者的电子医疗记录,以记录饲管停留时间、饲管放置路径、患者的胎龄、抑酸剂或抗生素的使用,以及坏死性小肠结肠炎(NEC)、败血症和自发性肠穿孔(SIP)的诊断。
在最初的研究中,从47名婴儿中收集了97根饲管,每根饲管分别分为咽段、食管段和胃段。在目前的研究中,我们只分析了来自咽段的数据,因为这些数据最有可能受到插入部位(口腔和鼻腔)的影响。
样品制备
每个试管用1ml无菌PBS和0.5 mL空气冲洗。咽段-从管出体点以下5厘米开始的3厘米部分(管插入深度)-纵向切开,用无菌手术刀切成大约2毫米的片段。
DNA文库构建与测序
从制备好的试管中提取DNA并按先前所述进行分析[14].简单地说,用每个样本的条形码引物扩增16s rRNA基因的V4区。通过凝胶电泳确认扩增成功,然后使用Qiagen QIAquick PCR纯化试剂盒(Qiagen, Hilden, Germany)对样品进行固结和纯化。纯化的条形码扩增子随后被提交到加州大学戴维斯基因组中心DNA技术测序核心,用于配对端文库制备和使用Illumina MiSeq DNA测序系统(Illumina, San Diego, CA, USA)测序。
结果读取使用Sabre解复用[15],然后导入QIIME2-2018.4-2018.4 [16].bp 22之前和bp 210之后的碱基从正向读取进行修剪。bp 24之前和bp 210之后的碱基从反向读取修整。然后使用DADA2 [17].所得到的复制子序列变异(RSV)表、系统发育树、代表性序列和分类分配从QIIME2-2018.4导出[18]用于r3.4.3统计软件的下游分析[19].
排除试剂盒对照样品中检测到的rsv后,排除测序深度小于1500 reads的咽段。样本被提纯到1528个reads,这是除去试剂盒污染相关rsv后最低的样本的reads深度,剩下41名婴儿的73个咽段。我们从每个婴儿中选择一个咽段(NG或OG)进行更详细的分析,尽可能选择从相似的时间和停留时间收集的管(27名婴儿使用NG管,14名婴儿使用OG管)。
统计分析
采用R版本3.4.3统计软件和QIIME2-2018.4完成统计分析。在进行16s rRNA基因测序分析时,检查RSV表中样本的测序深度,排除最高阴性对照测序深度5倍以内的所有样本。然后使用纯素包2.4-2[将序列细化到样本的读取深度,读取次数最少。20.,21].Alpha多样性采用Shannon和Simpson指数进行分析。这些咽样本在NG管和OG管之间的差异使用Wilcoxon秩和检验。
beta多样性分别由Bray-Curtis, Jaccard, Unweighted UniFrac和加权UniFrac距离进行分析。利用主坐标分析(PCoA)直观地探讨了微生物群落β多样性的差异。beta多样性的差异使用PERMANOVA进行测试,由Adonis命令在素食中实现[22].
微生物组组成的偏置校正分析(ANCOM-BC) [23]用于检测OG管和NG管之间微生物组成的差异。ANCOM-BC采用Wilcoxon秩和检验来识别差异丰富的类群,并包括通过Holm-Bonferroni方法进行多次假设修正;它是比较组间相对丰度的一个有价值的工具,因为它能够在保持能量的同时将错误发现率控制在名义水平。ANCOM-BC检测问值<0.05被认为是显著的(q值为为优化错误发现率调整的p值)。测定OG管和NG管细菌属的差异以及临床变量的差异。分析的临床数据包括胎龄(足月婴儿≥37周或早产儿<37周)、分娩方式(剖宫产或阴道分娩)、乳汁类型(母乳、婴儿配方奶或混合饮食)和抗生素使用。
结果
表格1总结各组婴儿的人口学及临床资料。OG组早产儿比例高于NG组(93% vs. 67%)。因此,与使用NG管的婴儿相比,使用OG管的婴儿在分娩当天接受抗生素、产前类固醇和抗生素的频率更高(p值分别为0.04、0.008和0.005),且OG组拔管时的经后年龄低于NG组。使用OG管的婴儿与使用NG管的婴儿在取管当天接受抗生素或其他临床因素的差异无统计学意义。
细菌丰度
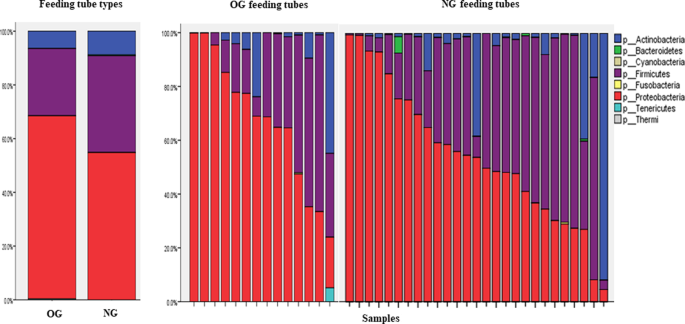
在样本中发现的最丰富的门是变形菌门、厚壁菌门和放线菌门。同时检测到拟杆菌门、蓝藻门、梭杆菌门、软杆菌门和热杆菌门。数字1在OG管和NG管中可见细菌门。NG和OG管的平均相对丰度分别为变形菌门(Proteobacteria,分别为49%和59%)、厚壁菌门(Firmicutes,分别为32%和22%)和放线菌门(Actinobacteria,分别为8%和6%)。
变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)的相对丰度在所有食管中呈负相关(Spearman相关系数−0.75,p< 0.001)变形菌门和放线菌门(Spearman相关系数−0.48,p= 0.002)。这一模式在NG和OG亚群中分别成立,变形菌门和放线菌门的相对丰度都呈负相关(Spearman相关系数−0.48,p= 0.012)、变形菌门和厚壁菌门(Spearman相关系数−0.67,p在NG管中,Proteobacteria和Firmicutes的相对丰度均< 0.001)(Spearman相关系数−0.85,p< 0.001)。
共检出细菌科15个,平均相对丰度大于1%(补充表1).肠杆菌科在两种饲管中均最为丰富(NG管为27%,OG管为38%)。NG管中Moraxellaceae(14%)和Staphylococcaceae(11%)含量高于OG管,而OG管中Streptococcaceae(10%)和Neisseriaceae(6%)含量高于OG管。
通过ANCOM-BC分析,9个属/种在NG和OG试管中表达不同(表2)2).kroppenstedtii棒状杆菌,luteciae链球菌,假单胞菌在OG管中含量高于NG管。相比之下,肠球菌、葡萄球菌、链球菌、奈瑟菌、副流感嗜血杆菌,假单胞菌fragi,在NG管中含量较高。假单胞菌在出生第一天接受抗生素治疗的婴儿中含量更高(问< 0.01)。在属水平上,早产儿和足月婴儿、分娩方式、饲管持续时间和奶喂养类型之间无显著差异。
Alpha和Beta多样性分析
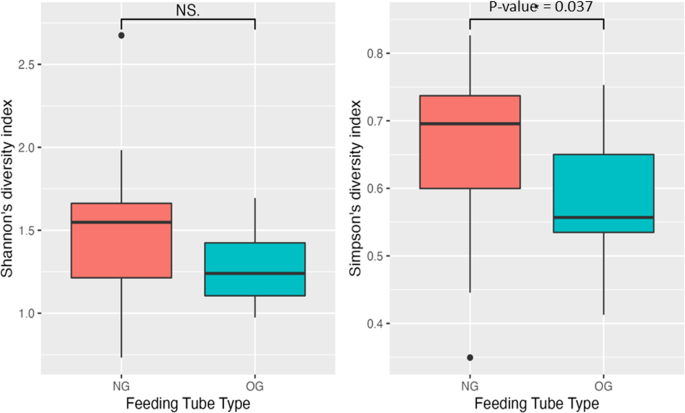
Alpha多样性用Shannon多样性指数和Simpson多样性指数来衡量。根据Simpson指数,NG管的α多样性显著高于OG管,而Shannon指数则不显著(图2)。2).基于早产/足月婴儿、分娩方式、饲管停留时间、抗生素、奶型喂养或NEC或SIP病史等临床变量,所有饲管或亚组(NG vs OG)的α多样性均无显著差异(补充表)2).
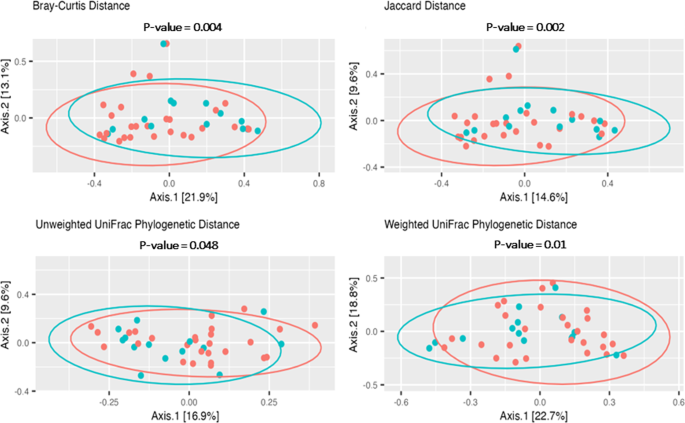
Beta多样性使用Bray-Curtis, Jaccard, Unweighted UniFrac和加权UniFrac测量OG和NG管之间的差异。评估PERMANOVA检验的统计学意义。NG管和OG管样品的微生物群落根据饲管插入路径(NG vs OG)存在显著差异(p= 0.004)。使用Jaccard、Unweighted UniFrac和Weighted UniFrac(分别为0.002、0.048和0.02)也得到了类似的结果。这表明NG管和OG管群落存在显著差异。数字3.显示了分析的所有进给管样品的Bray-Curtis、Jaccard、Unweighted UniFrac和Weighted UniFrac距离的主坐标分析图(PCoA)。补充表3.总结了NG和OG之间的beta差异以及所有饲管的临床标准。值得注意的是,抗生素的使用和喂食管的放置时间影响了beta多样性的一些测量。
讨论
新生婴儿的微生物群是高度动态的,在生命的最初几年里,在特定的身体部位有不同的微生物群落(在分类上和功能上),在组成上经历快速变化[24,25].喂食管上的生物膜可能受到放置部位(口腔或鼻腔)的细菌以及胃和肠道细菌的影响。婴儿经常有运动障碍,表现为胃食管反流(通常进入鼻子和嘴巴),腹胀和细菌过度生长。细菌代谢产物或宿主肠道和呼吸道共同的粘膜免疫反应的继发效应也可能影响这些生物膜[10,26,27,28].肠道和呼吸道具有相同的胚胎起源,其粘膜表面由柱状上皮细胞组成,可感知共生细菌,并在婴儿成熟时形成局部和全身免疫,并作为经后年龄的功能[26,27,29].在NICU中,食管生物膜也可能受到饮食、抗生素、治疗方法和环境暴露的影响[30.,31,32].这些变化的影响可以通过在关键的出生后免疫能力早期期间抗生素诱导的新生儿肠道微生物群的改变来说明[31,32,33].
在我们最初的研究中,我们发现食管上的生物膜主要由变形菌门而且厚壁菌门在门的水平上放线菌少量存在的这些细菌曾被报道为NICU患者喂食管、肠内喂食系统延伸管和新生儿胃食管菌群中细菌数量最多的组成部分[1,2,3.,6,34,35].我们还发现,喂食管生物膜受到婴儿肠道微生物的影响,并且在喂食管生物膜中的微生物中常见抗生素耐药基因。
在本研究中,我们重点研究了NG管和OG管上生物膜的差异,以及临床因素与饲管生物膜的相关性。我们只关注咽部分的喂食管,因为这些部分最有可能受到插入部位的影响。在科和属/种水平上,NG管和OG管在α和β多样性上存在显著差异。NG管和OG管生物膜之间的一些差异可能与出生时胎龄的差异有关(包括产前类固醇的影响,分娩时和产后抗生素的影响,以及鼻CPAP的需要,这可能限制了NG管的使用);虽然我们的分析没有发现统计学意义(p的值,即0.07及0.093.),更大样本量的评估肯定会证明胎龄的显著影响。最近的一项研究表明,与OG管相比,NG管误吸和管移位的发生率较低,并且NG管比OG管喂养的婴儿出生体重恢复得更快[36].我们的数据提出了一个问题,即食管定植的差异是否是这些差异背后的机制之一。
变形菌门(Proteobacteria)和肠杆菌科(Enterobacteriaceae)在OG和NG管中的优势在门水平上具有临床意义,因为这些微生物被描述为肠道生态失调的标志[37]并与早产儿NEC风险增加有关[38].值得注意的是,NG管和OG管在属/种水平上,最常与NEC和晚发脓毒症相关的肠杆菌科没有显著差异(埃希氏杆菌属而且克雷伯氏菌).我们发现OG管和NG管在属/种水平上存在差异假单胞菌不同的物种更常见。如果这在未来的研究中得到证实,了解这种差异偏好背后的机制将是有价值的假单胞菌物种是机会性病原体,与其他物种一起形成青霉素和其他β -内酰胺抗性生物膜,占领医院并引起NICU暴发[39,40].
我们在NG管中发现Moraxellaceae和Staphylococcaceae增加,而在OG管中发现Streptococcaceae和Neisseriaceae增加,这与鼻咽和口咽定植的差异是一致的。改变鼻腔菌群影响的未来研究(如甲氧西林耐药菌株的脱色)金黄色葡萄球菌)或比较凝固酶阳性和阴性葡萄球菌定植的婴儿NG管上的生物膜将是有价值的。
先前的研究表明,在新生儿重症监护室环境中存在一些与婴儿肠道相关的菌株,并且这些菌株在婴儿和病房环境之间存在交换[41].未来的研究需要调查NICU环境清洁方案对食管生物膜的影响以及这些生物膜中常见生物的疾病爆发。在这项研究中,没有一个婴儿接受益生菌膳食补充剂;探讨不同益生菌菌株对饲管定殖的影响是有价值的。在探索用共生生物或抗菌分子涂覆的喂食管的临床影响方面也可能有价值。
本研究中使用的分析技术的一个缺点是它们不能区分病原体和共生菌株。这具有临床意义,因为共生细菌的缺乏和潜在致病菌的过多都与危及生命的疾病有关[42].此外,许多菌株肠杆菌科从NICU喂食管中分离出来的大肠杆菌对抗生素有耐药性[3.].虽然已经描述了个体身体部位内的许多微生物群落[24,43,44,45,46],但对跨多个身体部位或系统的微生物群之间的关联研究较少[47,48].
这项研究还有一些其他的局限性。队列研究有助于建立相关性,但不是因果关系。样本量很小,是基于可行性而不是样本量计算。此外,对于那些收集了几根试管进行比较的婴儿,选择一根试管会增加临床因素混淆的可能性。这项研究也只调查了细菌。病毒、真菌和古菌在喂食管生物膜中的潜在作用,以及人乳成分(如免疫球蛋白、乳铁蛋白、溶菌酶和人乳寡糖)对喂食管微生物群落的影响,未来的研究可能有价值。
结论
新生儿喂食管以变形菌门,特别是肠杆菌科、莫拉菌科和奈西菌科为主,厚壁菌门,特别是葡萄球菌科和链球菌。通过鼻腔和口腔途径放置的饲管的群落组成不同,NG管中Moraxellaceae和Staphylococcaceae增加,OG管中Neisseriaceae和Streptococcaceae增加。在这个小队列中,胎龄、分娩方式、喂养方式和其他临床因素的差异的影响似乎不如插入部位重要。进一步的研究表明OG和NG管之间的差异以及插入部位的潜在临床影响。
数据可用性
数据可由作者索取。
参考文献
peterson SM, Greisen G, Krogfelt KA。新生儿科的鼻胃喂食管产生高浓度的潜在致病菌-甚至在插入后1天。儿科决议2016;80:395-400。
Mehall JR, Kite CA, Saltzman DA, Wallett T, Jackson RJ, Smith SD。新生儿肠内喂养细菌污染发生率及并发症的前瞻性研究。中华儿科杂志,2002;37:1177-82。
Hurrell E, Kucerova E, Loughlin M, Caubilla-Barron J, Hilton A, Armstrong R,等。新生儿肠内喂食管作为肠杆菌科成员定植的位点。BMC感染传播2009;9:46。
马苏德,马苏德,马苏德,马苏德,马苏德,等。新生儿鼻胃喂食管分离大肠埃希菌K1的分子特征。BMC感染疾病。2015;15:449。
Mehall JR, Kite CA, Gilliam CH, Jackson RJ, Smith SD。肠内喂食管是医院耐药病原体的储存库。中华儿科杂志,2002;37:1011-2。
Gomez M, mole L, Melgar A, Ureta N, Bustos G, Fernandez L,等。早产儿早期肠道定植:肠内喂食管的影响。中华儿科胃肠病学杂志,2016;62:893-900。
狄奥多西乌AA,多莉RB,瑞德RC,琼斯CE。婴儿咽部微生物群:起源,影响和操作。传染病杂志2020;33:548-55。
陆震,戴伟,刘勇,周强,王华,李东,等。MPP和非MPP患儿鼻咽和口咽微生物群的变化。基因(巴塞尔)。2017; 8:380。
Proctor DM, Relman DA。人类鼻、口、喉的景观生态和微生物群。细胞宿主微生物,2017;21:421-32。
Gallacher DJ, Kotecha S.新生儿呼吸微生物组。前沿儿科。2016;4:10。
米卡·米,麦克·I,柯腾·I,奇·W,艾比·S,弗雷·乌,等。婴儿鼻腔微生物群动态:一项前瞻性队列研究。中华过敏临床免疫杂志,2015;
Sampaio-Maia B, Monteiro-Silva F.童年时期口腔微生物群的获得和成熟:最新进展。登特·雷斯J(伊斯法罕)。2014; 11:291 - 301。
王志强,王志强,王志强,等。婴儿呼吸道微生物群的成熟、环境驱动因素和健康后果。前瞻性队列研究。美国呼吸急救医学杂志。2017;196:1582-90。
塔夫脱DH, Salinero LK, Vongbhavit K, Kalanetra KM, Masarweh C, Yu A,等。新生儿肠内喂食管中的细菌定植和抗微生物药物耐药基因。FEMS微生物生态学报2019;95:fiz039。
Joshi N. Sabre:用于FastQ文件的条形码多路分解和修剪工具。GitHub, 2011年。
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK,等。QIIME允许分析高通量群落测序数据。Nat Methods. 2010; 7:335-6。
Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2:基于Illumina扩增子数据的高分辨率样本推断。Nat Methods. 2016; 13:581-3。
McDonald D, Price MN, Goodrich J, Nawrocki EP, DeSantis TZ, Probst A,等。一种改进的绿基因分类学,用于细菌和古生菌的生态和进化分析。《科学》2012;6:610-8。
R核心团队。R:统计计算的语言和环境。维也纳,奥地利:R统计计算基金会,2016。
群落生态学的R函数包。中国蔬菜科学,2003;14:923-70。
Oksanen J, Blanchet FG, Friendly M, Kindt R, Legendre P, McGlinn D,等。素食:社区生态包,2017。
置换多元方差分析(PERMANOVA)。威利StatsRef;John Wiley & Sons有限公司,2017。
林H,裴德达SD。带有偏差校正的微生物组组成分析。Nat Commun. 2020;11:3514。
Chu DM, Ma J, Prince AL, Antony KM, Seferovic MD, Aagaard KM。婴儿微生物群落结构和功能在多个身体部位的成熟,并与分娩方式有关。中国医学杂志。2017;23:314-26。
田中M,中山J.肠道菌群在婴儿期的发展及其对晚年健康的影响。Allergol Int. 2017; 66:515-22。
沃纳BB,哈瓦斯a,肺部,微生物和发育中的新生儿。新生儿学2015;107:337-43。
张志刚,张志刚,张志刚,张志刚,等。微生物群与肠肺轴之间的新兴致病联系。微生物学报,2017;15:55-63。
Wesemann DR, Nagler CR.过敏性疾病背景下的微生物群、时间和屏障功能。免疫2016;44:728-38。
新生儿先天免疫:基本机制和临床相关性。中华免疫杂志2007;7:379-90。
郭丽玲,刘志强,刘志强,等。早产和营养对发育中的肠道微生物群和早产儿生长的影响。微生物2017;5:158。
布鲁克斯B,弗莱克BA,米勒CS,莎伦I,托马斯BC,贝克R,等。新生儿重症监护室里的微生物与早产儿肠道里的微生物相似。微生物2014;2:1。
Quercia S, Candela M, Giuliani C, Turroni S, Luiselli D, Rampelli S,等。从一生到进化:人类肠道菌群适应的时间尺度。前沿微生物,2014;5:587。
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK,等。肠道微生物群的成熟和儿童哮喘的风险。Nat Commun. 2018;9:141。
Milisavljevic V, Garg M, Vuletic I, Miller JF, Kim L, Cunningham TD,等。VLBW新生儿胃食管微生物群的前瞻性评估。BMC儿科,2013;13:49。
Matlow A, Wray R, Goldman C, Streitenberger L, Freeman R, Kovach D.儿科机构肠道饲料管理装置的微生物污染。中华流行病学杂志,2003;31:49-53。
Badran AT, Hashish M, Ali A, Shokeir MA, Shaaban A勘误表:早产儿鼻胃管喂养与经胃管喂养:试点随机临床试验。Am J围产期醇,2020;38:1526-32。
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ。畸形变形菌扩张:上皮功能障碍的微生物特征。中国生物医学工程学报。2017;39:1-6。
Pammi M, Cope J, Tarr PI, Warner BB, Morrow AL, Mai V,等。坏死性小肠结肠炎前早产儿肠道生态失调:系统回顾和荟萃分析。微生物2017;31。
Stanton RA, McAllister G, Daniels JB, Breaker E, Vlachos N, Gable P,等。卫生保健相关病原体铜绿假单胞菌核心基因组多位点序列分型方案的建立与应用。中国临床微生物学杂志。2020;58:e00214-20。
翁mk, Brooks RB, Glowicz J, Keckler MS, Christensen BE, Tsai V,等。新生儿重症监护室铜绿假单胞菌感染暴发调查。Am J感染控制,2019;47:1148-50。
Brooks B, Olm MR, Firek BA, Baker R, Thomas BC, Morowitz MJ,等。对医院房间和婴儿的菌株解析分析揭示了人类和房间微生物组之间的重叠。Nat Commun. 2017;8:1814。
马安德伍德,孙k .极早产儿的微生物群。临床围产期。2017;44:407-27。
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM,等。早产儿肠道中细菌种群的模式进展。美国国家科学研究院。2014; 111:12522-7。
人类微生物组项目联盟。健康人体微生物群的结构、功能和多样性。自然2012;486:207-14。
科斯特洛EK,卡莱尔EM,比克EM,莫罗维茨MJ,雷尔曼DA。低出生体重儿体内多个部位的微生物群组装。MBio 2013; 4: e00782-13。
Gritz EC, Bhandari V.人类新生儿肠道微生物组:简要回顾。前沿儿科。2015;3:17。
Faust K, Lima-Mendez G, Lerat JS, Sathirapongsasuti JF, Knight R, Huttenhower C,等。微生物关联网络的跨生物群系比较。前沿微生物。2015;6:1200。
李志强,李志强,李志强,等。人类微生物群中的微生物共现关系。科学通报。2012;8:e1002606。
资金
本研究由美国国立卫生研究院[F32HD093185] (DHT)和[AT008759] (DAM)资助。
作者信息
作者及隶属关系
贡献
KV:研究设计、患者入组、数据分析并撰写初稿;LKS、KMK、CM、AY、DHT样品处理分析,数据分析,稿件编辑;DAM, MAU:研究设计,稿件编辑。所有合著者都同意了手稿的最终版本。
相应的作者
道德声明
相互竞争的利益
DAM是Evolve Biosystems和BCD Biosciences的联合创始人。Evolve Biosystems是一家专注于基于饮食的肠道微生物群操纵的公司,BCD Biosciences是一家推进新型生物活性聚糖的公司。进化论生物系统公司和BCD生物科学公司都没有参与这篇手稿的概念化、设计、数据收集、分析或准备。其他作者都没有潜在的利益冲突。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Vongbhavit, K., Salinero, l.k., Kalanetra, K.M.et al。新生儿重症监护室婴儿鼻胃和口胃肠内喂养管细菌定植的比较。J Perinatol42, 1446-1452(2022)。https://doi.org/10.1038/s41372-022-01452-z
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41372-022-01452-z