摘要
异柠檬酸脱氢酶的代谢基因(IDH1 2)在胶质瘤中经常发生突变。突变的IDH定义一种不同的胶质瘤亚型并预测治疗反应。IDH突变具有显著的新胚性活性,将α-酮戊二酸(α-KG)转化为2-羟基戊二酸(2-HG),后者现在通常被称为肿瘤代谢产物和胶质瘤的生物标志物。PCR-sequencing (n= 220),免疫组化染色(IHC,n= 220),气相色谱质谱(GC-MS,n= 87)用于鉴别IDH比较了胶质瘤的突变,以及这些策略的敏感性和特异性。pcr测序和免疫组化染色是可靠的回顾性评估IDH1但这两种方法通常都需要1-2天,这阻碍了它们在快速诊断中的应用。基于gc - ms的方法可以定性和定量地检测2-HG,提供有关疾病的信息IDH1胶质瘤的突变状态,敏感性和特异性为100%。进一步优化基于GC-MS的方法(称为小柱法)使我们能够在40分钟内测定胶质瘤样本中的2-HG,而无需复杂或耗时的制备。最重要的是,2-HG/谷氨酸的比值被证明是确定突变状态的可靠参数。小柱法能够快速识别2-HG,为术中诊断提供了一种有前途的策略IDH1-突变胶质瘤。
介绍
全面的基因组研究显示,异柠檬酸脱氢酶(IDH)经常发生在多种类型的人类癌症中,包括神经胶质瘤的一个子集[1].随后的研究表明IDH突变可能是神经胶质瘤的有力预后因素[2].IDH1突变也被认为是恶性星形细胞瘤的预测生物标志物,可用于广泛的切除和放化疗,使患者受益[3.].因此,IDH突变已被引入胶质瘤的分子分型和综合诊断[4,5].几乎所有的IDH这些突变的目标是酶活性位点的一个氨基酸残基,即IDH1中的Arg132和IDH2中的Arg172和Arg140。肿瘤来源的IDH1和IDH2突变取消了它们将异柠檬酸盐转化为α-酮戊二酸(α-KG)的正常催化活性[2,6,7].最显著的特征IDH突变是新形态的功能获得:依赖nadph的α-KG还原为正常微量代谢物2-羟戊二酸(2-HG),现在通常被称为肿瘤代谢物[6,8].
作为代谢的直接结果IDH在胶质瘤中,2-HG可累积至5-35μmol /gIDH突变(8].利用2-HG异常富集,磁共振波谱(MRS) [9,10]以及质谱分析[11,12]已被报道用于检测2-HG并定义IDH胶质瘤组织的突变状态。MRS作为一种无创监测2-HG的方法,其敏感性会急剧降低,特别是在小肿瘤中[13].虽然在高场MRS (7.0 Tesla)中准确率可以提高,但其临床应用尚未得到证实[14].由于气相色谱质谱法(GC-MS)比MRS灵敏得多,因此可以很好地平衡灵敏度和可靠性,检测生物样品中的代谢物。气相色谱-质谱联用首次用于酸尿患者尿液样本中2-HG的检测[15],随后在AML患者的血清样本中发现IDH1-R132H或IDH2-R140Q突变[16]以及培养的含有内源性的癌细胞株IDH突变(17].在本研究中,我们用GC-MS对2-HG进行定性和定量的检测,结果提供了信息IDH1脑肿瘤的突变状态,敏感性和特异性为100%。进一步优化基于gc - ms的方法使我们能够在40分钟内确定2-HG。重要的是,利用2-HG/谷氨酸的比值来检测突变,因为野生型肿瘤中2-HG很少[18,19].且比例能准确区分IDH1——这可能为胶质瘤的术中诊断和患者管理提供一种新的范式。
材料与方法
样本采集和统计分析
患者入组、样本采集、统计分析细节见补充信息.经华山医院当地伦理委员会批准后,所有患者均获得同意书。神经病理学家根据《2016年世界卫生组织中枢神经系统肿瘤分类》对这些肿瘤样本进行临床分类和分级[20.].详细介绍了测序和免疫组化的过程补充信息.
GC-MS-based 2-HG检测
通过添加150µL−80°C甲醇:水混合物(80%:20%;Cat#34860, Sigma-Aldrich)到脑组织(约25 mg),然后在4°C下均质20 s (OSE-Y10, Tiangen)。这些冷冻的,甲醇萃取的均质组织,然后在14000转/分下离心6分钟,沉淀细胞和组织碎片,60µL清除的组织上清转移到螺旋盖v型玻璃底瓶(VAAP-31509-1232-100, CNW),并在真空干燥设备(Concentrator Plus, Eppendorf)中在30°C下干燥10分钟。为了进行分析,将残渣与20µL n -叔丁基二甲基硅基- n -甲基三氟乙酰胺(MTBSTFA, Cat#394882, Sigma-Aldrich)和35µL吡啶(Cat#270407, Sigma-Aldrich)在70°C下混合20分钟。将1微升衍生样品注入Aligent 7890a气相色谱- Agilent 5975C质谱联用。毛细管柱(Cat# 19091S-433, HP-5ms Intuvo, 30 m × 0.25 mm × 0.25μm;安捷伦科技公司(Agilent Technologies)采用氦气作为载气进行分离。气相色谱-质谱联用和数据处理的参数补充信息.
GC-MS-based 2-HG定量
D-2-HG (Sigma-Aldrich, Cat#94577)作为标准样品溶解于ddH中2O的浓度为10mm。将两倍稀释的样品与100µL−80°C甲醇:水混合物(80%:20%)混合,40µL混合物转移到螺旋盖v型玻璃底瓶中,按照上述方法在真空干燥装置中干燥,遵循标准GC-MS方法检测2-HG丰度。据此制作2-HG标准曲线进行定量。
对于胶质瘤样本中的2-HG定量,代谢物提取是通过向脑组织(约10 mg)中加入200µL−80°C甲醇:水的混合物(80%:20%),然后进行90 s均质(tissuelyer -48,上海晶鑫),并在4°C下以14000 rpm离心10分钟完成的。转移200微升上清液,30°C干燥1 h。将残渣与35 μ L含20 mg/mL盐酸甲氧基胺的吡啶(Sigma-Aldrich, Cat#226904)混合,然后在70°C下孵育0.5 h。在加入20 μ L MTBSTFA后,在70°C下衍生化40 min。将1微升衍生样品注入GC-MS进行2-HG检测定量。
方法验证
微型柱法根据美国fda为工业界制定的生物分析方法验证指南进行了验证[21].评价了选择性、定量下限(LLOQ)、基质效应、回收率、精密度、准确度和稳定性。细节和结果显示在补充信息.
结果
回顾性评估IDH1通过pcr测序和免疫组化染色检测胶质瘤的突变
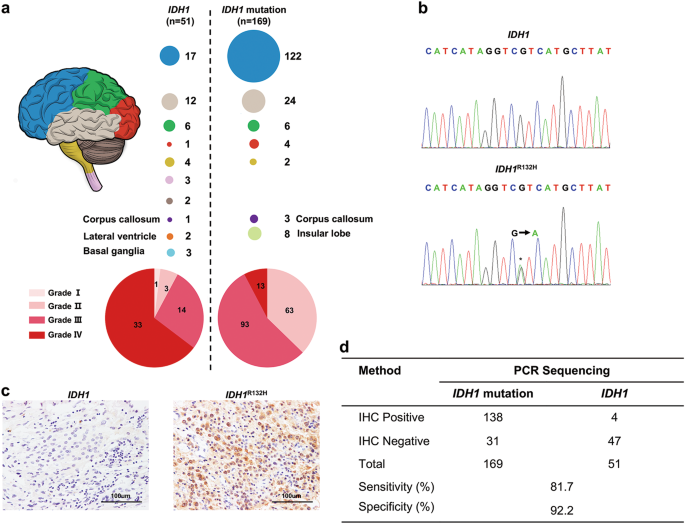
在220个胶质瘤样本中,169个是杂合的IDH1R132H突变经pcr测序鉴定(76.8%,WHO分级及位置见图。1b).我们发现的比例要高得多IDH1在低级别胶质瘤(LGG, WHO II & III级,92.3%)中,与gbm(7.7%)相比IDH1神经胶质瘤突变)。此外,IDH1——突变胶质瘤主要位于额叶(图。1),这与以往的研究一致(关于该群体的特征,补充表S1) [22].
接下来,我们评估了IDH1通过免疫组化(IHC)检测胶质瘤样本的突变状态IDH1R132H突变体(图;1 c).169年IDH1阳性138例(81.7%)IDH1免疫组化导致R132H突变(图;1 d).51例IDH1野生型胶质瘤标本中,抗体染色阴性47例(92.2%)IDH1R132H突变,4例出现IHC假阳性(图;1 d).pcr测序和免疫组化染色均可用于肿瘤的诊断,具有较高的敏感性和特异性IDH胶质瘤术后突变状态。需要注意的是,这两种方法通常都需要1-2天的时间,阻碍了快速诊断的应用。
气相色谱-质谱法定量检测2-汞IDH1突变的神经胶质瘤
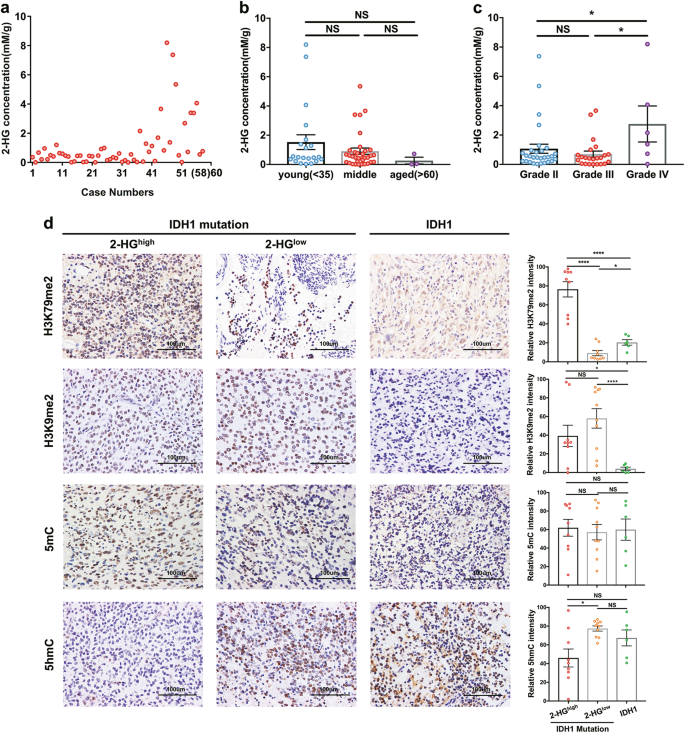
GC-MS技术提供了一种潜在的敏感和可靠的检测方法,不仅用于检测2-HG,而且还用于其定量。在GC-MS方法的样品制备过程中,手术解剖的胶质瘤样品(约10 mg)离心后用预冷甲醇均质,上清进行真空干燥、衍生化、GC-MS检测和定量。重建自适应的标准曲线,以覆盖左50%曲线内的最大响应值。58例胶质瘤样本杂合子IDH1通过测序鉴定出R132H突变,我们发现在49/58(84.5%)的测试样本中,2- hg水平低于2 mM/g组织(图4)。2).在一些情况下,有避风港IDH1突变时,2-HG浓度可高达8.2 mM/g(图;2).
2-HG水平在年轻人中较高IDH1-突变患者(< 35岁,n= 21, 1.525±2.30 mM/g),以及中年患者(35岁≤年龄≤60岁,n= 34, 0.909±1.22 mM/g),老年患者有降低趋势(> 60岁,n= 3,0.263±0.403 mM/g)(图2 b).由于老年组样本量有限,故未发现统计学差异(图2)。2 b).此外,我们还观察到GBM中2-HG浓度较高(n= 6,2.757±3.006 mM/g),与LGG包括WHO二级(n= 29, 1.071±1.663 mM/g)和III级(n= 23, 0.701±0.988 mM/g,P< 0.05)。(无花果。2摄氏度)
总的来说,这些结果表明GC-MS可以提供一个可靠的策略来量化胶质瘤中的2-HGIDH1用少量的组织进行突变。
高浓度累积2-HG对组蛋白去甲基化的抑制作用IDH1突变的神经胶质瘤
IDH1R132突变仅在原发肿瘤组织中产生D-2-HG [8], D-2-HG作为α-KG的拮抗剂,竞争性地抑制多种α-KG/Fe(II)依赖的双加氧酶,包括组蛋白酶和DNA去甲基化酶[23,24].体外研究表明,D-2-HG具有最低的半最大抑制浓度(IC50),范围为24 μM ~ 106 μM [23].如图所示。22-HG(即D-2-HG)的浓度范围为5.4 μ M/g ~ 8.2 mM/gIDH1-突变胶质瘤样本,提示组蛋白去甲基酶可能在这些样本中被抑制。为了验证这一假设,我们分析了胶质瘤样本中的组蛋白H3赖氨酸79 (H3K79)和H3赖氨酸9 (H3K9)甲基化。二维).我们的数据表明H3K79二甲基化在IDH12- hg水平高于2 mM/g肿瘤组织的突变病例(称为2- hg高,n= 9),与野生型IDH1肿瘤(P< 0.0001,n= 6)。值得注意的是,H3K79二甲基化没有增加IDH1-突变胶质瘤样本,其中2-HG水平低于0.1 mM/g肿瘤组织(称为2-HG低,n与野生型IDH1肿瘤相比= 10)。2-HG组H3K79二甲基化显著升高高组比2-HG组高低集团(P< 0.0001)。H3K79的甲基化由DOT1L/KMT4催化,并在多种细胞途径中发挥作用,包括端粒沉默、细胞发育、细胞周期检查点、DNA修复和转录调控[25].我们的研究结果表明,尚未确定的假定的H3K79去甲基酶的活性似乎对细胞中2-HG的浓度敏感,并且只有当2-HG积累到高水平时才能被抑制。
另一方面,H3K9二甲基化在2-HG中均显著升高高和2-HG低组窝藏IDH1与IDH1野生型组相比(P< 0.05和P分别< 0.0001)。H3K9二甲基化水平在2-HG之间未发现明显变化高和2-HG低组与IDH1突变。来自TCGA数据集的生物信息学分析表明,大多数H3K9二甲基化相关组蛋白去甲基酶基因[26,27],例如Kdm1a, kdm3b, kdm4b, kdm4c, kdm4d, kdm5b,KDM7A的水平上调IDH1-突变胶质瘤与野生型肿瘤的比较(补充图。S1).这些结果支持了这样一种观点IDH1突变和2-HG积累导致组蛋白去甲基酶活性受到抑制,而不是抑制其表达。
高浓度累积2-HG对DNA羟甲基化的抑制作用IDH1突变的神经胶质瘤
除α- kg依赖性组蛋白去甲基酶外,2-HG还抑制TET1和TET2在体外和体内的催化活性IDH突变细胞[24,28].的协议,IDH胶质瘤突变与CpG岛甲基化表型(G-CIMP)相关[29],在原代星形胶质细胞中异位表达时,可单独建立G-CIMP [30.].我们发现5-甲基胞嘧啶(5mC)的平均相对强度在2-HG之间没有明显差异高(n= 9), 2-hg低(n= 10),野生型组(n= 6)(图二维).5-羟甲基胞嘧啶(5hmC)的平均相对强度在2-HG有降低的趋势高与IDH1野生型组相比。然而,在2-HG中未观察到降低5hmC的趋势低与IDH1野生型组相比。值得注意的是,2-HG组的5hmC水平显著降低高组比2-HG组高低集团(P< 0.05)。来自TCGA的基因表达数据证实了这一点春节基因表达显著上调IDH1-突变胶质瘤与IDH1野生型肿瘤的比较(补充图。S2),支持这一观点IDH1突变和2-HG导致胶质瘤中TET活性的抑制,而不是抑制其表达。此外,这些结果也表明,只有当2-HG积累到较高水平时,TET酶的催化活性才会被抑制IDH突变的神经胶质瘤。
压缩GC-MS快速检测2-HG
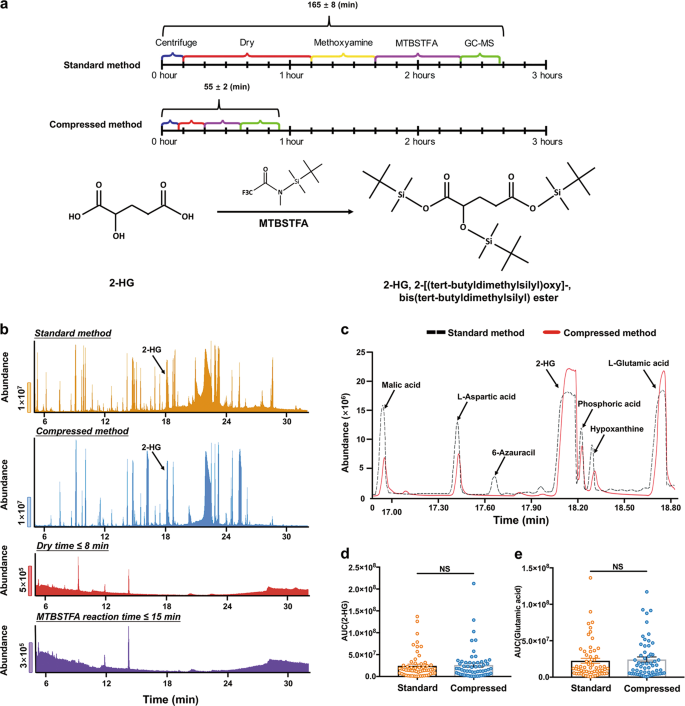
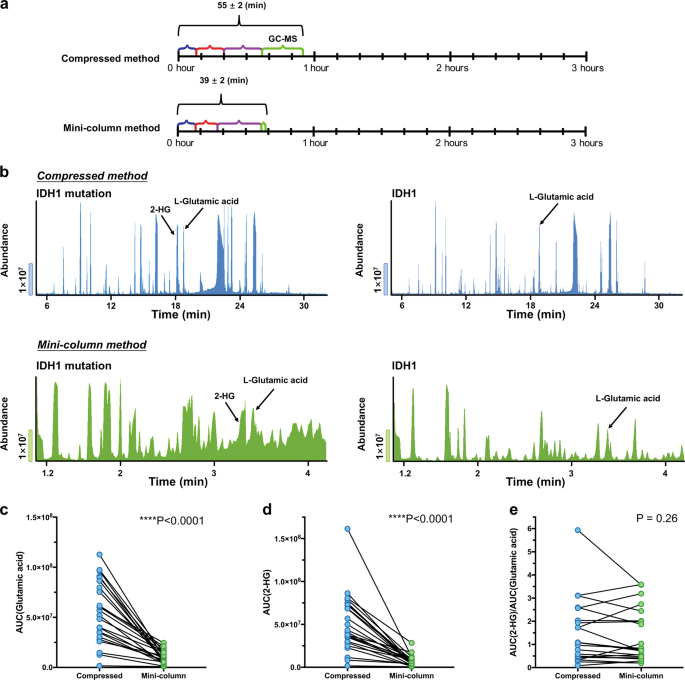
pcr测序和IHC染色均需1天以上才能完成,不适用于快速诊断IDH临床实践中的突变。气相方法的标准程序包括均质化、离心、真空干燥、肟化由methoxyamine盐酸(氧化物)和衍生N-tert-Butyldimethylsilyl-N - methyltrifluoroacetamide (MTBSTFA),通常需要大约3 h(即165±8分钟)(图3).值得注意的是,2-HG是一种不含羰基的小分子代谢物,因此不能与MOX反应[31].考虑到2-HG含有3个羟基,因此可以与MTBSTFA反应(图。3),我们开发了一种压缩GC-MS程序,目的是快速检测2-HG。为了加速GC-MS过程,我们测试了各种条件以缩短GC-MS每一步及其组合的时间周期。我们确定离心时间可缩短至6 min,真空干燥时间可缩短至10 min,可省去盐酸甲氧胺肟化步骤,MTBSTFA反应时间可缩短至20 min,且不丢失2-HG峰的检测(图2-HG峰)。3, b).因此,压缩GC-MS过程可以在不到1小时(55±2分钟)内完成从组织样本制备到2- hg检测。
接下来,我们在87例胶质瘤患者队列中测试了这种基于压缩GC-MS的2-HG检测方法的临床应用潜力(关于该人群的特征,补充表)S2).手术流程从术前MRI诊断开始,到回顾性评估结束IDH1pcr测序和免疫组化染色。手术解剖的胶质瘤样本直接使用基于GC-MS的方法进行代谢物分析(补充图)。S3).压缩GC-MS方法省略了MOX肟化步骤,干扰了含羰基代谢物的检测。事实上,含有羰基的代谢物的AUC(曲线下面积),如6-氮杂嘌呤和次黄嘌呤(图2)。3 c),压缩GC-MS法测定的含量明显小于标准GC-MS法测定的含量。既不是2-HG也不是l-谷氨酸,通常用于2-HG标准化[32,33],有羰基。因此,2-HG或l-谷氨酸经压缩GC-MS法测定,与标准方法(n= 58,成对t以及;无花果。3 d, e)。
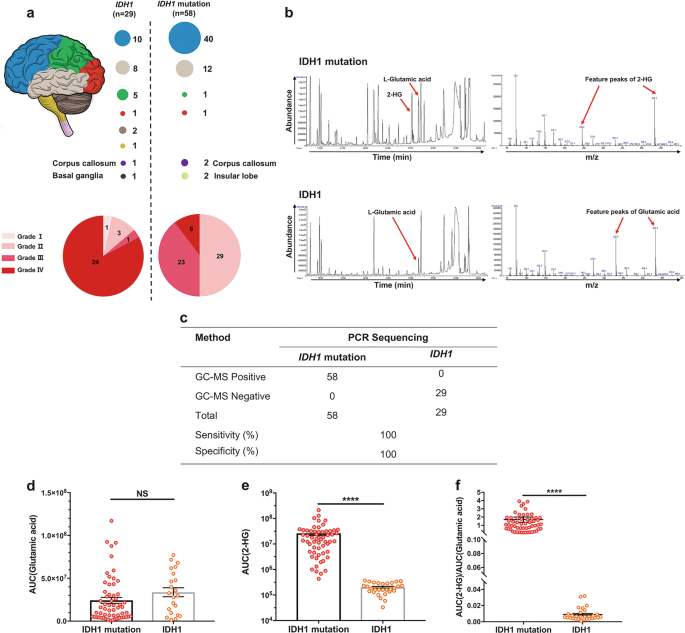
在这87个案例中,58个样本被确定为窝藏IDH1pcr测序突变(补充表S2).采用压缩GC-MS法,58例均检测到2-HG累积IDH1-突变样本(图;4 a、b, c).经pcr -测序鉴定为野生型IDH1的29份样本中,压缩GC-MS法分析均未发现2-HG累积(图2-HG累积)。4 b).因此,这些发现表明压缩GC-MS方法在识别中的准确率为100%IDH-突变的胶质瘤样本。与我们之前的发现一致(图。1),我们发现IDH1-突变/2- hg阳性的病例在WHO级和III级胶质瘤中富集,压缩法主要位于额叶(图。4).的AUCl-谷氨酸经压缩GC-MS测定之间保持不变IDH1-突变型和野生型肿瘤(图;4 d).这与紧密的保留时间一起l-谷氨酸(GLU, 18.72 min)和2-HG (18.12 min),为快速GC-MS程序提供了方便的半定量内控。我们发现2-HG/GLU比值在所有病例中均显著增加IDH1-突变病例(1.685±2.367,n= 58;P< 0.0001),而IDH1野生型(0.0096±0.0078,n= 29,图4 d, e, f).因此,2-HG/GLU的比值是一种更准确的区分方法IDH1突变型和野生型胶质瘤:2-HG/GLU比值低于0.04表示野生型IDH状态,而高于0.1的比值仅在突变型和野生型胶质瘤中发现IDH1在分析样本的两个队列中未见0.04 ~ 0.1范围内的比值(图2)。4 f).
一种快速定性的GC-MS程序用于2-HG检测和快速诊断IDH1突变的神经胶质瘤
快速诊断IDH突变后,气相色谱机毛细管柱由30米缩短至5米(小柱法)。结果,GC运行时间从32分钟(标准方法)显著缩短到4.2分钟(迷你列方法)。在GC运行过程中,标准柱法和小柱法分别在18.1 min和3.3 min出现2-HG峰。总检测时间(小柱法)为39±2 min,压缩法为55±2 min (P< 0.0001,图;5)(补充表格S3).5米柱法分离效率和峰明显降低,但2-HG峰在标准柱上出现于3.3 min,而在标准柱上为18.1 min,仍能充分分离并被质谱清晰识别。5 b).
目的评价小柱法在2-HG检测和鉴别中的准确性和临床应用价值IDH采用压缩法和小柱法对43例手术切除胶质瘤进行2-HG检测。在这43个样本中,有24个港湾IDH124份样品经压缩柱GC-MS法或小柱GC-MS法均为2-HG阳性。的AUCl-谷氨酸或2-HG在小柱法上显著小于(P< 0.001,成对t以及;无花果。5度, d).然而,小柱法测定的2-HG/GLU与压缩GC-MS法测定的2-HG/GLU比值相似(P= 0.26,成对t以及;无花果。5 e).24个样品中2-HG/GLU的比值普遍在0.1以上IDH1在19份野生型样品中,2-HG/GLU比值< 0.04,表明2-HG/GLU比值可作为判断该突变的可靠指标IDH临床病例的突变状态(补充图。S4).综上所述,这些结果表明,小柱法虽然不适合定量,但可以可靠、快速地识别2-HG,从而IDH1手术解剖胶质瘤样本的突变状态,为快速诊断胶质瘤提供了一种潜在的广泛临床应用的新方法IDH突变。
讨论
IDH突变定义了异质性胶质瘤的不同亚型[34,35],而这些亚组表现出独特的临床特征和对治疗的反应[3.,36,37].精准诊断IDH突变对胶质瘤患者的护理管理至关重要。近年来,质谱技术的发展取得了迅速的进展,其中包括小代谢物的鉴定。发现突变体产生D-2-HGIDH提供了一个极好的例子来说明基于质谱技术的前景[8].
在本研究中,我们开发了基于GC-MS的2-HG检测和定量方法。我们的数据表明,D-2-HG浓度在IDH1——突变胶质瘤,范围从5.4 μ M/g到8.2 mM/g肿瘤组织。2-HG在其碳主链中携带一个不对称碳原子,导致形成两种对映体:D-2-HG和L-2-HG。2-HG的两种对映体都是正常的内源性代谢产物,但在结合和抑制α- kg依赖性双加氧酶活性方面可能存在差异。D-2-HG抑制α- kg依赖的双加氧酶(包括组蛋白和DNA去甲基化酶)的活性已被广泛认识。全面的体外研究报道,D-2-HG抑制α- kg依赖性双加氧酶家族成员的活性差异很大,组蛋白去甲基酶KDM4A/JMJD2A和KDM4C/JMJD2C是最敏感的(IC50= 24µM和79µM),脯氨酸羟化酶结构域蛋白2 (PHD2)和γ-丁基甜菜碱羟化酶(BBOX)非常耐药(IC50=分别为7.3毫米及13.2毫米)[23].此外,D-2-HG还在体外抑制小鼠Tet1和Tet2 (IC50分别为4毫米及5毫米)[28,38].因此,D-2-HG可以不同程度地抑制胶质瘤中α- kg依赖的双加氧酶IDH突变和IC最低的50D-2-HG的值优先被抑制。为了支持这一观点,我们在本研究中表明,2-HG在2-HG中都有积累低和2-HG高均可抑制α- kg依赖性的KDM4A/JMJD2A和KDM4C/JMJD2C,而KDM4C/JMJD2C对2-HG的抑制非常敏感[23].另一方面,2-HG在2-HG中积累低而2-HG的累积量较高(如4 ~ 5 mM) [38]将被用于催化抑制TET。总的来说,这些结果提供了体内证据,再次肯定了高积累的2-HG对α- kg依赖性组蛋白和DNA去甲基酶的抑制作用IDH1突变的神经胶质瘤。观察到的不同α- kg依赖性双加氧酶的差异抑制的临床意义需要进一步研究。
快速诊断IDH突变迫切需要帮助神经外科医生设计治疗脑肿瘤的策略,原因有几个。首先,IDH突变可以将LGG与胶质细胞增生和正常脑组织区分开来。第二,胶质瘤边缘2-HG浓度通常急剧下降[12],对肿瘤边界的识别有很大帮助。三是快速诊断IDH突变对决定切除范围具有潜在的重要意义。如果肿瘤位于大脑的非功能区,全切除或最大限度的手术切除一定会有利于隐匿的患者IDH1突变。如果IDH-突变的肿瘤毗邻或位于大脑功能区域,这些肿瘤应保留重要的神经功能,并应对放化疗高度敏感[36].在目前的研究中,我们开发了一种新的基于压缩gc - ms的方法,可以准确、快速地识别IDH2-HG监测脑肿瘤突变状态。经过进一步改进,GC运行时间已成功缩短至4.2 min,使我们能够在术后40 min内检测到少量胶质瘤样本中的2-HG。最近,据报道,解吸电喷雾电离质谱(DESI-MS)可以在冷冻组织涂片中识别2-HG(约3分钟,与样品制备时间无关),并有助于快速的分子诊断IDH胶质瘤的突变[39].DESI-MS和GC-MS都便于2-HG的检测,因为DESI-MS不需要参考库,而GC-MS拥有标准的Mass Database,可以广泛应用于建立包括2-HG在内的代谢产物和任何其他肿瘤代谢产物的标准检测方案[40].需要注意的是,在进行DESI-MS测定肿瘤细胞百分比(TCP)之前,需要建立参考库[41].建立了液相色谱/电喷雾电离串联质谱(LC/ ESI-MS /MS)方法准确检测2-HG [42],但不能完全区分突变型和野生型。由于野生型肿瘤中2-HG较少,单纯依靠2-HG不能作出准确诊断。我们相信环境电离法和基于gc - ms的方法都将有助于术中诊断,具有广泛的临床应用价值IDH突变状态,加快临床决策,并在不久的将来改善神经肿瘤患者的护理和治疗。
参考文献
帕森斯DW,琼斯S,张X,等。人类多形性胶质母细胞瘤的整合基因组分析。科学。2008;321:1807-12。
闫华,帕森斯DW,金刚,等。胶质瘤中的IDH1和IDH2突变。中华外科杂志,2009;36(2):366 - 366。
王晓燕,王晓燕,王晓燕,等。IDH1突变的恶性星形细胞瘤更易于手术切除,并且与最大限度的手术切除相关的生存益处。神经外科杂志2014;16:81-91。
蔡凯瑞,马志刚,马志刚,等。分子分析揭示了生物离散子集和途径扩散神经胶质瘤的进展。细胞。2016;164:550 - 63。
张志刚,张志刚,张志刚,等。基于肿瘤中1p/19q、IDH和TERT启动子突变的胶质瘤组。中华外科杂志,2015;
王志强,王志强,等。白血病相关IDH1和IDH2突变的共同特征是将α -酮戊二酸转化为2-羟基戊二酸的新形态酶活性。中国癌症杂志,2010;17:225-34。
赵松,林勇,徐伟,等。胶质瘤衍生的IDH1突变主要抑制IDH1的催化活性并诱导HIF-1alpha。科学。2009;324:261-5。
邓丽丽,白德伟,葛洛斯,等。癌症相关的IDH1突变产生2-羟戊二酸。大自然。2009;462:739-44。
王晓明,王晓明,王晓明,等。idh突变胶质瘤患者体内谱编辑和二维相关磁共振波谱检测2-羟戊二酸。科学翻译,2012;4:116ra4。
崔春华,李志刚,李志刚,等。磁共振波谱法检测idh突变胶质瘤患者2-羟戊二酸的研究。医学杂志,2012;18:624-9。
王志强,王志强,等。定量代谢组分析分析了IDH1突变胶质瘤中谷氨酰胺溶解的激活。《肿瘤生物学》2014;35:5911-20。
李志强,李志强,李志强,等。术中肿瘤代谢物质谱图谱用于指导脑肿瘤手术。美国国家科学研究院。2014; 111:11121-6。
米德拉富恩特,杨永杰,鲁贝尔,等。2-羟基戊二酸质子磁共振波谱在异柠檬酸脱氢酶突变胶质瘤疾病监测中的应用神经外科杂志,2016;18:283-90。
王志刚,王志刚,等。通过2-羟戊二酸的无创3D功能光谱映射评估idh突变胶质瘤患者的治疗反应。临床癌症决议2016;22:1632-41。
Struys EA, Verhoeven NM, Roos B, Jakobs C. D-2-羟基戊二酸尿、l -2-羟基戊二酸尿和D/ l -2-羟基戊二酸尿患者成纤维细胞培养液中疾病相关代谢物。临床化学。2003;49:1133-8。
李志强,李志强,李志强,等。IDH1-R132H和IDH2-R140Q突变的AML患者2-羟戊二酸水平升高。中华血液病杂志,2010;
马山,姜波,邓伟,等。d -2-羟基戊二酸是维持含idh突变癌细胞的致癌性所必需的,但对细胞生长是可可可无的。Oncotarget。2015;6:8606-20。
叶东,管kl,熊勇。D-和l -2-羟戊二酸的代谢、活性及靶向性。癌症趋势。2018;4:151-65。
李志强,李志强,李志强,等。结直肠癌肿瘤代谢产物d -2-羟基葡萄糖酸直接诱导上皮-间质转化,并与远处转移相关。科学通报2016;6:36289。
李文杰,李志强,李志强,等。2016年世界卫生组织中枢神经系统肿瘤分类:摘要。神经病理学报2016;131:803-20。
美国食品和药物管理局,工业指南:生物分析方法验证,2001年,[访问2017年11月15日]。可以从http://www.fda.gov/downloads/Drugs/Guidance/ucm070107.pdf.
Ichimura K, Pearson DM, Kocialkowski S,等。IDH1突变存在于大多数常见的成人胶质瘤中,但在原发性胶质瘤中很少见。神经外科杂志2009;11:341-7。
乔杜里,杨桂奎,田玉梅,等。肿瘤代谢产物2-羟戊二酸抑制组蛋白赖氨酸去甲基酶。EMBO代表2011;12:463-9。
徐伟,杨华,刘勇,等。肿瘤代谢产物2-羟基戊二酸是α -酮戊二酸依赖性双加氧酶的竞争性抑制剂。《癌症杂志》2011;19:17-30。
Farooq Z, Banday S, Pandita TK, Altaf M.组蛋白H3K79甲基化的多面性。Mutat Res Rev Mutat Res 2016; 768:46-52。
张志强,王志强,王志强,等。cBio癌症基因组学门户:探索多维癌症基因组学数据的开放平台。癌症发现,2012;2:401-4。
高军,巴克索,杜格鲁索,等。使用cBioPortal对复杂癌症基因组学和临床资料进行综合分析。科学通报。2013;6:pl1。
李志强,李志强,等。2-羟基戊二酸(R)-对映体的转化与EGLN活化有关。大自然。2012;483:484-8。
卢什梅尔,魏森伯格,迪夫斯,等。鉴定CpG岛甲基化表型,定义胶质瘤的一个独特亚群。中国生物医学工程杂志,2010;17:10 - 22。
张志强,张志强,张志强,等。IDH1突变足以建立胶质瘤高甲基化表型。大自然。2012;483:479 - 83。
闫艳,林培林,王晓明,等。硫代类固醇代谢产物的质谱分析。中国生物工程学报。2014;25:869-79。
张志刚,张志刚,张志刚,等。白血病IDH1和IDH2突变导致高甲基化表型,破坏TET2功能,损害造血分化。癌症杂志,2010;18:553-67。
李志强,李志强,等。气相色谱/质谱法检测福尔马林固定石蜡包埋胶质瘤标本中2-羟基戊二酸。《大脑病理》2012;22:26-31。
Sturm D, Witt H, Hovestadt V,等。H3F3A和IDH1的热点突变定义了不同的胶质母细胞瘤表观遗传和生物学亚群。中国癌症杂志,2012;22:425-37。
杨华,叶东,管kl,熊勇。IDH1和IDH2突变在肿瘤发生中的作用机制和临床前景。临床癌症,2012;18:5562-71。
陈志强,陈志强,等。放疗加丙卡嗪、CCNU和长春新碱治疗低度胶质瘤。中华医学杂志。2016;374:1344-55。
川口T,田田Y,柴原I,等。无1p/19q共缺失的IDH 1/2突变的WHO级胶质瘤患者行全切除术的影响中华神经外科杂志,2016;
劳卡·T, Mariani CJ, Ihantola T,等。富马酸和琥珀酸通过TET酶调控缺氧诱导基因的表达。中国生物化学杂志,2016;291:4256-65。
皮罗V,阿尔法罗CM,贾木许AK,等。用解吸电喷雾质谱法评估胶质瘤切除术中肿瘤边缘。美国国家科学研究院。2017; 114:6700-5。
贾木许AK,皮罗V,贝尔德Z,等。解吸电喷雾电离质谱法测定人脑肿瘤的脂质和代谢物。美国国家科学研究院。2016; 113:1486 - 91。
皮罗V,贾木许AK,阿尔法罗CM,等。神经涂片在术中脑癌诊断和DESI-MS肿瘤细胞百分比的应用。分析师。2017;142:449-54。
金森M,前川M,柴原I,等。用质谱法快速检测异柠檬酸脱氢酶1和2基因突变。脑肿瘤病理杂志2018;35:90-6。
确认
我们非常感谢R. Graham Cooks的建议和手稿修改。我们感谢所有外科医生(复旦大学华山医院神经外科)在样本收集方面的努力。同时,我们也感谢复旦MCB实验室的成员在整个研究过程中的讨论和支持。国家重点研发计划(No. 2016YFA0501800),国家自然科学基金(No. 81572483, 81522033, 81372198),上海市科委(No. 16JC1404000, No. 15441904500),上海市自然科学基金和重大基础研究计划(No. 16JC1420100)资助。
作者信息
作者及隶属关系
相应的作者
道德声明
利益冲突
作者宣称他们没有利益冲突。
权利和权限
关于本文
引用本文
徐浩,夏玉坤。,李,CJ。et al。快速诊断IDH1-突变胶质瘤2-HG气相色谱质谱检测。实验室投资99, 588-598(2019)。https://doi.org/10.1038/s41374-018-0163-z
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41374-018-0163-z
这篇文章被引用
利用自动解吸电喷雾电离质谱分析组织微阵列的高通量分析
科学报告(2022)
肿瘤代谢与肿瘤微环境:相互促进?
中国生命科学(2022)
结合高强度FLAIR边缘和影像学特征鉴定IDH突变体1p/19q非共缺失低级别胶质瘤
欧洲放射学(2022)
低糖消耗对IDH1基因突变胶质瘤的诊断价值
BMC癌症(2021)