摘要
核因子红系2相关因子2 (Nrf2),调节关键抗氧化蛋白的表达,最近被证明在癌症进展中发挥关键作用。对放射治疗的耐药性是治疗口腔鳞状细胞癌的主要障碍。然而,对于OSCC中Nrf2与放射抗性之间的关系知之甚少。使用两种OSCC细胞系(SAS和HSC-2)及其临床相关的抗辐射(CRR)克隆(SAS- r, HSC-2- r)。评估了Nrf2下调对放射敏感性的影响以及糖酵解在Nrf2介导的放射抗性中的作用。110例接受术前放化疗和手术的OSCC患者进行了磷酸化Nrf2 (p-Nrf2)免疫组化。Nrf2在体外CRR细胞和小鼠异种移植模型中稳定上调。此外,Nrf2表达升高与辐射抗性有关。nrf2依赖性糖酵解和谷胱甘肽合成的增强参与了放射抗性的发展。此外,p-Nrf2的表达与放化疗的病理反应密切相关,其表达可预测晚期OSCC患者的预后。 Our results suggest that Nrf2 plays an important role in the radioresistance of OSCC accompanied by metabolic reprogramming. Targeting Nrf2 antioxidant pathway may represent a promising treatment strategy for highly malignant OSCC.
简介
放射治疗是头颈部癌症,包括口腔鳞状细胞癌(OSCC)的重要治疗方式,它通过产生活性氧(ROS)造成DNA损伤,有效地消融癌细胞。1.然而,治疗往往与肿瘤对放疗的耐药性相混淆,这与手术切除和化疗观察到的情况类似2.一般来说,具有抗氧化活性的癌细胞可以通过清除ROS来逃避辐射的破坏作用,从而导致辐射抗性3..因此,阐明抗辐射OSCC细胞的特性是提高放疗疗效的重要目标。此外,为了改善患者的预后,探索新的生物标志物来指导OSCC的治疗管理和预测预后是非常重要的。此外,开发新的治疗策略至关重要。
核因子红系2相关因子2 (Nrf2) - kelch样ech相关蛋白1 (Keap1)信号通路是细胞对抗氧化应激的主要防御机制之一4.在基本条件下,Nrf2被其阻遏因子Keap1隔离在细胞质中,并通过泛素-蛋白酶体途径构成性降解4.在细胞暴露于氧化应激后,Nrf2逃脱keap1介导的抑制,并转移到细胞核,在细胞核中诱导许多细胞保护基因的转录4.最近的研究表明,激活的Nrf2是与包括头颈部癌症在内的各种癌症的肿瘤发展和进展相关的关键转录因子5,6,7,8.此外,nrf2介导的抗氧化途径与包括OSCC在内的几种恶性肿瘤的化疗耐药和放射耐药有关1,9.尽管我们之前报道过nrf2介导的抗氧化途径在OSCC的放射敏感性中发挥重要作用10,其详细机制尚未完全阐明。
自从被称为Warburg效应的好氧糖酵解系统被发现以来,癌细胞的有利和特征性代谢机制已被报道11,12,13.激活代谢的癌细胞积累了丰富的营养物质,包括葡萄糖和谷氨酰胺,并将其代谢产物分流到合成代谢途径11.Mitsuishi等人报道,稳定的Nrf2激活促进了代谢活动的重编程,除了增强细胞保护外,还导致了恶性表型,如细胞增殖14.2-脱氧葡萄糖(2-DG)抑制糖酵解代谢,抑制葡萄糖摄取,导致抗辐射细胞凋亡诱导死亡15,16,17.综上所述,我们推测Nrf2的高表达和核积累通过Nrf2依赖的代谢重编程直接参与治疗耐药性。
在本研究中,我们通过体外和体内分析研究了Nrf2在OSCC放射敏感性中的生物学作用。
材料与方法
亲本细胞系和临床相关的抗辐射(CRR)细胞系的建立
人类OSCC细胞系SAS和HSC-2从日本国立生物医学创新、健康和营养研究所的日本研究生物资源库中获得。CRR细胞系SAS- r和HSC-2- r分别由SAS和HSC-2细胞通过逐渐暴露于0.5-2 Gy/day的x射线剂量,如前所述18.这些细胞系用添加10%胎牛血清的DMEM培养,并在5% CO的湿度下保持2大气温度为37°C。
动物和体内实验方案
BALB/c-nu/nu雌性小鼠(6周龄)购自日本横滨Charles River Japan(日本横滨),由熊本大学动物资源开发中心饲养,按照熊本大学动物保护政策处理。将OSCC和CRR细胞胰蛋白酶化,用无血清培养基洗涤,在PBS中重悬,并调整至1 × 10的密度7/200 μl。然后,将细胞悬液皮下注射到裸鼠背部(n= 4/细胞系)。当肿瘤体积接近150mm时3.,开始实验(第0天)。小鼠暴露于单次剂量为10戈瑞的x射线下。除了肿瘤区域,老鼠的身体被铅屏蔽保护免受辐射。照射后7天,切除肿瘤组织,置于无菌管中,立即用10%福尔马林固定。
患者临床样本
为了进行组织病理学分析,我们从2003年10月至2011年10月熊本大学医院收治的110例晚期OSCC患者中提取了原发性OSCC组织样本。在II期研究中,所有患者术前均接受同步放化疗(CRT)治疗,包括总辐射剂量为30 Gy,随后进行治愈性手术19,20..根据口腔癌临床实践指南规划OSCC患者的治疗策略21.所有肿瘤均根据美国癌症联合委员会(2017)第八版TNM分级进行分期。区分程度根据世界卫生组织的等级分类确定。本研究按照熊本大学伦理委员会的指导方针进行(项目标识代码:SENSHIN No. 2389, RINRI No. 1427)。根据熊本大学(SENSHIN No. 2389)的指导方针,所有患者在活检和手术前均获得知情同意。本研究为回顾性分析,不需要个人同意;然而,患者有机会通过选择退出的形式拒绝参与(RINRI No. 1427)。采用术前CRT前活检标本的组织样本进行免疫组化分析。样品用10%的福尔马林固定,石蜡包埋。
免疫组化染色及组织病理学评价
一般认为,转位到细胞核的p-Nrf2作为转录因子在细胞中起着重要的作用22;因此,我们决定使用p-Nrf2特异性抗体来研究Nrf2的临床病理意义。免疫组化染色如前所述23.抗人磷酸化Nrf2 (p-Nrf2, Ser40;EP1809Y 1:10 0;Abcam, Cambridge, UK),抗人Ki-67抗体(1:100;Dako, Glostrup,丹麦)。使用ImageJ version 1.53 (NIH, Bethesda, Maryland, USA)定量p-Nrf2和Ki-67的表达。使用手术获得的标本,根据Shimasoto等人提出的标准对CRT的组织学反应进行分级。24分级如下:一级,肿瘤结构未破坏;IIa级,肿瘤结构破坏轻微(即经常观察到“活的肿瘤细胞”);IIb级,肿瘤结构破坏严重(即“存活的肿瘤细胞”稀疏);III级,无存活的肿瘤细胞;IV级,没有肿瘤细胞残留。
免疫组化染色评价
通过计算p-Nrf2染色阳性细胞核的癌细胞数量来确定p-Nrf2的表达。正常人胎盘组织样本作为阳性对照,原发口腔癌组织作为阴性对照,其处理方法与样本相似,但不包括将一抗替换为通用阴性对照抗兔抗体(Dako)。三名独立观察员(KK、NT和MH)用盲法解释免疫组化数据。对于每个标本,使用高功率场(×20 objective和×10 ocular)的染色强度和阳性细胞比例来评估p-Nrf2的表达。核p-Nrf2表达用四值强度评分(0,1 +,2+,或3+)以及反应性程度表示为百分比(0 - 100%)进行量化。p-Nrf2免疫组化表达评分由强度评分和反应程度(范围0-300)相乘确定。p-Nrf2高表达定义为得分超过80,这代表了使用全活检组织切片评估的oscc的中位表达。免疫组化评分在检查者之间不一致的,最终达成一致。
辐照
使用150 kvp x射线发生器(MBR-1520R型;日立,东京,日本)使用0.5毫米铝加0.1毫米铜过滤器进行总过滤。用套管电离室(IC 17A, Far West Technology, Goleta, CA, USA)测量的剂量率为1.01 Gy/min。
Western blot分析
全细胞和核蛋白(Minute™细胞质和核提取试剂盒;使用7.5%或10.0% SDS-PAGE分离,转移到硝化纤维膜上,并用抗Nrf2抗体(1:15 000;Abcam), p-Nrf2 (Ser40) (1:15 000;Abcam), Keap1 (1:1000;Cell Signaling Technology, Danvers, MA, USA),磷酸化p62 (phospho-p62, Ser351, 1:1000;医学生物实验室有限公司,美国马萨诸塞州沃本),STAT3 (1:1000;Cell Signaling Technology),磷酸化STAT3 (phospho-STAT3, Thy705, 1:500;细胞信号技术),Lamin B1 (1:10 00;Abcam)和β-actin (1:10 000;西格玛奥尔德里奇,圣路易斯,密苏里州,美国)。 After overnight incubation at 4 °C, the membranes were washed and incubated with appropriate horseradish peroxidase-conjugated secondary antibodies and visualized using an ECL prime detection kit (GE Healthcare, Buckinghamshire, UK).
改良高密度生存(HDS)试验
改进的HDS测定方法参照Kuwahara等的方法进行。25.指数生长的细胞(5 × 105)接种于60mm组织培养皿(Asahi Techno Glass, Shizuoka, Japan),并在含1% FBS的DMEM中孵育48小时。然后将细胞暴露在2、4、6或10戈瑞的辐射下。在培养72小时后,每个烧瓶中10%的细胞被播种到新的60mm培养皿中,并继续培养72小时。最后,通过台盼蓝染料排斥试验计算每个培养皿的细胞总数,并绘制细胞存活率。
细胞增殖试验
为了评估正常增殖,使用细胞计数试剂盒-8 (Dojindo, Kumamoto, Japan)每24小时定量OSCC和CRR细胞。
RNA分离及实时定量聚合酶链式反应(RT-qPCR)
使用mirVana™miRNA分离试剂盒(Life Technologies, Palo Alto, CA, USA)从处理过的细胞中分离总RNA。然后使用ReverTra qPCR RT试剂盒(Toyobo, Osaka, Japan)将总RNA逆转录为cDNA。每个反应使用Thunderbird SYBR qPCR Mix (Toyobo)在Light Cycler 1.5 (Roche, Indianapolis, IN, USA)上进行。采用比较Ct法,以甘油醛-3-磷酸脱氢酶(GAPDH)为对照,测定表达的倍数变化。每个样品一式三份。引物用于Nrf2 (forward, 5 ' -AGTGGATCTGCCAACTACTC-3 ';反向,5 ' -CATCTACAAACGGGAATGTCTG-3 '),苹果酶1 (ME1;向前,5“-CTGCCTGTCATTCTGGATGT-3”;反向,5 ' -ACCTCTTACTCTTCTCTGCC-3 '),谷氨酸半胱氨酸连接酶催化亚基(GCLC;向前,5“-TGAAGGGACACCAGGACAGCC-3”; reverse, 5′-GCAGTGTGAACCCAGGACAGC-3′); glutamate-cysteine ligase modifier subunit (GCLM; forward, 5′-AATCTTGCCTCCTGCTGTGTGA-3′; reverse, 5′-TGCGCTTGAATGTCAGGAATGC-3′), and GAPDH (forward, 5′-CAACAGCCTCAAGATCATCAGC-3′; reverse, 5′-TTCTAGACGGCAGGTCAGGTC-3′). The cycling conditions consisted of initial denaturation at 98 °C for 5 min followed by 45 cycles at 98 °C for 15 s, 58 °C for 30 s, and 72 °C for 60 s. These experiments were performed in triplicate.
小干扰RNA (siRNA)转染
本实验采用OSCC和CRR细胞。转染siRNA 24小时前,将细胞在不含抗生素的新鲜培养基中稀释,转移到60mm培养皿中。按照制造商说明书所述,使用Lipofectamine RNAi MAX (Invitrogen)培养细胞并转染nrg2特异性siRNA和Stealth™RNAi通用阴性对照(40 nM, Stealth siRNA, Invitrogen, Carlsbad, CA, USA)。siRNA序列如下:Nrf2-1 sense, 5 ' -CCA ACC AGU UGA CAG UGA ACU CAU U-3 ';Nrf2-1反义,5 ' -AAU GAG UUC ACU GUC AAC UGG UUG G-3 ';Nrf2-2感,5 ' -CAA ACU GAC AGA AGU UGA CAA UUA U-3 ';和Nrf2-2反义,5 ' -AUA AUU GUC AAC UUC UGU CAG UUU G-3 '。转染48小时后收集细胞进行体外实验。
海马XF24代谢通量分析
糖酵解压力测试使用Seahorse XF24分析仪(Seahorse Biosciences, Santa Clara, CA, USA)进行。用葡萄糖(25 mM)和糖酵解抑制剂2-DG(100µM;Wako,大阪,日本)。以指数生长的OSCC细胞及其相应的CRR克隆以5 × 10播种424孔细胞培养XF微孔板(Seahorse Biosciences)中的细胞/孔,然后用DMEM粘附过夜。然后用检测介质(无缓冲的DMEM,无葡萄糖,pH 7.4)清洗细胞,然后用无葡萄糖的检测介质(pH 7.4, 675 μ l)在37°C CO中孵育1小时2无孵化器。在注射葡萄糖前28分钟进行4次基线OCR和ECAR测量。在注射葡萄糖后的32分钟内也进行了OCR和ECAR测量。然后,在注射2-DG后32分钟内进行OCR和ECAR测量。
氧化谷胱甘肽(GSSG)/还原性谷胱甘肽(GSH)定量测定
对细胞进行辐照或转染siRNA。照射后24小时或转染后48小时收集细胞。根据制造商的说明,使用GSSG/GSH定量试剂盒(Dojindo)定量GSSG/GSH水平。
细胞ROS/超氧化物检测方法
首先,转染siRNA后孵育HSC-2-WT和HSC-2-R细胞48 h。第二,细胞(2 × 103.)接种到96孔板(Asahi Techno Glass)上,在含1% FBS的DMEM中孵育24小时。然后,这些细胞暴露在10戈瑞的辐射下。培养24 h后,使用细胞ROS/超氧化物检测试剂盒(Abcam)检测细胞中ROS/超氧化物的出现。使用FilterMAX F5微孔板阅读器(Molecular Devices, San Jose, CA, USA)进行观察。ROS/超氧化物检测方案基于两种荧光染料:用于检测总ROS的氧化应激检测试剂(Ex/Em 490/525 nm)和用于检测总ROS的超氧化物检测试剂(Ex/Em 550/620 nm)。
统计分析
采用卡方检验确定p-Nrf2表达状态与临床参数的相关性。采用Kaplan-Meier法进行生存分析,采用log-rank检验确定p-Nrf2表达与患者生存的相关性。采用Cox回归模型进行多变量生存分析,研究p-Nrf2表达对总生存期(OS)和无病生存期(DFS)的影响。用Student 's对两组之间的差异进行统计分析t采用Bonferroni-Dunn检验进行单向方差分析,而三个或三个以上组之间的差异则采用Bonferroni-Dunn检验。所有p数值基于双尾统计分析p< 0.05为有统计学意义。所有统计分析均使用JMP 9软件程序(SAS研究所公司,Cary, NC, USA)进行。
结果
p-Nrf2在体内外CRR细胞中均过表达
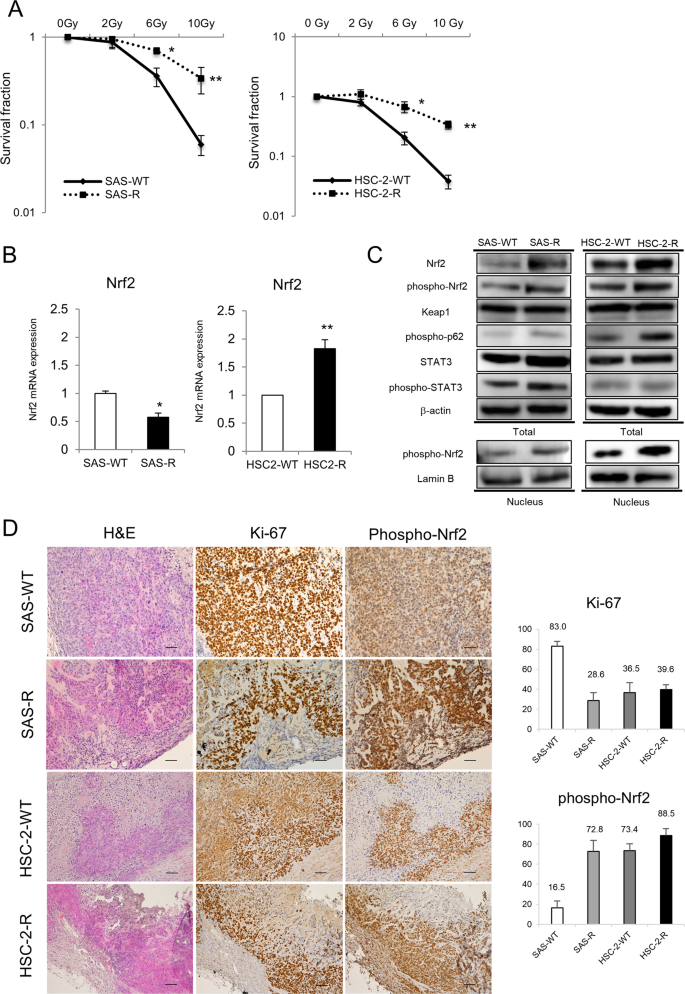
首先,为了确认SAS-R和HSC-2-R细胞是否获得CRR表型,如Kuwahara等人所述,对OSCC和CRR细胞进行辐照。25.SAS-R和HSC-2-R细胞的存活率均显著高于其亲本细胞(图。1).其次,我们通过RT-qPCR和Western blot检测了OSCC和CRR细胞中Nrf2、p-Nrf2和Nrf2激活相关分子(Keap1、p62和STAT3)的表达。第三,我们通过免疫组织化学方法检测了p-Nrf2在小鼠异种移植瘤中的表达模式。尽管抗辐射的SAS-R细胞在细胞质和细胞核中Nrf2和p-Nrf2蛋白水平显著升高,但与亲代细胞相比,SAS-R细胞中的Nrf2 mRNA水平较低(图2)。1 b, C).相反,在HSC-2- r细胞中,与HSC-2细胞相比,Nrf2和p-Nrf2在mRNA和蛋白水平上均有过表达(图2)。1 b, C).观察到Keap1和磷酸化p62的表达增加,它们是p-Nrf2的阳性调节因子,以及STAT3的磷酸化,被认为参与调节CRR细胞中这些分子的表达10.此外,我们发现Nrf2蛋白在许多OSCC细胞系中过表达(补充图。S1).此外,在体内小鼠异种移植模型中,Nrf2的活性形式p-Nrf2在CRR细胞中的表达显著增加;然而,增殖活性没有差异(图。1 d).此外,我们证实了p-Nrf2在辐照(10 Gy) CRR细胞中的表达高于未辐照的CRR细胞(数据未显示)。
一个SAS细胞、HSC-2细胞及其各自临床相关的抗辐射(CRR)克隆在暴露于2、6和10 Gy x射线辐射后的存活分数采用改良的高密度生存试验进行评估。*p< 0.05和**p< 0.01。B采用实时定量聚合酶链式反应检测正常条件下SAS细胞、HSC-2细胞及其各自CRR克隆Nrf2 mRNA水平。结果以三个独立实验的平均值±标准差表示。*p< 0.05和**p< 0.01。C正常情况下SAS、HSC-2、CRR细胞中Nrf2、磷酸化Nrf2 (phospho-Nrf2)、Keap1、磷酸化p62 (phospho-p62)、STAT3、磷酸化STAT3 (phospho-STAT3)的蛋白表达。制备全细胞蛋白和核蛋白,Western blotting检测Nrf2、phospho-Nrf2、Keap1、phospho-p62、STAT3和phospho-STAT3的表达。D异种移植术后第21天切除的口腔鳞癌组织H&E代表性显微镜图像及磷酸化nrf2和Ki-67免疫组化染色。原始放大倍数,×100;Bar, 100µm。用ImageJ软件定量Phospho-Nrf2和Ki-67。
Nrf2抑制使OSCC和CRR细胞对辐射敏感
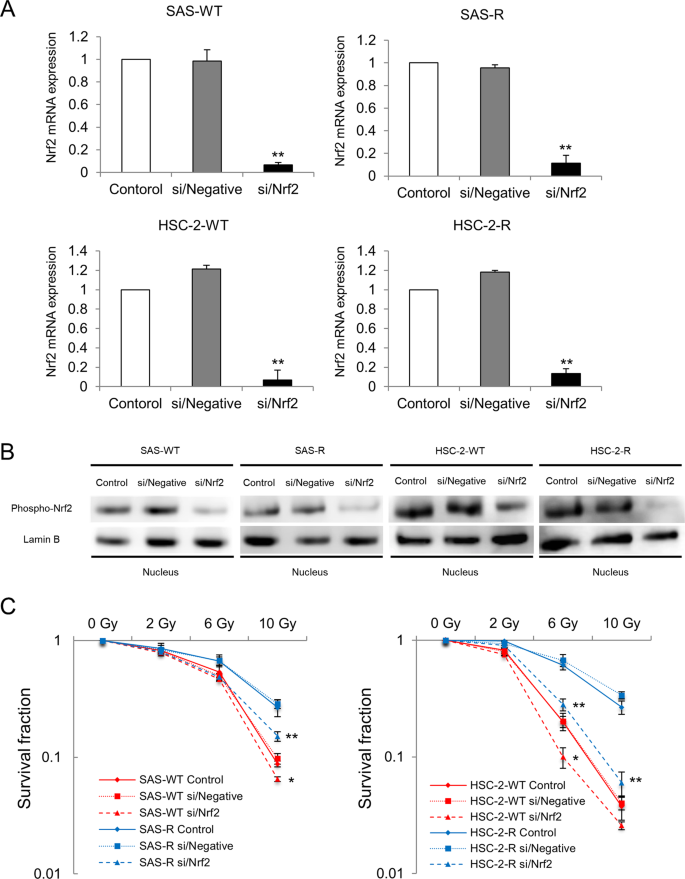
我们研究了Nrf2下调是否影响辐照OSCC和CRR细胞的辐射敏感性。由于从所有实验中获得的数据在Nrf2-1和Nrf2-2 siRNA结构之间是相似的,我们只提供了Nrf2-1的数据,用于后续涉及Nrf2抑制的实验(补充图2)。S2).首先,我们在mRNA和核蛋白水平上证实了siRNA对OSCC和CRR细胞Nrf2表达的抑制作用(图。2 a, B).其次,为了确定Nrf2的下调是否会影响OSCC和CRR细胞的放射敏感性,我们使用改良的HDS法抑制Nrf2表达后检测了它们的放射敏感性,观察到Nrf2的抑制导致辐照OSCC和CRR细胞的存活部分显著降低(图2)。2摄氏度).
一个用对照、si/Negative或si/Nrf2转染SAS细胞、HSC-2细胞及其各自临床相关抗辐射(CRR)克隆Nrf2 mRNA水平。转染48 h后提取总RNA,实时定量聚合酶链反应检测Nrf2 mRNA表达情况。结果以三个独立实验的平均值±标准差表示。B对照组、si/Negative或si/Nrf2转染后,SAS、HSC-2和CRR细胞Nrf2蛋白表达。转染48 h后制备核片段,Western blotting检测磷酸化的Nrf2 (phospho-Nrf2)蛋白表达情况。CNrf2下调对OSCC和CRR细胞放射敏感性的影响。在对照组、si/Negative或si/Nrf2转染后48小时,细胞暴露于2、6或10 Gy的x射线辐射中。然后,用改良的高密度存活法测定存活率。*p< 0.05和**p< 0.01。
海马XF代谢通量分析评价OSCC和CRR细胞糖酵解代谢
最近的研究表明,nrf2介导的代谢途径参与了癌症的放射抵抗26.因此,我们检测了OSCC细胞及其各自CRR细胞的糖酵解代谢。HSC-2无功能TP53突变27其CRR细胞系HSC-2-R的糖酵解活性高于HSC-2-WT细胞。然而,通过siRNA抑制Nrf2, HSC-2-WT和HSC-2-R细胞的糖酵解降低(图2)。3).此外,我们利用HSC-2-WT和HSC-2-R细胞研究了糖酵解和TCA周期相关基因表达水平的变化。结果显示,HSC-2-R细胞强烈表达ME1和GCLC/GCLM,分别合成丙酮酸和谷胱甘肽(图。3 b).相比之下,在nrf2特异性siRNA处理条件下,ME1和GCLC/GCLM mRNA表达明显下降(图2)。3 c).在SAS-WT中有一个泛函TP53突变28,29其CRR细胞系SAS-R的糖酵解活性低于HSC-2-WT和HSC-2-R细胞。在Nrf2敲除条件下,糖酵解活性的变化与HSC-2-WT和HSC-2-R相比较小(图2)。3 d).虽然在SAS- r细胞中ME1 mRNA的表达明显低于SAS细胞,但与SAS细胞相比,SAS- r细胞中GCLC/GCLM的表达未见明显变化(图2)。3 e).此外,在Nrf2敲低条件下,SAS细胞ME1和GCLC/GCLM的表达没有明显变化(图2)。3 f).自TP53OSCC中最常见的突变基因(约70-80%)是什么30.,我们对HSC-2-WT和HSC-2-R细胞进行了进一步的体外实验。
一个,D糖酵解压力测试使用Seahorse XF24分析仪进行。一个用葡萄糖和2-脱氧葡萄糖(2-DG)处理前后的HSC-2-WT细胞和HSC-2-R细胞测定耗氧率(OCR)和细胞外酸化率(ECAR)。转染48 h后接种HSC-2-WT和HSC-2-R细胞,进行糖酵解应激试验。D糖酵解应激试验采用SAS-WT细胞和SAS-R细胞,方法与实验相同一个.B,C,E,F采用实时定量聚合酶链式反应(RT-qPCR)检测苹果酶1 (ME1)和谷氨酸-半胱氨酸连接酶催化亚基(GCLC)/谷氨酸-半胱氨酸连接酶修饰亚基(GCLM)的mRNA水平。结果以三个独立实验的平均值±标准差表示。B,E正常情况下OSCC和CRRR细胞ME1和GCLC/GCLM mRNA水平。C,F转染si/Negative或si/Nrf2的OSCC细胞和CRR细胞ME1和GCLC/GCLM mRNA水平。转染48 h后提取总RNA, RT-qPCR检测Nrf2 mRNA表达情况。G- - - - - -我采用GSSG/GSH定量法检测nrf2介导的抗氧化能力。GHSC-2-WT和HSC-2-R细胞暴露于10gy辐射24小时后谷胱甘肽的产生。转染si/Negative或si/Nrf2 48 h后HSC-2-WT和HSC-2-R细胞中GSH的产生。H照射24小时后,用细胞ROS/超氧化物检测试剂盒检测细胞中的ROS/超氧化物水平。我照射后24小时,检测转染si/Negative或si/Nrf2细胞的ROS/超氧化物水平。ROS/超氧化物检测方案基于两种荧光染料:用于检测总ROS的氧化应激检测试剂(Ex/Em 490/525 nm)和用于检测总ROS的超氧化物检测试剂(Ex/Em 550/620 nm)。*p< 0.05和**p< 0.01。
Nrf2对HSC-2-R细胞抗氧化能力的影响
我们研究了Nrf2在HSC-2-R细胞中是否通过谷胱甘肽调节氧化应激。首先,我们用GSSG/GSH定量测定了抗氧化能力。正常情况下和氧化应激下,HSC-2-R细胞GSH水平显著升高。同时,Nrf2抑制HSC-2-WT和HSC-2-R细胞中GSH水平显著降低(图2)。3 g).类似地,暴露于10 Gy辐射后,HSC-2-R细胞的ROS/超氧化物水平降低(图2- r)。3 h).此外,siRNA抑制Nrf2后,HSC-2-WT和HSC-2-R细胞的ROS/超氧化物水平升高(图2)。3我).这些结果表明,在激活Nrf2下,HSC-2-WT和HSC-2-R细胞通过谷胱甘肽清除ROS。
p-Nrf2在OSCC患者肿瘤中表达的临床意义
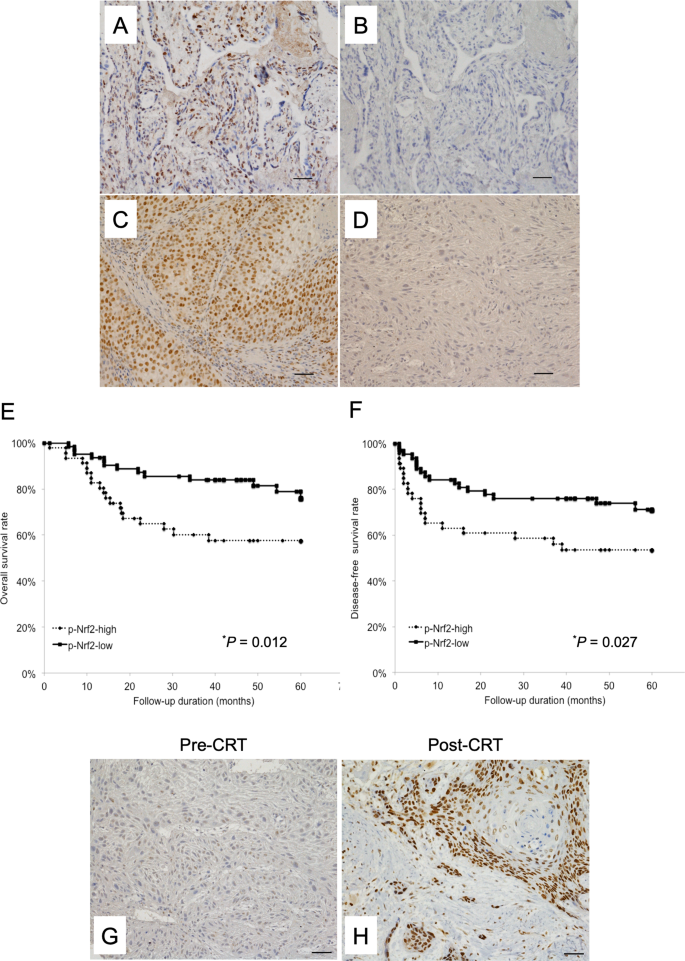
为了进一步确定功能性Nrf2在OSCC组织中的特殊作用,我们通过免疫组织化学染色检测了110例OSCC患者活检标本中p-Nrf2的表达。代表性结果如图所示。4模拟.在癌细胞核中观察到不同程度的p-Nrf2免疫反应。表中总结了研究人群的临床病理特征1.根据资料和方法中p-Nrf2的表达,将患者分为p-Nrf2-高组和p-Nrf2-低组。术前CRT病理反应较差的患者p-Nrf2阳性的频率明显较高(p= 0.010,表1).相反,根据p-Nrf2状态,几种临床病理特征无明显差异。p- nrf2高肿瘤患者的5年OS率明显低于p- nrf2低肿瘤患者(p= 0.018,图4 e).此外,在OSCC患者中,p-Nrf2阳性表达与较差的5年DFS发生率相关(p= 0.039,图4 f).此外,尽管CRT前p-Nrf2高的肿瘤比例为41.8%,但术前CRT后几乎所有剩余OSCC细胞都表现出强烈的Nrf2表达(图2)。4 g H).使用Cox比例风险回归模型对OS和DFS进行多因素分析,pn分期、术前CRT的病理反应和p-Nrf2表达是重要的预后因素(表2)2).
一个- - - - - -Dp-Nrf2免疫组化染色代表性图像根据其表达(原始放大,×200)。使用p-Nrf2 (Ser40)特异性抗体对组织进行免疫组化染色。一个人正常胎盘组织(阳性对照)。B人正常胎盘组织(阴性对照)。C显示p-Nrf2高强度染色的患者。Dp-Nrf2低强度染色1例。Bar, 50µm。E,F110例OSCC患者基于p-Nrf2表达的Kaplan-Meier曲线。OSCC患者根据p-Nrf2表达状态分为两组(p-Nrf2-低和p-Nrf2-高)。E总体生存率。F无病生存。*p< 0.05。G,H用免疫组织化学方法对OSCC组织样本进行p-Nrf2染色。G在放化疗(CRT)前获得的活检样本中没有p-Nrf2的表达。H对CRT耐药的细胞在原发病变中表达p-Nrf2。原始放大倍数,×200;Bar, 50µm。
讨论
Kuwahara等建立CRR细胞,了解辐射抵抗机制18.本研究使用新建立的HSC-2-R细胞系的研究结果支持了之前的研究,表明CRR细胞应被认为是阐明癌细胞辐射抵抗机制的合适研究资源。据我们所知,还没有其他的报道使用CRR细胞确定了OSCC放射抗性的分子机制。与以往研究OSCC辐射抗性的研究不同,这是第一次使用两个CRR细胞系来阐明OSCC辐射抗性的机制。
在本研究中,Nrf2及其激活形式p-Nrf2在CRR克隆中均过表达。但Nrf2 mRNA的表达变化不一致。这些结果可能部分归因于Nrf2的负反馈,特别是在SAS-R细胞中。我们之前报道过照射后OSCC中Nrf2的磷酸化依赖于Keap1/Nrf2系统,可能受IL-6-STAT3通路调控10.因此,在两种CRR细胞系中都观察到STAT3磷酸化水平的升高。此外,我们还发现Nrf2的正向调控因子Keap1能够磷酸化p6231,32在CRR细胞中上调。这些结果表明,STAT3通路激活后Nrf2的稳定(这是p-Nrf2核易位所必需的)在CRR细胞中Nrf2和p-Nrf2表达的升高中起作用。
Nrf2是防御性抗氧化反应机制的关键组成部分,保护正常细胞免受破坏性氧化条件的影响4,33.然而,越来越多的证据表明Nrf2及其下游靶基因在许多类型的人类癌症中过表达34它可能在癌症的发展和进展中起着重要作用8,34,35.我们同样观察到,与正常和发育不良组织相比,OSCC肿瘤中p-Nrf2的核定位增加(这表明其激活)。S3).此外,我们Nrf2在CRR细胞中的表达和激活高于亲本OSCC细胞。此外,抑制Nrf2可使OSCC和CRR细胞对辐射敏感。这些结果表明,OSCC细胞中的恶性表型(包括放射抗性)可以由Nrf2抗氧化途径调控,有证据表明Nrf2介导的抗氧化在恶性肿瘤的发生和进展中起着重要作用。
最近,我们证明了当ROS生成被Nrf2抗氧化系统抑制时,OSCC细胞表现出降低的辐射敏感性10.增强的nrf2介导的抗氧化反应清除癌细胞中的ROS,使这些细胞逃脱放疗的破坏性影响1,3.,36,37.事实上,Nrf2是编码多种细胞保护酶的基因的关键转录调节因子,以应对氧化应激1.在本研究中,我们阐明了Nrf2在抗辐射HSC-2-R细胞中控制ME1和GCLC/GCLM的表达,并调节抗氧化能力,从而抑制谷胱甘肽水平。通过增强谷胱甘肽水平来清除ROS的能力赋予了癌细胞的放射抗性38,39.此外,Nrf2的核积累使其能够促进代谢活动,包括葡萄糖代谢14.此外,Nakashima等人报道ME1表达与人OSCC的糖酵解有关40.因此,代谢重编程导致糖酵解和谷氨酰胺代谢的激活可能通过增强nrf2介导的抗氧化参与抑制ROS生成而与辐射抵抗有关。
在这项研究中,Nrf2获得了许多值得注意的发现。在SAS-WT和SAS-R细胞中,与HSC-2-WT和HSC-2-R细胞相比,糖酵解代谢未观察到明显的nrf2依赖性变化。在最近的一项研究中,Harami等人报道了p53表达突变的肿瘤通常与糖酵解酶的上调有关41.此外,据报道,无功能突变体TP53促进葡萄糖饥饿下丙酮酸的摄取,从而在恶性黑素瘤中保护癌细胞免受氧化应激42.相反,Faraonio等人报道p53激活抑制nrf2依赖的抗氧化应激反应43.正如已经报道的,SAS在TP53但没有丧失功能28,29,44.综上所述,本研究结果提示不同状态的nrf2依赖性代谢变化存在差异TP53SAS细胞与HSC-2细胞之间的突变27,29.然而,p53和Nrf2在OSCC放射抵抗中的作用还有待进一步研究。
癌细胞核Nrf2的强表达也与较差的临床特征相关45,46,47,48.值得注意的是,Kawasaki等人报道,核Nrf2表达与食管鳞状细胞癌患者对CRT的不良反应显著相关45.我们的数据表明,p-Nrf2有助于OSCC细胞对化疗和/或放疗的耐药性。由于尚无研究(据我们所知)研究了术前接受5- fu为基础的CRT的OSCC患者Nrf2表达与预后之间的关系,我们的研究首次证明了高p-Nrf2表达与OSCC患者对CRT的不良反应和较短的DFS和OS显著相关。此外,正如在其他恶性肿瘤中观察到的那样,我们的数据表明,p-Nrf2表达是OSCC患者的独立预后因素。此外,术前CRT显著增加了Nrf2强表达细胞的百分比。这些数据表明Nrf2抗氧化途径有助于临床上OSCC的内在和获得性放化疗耐药。
必须指出一些研究的局限性。一个主要的限制是使用一个无功能突变的CRR克隆TP53在体内小鼠模型中,关于Nrf2抑制下的放射敏感性和生存率的数据很少。为了解决这一限制,我们目前正在建立另一个CRR克隆。进一步的研究必须在体内模型中证实Nrf2抑制下联合治疗对多种抗辐射OSCC细胞的影响。
总之,我们首次证明了Nrf2通过抗氧化能力控制OSCC细胞的辐射抵抗,并伴随着代谢调节,p-Nrf2表达与CRT的结果密切相关,并与术前CRT后OSCC患者的预后相关。我们的数据表明,靶向Nrf2抗氧化途径来克服放化疗耐药将增强难治性OSCC患者对治疗的反应,从而提高生存率。
数据可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。
参考文献
周松,叶玮,邵强,张敏,梁娟。Nrf2是人类癌症放射耐药的潜在治疗靶点。暴击血血88, 706-715 (2013)
王丽娟,王丽娟。中国癌症统计杂志,2012。CA癌症J临床62, 10-29 (2012)
梅迪恩,赵rw,罗波,T Kalisky, Dorie MJ, Kulp AN等。肿瘤干细胞中活性氧水平与放射抗性的关系。自然458, 780-783 (2009)
田口K,本桥H,山本M. Keap1-Nrf2通路在应激反应和癌症进化中的分子机制。基因的细胞16、123-140 (2011)
Solis LM, Behrens C, Dong W, Suraokar M, Ozburn NC, Moran CA等。Nrf2和Keap1在非小细胞肺癌中的异常及其与临床病理特征的关系临床癌症研究16, 3743-3753 (2010)
Stacy DR, Ely K, Massion PP, Yarbrough WG, Hallahan DE, Sekhar KR, Freeman ML.核因子E2 p45相关因子2 (NRF2)在头颈部鳞状细胞癌中的表达升高。头颈28, 813-818 (2006)
Sukumari-Ramesh S, Prasad N, Alleyne CH, Vender JR, Dhandapani KM。Nrf2过表达可减弱carmustin诱导的U87MG人脑胶质瘤细胞的细胞毒性。BMC癌症15, 118 (2015)
徐太平,齐俊涛,孔恩。Nrf2是MCF7乳腺癌细胞在缺氧条件下耐药的关键。Oncotarget7, 14659-14672 (2016)
黄海昌,阮涛,Pickett CB。蛋白激酶C对Nrf2 ser40位点的磷酸化调控抗氧化反应元件介导的转录。生物化学277, 42769-42774 (2002)
松冈Y,中山H,吉田R,广苏A,永田M,田中T等。IL-6在口腔鳞状细胞癌中通过nrf2 -抗氧化途径抑制氧化应激来控制对辐射的抵抗。Br J癌115, 1234-1244 (2016)
DeBerardinis RJ, Lum JJ, Hatzivassiliou G, Thompson CB。癌症生物学:代谢重编程为细胞生长和增殖提供燃料。细胞金属底座7, 11-20 (2008)
肿瘤细胞代谢:癌症的阿基里斯之踵。癌症细胞13, 472-482 (2008)
童X,赵峰,汤普森CB。癌细胞中从头核苷酸生物合成的分子决定因素。Genet开发总监19, 32-37 (2009)
三石Y,田口K,河谷y,柴田T, Nukiwa T, Aburatani H等。Nrf2在代谢重编程中将葡萄糖和谷氨酰胺重定向到合成代谢途径。癌症细胞22, 66-79 (2012)
张伟伟,张伟伟,朱国栋。2-脱氧葡萄糖作为化疗药物的评价:细胞死亡机制。Br J癌87, 805-812 (2002)
杜德华,王志强,王志强,王志强,等。2-脱氧-d -葡萄糖诱导的人肿瘤细胞系能量学和辐射反应的异质性。国际放射肿瘤生物物理50, 1051-1061 (2001)
亲爱的JL, Qureshi U, Begent RH, Pedley RB。放射免疫治疗联合抗缺氧治疗2-脱氧-d -葡萄糖导致疗效降低。临床癌症研究13, 1903-1910 (2007)
库原勇,李林,巴巴涛,中川勇,志村勇,山本勇等。临床相关抗辐射细胞能有效修复x射线诱导的DNA双链断裂。癌症科学One hundred., 747-752 (2009)
永田M,中山H,田中T,吉田R,吉竹Y,福马D等。cIAP2过表达导致口腔鳞状细胞癌5-FU耐药和预后不良。Br J癌105, 1322-1330 (2011)
吉田R,中山H,永田M,博苏A,田中T,河原K等。核stemin的过表达有助于口腔鳞状细胞癌的恶性表型和不良预后。Br J癌111, 2308-2315 (2014)
日本口腔颌面外科学会,2009年口腔癌治疗循证临床实践指南。摘要S. CD-ROM,第1版,第1版:金原株式会社;2009
Kitamura H & Motohashi H. NRF2对癌细胞的依赖性。癌症科学109, 900-911 (2018)
吉田R,永田M,中山H,新立喜多K,哈桑W,田中T等。Notch1在口腔鳞状细胞癌中的病理意义。实验室投资93, 1068-1081 (2013)
下佐藤,李志强,李志强。肿瘤放化疗疗效的组织学评价。Jpn J clinin Oncol1, 19-35 (1971)
库原Y,森M,大川T,志村T,大竹Y,森S等。改良的高密度生存试验是预测分级辐射照射有效性的有用工具。J辐射分辨率51, 297-302 (2010)
Sharma PK, Varshney R. 2-脱氧-d -葡萄糖和6-氨基烟酰胺介导的Nrf2下调调控通过gsh介导的防御作用导致恶性细胞的放射增敏。自由基储存46, 1446-1457 (2012)
Ichwan SJ, Yamada S, Sumrejkanchanakij P, Ibrahim-Auerkari E, Eto K,池田MA。p53丝氨酸46磷酸化缺陷有助于口腔鳞癌细胞获得p53耐药。致癌基因25, 1216-1224 (2006)
Yasumoto J, Kirita T, Takahashi A, Ohnishi K, Imai Y, Yuki K, Ohnishi T.人舌鳞癌细胞携带野生型或突变型p53后高温后凋亡相关基因的表达。癌症列托人204, 41-51 (2004)
Yoshida R, Fujimoto T, Kudoh S, Nagata M, Nakayama H, Shinohara M, Ito T.核stemin影响口腔鳞状细胞癌细胞的增殖而不影响分化。癌症科学102,1418-1423 (2011)
林德曼A,高桥H,帕特尔AA,奥斯曼AA,迈尔斯JN。针对OSCC中TP53突变的DNA损伤反应。J登特保留区97, 635-644 (2018)
一村Y, Waguri S, Sou YS, Kageyama S,长谷川J,石村R等。p62的磷酸化在选择性自噬过程中激活Keap1-Nrf2通路。摩尔细胞51, 618-631 (2013)
小松M,黑川H, Waguri S,田口K,小林A,一村Y等。选择性自噬底物p62通过失活Keap1激活应激反应转录因子Nrf2。Nat细胞生物学12, 213-223 (2010)
铃木文,山本。Keap1-Nrf2体系的分子基础。自由基生物医学88, 93-100 (2015)
张丹丹。Nrf2- keap1 - are信号通路:Nrf2在癌症中的调控及双重功能。抗氧化还原信号13, 1623-1626 (2010)
Furfaro AL, Traverso N, Domenicotti C, Piras S, Moretta L, Marinari UM等。Nrf2/HO-1轴在癌细胞生长和耐药中的作用oxidmedcell longv2016, 1958174 (2016)
莱利。生物学中的自由基:氧化应激和电离辐射的影响。辐射生物学65,27 - 33 (1994)
Singh A, Bodas M, Wakabayashi N, Bunz F, Biswal S. Nrf2功能在非小细胞肺癌细胞中的增益赋予辐射抗性。抗氧化还原信号13, 1627-1637 (2010)
长野O,冈崎S, Saya H.氧化还原调控干细胞样癌细胞的CD44变异亚型。致癌基因32, 5191-5198 (2013)
Kagami T, Yamade M, Suzuki T, Uotani T, Tani S, Hamaya Y等。CD44v8-10在癌干细胞样细胞中的高表达水平与放化疗治疗的食管鳞癌患者预后不良有关。Oncotarget9, 34876-34888 (2018)
中岛C,山本K,藤原谷R,罗Y,松岛S,藤井K等。在人口腔鳞癌中,胞质苹果酶(ME1)的表达与疾病进展相关。癌症科学109, 2036-2045 (2018)
Harami-Papp H, Pongor LS, Munkácsy G, Horváth G, Nagy ÁM, Ambrus A等。乳腺癌中TP53突变影响能量代谢并增加糖酵解。Oncotarget7, 67183-67195 (2016)
Chavez-Perez VA, Strasberg-Rieber M, Rieber M.突变p53 (R175H)人黑色素瘤细胞代谢利用外源性丙酮酸促进葡萄糖消耗下的生存。癌症生物学12, 647-656 (2011)
Faraonio R, Vergara P, Di Marzo D, Pierantoni MG, Napolitano M, Russo T, Cimino F. p53抑制nrf2依赖的抗氧化反应基因转录。生物化学281, 39776-39784 (2006)
安口A,川久保玲-安口T,盛冈M,叶川M,西奈川T,小野K等。miR203a-3p在口腔鳞癌细胞中XVII型胶原表达的调控J物化学166, 163-173 (2019)
川崎Y,奥村H,内户Y,喜多Y,佐佐木K,大木T等。Nrf2有助于预测放化疗对食管鳞状细胞癌的疗效。安外科医生21, 2347-2352 (2014)
郑华,农智,卢刚。核因子e2相关因子2表达与胃癌进展的相关性。医学科学与临床研究21, 2893-2899 (2015)
小野寺Y,元桥H,高木K,三木Y,柴原Y,渡边M等。NRF2在人乳腺癌患者中的免疫定位作为预后因素Endocr Relat Cancer21, 241-252 (2014)
Soini Y, Eskelinen M, Juvonen P, Kärjä V, Haapasaari KM, Saarela A, Karihtala P.核Nrf2表达与胰腺腺癌生存不良有关。Pathol Res practice210, 35-39(2014)。
确认
我们要感谢Enago (www.enago.jp)进行英文编辑检讨。
资金
这项工作得到了日本科学促进协会(JSPS) KAKENHI的支持,资助号为JP19K19237, JP21K17145 (YM)和JP21K10048 (RY)。
作者信息
作者及隶属关系
贡献
YM, RY和HN (Hideki Nakayama)执行研究概念和设计;YM、KK、JS、HA、HN、NT、MH进行了研究方法的开发和论文的撰写、评审和修改;YM, MN, AH, RT, RM, HN (Hideki Nakayama)提供了数据的获取,分析和解释,以及统计分析;YK和MF提供了技术和物资支持。所有作者均已阅读并通过最终论文。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
伦理批准并同意参与
在涉及人类参与者的研究中执行的所有程序都符合机构和/或国家研究委员会的道德标准以及1964年赫尔辛基宣言及其后来的修正案或可比的道德标准。研究中所有个体参与者都获得了知情同意。动物实验由熊本大学动物实验伦理委员会(C28-069)批准,并按照实验室动物实验指南进行。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
松冈,Y,吉田,R,河原,K。et al。抗氧化应激调节因子Nrf2增强口腔鳞状细胞癌的放射抗性,并伴有代谢调节。实验室投资102, 896-907(2022)。https://doi.org/10.1038/s41374-022-00776-w
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41374-022-00776-w