摘要gydF4y2Ba
肺纤维化是各种疾病的结果,没有令人满意的治疗方法。外泌体介导的长链非编码rna (lncrna)转移与肺部疾病的病理过程有关。在此,我们研究了肺泡上皮细胞(AEC)源性外泌体转移的HOTAIRM1对间质性肺纤维化(IPF)的治疗潜力及其潜在的分子机制。采用下一代基于测序的基因表达谱鉴定与IPF相关的lncrna。外泌体是从缺氧诱导的aec中分离出来的(aec -外泌体),并在使用前进行鉴定。在博莱霉素诱导的IPF小鼠模型和分离的外泌体中检测HOTAIRM1的表达,并分析HOTAIRM1下游的miRNA。IPF小鼠肺组织和AEC外泌体中HOTAIRM1表达增加。aec -外泌体传递的HOTAIRM1促进肺成纤维细胞(LFs)的增殖和转分化。在机制上,HOTAIRM1竞争性结合miR-30d-3p并招募YY1上调HSF1的表达。此外,miR-30d-3p通过结合HSF1的3 ' -UTR靶向HSF1并降低其表达。 In vivo assays confirmed the promoting effect of exosomes-HOTAIRM1 on extracellular matrix remodeling by regulating the miR-30d-3p/HSF1/YY1 axis. Overall, HOTAIRM1 loaded by AEC exosomes can accelerate IPF by disrupting miR-30d-3p-mediated inhibition of HSF1 and inducing recruitment of HSF1 by YY1. These results highlight a promising strategy to overcome IPF.
简介gydF4y2Ba
间质性肺疾病是一系列弥漫性肺实质疾病,可增加发病率和死亡率[gydF4y2Ba1gydF4y2Ba].大多数类型的间质性肺病可发展为广泛纤维化[gydF4y2Ba2gydF4y2Ba].肺纤维化是由伤口愈合异常引起的,其结果是慢性炎症反应和细胞外基质成分过度积累[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].本病有多种病因,包括遗传缺陷、自身免疫性疾病和环境暴露,一旦发展,它是不可逆的,而且通常是进行性的[gydF4y2Ba5gydF4y2Ba].因此,揭示间质性肺纤维化(IPF)发病机制潜在的早期检测分子标记对降低其发生频率至关重要。gydF4y2Ba
外泌体是具有单层膜的小囊泡(直径30-200 nm),富含蛋白质、脂质、核酸等,并呈现细胞样拓扑[gydF4y2Ba6gydF4y2Ba].外泌体长链非编码rna (Exosomal long noncoding RNAs, lncRNAs)在肺纤维化等肺部疾病的诊断、预后和治疗中具有重要的临床应用价值[gydF4y2Ba7gydF4y2Ba].LncRNAs是一种长度超过200个核苷酸的非编码RNA,在纤维化肺组织中表达明显改变,是抑制肺纤维化发展的潜在分子靶点[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].lncRNA HOXA转录反义RNA髓样特异性1 (HOTAIRM1)在非小细胞肺癌(NSCLC)中高度表达,由于其与预后不良和临床病理分级相关,可能是一种有前途的诊断和预后生物标志物[gydF4y2Ba10gydF4y2Ba].然而,它在指规数中的潜在作用仍然难以捉摸。本研究中使用的LncBase和miRWalk数据库提供了HOTAIRM1和microRNA (miR)-30d-3p之间结合亲和力的信息。镉(一种已知的人类肺癌致癌物)对人类肺上皮细胞中miR-30的抑制可导致许多肺部疾病,如慢性阻塞性肺疾病和纤维化[gydF4y2Ba11gydF4y2Ba].已发表的数据表明,miR-30a的过表达取消了胰腺癌细胞中阴阳1 (YY1)的促自噬作用[gydF4y2Ba12gydF4y2Ba].YY1的表达增强可促进原代肺泡上皮细胞(AECs)的纤维化前表型,从而加速肺纤维化的进展[gydF4y2Ba13gydF4y2Ba].YY1已被证明在乳腺癌中直接激活HSF1的转录[gydF4y2Ba14gydF4y2Ba].同时,HSF1下调可抑制人胚胎肺成纤维细胞的增殖能力和成纤维性转化,从而防止IPF [gydF4y2Ba15gydF4y2Ba].因此,我们设计了这项研究,以检查缺氧诱导的aec衍生外泌体(aec -外泌体)穿梭的HOTAIRM1在IPF进展中的作用及其与miR-30d-3p、YY1和HSF1的关系。gydF4y2Ba
材料与方法gydF4y2Ba
道德声明gydF4y2Ba
本研究经四川省人民医院动物伦理委员会(2019047 A)批准,并符合美国国立卫生研究院《实验动物护理与使用指南》。为尽量减少动物的痛苦,政府作出了广泛的努力。gydF4y2Ba
基于下一代测序(NGS)的基因表达分析gydF4y2Ba
RNA-Seq数据集GSE124685的FPKM数据从Gene Expression Omnibus (GEO)数据库中下载,该数据库包括35个正常样本和49个IPF样本。使用R语言“limma”包将矩阵中的重复探针替换为平均值后,利用Wilcoxon法鉴定|logFC | > 2和IPF中的差异表达基因gydF4y2BapgydF4y2Ba值< 0.05为阈值。rna -蛋白质相互作用分析采用RNAInter数据库。应用GEPIA数据库分析GTEx肺组织中基因表达的相关性。使用LncBase和miRWalk数据库预测lncrna和mrna结合的mirna。gydF4y2Ba
IPF小鼠模型构建gydF4y2Ba
雄性C57BL/6小鼠(体重23-25 g, 6 - 8周龄;中国科学院上海药物研究所实验动物中心)饲喂细粒,给予gydF4y2Ba随意gydF4y2Ba在22±1°C的条件下,使用12小时的明暗循环。小鼠驯化一周后,随机分为正常组(gydF4y2BangydF4y2Ba= 6)和一个IPF组(gydF4y2BangydF4y2Ba= 48)。IPF小鼠用戊巴比妥钠100 mg/kg麻醉后,气管内注射博莱霉素(50 mg/kg /只,50 μL生理盐水;浙江海正药业股份有限公司(台州)。2周后采用阻力和顺应性容积描记仪(玉炎仪器,中国)测定肺功能。肺顺应性明显降低,肺阻力增加,说明IPF模型构建成功。正常小鼠气管内注射等量生理盐水。gydF4y2Ba
然后将48只IPF小鼠随机用lv-oe-NC(注射携带oe-NC的慢病毒)、lv-oe-HOTAIRM1(注射携带oe-HOTAIRM1的慢病毒)、lv-sh-NC(注射携带sh-NC的慢病毒)、lv-sh-HOTAIRM1(注射携带sh-HOTAIRM1的慢病毒)、外泌体-oe-NC + sh-NC(用携带oe-NC转染的aec的外泌体处理并注射携带sh-NC的慢病毒)处理,外泌体-oe- hotairm1 + sh-NC(用oe- hotairm1转染的aec的外泌体处理,并注射携带sh-NC的慢病毒)和外泌体-oe- hotairm1 + sh-HSF1(用oe- hotairm1转染的aec的外泌体处理,并注射携带sh-HSF1的慢病毒)。慢病毒颗粒滴度为1 × 10gydF4y2Ba9gydF4y2BaTU/mL(所有慢病毒颗粒均来自Genechem。,中国上海)。在博莱霉素诱导第5天及之后,将慢病毒注入小鼠体内gydF4y2Ba通过gydF4y2Ba尾静脉注射200 μL生理盐水或外泌体gydF4y2Ba通过gydF4y2Ba尾静脉每4天一次。三周后,从安乐死后的小鼠身上采集肺组织,用4%的多聚甲醛固定,并用石蜡包埋用于后续实验。一部分肺组织被储存在液氮中以备以后使用。gydF4y2Ba
苏木精-伊红染色gydF4y2Ba
固定后,使用自动切片机(RM2265,北京长恒融创科技有限公司,北京,中国)对石蜡包埋肺组织进行切片。脱蜡和复水后,切片按照HE染色试剂盒(南京盛航生物技术有限公司,中国南京,BC-DL-001-100 mL)的规格进行染色,然后在光学显微镜下观察(Eclipse E200,上海奋业光电设备有限公司,中国上海)。由两名病理学家采用双盲方式评估肺组织水肿、炎症细胞浸润、出血和细胞坏死。gydF4y2Ba
马松三色染色gydF4y2Ba
切片前处理与HE染色相同。按照Masson三色染色试剂盒(Solarbio, Beijing, China)的指示对切片进行染色。染色结果显示胶原纤维呈蓝色。用光学显微镜(Eclipse E200, Fenye光电设备)进行可视化,用ImageJ软件进行定量。gydF4y2Ba
免疫组织化学gydF4y2Ba
首先对4 μm厚的石蜡切片进行脱蜡、水合和清洗,然后进行内源性过氧化物酶中和和抗原提取。接下来,利用山羊血清(C-0005,上海昊然生物技术有限公司,中国上海)在37℃下阻断过氧化酶的活性1小时,并在4℃下用抗α-SMA (1:50, ab5694, Abcam,英国)、I型胶原蛋白(1:50,ab270993, Abcam)、纤连蛋白(1:100,PA5-29578,美国瑟默飞世尔科学公司,Waltham, MA,美国)和Vimentin (1:200, ab92547, Abcam)的兔一级抗体检测过夜。次日用抗- igg (ab172730, Abcam)作为二抗重新检测。PBS洗涤后,切片用两步测定试剂盒(PV-9000,北京诺布瑞德科技有限公司,中国北京)处理,DAB试剂盒(C520017,上海生工生物科技有限公司,中国上海),苏木精反染(PT001,上海博果生物科技有限公司,中国上海),65°C干燥并密封。最后,在直立显微镜(BX63,福建创普科技有限公司,中国福建)下,从每个切片中随机选择5个高倍场进行显微图像拍摄,并使用ImageJ软件进行量化。gydF4y2Ba
羟脯氨酸测定gydF4y2Ba
新鲜肺组织在100℃下干燥至少24 h,在缺氧条件下用0.5 μM醋酸和0.1 mg/mL胃蛋白酶水解,密封于真空瓶中,4℃再次水解。第二天使用中国南京建成生物工程研究所提供的羟脯氨酸检测试剂盒(A030-1-1)评估肺组织中羟脯氨酸水平。gydF4y2Ba
细胞培养gydF4y2Ba
小鼠AEC系MLE12 (C2008,英湾生物科技,上海,中国)在含5% CO的培养箱中,用Roswell Park Memorial Institute (RPMI) 1640培养基(11875101,赛默飞世尔科技)添加10%胎牛血清(FBS)、50u /mL青霉素和50u /mL链霉素培养gydF4y2Ba2gydF4y2Ba37°C。对于低氧暴露,MLE12细胞系在含1% O的无血清培养基中孵育4小时gydF4y2Ba2gydF4y2Ba, 95% ngydF4y2Ba2gydF4y2Ba,及5% COgydF4y2Ba2.gydF4y2Ba然后,细胞在常氧(21% OgydF4y2Ba2gydF4y2Ba)环境。gydF4y2Ba
小鼠原代肺成纤维细胞(LFs)培养:将6- 8周龄C57BL/6小鼠肺组织切成1毫米大小gydF4y2Ba3.gydF4y2Ba碎片。将切片浸泡在含有30 mg胶原酶IV、1 g FBS、96 mL Hank’s缓冲液和4 mL 0.25%胰蛋白酶的消化缓冲液(Sigma)中。1 h后,应变组织悬浮液在300 g、4°C下离心5 min。将颗粒在DMEM (D0819,上海西格玛-奥尔德里奇贸易有限公司,中国上海)中重新悬浮,然后在500 g和4°C下离心5分钟,在300 g和4°C下离心5分钟。收获的细胞经波形蛋白免疫组化染色鉴定为LFs,最后在37℃含5% CO的培养箱中培养gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
外泌体的分离与鉴定gydF4y2Ba
在10cm培养皿中,在常氧和缺氧条件下培养的AECs在无外泌体血清培养基中培养(离心12万倍)gydF4y2BaggydF4y2Ba4℃,14 h)保温72 h。当细胞达到90-100%融合时,在3000 ×g和4°C下离心10分钟,去除细胞。随后再次离心(10000 ×gydF4y2BaggydF4y2Ba)在4°C下进行30分钟,以去除死细胞和碎片。收集上清液,通过0.22 μm过滤器(SLGV033RB, Solarbio)过滤去除较小的细胞碎片,然后在10万×下进行超离心gydF4y2BaggydF4y2BaOptima L-80XP(上海爱研生物技术有限公司,中国上海),4°C 2小时。去除上清后,将颗粒悬浮液(在70ml冰冷PBS中制备)在100,000 ×下进行超离心gydF4y2BaggydF4y2Ba4℃保温2小时。小心地丢弃PBS,使用试剂盒纯化颗粒并在PBS中重悬。之后,在相同条件下进行第二次超离心,并将沉淀物低温保存(- 80°C)以备以后使用或立即使用。gydF4y2Ba
利用日立H-7650透射电子显微镜(TEM;日立化学,东京,日本)。使用NanoSight纳米颗粒跟踪分析仪(ZetaView_Particle Metrix, DKSH, China)测量外泌体的尺寸分布。Western blot检测外泌体表面标志物(CD63 [1:3000, rabbit, ab134045, Abcam], TSG101 [1:1000, rabbit, ab125011, Abcam]和GM130 [1:500, rabbit, PA1-077,赛默飞雪科学])的表达。gydF4y2Ba
LFs吸收外泌体gydF4y2Ba
瞬时转染cy3标记的HOTAIRM1 (Cy3-HOTAIRM1, 1.2 × 10gydF4y2Ba6gydF4y2Ba)分别放置于共培养室的下室,1 × 10gydF4y2Ba6gydF4y2BaLFs被添加到上腔。共培养24 h后,荧光显微镜下观察LFs中Cy3荧光。aec - hotairm1 - cy3外泌体与LFs在37°C下孵育12 h。细胞用4%多聚甲醛固定,PBS洗涤,DAPI染色(P36931,赛默飞世尔科学公司)。利用共聚焦显微镜(蔡司LSM 800,北京欧普顿光学技术有限公司,中国北京)观察LFs对标记ev的吸收。每个样本随机抓取5张图像。gydF4y2Ba
细胞治疗gydF4y2Ba
用0.25%胰蛋白酶分离对数生长期的LFs,接种于6孔板,1 × 10gydF4y2Ba5gydF4y2Ba细胞/孔,培养24 h。当达到60-75%合流时,将细胞暴露于10 μM MG132(蛋白酶抑制剂,M7449, Sigma-Aldrich)中,然后使用Lipofectamine 2000试剂(11668019,Thermo Fisher Scientific),用oe-NC、oe-HOTAIRM1、sh-HOTAIRM1 + mimic NC、oe-HOTAIRM1 + mimic NC、oe-HOTAIRM1 + miR-30d-3p mimic、oe-NC + sh-NC、oe-HOTAIRM1 + sh-NC、oe-HOTAIRM1 + sh-YY1、miR-30d-3p mimic、miR-30d-3p inhibitor、oe-YY1、sh-YY1#1、sh-HSF1#1、sh-HSF1#2、mimic NC + oe-NC, miR-30d-3p mimic + oe-NC, miR-30d-3p mimic + oe-HSF1, oe-YY1 + sh-NC和oe-YY1 + sh-HSF1。这些质粒购自上海基因化学有限公司(中国上海)并由其合成。6小时后更换培养基继续培养。48 h后,细胞用于后续实验。gydF4y2Ba
RNA分离和定量gydF4y2Ba
使用TRIzol试剂(10296010,赛默飞世尔科学公司)从细胞或组织中提取总RNA。使用NanoDrop™Lite分光光度计(ND-LITE, Thermo Fisher Scientific)测定总RNA的浓度和纯度。使用TaqMan™MicroRNA逆转录试剂盒(4366597,赛默飞世尔科技)、PrimeScript RT试剂盒(RR047A,武汉凯亚生物科技有限公司,中国湖北)和mirry - lna - mirna - pcr试剂盒(339306,未来生物科技,北京,中国)将总RNA逆转录为互补DNA (cDNA)。RT-qPCR采用Applied Biosystems QuantStudio系统(上海建菱信息技术有限公司,中国上海)。miRNA以U6为加载对照,其余基因以GAPDH为加载对照。引物由Sangon设计,序列见表gydF4y2BaS1gydF4y2Ba.采用相对定量(2gydF4y2Ba−ΔΔCtgydF4y2Ba)方法。gydF4y2Ba
Western blot分析gydF4y2Ba
利用含1%蛋白酶抑制剂的放射免疫沉淀法溶解缓冲液从组织或细胞中提取总蛋白,浓度由双吲哚酸试剂盒(A53226,赛默飞雪科学公司)测定。接下来,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,并转移到聚偏氟乙烯膜上。然后在室温下使用5%脱脂奶粉将膜阻断1小时,并在4℃下用兔抗α-SMA(1µg/mL, ab5694, Abcam)、I型胶原蛋白(1:1000,ab270993, Abcam)、纤连蛋白(1:1000,PA5-29578,赛默飞世尔科学)、PCNA(1µg/mL, PA5-32541,赛默飞世尔科学)和β-肌动蛋白(#8457,1:1000,细胞信号技术[CST], Beverly, MA,美国,作为一个对照)孵育过夜。第二天,加入二抗辣根过氧化物酶标记的山羊抗兔IgG (#7074, 1:2000, CST)孵育1小时。膜显影,用ImageJ 1.48软件定量条带强度。gydF4y2Ba
染色质免疫沉淀(ChIP)gydF4y2Ba
按照ChIP试剂盒的制造商说明书(P2078, Beyotime)进行ChIP检测。转染YY1的LFs用1%甲醛溶液固定10分钟产生dna -蛋白质交联,用1.1 mL甘氨酸孵育5分钟终止交联。样品在裂解缓冲液中裂解,超声处理得到200-1000 bp染色质片段。然后,取10µL上清液作为输入,用抗yy1抗体(2.5µg/10gydF4y2Ba6gydF4y2Ba细胞,PA5-29171,赛默飞世尔科学公司)或NC IgG (#7074, 1:2000, CST)在4°C过夜。免疫沉淀后,染色质在65°C下去交联4 h,纯化DNA, RT-qPCR检测。HSF1序列见表gydF4y2BaS1gydF4y2Ba.gydF4y2Ba
荧光原位杂交(FISH)gydF4y2Ba
cy3标记的HOTAIRM1探针和fitc标记的miR-30d-3p/YY1探针来自中国广州基因种子生物科技有限公司。在圆形覆盖物上培养初级LFs,然后在含0.5% Triton X-100的PBS中固定并脱水。将FISH探针稀释(1:50),变性,平衡,并添加到细胞中,在37°C孵育一夜。杂交后,用DAPI-Antifade标记细胞10 min,玻璃载玻片用橡胶胶粘剂密封,在黑暗中保存20 min以上。最后使用TCS SP8 X激光共聚焦显微镜系统(88211109,北京影像商贸有限公司,中国北京)进行定位观察。gydF4y2Ba
双荧光素酶报告法gydF4y2Ba
3ʹutr HOTAIRM1序列携带假定miR-30d-3p结合位点或变异的结合位点插入pGL3-basic向量(6107年,上海Jiran生物技术有限公司,上海,中国),与HOTAIRM1-3ʹ-UTR-wild类型(WT)(5ʹ-ACUGAA-3ʹ),HSF1-3ʹ-UTR-WT(5ʹ-ACUGAA-3ʹ),HOTAIRM1-3ʹ-UTR-mutant(傻瓜)(5ʹ-TGACTT-3ʹ)和HSF1-3ʹ-UTR-MUT(5ʹ-TGACTT-3ʹ)。HEK-293T细胞在24孔板中培养24 h。在达到50-60%合流时,使用上述报告质粒和mimic NC或miR-30d-3p mimic结合Lipofectamine 2000试剂对细胞进行操作。另外,10 ng pRL-TK Renilla荧光素酶作为对照。24 h后,采用双荧光素酶报告基因检测系统(深圳拓普生物科技有限公司,中国深圳)检测荧光素酶活性,用Renilla荧光素酶活性归一化。gydF4y2Ba
细胞计数试剂盒-8 (CCK-8)测定gydF4y2Ba
96孔板LFs (5 × 10gydF4y2Ba3.gydF4y2Ba细胞/孔)用10 μL/孔的CCK-8溶液(Beyotime)在37℃的加湿培养箱中孵育1 h,在450nm处用酶标仪记录光密度(OD)值(abx700005,奇微亿成科技股份有限公司,北京,中国)。gydF4y2Ba
免疫荧光gydF4y2Ba
LFs在4%的多聚甲醛中固定30分钟,在室温下渗透并堵塞。细胞与抗体孵育在4°C过夜。抗体包括α-SMA (#19245, 1:200, CST)、HSF1(兔,1:200,ab76076, Abcam)、I型胶原蛋白(ab260043, 1:200, Abcam)、纤连蛋白(ab2413, 1:200, Abcam)、Ki67(兔,1:100,ab15580, Abcam)和PCNA(兔,1:500,ab18197, Abcam)。清洗后,用Alexa Fluor培养细胞gydF4y2Ba®gydF4y2Ba555耦合山羊抗兔子(#60839,1:50,CST)在黑暗中。核染色DAPI (Roche Molecular Biochemicals, Basel, Switzerland)持续5分钟。最后在荧光显微镜下观察细胞(80i,上海恒浩仪器有限公司,中国上海),并使用ImagePro Plus软件进行荧光定量分析。gydF4y2Ba
统计分析gydF4y2Ba
所有数据均使用GraphPad Prism 8.0 (GraphPad Software, La Jolla, CA, USA)进行分析。实验分别进行三次。测量数据以均数±标准差表示。两组数据采用非配对比较gydF4y2Bat测试gydF4y2Ba.采用单因素方差分析(one-way analysis of variance, ANOVA)和Tukey多元比较检验对多组间差异进行统计学分析。使用双向方差分析或重复测量方差分析对每组内基于时间的测量进行统计分析,然后采用Tukey的事后检验进行多重比较。值为gydF4y2BapgydF4y2Ba< 0.05被认为是显著的。gydF4y2Ba
结果gydF4y2Ba
HOTAIRM1在IPF中高度表达,促进IPF进展gydF4y2Ba
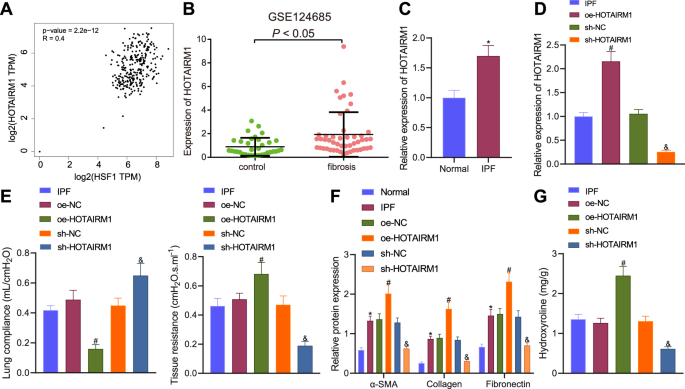
我们首先进行了GEPIA数据库分析,发现GTEx肺组织中HOTAIRM1的表达与HSF1的表达呈正相关,r值为+0.4(图4)。gydF4y2Ba1gydF4y2Ba).对GSE124685数据集的分析显示,IPF样本中的细胞比正常样本中产生更多的HOTAIRM1(图2)。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaGEPIA数据库中GTEx肺组织HOTAIRM1和HSF1表达的相关性gydF4y2BaBgydF4y2BaHOTAIRM1正常表达(gydF4y2BangydF4y2Ba= 35)及IPF样本(gydF4y2BangydF4y2Ba= 49)的GSE124685数据集。gydF4y2BaCgydF4y2BaRT-qPCR检测HOTAIRM1在正常(gydF4y2BangydF4y2Ba= 6)和IPF小鼠(gydF4y2BangydF4y2Ba= 6)。gydF4y2BaDgydF4y2BaRT-qPCR检测经oe-HOTAIRM1或sh-HOTAIRM1处理的IPF小鼠肺组织中HOTAIRM1的表达。gydF4y2BaEgydF4y2Ba使用oe-HOTAIRM1或sh-HOTAIRM1治疗的正常小鼠和IPF小鼠肺组织的肺顺应性和肺阻力。gydF4y2BaFgydF4y2BaWestern blot检测经oe-HOTAIRM1或sh-HOTAIRM1处理的IPF小鼠肺组织中α-SMA、I型胶原蛋白和纤连蛋白。gydF4y2BaGgydF4y2Ba用oe-HOTAIRM1或sh-HOTAIRM1治疗的IPF小鼠肺组织中羟脯氨酸的水平。gydF4y2BangydF4y2Ba每次治疗小鼠= 6。数据以均数±标准差表示。两组数据采用非配对分析gydF4y2Bat测试gydF4y2Ba多组间采用单因素方差分析,采用Tukey事后检验。*gydF4y2BapgydF4y2Ba与正常小鼠相比< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与e- nc处理的小鼠相比< 0.05。gydF4y2Ba&gydF4y2BapgydF4y2Ba与sh- nc处理的小鼠相比< 0.05。gydF4y2Ba
在所建立的IPF小鼠模型中,肺顺应性降低,肺阻力增强(补充图。gydF4y2Ba1gydF4y2Ba),说明IPF小鼠模型构建成功。RT-qPCR数据显示,与正常小鼠相比,IPF小鼠肺组织中的HOTAIRM1水平升高(图2)。gydF4y2Ba1 cgydF4y2Ba).因此,我们推测HOTAIRM1可能是影响IPF发生的关键lncRNA。gydF4y2Ba
为了验证,首先进行了功能增加和功能丧失测试,结果显示,携带eo -HOTAIRM1的慢病毒治疗上调了HOTAIRM1的表达,而携带sh-HOTAIRM1的慢病毒治疗降低了其在IPF小鼠肺组织中的表达(图。gydF4y2Ba1 dgydF4y2Ba).此外,HOTAIRM1过表达降低了肺顺应性,增加了肺阻力,但沉默HOTAIRM1导致相反的结果(图)。gydF4y2Ba1 egydF4y2Ba).HE和Masson三色染色显示IPF小鼠肺组织有明显的炎症细胞浸润,毛细血管增生,胶原纤维束增加,肺纤维化增强。此外,在HOTAIRM1过表达的情况下,肺组织病理和纤维化更为明显,而HOTAIRM1沉默后,肺组织病理和纤维化被否定(补充图。gydF4y2Ba2 a, BgydF4y2Ba).gydF4y2Ba
此外,免疫组化结果(补充图;gydF4y2Ba2摄氏度gydF4y2Ba)和Western blot分析(图;gydF4y2Ba1 fgydF4y2Ba)纤维化相关蛋白在IPF小鼠肺组织中α-SMA、I型胶原和纤维连接蛋白的表达高于正常小鼠;HOTAIRM1过表达引起了更明显的增加。相反,HOTAIRM1沉默后导致了下降。此外,小鼠肺组织中的羟脯氨酸水平在HOTAIRM1升高时升高,而在没有HOTAIRM1时降低(图2)。gydF4y2Ba1克gydF4y2Ba).总之,HOTAIRM1可能在IPF小鼠的肺组织中上调,并可能有助于IPF的发生和进展。gydF4y2Ba
HOTAIRM1富集于缺氧处理AECs的外泌体中,促进IPF进展gydF4y2Ba
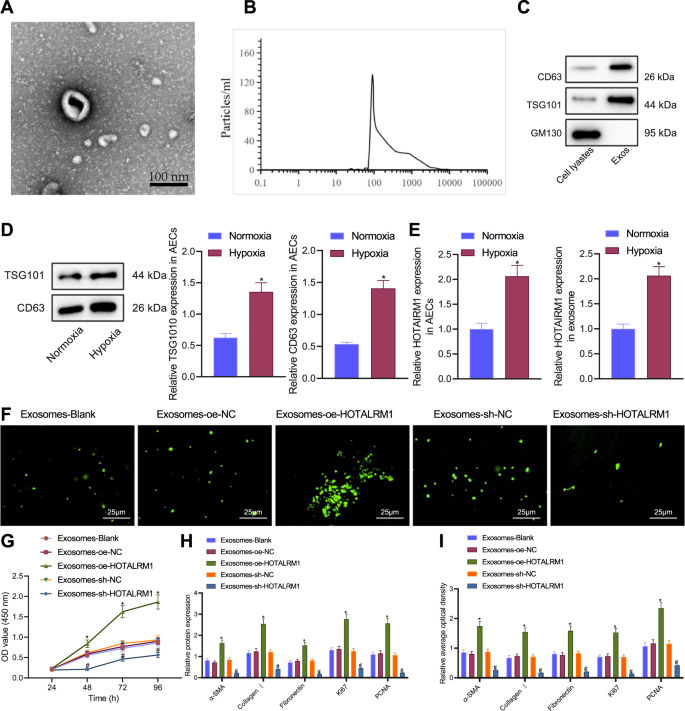
我们从aec中分离并鉴定了外泌体。在透射电镜下,外泌体具有代表性的双层膜结构,直径分布约为110 nm(图2)。gydF4y2Ba2 a, BgydF4y2Ba).Western blot分析进一步显示CD63和TSG101蛋白富集于分离的外泌体中,而NC GM130蛋白缺失(图3)。gydF4y2Ba2摄氏度gydF4y2Ba),表明外泌体分离成功。gydF4y2Ba
一个gydF4y2Ba从缺氧诱导的AECs中分离出的Exos在TEM下的形态特征(比例尺= 100 nm)。gydF4y2BaBgydF4y2Ba缺氧处理aec分离出的Exos大小分布分析。gydF4y2BaCgydF4y2BaWestern blot检测Exos中Exo标记蛋白CD63、TSG101和GM130。gydF4y2BaDgydF4y2BaWestern blot分析缺氧诱导aec中CD63和TSG101蛋白。gydF4y2BaEgydF4y2BaRT-qPCR检测缺氧诱导的aec和Exos中HOTAIRM1的表达。gydF4y2BaFgydF4y2BaLFs摄取AEC-Exos。gydF4y2BaGgydF4y2BaCCK-8检测与Exos-oe-HOTAIRM1或Exos-sh-HOTAIRM1共培养的LFs增殖情况。gydF4y2BaHgydF4y2BaWestern blot检测与exoos -oe- hotairm1或exoos -sh- hotairm1共培养的LFs中α-SMA、I型胶原蛋白、纤连蛋白、Ki67和PCNA蛋白。gydF4y2Ba我gydF4y2Ba与exoos -oe- hotairm1或exoos -sh- hotairm1共培养的LFs中α-SMA、I型胶原蛋白、纤连蛋白、Ki67和PCNA蛋白的免疫荧光分析数据以三次技术重复的平均值±标准差表示。两组数据采用非配对分析gydF4y2Bat测试gydF4y2Ba多组间采用单因素方差分析,采用Tukey事后检验。采用重复测量方差分析(Repeated measures ANOVA)和Tukey事后检验(post-hoc test)对不同时间点的数据进行比较。*gydF4y2BapgydF4y2Ba与常氧霞处理的AECs或与Exos-oe-NC共培养的LFs相比< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与Exos-sh-NC共培养的LFs相比< 0.05。gydF4y2Ba
Western blot分析显示,缺氧增加了AECs外泌体的释放(图。gydF4y2Ba二维gydF4y2Ba),缺氧条件下AECs和外泌体中HOTAIRM1的表达高于常氧条件下(图。gydF4y2Ba2 egydF4y2Ba).上述结果表明,缺氧可以诱导AECs释放更多的外泌体,外泌体携带更多的HOTAIRM1。gydF4y2Ba
瞬时转染cy3标记的HOTAIRM1和LFs的AECs共培养数据表明,超过90%的LFs存在cy3标记的绿色荧光。同样,在AEC-HOTAIRM1-Cy3外泌体孵育的LFs中也检测到绿色荧光信号,而在没有HOTAIRM1的情况下,信号下降(图2)。gydF4y2Ba2 fgydF4y2Ba).上述结果表明,HOTAIRM1可以通过AECs分泌的外泌体传递到LFs。gydF4y2Ba
CCK-8数据显示,与外泌体-oe- hotairm1共培养的LFs增殖增强,但在外泌体-sh- hotairm1存在时观察到增殖下降(图2)。gydF4y2Ba2 ggydF4y2Ba).此外,与外泌体-oe- hotairm1共培养的LFs中α-SMA、I型胶原蛋白、纤连蛋白、Ki67和PCNA蛋白水平高于与外泌体-oe- nc共培养的LFs。相反,这些蛋白在外泌体-sh- hotairm1存在时下调(图。gydF4y2Ba2 h,我gydF4y2Ba).综上所述,这些结果支持HOTAIRM1可以通过aec -外泌体进入LFs,从而促进LFs的增殖和转分化。gydF4y2Ba
HOTAIRM1招募YY1激活HSF1表达gydF4y2Ba
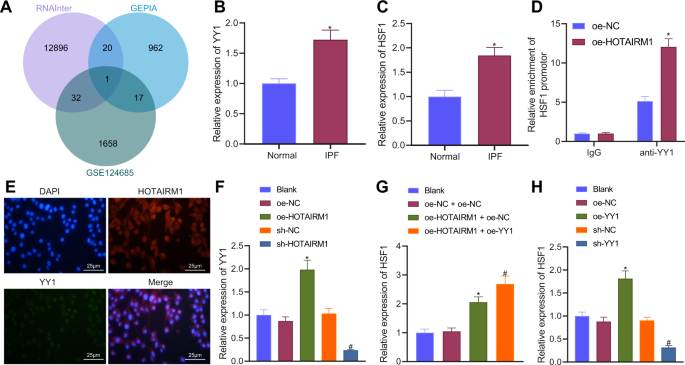
然后我们阐明了HOTAIRM1在IPF中的下游机制。通过对RNAInter数据库预测的与YY1结合的lncRNAs、GEPIA数据库中GTEx肺组织中与hsf1相关的lncRNAs和GSE124685数据集中的差异lncRNAs的维恩图分析表明,只有HOTAIRM1在交叉点被发现(图2)。gydF4y2Ba3gydF4y2Ba).RT-qPCR数据显示,YY1和HSF1在IPF小鼠肺组织中表达上调(图。gydF4y2Ba3 b, CgydF4y2Ba).ChIP检测结果显示,抗- yy1组HSF1的富集增加,HOTAIRM1的过表达富集了额外的HSF1启动子(图2)。gydF4y2Ba3 dgydF4y2Ba).此外,FISH分析显示HOTAIRM1和YY1在细胞核中共定位(图2)。gydF4y2Ba3 egydF4y2Ba).如图所示。gydF4y2Ba3 fgydF4y2Ba, HOTAIRM1过表达后YY1表达增加,HOTAIRM1沉默后YY1表达消失。cao - hotairm1 + oe-NC或cao - hotairm1 + oe-YY1可导致HSF1表达上调,cao - hotairm1 + oe-YY1处理后HSF1表达上调更为明显(图2)。gydF4y2Ba3 ggydF4y2Ba).此外,在YY1过表达时,HSF1表达升高,而在没有YY1的情况下观察到相反的结果(图1)。gydF4y2Ba3 hgydF4y2Ba).上述数据表明,HOTAIRM1可以招募YY1来提高HSF1的表达。gydF4y2Ba
一个gydF4y2BaRNAInter数据库预测的与YY1结合的lncrna、GEPIA数据库中GTEx肺组织中与hsf1相关的lncrna和GSE124685数据集中的差异lncrna的维恩图。gydF4y2BaBgydF4y2BaRT-qPCR检测正常(gydF4y2BangydF4y2Ba= 6)和IPF小鼠(gydF4y2BangydF4y2Ba= 6)。gydF4y2BaCgydF4y2BaRT-qPCR检测正常(gydF4y2BangydF4y2Ba= 6)和IPF小鼠(gydF4y2BangydF4y2Ba= 6)。gydF4y2BaDgydF4y2Ba用ChIP-PCR法测定YY1在HSF1启动子区相对富集程度。gydF4y2BaEgydF4y2BaFISH法分析HOTAIRM1和YY1的亚细胞共定位。gydF4y2BaFgydF4y2BaRT-qPCR检测HOTAIRM1或sh-HOTAIRM1处理后YY1的表达。gydF4y2BaGgydF4y2BaRT-qPCR检测oe-HOTAIRM1或sh-HOTAIRM1处理后HSF1的表达。gydF4y2BaHgydF4y2Ba用oe-YY1或sh-YY1处理后,RT-qPCR检测YY1的表达。数据以三次技术重复的平均值±标准差表示。两组数据采用非配对分析gydF4y2Bat测试gydF4y2Ba多组间采用单因素方差分析,采用Tukey事后检验。*gydF4y2BapgydF4y2Ba与正常小鼠、one - nc或one - nc + one - nc处理小鼠比较,均< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与sh-NC或oe-HOTAIRM1 + oe-NC治疗比较< 0.05。gydF4y2Ba
HOTAIRM1竞争性结合miR-30d-3p并增强HSF1的表达gydF4y2Ba
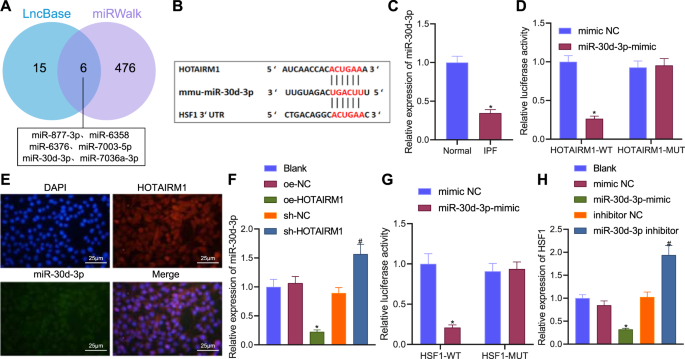
LncBase和miRWalk数据库预测了6个可能与HOTAIRM1和HSF1结合的miRNAs(图2)。gydF4y2Ba4gydF4y2Ba),并预测miR-30d-3p与HOTAIRM1和HSF1的潜在结合位点(图。gydF4y2Ba4 bgydF4y2Ba).RT-qPCR显示,与正常小鼠相比,IPF小鼠肺组织中miR-30d-3p的表达降低(图。gydF4y2Ba4摄氏度gydF4y2Ba).此外,在HEK-293T细胞中使用miR-30d-3p模拟物可以抑制HOTAIRM1-WT的荧光素酶活性,而不改变HOTAIRM1-MUT的活性(图2)。gydF4y2Ba4 dgydF4y2Ba),表明HOTAIRM1可以特异性结合miR-30d-3p。同时,FISH数据显示,HOTAIRM1和miR-30d-3p明显共定位于细胞质(图。gydF4y2Ba4 egydF4y2Ba).HOTAIRM1过表达后miR-30d-3p表达降低,而HOTAIRM1缺失时miR-30d-3p表达上调(图。gydF4y2Ba4 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaLncBase和miRWalk数据库预测的与HOTAIRM1和HSF1结合的miRNAs的维恩图。gydF4y2BaBgydF4y2Ba推测miR-30d-3p与HOTAIRM1和HSF1之间的结合位点。gydF4y2BaCgydF4y2BaRT-qPCR检测正常肺组织中miR-30d-3p的表达(gydF4y2BangydF4y2Ba= 6)和IPF小鼠(gydF4y2BangydF4y2Ba= 6)。gydF4y2BaDgydF4y2BaHEK-293T细胞中双荧光素酶报告实验证实了HOTAIRM1和miR-30d-3p的结合。gydF4y2BaEgydF4y2BaFISH法分析HOTAIRM1和miR-30d-3p的亚细胞共定位。gydF4y2BaFgydF4y2BaRT-qPCR检测oe-HOTAIRM1或sh-HOTAIRM1存在时miR-30d-3p的表达。gydF4y2BaGgydF4y2BaHEK-293T细胞中双荧光素酶报告实验证实了HSF1和miR-30d-3p的结合。gydF4y2BaHgydF4y2Ba在miR-30d-3p模拟物或miR-30d-3p抑制剂存在时,RT-qPCR检测HSF1表达。数据以三次技术重复的平均值±标准差表示。两组数据采用非配对分析gydF4y2Bat测试gydF4y2Ba多组间采用单因素方差分析,采用Tukey事后检验。*gydF4y2BapgydF4y2Ba与正常小鼠或模拟NC或oe-NC处理小鼠比较< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与sh-NC或抑制剂NC治疗比较< 0.05。gydF4y2Ba
此外,miR-30d-3p模拟物在不改变HSF1-MUT的情况下降低了HSF1-WT的荧光素酶活性(图3)。gydF4y2Ba4 ggydF4y2Ba),证明了miR-30d-3p与HSF1之间的特异性结合。此外,RT-qPCR结果证实,过表达miR-30d-3p后,HSF1表达下调,而抑制miR-30d-3p后,结果相反(图3)。gydF4y2Ba4 hgydF4y2Ba).这些结果表明,HOTAIRM1可以通过竞争性地与miR-30d-3p结合来减弱miR-30d-3p与HSF1的结合,从而增强HSF1的表达。gydF4y2Ba
HOTAIRM1通过miR-30d-3p/YY1/HSF1轴促进LFs的增殖和转分化gydF4y2Ba
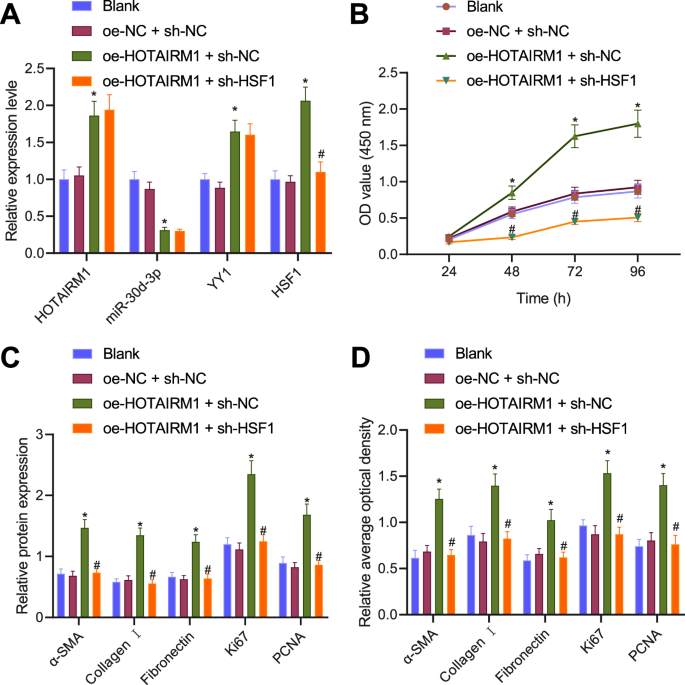
上述结果使我们能够确定HOTAIRM1是否通过miR-30d-3p/YY1/HSF1轴诱导LFs的增殖和转分化。RT-qPCR检测HOTAIRM1、miR-30d-3p、YY1、HSF1的表达水平。HOTAIRM1、miR-30d-3p、YY1、HSF1的表达在空白组和oe-NC + sh-NC组之间无明显差异。与oe-NC + sh-NC组相比,oe-HOTAIRM1 + sh-NC组HOTAIRM1、YY1、HSF1表达明显升高,miR-30d-3p表达明显降低。与oe-HOTAIRM1 + sh-NC组相比,oe-HOTAIRM1 + sh-HSF1组HSF1表达明显降低(图2)。gydF4y2Ba5gydF4y2Ba).CCK-8结果表明,经oe-HOTAIRM1 + sh-NC处理的LFs增殖增加,而在oe-HOTAIRM1 + sh-HSF1存在时,其增殖受到抑制(图2)。gydF4y2Ba5 bgydF4y2Ba).此外,Western blot分析和免疫荧光检测结果显示,oe-HOTAIRM1 + sh-NC处理的LFs中α-SMA、I型胶原、纤连蛋白、Ki67和PCNA的表达增加,而oe-HOTAIRM1 + sh-HSF1处理则逆转了这一变化(图2)。gydF4y2Ba5 c, DgydF4y2Ba).总之,上述数据显示,HOTAIRM1通过介导miR-30d-3p/YY1/HSF1轴,增加了LFs的增殖和转分化。gydF4y2Ba
一个gydF4y2BaRT-qPCR检测经oe-HOTAIRM1 + sh-NC或oe-HOTAIRM1 + sh-HSF1处理的肝细胞中HOTAIRM1、YY1、HSF1和miR-30d-3p的表达。gydF4y2BaBgydF4y2Ba用oe-HOTAIRM1 + sh-NC或oe-HOTAIRM1 + sh-HSF1治疗的肝细胞增殖的CCK-8检测。gydF4y2BaCgydF4y2BaWestern blot检测经oe-HOTAIRM1 + sh-NC或oe-HOTAIRM1 + sh-HSF1处理的肝细胞α-SMA、I型胶原蛋白、纤连蛋白、Ki67和PCNA蛋白。gydF4y2BaDgydF4y2Ba免疫荧光分析oe-HOTAIRM1 + sh-NC或oe-HOTAIRM1 + sh-HSF1处理的LFs中α-SMA、I型胶原蛋白、纤连蛋白、Ki67和PCNA蛋白。数据以三次技术重复的平均值±标准差表示。多组数据采用单因素方差分析和Tukey事后检验进行评估。采用重复测量方差分析(Repeated measures ANOVA)和Tukey事后检验(post-hoc test)对不同时间点的数据进行比较。*gydF4y2BapgydF4y2Ba与oe-NC + sh-NC治疗比较< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与oe-HOTAIRM1 + sh-NC组比较< 0.05。gydF4y2Ba
Exosome-HOTAIRM1通过miR-30d-3p/YY1/HSF1轴促进IPF小鼠的细胞外基质重塑gydF4y2Ba
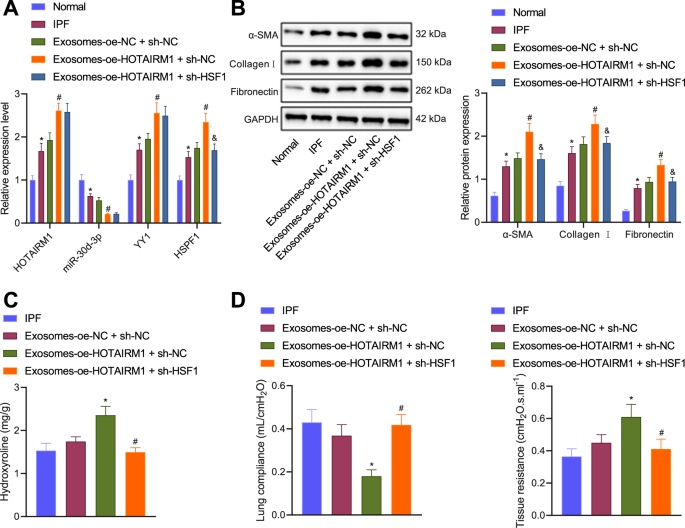
为了进一步证实外泌体-HOTAIRM1在体内调控IPF进展的机制,我们在常氧条件下在ACEs中过表达HOTAIRM1,提取外泌体,然后将外泌体和慢病毒注射到IPF小鼠体内gydF4y2Ba通过gydF4y2Ba尾静脉。RT-qPCR结果显示,IPF小鼠肺组织中HOTAIRM1、YY1和HSF1的表达趋势升高,miR-30d-3p水平降低。外泌体-oe- nc + sh-NC处理后,IPF小鼠中这些因子的表达无显著差异。相对于外泌体-oe- nc + sh-NC,外泌体-oe- hotairm1 + sh-NC导致YY1和HSF1表达升高,但miR-30d-3p表达降低。与外泌体-oe- hotairm1 + sh-NC相比,外泌体-oe- hotairm1 + sh-HSF1处理后,YY1表达增加,但HSF1表达降低(图2)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaRT-qPCR检测IPF小鼠和Exos-oe-HOTAIRM1 + sh-NC或Exos-oe-HOTAIRM1 + sh-HSF1处理小鼠肺组织中HOTAIRM1、YY1、HSF1和miR-30d-3p的表达。gydF4y2BaBgydF4y2BaWestern blot分析IPF小鼠和Exos-oe-HOTAIRM1 + sh-NC或Exos-oe-HOTAIRM1 + sh-HSF1处理小鼠肺组织中α-SMA、I型胶原蛋白和纤维连接蛋白。gydF4y2BaCgydF4y2BaIPF小鼠和Exos-oe-HOTAIRM1 + sh-NC或Exos-oe-HOTAIRM1 + sh-HSF1处理小鼠肺组织中羟脯氨酸水平。gydF4y2BaDgydF4y2BaIPF小鼠和Exos-oe-HOTAIRM1 + sh-NC或Exos-oe-HOTAIRM1 + sh-HSF1治疗小鼠肺组织的肺顺应性和肺阻力。gydF4y2BangydF4y2Ba每次治疗小鼠= 6。数据以均数±标准差表示。多组数据采用单因素方差分析和Tukey事后检验进行评估。*gydF4y2BapgydF4y2Ba与正常小鼠或经Exos-oe-NC + sh-NC处理的IPF小鼠相比< 0.05。gydF4y2Ba#gydF4y2BapgydF4y2Ba与Exos-oe-NC + sh-NC或Exos-oe-HOTAIRM1 + sh-NC处理的IPF小鼠相比< 0.05。gydF4y2Ba&gydF4y2BapgydF4y2Ba与Exos-oe-HOTAIRM1 + sh-NC处理的IPF小鼠相比< 0.05。gydF4y2Ba
HE和Masson三色染色显示ipf诱导小鼠和外泌体- e- nc + sh-NC处理小鼠肺组织中有明显的炎症细胞浸润和毛细血管增生,胶原纤维束增加和肺纤维化。此外,外泌体传递增加的HOTAIRM1加重了肺组织病理和纤维化,沉默HSF1后,HOTAIRM1被破坏(补充图)。gydF4y2Ba3 a, BgydF4y2Ba).如补充图所示。gydF4y2Ba3 cgydF4y2Ba和无花果。gydF4y2Ba6 bgydF4y2Ba外泌体-oe- nc + sh-NC处理的IPF小鼠肺组织α-SMA、I型胶原蛋白和纤连蛋白的表达与未处理的IPF小鼠相似。外泌体-oe- hotairm1 + sh-NC产生了更明显的增加,但sh-HSF1逆转了这种增加。未处理的IPF小鼠和外泌体-oe- nc + sh-NC处理小鼠肺组织中羟脯氨酸水平相似。外泌体-oe- hotairm1 + sh-NC导致羟脯氨酸水平高于外泌体-oe- nc + sh-NC。相反,这种增加被HSF1沉默所消除(图。gydF4y2Ba6摄氏度gydF4y2Ba).gydF4y2Ba
IPF小鼠和外泌体-oe- nc + sh-NC处理的小鼠表现出相似的肺顺应性和肺抵抗。外泌体-oe- hotairm1 + sh-NC诱导肺顺应性降低和肺阻力增加。然而,在外泌体-oe- hotairm1 + sh-HSF1的治疗中观察到相反的结果。gydF4y2Ba6 dgydF4y2Ba).综上所述,这些证据表明外泌体- hotairm1通过miR-30d-3p/YY1/HSF1轴诱导IPF小鼠细胞外基质重塑。gydF4y2Ba
讨论gydF4y2Ba
外泌体已被开发为多种疾病模型的治疗剂,因为来自不同类型细胞的外泌体可以在细胞之间传递不同的RNA谱[gydF4y2Ba6gydF4y2Ba].本研究的关键发现是通过控制miR-30d-3p/HSF1/YY1轴,aec -外泌体包裹的HOTAIRM1对IPF进展的加速作用。gydF4y2Ba
据报道,严重的肺纤维化伴随着肺顺应性的急剧下降和肺气道阻力的增加[gydF4y2Ba16gydF4y2Ba].我们的初步结果提供了证据,表明HOTAIRM1在IPF小鼠的肺组织中上调,并可能促进IPF的发生和进展,这可以通过降低肺顺应性和增加肺阻力以及增强纤维相关蛋白α-SMA、I型胶原蛋白和纤维连接蛋白的表达以及羟脯氨酸水平来证明。最近的一项研究表明,HOTAIRM1的下调导致非小细胞肺癌的细胞活力、迁移、侵袭和糖酵解代谢受到抑制[gydF4y2Ba17gydF4y2Ba].近来,HOTAIRM1被认为是糖皮质激素耐药的促进剂[gydF4y2Ba18gydF4y2Ba]和成骨分化[gydF4y2Ba19gydF4y2Ba].目前的结果为HOTAIRM1在IPF中的作用提供了额外的证据。HOTAIRM1的下调可能具有抗纤维化活性,可以考虑用于IPF的治疗。gydF4y2Ba
我们随后发现HOTAIRM1可以通过aec -外泌体进入LFs,从而促进LFs的增殖和转分化。HOTAIRM1在外泌体中检测到高水平,可以在亲本细胞和受体细胞之间传递HOTAIRM1 [gydF4y2Ba17gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].此外,肺上皮细胞与LFs之间的双向通信是IPF启动的原因[gydF4y2Ba21gydF4y2Ba].缺氧可刺激管状上皮细胞分泌外泌体,使外泌体在细胞内转移RNA,促进成纤维细胞的活化和增殖[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].上述信息表明,HOTAIRM1对LFs增殖和转分化的促进作用可能归因于aec -外泌体将HOTAIRM1转移到LFs中。gydF4y2Ba
机制研究表明,HOTAIRM1招募YY1激活HSF1的表达。同样,大量研究表明lncrna可以通过与转录因子YY1相互作用来调控靶基因的转录[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].同时,沉默YY1可降低HSF1的表达,从而降低促增殖和纤维化标志物在人胚胎肺成纤维细胞中的表达,抑制人胚胎肺成纤维细胞的增殖和成纤维转化[gydF4y2Ba15gydF4y2Ba].与这一发现部分一致的是,我们的数据强调了hotairm1介导的YY1/HSF1激活在IPF发生发展中的重要作用,并为探索新的IPF发病标志物和生物标志物提供了参考。gydF4y2Ba
越来越多的证据证实,HOTAIRM1作为miR-107和miR-106a-5p等miRNA的竞争性内源性RNA,进而调控miRNA靶基因的表达[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].本研究表明,HOTAIRM1竞争性结合miR-30d-3p,从而增加了miR-30d-3p靶基因HSF1的表达。已经证实,mirna可以与特定靶mrna的3ʹUTR相互作用,从而抑制其表达[gydF4y2Ba28gydF4y2Ba].目前的研究还代表了miR-30d-3p对HSF1转录后调控的第一个证据,这可能在调控IPF进展中具有重要意义。miR-30d在PF组织中表达下调,但其过表达减弱TGF-β1诱导的原发性正常人LF增殖分化,以及α-SMA和I型胶原蛋白水平[gydF4y2Ba29gydF4y2Ba].值得注意的是,PF被认为是异常伤口愈合的结果,诱导成纤维细胞积累、分化和激活,以及过多的细胞外基质成分,特别是胶原蛋白的沉积[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].结合目前外泌体-HOTAIRM1通过miR-30d-3p/YY1/HSF1轴促进LFs的增殖和转分化以及细胞外基质重塑的结果,aec -外泌体穿梭的HOTAIRM1可能通过miR-30d-3p/YY1/HSF1轴对IPF的发生和进展起关键作用。gydF4y2Ba
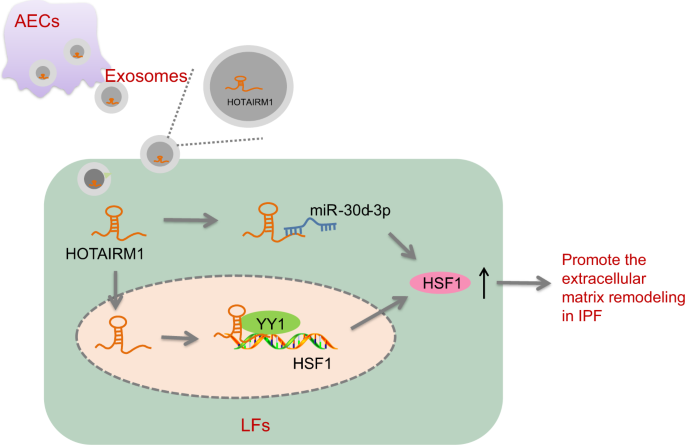
总之,我们的研究数据支持这样的观点,即AEC外泌体将HOTAIRM1从缺氧诱导的AEC转移到LFs中,其中HOTAIRM1竞争性地与miR-30d-3p结合,并招募YY1上调HSF1,从而促进IPF的细胞外基质重塑(图3)。gydF4y2Ba7gydF4y2Ba).因此,我们的发现为IPF的进展机制提供了新的见解,并代表了一种对抗IPF的新策略。由于关于HOTAIRM1与miR-30d-3p、YY1和HSF1相互作用的文献缺乏,需要进一步的研究来验证当前研究的结果。gydF4y2Ba
数据可用性gydF4y2Ba
本研究的数据和资料可根据要求从通讯作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Antoniou, K. M., Margaritopoulos, G. A., Tomassetti, S., Bonella, F., Costabel, U. & Poletti, V.间质性肺病。gydF4y2Ba欧元。和。牧师gydF4y2Ba.gydF4y2Ba23gydF4y2Ba, 40-54(2014)。gydF4y2Ba
肺纤维化,第一部分:流行病学、发病机制和诊断。gydF4y2Ba呼吸专家。地中海。gydF4y2Ba11gydF4y2Ba, 343-359(2017)。gydF4y2Ba
Sgalla, G., Kulkarni, T., Antin-Ozerkis, D., Thannickal, V. J. & Richeldi, L.肺纤维化2018最新进展。gydF4y2Ba点。j .和。暴击。保健医疗gydF4y2Ba.gydF4y2Ba200gydF4y2Ba, 292-300(2019)。gydF4y2Ba
Chioma, O. S. & Drake, W. P.微生物在肺纤维化中的作用。gydF4y2Ba耶鲁·j·比尔。地中海。gydF4y2Ba90gydF4y2Ba, 219-227(2017)。gydF4y2Ba
Mathai, s.k. & Schwartz, d.a.肺纤维化的转化研究。gydF4y2BaTransl。Res。gydF4y2Ba209gydF4y2Ba, 1-13(2019)。gydF4y2Ba
Pegtel, D. M. & Gould, S. J.外泌体。gydF4y2Ba为基础。学生物化学启gydF4y2Ba.gydF4y2Ba88gydF4y2Ba, 487-514(2019)。gydF4y2Ba
Poulet C, Njock MS, Moermans C, Louis E, Louis R, M,等。肺部疾病中的外泌体长非编码rna。gydF4y2BaInt。理学。gydF4y2Ba21gydF4y2Ba, 3580-3635(2020)。gydF4y2Ba
曹刚,张俊,王敏,宋晓霞,刘伟,毛成,等。长链非编码rna在博莱霉素诱导肺纤维化中的差异表达。gydF4y2BaInt。理学医学gydF4y2Ba.gydF4y2Ba32gydF4y2Ba, 355-364(2013)。gydF4y2Ba
Bhan, A., Soleimani, M. & Mandal, s.s. Long非编码RNA和癌症:一个新的范式。gydF4y2Ba癌症ResgydF4y2Ba77gydF4y2Ba, 3965-3981(2017)。gydF4y2Ba
熊飞,尹海华,张海华,朱春华,张波,陈寿等。长链非编码RNA HOTAIRM1在非小细胞肺癌中的临床病理特征及预后意义gydF4y2Ba麝猫。检测Mol,生物标记物gydF4y2Ba24gydF4y2Ba, 47-53(2020)。gydF4y2Ba
Tanwar, V. S., Zhang, X., Jagannathan, L., Jose, C. C. & Cuddapah, S.镉暴露通过miR-30抑制人肺上皮细胞上调SNAIL。gydF4y2BaToxicol达成。杂志。gydF4y2Ba373gydF4y2Ba, 1-9(2019)。gydF4y2Ba
杨超,张建军,彭玉萍,朱勇,尹立东,魏建生等。阴阳1/miR-30a调节电路调节胰腺癌细胞自噬gydF4y2Baj . Transl。地中海。gydF4y2Ba15gydF4y2Ba, 211(2017)。gydF4y2Ba
张超,朱晓霞,华勇,赵启刚,王凯,郑亮等。YY1介导tgf -beta1诱导的肺泡上皮细胞EMT和促纤维形成。gydF4y2Ba和Res。gydF4y2Ba20.gydF4y2Ba, 249(2019)。gydF4y2Ba
杨伟,冯斌,孟,杨,王俊,耿斌,崔强等。FAM3C-YY1轴是tgfbeta通过激活HSF1促进人乳腺癌MDA-MB-231细胞增殖和迁移的关键。gydF4y2Ba细胞生物学。gydF4y2Ba23gydF4y2Ba, 3464-3475(2019)。gydF4y2Ba
陈良、杨勇、彭旭、严宏、张旭、尹亮等。转录因子YY1通过激活HSF1/miR-214轴抑制THY1的表达促进间质性肺纤维化。gydF4y2Ba老化gydF4y2Ba12gydF4y2Ba, 8339-8351(2020)。gydF4y2Ba
刘晓霞,杨良,郭东,侯良,尚锐,梅耶,等。心力衰竭时肺气道阻力的显著增加:呼吸困难的潜在重要因素。gydF4y2Baj . Cardiovasc。Transl。Res。gydF4y2Ba12gydF4y2Ba, 271-279(2019)。gydF4y2Ba
陈冬,李颖,王颖,徐娟。LncRNA HOTAIRM1下调通过miR-498/ABCE1轴抑制非小细胞肺癌细胞糖酵解代谢和肿瘤进展gydF4y2Ba基因染色体组gydF4y2Ba43gydF4y2Ba, 183-194(2021)。gydF4y2Ba
梁良,顾伟,李敏,高荣,张晓霞,郭成等。AML1控制的长链非编码RNA HOTAIRM1通过抑制ARHGAP18激活RHOA/ROCK1通路增强糖皮质激素抵抗。gydF4y2Ba细胞死亡。gydF4y2Ba12gydF4y2Ba, 702(2021)。gydF4y2Ba
任勇,张凯,王俊,孟,X.,杜晓霞,石忠等。HOTAIRM1通过灭活NF-kappaB通路促进成骨分化并缓解破骨细胞分化。gydF4y2Ba生物学报gydF4y2Ba53gydF4y2Ba, 201-211(2021)。gydF4y2Ba
张志强,张志强,张志强,等。长链非编码RNA hotairm1在脓毒症期间促进S100A9支持MDSC扩张。gydF4y2Baj .中国。细胞ImmunolgydF4y2Ba,gydF4y2Ba11gydF4y2Ba, 600(2020)。gydF4y2Ba
Sakai, N. & Tager, a.m.两种纤维化:肺纤维化中的上皮细胞-成纤维细胞相互作用。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1832gydF4y2Ba, 911-921(2013)。gydF4y2Ba
管宏,彭荣,毛丽丽,方芳,徐波,陈敏,损伤小管上皮细胞通过含mir -150的外泌体激活成纤维细胞促进肾纤维化。gydF4y2BaExp Cell ResgydF4y2Ba.gydF4y2Ba392gydF4y2Ba, 112007(2020)。gydF4y2Ba
王伟,韩勇,Jo, H. A, Lee J. & Song Y. S.非编码rna通过外泌体穿梭重塑低氧肿瘤微环境。gydF4y2Baj .内科杂志。肿瘤防治杂志。gydF4y2Ba13gydF4y2Ba, 67(2020)。gydF4y2Ba
韩晓霞,姜海华,齐建军,李建军,杨建军,田勇等。新型lncRNA UPLA1介导肺腺癌的发生和预后gydF4y2Ba细胞死亡gydF4y2Ba.gydF4y2Ba11gydF4y2Ba, 999(2020)。gydF4y2Ba
宋晟,王志强,李永勇,马丽丽,金俊,史考特,a.w等。PPARdelta与河马共激活因子YAP1相互作用,促进SOX9表达和胃癌进展。gydF4y2BaMol. Cancer Res。gydF4y2Ba18gydF4y2Ba, 390-402(2020)。gydF4y2Ba
李东,柴林,于旭,宋勇,朱霞,樊胜等。HOTAIRM1/miR-107/TDG轴调控甲状腺乳头状癌细胞的增殖和侵袭。gydF4y2Ba细胞死亡。gydF4y2Ba11gydF4y2Ba, 227(2020)。gydF4y2Ba
Chao H., Zhang M., Hou H., Zhang Z. & Li N. HOTAIRM1通过海绵miR-106a-5p促进ARHGAP24表达抑制卵巢癌细胞增殖和侵袭。gydF4y2Ba生命科学gydF4y2Ba.gydF4y2Ba243gydF4y2Ba, 117296(2020)。gydF4y2Ba
阿里·赛达Z, Langden SSS, Munkhzul C,李敏,宋世杰。MicroRNA在癌症中的表达调控机制。gydF4y2BaInt。理学。gydF4y2Ba21gydF4y2Ba, 1723(2020)。gydF4y2Ba
赵晟,肖旭,孙晟,李东,王伟,付勇等。MicroRNA-30d/JAG1轴通过Notch信号通路调节肺纤维化gydF4y2BaPathol Res. practice。gydF4y2Ba214gydF4y2Ba, 1315-1323(2018)。gydF4y2Ba
邓Z., Fear, M. W., Suk Choi, Y., Wood, F. M., Allahham, A. & Mutsaers, S. E.等。肺纤维化中的细胞外基质和机械传导。gydF4y2BaInt。学生物化学j。细胞生物。gydF4y2Ba126gydF4y2Ba, 105802(2020)。gydF4y2Ba
Kolahian, S., Fernandez, i.e., Eickelberg, O. & Hartl, D.肺纤维化的免疫机制。gydF4y2Ba点。j .和。细胞分子生物学gydF4y2Ba55gydF4y2Ba, 309-322(2016)。gydF4y2Ba
资金gydF4y2Ba
四川省科技厅项目(2021YFS0373)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
l.c., Y.Y和R.Y.设计了这项研究。x.p.、h.y.和X.H.整理了数据,进行了数据分析,并产生了手稿的初稿。L.C.和Y.Y.参与了手稿的起草。所有作者均已阅读并批准最终提交的稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
伦理批准/同意参与gydF4y2Ba
本研究经四川省人民医院动物伦理委员会(2019047 A)批准,并符合美国国立卫生研究院《实验动物护理与使用指南》。为尽量减少动物的痛苦,政府作出了广泛的努力。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
陈良,杨,杨,岳,瑞。gydF4y2Baet al。gydF4y2Ba来自缺氧诱导的肺泡上皮细胞的外泌体通过hotairm1依赖机制刺激间质性肺纤维化。gydF4y2Ba实验室投资gydF4y2Ba102gydF4y2Ba, 935-944(2022)。https://doi.org/10.1038/s41374-022-00782-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41374-022-00782-ygydF4y2Ba