摘要gydF4y2Ba
肺鳞状细胞癌(LSCC)是一种常见的进行性肺癌亚型。本研究旨在证实PAK2/SOX2/DEK轴对LSCC发展的调节作用。喉鳞癌组织(gydF4y2BangydF4y2Ba= 83)和相邻正常组织,用qRT-PCR和Western blotting检测SOX2的表达。利用Kaplan-Meier分析探讨SOX2表达与LSCC患者预后的相关性。通过免疫共沉淀和谷胱甘肽- s转移酶下拉实验验证SOX2与DEK的结合。然后对LSCC细胞进行功能增益和功能损失检测,采用CCK-8和Transwell检测细胞的恶性行为。进一步建立LSCC小鼠异种移植模型进行体内验证。SOX2、PAK2和DEK在LSCC组织和细胞中的表达水平上调。SOX2过表达与LSCC患者预后不良相关。SOX2的下调降低了LSCC细胞的生存能力以及迁移和侵袭潜能。PAK2与SOX2直接相互作用。PAK2过表达通过与SOX2相互作用加速LSCC细胞的恶性表型。 Moreover, SOX2 activated the expression of DEK, and silencing DEK attenuated the malignant behaviors of LSCC cells. In conclusion, PAK2 could bind to the transcription factor SOX2 and thus activate the expression of DEK, thereby driving the malignant phenotypes of LSCC cells both in vivo and in vitro.
简介gydF4y2Ba
肺癌是全球癌症相关死亡的主要原因之一gydF4y2Ba1gydF4y2Ba.肺癌一般分为小细胞肺癌和非小细胞肺癌(NSCLC)两种,NSCLC又可分为大细胞肺癌、肺鳞状细胞癌(LSCC)和肺腺癌gydF4y2Ba2gydF4y2Ba.在三种亚型中,LSCC约占NSCLC的30%,其特点是生存率低,复发率高gydF4y2Ba3.gydF4y2Ba.尽管对LSCC的治疗进行了大量的努力,但一些现有的治疗方案,包括一种新开发的靶向治疗,都未能取得令人满意的治疗效果,这可能与LSCC复杂的基因组模式有关gydF4y2Ba4gydF4y2Ba.因此,寻找新的靶点是发展LSCC治疗的迫切需要。gydF4y2Ba
SOX2是一种转录因子,作为多能干细胞的调节因子,已被确定为鳞状上皮的发育和维持的贡献者gydF4y2Ba5gydF4y2Ba.在一系列鳞状细胞癌(SCCs)中已经报道了SOX2的扩增及其致癌性。gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.更重要的是,之前的研究已经揭示了SOX2参与LSCCgydF4y2Ba8gydF4y2Ba.然而,SOX2参与LSCC进展的分子机制尚不清楚。我们的生物信息学分析最初确定p21活化激酶2 (PAK2)是一种与SOX2相互作用的蛋白,值得注意的是,SOX2与PAK2之间的相互作用在之前的系统分析中已被揭示gydF4y2Ba9gydF4y2Ba.有趣的是,最近的一个病例表明PAK过表达与口腔SCC有关gydF4y2Ba10gydF4y2Ba而PAK2在LSCC中的潜在作用尚不清楚。因此,本研究旨在通过PAK2与SOX2的相互作用,探讨PAK2对LSCC的潜在影响。gydF4y2Ba
除了SOX2与PAK2的相互作用外,也有研究认为SOX2介导的缺陷核(defective kernel, DEK)上调有助于SOX2在LSCC中的调控作用gydF4y2Ba5gydF4y2Ba.DEK是一种典型的致癌基因,参与了多种癌症的进展gydF4y2Ba11gydF4y2Ba.此外,DEK在NSCLC中表达上调,DEK过表达参与了NSCLC的发病过程,刺激了NSCLC细胞的增殖和侵袭gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.在本研究中,我们假设PAK2通过与SOX2的正向相互作用和上调DEK的表达来诱导LSCC的发生和发展。gydF4y2Ba
方法和材料gydF4y2Ba
生物信息学分析gydF4y2Ba
以“肺鳞状细胞癌”为关键词,分别从GeneCards(相关性评分:前300个基因)、DisGeNET(筛选标准:评分≥0.1)和Phenolyzer数据库中检索lscc相关基因,然后使用jvenn工具进行交叉,以识别候选基因。通过生物信息学工具STRING(置信度0.4)进行蛋白-蛋白相互作用(PPI)分析,筛选关键靶点。采用Mann-Whitney U法检测TCGA数据库中LSCC与相邻正常样本候选基因的差异表达,格式为每百万reads转录本,然后进行log2转换。R(3.6.3版)“ggplot2”包用于绘制箱线图。从KMplot数据库中检索肺癌样本中HRAS和SOX2表达的Kaplan-Meier生存曲线,根据基因表达的中位数将患者分为两组,以gydF4y2BapgydF4y2Ba< 0.01为阈值。gydF4y2Ba
随后,利用GeneCards和BioGRID数据库预测与SOX2互作的基因,并通过PPI网络分析鉴定关键上游PAK2。利用starBase工具对TCGA数据库中PAK2和SOX2进行共表达分析。通过JASPAR数据库(Organisms: homo sapiens)预测了两者之间的结合位点。gydF4y2Ba
伦理批准gydF4y2Ba
这项研究是根据gydF4y2Ba赫尔辛基宣言gydF4y2Ba经南昌大学第一附属医院伦理委员会批准。向所有患者解释详细的研究目标和计划的程序,随后向所有患者提供签署的知情同意文件。动物实验经南昌大学第一附属医院动物护理使用委员会批准,并按规定进行gydF4y2Ba《实验动物护理和使用指南》gydF4y2Ba由美国国立卫生研究院发表。gydF4y2Ba
组织收集和细胞培养gydF4y2Ba
收集2015年1月至2017年3月在南昌大学第一附属医院行首次手术的LSCC患者共83例LSCC组织及相邻正常组织。这些患者术前从未接受过化疗或放疗,术后按照2004年国家综合癌症网络(NCCN)肿瘤学临床实践指南:非小细胞肺癌接受了标准治疗。如果癌症复发,后续治疗方法由负责的医生决定。所有病例均按照世界卫生组织LSCC标准进行分类。gydF4y2Ba
4株LSCC细胞系(LTEP-S, SK-MES-1, NCI-H2170, NCI-H520), 1株正常肺上皮细胞系BEAS-2B和正常人胚胎肾HEK-293T细胞系购自国家细胞系资源基础设施。BEAS-2B和LTEP-S细胞在含10%胎牛血清(FBS, GIBCO)的高糖DMEM (GIBCO, Grand Island, NY)中培养。NCI-H2170和NCI-H520细胞在含10%胎牛血清的RPMI 1640培养基(GIBCO)中培养。HEK-293T和SK-MES-1细胞在含10% fbs的MEM培养基(GIBCO)中培养。所有细胞在5% CO中培养gydF4y2Ba2gydF4y2Ba培养箱在37°C和95%饱和湿度。gydF4y2Ba
免疫组织化学(包含IHC)gydF4y2Ba
切片依次浸泡在二甲苯-无水乙醇-95%乙醇-70%乙醇中(每次5分钟),然后用0.01 M柠檬酸钠缓冲液在95℃加热。然后在室温下用正常的山羊血清阻塞溶液阻塞切片。切片用相应的一抗(anti-SOX2, ab97959, 1:100;anti-PAK2, ab76293, 1:200;anti-DEK, ab249362, 1:100;Abcam,剑桥,英国)。然后用二抗在室温下孵育1 h。DAB显色后,切片用苏木精复染镜检。gydF4y2Ba
细胞转染gydF4y2Ba
将LSCC细胞株NCI-H2170和NCI-H520分为15组,分别用短发夹RNA (shRNA, sh)阴性对照(NC)、sh- sox2 -1、sh- sox2 -2 -2、sh- sox2 -3、过表达(oe)-NC、oe- sox2、oe- pak2 + sh-NC、oe- pak2 + sh- sox2、sh- pak2、sh- dek -1、sh- dek -2、sh- dek -3、sh-NC + oe-NC、sh- sox2 + oe-NC、sh- sox2 + oe- dek处理。过表达载体为pcDNA3.1, RNAi载体为pRNAT-U6.1/neo,均由GenePharma(中国上海)设计构建。转染按照Lipofectamine 2000 (Invitrogen, Carlsbad, CA)的协议进行。然后用G418 (400 ug/ml)培养细胞,筛选沉默DEK的稳定细胞。2周后,再次用G418 (200 ug/ml)培养细胞,筛选稳定转染的NCI-H2170和NCI-H520细胞,培养2个月。gydF4y2Ba
RNA提取及定量逆转录聚合酶链反应(qRT-PCR)gydF4y2Ba
用TRIzol试剂(15596026,Invitrogen)从组织中提取总RNA。按照PrimeScript RT reagent Kit (RR047A, Takara, Shiga, Japan)的规程,将RNA反转录为cDNA。然后采用SYBR Premix EX Taq试剂盒(RR420A, Takara)和ABI7500 PCR系统(ABI, Foster City, CA)进行qRT-PCR检测。引物由上海生工生物技术有限公司(上海,中国)合成,详见补充表gydF4y2Ba1gydF4y2Ba.每组重复3口井。此外,相对定量方法(2gydF4y2Ba−gydF4y2Ba△gydF4y2Ba△gydF4y2BaCTgydF4y2Ba方法)计算相对转录水平(归一化为β-actin)。gydF4y2Ba
Western blot检测gydF4y2Ba
利用含苯甲基磺酰氟的RIPA裂解缓冲液从细胞中提取总蛋白,然后使用BCA检测试剂盒(70-PQ0012, Multi Sciences,杭州,浙江,中国)测定蛋白浓度。然后用SDS-PAGE分离蛋白(50µg),电转移到PVDF膜上,用5%脱脂奶粉在室温下封堵1 h。然后用稀释后的兔一抗(抗dek (ab74975, 1:500, Abcam)、抗ki67 (ab16667, 1:100, Abcam)、抗sox2 (ab97959, 1:100, Abcam)、抗mmp -9 (ab137867, 1:100, Abcam)、抗e -cadherin (ab15148, 1:500, Abcam)、抗n -cadherin (ab18203, 1:100, Abcam)、抗-β-肌动蛋白(ab227387, 1:50, Abcam) 4℃孵育过夜。清洗后,用辣根过氧化物酶(HRP)标记的IgG二抗(ab97051, 1:2000, Abcam)进一步孵育1小时。然后使用增强型化学发光检测试剂盒(Thermo Fisher Scientific, San Jose, PA)来可视化蛋白质带。此外,利用ECL荧光检测试剂盒(BB-3501, Amersham, Little Chalfont, UK)对印迹进行可视化,并使用Bio-Rad图像分析系统(Bio-Rad, Hercules, CA)对图像进行拍摄。蛋白条带灰度用Quantity One v4.6.2软件定量,归一化为β-actin。gydF4y2Ba
免疫共沉淀(Co-IP)试验gydF4y2Ba
细胞用RIPA缓冲液(赛默飞世尔科学公司)裂解,超声30分钟,13000离心gydF4y2BaggydF4y2Ba在4°C下放置30分钟。特异性抗体和上清液在4℃下混合过夜,然后用Pierce protein A/G磁珠(Thermo, 88803)孵育4小时。离心收集珠粒,与负载缓冲液混合,SDS-PAGE和Western blot检测。gydF4y2Ba
谷胱甘肽- s -转移酶(GST)下拉试验gydF4y2Ba
从NCBI参考序列NM_002577.4中获得PAK2的CDS序列,由北京ABXBio构建到Pgex-4T-3质粒中,形成GST-PAK2重组表达载体,并转化到e.c oli Rosetta中。阳性克隆后,IPTG诱导原核表达,谷胱甘肽琼脂糖亲和层析柱纯化GST-PAK2蛋白。纯化的GST-PAK2蛋白和gst标记蛋白与GST-Beads(固定化谷胱甘肽)在EP管中混合,在色谱柜中4°C旋转1 h。收集转染过表达SOX2质粒的细胞,充分裂解,取20%的裂解液作为输入(阳性对照)。然后将剩余的裂解液添加到EP管中,在色谱柜中以4°C旋转4小时。然后用SOX2抗体Western blot对GST-Beads进行洗涤和分析。此外,在洗涤前取2%体积的混合物进行Western blot分析。gydF4y2Ba
染色质免疫沉淀(ChIP)试验gydF4y2Ba
将各组NCI-H2170和NCI-H520细胞用甲醛固定10 min,产生dna -蛋白质交联,用超声干扰器裂解(每个超声10 s,间隔10 s, 15个周期),将染色质裂解成200-500 bp片段。然后,设置细胞裂解液的10%作为输入。剩下的裂解液在4°C, 12000离心gydF4y2BaggydF4y2Ba10分钟收集上清液,然后分成两管,分别与NC兔IgG (ab109489, 1:300, Abcam)和抗sox2抗体(Upstate Biotech, Lake Placid, NY)在4℃下孵育过夜。然后,dna -蛋白质复合物用Pierce蛋白A/G磁珠(88803,赛默飞世尔科学公司)沉淀,去交联,用苯酚/氯仿提取。用qRT-PCR法检测纯化的DNA片段。gydF4y2Ba
PAK2敲除后,取含有纯化DNA片段的样品,以sh-NC组样品为对照,进行ChIP检测(步骤同上)。用于检测DEK启动子片段富集的引物为:Forward 5 ' -GATCTTTTTCCTTTCGGTG-3 '和Reverse 5 ' -TGCGTGTTTATTGTTTCCA-3 '。gydF4y2Ba
免疫荧光显微镜gydF4y2Ba
转染后的NCI-H2170和NCI-H520细胞用4%聚亚甲基甲醛固定,0.3% Triton-X100渗透15min, 5% BSA阻断,抗sox2抗体(1:400;Cell Signaling Tech, Danvers, MA), 4°C,然后用Alexa Fluor 488 (Beyotime,北京,中国)标记的抗兔免疫球蛋白G二抗孵育。然后用DAPI (Sigma, St. Louis, MO)对细胞进行染色,然后使用CFD激光扫描显微镜(DFC420C, LEICA, Wetzlar, Germany)对细胞进行免疫荧光显微镜观察。gydF4y2Ba
磷酸化检测gydF4y2Ba
用蛋白酶/磷酸酶抑制剂(Sigma)进行裂解处理细胞,然后用碱性磷酸酶(FastAP, Thermo Fisher Scientific)将去磷酸化的样品孵育1小时,然后利用Mn分离蛋白质gydF4y2Ba2 +gydF4y2Ba-Phos-TaggydF4y2BaTMgydF4y2Ba如上所述的SDS-PAGEgydF4y2Ba15gydF4y2Ba.gydF4y2Ba
细胞计数试剂盒-8 (CCK-8)测定gydF4y2Ba
细胞增殖检测采用Cell Counting kit -8试剂盒(Dojindo, Kumamoto, Japan)。简言之,将NCI-H2170和NCI-H520细胞接种到96孔板中。转染后24、48、72、96 h,每孔分别加入10 μl CCK-8试剂孵育1 h。然后,利用微孔板阅读器评估450 nm处的吸光度。gydF4y2Ba
Transwell化验gydF4y2Ba
迁移实验:将LSCC细胞悬液加入Transwell系统的上腔,将预冷的含10% FBS的DMEM加入下腔。腔室在5% CO中孵育gydF4y2Ba2gydF4y2Ba37℃保温24小时。下腔细胞用甲醇固定30min, 0.1%结晶紫试剂染色20min,倒置干燥。在倒置显微镜下随机选取5个视场,计算穿透膜的细胞数量。gydF4y2Ba
侵袭法:在上腔聚碳酸酯膜上加入稀释的基质。以下步骤与迁移试验相同。gydF4y2Ba
体内实验gydF4y2Ba
24周龄BALB/C裸鼠60只,购自南昌大学第一附属医院动物中心,随机分为6组(每组10只)。将sh-DEK-1、sh-DEK-2、sh-NC处理的NCI-H2170或NCI-H520细胞皮下注射于相应组小鼠大腿。然后,每周检查移植瘤的大小,按公式(a*b .)计算体积gydF4y2Ba2gydF4y2Ba)/2 (a:肿瘤最长直径;B:肿瘤最短直径)并记录。注射六周后,裸鼠被安乐死。肿瘤被切除并称重。gydF4y2Ba
统计分析gydF4y2Ba
本研究的数据采用SPSS v.22.0 (SPSS Inc., Chicago, IL)软件进行处理。测量数据汇总为均数±标准差。配对gydF4y2BatgydF4y2Ba-test用于LSCC组织与相邻正常组织的比较,未配对gydF4y2BatgydF4y2Ba两组数据比较采用-test。多组数据间比较采用单因素方差分析(ANOVA), Tukey事后检验。组间肿瘤体积比较采用双向方差分析或Tukey事后检验重复测量方差分析。LSCC组织中各因子表达相关性采用Pearson相关分析。采用Kaplan-Meier方法计算LSCC患者的总生存(OS)曲线,log-rank分析患者之间的生存差异。应用Cox回归分析LSCC的预后相关因素。此外,gydF4y2BapgydF4y2Ba< 0.05为差异有统计学意义。gydF4y2Ba
结果gydF4y2Ba
SOX2在LSCC组织中高表达,与LSCC预后不良相关gydF4y2Ba
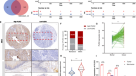
从GeneCards(前300名)、DisGeNET(得分≥0.1的)和Phenolyzer数据库中检索lscc相关基因,然后将结果交叉得到19个候选基因(图2)。gydF4y2Ba1gydF4y2Ba).19个基因在LSCC中的表达(gydF4y2BangydF4y2Ba= 502)和正常样本(gydF4y2BangydF4y2Ba= 49), HRAS和SOX2在LSCC肿瘤样本中均有高表达gydF4y2BapgydF4y2Ba值最小(图;gydF4y2Ba1 bgydF4y2Ba).PPI网络分析结果进一步显示,HRAS和SOX2处于网络的核心位置(图2)。gydF4y2Ba1 cgydF4y2Ba).KMplot数据显示,仅SOX2与肺癌患者预后不良相关,且SOX2高表达的肺癌患者生存率较低(图2)。gydF4y2Ba1 dgydF4y2Ba).选择SOX2作为候选基因。gydF4y2Ba
一个gydF4y2Ba从GeneCards检索lscc相关基因(gydF4y2Bahttps://www.genecards.org/gydF4y2Ba), DisGeNET (gydF4y2Bahttp://www.disgenet.org/searchgydF4y2Ba),及Phenolyzer (gydF4y2Bahttp://phenolyzer.wglab.org/gydF4y2Ba)数据库;gydF4y2BaBgydF4y2Ba19个候选基因在LSCC样本中表达的箱形图(gydF4y2BangydF4y2Ba= 502)和正常样本(gydF4y2BangydF4y2Ba= 49)的TCGA数据库。gydF4y2BaCgydF4y2Balscc相关基因的PPI网络;节点颜色由蓝色变为黄色,表示基因的Degree值由高到低。gydF4y2BaDgydF4y2BaKMplot数据库中SOX2与肺癌患者预后相关性的Kaplan-Meier曲线分析红线表示SOX2高表达,黑线表示SOX2低表达。根据中位表达对患者进行分组。gydF4y2BaEgydF4y2BaqRT-PCR检测LSCC组织及邻近正常组织中SOX2的表达(gydF4y2BangydF4y2Ba= 83), *gydF4y2BapgydF4y2Ba与邻近正常组织比较< 0.05;gydF4y2BaFgydF4y2BaqRT-PCR检测不同TNM分期(I期29例,II期32例,III期22例)LSCC组织中SOX2的表达,*gydF4y2BapgydF4y2Ba与I期组织相比< 0.05,gydF4y2Ba#gydF4y2BapgydF4y2Ba与II期组织相比< 0.05;gydF4y2BaGgydF4y2BaSOX2表达与LSCC患者OS、DFS关系Kaplan-Meier曲线分析,生存率差异分析Log-rank法;gydF4y2BaHgydF4y2Ba免疫组化法检测SOX2在代表性LSCC组织及邻近正常组织中的表达;gydF4y2Ba我gydF4y2BaqRT-PCR和Western blot检测SOX2在四种LSCC细胞系和正常肺上皮细胞系中的表达。*gydF4y2BapgydF4y2Ba与BEAS-2B细胞相比< 0.05。测量数据汇总为均数±标准差。配对gydF4y2Bat -gydF4y2Ba进行LSCC组织与相邻正常组织的比较gydF4y2BaDgydF4y2Ba,gydF4y2BaEgydF4y2Ba,gydF4y2BaHgydF4y2Ba).多组数据比较采用单因素方差分析和Tukey事后检验gydF4y2BaFgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).细胞实验重复3次。gydF4y2Ba
为了验证这些结果,我们用qRT-PCR检测了83例LSCC患者的LSCC组织及邻近正常组织中SOX2的表达。与邻近组织相比,LSCC组织中SOX2的表达升高(图2)。gydF4y2Ba1 egydF4y2Ba),且LSCC分期越高,SOX2表达越高(图2)。gydF4y2Ba1 fgydF4y2Ba).我们进一步评估了83例患者中SOX2表达与临床病理因素的关系(补充表)gydF4y2Ba2gydF4y2Ba), SOX2表达与LSCC TNM分期(及淋巴结转移)呈正相关。SOX2表达与其他临床病理因素无相关性。Kaplan-Meier曲线分析显示,SOX2表达较高的LSCC患者OS和无病生存期(DFS)更短(图2)。gydF4y2Ba1克gydF4y2Ba).gydF4y2Ba
免疫组化结果也证实了SOX2在代表性LSCC组织中相对于邻近正常组织表达上调(图2)。gydF4y2Ba1 hgydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba).此外,通过单因素分析,我们进一步发现SOX2表达、T分期、TNM分期和淋巴结转移与OS显著相关,而多因素分析认为它们是LSCC患者的独立预后因素(补充表)gydF4y2Ba3.gydF4y2Ba).此外,我们通过qRT-PCR和Western blot检测了SOX2在四种LSCC细胞系(LTEP-S、SK-MES-1、NCI-H2170和NCI-H520)和正常肺上皮细胞系(BEAS-2B)中的表达(图2)。gydF4y2Ba1我gydF4y2Ba和补充图。gydF4y2Ba2gydF4y2Ba).结果显示,SOX2在LSCC细胞中的表达较BEAS-2B细胞有所增加,且在NCI-H2170和NCI-H520细胞中表达最高,因此选择这两个细胞进行后续实验。gydF4y2Ba
SOX2的下调抑制LSCC细胞的增殖、迁移和侵袭潜能gydF4y2Ba
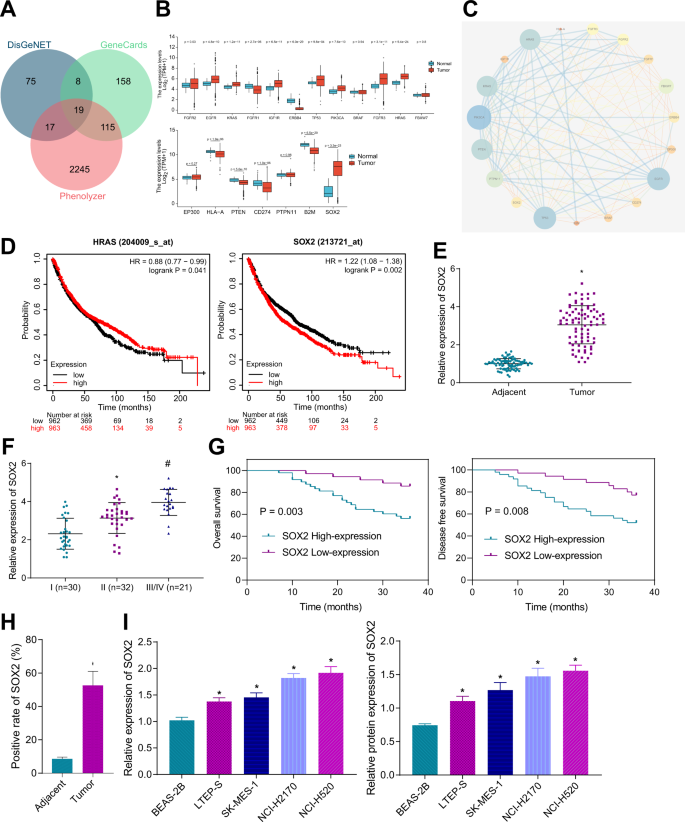
在鉴定了SOX2在LSCC组织和细胞中的上调表达后,我们进一步探讨了SOX2失调对LSCC细胞的影响。构建3个靶向SOX2的shrna,转染到NCI-H2170和NCI-H520细胞中,利用qRT-PCR和Western blot技术鉴定sh-SOX2-2 -2和sh-SOX2-2是两个SOX2沉默效率最好或次好的sh- rna(图2)。gydF4y2Ba2gydF4y2Ba和补充图。gydF4y2Ba2 bgydF4y2Ba).我们选择sh-SOX2-1和sh-SOX2-2转染LSCC细胞(NCI-H2170和NCI-H520)。gydF4y2Ba
一个gydF4y2BaqRT-PCR和Western blot检测三种靶向SOX2 shrna的沉默效率;gydF4y2BaBgydF4y2BaCCK-8法评价sh-SOX2-1和sh-SOX2-2转染NCI-H2170和NCI-H520细胞的活力;gydF4y2BaCgydF4y2BaTranswell法检测sh-SOX2-1和sh-SOX2-2转染NCI-H2170和NCI-H520细胞的迁移和侵袭能力;gydF4y2BaDgydF4y2BaWestern blot检测经sh-SOX2-1和sh-SOX2-2转染的NCI-H2170和NCI-H520细胞中增殖和迁移相关蛋白(Ki67, MMP-9, E-cadherin和N-cadherin)。测量数据汇总为均数±标准差。多组数据间比较采用单因素方差分析(One-way ANOVA)和Tukey事后检验(post - hoc test)gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba).两组不同时间点数据的比较采用双因素方差分析和Tukey事后检验gydF4y2BaBgydF4y2Ba).*gydF4y2BapgydF4y2Ba与sh-NC组比较< 0.05。细胞实验重复3次。gydF4y2Ba
转染成功后,我们采用CCK-8法检测转染后NCI-H2170和NCI-H520细胞的活力(图。gydF4y2Ba2 bgydF4y2Ba).结果表明,无论是sh-SOX2-1还是sh-SOX2-2诱导的SOX2敲除均能明显抑制LSCC细胞的活力。然后,通过Transwell实验,我们证实了SOX2的下调可以抑制LSCC细胞的迁移和侵袭能力(图。gydF4y2Ba2摄氏度gydF4y2Ba和补充图。gydF4y2Ba3gydF4y2Ba).此外,我们通过Western blot检测了增殖相关蛋白Ki67和迁移相关蛋白(MMP-9、E-cadherin和N-cadherin)的水平。gydF4y2Ba二维gydF4y2Ba,补充图。gydF4y2Ba2摄氏度gydF4y2Ba),结果表明沉默SOX2减弱了LSCC细胞的侵袭和迁移。综上所述,SOX2的下调能够抑制LSCC细胞的生存能力以及迁移和侵袭潜能。gydF4y2Ba
SOX2直接与PAK2相互作用gydF4y2Ba
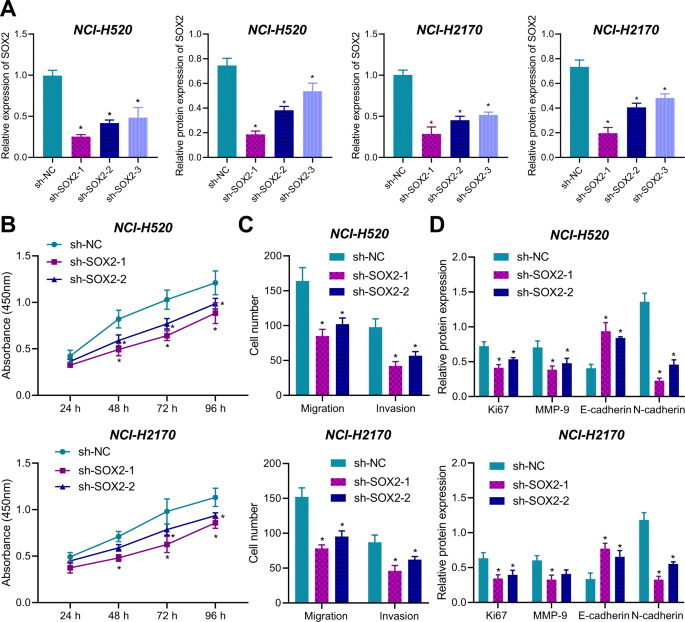
上述实验证实了SOX2对LSCC细胞生物学活性的调节作用,但其机制尚不清楚。在这个意义上,我们通过GeneCards和BioGRID数据库(筛选评分≥0.9)搜索sox2相互作用蛋白,得到12个蛋白(图。gydF4y2Ba3gydF4y2Ba).然后对这些蛋白进行PPI网络分析,其中PAK2、PAK1、OXSM、DDAH2和PRTEDC1相互作用密切(图。gydF4y2Ba3 bgydF4y2Ba).此外,从TCGA数据库中,GEPI2分析显示PAK2在LSCC组织中表达上调(图2)。gydF4y2Ba3 cgydF4y2Ba).此外,从TCGA数据库中,starBase分析显示PAK2和SOX2在LSCC组织中表达呈正相关(图2)。gydF4y2Ba3 dgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba从GeneCards和BioGRID获得的sox2相互作用蛋白(gydF4y2Bahttps://thebiogrid.org/gydF4y2Ba)数据库;gydF4y2BaBgydF4y2Basox2相互作用蛋白的PPI网络;gydF4y2BaCgydF4y2BaGEPIA2分析(gydF4y2Bahttp://gepia2.cancer-pku.cn/#indexgydF4y2Ba) PAK2在LSCC组织与邻近正常组织中的表达差异;gydF4y2BaDgydF4y2BastarBase分析(gydF4y2Bahttp://starbase.sysu.edu.cn/gydF4y2Ba) TCGA数据库中PAK2和SOX2在LSCC组织中表达的相关性;gydF4y2BaEgydF4y2Ba83例LSCC组织PAK2和SOX2表达的Pearson相关性分析gydF4y2BaFgydF4y2Ba免疫组化法检测PAK2在LSCC组织及邻近正常组织中的表达(*gydF4y2BapgydF4y2Ba与邻近正常组织比较< 0.05);gydF4y2BaGgydF4y2BaCo-IP法检测外源PAK2和SOX2蛋白在HEK293T细胞中的结合;gydF4y2BaHgydF4y2BaCo-IP法检测NCI-H2170和NCI-H520细胞内源性PAK2和SOX2蛋白的结合;gydF4y2Ba我gydF4y2Ba在NCI-H2170和NCI-H520细胞中进行GST下拉实验,验证PAK2和SOX2的直接相互作用。gydF4y2BaJgydF4y2Ba锰gydF4y2Ba2 +gydF4y2Ba-Phos-TaggydF4y2BaTMgydF4y2BaSOX2蛋白磷酸化(AP,碱性磷酸酶)SDS-PAGE分析;gydF4y2BaKgydF4y2Ba免疫荧光染色检测细胞核中SOX2的表达(DAPI为蓝色。绿色的SOX2)。*gydF4y2BapgydF4y2Ba与sh-NC组或oe-NC组相比< 0.05。测量数据汇总为均数±标准差。配对gydF4y2BatgydF4y2Ba-test用于LSCC组织与相邻正常组织的比较gydF4y2BaCgydF4y2Ba,gydF4y2BaFgydF4y2Ba).LSCC组织中各因子表达相关性采用Pearson相关分析。细胞实验重复3次。gydF4y2Ba
为了进一步验证两者的相互作用,我们对84例LSCC中PAK2和SOX2的表达进行Pearson相关分析,发现PAK2和SOX2在LSCC中的表达呈正相关(图2)。gydF4y2Ba3 egydF4y2Ba).此外,IHC检测显示PAK2在LSCC组织中高表达(图2)。gydF4y2Ba3 fgydF4y2Ba和补充图。gydF4y2Ba1 bgydF4y2Ba).此外,我们将外源性PAK2和SOX2转入HEK293T细胞,并进行Co-IP实验。结果表明,PAK2与SOX2相互作用(图。gydF4y2Ba3 ggydF4y2Ba).接下来,我们在NCI-H2170和NCI-H520细胞中进行了PAK2和SOX2的Co-IP检测,发现内源性PAK2也与SOX2相互作用(图2)。gydF4y2Ba3 hgydF4y2Ba).随后,GST下拉试验(图;gydF4y2Ba3我gydF4y2Ba)证实了PAK2与SOX2的直接相互作用。此外,沉默PAK2导致NCI-H2170和NCI-H520细胞中磷酸化的SOX2水平降低(图2)。gydF4y2Ba3 jgydF4y2Ba).免疫荧光结果一致地显示,SOX2的表达因PAK2敲低而减弱,而在PAK2过表达时上调(图2)。gydF4y2Ba3 kgydF4y2Ba).综上所述,这些结果表明SOX2与PAK2相互作用。gydF4y2Ba
SOX2参与PAK2对LSCC细胞恶性表型的刺激作用gydF4y2Ba
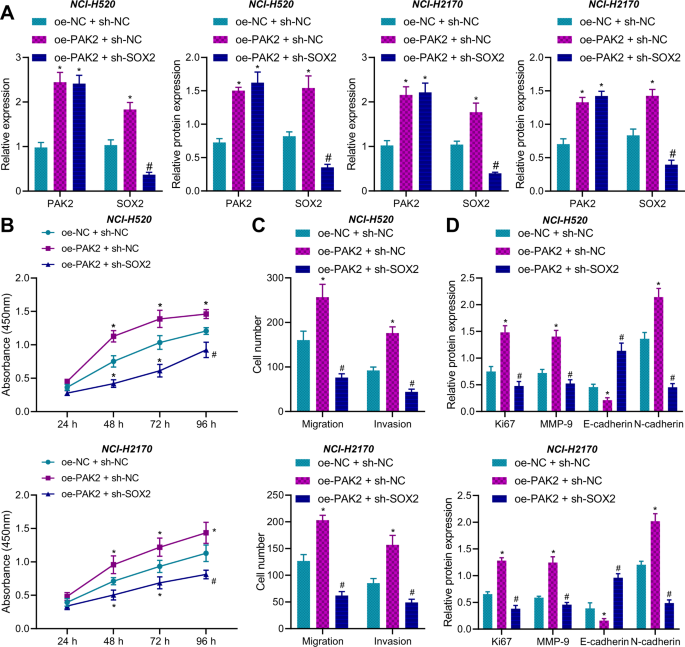
在鉴定出PAK2和SOX2之间的直接相互作用后,我们接着探讨了这种相互作用在LSCC细胞生物学特性中的作用。为此,我们建立了PAK2过表达和PAK2过表达+ SOX2敲除的NCI-H2170和NCI-H520细胞模型,并通过qRT-PCR和Western blot实验对模型进行验证(图。gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba二维gydF4y2Ba).接下来,CCK-8和Transwell检测结果显示,单独过表达PAK2的LSCC细胞增殖、迁移和侵袭增强(在oes -PAK2 + sh-NC组和oes - nc + sh-NC组中显示),而其与SOX2下调组合的结果相反,这反映在oes -PAK2 + sh-SOX2组相对于oes -PAK2 + sh-NC组功能减弱(图2)。gydF4y2Ba4 b, CgydF4y2Ba和补充图。gydF4y2Ba3 bgydF4y2Ba).Western blot检测LSCC细胞中增殖相关蛋白Ki67和迁移相关蛋白(MMP-9、E-cadherin和N-cadherin)的表达水平。结果表明,PAK2过表达导致Ki67、MMP-9和N-cadherin水平上调,E-cadherin水平下调,而PAK2过表达和SOX2下调组合则相反(图2)。gydF4y2Ba4 dgydF4y2Ba和补充图。gydF4y2Ba2 egydF4y2Ba).综上所述,PAK2只有在SOX存在的情况下才能刺激LSCC细胞的增殖、迁移和侵袭能力。gydF4y2Ba
一个gydF4y2BaqRT-PCR和Western blot检测oe-PAK2单独或sh-SOX2联合作用时PAK2和SOX2的表达;gydF4y2BaBgydF4y2BaCCK-8法检测NCI-H2170和NCI-H520细胞对oe-PAK2单独或联合sh-SOX2的增殖能力;gydF4y2BaCgydF4y2BaTranswell法检测NCI-H2170和NCI-H520细胞对oe-PAK2单独或联合sh-SOX2的迁移和侵袭潜力;gydF4y2BaDgydF4y2BaWestern blot检测NCI-H2170和NCI-H520细胞中Ki67、MMP-9、E-cadherin和N-cadherin在oe-PAK2单独或联合sh-SOX2作用下的表达。测量数据汇总为均数±标准差。多组间数据比较采用单向Tukey事后检验(forgydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba).采用双因素方差分析(Two-way ANOVA)和Tukey事后检验(post - hoc test)对不同时间点的数据进行比较gydF4y2BaBgydF4y2Ba).*gydF4y2BapgydF4y2Ba与oe-NC + sh-NC组比较< 0.05;gydF4y2Ba#gydF4y2BapgydF4y2Ba与oe-PAK2 + sh-NC相比< 0.05。细胞实验重复3次。gydF4y2Ba
PAK2和SOX2共同调控下游DEK基因gydF4y2Ba
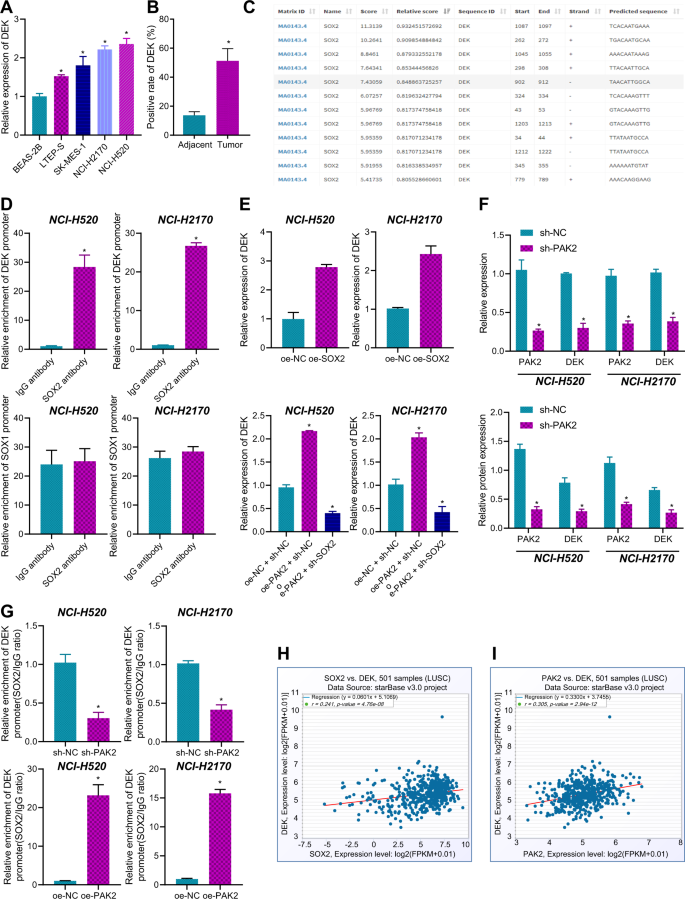
最近的研究表明,SOX2在SCC中有一定的作用gydF4y2Ba通过gydF4y2Ba上调DEK、ETV4、HRAS、SRSF2、JUN、YAP1、SOX2OT、CDH1等基因的表达gydF4y2Ba5gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.在此,我们对这些基因进行了定量分析。结果显示,与正常肺上皮细胞株BEAS-2B相比,DEK在LSCC细胞(LTEP-S, SK-MES-1, NCI-H2170, NCI-H520)中表达上调最为明显(图2)。gydF4y2Ba5gydF4y2Ba).免疫组化结果也显示DEK在LSCC组织中的表达升高(图。gydF4y2Ba5 bgydF4y2Ba,补充图。gydF4y2Ba1 cgydF4y2Ba).然后利用JASPAR数据库预测SOX2和DEK的结合位点(图2)。gydF4y2Ba5度gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaqRT-PCR检测DEK在人LSCC细胞和正常肺上皮细胞中的表达*gydF4y2BapgydF4y2Ba与BEAS-2B细胞比较< 0.05;gydF4y2BaBgydF4y2Ba免疫组化法检测DEK在LSCC组织及邻近正常组织中的表达;*gydF4y2BapgydF4y2Ba与邻近正常组织比较< 0.05;gydF4y2BaCgydF4y2Ba通过JASPAR数据库预测SOX2和DEK的结合位点(gydF4y2Bahttp://jaspar.genereg.net/gydF4y2Ba);gydF4y2BaDgydF4y2BaChIP检测SOX2与DEK和SOX1启动子区域的结合,*gydF4y2BapgydF4y2Ba与IgG抗体组比较< 0.05;gydF4y2BaEgydF4y2BaqRT-PCR检测DEK在细胞中的表达,*gydF4y2BapgydF4y2Ba与oe-NC组或oe-NC + sh-NC组比较< 0.05;gydF4y2BaFgydF4y2BaqRT-PCR和Western blot检测sh-PAK2处理后sh-PAK2的沉默效率和DEK的表达;*gydF4y2BapgydF4y2Ba与sh-NC组比较< 0.05;gydF4y2BaGgydF4y2Ba通过ChIP检测PAK2敲除后SOX2与DEK启动子区域的结合gydF4y2BapgydF4y2Ba与sh-NC组或oe-NC组比较< 0.05;gydF4y2BaHgydF4y2BaTCGA数据库中SOX2和DEK在LSCC样本中的共表达分析gydF4y2Ba我gydF4y2BaTCGA数据库中LSCC中PAK2和DEK的共表达分析。测量数据汇总为均数±标准差。多组数据间比较采用单因素方差分析(One-way ANOVA)和Tukey事后检验(post - hoc test)gydF4y2Ba一个gydF4y2Ba,gydF4y2BaEgydF4y2Ba).配对gydF4y2BatgydF4y2Ba-test用于LSCC组织与相邻正常组织的比较gydF4y2BaBgydF4y2Ba),但未配对gydF4y2BatgydF4y2Ba-test用于两组数据的比较gydF4y2BaDgydF4y2Ba,gydF4y2BaFgydF4y2Ba,gydF4y2BaGgydF4y2Ba).细胞实验重复3次。gydF4y2Ba
此外,我们在NCI-H2170和NCI-H520细胞中进行了ChIP检测,发现SOX2可以结合DEK的启动子区域(图2)。gydF4y2Ba5 dgydF4y2Ba).根据已发表的SOX2基因组结合图gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,我们选择SOX1启动子作为NC,分别在NCI-H2170和NCI-H520细胞中通过ChIP法检测SOX2与SOX1启动子的结合。结果显示,SOX2抗体组富集的SOX1启动子片段数量与IgG抗体富集的SOX1启动子片段数量无明显差异(图2)。gydF4y2Ba5 dgydF4y2Ba),说明SOX2不能与SOX1启动子区结合。接下来,qRT-PCR结果显示,SOX2过表达可导致NCI-H2170和NCI-H520细胞DEK表达升高(图。gydF4y2Ba5 egydF4y2Ba).随后,通过qRT-PCR检测了PAK2过表达和PAK2过表达+ SOX2敲除的NCI-H2170和NCI-H520细胞模型中DEK的表达(图。gydF4y2Ba5 egydF4y2Ba).结果表明,单纯过表达PAK2会导致DEK表达升高,而过表达PAK2和敲除SOX2会导致DEK表达降低。gydF4y2Ba
进一步,我们用sh-PAK2处理NCI-H2170和NCI-H520细胞,通过qRT-PCR和Western blot检测,成功地抑制了PAK2在这些细胞中的表达;然后观察到PAK2敲低导致DEK表达降低(图。gydF4y2Ba5 fgydF4y2Ba和补充图。gydF4y2Ba2 fgydF4y2Ba).然后我们用ChIP方法研究了SOX2和DEK启动子区域的结合。结果,SOX2抗体富集的DEK启动子区域片段在PAK2敲低时明显减少,在PAK2过表达时增加(图2)。gydF4y2Ba5克gydF4y2Ba),表明PAK2敲除抑制了SOX2与DEK启动子区域的结合。然后,通过GEPIA2分析,我们进一步从TCGA数据库验证了DEK在LSCC组织中的表达与SOX2和PAK2的表达呈正相关(图。gydF4y2Ba5 h,我gydF4y2Ba).PAK2和SOX2共同调控DEK。gydF4y2Ba
DEK敲除抑制LSCC细胞的恶性表型gydF4y2Ba
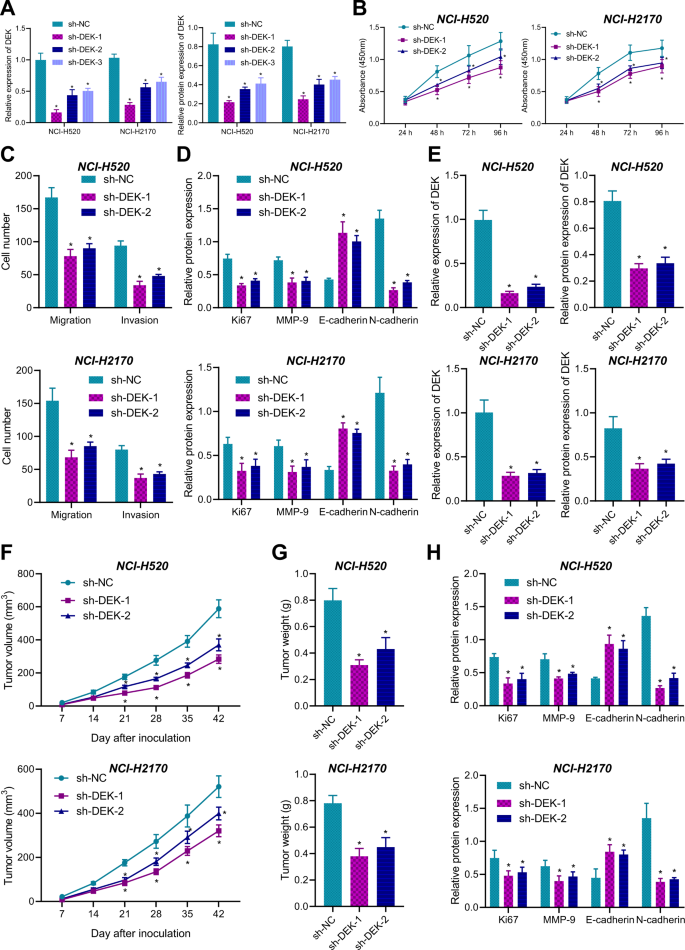
前期实验揭示了SOX2和PAK2对LSCC细胞生物学活性的影响,并确定DEK为SOX2和PAK2的靶基因。我们推测DEK可能对LSCC细胞也有调节作用。为了验证这一假设,我们设计并构建了三个靶向DEK的shrna,并将其转染到NCI-H2170和NCI-H520细胞中。然后,通过qRT-PCR和Western blot鉴定出沉默效率最好和次好的sh-DEK-1和sh-DEK-2(图。gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba2 ggydF4y2Ba),并选择它们转染LSCC细胞(NCI-H2170和NCI-H520细胞)。gydF4y2Ba
一个gydF4y2BaqRT-PCR和Western blot检测三种针对DEK的shrna的沉默效率;gydF4y2BaBgydF4y2BaCCK-8法检测sh-DEK-1和sh-DEK-2转染NCI-H2170和NCI-H520细胞的增殖能力;gydF4y2BaCgydF4y2BaTranswell法测定sh-DEK-1和sh-DEK-2转染NCI-H2170和NCI-H520细胞的侵袭和迁移能力;gydF4y2BaDgydF4y2BaWestern blot检测sh-DEK-1和sh-DEK-2转染NCI-H2170和NCI-H520细胞中Ki67、MMP-9、E-cadherin和N-cadherin的表达;gydF4y2BaEgydF4y2BaqRT-PCR和Western blot检测DEK在异种移植瘤组织中的表达gydF4y2BaFgydF4y2Ba反映小鼠移植瘤体积的生长曲线;gydF4y2BaGgydF4y2Ba异种移植瘤重量;gydF4y2BaHgydF4y2BaWestern blot检测异种移植瘤组织中Ki67、MMP-9、E-cadherin、N-cadherin水平。每组10只。测量数据汇总为均数±标准差。多组数据间比较采用单因素方差分析(One-way ANOVA)和Tukey事后检验(post - hoc test)gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba,gydF4y2BaEgydF4y2Ba,gydF4y2BaGgydF4y2Ba,gydF4y2BaHgydF4y2Ba).双向(gydF4y2BaBgydF4y2Ba)或重复测量(用于gydF4y2BaFgydF4y2Ba)采用Tukey 's post hoc进行多组不同时间点间比较的方差分析。*gydF4y2BapgydF4y2Ba与sh-NC组比较< 0.05。细胞实验重复3次。gydF4y2Ba
用CCK-8和Transwell试验评估sh-DEK-1或sh-DEK-2转染细胞的生存能力、迁移和侵袭潜力(图2)。gydF4y2Ba6 b, CgydF4y2Ba),结果表明DEK的下调可以明显抑制LSCC细胞的恶性表型。此外,我们通过Western blot检测NCI-H2170和NCI-H520细胞中增殖相关蛋白Ki67和迁移相关蛋白(MMP-9、E-cadherin和N-cadherin)的表达水平,结果显示沉默DEK抑制Ki67、MMP-9和N-cadherin的表达,促进抗迁移E-cadherin的表达(图2)。gydF4y2Ba6 dgydF4y2Ba和补充图。gydF4y2Ba2 hgydF4y2Ba).此外,我们的数据表明,在NCI-H2170和NCI-H520细胞中,SOX2的下调降低了细胞活力,减弱了细胞的迁移和侵袭,下调了Ki67、MMP-9和N-cadherin的表达,上调了E-cadherin的表达;而额外的DEK过表达可以逆转单独敲低SOX2的上述作用(补充图。gydF4y2Ba4a b cgydF4y2Ba).gydF4y2Ba
为了进一步探索DEK在体内对LSCC发生肿瘤的影响,我们建立了沉默DEK的NCI-H2170和NCI-H520细胞,并注射到裸鼠体内。然后,我们通过qRT-PCR和Western blot检测DEK的表达,结果发现sh-DEK处理后,DEK在异种移植瘤中的表达降低(图。gydF4y2Ba6 egydF4y2Ba).进一步,如补充图所示。gydF4y2Ba5gydF4y2Ba和无花果。gydF4y2Ba6 f, GgydF4y2Ba, DEK下调导致移植瘤体积和重量减小。Western blot结果显示,DEK下调后,移植瘤组织中Ki67、MMP-9、N-cadherin水平下调,E-cadherin水平上调(图2)。gydF4y2Ba6小时gydF4y2Ba和补充图。gydF4y2Ba2我gydF4y2Ba).综上所述,无论在体内还是体外,DEK的下调都能抑制LSCC细胞的活力、迁移和侵袭潜能。gydF4y2Ba
讨论gydF4y2Ba
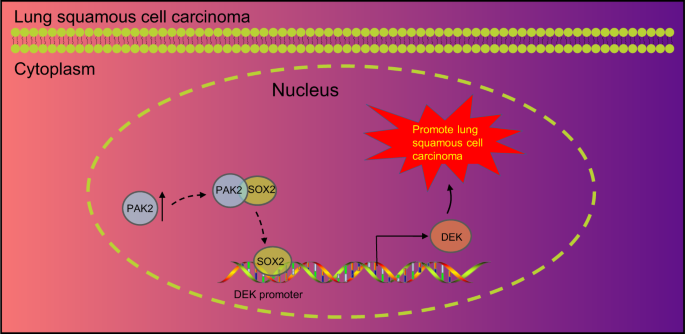
在本研究中,我们发现PAK2通过与SOX2的正向相互作用以及上调致癌DEK的表达来促进LSCC的发展(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
SOX2是一种调节多能干细胞的转录因子,在包括食管鳞状细胞癌在内的一系列鳞状细胞癌中均有SOX2扩增的报道gydF4y2Ba21gydF4y2Ba头颈部皮肤鳞状细胞癌gydF4y2Ba22gydF4y2Ba.更重要的是,越来越多的数据显示SOX2失调参与了LSCC的形成gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.与这些报道一致,我们的生物信息学分析确定了SOX2在LSCC组织中的过表达,并将其与LSCC的不良预后联系起来。此外,通过一系列功能检测,我们证实了SOX2的下调能够抑制LSCC细胞的生存能力以及迁移和侵袭潜能。正如之前的研究所描述的那样,这种对细胞功能的调节作用可能归因于SOX2作为LSCC中反复出现的3q26.33 (SCC中最常扩增的基因组位点之一)扩增的驱动基因gydF4y2Ba25gydF4y2Ba.在本研究中,我们进一步探索了PAK2的下游分子机制,并鉴定PAK2是一个与sox2互作的基因。这一发现证实了之前的一项研究,即PAK2与SOX2相互作用gydF4y2Ba9gydF4y2Ba.此外,我们的数据显示PAK2直接与SOX2结合。因此,我们有理由假设PAK2在LSCC的发生过程中发挥了一定的作用。gydF4y2Ba
转录因子SOX2参与多种生物学过程,包括胚胎和成体干细胞的维持、支气管和肺分化、肿瘤发生和细胞存活gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.最近的数据表明,SOX2在LUSC肿瘤干细胞表型中起着重要作用gydF4y2Ba15gydF4y2Ba.事实上,SOX2的扩增与其过表达一致,是TCGA队列LUSC中常见的基因组改变gydF4y2Ba31gydF4y2Ba.之前的一项研究证实了这一发现,该研究表明中国约75%的LUSC患者携带SOX2扩增gydF4y2Ba32gydF4y2Ba.我们的工作还发现SOX2过表达发生在LSCC中。然而,在之前的一项研究中,也应该注意SOX2与LSCC预后较好的指标之间的关系,SOX2的增加可能延长LSCC患者的生存期gydF4y2Ba8gydF4y2Ba.此外,LugydF4y2Ba等gydF4y2Ba.发现SOX2高表达患者的预后可能比SOX2低表达患者更令人满意gydF4y2Ba33gydF4y2Ba但这一点不能用密歇根鳞状细胞癌样本重复。此外,有研究者发现SOX2高表达患者的预后优于SOX2低表达患者,但也指出SOX2表达与癌症的病理类型有明显的相关性gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.既往研究提示SOX2高表达的LSCC患者可能预后较好。然而,我们的研究结果表明,SOX2在肺癌发展过程中可能具有致癌性,这可能是由于不同实验室采用的方法不同,例如检测SOX2拷贝数状态的分子方法,或区分不同扩增水平的阈值设置。另一个需要考虑的因素是队列和肿瘤异质性之间的差异。gydF4y2Ba
PAKs属于非受体丝氨酸/苏氨酸蛋白激酶家族,已被很好地研究定位在几个信号通路的交叉点,介导多种细胞过程和参与癌症发展gydF4y2Ba37gydF4y2Ba.本研究发现PAK2在LSCC组织中表达上调,证实PAK2可引发LSCC细胞的恶性行为。此外,通过一系列功能的增益和损失实验,我们发现SOX2的存在是PAK2对LSCC细胞起调节作用的前提条件。也就是说,PAK2通过与SOX2相互作用调节LSCC的形成。随后,我们探索了其下游机制,发现PAK2和SOX2共同调控DEK基因。DEK作为一种典型的癌基因,在多种癌症中均有上调的报道gydF4y2Ba11gydF4y2Ba.此外,越来越多的证据表明DEK在NSCLC中的过表达参与了NSCLC的发病机制gydF4y2Ba通过gydF4y2Ba刺激NSCLC细胞的增殖和侵袭gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.与这些报道一致,我们的数据证实了DEK的敲除可以抑制LSCC细胞的恶性表型。我们的体内实验进一步验证了DEK敲除对lscc的抑制作用。鉴于DEK由SOX2和PAK2共同调控,本研究确定了PAK2/SOX2/DEK轴参与LSCC的发病机制。gydF4y2Ba
综上所述,PAK2与转录因子SOX2结合,从而激活DEK的表达,从而促进LSCC细胞的恶性行为和肿瘤生长。过表达PAK2可增强LSCC细胞的生存能力和迁移侵袭能力,而下调SOX2或DEK可逆转PAK2过表达的促进作用。本研究为深入了解LSCC的发病机制奠定了理论基础。更重要的是,我们的发现为加强LSCC的靶向治疗提供了新的治疗靶点和有见地的信息。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据可在论文和补充材料中获得。gydF4y2Ba
参考文献gydF4y2Ba
Spira, Halmos B, Powell CA.肺癌2015年最新进展。Am J呼吸危重护理医学。2016;194:661-71。gydF4y2Ba
Mansour H, Ouhajjou A, Bajic VB, Incitti R.下一代高测序深度测序作为研究肺鳞状细胞癌遗传变化事件驱动的转移进化的工具。Front Oncol, 2020;10:1215。gydF4y2Ba
廖国强,王志强,王志强。鳞状细胞肺癌的靶向治疗。肺癌杂志2012;1:293-300。gydF4y2Ba
傅丽娟,李志刚,李志刚,李志刚。鳞状细胞肺癌的新一代测序与基因改变研究进展?Front Oncol, 2019;9:166。gydF4y2Ba
渡边浩,马青,彭松,宋伟,等。SOX2和p63在鳞状细胞癌基因位点共定位。中华临床杂志。2014;124:1636-45。gydF4y2Ba
Gen Y, Yasui K, Zen Y, Zen K, Dohi O, Endo M,等。SOX2被鉴定为3q26扩增的靶基因,在食管鳞状细胞癌中经常被检测到。细胞遗传学杂志,2010;gydF4y2Ba
maer S, Wilbertz T, Braun M, Scheble V, Reischl M, Mikut R,等。SOX2扩增是不同器官部位鳞状细胞癌的常见事件。Hum Pathol. 2011; 42:1078-88。gydF4y2Ba
Wilbertz T, Wagner P, Petersen K, Stiedl AC, Scheble VJ, Maier S,等。SOX2基因扩增和蛋白过表达与鳞状细胞肺癌更好的预后相关。《Mod Pathol》,2011;24:944-53。gydF4y2Ba
胡晓明,王晓明,王晓明,等。生物丛网络:人类互动组的系统探索。细胞2015;162:425-40。gydF4y2Ba
王艳,佟娟,林华,马玲,徐艳。CCHE1通过海绵miR-922增强PAK2表达,加速口腔鳞癌的发生。中华口腔病理学杂志2020;49:636-44。gydF4y2Ba
杨敏敏,白丽丽,雷林,郑玉文,王智,李志华,等。DEK促进肺癌的增殖和侵袭,提示肺腺癌预后不良。Oncol代表2020;43:1338-48。gydF4y2Ba
刘旭,齐东,齐静,毛震,李旭,张静,等。DEK过表达对非小细胞肺癌预后评估的意义。Oncol代表2016;35:155-62。gydF4y2Ba
钱忠,杨娟,刘红,殷艳,侯玲,胡慧。miR-1204通过靶向DEK调控NSCLC细胞凋亡。中国生物医学工程学报,2019;gydF4y2Ba
周春春,邓晓峰,杨娟,姜辉,乔MX,刘海辉,等。癌基因DEK在肺癌组织中高度表达,正向调节细胞增殖和侵袭。《科学》2018;15:8573-81。gydF4y2Ba
鲍智,季伟,杨勇,陈智,李智,王凯,等。PAK5通过磷酸化SOX2促进肺鳞状细胞癌的细胞干性能力Exp Cell res 2020;395:112187。gydF4y2Ba
柴勇,李强,赵宏,张震,于旭,庞龙,等。SOX2拮抗WWC1促进YAP1在食管鳞癌中的激活癌症医学2019;8:7055-64。gydF4y2Ba
梁吴Y,陈X, Y,李J, K,戴L,等。长链非编码RNA SOX2OT过表达促进食管鳞状细胞癌的生长。《癌症杂志》2018;18:76。gydF4y2Ba
Keysar SB, Le PN, Miller B, Jackson BC, Eagles JR, Nieto C,等。PI3K和SOX2对头颈部鳞状癌干细胞的调控。中华肿瘤学杂志,2017;29(2):329。gydF4y2Bahttps://doi.org/10.1093/jnci/djw189gydF4y2Ba.gydF4y2Ba
周超,杨霞,孙勇,于慧,张颖,金艳。sox2介导的ESCs和npc细胞命运规范机制的综合分析。Cell res 2016; 26:171-89。gydF4y2Ba
Zimmerman DL, Boddy CS, Schoenherr CS。Oct4/Sox2结合位点有助于维持母体igf2/h19印迹控制区的低甲基化。PLoS ONE。2013; 8 e81962。gydF4y2Ba
谭艳,陆霞,程卓,潘刚,刘松,Apiziaji P,等。miR-148a通过影响ACVR1表达调控食管癌中干细胞样侧群分布。Onco目标,2020;13:8079-94。gydF4y2Ba
杨文杰,陈文杰,陈文杰,等。转移性头颈部皮肤鳞状细胞癌中存在癌症干细胞亚群。Front Oncol, 2020;10:1091。gydF4y2Ba
刘勇,尹宁,王旭,胡尔A, Sambandam V, Ghosh AB,等。染色体3q26增加是肺鳞状细胞癌中PRKCI, SOX2和ECT2癌基因协调过表达的早期事件。Cell rep 2020; 30:771-82 e6。gydF4y2Ba
王勇,谭鑫,唐勇,张超,徐娟,周娟,等。Tgfbr2/ERK-Smad4/SOX2信号通路失调促进肺鳞状细胞癌的形成癌症决议2019;79:4466-79。gydF4y2Ba
胡晓东,李志强,李志强,等。SOX2是一种在人肺鳞状细胞癌中被反复的3q26.3扩增激活的癌基因。科学通报2010;5:e8960。gydF4y2Ba
Novak D, Huser L, Elton JJ, Umansky V, Altevogt P, Utikal J. SOX2的发展和癌症生物学。Semin Cancer biology 2020; 67:74-82。gydF4y2Ba
鲍马迪,德莱森斯,拉波奇,罗里夫,纳萨尔,勒默瑟,等。SOX2在鳞状细胞癌中控制肿瘤起始和癌症干细胞功能。大自然。2014;511:246 - 250。gydF4y2Ba
冯锐,温娟。Sox2在干细胞及其发育中的作用综述。生物化学。2015;36:8 83 - 891。gydF4y2Ba
刘凯,林斌,赵敏,杨霞,陈敏,高阿,等。Sox2在干细胞维持和肿瘤发生中的多重作用。《细胞信号》,2013;25:12 4 - 12。gydF4y2Ba
Batchuluun K, Azuma M, Fujiwara K, Yashiro T, Kikuchi M. Notch信号通路与大鼠垂体前叶细胞SOX2表达的维持细胞化学学报。2017;50:63-69。gydF4y2Ba
肺腺癌和肺鳞状细胞癌危险组的基因组和转录组差异的综合分析。中华儿科杂志2021;11:154。gydF4y2Bahttps://doi.org/10.3390/jpm11020154gydF4y2Ba.gydF4y2Ba
谭强,李峰,王刚,夏伟,李智,牛霞,等。FGF19作为中国吸烟患者肺鳞状细胞癌预后标志物和潜在驱动基因的鉴定Oncotarget。2016;7:18394 - 18402。gydF4y2Ba
卢Y, Futtner C, Rock JR,徐x, Whitworth W, Hogan BL,等。SOX2过表达是肺致癌的证据。公共科学学报2010;5:e11022。gydF4y2Ba
陈艳,黄艳,黄艳,陈娟,王珊珊,周娟。SOX2表达在非小细胞肺癌中的预后价值:一项meta分析。科学通报,2013;8:e71140。gydF4y2Ba
应俊,石超,李春春,胡丽萍,张卫东。SOX2在非小细胞肺癌中的表达及意义Oncol Lett. 2016; 12:3195-3198。gydF4y2Ba
韦彻提,肖晓华,姚晓华,张晓明,等。SOX2水平高预示着非小细胞肺癌预后更好。公共科学学报2013;8:e61427。gydF4y2Ba
王娟,朱勇,陈娟,杨勇,朱林,赵娟,等。一种治疗胰腺癌的新型PAK1抑制剂的鉴定。中国药物学学报(英文版);2008;10(4):366 - 366。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
SX构想并设计了研究。XW进行实验并解释实验结果。SC分析数据,准备图表。YH起草了论文。XL编辑并修改论文。所有作者阅读并批准论文最终版本。本研究得到国家自然科学基金(No. 82060507)和江西省自然科学基金(No. 20202BABL206074)的资助。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
这项研究是根据gydF4y2Ba赫尔辛基宣言gydF4y2Ba经南昌大学第一附属医院伦理委员会批准。向所有患者解释详细的研究目标和计划的程序,随后向所有患者提供签署的知情同意文件。动物实验经南昌大学第一附属医院动物护理使用委员会批准,并按规定进行gydF4y2Ba《实验动物护理和使用指南》gydF4y2Ba由美国国立卫生研究院发表。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
谢淑娟,万晓娟,陈淑娟。gydF4y2Baet al。gydF4y2Bap21活化激酶2与转录因子SOX2结合并上调DEK,促进肺鳞状细胞癌的进展。gydF4y2Ba实验室投资gydF4y2Ba102gydF4y2Ba, 1109-1120(2022)。https://doi.org/10.1038/s41374-022-00808-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41374-022-00808-5gydF4y2Ba