摘要
近年来的研究表明,高血糖是心血管疾病(CVD)发生和加重的主要危险因素。然而,糖尿病性心肌病(DCM)的分子机制尚未完全阐明。在本研究中,我们着重探讨了DCM的潜在机制。在我们的研究中,瘦素受体缺陷db/db小鼠被用来建立2型糖尿病(T2DM)模型。WT小鼠和db/db小鼠给予4-苯基丁酸(4- pba) (25 mg/kg/d)和生理盐水,每隔一天腹腔注射一次,连续4周。WT和db/db小鼠6 ~ 8周龄尾静脉注射rAAV9-Sh-MAPK10和rAAV9-Sh-GFP 100 μL。采用超声心动图检测心功能,组织学检查评估心室肥厚和纤维化。采用定量RT-qPCR检测Jun n -末端激酶3 (JNK3, MAPK10)、心房钠素(ANF)、脑钠肽(BNP)、I型和III型胶原蛋白的mRNA表达。采用免疫印迹法检测心肌肥厚相关蛋白、纤维化相关蛋白、内质网应激(ERS)相关蛋白和凋亡相关蛋白水平。TUNEL染色检测心肌细胞凋亡情况。 In contrast to 12-week-old db/db mice, 16-week-old db/db mice showed the most severe myocardial dysfunction. The DCM induced by hyperglycemia was largely alleviated by 4-PBA (25 mg/kg/day, intraperitoneal injection). Similarly, tail vein injection of rAAV9-Sh-MAPK10 reversed the phenotype of the heart in db/db mice including cardiac hypertrophy and apoptosis in db/db mice. The mechanistic findings suggested that hyperglycemia initiated the ERS response through the negative regulation of sirtuin 1 (SIRT1), leading to the occurrence of myocardial dysfunction, and specific knockdown of MAPK10 in the heart directly reversed myocardial dysfunction induced by hyperglycemia. We demonstrated that hyperglycemia promotes DCM in db/db mice through the ERS-MAPK10 signaling pathway in diabetic mice.
简介
糖尿病的病例在世界范围内急剧增加,糖尿病已逐渐被证明是心血管疾病(CVD)发展和恶化的主要危险因素。1,2,3..糖尿病心肌病(DCM)独立于心外膜冠状动脉疾病、高血压和瓣膜病,表现为纵向心肌功能障碍恶化,主要表现为心肌肥厚4,5,6.心肌细胞体积增大,心室壁变厚,以克服心室壁应力,维持心脏在应对压力过载增加和病理刺激时的功能和效率;这个过程被定义为心脏肥厚7.心脏肥厚被分为生理性或病理性心肌肥厚,这些形式似乎取决于置于心脏上的有害刺激的类型、持续时间和大小8.病理性心脏肥厚和心室舒张功能障碍最终将发展为严重的心血管疾病,包括心力衰竭、心律失常和死亡9.
内质网(ER)功能的扰动被称为内质网应激(ERS),它导致内质网中未折叠和错误折叠蛋白质的积累,并触发未折叠蛋白质反应(UPR)。10.大量研究表明,糖尿病模型中UPR通路相关蛋白PERK、激活转录因子6、p-EIf2、CHOP、激活转录因子4 (ATF4)、IRE1α等在心脏中表达上调11,12,13.当ERS延长或严重时,它诱导细胞凋亡以消除不健康的细胞,并有助于心脏肥厚12,14.研究表明,c-Jun nh2末端激酶(JNK)通路参与生存信号、细胞死亡、癌症和糖尿病15.然而,DCM的发生机制尚不明确,阐明高血糖诱发DCM的发生机制对于糖尿病患者不良心血管事件的治疗至关重要。
本研究探讨了db/db小鼠在不同时间点的心肌功能。我们还观察了ERS抑制剂4-PBA治疗后db/db小鼠心肌功能障碍的减弱。此外,我们发现心肌特异性敲除MAPK10可逆转糖尿病小鼠的心肌功能障碍。我们的研究结果表明,MAPK10是高血糖诱导的心脏重塑的关键分子。
材料与方法
伦理声明,动物和治疗
6 - 8周大的雄性小鼠,包括野生型(WT)和BKS-Leprem2Cd479/Gpt (db/db)小鼠,购自GemPharmatech Co. Ltd.。所有小鼠在大连医科大学小鼠屏障设施中饲养,光照/暗循环12 h,免费提供正常饮食和水。我们每周用血糖仪(PHI8080005)(北京,中国)使用葡萄糖氧化酶法和葡萄糖条(DP0LM3F03A)(北京,中国)测量血糖。在12周龄时,WT和db/db小鼠腹腔注射4-苯基丁酸(4-PBA) (HY-AO281) (25 mg/kg/天),该药物从MedChemExpress (Monmouth Junction, NJ, USA)购买,或每隔一天注射等量的生理盐水,直至心脏取出。在WT和db/db小鼠6-8周龄时注射表达绿色荧光蛋白(rAAV9- gfp)或丝裂原活化蛋白激酶(MAPK) 10-特异性短发夹RNA (rAAV9- sh - mapk10)的rAAV9病毒,这些病毒由汉生物(中国上海)根据制造商的方案生产。所有的动物实验均符合大连医科大学动物护理与使用委员会的指导方针,该委员会批准了所有的方案。
超声心动图
经胸超声心动图使用Vevo 1100高分辨率成像系统(Visual sonic, Inc, Toronto, Ontario, Canada)进行测量16.左室(LV)射血分数(EF)和分数缩短(FS)通过胸骨旁短轴m型成像测定,并从三个心动周期取平均值16.从心尖4腔位观察二尖瓣流入的脉冲波多普勒图像用于确定透射E/A比,这是左室舒张参数的一个指标17.
RNA提取及实时聚合酶链反应(RT-PCR)
用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)从小鼠心脏中提取总RNA。利用RT试剂盒(MedChemExpress, Monmouth Junction, NJ, USA)将RNA (1 μg)反转录为cDNA,随后将cDNA作为定量RT - pcr的模板。采用SYBR Green qPCR试剂(MedChemExpress, Monmouth Junction, NJ, USA)进行定量RT-PCR, β-actin作为内对照。采用以下引物进行PCR分析。ANF:正向5 ' -CTG GGA CCC CTC CGA TAG AT-3 ',反向5 ' -TTC GGT ACC GAA GCT GTT G-3 ';BNP,正向5 ' -TTT GGG CTG TAA CGC ACT GA-3 ',反向5 ' -CAC TTC AAA GGT GGT GGT GGT GGT CCC AGA-3 ';I型胶原蛋白:正向5 ' -CCT CAG GGT ATT GCT GGA CAA C-3 ',反向5 ' -CAG AAG GAC CTT GTT TGC CAG G-3 ';III型胶原蛋白:正向5 ' -TGA CTG TCC CAC GTA AGC AC-3 ',反向5 ' -GAG GGC CAT AGC TGA ACT GA ';MAPK10:正向5 ' -AGG TGG ACA ACC AGT TCT ACA-3 ',反向5 ' -GCA CAG ACT ATT CCC TGA gc -3 ', β-actin:正向5 ' -ACT GCC GCA TCC TCT TCC T-3 ',反向5 ' -TCA ACG TCA CAC TTC ATG ATG ATG GA-3 '和III型胶原:正向5 ' -AAA TTC TGC CAC CCC GAA CT-3 ',反向:5 ' -CCA GTG CTT ACG TGG GAC AGT-3 '。
Western blot分析
利用RIPA缓冲液从快速冷冻的心脏组织中提取蛋白质(Solarbio科技有限公司,北京,中国)。采用10% SDS-PAGE凝胶电泳分离蛋白质,将蛋白质转移到聚偏氟乙烯膜上,与相应抗体在4℃下孵育1-2天。抗IRE1α抗体(#3364EA39)购自Invitrogen公司(Carlsbad, CA, USA)。抗sirtuin 1 (SIRT1) (#13161-1-AP)、Caspase 3 (#19677-1-AP)、Bcl2 (#26593-1-AP)、Bax (#50599-1-AP)和β-Tubulin (#10094-1-AP)的抗体购自Proteintech Group (Rosemont, USA)。抗转化生长因子-β1 (TGF-β1) (#3711 S)、CHOP (#P35638)、pERK1/2 (#P27361)和ERK1/2 (#P28482)的抗体购自Cell Signaling Technology (Boston, MA, USA)。抗ATF4抗体(#ab23760)和MAPK10抗体(#ab126591)购自Abcam (London, England)。然后,将膜与辣根过氧化物酶偶联二抗(1:3000-1:5000)在室温下孵育至少1小时。所有印迹均使用ECL Plus化学发光系统开发,并用Gel-Pro 4.5分析仪(Media Cybernetics, USA)分析信号强度。
组织病理学分析
小鼠被安乐死,并通过左心室注入生理盐水。心脏被取出并称重,胫骨的长度也被测量。心脏上部2/3用4%多聚甲醛固定~48 h,石蜡包埋,4 μm切片。心室切片用苏木精和伊红染色(H&E) (G1120;Solarbio,北京,中国),马松三色(G1340;Solarbio, Beijing, China)和罗丹明标记的小麦胚芽凝集素(WGA) (1.25 mg/mL;ZD0510,矢量实验室,伯林盖姆,CA,美国)。病理学家以双盲方式评估了在×100倍率下拍摄的马森三色染色心室切片图像,并使用1100万像素CCD相机(Olympus-SIS, Shinjuku, Tokyo, Japan)进行了分析。阳性区域用NIH Image 1.61软件进行定量。
TUNEL分析
根据制造商的说明,使用tdt介导的dUTP缺口末端标记(TUNEL)系统(Roche, Mannheim, Germany)评估心脏切片中的心肌细胞凋亡。心肌细胞首先用α-肌动蛋白(6487 T)免疫组化染色鉴定,α-肌动蛋白购自Cell Signaling Technology (Boston, MA, USA)。然后心肌细胞用TUNEL染色染料染色,细胞核用DAPI反染。在显微镜下每切片10个野内计数tunel -阳性心肌细胞数量,并测定tunel -阳性心肌细胞百分比。
统计分析
结果以均数±标准差(SD)表示。GraphPad Prism 8软件采用双因素方差分析分析组间差异p值< 0.05为有统计学意义。
结果
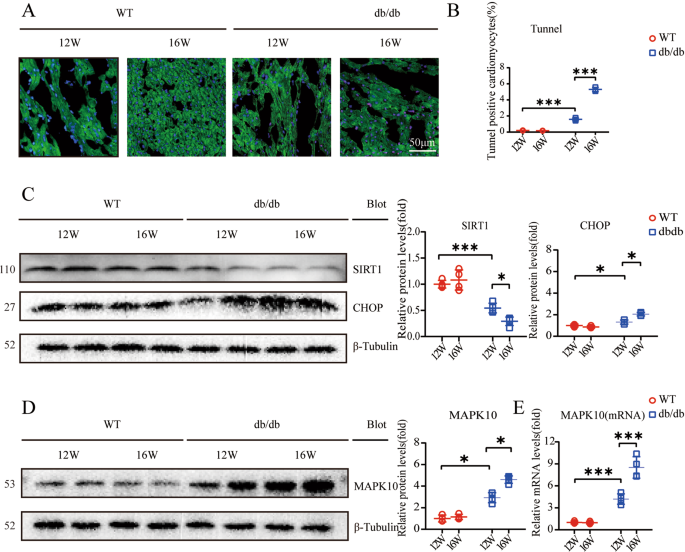
高血糖可导致db/db小鼠心肌肥厚和舒张功能障碍
为了探讨高血糖是否导致心肌功能障碍,我们首先进行了超声心动图检查,超声心动图评估显示左室收缩功能增加,主要表现为EF%和FS%的增加。16周大的db/db小鼠与12周大的db/db小鼠相比,心脏收缩力略有增加,因为12周大的db/db小鼠已经显示出心脏收缩力的广泛增加(图2)。1 a, B).此外,与12周龄db/db小鼠相比,16周龄db/db小鼠的心脏重量/胫骨长度(HW/TL)比例略有增加(图2)。1 c, D).同样,与WT小鼠相比,db/db小鼠的心肌细胞横截面积显著增加,16周龄db/db小鼠比12周龄db/db小鼠大(图2)。1 e, F).此外,db/db小鼠的心室舒张功能指标,即透射E/A比下降,特别是16周龄db/db小鼠的E/A比最低(图2)。1 h,我).肥厚相关基因,包括心房钠素(ANF)和脑钠肽(BNP),在db/db小鼠中表达水平升高,尤其是在16周龄db/db小鼠中(图2)。1克).心肌纤维化表现为纤维化相关基因的上调,包括TGF-β1下游的I型胶原和III型胶原,以及间质纤维化面积分数的显著增加(图1)。1 j-l).
一个左室m型超声心动图;B测量12周龄和16周龄小鼠的射血分数(EF%)和分数缩短(FS%) (n= 4);C12周龄和16周龄小鼠心脏切片(左)苏木精和伊红(H&E)染色;D心脏重量与胫骨长度(HW/TL)比值(n= 4);E,Ftritc标记的小麦胚芽凝集素(WGA)心脏切片染色和心肌细胞横截面积定量(每颗心脏计数200个细胞,n= 4) 12周龄和16周龄小鼠;G实时定量聚合酶链式反应(PCR)分析12周龄和16周龄小鼠心房利钠因子(ANF)和脑利钠肽(BNP)肥厚基因(n= 4);H,我12周龄和16周龄小鼠尖顶4室二尖瓣流入的脉冲波多普勒图像(左)及E/A比值计算(n= 4);J而且K心脏间质纤维化的马松三色染色及纤维化面积的定量(n= 4);l小鼠心脏间质纤维化相关基因(I型胶原和III型胶原)相对mRNA水平(n= 4)。
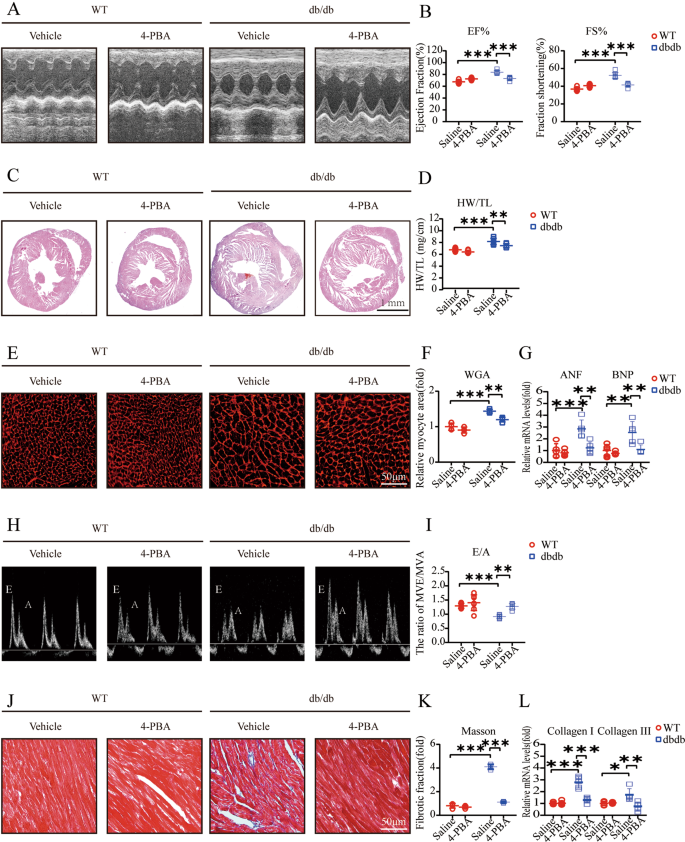
PBA逆转高血糖诱导的db/db小鼠心肌肥厚和舒张功能障碍
高血糖可诱发ERS反应18以及心肌细胞凋亡19.CHOP作为调节ERS的重要因子,在16周龄db/db小鼠中明显上调,且相对于12周龄db/db小鼠较高(图2)。2摄氏度).此外,TUNEL染色显示凋亡阳性比例增加(图。2 a, B).此外,先前有报道称高血糖会抑制SIRT1的表达20., SIRT1缺陷加剧ers相关的CVD21.在我们的研究中,我们发现SIRT1表达下降,特别是在16周大的db/db小鼠中(图2)。2摄氏度).此外,MAPK10蛋白和mRNA表达增加(图。2 d, F).4-PBA是ERS的抑制剂22.为了探讨4-PBA是否能缓解db/db小鼠的心功能障碍,WT和db/db小鼠从12周龄开始腹腔注射4-PBA (25 mg/kg/天)。研究表明,4-PBA改善心肌收缩能力,维持相对较低水平的EF%和FS%(图。3 a, B).此外,包括HW/TL比、心肌细胞横截面积以及ANF和BNP mRNA表达水平在内的肥大标志物显著降低(图。3 c g).4-PBA处理后,db/db小鼠的透射E/A比值升高(图2)。3 h,我).马尾松染色显示纤维化部分减少,定量RT-PCR显示给药后纤维化基因表达下调(图4-PBA)。3 j-l).
一个左室m型超声心动图;B射血分数(EF%)及分数缩短(FS%)的测量(n= 7);C心脏切片苏木精和伊红(H&E)染色(左);D心脏重量与胫骨长度(HW/TL)比值(n= 7);E,Ftritc标记的小麦胚芽凝集素(WGA)心脏切片染色(左)和心肌细胞横截面积定量(每颗心脏计数200个细胞,n= 7);G房利钠因子(ANF)、脑利钠肽(BNP)等增生性基因实时定量聚合酶链反应分析(n= 7);H,我尖尖4腔二尖瓣流入的脉冲波多普勒图像及E/A比值WT和db/db (n= 7);J,K心脏间质纤维化的马松三色染色。纤维化区域的定量(n= 7);l小鼠心脏间质纤维化相关基因(I型胶原和III型胶原)的相对mRNA水平(n= 7)。
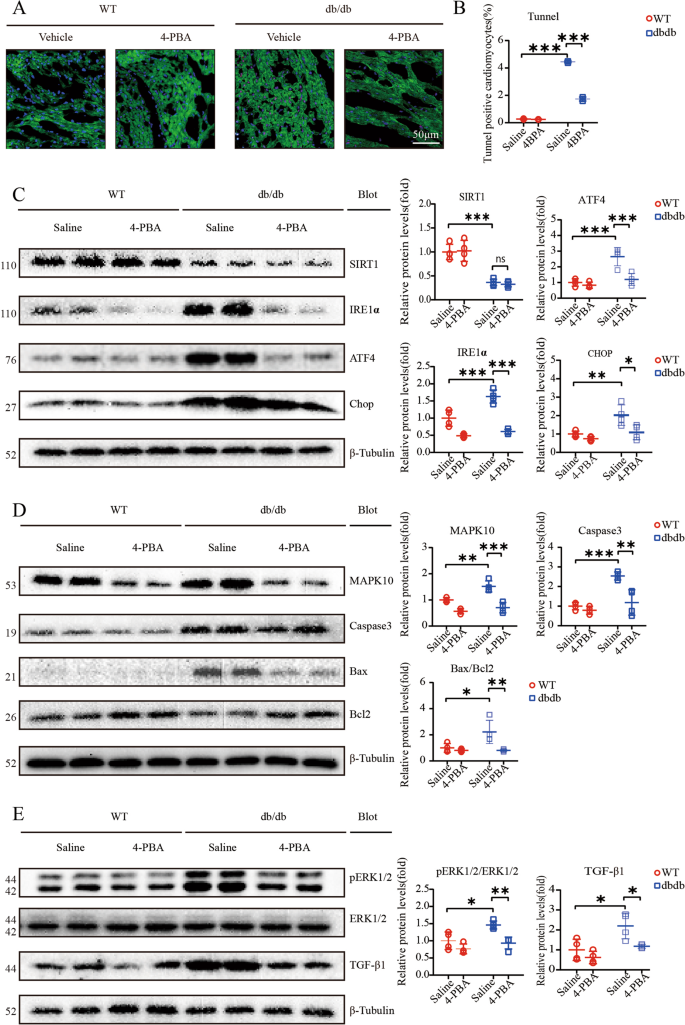
4-PBA减弱ERS和凋亡,进一步加剧心功能障碍
我们的研究表明,SIRT1的表达不受4-PBA的影响;然而,我们通过western blotting检测了ERS通路相关蛋白,结果表明IRE1α、ATF4和CHOP的表达明显降低(图4)。4摄氏度).TUNEL染色显示4-PBA显著降低了db/db小鼠心肌细胞凋亡率(图2)。4 a、B).4-PBA处理后凋亡相关通路蛋白Caspase3和Bax/Bcl2明显下调(图2)。4 d).此外,4-PBA显著降低了MAPK10蛋白的表达。4 d).TGF-β信号通路是心脏纤维化的重要途径,我们的数据表明,4-PBA强烈降低TGF-β蛋白表达;此外,增强的肥厚标志物ERK1/2磷酸化显著降低(图。4 e).
在db/db小鼠心脏中敲除MAPK10可逆转心脏肥厚和舒张功能障碍
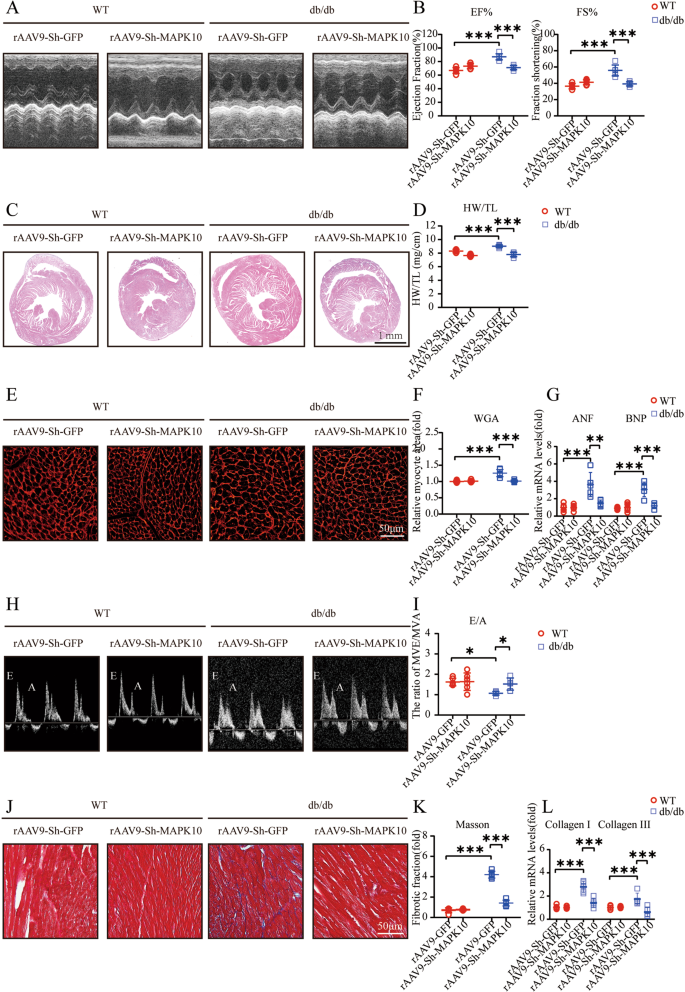
我们进一步研究了在小鼠心脏特异性敲除MAPK10是否可以逆转db/db小鼠的心功能障碍。注射raav9 -sh- mapk10的db/db小鼠的心脏收缩力得到改善,EF%和FS%的降低反映了这一点(图。5 a、B).此外,在MAPK10敲低后,肥大标记物显著减少。5比).透射E/A比值显著增加(图。5 h,我).此外,包括I型胶原和III型胶原在内的间质纤维化部分和纤维化相关基因的表达显著降低。(无花果。5 j-l).
一个,B左室m型超声心动图,射血分数(EF%)和分数缩短(FS%)测定(n= 6);C心脏切片苏木精和伊红(H&E)染色(左);D心脏重量与胫骨长度(HW/TL)比值(n= 6);E,Ftritc标记的小麦胚芽凝集素(WGA)心脏切片染色(左)和心肌细胞横截面积定量(每颗心脏计数200个细胞,n= 6);G房利钠因子(ANF)、脑利钠肽(BNP)等增生性基因实时定量聚合酶链反应分析(n= 6);H,我尖尖4腔二尖瓣流入的脉冲波多普勒图像及E/A比值WT和db/db的计算(n= 6);J,K心脏间质纤维化的马松三色染色。纤维化区域的定量(n= 6);l小鼠心脏间质纤维化相关基因(I型胶原和III型胶原)的相对mRNA水平(n= 6)。
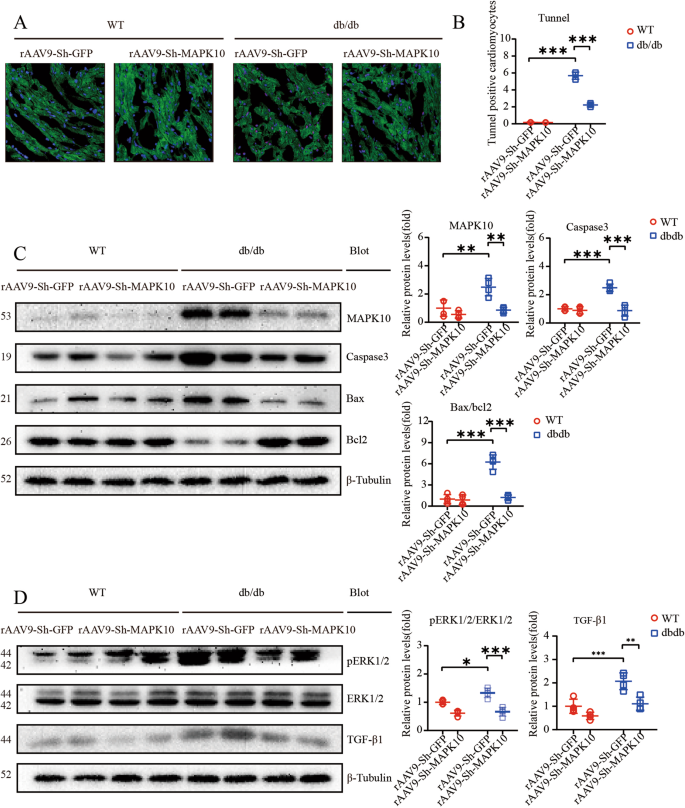
MAPK10下调可减轻细胞凋亡和心肌功能障碍
western blotting显示,raav9 -sh-MAPK10介导的MAPK10水平明显下降,MAPK10蛋白水平明显下降(图2)。6摄氏度).TUNEL染色显示注入raav9 -sh- mapk10的db/db小鼠心脏TUNEL阳性心肌细胞分数急剧减少(图2)。6 a、B).此外,我们发现Caspase3和Bax/Bcl2蛋白水平显著降低(图。6摄氏度).Western blotting显示p-ERK1/2、ERK1/2和TGF-β1蛋白表达明显降低,这与心脏肥厚和纤维化的缓解有关(图2)。6 d).
讨论
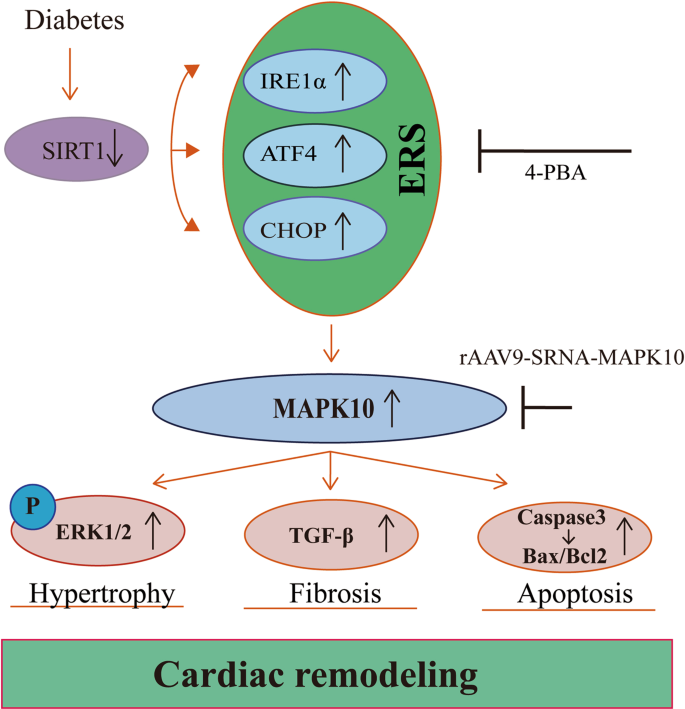
本研究发现MAPK10在逆转ers诱导的DCM中具有新的生理作用(图2)。7).12周龄db/db小鼠开始出现轻度DCM, 16周龄db/db小鼠出现更明显的收缩功能障碍、舒张功能障碍和凋亡,MAPK10表达随时间增加。ERS抑制剂4-PBA显著降低了MAPK10的表达,缓解了DCM。同样,在db/db小鼠心脏中,MAPK10的下调强烈逆转了包括高血糖诱导的心脏肥厚、舒张功能障碍和细胞凋亡在内的有害影响。因此,MAPK10是高血糖诱发DCM的关键因素。DCM高血糖的工作模型如图所示。7.
先前的数据表明,心肌细胞和成年诱导的sirt1敲除小鼠易发生心脏损伤21SIRT1活化被证明是DCM的治疗靶点23,24.在机制上,SIRT1负责在体外DCM中CHOP的激活25.我们的研究结果表明SIRT1蛋白表达显著降低,尤其是在16周龄db/db小鼠中(图2)。2摄氏度).我们还发现CHOP蛋白水平增加,表明ERS信号通路被激活(图。2摄氏度).ERS信号转导的关键特征是ERS传感器IRE1α、ATF4和CHOP的表达增加26,27.也有证据表明ATF4的翻译通过直接结合CHOP的5 ' -UTR激活CHOP的表达27.因此,我们使用4-PBA通过测量这些蛋白的表达水平来探索ERS反应的作用。结果显示,4-PBA可抑制IRE1α、ATF4和CHOP的表达,提示4-PBA可减弱ERS反应(图4-PBA)。4摄氏度).此外,db/db小鼠在12周时开始出现心室肥厚,在16周时出现最严重的收缩功能障碍,主要表现为EF%和FS%升高,HW/TL比和心肌横截面积等其他肥厚标志物升高(图。1比).结果还显示db/db小鼠的舒张功能障碍,表现为E/ a比值降低和间质纤维化增加(图2)。1 h l).我们的数据也显示了16周龄db/db小鼠的细胞凋亡(图。2 a, B).在db/db小鼠中,4-PBA的使用与心肌功能障碍的缓解有关(图2)。3.).令人惊讶的是,在db/db小鼠中,MAPK10蛋白表达也随着时间的推移而明显下降(图2)。4).
ERS反应的激活往往与多种心血管疾病的病理生理过程有关。研究表明,ERS激活导致许多通路的激活,如纤维化、炎症和肥大。张等人。28结论表明,ERS的激活,表现为CHOP表达上调,是MAPK信号通路刺激的原因,最终导致心力衰竭28.结果表明,ERS的激活可以增强ERK1/2的磷酸化,以及TGF-β1的激活,从而加速心肌重塑的发生和发展24.因此,在db/db小鼠中使用ERS抑制剂可能无法证明下游MAPK10是否在DCM中起关键作用。MAPK10 (JNK3)是JNK家族的成员,该家族包括JNK1, JNK2和JNK329,据报道主要在心脏、大脑和睾丸中表达,在ERS反应中发挥核心作用30..更重要的是,JNK3的基础活性相对较低;在应激下,JNK3通过上调被激活31.先前的数据也表明MAPK10是心肌细胞凋亡相关的关键分子,IRE1α负责JNK的激活32.因此,我们对MAPK10进行了心脏特异性敲低,以验证MAPK10是否是高血糖诱导的心脏重塑的关键分子。数据显示,db/db小鼠的心肌功能障碍,包括收缩功能障碍、舒张功能和细胞凋亡,在db/db小鼠中通过TGF-β信号通路和ERK1/2磷酸化完全逆转(图2)。6 d).此外,凋亡相关蛋白Caspase3的表达和Bax/Bcl2比值显著降低。
这项研究有几个局限性。首先,db/db小鼠是典型的瘦素受体缺陷T2DM模型,广泛应用于基础研究。然而,瘦素受体缺乏只是T2DM的发病机制之一,这种机制较为罕见,而由环境因素、遗传学和表观遗传学等其他危险因素引起的高胰岛素血症和胰岛素抵抗在人类T2DM中更为常见。因此,未来需要在更多的T2DM模型中探索和验证其结果和机制。其次,我们没有进行体外实验来验证高血糖诱导的MAPK10激活。
综上所述,本研究表明高血糖通过ERS-MAPK10信号通路促进db/db小鼠心肌功能障碍。MAPK10可能成为未来糖尿病相关心血管疾病的心脏保护治疗策略的潜在靶点。
数据可用性
用于支持本研究结果的数据可根据合理要求从相应作者处获得。
改变历史
8月30日
参考文献
Mayer-Davis EJ, Lawrence JM, Dabelea D, Divers J, Isom S, Dolan L等。2002-2012年青少年1型和2型糖尿病发病率趋势N英语J医学376, 1419-1429(2017)。
张建民,张建民,张建民,张建民等。心脏病和中风统计数据-2018年更新:美国心脏协会的一份报告。循环137, e67-e492(2018)。
糖尿病性心肌病,因果关系。Rev Endocr Metab Disord11, 31-39(2010)。
Aneja, Tang WH, Bansilal S, Garcia MJ, Farkouh ME。糖尿病性心肌病:对发病机制、诊断挑战和治疗方案的洞察。Am J医学121, 748-757(2008)。
李国强,李国强,李国强。超声心动图在糖尿病心肌病中的应用。赫兹38, 42-47(2013)。
Asbun J, Villarreal FJ。糖尿病心肌病背景下心肌纤维化的发病机制。J Am Coll Cardiol47, 693-700(2006)。
Oldfield CJ, Duhamel TA, Dhalla NS。心脏肥厚由生理性向病理性转变的机制。J Physiol Pharmacol可以吗98, 74-84(2020)。
清水I,南氨基T.生理性和病理性心肌肥厚。J Mol细胞心脏97, 245-262(2016)。
中村,李志刚。心脏肥厚的生理和病理机制。快速心脏运动15, 387-407(2018)。
内质网未折叠蛋白反应中的信号整合。Nat Rev Mol细胞生物学8, 519-529(2007)。
Minamino T, Komuro I, Kitakaze M.内质网应激作为心血管疾病治疗靶点。中国保监会Res107, 1071-1082(2010)。
傅海燕,冈田K,廖毅,冢本O, Isomura T, Asai M等。C/EBP同源蛋白的消融减弱内质网介导的细胞凋亡和压力过载引起的心功能障碍。循环122, 361-369(2010)。
Puthalakath H, O 'Reilly LA, Gunn P, Lee L, Kelly PN, Huntington ND等。内质网应激通过激活BH3-only蛋白bim引发细胞凋亡。细胞129, 1337-1349(2007)。
张志刚,张志刚,张志刚。内质网应激诱导细胞凋亡的研究进展。EMBO代表7, 880-885(2006)。
韦斯顿CR,戴维斯RJ。JNK信号转导通路。Curr Opin细胞生物学19, 142-149(2007)。
廖娟,郭旭,王敏,董超,高敏,王海等。低密度脂蛋白受体敲除小鼠在改良西式饮食中B类清道夫受体1型缺失导致冠状动脉粥样硬化和缺血性心脏病。J动脉粥样硬化血栓24, 133-146(2017)。
田清水,奈朗,陈萍,于波,Knapp M, Janardanan J等。ROCK2的成纤维细胞缺失可减弱心脏肥厚、纤维化和舒张功能障碍。江森自控的洞察力2, e93187(2017)。
Cicek FA, Toy A, Tuncay E, Can B, Turan B β受体阻滞剂timolol通过抑制内质网应激来缓解高血糖诱导的心脏损伤。J Bioenerg Biomembr46, 377-387(2014)。
杨敏,林颖,王艳,王艳。高糖通过Foxo1 /GRK2信号通路诱导心肌细胞凋亡。生物化学生物物理Res公社513, 154-158(2019)。
李志强,李志强,李志强,等。SIRT1在糖尿病性心肌病中的作用。生物医学Pharmacother90, 386-392(2017)。
Prola A, Pires Da Silva J, Guilbert A, Lecru L, Piquereau J, Ribeiro M等。SIRT1通过eIF2α去乙酰化保护心脏免受内质网应激诱导的细胞死亡。细胞死亡不同24, 343-356(2017)。
罗涛,陈波,王霞。4-PBA通过减轻内质网应激防止压力过大引起的心肌肥厚和间质纤维化。化学与生物互动242, 99-106(2015)。
Caron AZ, He X, Mottawea W, Seifert EL, Jardine K, Dewar-Darch D等。SIRT1脱乙酰酶保护小鼠免受代谢综合征症状的影响。美国实验生物学学会联合会J28, 1306-1316(2014)。
郭锐,刘波,王凯,周松,李伟,徐勇。白藜芦醇通过抑制NF-κB通路改善糖尿病血管炎症和巨噬细胞浸润。Diab Vasc Dis Res11, 92-102(2014)。
郭锐,刘伟,刘波,张波,李伟,徐莹。SIRT1抑制糖尿病心肌病心肌细胞凋亡:内质网应激反应机制的探讨。国际J心脏191, 36-45(2015)。
王志刚,李志刚,李志刚。CHOP/GADD153在内质网应激中的作用。细胞死亡不同11, 381-389(2004)。
张晓霞,郭emaere EL, Seddiki N, Célia H, Gavioli M, Cascales E等。映射之间的交互大肠杆菌TolQ跨膜段。生物化学286, 11756-11764(2011)。
张强,卢琳,梁涛,刘明,王志林,张丕平。MAPK通路对梗死后心衰小鼠心肌细胞凋亡的调控作用Bratisl Lek Listy118, 339-346(2017)。
Bogoyevitch MA, Kobe B. JNK的用途:c-Jun n端激酶的多种底物。微生物摩尔生物学Rev70, 1061-1095(2006)。
许维多娃M, Anfinogenova Y, atchina - vasserman EN, Schepetkin IA, atchina DN。c-jun n末端激酶(JNKs)在心肌和脑缺血再灌注损伤中的作用。前药物杂志9, 715(2018)。
杨德德,宽春,Whitmarsh AJ, Rincón M,郑涛,Davis RJ等。缺乏Jnk3基因的小鼠海马区未出现兴奋毒性诱导的细胞凋亡。自然389, 865-870(1997)。
田野飞,王旭,张勇,郑平,等。内质网应激与跨膜蛋白激酶IRE1激活JNK蛋白激酶的偶联。科学287, 664-666(2000)。
确认
本研究由辽宁省振兴人才计划(XLYC2002096)和长江学者计划(T2017124)资助。
作者信息
作者及隶属关系
贡献
X-L.Y。和Y-L.X。构思和设计的研究。Y-W.D。,F.l.,Z-t.L., J-hG., and Y.Z. performed the experiments. Y-W.D. and F.L. collected, analyzed and interpreted the data. Y-W.D. wrote the paper. X-L.Y. and Y-L.X. acquired the funding. X-L.Y., X.Y. and Y.X. supervised the study. X-L.Y. and Y-L.X. reviewed and edited the paper.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
由于图4和图6中的错误,本文的原始在线版本进行了修改。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
邓,YW。,liu, F., Li, ZT.et al。高血糖通过ERS-MAPK10信号通路促进db/db小鼠心肌功能障碍。实验室投资102, 1192-1202(2022)。https://doi.org/10.1038/s41374-022-00819-2
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41374-022-00819-2