摘要
之前的研究表明circST6GALNAC6在膀胱癌中是一种肿瘤抑制因子。然而,circST6GALNAC6在铁下垂中的作用尚不清楚。在目前的研究中,利用erastin诱导膀胱癌细胞铁下垂。功能实验表明,circST6GALNAC6过表达可促进膀胱癌细胞体内外铁下垂。机制研究表明circST6GALNAC6结合在小热休克蛋白1 (small heat shock protein 1, HSPB1)的n端,从而阻断了erastin诱导的HSPB1在Ser-15位点的磷酸化,Ser-15位点是铁脱铁应激保护性反应的磷酸化位点。此外,蛋白激酶C通过增加HSPB1的整体磷酸化水平来抑制circst6galnac6诱导的铁坠病,进一步证明了磷酸化激活HSPB1在抵抗铁坠病中的作用。最后确定HSPB1/p38 MAPK通路参与circST6GALNAC6调控膀胱癌铁下垂下游信号转导。circST6GALNAC6表达水平对膀胱癌铁下垂敏感性的调控机制被揭示为circRNA调控多种蛋白功能。CircST6GALNAC6通过占据HSBP1的磷酸化位点(Ser-15)并激活P38 MAPK信号通路抑制HSPB1,促进细胞铁下垂。因此,增强circST6GALNAC6的表达促进铁脱落或将circST6GALNAC6作为铁脱落敏感性的生物标志物,对膀胱癌铁脱落干预方法的开发和应用具有相当重要的意义。
简介
膀胱癌是世界上最常见的恶性肿瘤之一,也是癌症相关死亡的主要原因1.根据美国癌症协会的估计,膀胱癌占美国所有癌症诊断病例的4.4%,2021年估计有83730例新诊断和17200例死亡2.转移是膀胱癌患者死亡的主要原因,5年生存率仅为8.1%3..尽管近几十年来在根治性膀胱切除术和辅助化疗方面取得了显著进展,但转移性膀胱癌患者的死亡率没有显著降低2.因此,进一步了解膀胱癌转移的分子调控网络对于制定精准的膀胱癌治疗策略是必要的。
最近的证据表明,铁下垂(一种新的铁依赖形式的非凋亡细胞死亡)对膀胱癌的治疗效果。Kong等人报道了一种天然产物黄芩苷通过诱导铁下垂抑制膀胱癌的进展4.脂质过氧化物积累引起的铁下垂也常发生在化疗后复发的膀胱癌中5.这些发现表明,确定铁下垂的作用可能为膀胱癌提供一种潜在的治疗方法。
环状RNA (Circular RNA, circRNA)是一种具有独特共价封闭结构的非编码RNA家族新成员,大约在40年前被首次报道6,7.几十年来,circRNA一直被认为是无用的“噪音”基因转录。然而,随着高通量测序技术的快速发展,越来越多的circRNA(s)被发现在肿瘤细胞中表达异常,提示circRNA(s)可能在癌细胞的增殖、转移和凋亡等生物学事件中发挥重要作用8,9,10.最近的研究表明,circRNA可能参与了胃癌、胶质瘤和乳腺癌等多种癌症的铁下垂调控11,12,13.
在之前的研究中,我们进行了第二代测序,以筛选膀胱癌组织与其癌周组织之间不同表达的circRNAs。结果表明,circST6GAlNAC6(来源于ST6GALNAC6基因的第5外显子),信息包括hsa_circ_0088708,来自circBase数据库(http://www.circbase.org/),在膀胱癌组织中显著减少。circST6GAlNAC6主要存在于细胞质中,通过吸附miR-200作为膀胱癌细胞的负调控因子14.本研究描述了circRNA在膀胱癌中的作用,但其分子基础尚不清楚。
热休克蛋白(HSPs)是细胞在应激刺激下产生的一组蛋白质,如热休克、冷、缺氧和pH值变化15.HSPs通常作为分子伴侣,通过稳定错误折叠的肽、恢复变性蛋白质或促进其降解来保护细胞免受应激条件的影响。有证据表明HSPs通过控制肿瘤细胞凋亡和坏死在调控肿瘤进展中发挥重要作用16,17.HSBP1是小热休克蛋白的重要成员,也被称为HSP27或HSP25,在erastin处理(铁上坠的诱导物)后,高度诱导人宫颈癌细胞,并阻止肿瘤细胞发生erastin诱导的铁上坠18.HSPB1在膀胱癌中显著上调19;因此,HSPB1可能是膀胱癌细胞铁下垂的重要参与者。P38丝裂原活化蛋白激酶(MAPK)通路可被多种环境刺激物激活,并调节各种细胞过程,包括生存、凋亡和增殖20.,21.几篇论文报道了MAPK通路参与铁下垂22,23,24,但没有研究揭示其与HSPB1的关系。
在此,circST6GALNAC6的过表达被报道在体外和体内促进乳脂素诱导的铁下垂。在机制上,circST6GALNAC6与HSPB1结合,降低了HSPB1的磷酸化,从而抑制了HSPB1/ P38 MAPK信号通路的激活,增加了膀胱癌细胞对铁下垂的敏感性。目前的研究结果表明circST6GALNA6/HSBP1可能是膀胱癌的潜在治疗轴。
材料与方法
人膀胱癌标本
30例膀胱癌患者在中南大学湘雅第二医院手术中获得,并签署知情同意书。本研究也获得了中南大学湘雅第二医院伦理委员会的批准。术后所有组织立即在液氮中快速冷冻,并在- 80°C保存。
膀胱癌细胞系及治疗
人膀胱癌细胞系UM-UC-3和J82来源于中国科学院细胞库(中国上海)。在含有胎牛血清(10%,赛默飞世尔科学公司)和青霉素/链霉素(1%,Sigma,美国)的DMEM培养基(Gibco,美国)中培养的细胞在37°C和5% CO的细胞培养箱中维持2在恒定湿度(95%)下。必要时,膀胱癌细胞分别与erastin (MedChemExpress, USA)、Ferrostatin-1 (MedChemExpress, USA)、Deferoxamine (MedChemExpress, USA)或SB203580 (Selleck, USA)孵育。
克隆circST6GALNAC6(全长),插入到pLV-CMV- ef1 - zsgreen1 - puro载体(简称为pLV-CMV)中建立circST6GALNAC6过表达膀胱癌细胞系,并在pLV-CMV中插入一段潦草序列作为阴性对照(circRNA-NC)。在两种辅助载体pSPAX2和pMD2G存在的情况下,将该构建物共转染到HEK293T细胞中,生成慢病毒,分别用于感染UM-UC-3和J82细胞。感染或转染24 h后,收集UM-UC-3和J82细胞,用erastin (10 μM, Solarbio, China)处理24 h,用于后续实验。
全身HSPB1,▵将N- HSPB1 (N端缺失)和Ser-15突变(S15A)插入pcDNA3.1载体,构建过表达HSPB1的UM-UC-3和J82细胞。PKC表达载体PLV-CMV-PKC及其阴性对照PLV-CMV和特异性shHSPB1购自中国上海Genema公司。
实时定量PCR (qRT-PCR)分析
用TRIzol (Invitrogen, USA)从处理过的UM-UC-3和J82细胞中分离总RNA,并使用NanoDrop 2000C分光光度计(Thermo Fisher Scientific, USA)测量提取的RNA浓度。接下来,根据制造商的说明,使用PrimeScript™RT试剂盒(Takara, Japan)将RNA反转录为cDNA。使用AceQ Universal SYBR qPCR Master Mix (Vazyme,中国)在ABI 7500 PCR系统(Applied Biosystems,美国)上检测circST6GALNAC6的相对表达,并使用2−ΔΔCt方法。内部对照采用GAPDH。以下引物列于表中1.
细胞计数试剂盒-8 (CCK-8)
采用CCK-8 (Dojindo, Japan)法测定UM-UC-3和J82细胞的细胞活力。将处理过的UM-UC-3和J82细胞简单接种到96孔板上,并添加复制孔。37°C孵育24 h后,每孔加入CCK-8试剂(每100µL培养基10µL),然后孵育2 h。使用Varioskan Flash读取器(Thermo Fisher Scientific, USA)在450nm处测量每个孔的吸光度。
Western blot分析
使用RIPA缓冲液从处理过的UM-UC-3和J82细胞或异种移植瘤中分离蛋白质(Thermo Fisher, USA)。测定蛋白浓度后,用10% SDS-PAGE分离50 μg蛋白样品。然后将分离的蛋白质转移到硝化纤维膜上,然后用5%的低脂牛奶孵育2小时。然后,用SLC7A11 (1:1000, #12691, CST)、GPX4 (1:2000, ab252833, Abcam)、COX2 (1:1000, ab188183, Abcam)、HSPB1 (1:1000, ab109376, Abcam)、p-HSPB1 (1:2000, #2401, #2404, #2405, CST)、p38 (1:2000, ab178899, Abcam)、p-p38 (1:1000, ab178817, Abcam)、JNK (1:50, ab199380, Abcam)、p-JNK (1:50, ab124956, Abcam)、PKC (1:50, ab181558, Abcam)和GAPDH (1:2000, ab8245, Abcam)孵育膜。用一抗孵育24小时后,用二抗(Abcam)孵育2小时,用增强化学发光试剂(EMD Millipore, USA)检测信号。
脂质ROS、GSH、MDA水平测定
处理后的UM-UC-3和J82细胞分别与2ʹ,7ʹ-二氯荧光素二乙酸酯(BODIPY-C11, 50 mM, ab克隆)孵育30分钟,测定脂质ROS的相对水平。PBS洗涤三次后,使用荧光显微镜(Olympus, Japan)检查细胞荧光,并使用CytoFLEX (BECKMAN, USA)测定荧光强度。用GSH比色检测试剂盒(CS0260, Sigma, USA)和脂质过氧化(MDA)检测试剂盒(ab118970, Abcam)分别检测处理过的UM-UC-3和J82细胞裂解液中GSH和MDA的相对水平。具体检测步骤遵循两种试剂盒的说明。
细胞铁水平检测
用phen green SK (PGSK)染色和荧光共聚焦成像法测定细胞铁水平。简而言之,处理后的UM-UC-3和J82细胞用PGSK (5 μM, P14313, Molecular Probes, USA)用PBS洗涤2次后孵育20 min。使用荧光共聚焦显微镜(Nikon, TSR, Japan)检测各组细胞的荧光。PGSK在铁下垂细胞中的绿色荧光减弱。此外,采用普鲁士蓝铁染色试剂盒(with Eosin solution, G1424, Solarbio, China)检测肿瘤体内铁水平。
CircRNA下拉和质谱分析
生物素化circST6GALNA6探针由Genema(中国上海)设计和提供,在PA缓冲溶液(Tri-HCl 10, MgCl210和NH4cl100 mM),然后固定在MyOne链霉亲和素C1 Dynabeads(赛默飞世尔,#65001)。制备细胞裂解物,处理J82细胞(2 × 106)收集并重新悬浮在结合缓冲液中(HEPES, 10 mM, KCl 50 mM, EDTA 1 mM, 10%甘油和105% Triton X-100)。上清液在13000 RPM离心10 min后用Dynabeads孵育2 h。随后用PBS清洗珠子两次,并在Western blot样品缓冲液中煮沸10分钟。然后在分子生物学核心设施用质谱分析了一半的样本。Western blot检测其他标本HSPB1蛋白。
荧光原位杂交(FISH)和免疫荧光染色
cy5标记的circST6GALNAC6由Genema(中国上海)设计和提供。处理后的UM-UC-3和J82细胞接种于盖玻片上培养24 h后,用4%多聚甲醛固定。接下来,细胞用cy3标记的circST6GALNAC6探针(1:50)在含0.5% Triton X-100的PBS中孵育过夜。然后用抗hspb1 (1:500, ab109376, Abcam)孵育过夜,再用SYPRO Orange偶联二抗孵育2 h。信号在共聚焦显微镜下观察(奥林巴斯,日本)。
RNA免疫沉淀(RIP)
处理过的UM-UC-3和J82细胞在含有RNase和蛋白酶抑制剂的裂解缓冲液(Thermo Scientific, USA)中裂解。提取的蛋白质与抗hspb1一起孵育一夜(1:400,CST,美国),然后使用蛋白G Sepharose Fast Flow悬浮液(GE Amersham,英国)将其拉下。与蛋白酶K孵育1小时后,用TRIzol试剂(Invitrogen)进行RNA纯化。
鼠标异种移植
裸鼠(雄性,7-8周龄)由湖南SJA实验动物有限公司提供。动物实验按照中南大学动物实验伦理委员会的指导方针进行。J82细胞(2 × 105稳定表达circrNA-NC或circST6GALNAC6的细胞分别在裸鼠左侧皮下植入(n= 5 /组)。接种7 d后,给予erastin (1mg /kg,每周3次)治疗21 d,同时瘤内注射PLV-CMV-PKC和PLV-CMV-NC。实验是随机选择性别、年龄和体重相匹配的窝友进行的。动物随后被CO处死2在规定时间窒息,切除肿瘤并称重。一半的新鲜异种移植瘤在RIPA缓冲液中溶解,并进行Western blot分析。剩余肿瘤标本用4%多聚甲醛固定,切成5 μM切片进行免疫组化分析。简单地说,肿瘤切片用PBS冲洗三次,并与正常驴血清(20%,Sigma,美国)在小瓶中孵育2小时。随后,标记抗GPX4 (1:2000, ab252833, Abcam)、COX2 (1:1000, ab188183, Abcam)、p-HSPB1 (1:2000, #95357, CST) SLC7A11 (1:1000, #12691, CST或IHC的ab37185)的一抗,孵育过夜。切片用PBS冲洗2次后,用酶标二抗(1:5000,ab205718, Abcam)孵育2 h。采用Ki-67免疫组化试剂盒(YanJinbio, China)检测肿瘤切片细胞增殖情况。
统计分析
本研究数据以均数±标准差(mean±SE)表示。使用GraphPad Prism(7.0版)收集和分析数据。未配对学生的t采用测试来比较两组的平均数。采用单向(一个自变量)或双向(两个自变量)方差分析与Tukey的多重比较检验,对所有成对组合的不同组进行比较。小动物——一张长有P<0.05为有统计学意义。
结果
CircST6GALNAC6增加膀胱癌的铁下垂
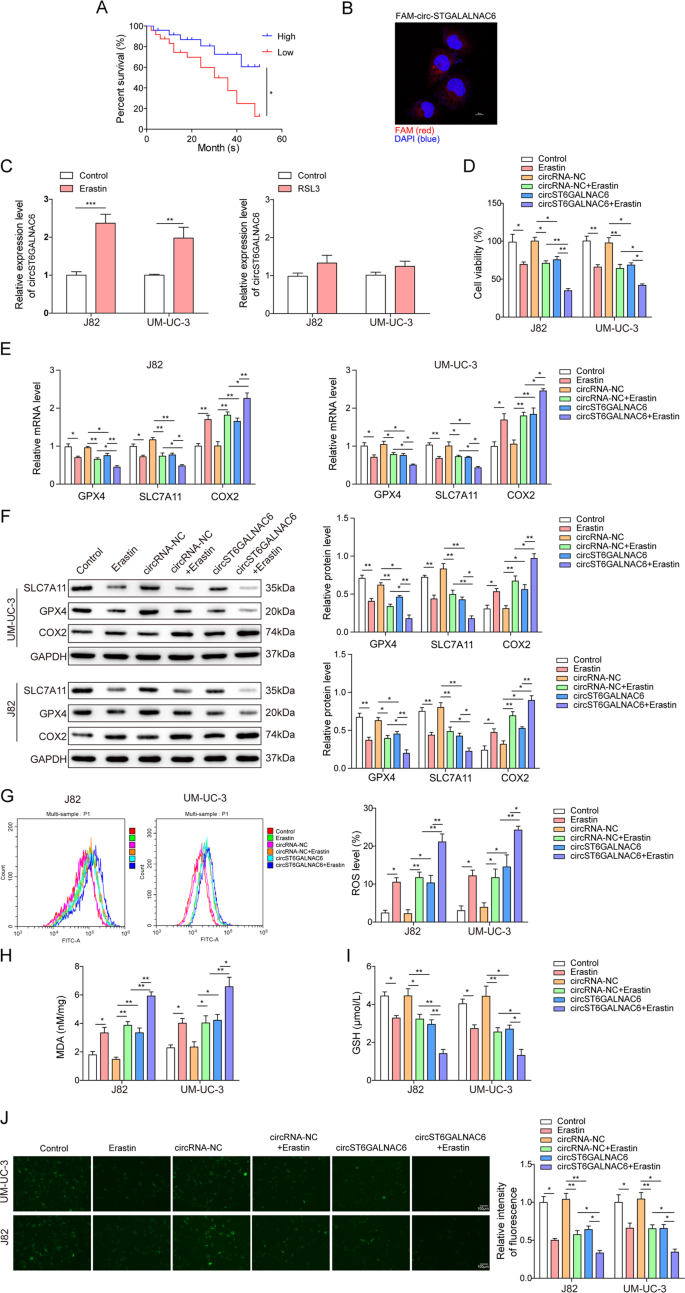
前期研究表明circST6GAlNAC6是从ST6GALNAC6基因的第5外显子转录剪接而来,全长407 nt(补充图。S1).进行Kaplan-Meier生存分析,circST6GALNAC6高表达膀胱癌患者的生存率普遍高于低表达膀胱癌患者(图2)。1).CircST6GAlNAC6主要存在于膀胱癌细胞的细胞质中(图。1 b),揭示了它可以充当“蛋白质海绵”或“miRNA海绵”。
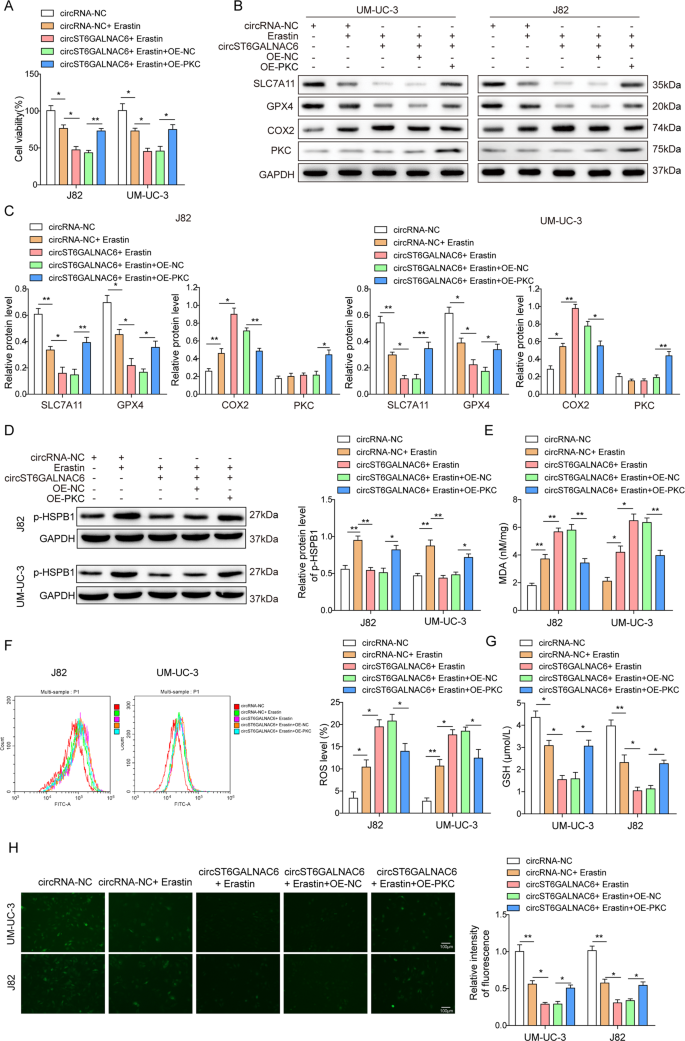
一个采用Kaplan-Meier生存分析,分析circST6GALNAC6低表达和高表达膀胱癌患者的生存率。BcircST6GALNAC6在J82细胞系中的细胞定位。C用erastin处理J82和UM-UC-3细胞24 h后,用qRT-PCR检测circST6GALNAC6的表达。D用circST6GALNAC6过表达质粒或阴性对照质粒转染J82和UM-UC-3细胞,并用erastin处理24 h。采用CCK-8法测定处理后J82和UM-UC-3细胞的细胞活力。E存在和FWestern blot法分别在处理后的J82和UM-UC-3细胞中检测铁坠病相关蛋白mRNA和蛋白水平的表达。G通过Bodipy-C11染色和流式细胞术分析J82和UM-UC-3细胞处理后ROS的产生情况。HMDA和我用商业试剂盒检测处理过的UM-UC-3和J82细胞裂解液中的谷胱甘肽水平。J用荧光指示剂PGSK测定处理后J82和UM-UC-3细胞的胞内铁含量。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
采用2种激活剂(erastin和RSL3)分别在0、5、10、20、50和100 μM诱导膀胱癌细胞株T24、J82、5637、UM-UC-3和SW780 24 h,研究circST6GALNAC6在铁脱铁中的作用。通过CCK-8试验分析细胞存活率,细胞存活率以erastin或RSL3剂量依赖方式降低(补充图。S2A),然而,RSL3处理并不像erastin那样诱导circST6GALNAC6的表达(图。1 c).这一发现表明circST6GALNAC6可能只与线粒体ros依赖性铁衰有关,而这种铁衰是由erastin诱导的,与RSL3无关。
Erastin主要通过影响线粒体电压依赖性阴离子通道诱导铁下垂。因此,通过细胞内电子显微镜检查膀胱癌细胞的线粒体形态。与erastin处理下的NC组相比,circST6GALNAC6过表达组的不典型形态(体积小,内嵴消融,基质密度加深)更多(补充图)。开通而且S3).此外,在erastin处理后,J82和UM-UC-3的细胞活力显著降低,circST6GALNAC6过表达后进一步降低(图。1 d).在脱皮素诱导的铁脱铁过程中,铁脱铁相关蛋白(SLC7A11, GPX4)的mRNA和蛋白水平显著降低,COX2水平升高,circST6GALNAC6进一步增强了这些指标表达变化的意义(图2)。1 e, F).脂质ROS、丙二醛(MDA)、谷胱甘肽(GSH)和铁(Fe2 +)的水平也改变后,erastin和circST6GALNAC6过表达(图。1 g-j),提示circST6GALNAC6过表达增加膀胱癌细胞系铁下垂。
接下来,在有或没有erastin的circST6GALNAC6-OE细胞中分别加入铁脱铁抑制剂fe -1和deferoxamine。结果表明,两种抑制剂均能减弱circST6GALNAC6对铁脱铁的影响,表现为细胞活力的恢复、铁脱铁相关蛋白(GPX4、SLC7A11、COX2和GSH)的蛋白水平以及MDA、脂质ROS和Fe的降低2 +内容(补充图。S4A- - - - - -F).
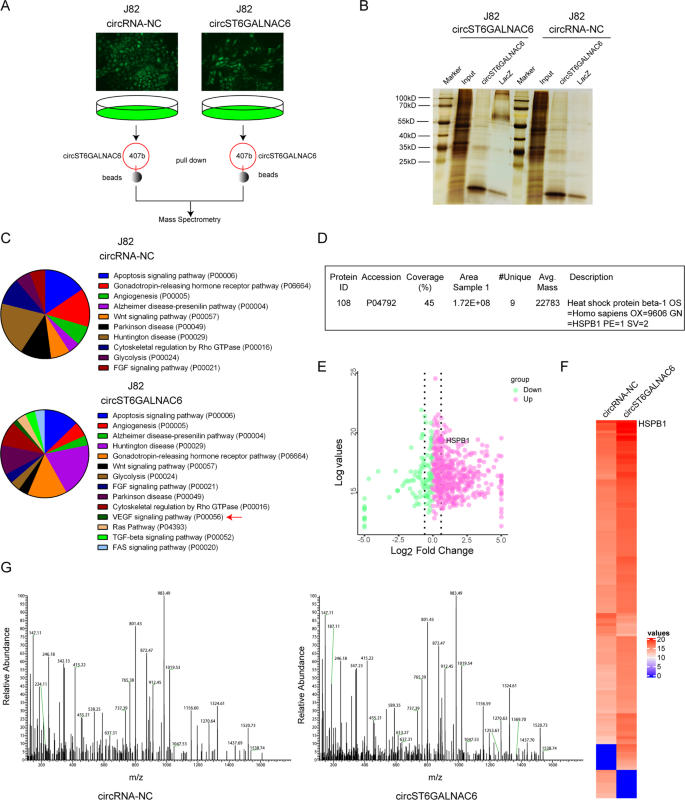
膀胱癌中HSPB1与circST6GALNA6结合
对circST6GALNAC6- oe细胞银染色测定的circST6GALNAC6下拉蛋白进行质谱分析。2 a, B),探讨circST6GALNAC6铁下垂的调控机制。基因本体分析显示,这些蛋白与VEGF、凋亡、RAS等多种途径密切相关(图。2摄氏度).研究发现,与NC相比,circST6GALNAC6-OE细胞中VEGF信号通路的关键成员HSPB1高度富集。2 d).考虑到它在癌细胞抵抗铁坠病中的作用18目前,circST6GALNAC6在通过HSPB1调节膀胱癌铁衰中的作用尚不明确。
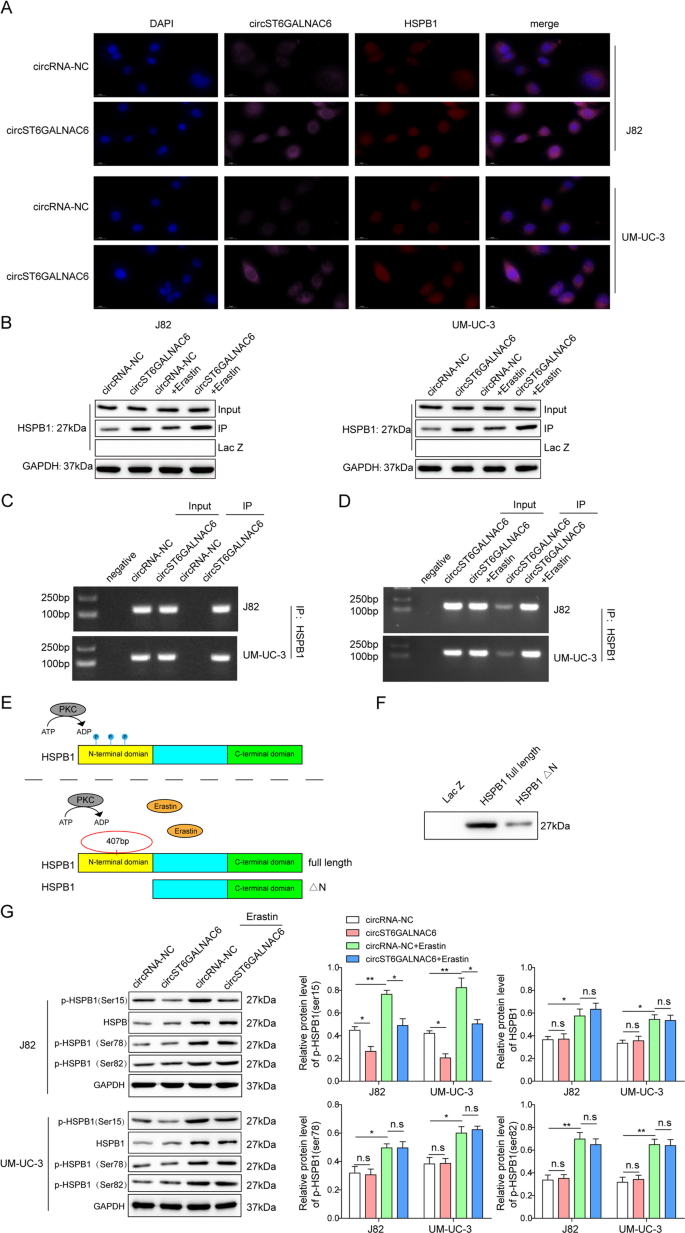
Erastin增强膀胱癌中circST6GALNAC6和HSPB1的结合
通过FISH和免疫荧光分析、RNA免疫沉淀(RIP)和RNA下拉实验验证circST6GALNAC6与HSPB1的结合关系。使用circST6GALNAC6探针在存在erastin时比不存在erastin时获得更多的HSPB1(图。3模拟).
一个免疫荧光双染色显示circST6GALNAC6和HSPB1分别位于J82和UM-UC-3细胞中。BRNA下拉C,D采用RIP测定在有或没有erastin的J82和UM-UC-3细胞中circST6GALNAC6和HSPB1之间的相互作用。EcircST6GALNAC6与HSPB1的关系模型。F采用RNA下拉实验研究了circST6GALNAC6在HSPB1蛋白中的结合位点。GWestern blot检测经circST6GALNAC6或circRNA-NC转染的J82和UM-UC-3细胞在蛋白激酶C和erastin存在下p-HSPB1水平。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
进一步探讨了circST6GALNAC6在HSPB1中的结合域。n端结构域的缺失和集中磷酸化位点导致circST6GALNAC6不能与HSPB1结合(图2)。3 e, F).CircST6GALNAC6过表达显著抑制了Ser-15位点的HSPB1磷酸化水平,对Ser-78和Ser-82位点无明显影响(图5)。3 g).这些结果表明circST6GALNAC6有效地结合在HSPB1的n端结构域上,并抑制了铁下垂胁迫下诱导的Ser-15位点的磷酸化激活。
然后用PKC激活HSPB1磷酸化。当circST6GALNAC6过表达时,加入PKC,以确定PKC是否逆转circST6GALNAC6介导的Ser-15位点的磷酸化抑制,从而产生与p-HSPB1相反的膀胱癌细胞铁上坠作用。细胞活力、铁脱铁相关蛋白,包括HSPB1和p-HSPB1的表达以及脂质ROS、Fe2+、MDA和GSH的数据均支持circST6GALNAC6降低了HSPB1的磷酸化水平,增加了膀胱癌对铁脱铁的敏感性(图2)。4 g).
用circST6GALNAC6过表达质粒或/和ose - pkc转染J82和UM-UC-3细胞,并用erastin处理24 h。一个采用CCK-8法检测处理后UM-UC-3和J82细胞的细胞活力。B- - - - - -DWestern blot检测处理后J82和UM-UC-3细胞中SLC7A11、GPX4、COX2、p-HSPB1和PKC蛋白的表达。制作(E) mda, (F)活性氧及(G)测定处理后J82细胞和UM-UC-3细胞的谷胱甘肽含量。H用荧光指示剂PGSK测定处理后J82和UM-UC-3细胞的胞内铁含量。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
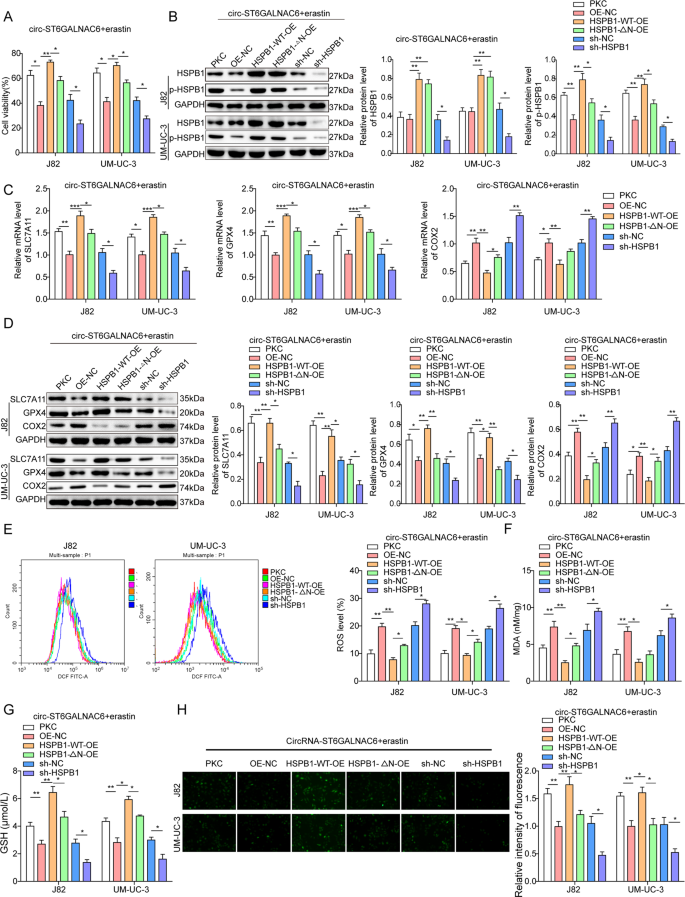
随后的研究检测了HSPB1过表达或下调对膀胱癌细胞铁下垂的影响。首先,获得全长HSPB1野生型表达载体,▵n端表达载体、shHSPB1和shRNA干扰载体(补充图S5),然后用这些载体转染膀胱癌细胞。两组小鼠均采用与前研究相同的实验方法进行铁下垂检测。结果表明,circST6GALNAC6结合n端结构域是HSPB1在膀胱癌中发挥铁坠胁迫抵抗作用的主要功能单元,依赖于phospho-Ser-15,而phospho-Ser-15在circST6GALNAC6过表达时被显著抑制。本节得出结论,HSPB1磷酸化抑制与circST6GALNAC6结合引起的空间占位效应有关,因此显著影响膀胱癌中的铁下垂(图)。5A和H和补充图。S6).
一个采用CCK-8法评价circST6GALNAC6和OE-PKC、OE-NC、HSPB1- wt - oe、HSPB1-处理后的细胞活力△N-OE, sh-NC或sh-HSPB1中存在erastin。B在存在erastin的细胞中检测HSPB1和p-HSPB1蛋白水平。C,D采用qRT-PCR和Western blot方法检测在erastin作用下细胞中SLC7A11、GPX4和COX2的表达。生产(E) ros, (F) MDA和(G)在存在erastin的细胞中测量谷胱甘肽(GSH)。H用荧光指示剂PGSK测定处理后细胞内铁含量。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
CircST6GALNAC6/HSPB1轴通过p38 MAPK通路调控膀胱癌细胞铁下垂
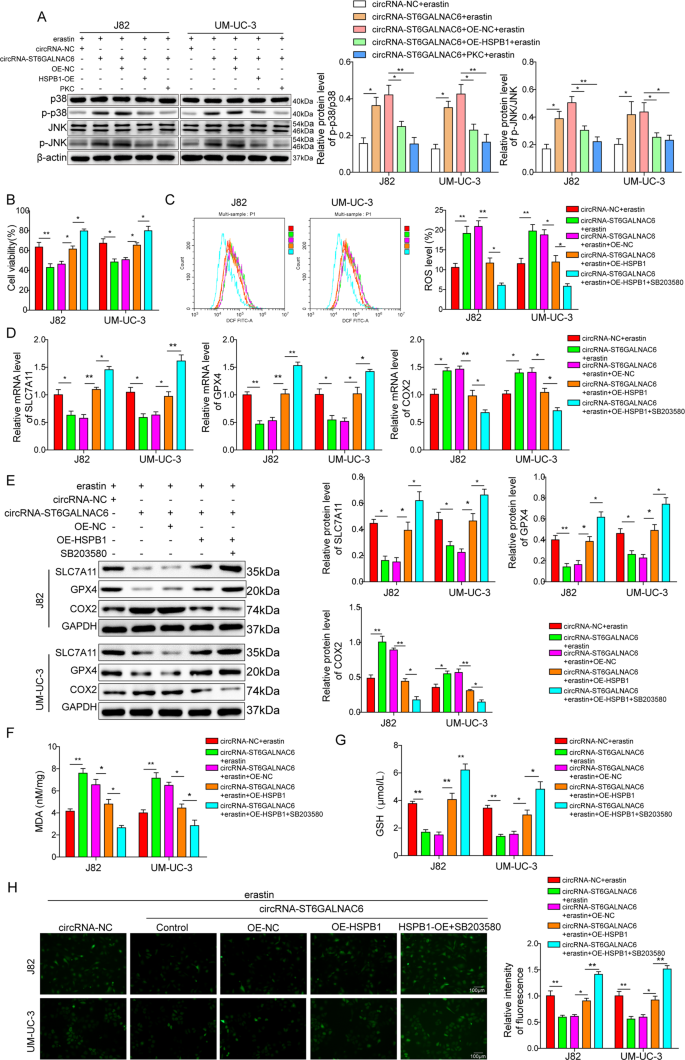
circST6GALNAC6/HSPB1轴的潜在下游信号通路被确定为膀胱癌铁下垂的执行途径。结果显示,circST6GALNAC6-OE组在脱皮素诱导的铁下垂过程中p-p38 MAPK和p-JNK蛋白水平显著升高,但通过过表达HSPB1或用PKC处理细胞,p-p38 MAPK和p-JNK蛋白水平被消除。6).P38抑制剂或HSPB1过表达在erastin处理中显著增加circST6GALNAC6-OE细胞的存活率(图。6 b).此外,脂质ROS、MDA、Fe2 +COX2降低,SLC7A11、GPX4、GSH升高(图;6 c g),提示膀胱癌细胞铁下垂可通过CircST6GALNAC6/HSPB1/p38 MAPK途径有效促进。
一个在有erastin存在的HSPB1-OE处理的circST6GALNAC6过表达细胞中检测p38、p-p38、JNK和p-JNK蛋白水平。B在有或没有p38抑制剂的erastin存在的情况下,用HSPB1-OE处理的circST6GALNAC6过表达细胞的CCK-8分析细胞活力。C在有或没有p38抑制剂的erastin存在的情况下,用HSPB1-OE处理的circST6GALNAC6过表达细胞的ROS水平。D,E用HSPB1-OE加或不加p38抑制剂处理circST6GALNAC6过表达细胞后,在erastin存在下对SLC7A11、GPX4和COX2进行qRT-PCR和Western blot分析。F,G用HSPB1-OE加或不加p38抑制剂处理circST6GALNAC6过表达细胞后,在erastin存在下MDA和GSH的产生。H用荧光指示剂PGSK测定处理后细胞内铁含量。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
circST6GALNA6/HSPB1/p38 AMPK轴在膀胱癌细胞铁下垂调控中的体内验证
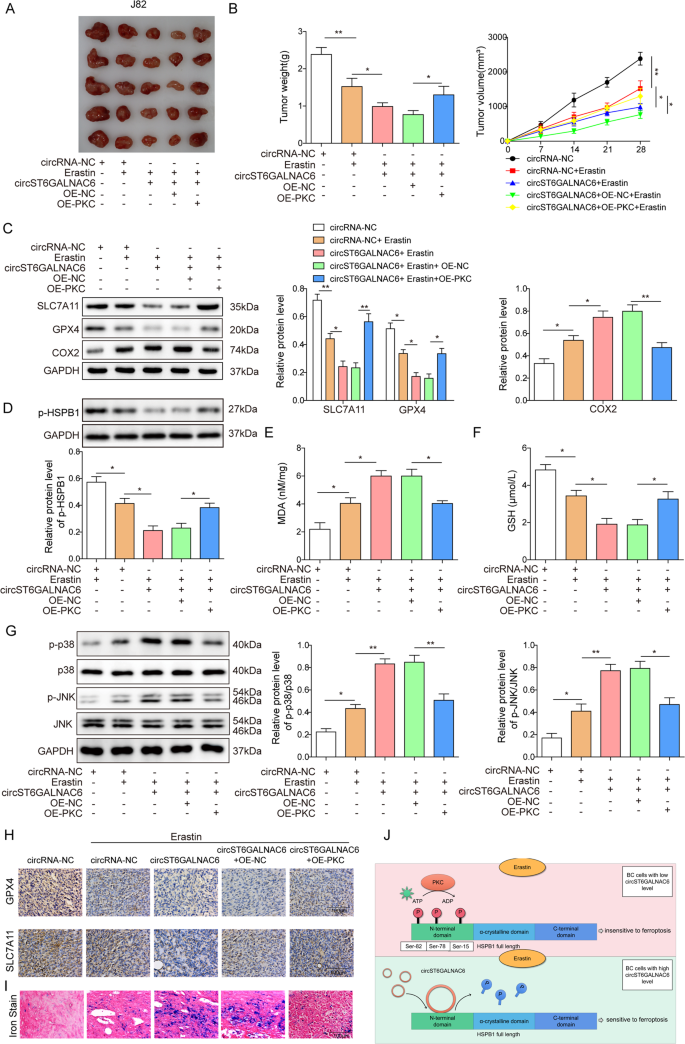
以circST6GALNA6过表达J82细胞移植裸鼠模型,在体内进一步检测circST6GALNA6/HSPB1/p38 AMPK轴对膀胱癌细胞铁下垂的调节作用。结果显示circST6GALNAC6过表达增强了erastin对肿瘤体积的抑制作用(图。7一个)和重量(图;7 b),而PKC治疗组未观察到这一现象。Western blot检测各组异种移植瘤中SLC7A11、GPX4、COX2、p-HSPB1的表达。PKC组circST6GALNAC6过表达对erastin诱导的SLC7A11、GPX4减少和COX2升高的促进作用被逆转(图2)。7 c).与体外实验结果一致,circST6GALNAC6可抑制HSPB1的磷酸化水平,PKC过表达可部分挽救HSPB1的磷酸化水平(图2)。7 d).PKC治疗还消除了circST6GALNAC6过表达对异种移植瘤中eratin诱导的MDA上调和GSH下调的增强效应。7 e, F分别)。Erastin增加了p-p38和p-JNK蛋白的表达水平,circST6GALNAC6或PKC过表达都进一步增强或阻断了p-p38和p-JNK蛋白的表达水平。7 g).最终采用免疫组化(IHC)和铁染色方法评估各组中SLC7A11、GPX4的表达和铁含量,结果显示,额外PKC处理部分避免了circST6GALNAC6过表达导致的GPX4、SLC7A11水平下降和铁含量升高(图。7小时,我).通过RNA下拉和RIP-PCR实验进一步评价circST6GALNAC6与HSPB1在体内的相互作用,结果均表明circST6GALNAC6可与HSPB1结合(补充图2)。S7A B).总的来说,这些发现支持circST6GALNAC6通过降低体内HSPB1的磷酸化水平来增加膀胱癌细胞的铁下垂。
将稳定表达circST6GALNAC6或/和OE-PKC的J82细胞送入裸鼠左侧。小鼠接种7 d后,用1 mg/kg的erastin处理21 d。在实验结束时,切除肿瘤,拍照并称重。一个显示各组肿瘤的代表性图像。B肿瘤体积及生长曲线。C,D检测各组肿瘤组织中SLC7A11、GPX4、COX2、p-HSPB1蛋白表达情况。制作(E) MDA和(F)测定各组肿瘤中谷胱甘肽含量。G检测各组肿瘤中p-p38、p38、p-JNK、JNK蛋白的表达。H各组肿瘤组织Ki67、SLC7A11、GPX4、p-HSPB1免疫组化分析。我各组肿瘤均有铁染色。J结论的图形模型。图中的平均值±标准差表示三个重复的相对水平。* p< 0.05, **p< 0.01。
讨论
circRNA(s)在人类癌症中的极端稳定性、高丰度和组织特异性表达使其成为一种有前途的生物标志物和癌症诊断和治疗的靶点25.因此,circRNA(s)在调节癌细胞的各种细胞事件中起着至关重要的作用25.最近的报道表明,circRNA(s)是调节癌细胞铁下垂的关键介质之一。例如,circ_0008035被发现是一种“癌基因”,通过miR-599/EIF4A1轴抑制胃癌细胞铁下垂11.Circ_ABCB10有助于提高直肠癌细胞对铁下垂的敏感性26.Circ_IL4R促进肝细胞癌的发生,抑制铁下垂27.不同的环状rna (circRNA(s))对铁下垂有不同的影响和调控机制。因此,circRNA(s)与铁下垂的关系值得进一步研究。
目前的研究首次表明,circST6GALNAC6通过与HSPB1相互作用,在体内外增强了膀胱癌细胞对eratin诱导的铁坠症的敏感性,因此,通过控制circST6GALNAC6/HSPB1/P38调节轴诱导铁坠症可能是膀胱癌的一种新的治疗选择。
HSPB1在多种肿瘤组织中广泛表达,HSPB1高表达与预后不良密切相关28.在BC中,HSPB1与肿瘤分级、临床分期、DNA倍体及复发密切相关,其表达对膀胱癌患者的生存有统计学意义29.circST6GALNAC6过表达组与对照组相比,总HSPB1蛋白水平无变化。circST6GALNAC6过表达显著降低了HSPB1的磷酸化水平,促进了铁下垂。这些发现与先前的研究一致,表明HSPB1磷酸化对铁下垂的贡献18.
生物信息学(rna -蛋白质相互作用预测,RPISeq)表明,最有可能的circST6GALNAC6结合域是HSPB1的n端,在那里发现了三个常见的磷酸化位点(Ser-15, Ser-78和Ser-82)30..因此,circST6GALNAC6结合到HSPB1的n端结构域可能会导致这些可能的磷酸化位点通过空间占用而失活(图2)。7 j).
本研究结果表明,erastin可以增加p-HSPB1 (Ser-15, Ser-78和Ser-82)的表达,但仅通过circST6GALNAC6结合减少了Ser-15磷酸化位点,从而缓解了HSPB1对铁下垂的抑制作用。删除HSPB1的n端,进一步确认circST6GALNAC6在HSPB1中的结合域。结果显示circST6GALNAC6不与HSPB1结合,circST6GALNAC6对膀胱癌铁衰的影响被消除。以上结果表明circST6GALNAC6与HSPB1的n端结合。
综上所述,本研究明确了circST6GALNAC6在膀胱癌细胞铁下垂中的可能调控机制。CircST6GALNAC6通过与HSPB1的Ser-15位点附近结合并阻断其磷酸化,增加了膀胱癌细胞对擦黄素诱导的铁坠病的敏感性。这一机制部分依赖于铁衰胁迫下HSPB1的磷酸化抑制。迄今为止,很少有研究报道circRNA(s)通过结合HSPs影响铁下垂。细胞应激反应是一个复杂的网络。因此,erastin诱导的HSPB1磷酸化可能是一个级联的开始,值得进一步深入研究。
数据可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。
参考文献
马丁内斯·罗德里格斯,R. H, Buisan Rueda, O. & Ibarz, L.膀胱癌:现在和未来。地中海中国149, 449-455(2017)。
西格尔,R. L.,米勒,K. D., Fuchs, H. E. & Jemal, A.癌症统计,2021。CA癌症J临床71, 7-33(2021)。
阿卜杜拉,F.,甘达利亚,G.,图雷,R.,施米奇斯,J.,田,Z.,杰尔德雷斯,C.等。美国特定阶段膀胱癌的发病率、生存率和死亡率:趋势分析癌症的论文37, 219-225(2013)。
孔宁,陈晓燕,冯俊,段涛,刘少平,孙旭年等。黄芩苷通过下调FTH1诱导膀胱癌细胞铁下垂。药物学报B11, 4045-4054(2021)。
Qi, A., Wang, C., Ni, S.,孟,Y., Wang, T., Yue, Z.等。膀胱内黏胶水凝胶通过三层策略传递氧化铁纳米颗粒诱导耐化疗膀胱癌铁上睑病变。ACS Appl Mater接口,13, 44(2021)。
Hsu, m.t., & Coca-Prados, M.真核细胞细胞质中环状RNA的电子显微镜证据。自然280, 339-340(1979)。
Cocquerelle, C., Mascrez, B., Hetuin, D. & Bailleul, B.错误剪接产生环状RNA分子。美国实验生物学学会联合会J7, 155-160(1993)。
Memczak, S., Jens, M., Elefsinioti, A., Torti, F., Krueger, J., Rybak, A.等。环状rna是一大类具有调控作用的动物rna。自然495, 333-338(2013)。
rybaker - wolf, A., Stottmeister, C., Glazar, P., Jens, M., Pino, N., Giusti, S.等人。哺乳动物大脑中的环状rna是高度丰富的,保守的,动态表达的。摩尔细胞58, 870-885(2015)。
雷敏,郑国刚,宁强,郑健,董东。环状rna在人类癌症中的翻译和功能作用。摩尔癌症19, 30(2020)。
李超,田勇,梁勇,李强,Circ_0008035通过miR-599/EIF4A1轴参与胃癌细胞增殖,抑制细胞凋亡和铁脱落。癌细胞Int20., 84(2020)。
张海燕,张保文,张志斌,邓庆杰。环状RNA TTBK2通过miR-761/ITGB8轴调控胶质瘤细胞增殖、侵袭和铁脱落。欧洲最新医学药理学24, 2585-2600(2020)。
张慧,葛铮,王铮,高勇,王勇,曲欣。环状RNA RHOT1通过mir-106a-5p/STAT3轴促进乳腺癌进展并抑制铁下垂。老龄化(纽约州奥尔巴尼)13, 8115-8126(2021)。
谭松,康勇,李红,何宏强,郑良,吴淑琴等,circST6GALNAC6通过海绵miR-200a-3p调控STMN1/EMT轴抑制膀胱癌转移。细胞死亡12, 168(2021)。
热休克蛋白在癌症中的临床、预后和治疗意义。现行药物目标19, 1478-1490(2018)。
Takayama, S, Reed, J. C. & Homma, S.热休克蛋白作为细胞凋亡的调节因子。致癌基因22, 9041-9047(2003)。
Rogalla, T., Ehrnsperger, M., Preville, X., Kotlyarov, A., Lutsch, G., Ducasse, C.等。磷酸化对Hsp27寡聚化、伴侣功能和抗氧化应激/肿瘤坏死因子α的保护活性的调节生物化学274, 1897 -18956(1999)。
太阳,X。,或者,Z,谢,M, Kang,风扇,Y。,妞妞,X等。HSPB1作为铁性癌细胞死亡的新型调节因子。致癌基因34, 5617-5625(2015)。
Kamada, M., So, A., Muramaki, M., Rocchi, P., Beraldi, E., Gleave, M.使用基于核苷酸的治疗方法敲除Hsp27抑制肿瘤生长并增强人膀胱癌细胞的化疗。Mol Cancer Ther6, 299-308(2007)。
杨晓明,杨晓明,杨晓明。丝裂原活化蛋白激酶在细胞凋亡调控中的作用。致癌基因23, 2838-2849(2004)。
阿瑟,J. S. & Ley, S. C.丝裂原激活蛋白激酶在先天免疫。Nat Rev Immunol13, 679-692(2013)。
Chang w·T。弓,Y,傅,p . J。,c . Y。,c . Y。Chang黄懿慧et al。一种海洋萜类化合物,即异性瘤素,可诱导肝癌细胞凋亡和铁下垂,并参与ROS和MAPK通路。oxidmedcell longv2021, 7689045(2021)。
L。,,Y。,赵,Y。,Wang H,赵,江x, Y . et al。铁下垂与氧-葡萄糖剥夺/再氧诱导的支持细胞死亡有关。国际Mol医学41, 3051-3062(2018)。
李勇,陈峰,陈俊,陈绍生,何勇,刘伟等。双硫仑/铜通过ROS/MAPK和铁下垂途径诱导对鼻咽癌细胞和癌症相关成纤维细胞的抗肿瘤活性。癌症12, 138(2020)。
Kristensen, L. S., Hansen, T. B., Veno, M. T. & Kjems, J.癌症中的环状rna:该领域的机遇与挑战。致癌基因37, 555-565(2018)。
冼志勇,胡斌,王涛,蔡建林,曾建勇,邹强等。CircABCB10沉默通过调控直肠癌中miR-326/CCL5轴抑制细胞铁下垂和凋亡。赘生物67, 1063-1073(2020)。
徐强,周亮,杨国强,孟,F.,万勇,王磊等。CircIL4R通过调控miR-541-3p/GPX4轴促进肝细胞癌的发生并抑制铁下垂。细胞生物学44, 2344-2356(2020)。
Nagaraja, g.m, Kaur, P. & Asea, A.人和小鼠HspB1在转移中的作用。Curr Mol医学12, 1142-1150(2012)。
El-Meghawry El-Kenawy, A., El-Kott, A. F. & Hasan, M. S.热休克蛋白表达独立预测血吸虫病相关膀胱癌的生存结局。Int J生物学标记23, 214-218(2008)。
张,D, Wong, L. L. & Koay, E. S. Hsp27 Ser78磷酸化与乳腺癌HER-2/neu状态和淋巴结阳性的相关性。摩尔癌症6, 52(2007)。
资金
湖南省自然科学基金(No. 2019JJ40442)、国家自然科学基金(No. 2019JJ40442)资助。81972195),湖南省重点领域研发计划项目(批准号:81972195);2019SK2253),湖南省卫生健康委员会科研计划项目(批准号:2019SK2253);20201047)、湖南省临床医学技术创新指导项目(批准号:S2020SFYLJS0311)。
作者信息
作者及隶属关系
贡献
l.w.:概念化,方法论,写作-初稿准备,调查,验证。s.w.:方法论,可视化。软件,数据管理。k.a.:数据管理,验证。R.X:方法论,验证。软件,可视化。X.Z:构思,写作-初稿准备,监督,写作-审查和编辑。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
伦理批准并同意参与
裸鼠(雄性,7-8周龄)由湖南SJA实验动物有限公司提供,动物实验按照中南大学动物实验伦理委员会指导原则进行。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
根据与作者或其他权利持有人签订的出版协议,《自然》杂志或其许可方对本文拥有独家权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。
关于本文
引用本文
王磊,吴绍生,何宏。et al。CircRNA-ST6GALNAC6通过调节HSPB1/P38轴增加膀胱癌细胞对擦脂素诱导的铁下垂的敏感性。实验室投资102, 1323-1334(2022)。https://doi.org/10.1038/s41374-022-00826-3
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41374-022-00826-3