摘要gydF4y2Ba
尽管最近测序技术和使用数百个细胞系的大规模药物筛选取得了进展,但作为癌症治疗的指导,基于突变的生物标志物的预测准确性仍然不够。因此,使用替代生物标志物的新型诊断方法将是非常可取的。我们假设信号分子磷酸化的敏感性特异性变化可能在这方面有用。在这里,为了开发一种结合特异性生物标志物和患者来源的肿瘤类器官(PDOs)来预测癌症对顺铂的反应的方法,我们发现顺铂敏感细胞系或PDOs在顺铂治疗后24小时内表现出增强的c-Jun磷酸化(p-c-Jun)。我们还比较了6例匹配患者中6例PDOs对顺铂的反应与新辅助化疗(多西他赛/顺铂/5-氟尿嘧啶)的疗效。在机制上,c-Jun的诱导部分与顺铂诱导的TNF信号通路有关。我们的数据表明,对顺铂治疗的反应增强的c-Jun磷酸化可能是一种预测顺铂在选定癌症患者中的疗效的生物标志物。gydF4y2Ba
简介gydF4y2Ba
癌症患者治疗结果的预测很重要,因为个体间药物疗效的差异很大。大规模的药物筛选和测序技术促进了许多抗癌药物临床疗效预测方法的发展gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.然而,基于基因突变的预测准确性仍然有限gydF4y2Ba3.gydF4y2Ba新型的诊断方法仍然是需要的。gydF4y2Ba
患者源性肿瘤类器官(PDOs)是来源于人肿瘤组织的三维(3D)肿瘤细胞培养物gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.PDOs作为临床前癌症模型可能提供巨大的好处,因为它们紧密地概括了匹配的原始肿瘤组织的形态和遗传特征gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.此外,在各种肿瘤类型中,PDOs的建立成功率普遍高于传统2D细胞系gydF4y2Ba15gydF4y2Ba.gydF4y2Ba
为了开发新的诊断方法,我们专注于药物治疗后信号转导的敏感性相关变化,并提出这些变化可以用作预测性生物标志物。之前,我们报道了一个这样的例子,其中MEK抑制剂治疗后核糖体蛋白S6 (pS6)磷酸化的降低与胃癌和结肠癌细胞对该抑制剂的敏感性密切相关gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.通过联合使用PDOs,我们推测,MEK抑制后pS6的这种变化可能适用于作为MEK抑制剂疗效的预测生物标志物gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
顺铂被广泛应用于胃癌、食管癌、结直肠癌、肺癌、卵巢癌和膀胱癌等多种肿瘤的治疗,但基于基因组或转录组信息对其疗效的预测仍不尽如人意gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.因此,在本研究中,我们通过研究顺铂治疗后信号分子磷酸化状态与顺铂敏感性之间的相关性,探索顺铂敏感性的预测生物标志物。为了评估在PDOs中检测到的预测生物标志物是否具有敏感性特异性,我们建立了来自胃癌(GC)和食管癌(EC)的PDOs,然后分析了顺铂治疗后PDOs中对顺铂敏感性与细胞反应之间的关系。gydF4y2Ba
材料与方法gydF4y2Ba
病人gydF4y2Ba
pdo的建立得到了所有相关患者和大分大学伦理委员会的批准(批准号为1495和1496)。患者信息见表gydF4y2Ba1gydF4y2Ba.对于GC pdo,使用来自晚期GC患者的手术切除组织或内镜活检样本。对于EC pdo,使用来自计划接受DCF-NAC后手术的患者的内窥镜活检样本。gydF4y2Ba
细胞系gydF4y2Ba
我们使用了20个胃癌细胞系,这些细胞系的资源、培养条件和特性在我们之前的研究中有详细的介绍gydF4y2Ba17gydF4y2Ba.所有的细胞系在从供应商那里收到的一个月内被培养了几代,每一种细胞系的等份被冷冻。如前所述,它们于2014年11月通过短串联重复分析验证gydF4y2Ba17gydF4y2Ba.gydF4y2Ba
c- jun敲除细胞的建立gydF4y2Ba
根据Ran等人之前的报道,使用CRISPR/Cas9系统敲除TMK-1和NUGC-3细胞中的c-Jun。gydF4y2Ba21gydF4y2Ba.pSpCas9(BB)-2A-Puro (PX459)是张锋教授(Addgene质粒# 48139;gydF4y2Bahttp://n2t.net/addgene:48139gydF4y2Ba;RRID: Addgene_48139)。将靶向c-Jun的引导RNA(5ʹ-CCATAAGGTCCGCTCTCGGA-3ʹ)插入pSpCas9(BB)-2A-Puro中,将得到的质粒转染TMK-1和NUGC-3。转染1 d后,质粒阳性细胞用含2µg/ml嘌呤霉素的培养基富集48 h,用有限稀释法克隆。除使用非靶向pSpCas9(BB)-2A-Puro外,敲除实验的对照细胞以与敲除细胞相同的方式克隆。gydF4y2Ba
细胞系顺铂敏感性试验gydF4y2Ba
细胞以2-10 × 10的密度播种gydF4y2Ba3.gydF4y2Ba96孔板中的细胞/孔,根据其生长速度,在镀后96 h达到半合流。播种后,细胞孵育24小时,然后用生理盐水或顺铂(Pfizer Inc, New York, NY, USA)处理,用培养液稀释至0.1、1、5、10和20µM浓度72小时。采用CellTiter96水溶液细胞增殖试验(Promega, Madison, WI, USA)分析顺铂的生长抑制作用。IC50值采用抑制率与浓度之间的线性关系计算。gydF4y2Ba
患者来源的肿瘤类器官(PDOs)gydF4y2Ba
从GC和EC组织中建立的类器官,如先前报道的那样,进行了一些修改gydF4y2Ba7gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.对于来自GC组织的pdo,将原发组织的内镜活检或手术标本切碎成0.5 mmgydF4y2Ba3.gydF4y2Ba使用手术刀,用DMEM(赛默飞世尔科学公司,沃尔瑟姆,马萨诸塞州,美国)加1% FCS和1%青霉素/链霉素清洗三次。上清液转移到新的15毫升试管中,300倍离心gydF4y2BaggydF4y2Ba在4°C浸泡20分钟后加入冷洗介质,使体积增加到12毫升。收集的上皮细胞被包埋在1:2的洗涤介质和生长因子减少的Corning Matrigel (Corning, NY, USA)的混合物中,并作为20 μ l液滴放置在多孔板中。基本上,我们在12孔板中每孔播撒6个液滴,并将1毫升含有高级DMEM/F12(赛默飞世尔科学公司)的胃癌培养基覆盖,其中添加了50% Wnt条件培养基(生产细胞系的MTA来自荷兰Hubrecht研究所)、10% r -spondin1条件培养基(Trevigen, Gaithersburg, MD, USA)、10% noggin条件培养基(生产细胞系的MTA来自荷兰Hubrecht研究所)、1xB27 (Thermo Fisher Scientific), 1 mM烟酰胺(Sigma-Aldrich), 1.25 mM n -乙酰半胱氨酸(Sigma-Aldrich), 1µM A83-01 (Sigma-Aldrich), 100 ng/ml重组人EGF (PeproTech, London, UK), 5 nM胃蛋白酶I (Tocris Bioscience, Bristol, UK), 50 ng/ml重组人FGF10 (Tocris Bioscience), 100µg/ml Primocin (InvivoGen, San Diego, CA, USA)。每2天更换一次培养基。用TrypLE(赛默飞世尔科学公司)中断培养,并根据每个PDO的生长速度,每6-10天以1:2至1:4的比例分裂一次。gydF4y2Ba
对于来自EC组织的pdo,内镜活检被切碎成0.5 mmgydF4y2Ba3.gydF4y2Ba碎片用手术刀用冷洗介质冲洗三次。组织碎片用10 U/ml的disase II (Thermo Fisher Scientific)在室温下孵育10分钟。孵育后,用冷PBS冲洗片段,用TrypLE在37℃下消化10分钟,并在thermoixer C (Eppendorf, Humburg, Germany)上以750 rpm的速度混合。消化后,让剩余的组织碎片沉淀,将上清转移到一个新的15毫升含有洗涤介质的离心管中。剩余的组织碎片被消化,上清液再次转移到相同的15毫升试管中。上清液300 ×离心gydF4y2BaggydF4y2Ba在4°C后加入冷洗介质,使体积增加到12毫升。收集的上皮细胞被包埋在1:2的洗涤介质和Matrigel的混合物中,并如上所述以液滴的形式放置。将12孔板中ECs的PDOs覆盖1 ml含有高级DMEM/F12的EC培养基,其中含有10% R-spondin 1条件培养基、10% noggin条件培养基、1xB27、1 mM烟酰胺、1.25 mM n-乙酰半胱氨酸、0.5µM A83-01、100 ng/ml重组人EGF、10 nM胃泌素I和100µg/ml Primocin。每2天更换一次培养基。用TrypLE破坏培养,并根据生长速度每6-10天以1:2至1:4的比例分裂一次。gydF4y2Ba
患者源性肿瘤类器官的顺铂敏感性试验gydF4y2Ba
在药敏试验之前,用TrypLE破坏类器官,并在12孔板中以高于常规传代(1:1或更低)的密度培养。电镀3天后,用1 ml 0.2%的disase II在37°C下处理5分钟,从Matrigel中收集类器官。用洗涤介质洗涤后,用70µm细胞过滤器过滤类器官(Greiner Bio One, Frichenhausen, Germany),然后用15µm细胞过滤器再次过滤通过过滤器的类器官(pluriSelect, Leipzig, Germany)。用2-5 ml洗涤液收集捕获的类器官,计数,离心,重悬于含有10% Matrigel和顺铂(浓度为0、1、5、10、20或30µM)的类器官培养基中。然后在96孔板(96孔微孔板细胞排斥表面F-Bottom;Greiner Bio One), 37℃培养5天。使用CellTiter-Glo 3D细胞活力测定试剂盒根据制造商的说明(Promega)确定类器官活力。gydF4y2Ba
细胞凋亡检测gydF4y2Ba
为了研究细胞凋亡诱导,根据制造商的说明(Promega),使用Caspase-Glo 3/7测定系统在96孔格式中检测caspases 3和7的活性。gydF4y2Ba
蛋白质组分析器gydF4y2Ba
使用Proteome Profiler试剂盒,按照制造商的说明书(Human Phospho-Kinase Antibody Array ARY003B;研发系统,明尼阿波利斯,明尼苏达州,美国)。我们为每个样品使用400µg蛋白质。gydF4y2Ba
西方墨点法gydF4y2Ba
样品制备时,用生理盐水、5µM顺铂或10µM顺铂处理在10 cm培养皿中生长的细胞系24小时,用冷PBS洗涤两次,用sds修饰的RIPA缓冲液收集,含有蛋白酶和磷酸酶抑制剂鸡尾酒(cOmplete Mini和PhosSTOP EASY包装;Roche Diagnostics, Mannheim, Germany),然后在冰上孵育20分钟进行细胞裂解。同样,用生理盐水、10 μ M顺铂或20 μ M顺铂处理在Matrigel中生长的pdo 24小时,收集,并与1 ml细胞恢复液(Corning)在1.5 ml试管中冷藏20分钟。离心400 ×gydF4y2BaggydF4y2Ba在4°C下5分钟,用冷PBS冲洗,用sds修饰的RIPA缓冲液在冰上溶解20分钟。随后,细胞系或类器官的裂解物在17400 ×下离心gydF4y2BaggydF4y2Ba4℃加热20分钟。上清液转移到新管中,得到的细胞裂解液(20µg)与Laemmli样品缓冲液一起煮沸并进行SDS-PAGE。然后将样品转移到PVDF膜上(Merk Millicellpore, Darmstadt, Germany),用Block Ace (DS Pharma, Osaka, Japan)在RT下阻断30分钟,然后在4°C下用抗p-p38 (Thr180/Tyr182) (Cat#4631,细胞信号技术,Danvers, MA, USA), p-c-Jun (Ser63)(生物素化)(Cat#5464,细胞信号技术),p-c-Jun (Ser63) (Cat#2361,细胞信号技术),total C - jun (Cat#9165,细胞信号技术)的一抗孵育过夜,p-JNK (Thr183/Tyr185) (Cat#4668,细胞信号技术),β-肌动蛋白(Cat#sc-47778, Santa Cruz Biotechnology, Santa Cruz, CA, USA)或GAPDH (Cat#sc-32233, Santa Cruz Biotechnology)。清洗后,用合适的二抗在室温下孵育1小时。我们使用streptavidin-HRP (AB7403;Abcam)。信号可视化使用ECL Western blotting分析系统(GE Healthcare, Piscataway, NJ, USA)。用ImageJ测量p-c-Jun的条带强度,并与β肌动蛋白进行归一化。然后,在10µM顺铂处理的细胞中,c-Jun的磷酸化水平相对于模拟处理的细胞表达为倍数变化。gydF4y2Ba
免疫荧光gydF4y2Ba
如前所述,测定PDOs的免疫荧光gydF4y2Ba16gydF4y2Ba.用5 μ M顺铂处理或不使用5 μ M顺铂处理的pdo用4%多聚甲醛固定30 min,并用1xPBS轻轻洗涤三次。然后用0.5% Triton X-100/PBS渗透20分钟,用Block Ace (DS Pharma)在0.05% tween - 20/TBS中阻断1小时,在室温下,用1:500稀释的p-c-Jun (Ser73)一抗(Cat#3270, Cell Signaling Technology)在4℃下孵育过夜。随后,用0.05% Tween20/TBS洗涤类器官三次,并用二抗(Alexa Fluor R488, 1:500;赛默飞世尔科学公司)和DAPI(稀释1:1000)在RT 2小时。清洗后,使用LSM 710共聚焦激光显微镜(Carl Zeiss, Oberkochen,德国)捕获图像。gydF4y2Ba
多西他赛/顺铂/5-氟尿嘧啶(5FU)新辅助化疗反应评价(DCF-NAC)gydF4y2Ba
DCF-NAC方案包括3个疗程的1小时静脉输注多西他赛(70 mg/mgydF4y2Ba2gydF4y2Ba第1天,顺铂(70 mg/m)输注2小时gydF4y2Ba2gydF4y2Ba),并持续静脉滴注5-FU (750 mg/mgydF4y2Ba2gydF4y2Ba)在第1至5天。本课程每3周重复3次gydF4y2Ba24gydF4y2Ba.手术安排在化疗结束后4-6周内进行。对衍生出EC002、EC006、EC015、EC020、EC021和EC022的原发肿瘤的肿瘤体积进行评估gydF4y2Ba18gydF4y2BaF-FDG PET/CT,采用VOX-BASE II软件(J-MAC System,札幌,日本)进行分析。通过比较DCF-NAC第一个或第三个疗程前后原发肿瘤的SULmax(瘦体获得的最大标准化摄取值)来表示原发肿瘤的治疗反应率。用直径1.0 cm的感兴趣体积区(ROI)放置在肿瘤最热的区域测量SULmax。我们还测定了正常肝脏右叶3厘米直径的ROI中肿瘤的SULmax是否至少比肝脏的SULmean +2SDs高1.5倍。gydF4y2Ba
基因表达芯片gydF4y2Ba
对于基因表达微阵列,顺铂敏感PDO EC007用模拟培养基处理,10 μ M顺铂处理24小时,或10 μ M顺铂处理24小时加40 μ M JNK抑制剂(SP600125)处理最后3小时,分为3个重复,如图所示。gydF4y2Ba4gydF4y2Ba.收集总rna并用Cy3染料标记,然后按照前面所述进行微阵列分析gydF4y2Ba25gydF4y2Ba.简单地说,根据制造商的说明,使用FastGene RNA Premium Kit结合DNase处理(NIPPON Genetics, Tokyo, Japan)从每个PDO中提取总RNA,使用Quick Amp标记试剂盒(Agilent Technologies, Palo Alto, CA, USA)进行标记,并使用Human GE 4x44K v2 Microarray Kit (G4845A;Agilent Technologies)在65°C下放置17小时。清洗后,用高分辨率微阵列扫描系统(安捷伦科技)扫描微阵列载玻片上的信号,并用特征提取软件(安捷伦科技)进行量化。使用genspring GX11软件(安捷伦科技)对获得的原始数据进行分析。为了在多个阵列之间进行比较,探针集数据在每个芯片上进行中值归一化。然后,数据集中在四个对照样本的基因上,然后根据信号强度和标记值进行过滤。差异表达基因采用方差分析,并进行事后Tukey和Benjamini-Hochberg校正。经校正的基因gydF4y2BaPgydF4y2Ba<0.05为差异表达。为了鉴定顺铂治疗后JNK/c-Jun的靶基因,我们比较了顺铂治疗后JNK/c-Jun显著上调1.2倍以上的基因和顺铂存在时JNK抑制剂显著下调1.2倍以上的基因。使用DAVID对常见失调基因进行KEGG通路分析gydF4y2Ba26gydF4y2Ba.虚假发现率(FDR) <0.05的KEGG词条被认为是显著的。gydF4y2Ba
定量RT-PCRgydF4y2Ba
根据制造商的说明,使用具有通用探针库的LightCycler 480实时PCR系统和LightCycler 480探针主系统(Roche Diagnostics, Penzberg, Germany)对来自PDOs的总rna进行qRT-PCR分析。所有感兴趣基因的引物集均由罗氏诊断公司设计。所有检测均采用KPNA6内部控制规范。gydF4y2Ba
分泌TNFα的测量gydF4y2Ba
按照制造商说明书,使用Quantikine HS ELISA人TNF-α免疫测定法(研发系统)测定顺铂治疗后PDOs中的TNF-α分泌。gydF4y2Ba
统计分析gydF4y2Ba
双面学生的gydF4y2BatgydF4y2Ba用检验方法分析不同细胞系的实验差异。数据报告为四次测定的平均值±标准差。gydF4y2BaPgydF4y2Ba<0.05为差异有统计学意义。gydF4y2Ba
结果gydF4y2Ba
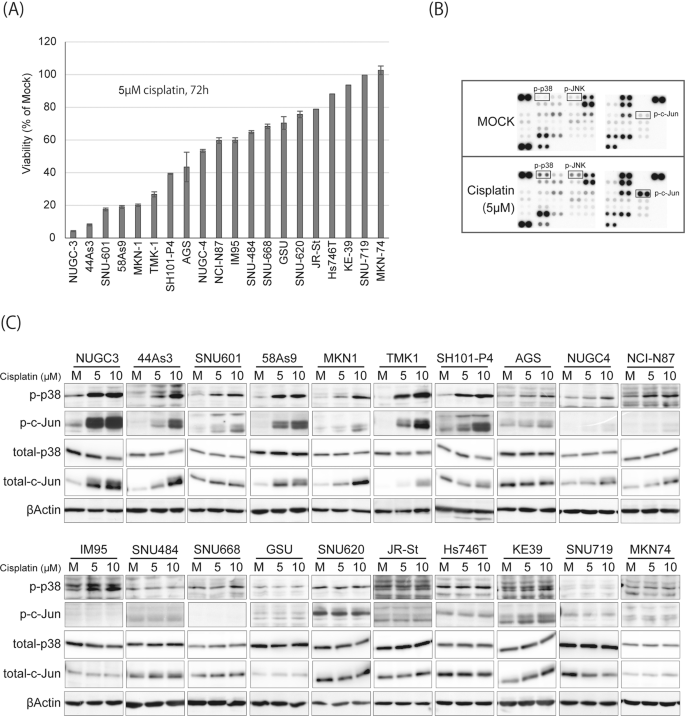
顺铂敏感性与GC细胞系中p38和c-Jun磷酸化增强有关gydF4y2Ba
为了筛选顺铂敏感性的候选生物标志物,我们使用了一系列GC细胞系作为药物试验模型,因为我们之前已经从传代比、药物试验所需的细胞数量和验证方面对这些细胞系进行了描述gydF4y2Ba17gydF4y2Ba.首先,我们评估了20个GC细胞系对顺铂的敏感性(图。gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2BaS1gydF4y2Ba).为了鉴定受顺铂影响的磷酸化蛋白,我们研究了顺铂敏感细胞系TMK-1中43种蛋白的磷酸化水平,无论有无顺铂治疗。如图所示。gydF4y2Ba1 bgydF4y2Ba和无花果。gydF4y2BaS2gydF4y2Ba, p38 (p-p38), JNK (p-JNK)和c-Jun (p-c-Jun)的磷酸化在治疗后得到了增强,这与其他组先前的研究一致gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.为了确定该通路的激活是否与所有20种GC细胞系的顺铂敏感性相关,我们使用Western blotting分析了顺铂处理后p38和c-Jun的磷酸化水平。如图所示。gydF4y2Ba1 cgydF4y2Ba对顺铂高度敏感的细胞系,包括NUGC-3、44As3、SNU-601、58As9、MKN-1、TMK-1和SH101-P4,对顺铂均表现出明显的p38和c-Jun的激活反应,而其他细胞系则反应不大。提示p38和c-Jun对顺铂反应的激活可能与顺铂敏感性相关。顺铂处理后,顺铂敏感细胞系的总c-Jun也增加,可能是由于c-Jun转录的自动激活。gydF4y2Ba
顺铂敏感性与PDOs中c-Jun磷酸化增强有关gydF4y2Ba
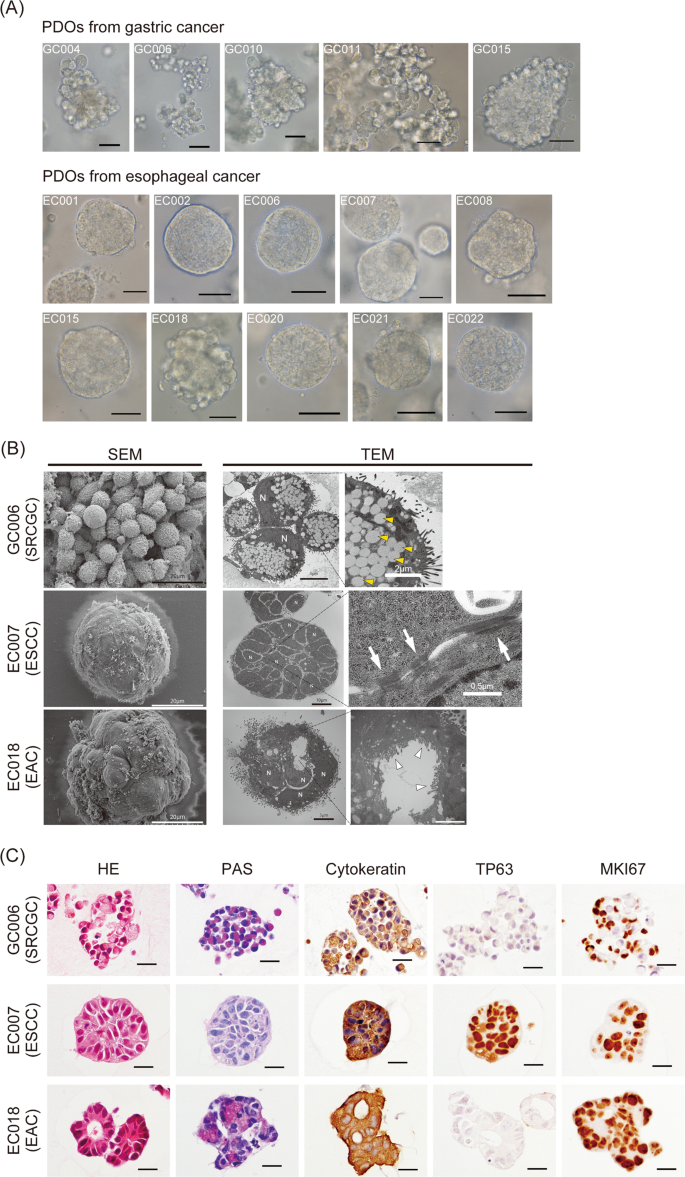
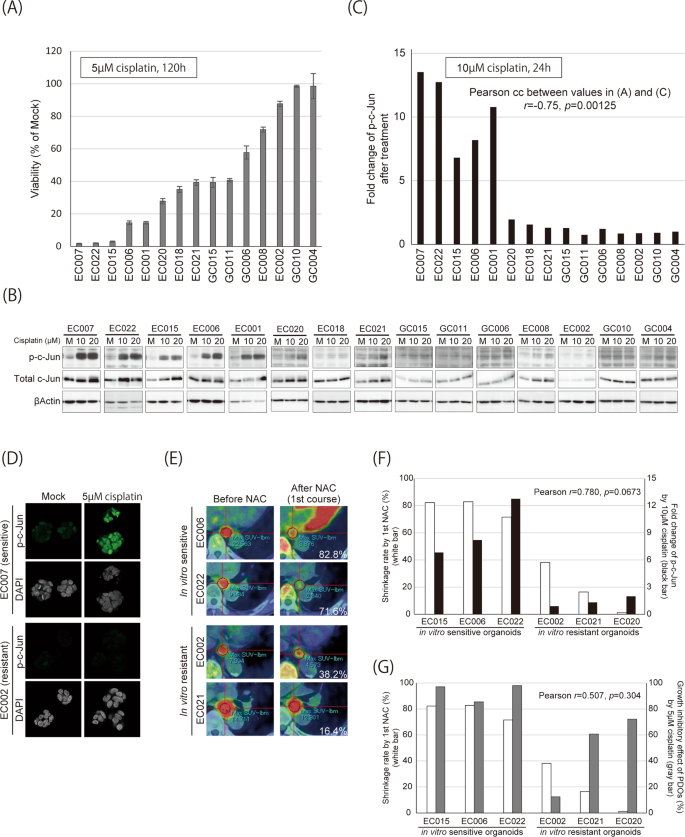
我们在细胞系上的数据表明,通过比较p-p38或p-c-Jun在顺铂存在和不存在的情况下,有可能识别顺铂敏感肿瘤。为了建立体外临床前模型,我们分别从5例GC和10例EC中建立PDOs(表2)gydF4y2Ba1gydF4y2Ba,无花果。gydF4y2Ba2gydF4y2Ba),并通过超微结构和免疫组织化学分析,检查了三种典型PDOs的典型组织学特征(图。gydF4y2Ba2 b, CgydF4y2Ba).然后,我们研究了这些PDOs对顺铂的敏感性以及顺铂处理后p38和c-Jun的磷酸化水平(图。gydF4y2Ba3 a, BgydF4y2Ba,gydF4y2BaS3gydF4y2Ba和无花果。gydF4y2BaS4gydF4y2Ba).5个最敏感的PDOs-EC001, EC006, EC007, EC015和ec022显示c-Jun磷酸化显著增加(图5)。gydF4y2Ba3 b, CgydF4y2Ba),提示c-Jun对顺铂反应的激活与其对顺铂的敏感性相关(Pearson’sgydF4y2BargydF4y2Ba=−0.75,gydF4y2BapgydF4y2Ba= 0.00125)。与细胞系获得的结果相反,即使在敏感PDOs中,p-p38也几乎不受顺铂治疗的影响(图2)。gydF4y2BaS4gydF4y2Ba).所有胃pdo的敏感性均低于5个最敏感的类器官(图。gydF4y2Ba3gydF4y2Ba),均未表现出p38或c-Jun对顺铂反应的激活(图。gydF4y2Ba3 bgydF4y2Ba).免疫染色也可检测到敏感和耐药类器官之间c-Jun激活的差异。gydF4y2Ba3 dgydF4y2Ba),暗示了其作为一种基于免疫荧光的生物标志物的潜在应用。gydF4y2Ba
一个gydF4y2Ba来自胃癌和食管癌的pdo的亮场显微镜图像。所有胃癌pdo均起源于低分化的肿瘤组织,表现出较低的一致性(GC006和GC011)和葡萄状生长模式(GC004、GC010和GC015),没有任何管腔结构。食管pdo除1例(EC018)外均起源于鳞状细胞癌组织,呈圆形,无管腔结构。EC018来源于食管腺癌组织,其轮廓比来源于鳞状癌组织的PDOs更不规则。gydF4y2BaBgydF4y2Ba胃印戒细胞癌(SRCGC) (GC006)、食管鳞状细胞癌(ESCC) (EC007)和食管腺癌(EAC) (EC018)衍生pdo的扫描(SEM)和透射(TEM)电子显微镜图像。扫描电镜(SEM)显示GC006细胞团簇凝聚力较弱,透射电镜(TEM)显示粘液颗粒丰富(黄色箭头)。此外,在GC006中,细胞核(N)被颗粒向细胞外围压缩。GC006的这些特征是SRCGC的典型特征。EC007在扫描电镜下显示为实心球形,含有大量无腔结构的细胞,与鳞状癌组织衍生的类器官的特征一致gydF4y2Ba7gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.细胞之间也观察到紧密连接(白色箭头)。电镜下EC018表面不规则,透射电镜下可见微绒毛排列的腔内结构(白色箭头),这是腺癌的特征。gydF4y2BaCgydF4y2Ba苏木精伊红(HE),周期酸-希夫(PAS;免疫组化抗AE1/AE3(泛细胞角蛋白标记物)、TP63(基底细胞标记物)和Ki67(增殖标记物)。GC006和EC018 PAS染色阳性,提示这些PDOs产生粘蛋白。3个类器官均为细胞角蛋白(AE1/AE3)阳性,提示其来源为上皮细胞。EC007中几乎所有的细胞都呈TP63阳性,因此它们具有鳞状细胞的特征。三种类器官均含有丰富的mki67阳性细胞,表明它们具有增殖能力。酒吧gydF4y2Ba一个gydF4y2Ba而且gydF4y2BaCgydF4y2Ba分别为50和20 μ m。gydF4y2Ba
一个gydF4y2BaPDOs用5 μ M顺铂处理5天,使用CellTiter-Glo 3D细胞活力测定试剂盒测定细胞活力。gydF4y2BaBgydF4y2BaPDOs用模拟培养基或顺铂(10或20 μ M)处理24小时,然后用抗p-c-Jun、总c-Jun或β-actin的抗体进行Western blotting。gydF4y2BaCgydF4y2Ba顺铂处理后p-c-Jun表达的折叠变化如“Materials and Methods”所述,排列顺序与中相同gydF4y2Ba一个gydF4y2Ba.折叠变化值与5 μ M顺铂处理细胞的存活率进行比较gydF4y2Ba一个gydF4y2Ba采用Pearson相关系数(Pearson cc)进行比较。gydF4y2BaDgydF4y2Ba对顺铂敏感(EC007)和耐药(EC002) PDOs用模拟培养基或5 μ M顺铂处理24 h,并对p-c-Jun进行免疫荧光。gydF4y2BaEgydF4y2BaFDG摄取是肿瘤体积的指示,用颜色表示(红色最高),并在CT图像上叠加。肿瘤体积用直径为1 cm的roi内的SULmax表示,并将其放置在每个肿瘤的最热区域。原发肿瘤收缩率(%)参照“材料与方法”计算,用白色表示。未修剪的图像如图所示。gydF4y2BaS5gydF4y2Ba.gydF4y2BaFgydF4y2Ba对比第一个疗程DCF-NAC后原发肿瘤的收缩率(白色条)与配对PDOs中顺铂诱导p-c-Jun的变化(黑色条;与(中的值相同gydF4y2BaCgydF4y2Ba))。gydF4y2BaGgydF4y2Ba比较第一个疗程DCF-NAC治疗后原发肿瘤的收缩率(白色条)与PDOs的生长抑制作用(灰色条;中的值计算gydF4y2Ba一个gydF4y2Ba).在gydF4y2BaFgydF4y2Ba而且gydF4y2BaGgydF4y2Ba,相关性分析采用Pearson相关检验。gydF4y2Ba
接下来,我们将PDOs中的p-c-Jun诱导与其匹配的原始肿瘤组织对包括多西他赛、顺铂和5-氟尿嘧啶(5-FU) (DCF-NAC)在内的新辅助化疗的临床反应进行了比较。10例EC患者中8例行DCF-NAC,其中6例行PET/CT评估肿瘤反应。其中4例PET/CT图像如图所示。gydF4y2Ba3 egydF4y2Ba而且gydF4y2BaS5gydF4y2Ba.我们测定了6例患者的PET/CT信息在第一次DCF-NAC治疗前后的肿瘤收缩比(图2)。gydF4y2Ba3 fgydF4y2Ba).化疗后出现大幅收缩(>70%)的肿瘤PDOs (EC015, EC006和EC022)在顺铂治疗后表现出明显的p-c-Jun诱导,尽管由于样本量小,这种相关性没有达到统计学意义(gydF4y2BapgydF4y2Ba= 0.0673)。我们还比较了匹配pdo中ddf - nac的临床反应与5µM顺铂的生长抑制作用,发现来自回归程度最大的三个肿瘤(EC015、EC006和EC022)的pdo也比其他3个类器官(EC002、EC021和EC020)表现出更大的生长抑制作用,尽管相关性远低于p-c-Jun诱导(gydF4y2BapgydF4y2Ba= 0.304)gydF4y2Ba3 ggydF4y2Ba).经内镜观察,DCF-NAC的影响也很明显。gydF4y2BaS6gydF4y2Ba).值得注意的是,EC020原发肿瘤在DCF-NAC治疗第1个疗程后仅出现轻微收缩(1.11%),但在第3个疗程后出现大幅收缩(79.48%)(图。gydF4y2Ba3 f, GgydF4y2Ba和无花果。gydF4y2BaS6gydF4y2Ba).gydF4y2Ba
我们还证实,冻融循环和长期传代对顺铂处理后的p-c-Jun敏感性或诱导均影响不大(数据未显示,图2)。gydF4y2BaS7gydF4y2Ba).这些结果表明,c-Jun磷酸化增强联合PDOs可能是预测含顺铂治疗敏感性的潜在可靠生物标志物。gydF4y2Ba
c-Jun的磷酸化增强部分参与了tnf诱导的细胞因子的表达gydF4y2Ba
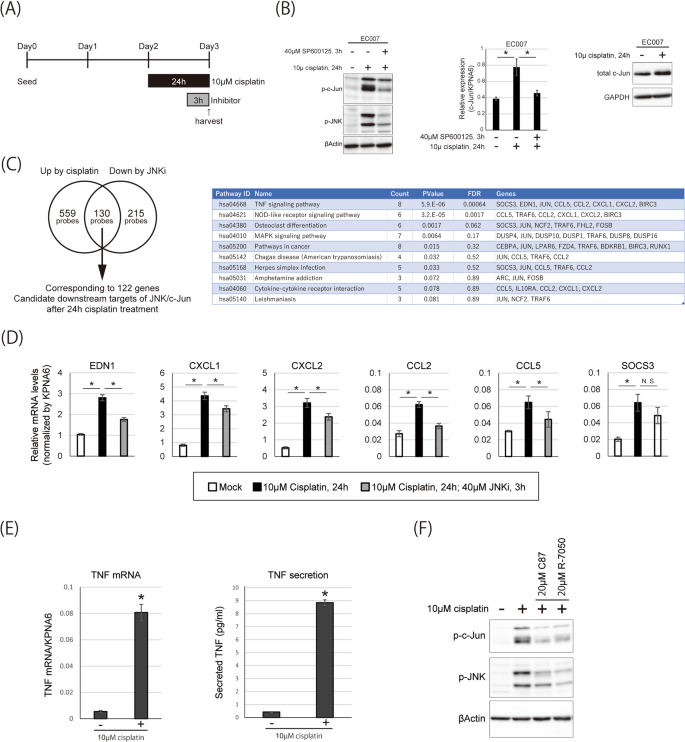
我们假设c-Jun是由c-Jun的主要上游激酶JNK磷酸化的,因为在TMK-1细胞中,顺铂处理也增强了JNK的磷酸化(图2)。gydF4y2Ba1 bgydF4y2Ba和无花果。gydF4y2BaS2gydF4y2Ba).我们在顺铂存在的情况下使用JNK抑制剂SP600125进行了测试,发现在顺铂敏感PDO EC007中,在顺铂处理的最后3小时内,JNK抑制了c-Jun和JNK的磷酸化(图7)。gydF4y2Ba4 a、BgydF4y2Ba).此外,顺铂处理后,EC007细胞中c-Jun的表达在mRNA和蛋白水平上均有所增加(图7)。gydF4y2Ba4 bgydF4y2Ba).这些结果表明,顺铂处理通过JNK通路在mRNA和蛋白水平上激活c-Jun。gydF4y2Ba
一个gydF4y2Ba顺铂及抑制剂治疗方案。gydF4y2BaBgydF4y2BaEC007,顺铂敏感PDO,用顺铂联合或不联合JNK抑制剂(SP600125)治疗gydF4y2Ba一个gydF4y2Ba分别进行Western blotting(左、右图)和qRT-PCR(中图)。gydF4y2BaCgydF4y2Ba顺铂处理后显著上调超过1.2倍的探针(左圈,共689个探针)和顺铂处理后JNK抑制后显著下调超过1.2倍的探针,如图gydF4y2Ba一个gydF4y2Ba(右圈,共345个探针)通过顺铂处理在EC007中鉴定出JNK/c-Jun的下游候选靶点(122个基因对应交集处的130个探针)。利用DAVID对候选基因进行KEGG通路分析,探索关键通路。FDR <0.05的KEGG项被认为是显著的。gydF4y2BaDgydF4y2Ba通过qRT-PCR检测TNF信号通路相关基因的表达水平。EC007采用顺铂联合或不联合JNK抑制剂(SP600125)治疗,治疗方案见gydF4y2Ba一个gydF4y2Ba.gydF4y2BaEgydF4y2Ba采用qRT-PCR和Quantikine HS ELISA人TNF-α免疫分析(研发系统)分析顺铂治疗对EC007中TNF的诱导作用。gydF4y2BaFgydF4y2BaTNF抑制c-Jun和JNK磷酸化的影响。EC007采用顺铂联合或不联合TNF抑制剂(C87和R-7050)治疗,治疗方案如图所示gydF4y2Ba一个gydF4y2Ba.gydF4y2Ba
为了解决JNK/c-Jun激活的后果,我们探索了在治疗的最后3小时内,在顺铂治疗24小时后,有或没有JNK抑制的整体基因表达谱。我们鉴定出122个基因在顺铂治疗后显著上调,而在JNK抑制后显著下调。进一步的KEGG通路分析显示,tnf相关分子在基因列表中富集最为显著(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).通过qRT-PCR验证TNFα信号相关基因的表达(图2)。gydF4y2Ba4 dgydF4y2Ba),除SOCS3外,只有轻微的上调趋势。事实上,顺铂可在mRNA和蛋白水平诱导TNFα的表达(图。gydF4y2Ba4 egydF4y2Ba).我们还研究了使用R-7050和C87抑制TNFα信号的作用,R-7050抑制TNFR与其适配器蛋白(例如TRADD和RIP)的相互作用,C87通过调节TNF和TNFR的相互作用来抑制TNFα信号。我们发现它们都部分抑制了JNK和c-Jun的磷酸化,尽管不是完全抑制。gydF4y2Ba4 fgydF4y2Ba).此外,我们试图研究TNF信号通路与R-7050和C87的抑制是否有助于顺铂耐药。然而,出乎意料的是,即使单独使用R-7050或C87治疗,也会在24小时内引起大量细胞死亡(数据未显示)。这些抑制剂早在治疗开始后5小时就诱导了细胞凋亡,早于顺铂诱导的细胞凋亡(数据未显示)。因此,R-7050和C87可能通过JNK/c- jun不依赖通路导致细胞死亡,使用TNF敲除细胞或TNF中和抗体可能更适合研究TNF抑制对顺铂敏感性的影响。还需要进一步的研究。综上所述,这些结果表明,JNK/c-Jun通路被TNF部分激活,经顺铂治疗后上调,并参与调控TNF下游细胞因子的表达。gydF4y2Ba
顺铂诱导的JNK/c-Jun通路激活有助于细胞凋亡gydF4y2Ba
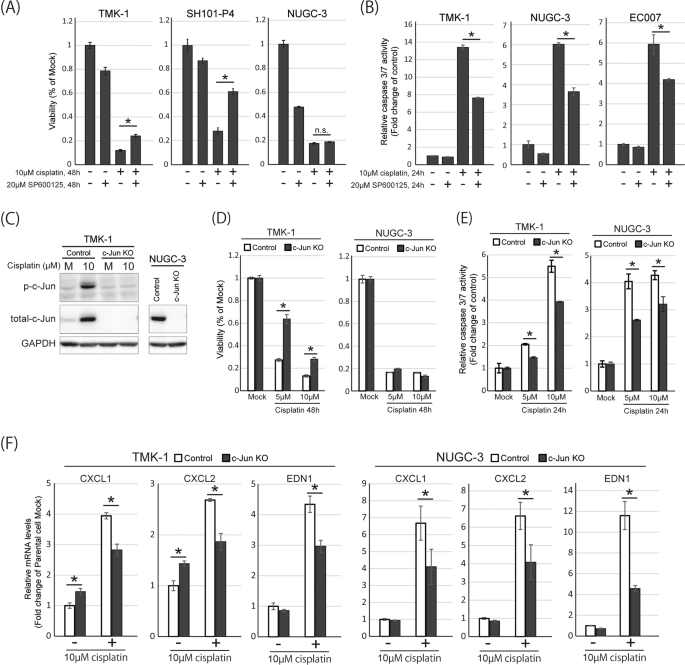
接下来,我们研究了JNK/c-Jun激活对顺铂敏感性的贡献。首先,我们使用JNK抑制剂SP600125在顺铂处理的细胞中抑制JNK的激活,并分析细胞活力和凋亡诱导。TMK-1和SH101-P4细胞在JNK抑制下对顺铂的反应中表现出改善的细胞存活率,而NUGC-3细胞则没有(图2)。gydF4y2Ba5gydF4y2Ba).相反,24小时顺铂处理引起caspase激活,这在两种细胞系以及PDO细胞系EC007中都被JNK抑制显著抑制(图7)。gydF4y2Ba5 bgydF4y2Ba).这些结果表明,顺铂治疗可引起细胞凋亡,JNK激活参与了细胞凋亡的诱导。其次,为了研究c-Jun在顺铂敏感性中的重要性,我们使用CRISPR/Cas9系统生成了c-Jun敲除细胞系。我们通过Western blotting证实了TMK-1和NUGC-3中c-Jun的敲除(图。gydF4y2Ba5度gydF4y2Ba),然后分析c-Jun敲除对敲除细胞中顺铂诱导的细胞毒性的影响。与JNK抑制实验结果相似,敲除c-Jun后,TMK-1细胞对顺铂表现出明显的耐药性,而NUGC-3细胞则没有(图5)。gydF4y2Ba5 dgydF4y2Ba).相比之下,两种敲除细胞系在顺铂处理后均显示caspase活化显著降低(图。gydF4y2Ba5 egydF4y2Ba).这些结果提示JNK/c-Jun的激活在一定程度上参与了顺铂诱导的细胞凋亡,抑制JNK/c-Jun可能与细胞凋亡诱导减少有关,这是顺铂耐药的特征之一gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.然而,JNK/c-Jun抑制细胞凋亡是否能改善顺铂治疗后的细胞生存,可能取决于癌细胞的细胞环境。此外,我们还发现c-Jun敲除抑制了顺铂诱导的细胞因子的表达(图。gydF4y2Ba5 fgydF4y2Ba),如EDN1, CXCL1和CXCL2,证实了JNK/c-Jun激活参与了顺铂治疗后这些细胞因子的表达。gydF4y2Ba
一个gydF4y2Ba用10 μ M顺铂和/或20 μ M SP600125处理TMK-1、SH101-P4和NUGC-3 48 h, MTS法测定细胞存活率。gydF4y2BaBgydF4y2Ba用10µM顺铂和/或20µM SP600125处理TMK-1、NUGC-3和EC007 24 h,使用caspase Glo 3/7检测试剂盒测定caspase 3和7的活性。数据表示为相对于模拟处理的细胞的折叠变化。gydF4y2BaCgydF4y2Ba用模拟培养基或10 μ M顺铂处理对照或c-Jun敲除的TMK-1细胞24小时,然后使用抗p-c-Jun、总c-Jun和GAPDH抗体进行Western印迹。使用抗总c-Jun和GAPDH抗体对对照或c-Jun敲除的NUGC-3细胞进行Western印迹。gydF4y2BaDgydF4y2Ba用模拟培养基或顺铂(5 μ M或10 μ M)处理对照或c- jun敲除的TMK-1和NUGC-3细胞48 h,用MTS法测定细胞存活率。gydF4y2BaEgydF4y2Ba用模拟培养基或顺铂(5 μ M或10 μ M)处理对照或c- jun敲除的TMK-1和NUGC-3细胞24 h,使用caspase Glo 3/7检测试剂盒检测caspase 3和7的活性。gydF4y2BaFgydF4y2Ba通过qRT-PCR检测CXCL1、CXCL2和EDN1在对照或c- jun敲除TMK-1和NUGC-3中的表达。细胞因子的表达值以KPNA6值归一化,数据以相对于模拟处理的对照细胞的倍数变化表示。gydF4y2Ba
讨论gydF4y2Ba
尽管顺铂已被广泛应用于各器官癌症的标准化疗,但目前的诊断仍难以预测其疗效。在本研究中,我们旨在开发一种新的诊断方法来预测顺铂疗效,并假设顺铂治疗可能会差异激活一些细胞信号通路,这种差异激活可以用作顺铂反应的生物标志物。直到大约十年前,这一假设还不可能得到验证,因为传统的诊断材料是静态的,即固定的、冷冻的或溶解的组织,因此对药物治疗缺乏任何生物反应。然而,最近类器官技术的进步使我们能够使用活的癌症组织作为诊断材料。gydF4y2Ba
在本研究中,我们发现应激反应蛋白,包括p-38, JNK和c-Jun,在顺铂处理下被激活。虽然许多先前的研究已经报道了类似的结果,但大多数研究只使用了少数细胞系,因为他们的目的是研究顺铂的作用机制。相比之下,我们使用了许多细胞系和PDOs来研究响应强度与顺铂敏感性之间的相关性,因为我们的目的是测试将响应作为生物标志物与PDOs联合使用的可行性。我们发现p-c-Jun的变化与15个PDO系对顺铂的敏感性相关gydF4y2BargydF4y2Ba= -0.75,gydF4y2BapgydF4y2Ba= 0.00125)。此外,在6例匹配患者中,6例PDOs中p-c-Jun的表达增强与新辅助化疗的效果有相关性(gydF4y2BapgydF4y2Ba= 0.067)。据我们所知,这是首次报道的将顺铂治疗引起的p-c-Jun变化作为顺铂联合PDOs反应的生物标志物的研究。gydF4y2Ba
我们选择c-Jun磷酸化作为三种胁迫响应性磷酸化蛋白(p-38, JNK和c-Jun)的候选生物标志物有两个原因。首先,相对于细胞系,PDOs中p-p38的表达没有被诱导太多。第二,pJNK表达的变化不像p-c-Jun那样动态,其激活也难以通过免疫荧光检测。通过顺铂处理,c-Jun磷酸化的增强是足够动态的,可以使PDOs的顺铂反应分层,并且容易被免疫荧光检测,因此有利于减少所需PDOs的数量。这使我们能够通过使用一种新型生物标志物与PDOs结合,开发一个基于细胞反应的诊断系统原型。为了建立该诊断系统用于临床,还需要进行更多样本的大规模研究。gydF4y2Ba
目前,在类有机相关研究中,基于atp的细胞活力测定主要用于评估药物敏感性。然而,该方法在应用于临床诊断类器官时存在一定的实际局限性,因为其成本高,获得足够数量的类器官需要很长时间。此外,单个类器官的大小或生长速度的变化往往导致分析间和分析内的变化,从而限制了其在药物分析中的适用性。为了减少这种变化,需要复杂的程序,例如在药物分析前过滤以获得相似大小的类器官(见材料和方法中的“类器官活力测定”)和数学建模以纠正生长速度的变化gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba.在本研究中,我们发现免疫荧光可检测到顺铂治疗引起的p-c-Jun表达的变化,这将有利于减少所需的类器官数量,使类器官大小无关。因此,在有或没有顺铂治疗的类器官中检测p-c-Jun可能是一种简单而可靠的诊断方法,在预测顺铂敏感性方面比传统的细胞活力测定具有潜在优势。gydF4y2Ba
先前的研究和我们目前的调查表明,PDOs可以从内窥镜活检样本中建立gydF4y2Ba7gydF4y2Ba,gydF4y2Ba34gydF4y2Ba尽管这些样本所含的组织量(10- 20mg)比手术切除标本(> 200mg)要少。从内镜活检样本中建立pdo对于预测个别患者的药物疗效具有优势,因为复发或转移性肿瘤患者通常不接受手术,化疗可能是无法手术的肿瘤,特别是消化道肿瘤的唯一选择。因此,需要从诊断过程中获得的少量肿瘤组织作为剩余标本的预测系统是可取的。本研究中提出的预测系统包括通过免疫染色检测生物标志物,从而潜在地减少所需pdo的数量。虽然本研究仅针对顺铂,但目前的预测方法也适用于其他类型的细胞毒性药物,这些药物的疗效也难以通过突变诊断进行评估。gydF4y2Ba
近年来,开发基于类器官的诊断系统的研究日益增多。然而,那些研究体外药物敏感性与临床化疗反应之间的相关性的研究仍然有限gydF4y2Ba35gydF4y2Ba.因此,需要进一步研究体内药敏和体外药敏之间的关系。在这里,我们比较了PDOs的顺铂敏感性与匹配的原发肿瘤的DCF-NAC反应。尽管PDOs及其原发肿瘤的治疗方法不同(即单独使用顺铂或联合其他药物[多西他赛/顺铂/5-FU]),但在顺铂治疗后PDOs表现出p-c-Jun表达增加的患者(EC006、EC015和EC022)比PDOs未表现出这种反应的患者(EC002、EC021和EC020)对DCF-NAC的反应更好。这一发现表明,通过使用PDOs,检测p-c-Jun可能是一种有用的方法,用于识别可能受益于顺铂基础化疗的EC患者。有趣的是,EC021和EC020的生长抑制作用与顺铂治疗后p-c-Jun表达的折叠变化无关(图。gydF4y2Ba3 a, BgydF4y2Ba).虽然我们不能完全解释这种不一致,但我们意识到p-c-Jun折叠变化与新辅助化疗临床反应的相关性更明显(r = 0.78,gydF4y2BapgydF4y2Ba= 0.0673)高于生长抑制效应(r = 0.507,gydF4y2BapgydF4y2Ba= 0.304)gydF4y2Ba3 f, GgydF4y2Ba).因此,需要使用更大样本的进一步研究来确定使用PDOs、通过评估p-c-Jun诱导或基于atp的细胞活力测定来预测顺铂疗效是否更好。gydF4y2Ba
我们的数据表明,顺铂治疗诱导敏感PDO (EC007)分泌TNF,并激活JNK/c-Jun,导致细胞因子上调。此前Biton等人报道了DNA损伤后的相同分子动力学。gydF4y2Ba36gydF4y2Ba.他们证明,过量依赖泊苷引起的持续DNA损伤诱导了前馈NF-kB/TNF信号环路,其中也参与了JNK的激活gydF4y2Ba36gydF4y2Ba.持续的DNA损伤不仅是由于DNA损伤剂的过量,而且由于DNA修复基因的缺陷导致DNA修复延迟。因此,我们认为顺铂诱导的p-c-Jun可能是顺铂处理细胞中延迟DNA修复的替代标记物,因为我们在恒浓度顺铂下评估了多个细胞系或PDOs中的p-c-Jun。gydF4y2Ba
先前的研究表明,DNA修复基因的缺陷使细胞对顺铂敏感gydF4y2Ba29gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.因此,DNA修复基因的突变或缺失也可能是顺铂敏感性的潜在生物标志物。然而,即使使用了数百个细胞系,大规模的相关性分析也无法发现与顺铂敏感性相关的特定DNA修复基因的突变或缺失gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.这可能是因为对顺铂的响应性可能主要与DNA修复的功能缺陷有关,而不是特定基因的基因组突变。例如,已证明的缺陷gydF4y2BaERCC8gydF4y2Ba核苷酸切除修复(NER)基因与顺铂敏感性高度相关gydF4y2Ba38gydF4y2Ba.然而,在基因编码区已经发现了33个突变gydF4y2BaERCC8gydF4y2Ba宇宙细胞系计划(gydF4y2Bahttps://cancer.sanger.ac.uk/cell_linesgydF4y2Ba),且各突变类型的功能意义尚不明确:即,要将司机突变与乘客突变分开,需要对该基因进行功能分析。此外,有超过50个DNA修复基因显示出多种类型的突变,包括司机突变和乘客突变。在这些DNA修复基因中,约有15个是NER基因,主要与顺铂敏感性相关gydF4y2Ba39gydF4y2Ba.与顺铂敏感性相关的大量基因和突变可能使任何预测分析的尝试变得复杂。因此,研究功能后果,如信号转导的激活或失活,作为顺铂反应的替代生物标志物,而不是聚焦功能不明的突变,可能更合理。gydF4y2Ba
总之,我们开发了一种利用PDOs和一种新型生物标志物组合预测顺铂疗效的潜在有用方法。由于我们的研究存在一些局限性,例如样本量小,获得PDOs的成功率有限,并且专门关注c-Jun在敏感PDOs中的激活,因此在其临床应用得到证明之前,还需要更广泛的改进和验证。但考虑到顺铂是治疗各种实体肿瘤中应用最广泛、最有效的化疗药物之一,该方法值得进一步探索。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据可根据合理要求从相应作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Barretina, J, Caponigro, G, Stransky, N, Venkatesan, K, Margolin, AA, Kim, S,等。癌细胞系百科全书能够对抗癌药物敏感性进行预测建模。gydF4y2Ba自然gydF4y2Ba483gydF4y2Ba, 603-607(2012)。gydF4y2Ba
加内特,MJ,埃德尔曼,EJ,海德顿,SJ,格林曼,CD,达斯图尔,A,刘,KW等。癌细胞药物敏感性基因组标记的系统鉴定。gydF4y2Ba自然gydF4y2Ba483gydF4y2Ba, 570-575(2012)。gydF4y2Ba
Pauli, C, Hopkins, BD, Prandi, D, Shaw, R, Fedrizzi, T, Sboner, A,等。个性化体外和体内癌症模型,指导精准医疗。gydF4y2Ba癌症越是加大gydF4y2Ba7gydF4y2Ba, 462-477(2017)。gydF4y2Ba
Sato, T, Stange, DE, Ferrante, M, Vries, RG, Van Es, JH, Van den Brink, S,等。人结肠、腺瘤、腺癌和巴雷特上皮的上皮类器官长期扩张。gydF4y2Ba胃肠病学gydF4y2Ba141gydF4y2Ba, 1762-1772(2011)。gydF4y2Ba
萨克斯,N, Clevers, H.用于分析癌症表型的类器官培养。gydF4y2BaGenet开发总监gydF4y2Ba24gydF4y2Ba, 68-73(2014)。gydF4y2Ba
Vlachogiannis, G, Hedayat, S, Vatsiou, A, Jamin, Y, Fernandez-Mateos, J, Khan, K,等。患者来源的类器官模型转移性胃肠道癌的治疗反应。gydF4y2Ba科学gydF4y2Ba359gydF4y2Ba, 920-926(2018)。gydF4y2Ba
木岛,T,中川,H, Shimonosono, M, Chandramouleeswaran, PM, Hara, T, Sahu, V,等。三维类器官揭示食管和口咽鳞状细胞癌细胞的治疗耐药性。gydF4y2Ba细胞Mol胃肠醇肝醇gydF4y2Ba7gydF4y2Ba, 73-91(2019)。gydF4y2Ba
Driehuis E, van Hoeck A, Moore K, Kolders S, Francies HE, Gulersonmez MC,等。胰腺癌类器官概括疾病,并允许个性化药物筛选。gydF4y2Ba美国国家科学研究院gydF4y2Ba(2019)。gydF4y2Ba
Driehuis, E, Kolders, S, Spelier, S, Lohmussaar, K, Willems, SM, Devriese, LA,等。口腔粘膜类器官作为个体化癌症治疗的潜在平台。gydF4y2Ba癌症越是加大gydF4y2Ba9gydF4y2Ba, 852-871(2019)。gydF4y2Ba
van de Wetering, M, Francis, HE, Francis, JM, Bounova, G, Iorio, F, Pronk, A,等。结直肠癌患者活体类器官生物库的前瞻性推导。gydF4y2Ba细胞gydF4y2Ba161gydF4y2Ba, 933-945(2015)。gydF4y2Ba
Matano, M, Date, S,下川,M,高野,A,藤井,M, Ohta, Y,等。利用crispr - cas9介导的人类肠道类器官工程构建结直肠癌模型。gydF4y2BaNat地中海gydF4y2Ba21gydF4y2Ba, 256-262(2015)。gydF4y2Ba
央行,科幻小说。,Hwang, CI., Baker, LA., Chio, II., Engle, DD. & Corbo, V. et al. Organoid models of human and mouse ductal pancreatic cancer.细胞gydF4y2Ba160gydF4y2Ba, 324-338(2015)。gydF4y2Ba
Li, X, Francies, HE, Secrier, M, Perner, J, Miremadi, A, Galeano-Dalmau, N,等。类器官培养概括了食管腺癌的异质性,为无性研究和精确治疗提供了模型。gydF4y2BaNat CommungydF4y2Ba9gydF4y2Ba, 2983(2018)。gydF4y2Ba
Lee, SH, Hu, W, Matulay, JT, Silva, MV, Owczarek, TB, Kim, K,等。膀胱癌患者源性类器官模型的肿瘤演化和药物反应。gydF4y2Ba细胞gydF4y2Ba173gydF4y2Ba, 515-528 e517(2018)。gydF4y2Ba
Weeber, F, Ooft, SN, Dijkstra, KK,Voest, EE。肿瘤类器官作为药物发现的临床前癌症模型。gydF4y2Ba细胞化学及生物学gydF4y2Ba24gydF4y2Ba, 1092-1100(2017)。gydF4y2Ba
平下,Y,冢本,Y,工藤,Y, Kakisako, D,黑木,S, Hijiya, N,等。核糖体蛋白S6磷酸化的早期反应与结直肠癌细胞对曲美替尼的敏感性相关。gydF4y2Ba实验室投资gydF4y2Ba101gydF4y2Ba, 1036-1047(2021)。gydF4y2Ba
平下,Y,冢本,Y,柳原,K,藤本,S, Hijiya, N,中田,C,等。核糖体蛋白S6磷酸化降低与胃癌细胞对MEK抑制的敏感性相关。gydF4y2Ba癌症科学gydF4y2Ba107gydF4y2Ba, 1919-1928(2016)。gydF4y2Ba
Bellmunt, J, Pons, F,Orsola, A.顺铂新辅助化疗反应的分子决定因素。gydF4y2BaCurr Opin UrolgydF4y2Ba23gydF4y2Ba, 466-471(2013)。gydF4y2Ba
黄丽娟,黄丽娟,黄丽娟。非小细胞肺癌顺铂敏感性的药物基因组学研究。gydF4y2Ba蛋白质组学生物信息学gydF4y2Ba12gydF4y2Ba, 198-209(2014)。gydF4y2Ba
Ecke TH。以顺铂为基础的膀胱癌化疗中的生物标志物。gydF4y2BaAdv Exp医学生物学gydF4y2Ba867gydF4y2Ba, 293-316(2015)。gydF4y2Ba
Ran, FA, Hsu, PD, Wright, J, Agarwala, V, Scott, DA, Zhang, F.使用CRISPR-Cas9系统进行基因组工程。gydF4y2BaNat ProtocgydF4y2Ba8gydF4y2Ba, 2281-2308(2013)。gydF4y2Ba
Bartfeld, S, Bayram, T, van de Wetering, M, Huch, M, Begthel, H, Kujala, P,等。人胃上皮干细胞的体外扩增及其对细菌感染的反应。gydF4y2Ba胃肠病学gydF4y2Ba148gydF4y2Ba, 126-136 e126(2015)。gydF4y2Ba
Busslinger, GA, Weusten, BLA, Bogte, A, Begthel, H, Brosens, LAA,Clevers, H。人食管、胃和十二指肠的胃肠道上皮单细胞分辨率。gydF4y2Ba细胞代表gydF4y2Ba34gydF4y2Ba, 108819(2021)。gydF4y2Ba
Fujishima, H, Fumoto, S,柴田,T, Nishiki, K,冢本,Y, Etoh, T,等。食管癌患者对多西他赛、顺铂和5-氟尿嘧啶新辅助化疗完全缓解的17分子组预测gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba12gydF4y2Ba, e0188098(2017)。gydF4y2Ba
冢本,Y,中田,C,野口,T,谷川,M,阮,LT,内田,T,等。MicroRNA-375在胃癌中下调,并通过靶向PDK1和14-3-3zeta调节细胞存活。gydF4y2Ba癌症ResgydF4y2Ba70gydF4y2Ba, 2339-2349(2010)。gydF4y2Ba
金久,M,后藤,S,服部,M,青木木下,KF,伊藤,M,川岛,S,等。从基因组学到化学基因组学:KEGG的新进展。gydF4y2Ba核酸测定gydF4y2Ba34gydF4y2Ba, d354-357(2006)。gydF4y2Ba
闫,D,安,G,郭,MT. C-Jun n端激酶信号通路对顺铂的响应。gydF4y2Ba细胞Mol医学gydF4y2Ba20.gydF4y2Ba2013-2019(2016)。gydF4y2Ba
Mansouri, A, Ridgway, LD, Korapati, AL, Zhang, Q, Tian, L, Wang, Y,等。顺铂对JNK/p38 MAPK通路的持续激活导致卵巢癌细胞Fas配体诱导和细胞死亡。gydF4y2Ba生物化学gydF4y2Ba278gydF4y2Ba, 19245-19256(2003)。gydF4y2Ba
Helbig, L, Damrot, J, Hulsenbeck, J, Koberle, B, Brozovic, A, Osmak, M,等。应激激活蛋白激酶/c-Jun n端激酶在修复缺陷细胞中由顺铂诱导的DNA损伤引发的晚期激活。gydF4y2Ba生物化学gydF4y2Ba286gydF4y2Ba, 12991-13001(2011)。gydF4y2Ba
Brozovic, A, Osmak, M.顺铂对丝裂原活化蛋白激酶的激活及其在顺铂耐药中的作用。gydF4y2Ba癌症列托人gydF4y2Ba251gydF4y2Ba, 1-16(2007)。gydF4y2Ba
Wang, Q, Shi, S, He, W, Padilla, MT, Zhang, L, Wang, X,等。通过抑制miR-940, RIP1保留MKP1的表达并减弱jnk介导的凋亡,从而抑制顺铂耐药。gydF4y2BaOncotargetgydF4y2Ba5gydF4y2Ba, 1304-14(2014)。gydF4y2Ba
哈里斯,洛杉矶,弗里克,PL,加贝特,SP,哈德曼,KN,保罗,BB,洛佩兹,CF,等。体外抗增殖药物效果的无偏计量。gydF4y2BaNat方法gydF4y2Ba13gydF4y2Ba, 497-500(2016)。gydF4y2Ba
Hafner, M, Niepel, M, Chung, M,Sorger, PK.生长速率抑制指标正确测量癌症药物敏感性的混杂因素。gydF4y2BaNat方法gydF4y2Ba13gydF4y2Ba, 521-527(2016)。gydF4y2Ba
Nanki, K, Toshimitsu, K, Takano, A,藤井,M,下川,M, Ohta, Y,等。人胃癌发生过程中Wnt和R-spondin生态位独立性的不同途径。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 856-869 e817(2018)。gydF4y2Ba
Veninga, V,Voest, EE肿瘤类器官:指导精准医疗的机遇与挑战。gydF4y2Ba癌症细胞gydF4y2Ba39gydF4y2Ba, 1190-1201(2021)。gydF4y2Ba
Biton, S,Ashkenazi, A. NEMO和RIP1通过TNF-alpha前馈信号控制广泛DNA损伤的细胞命运。gydF4y2Ba细胞gydF4y2Ba145gydF4y2Ba, 92-103(2011)。gydF4y2Ba
布尔默,JT,扎卡尔,NJ,彩虹,AJ。转录偶联修复缺陷的人类细胞显示Jun n端激酶的延长激活和顺铂治疗后的敏感性增加。gydF4y2Ba癌症化疗药物gydF4y2Ba56gydF4y2Ba, 189-198(2005)。gydF4y2Ba
Furuta, T, Ueda, T, Aune, G, Sarasin, A, Kraemer, KH,Pommier, Y.转录偶联核苷酸切除修复作为人类细胞顺铂敏感性的决定因素。gydF4y2Ba癌症ResgydF4y2Ba62gydF4y2Ba, 4899-4902(2002)。gydF4y2Ba
靶向DNA修复和复制应激治疗卵巢癌。gydF4y2BaInt J临床肿瘤gydF4y2Ba22gydF4y2Ba, 619-628(2017)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢木本麻美女士的技术援助。我们也感谢Hans Clevers教授,Georg A Busslinger博士,Else Driehuis博士和Stieneke van den Brink女士对类器官实验的重要建议。这项工作得到了大分大学校长战略酌情基金(2020年和2021年)、JSPS kakeni资助号JP21H02703和JP18H02631、武田科学基金会(2020年)和日本AMED转化研究网络项目种子A (A232)的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化y.t.、Y.H.、M.M.;形式分析与调查y.t., s.k., s.f., S.Y., F.M.;写作-初稿准备y.t., y.h., N.H., M.M.;Writing-review和编辑t。快速出拳,顺丰速递,梁龙骥,花旗集团(C.N:行情,K.K, T.F, K.M.i, Y.U, T.E T.U,。M.T。t.d., k.u., S.H,。kmu和M.I.;Y.T.;资源t。快速出拳,,12,顺丰速递,梁龙骥,K.M.i, Y.U, T.E, T.H。s.h.、K.M.u.和M.I.; Supervision: K.M.u., M.I., N.H. and M.M. All authors have approved the final version of the paper.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
伦理批准gydF4y2Ba
本研究由大分大学医学院伦理委员会批准(批准号1495和1496)。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
根据与作者或其他权利持有人签订的出版协议,《自然》杂志或其许可方对本文拥有独家权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
冢本,Y,黑木,S,柴田,T。gydF4y2Baet al。gydF4y2Ba顺铂治疗增强的c-Jun磷酸化结合患者来源的肿瘤类器官作为顺铂反应的潜在预测生物标志物。gydF4y2Ba实验室投资gydF4y2Ba102gydF4y2Ba, 1355-1366(2022)。https://doi.org/10.1038/s41374-022-00827-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41374-022-00827-2gydF4y2Ba