摘要
目前的教条是存在一种造血多功能干细胞,驻留在骨髓中,它是静止的,但具有巨大的增殖和分化潜力。此外,造血系统基本上是分级的,从多能干细胞逐步分化为不同类别的造血细胞。然而,这里总结的结果表明,骨髓多功能造血干细胞是积极的循环,因此不断改变表型。在细胞周期分化过程中,B220和GR-1表位表面表达的顺序变化表明分化潜力的变化。进一步的数据表明,纯化的造血干细胞的潜力扩展到多种其他非造血细胞。在细胞周期的某些阶段,骨髓干细胞可能会分化为肺上皮细胞。因此,骨髓“造血”干细胞似乎也是其他非造血组织的干细胞。这些观察结果产生了通用干细胞的概念。骨髓干细胞并不局限于造血,它的分化潜能在细胞周期中不断变化。因此,骨髓中有一种万能的干细胞,它在细胞周期中改变其分化潜能。 This potential is expressed when it resides in tissues compatible with its differentiation potential, at a particular point in cell cycle transit, or when it interacts with vesicles from that tissue.
简介
造血干细胞(HSC)是一种表达c-kit、Sca-1和CD150的休眠的非循环系阴性细胞,具有分化为造血末端细胞和自我更新的能力。造血干细胞已被证明受组织微环境和循环细胞因子的影响。在小鼠移植研究中,通过确定致命照射小鼠的多系造血能力,该细胞已被最彻底地描述。通过利用分化谱系定义抗体的荧光激活细胞分选去除细胞,然后选择干细胞定义抗体,最常见的是抗sca -1,抗c-Kit和抗CD150,将其分离出来。细胞分离的潜在影响当然很重要。干细胞的抗体连接当然可能是刺激性的或抑制性的,需要研究出来。这应该是未来研究的一个方面。以类似的方式,需要评估排除染料的方法对细胞的影响。另外需要考虑的是辅助细胞对干细胞活性的潜在影响。关于辅助性T细胞和干细胞也有大量的文献,这可以被视为与本综述有关的一个单独的问题。 A review in 2015 by Goodell and colleagues [1注意到:“令人惊讶的是,在“干细胞”一词被创造出来100多年后,我们又在争论各种组织中不同细胞类型之间的相互关系。”他们接着说:“剩下的一个关键问题是,在这些组织中是否有一个‘超级’干细胞。”这是我们干细胞存在和调节新模型的核心。在他们的综述中,他们概述了三种可能的模式;一种是传统模型,一种是由一群性质略有不同的干细胞组成的联合模型,另一种是投机模型,在这种模型中,干细胞被视为罕见的储备细胞,偶尔会产生谱系限制祖细胞[1].
我们提出,事实上,有一个细胞可以作为所有组织的干细胞。这种细胞的表型是由它的细胞周期状态和它所在的组织决定的。在这里,我们概述了这个模型的数据和推理。回顾了四个主要的考虑因素(表1(1)干细胞在基线状态下的细胞表型随细胞周期通过的改变,(2)干细胞在细胞周期不同时间点的分化潜力(3)微环境的影响和干细胞可塑性(4)干细胞异质性。所有这些密切相关的考虑都指向一种适用于所有组织的循环通用干细胞的存在。
基线时细胞周期状态及表型随周期转运的变化
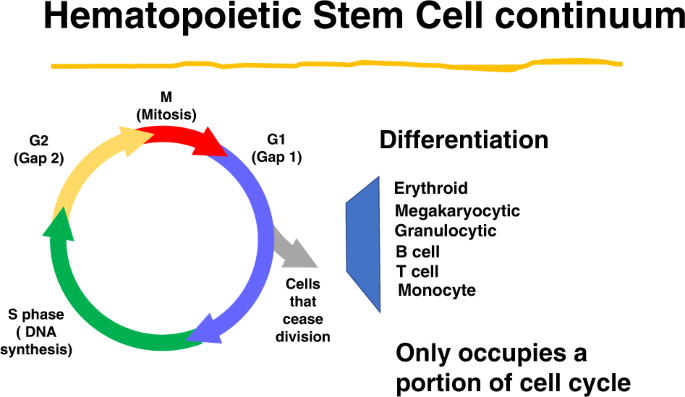
早在2002年,我们就提出了造血的连续体模型[2,3.].在持续的研究中,研究骨髓干细胞在细胞因子诱导的细胞周期转运的不同点。研究的细胞包括完整的未分离骨髓,血统阴性的罗丹明低Hoechst低(LRH)分离骨髓细胞和血统阴性的Sca-1阳性细胞,通过白细胞介素3 (IL-3), IL-6, IL-11和钢因子,或血小板生成素,Flt3配体和钢因子刺激细胞循环。观察到造血干细胞在细胞周期的不同时间点可逆地改变表型。这些变化可在短期和长期植入致死性辐照小鼠中看到[4],在homing to marrow [5],以祖细胞与干细胞的比率计算[6],表达黏附受体[7,8和一般基因表达[9],并分化为巨核细胞和粒细胞[10].这些研究是关于细胞通过细胞因子刺激的细胞周期转运的过程。随着细胞周期的进展,原始的长期再繁殖小鼠干细胞的表型发生了显著的变化。我们的数据表明,造血干细胞处于连续的变化中,而不是在经典描述的干细胞/祖细胞层次中。我们的数据在很大程度上依赖于体外细胞培养中细胞因子刺激的骨髓种群。因此,Passegue等人的出色工作。[11对我们很重要。这些研究人员评估血统阴性,c-Kit+本来+ Thy1.1intFlk2int用Hoechst 33422 P和Pyronin Y染色分离出细胞的DNA/RNA含量,并在细胞周期的不同时间点进行评估,长期植入致死性辐照小鼠。研究了以下馏分:G0(极低Pyronin 2n DNA)、G1 (Pyronin升高)和S/G2/M (Hoechst染色DNA含量升高)。仅在G0群体中可见到定植。这表明我们关于周期依赖性表型变化的数据可能不适用于基线稳定的造血干细胞,而支持连续体干细胞模型的数据可能与体外培养伪影有关。我们继续评估按照Passegue等人的方法分离的纯化干细胞。11].基本上,我们证实了他们的结果,显示G0组几乎完全长期移植。然而,在考虑这些数据的同时,我们注意到没有人评估过未分离的全鼠骨髓长期再繁殖干细胞的细胞周期状态。我们一直对卡纳曼和特维斯基的研究很感兴趣。12他觉得代表性和可用性启发式可能适用于这里。许多数据支持纯化方法,分级干细胞模型的明显性与分化到末端细胞,因此,减少了对替代可能性的追求。因此,我们开始评估在未分离的全骨髓细胞中长期再繁殖的多系干细胞的细胞周期状态。细胞经单独Hoechst染色或经Passegue等人描述的Hoechst 33342/PyroninY染色,分为G0、G1和S/G2/M或G0/G1和S/G2/M。[11],评估了它们在致命辐照C57BL/6 J宿主中的长期再繁殖能力。我们测定了12个月的血液和骨髓嵌合情况[13].在S/G2/M组分中,始终有50%或更多的植入(3个独立实验,每个时间点10-17只小鼠,p> 0.05 (Wilcoxon秩和分析),与纯化骨髓干细胞的结果形成鲜明对比。这是对细胞周期的瞬时观察。最后,在一次实验中,首次移植1年后的S/G2/M骨髓移植优于G0/G1骨髓移植。
这些是有争议的数据,所以我们试图用不同的方法来证实这些结果。此外,流式细胞术的细胞群存在一定的重叠,因此我们选择用氚化胸苷激酶自杀法评估纯化干细胞和未分离骨髓中的干细胞的细胞周期状态。这种方法比活性高3.h -胸腺嘧啶与正在生长的DNA链结合,杀死s期的细胞。细胞混合实验保证不会有无辜的旁观者效应,尽管这个β发射器的路径长度也表明不会有无辜的旁观者效应。WBM体外培养30 min3.h -胸腺嘧啶移植前。对照组包括非放射标记的胸苷激酶和未处理的WBM。氚化胸腺嘧啶治疗WBM组在致死照射的宿主小鼠1、3、6和12-14个月时,移植减少65-80%(每个时间点25-28只小鼠,4个实验,P< 0.001) (13].因此,使用胸苷激酶自杀的实验表明,长期繁殖的干细胞是循环的。
此外,我们还研究了lt -造血干细胞的体内通量−/ c - kit+/本来就+/ Flk-2−)通过细胞周期利用体内给药BrdU,包括腹腔内和口服。在BrdU启动后的12、24和48小时,我们观察到39%、65%和72%的LT-HSC被标记,31%、58%和67%的这些细胞处于G0/G1。因此,它们在这些时间间隔内完成了细胞周期。这是另一个迹象,连同细胞周期分离骨髓和氚化胸腺嘧啶实验,来自骨髓的lt -造血干细胞正在积极循环。
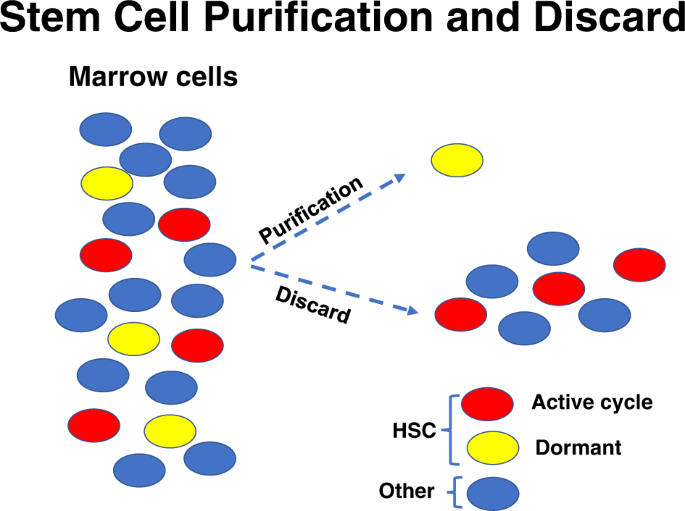
用标准的干细胞纯化方法去除这些循环细胞。1).实验进一步证明了这一点,实验显示从全骨髓分离的谱系阳性群体中有显著的再聚集干细胞含量[13].在氚化胸苷嘧啶暴露人群中,植入减少了84-99% (PWilcoxon秩和< 0.02)表明这些细胞正在增殖。
这些数据明确表明,长期的多谱系骨髓干细胞处于活跃的细胞周期中,在标准干细胞纯化方法中,随着骨髓细胞谱系的减少,这些细胞被丢弃。
造血分化潜能
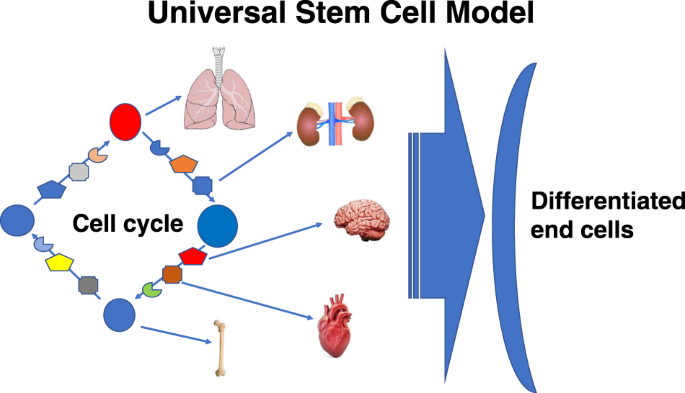
骨髓干细胞的一个重要特征是它们的分化能力。这也与它们的细胞周期状态有关。我们对LRH干细胞分化的早期研究表明,小鼠粒细胞和巨核细胞都有周期相关的“热点”。LRH以其静默性为基础进行分离,并通过纯化使其在细胞周期中高度同步。这些可能是最纯化的造血干细胞之一[14,15,16,17,18].在单细胞移植中,三分之一到四分之一的细胞会长期移植。当它们在促血小板生成素(TPO)、FlT-3配体和钢因子(碘化丙啶(PI)分析、细胞倍增时间和氚化胸苷激酶摄取中培养时,它们是紧密同步的[6,18,19].我们评估了这些干细胞在细胞因子(钢因子、Flt-3配体和TPO)刺激细胞周期转运的不同时间的分化[10].我们在培养14天后确定了其对G-CSF、GM-CSF和钢因子的响应分化,并发现巨核细胞在周期传输32 h (G1/早期S期)显著增加。在总共7个试验中,在32 h时的平均增长与0 h时有显著差异(p= 0.028)。巨核细胞经赖特-吉姆沙染色、乙酰胆碱酯酶和冯·血友病因子染色及CD41表达鉴定。在循环运输的后期水平恢复到基线水平。以类似的方式,我们观察到在s期中期分化为变髓细胞、条带和多形核粒细胞(非增生性粒细胞)的“热点”(热点)。p= 0.043)。因此,在细胞周期运输中存在细胞因子诱导特定造血谱系的点。这些数据仅限于造血系,但有充足的证据表明骨髓干细胞分化为非造血组织;所谓的“干细胞可塑性”(见下文)。我们确定,血统阳性骨髓细胞充满干细胞,这些细胞在干细胞纯化过程中被丢弃[13].这表明干细胞表达分化抗原。我们继续分离表达单一特异性分化抗原的骨髓细胞群。当分离B220或GR-1阳性骨髓细胞时,发现大量的长期再繁殖干细胞。进行了第二次细胞分类以提高种群的“纯度”。在这些实验中,B220或GR-1双分选细胞中不再存在长期再繁殖干细胞的含量[20.].然而,现在出现了一个单独的“少数”B220或GR-1阴性细胞群体,其中包含干细胞。通过氚化胸苷激酶自杀实验,该群体的其他分化表位阳性,分离的干细胞为c-Kit、Sca-1、CD150阳性,并积极循环。我们将这些数据解释为,骨髓干细胞在其细胞表面表达分化抗原,在本例中是B220或Gr-1,这种表达与细胞周期的阶段有关。由于第一次和第二次干细胞检测(这些连续的细胞排序)之间的时间间隔大约是2-3小时,因此似乎干细胞在这些短时间间隔内失去了B220或GR-1的表达。我们假设,正如干细胞可塑性研究表明的那样,这些细胞表达了多种其他分化抗原,并且这些抗原的表达随细胞周期的阶段而变化。干细胞在特定细胞周期阶段的最终命运将由其组织驻留决定。例如,表达肺上皮抗原的骨髓干细胞将优先在肺中形成上皮细胞,而不是在骨髓中,而如果它在细胞周期进程的不同点表达造血分化抗原,它将优先在骨髓中形成造血末端细胞。这里的末端细胞类型取决于循环通道中的点(图1)。2).从休眠开始经过第一个周期时基因表达的改变与这一假设一致[21,22].
微环境与干细胞可塑性——骨髓干细胞分化为非造血细胞
早期研究表明,非造血骨髓基质细胞构成了“造血诱导微环境(HIM)”[23].正常小鼠股骨集落形成单位脾(CFU-s)和集落形成单位培养物(CFU-c)的空间分布均在骨内膜附近[24].干细胞的生态位假说是由Schofield提出的。25].在这些研究中,大约一半的CFU-s菌落在脾脏表面,其中大多数是红系。颗粒细胞集落在包膜下片或沿着小梁可见,巨核细胞集落通常在包膜下[26,27,28].
主要骨髓细胞和干细胞体外培养基质支持的研究(Dexter培养)[29或淋巴样细胞(Whitlock-Witte培养)[30.进一步支持了特定类型的非造血基质细胞在指导和支持不同造血谱系选择方面的重要性。遗传鼠建立SL/SL模型d[31和W/Wv [32]分别显示了基质细胞或造血干细胞的特异性和单独的分子支持。利用高度纯化造血干细胞的后续研究最初集中在成骨细胞[33,34]和内皮细胞[35,36作为假定的生态位细胞。进一步的研究表明,关键事件可能发生在窦状周血管壁龛周围,可能涉及内皮细胞、周细胞、CXCL丰富的网状细胞、窦状巨核细胞、巢蛋白+细胞、成骨细胞、破骨细胞、T细胞、间充质干细胞、巨噬细胞、非髓鞘化许旺细胞和脂肪前成纤维细胞[37,38,39].大量假定的来自生态位的调控因子也被描述了,包括CXCL12 [40], E-selectin [41], vegfr 2 [42], N-cadherin [43),骨桥蛋白(44]、膜结合钢因子[45].虽然这些实体对造血干细胞有不同的影响,但除了膜结合SCF外,它们作为生态位维持因子的真正作用是不确定的。SL/SL的广泛研究d小鼠模型显示了该因子在造血微环境支持中的关键作用。这些研究中有许多可能因解释细胞位置研究的困难而混淆,也可能因使用纯化干细胞而混淆,因为纯化干细胞不能代表全部骨髓更新干细胞群。
也许对普遍的干细胞概念最有意义的是干细胞可塑性的研究,这表明造血骨髓细胞可以分化成特定于移植组织的非造血细胞。大量的出版物证明骨髓细胞在体内植入辐照小鼠后能够产生非造血细胞[46,47,48,49,50,51,52,53].后者被该领域的许多人驳回,但实际上似乎是真实的[46].在受到包括辐射在内的各种损伤的小鼠肺中,不同骨髓细胞类型对非造血细胞的贡献[54,55,56,57,58),弹性蛋白酶(59),野百合碱(60]和博莱霉素[61,62,63的治疗效果令人印象深刻。各种转基因小鼠模型也显示骨髓细胞衍生的肺细胞[64,65,66],这也在寄生虫和新生小鼠中观察到[67,68].
一个重要的贡献是克劳斯和他的同事的工作[69].从B6D2/F1雄性小鼠骨髓中提取细胞进行洗脱,洗脱后的雄性细胞用PKH26标记,2天后注入致死性照射的雌性小鼠和从骨髓中提取的荧光细胞。这些荧光细胞被作为单细胞注射到受到致命照射的雌性小鼠体内。11个月后,移植在各种组织中都可见到,但最令人印象深刻的是在肺中,在一只老鼠中,超过20%的肺细胞来自移植的单细胞。这些细胞被标记为上皮细胞。产生上皮肺细胞的关键骨髓细胞随后被证明与小的胚胎样干细胞相似[70,正如Kucia及其同事所描述的[71].23项独立的研究已经证实了这些来自早期骨髓细胞的单细胞结果,其中许多是典型的纯化造血干细胞。一项声称没有证实它们的研究悄悄撤回了。72].
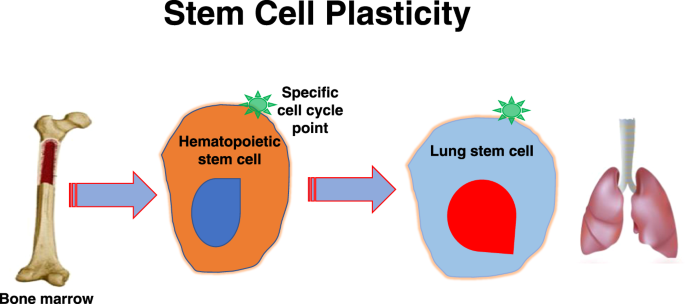
我们自己在骨髓到肺转化方面的研究为我们的通用干细胞模型提供了强有力的支持。我们最初发现,GFP +骨髓细胞移植到小鼠肺中,产生表达肺特异性mRNA的GFP +上皮肺细胞[54].这些转化现象随着受体辐射剂量的增加和对移植小鼠给予粒细胞集落刺激因子的增加而增加。谱系阴性、c-kit和Sca-1阳性细胞显示这些转化,而这些标记阴性的骨髓细胞没有。进一步的研究表明,使用细胞因子诱导的谱系- sca -1+细胞在细胞周期的不同时间点出现了一些基因表达的显著变化,而其他基因则没有变化[21,22].此外,我们还发现,在G1/S培养的骨髓细胞在细胞输注致死性照射小鼠后的3小时内归骨髓和6周至2个月后向上皮肺细胞的转化显著增加[73].这是涉及肺的周期相关干细胞可塑性的相对直接证据。实验证明了肺mRNA的周期相关诱导,在特定细胞周期阶段的谱系- sca -1阳性骨髓细胞与正常或辐照肺细胞、条件培养基或细胞外泡共培养,然后分析肺特异性mRNA。暴露于辐照的肺和肺小泡的G0/G1谱系- sca -1+细胞和暴露于正常肺或肺小泡的G1/S细胞中肺特异性mRNA的诱导增加[74].因此,骨髓干细胞的细胞周期状态和相互作用组织的性质(辐射与否)决定了骨髓干细胞肺基因型改变的程度。我们还介绍了最初的概念,即骨髓干细胞转化为产生肺细胞可以通过肺源性细胞外囊泡进入骨髓干细胞并将其转变为肺干细胞(机制见下文)介导。[75,76].综上所述,这些观察结果很好地符合以下概念:在细胞周期的某一点上,骨髓干细胞可以与处于特定功能状态的组织相互作用,产生骨髓干细胞源性肺细胞,而这种可塑性变化可能是由肺泡与骨髓细胞相互作用介导的。
对我们提出的模型有进一步意义的是,有研究表明,神经组织细胞植入后可产生造血骨髓细胞[77],虽然这没有得到其他研究的证实[78].总的来说,似乎可能存在多种诱导微环境,它们可能是细胞或组织特异性的。因此,人们可以设想一个假定的万能干细胞在体内跨越不同的器官,并在干细胞周期的适当点产生组织特异性干细胞(图。3.).
表中给出了微环境领域的概述2.
干细胞的异质性
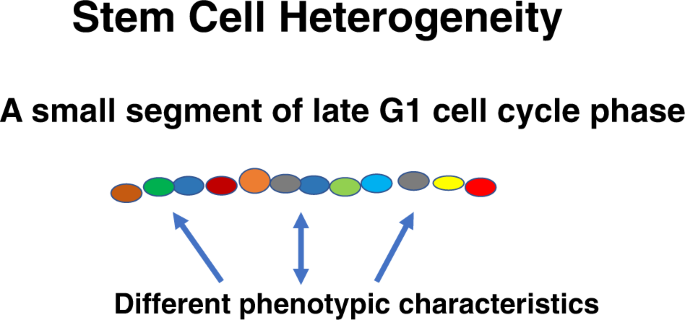
如果干细胞在循环,就意味着它的表型在不断变化。因此,在相对较短的周期传代时间间隔内会看到不同的表型。这将保护这一关键群体免受完全或完全的灾难性毒性。这表明存在一种干细胞结石,其中表型的周期相关变化代表衍生物,而最终结果是积分。针对不同干细胞类别异质性的多项研究均符合该模型[79,80,81,82,83,84,85].我们自己的工作表明,即使是在细胞因子诱导的细胞周期转运的不同点分离的高度纯化LRH干细胞,也几乎显示出完全的异质性[86,尽管这些细胞的群体确实显示出整体的分化模式。这类似于Till、McCulloch和Siminovitch之前关于脾脏集束形成单位的开创性工作[87].引用他们的工作:“在这方面,与放射性核素衰变的类比可能是有帮助的。如果一个人研究大量的放射性原子,他会看到一个非常有规律的衰变模式,遵循指数定律。然而,如果研究单个原子,就会发现它们以一种不可预测的、随机的方式衰变。我们对单细胞后代的研究似乎显示了造血功能的随机特征,而对大量细胞的研究则揭示了整个系统的有序行为。从这个角度来看,受调控的是整个种群,而不是单个细胞。有人认为,控制机制是通过改变"出生"和"死亡"的概率来发挥作用的。这立即提出了一个问题,干细胞试验发生了什么集落形成单位脾脏。由于缺乏与纯化干细胞研究的相关性,它被驳回了,但鉴于我们关于纯化干细胞的数据,也许应该重新考虑CFU-s作为一种干细胞检测方法的意义。在任何情况下,高度的异质性,甚至细胞周期同步的干细胞,与周期传代的持续变化表型一致(图。4).最近的重点是单细胞RNA干细胞的研究。scRNA在不同细胞群中表现出异质性,将其应用于小鼠造血干细胞也表现出异质性[88].我们可以假设,即使是这些纯化的细胞也显示出小的细胞周期进展来解释观察到的异质性。
其他细胞呢?
造血场有许多其他候选的干细胞/祖细胞。CFU-s被细分为不同的测定方法,在细胞输注后的早期或晚期计数菌落;菌落在后期可能代表更原始的干细胞。在不同成熟细胞类型的半固体培养基中进行菌落的体外克隆生长是许多研究者多年来的工作。布拉德利和梅特卡夫的作品[89普鲁兹尼克和萨克斯[90]首先描述了粒细胞巨噬细胞集落,然后描述了几乎所有分化造血细胞类型产生集落的细胞特征;红细胞(91),巨核细胞(92,肥大细胞[93),嗜酸性粒细胞(94, T细胞[95]和B细胞[96,以不同的组合。随后,具有多谱系潜力的爆炸形成单元和祖元[97,98也被描述过。总的来说,这些造血菌落从单系到多种多系细胞类型都不同,多系菌落一般需要多种细胞因子来生长,而单系可能对单一细胞因子有反应。总的来说,这些细胞类型被拟合到一个层次模型中,尽管它们的隔离研究并不明确。我们推测更原始的祖先可能是周期依赖的连续体。而已被最终提交的细胞不再在连续体上。其他细胞类可能在连续统上,也可能不在连续统上。许多非造血干细胞已经从骨髓中分离出来;其中包括间充质干细胞[99],多能成体祖细胞[One hundred.],骨髓分离的成人多系诱导细胞[101]和脐带血中发现的不受限制体细胞干细胞[102].如上所述,小的类胚胎干细胞是一种候选细胞,具有产生不同细胞类型的能力[103].这是一个小细胞,在人类中表现为CD133 + CXCR4 + CD34 + SSEA-4+,在小鼠中表现为Sca-1 + CXCR4 + SSEA-1+谱系−CD45−。这些非常原始的细胞可能是所有其他细胞的前身。
也有针对不同组织的干细胞/祖细胞的报道。这些细胞包括胃肠道干细胞[104]、表皮干细胞[105,肝卵形细胞[106]及神经干细胞[107,108,109].孙等人的工作。[110表明分化祖细胞的作用完全不同。利用转座子标记克隆标记细胞,他们的数据表明,长寿的祖细胞是大部分成年期稳定造血的主要驱动因素。这是干细胞/祖细胞领域的基本利益,但也与我们不断发展的通用干细胞模型一致。以类似的另一种方式,“不朽链”假说认为,当干细胞分裂时,它会选择性地保留那些包含较大子模板DNA链的姐妹染色单体[111].这一直备受争议[112但最近在神经圈培养物、永生化小鼠肿瘤细胞和肌肉干细胞中发现了支持这一假设的证据[113,114,115].这也可能与通用干细胞的概念一致。
我们假设上述祖细胞/干细胞可能都存在于细胞周期相关的连续体上。诚然,有些细胞会发生不可逆的分化;在红系系统中,可以设想BFU-e可能处于连续统循环中,而分化程度更高的CFU-e已丢失至末端分化。当然,也不排除其他的命运。
胚胎干细胞[116]及诱导多能干细胞[117],虽然非常有趣,但已被人工诱导,因此它们的周期相关分化潜力和在连续体上的可能位置在我们的体内干细胞生物学的模式中没有考虑。
机制呢?
这项工作提出了干细胞生物学中的细胞机制的观点。尽管已经有大量关于纯化干细胞分子机制的工作,我们认为这适用于细胞周期中特定点的休眠干细胞。至于全球干细胞种群,详细的分子研究应该在未来进行。然而,我们已经开始了解从一种细胞类型到另一种细胞类型可能的直接转化机制。关于组织来源的细胞外囊泡改变骨髓细胞表型的能力的研究表明,表型改变的机制可能是将组织转录调节剂转移到移植骨髓细胞。我们之前已经证明,小鼠肺细胞的细胞外囊泡在体外被骨髓细胞内化,骨髓细胞提供持续的肺上皮细胞基因和蛋白表达,并在移植到致命辐照小鼠后,移植受体肺中骨髓来源的肺上皮细胞数量增加[54,73,74,118].利用大鼠/小鼠细胞外囊泡和确定共同培养骨髓干细胞中诱导的表面活性剂mRNA的种类的工作表明,立即的遗传变化是由于mRNA和转录调节剂的细胞外囊泡从肺细胞的转移,但长期稳定的细胞表型变化是由于翻译调节剂的转移诱导稳定的表观遗传变化[76,118].因此,关于骨髓到肺转化的潜在细胞机制,我们可以设想一个骨髓“干细胞”在细胞周期的“肺倾向”点遇到肺组织的细胞外泡,最有可能是在组织中停留,导致骨髓干细胞内稳定的表观遗传变化,将其转化为肺干细胞,即,它是一个万能干细胞。
通用干细胞调节模型
目前的分级干细胞模型在概念上具有吸引力,符合大多数传统的思维。不幸的是,这创造了一个大的启发式错误的基础。根据维基百科的定义,“一种启发式或启发式技术是任何方法解决问题或自我发现它采用了一种实际的方法,但并不保证是正确的最优、完美或理性的,但仍足以达到眼前、短期的目标或近似”。这是造血干细胞生物学传统分级模型的基础。代表性和可用性启发式可能适用于这里。许多数据支持纯化方法:分级干细胞模型的明显性与分化到末端细胞,因此,减少了对替代可能性的追求。绝大多数的概念是,长期再繁殖的造血干细胞是静止的、稳定的,并导致分化为祖细胞,然后是末端功能造血细胞的分级系统。这就无法解释任何干细胞类别几乎完全的异质性,即使在同步的细胞周期转运中也是如此,以及大量关于骨髓干细胞类别在各种器官中分化成非造血细胞的文献和Sun等人的数据。[110“长寿的祖细胞是成年期大部分时间内稳定造血的主要驱动力”。早期数据表明,在提出造血干细胞生物学的分级模型时应谨慎。
摘自《实验血液学》上一篇题为“干细胞的蓝色”的社论[119];然后小川医生出现了,把一切都搞砸了。他描述了一系列令人眼花缭乱的不同菌落类型,从单个细胞中产生一到五种谱系[98,120,121,122,123].“这些都是非常优雅的实验,并得出了重要的新见解,包括表明在一个细胞周期内,来自一个细胞群的两个子细胞可能追求完全不同的谱系。这些数据是反对造血分级模型的有力证据。”
为了重申我们的模型,我们提出存在一种通用干细胞,它包括造血的LT-HSC,但也包括多个其他非造血的干细胞/祖细胞,在一个周期相关的干细胞/祖细胞连续体中。这种干细胞的分化依赖于细胞周期相关的分化潜能变化(由B220和Gr-1的表达和巨核细胞热点数据说明)及其组织驻留,通过细胞外囊泡调制,可将细胞转化为非造血组织特异性干细胞。该模型表明,随着干细胞在细胞周期中的进展,表型发生了持续的变化,这立即解释了不同的干细胞/祖细胞类别所观察到的恒定异质性。这也表明,在干细胞演算中,与细胞周期相关的表型变化是衍生物,而与最终群体相关的结果是积分。该模型如图所示。5.
干细胞领域先前的工作为进一步的进展奠定了基础。对纯化的LT-HSC的研究为该细胞在细胞周期的一个阶段提供了重要的见解。未来的进展将延伸到描述整个干细胞群。
接下来是什么?
许多重要的、但可通过实验验证的问题仍然存在。哪些细胞不在连续体中,是否存在多个连续体,什么时候分化是不可逆的,这些参数会随着年龄的增长而改变吗?细胞周期指定干细胞在组织恢复至关重要的治疗中是否有用?癌症干细胞是否也在一个连续体上?它们的定义在临床上是否有用?干细胞连续体是局限于干细胞还是适用于所有或其他类型的细胞?在连续体中,其他多个变量对干细胞命运的影响是什么?
总之,通用干细胞模型提出了干细胞生物学令人兴奋的新方法,具有有趣的治疗意义。
在这一领域可能进行的一系列实验如下:
- 1.
从全骨髓中选择骨髓细胞,用FACS对以抗sca -1、抗c- kit和抗cd150为起始的不同的或组合的干细胞抗体,评估可移植的多系小鼠骨髓干细胞的能力和纯度。
- 2.
评估Sca-1、c-Kit和CD150抗体对辐照小鼠干细胞试验中未分离骨髓细胞的影响。也使用类似的模式干细胞分离利用染料干细胞分离。
- 3.
取纯化的经钢因子、TPO和FLT3配体刺激的阴性罗丹明低Hoechst小鼠雄性骨髓细胞同步进行细胞周期,并测定其在不同周期进展时间的基因组和蛋白质组学特征。这是一个通过干细胞细胞周期同步进展的极好模型,即使LRH细胞并不指示整个骨髓干细胞群的表型。我们之前利用该模型演示了巨核细胞和粒细胞分化热点,并显示了这些细胞在细胞因子刺激下的紧密细胞周期同步。
- 4.
分离B220或GR1细胞。从雄性、小鼠骨髓中提取B220或GR-1阴性细胞进行双排序,然后取2 h双排序的B220或GR-1阴性细胞,评估其在单独使用钢或在钢、TPO和Flt3配体中不同时间的基因组/蛋白质组学特征。
- 5.
取上述3和4中确定的循环中的组织易发点,用Y阳性细胞或GFP阳性细胞和组织特异性标记物对其植入不同组织进行评估。用于移植的宿主小鼠将未经处理,或从照射开始遭受各种组织损伤。
- 6.
从不同正常或紊乱的组织中收获囊泡,然后评估它们对细胞周期中特定“组织倾向”点分离的细胞体外细胞分化的影响。
数据可用性
数据共享不适用于本文,因为在这篇综述文章中没有生成数据集。
参考文献
体细胞干细胞异质性:血液、皮肤和肠干细胞间室的多样性。生物学杂志2015;16:99 - 309。
Quesenberry PJ, Colvin GA, Lambert JF, Frimberger AE, Dooner MS, McAuliffe CI,等。新的干细胞生物学。气象学会2002;113:182-206。
Quesenberry PJ, Colvin GA, Lambert JF。明暗对照干细胞:统一的干细胞理论。血。2002;100:4266 - 71。
郝比宾,苏佩慈,谢昌昌,吴杰,Vergilis K, Grimaldi CI,等。淋巴造血干细胞的表型波动与细胞周期转运。中华医学杂志1998;188:393-8。
Cerny J, Dooner M, McAuliffe C, Habibian H, Stencil K, Berrios V,等。纯化小鼠淋巴造血干细胞的归巢:细胞因子诱导的缺陷。血液其他干细胞杂志2002;11:913-22。
Colvin GA, Lambert JF, Moore BE, Carlson JE, Dooner MS, Abedi M,等。内在造血干细胞/祖细胞可塑性:反转。细胞物理学报2004;1999:20 - 31。
Becker PS, Nilsson SK, Li Z, Berrios VM, Dooner MS, Cooper CL,等。黏附受体在造血细胞系和小鼠祖细胞中的表达:细胞因子和细胞周期状态的调节。Exp内科杂志。1999;27:533-41。
Berrios VM, Dooner GJ, Nowakowski G, Frimberger A, Valinski H, Quesenberry PJ,等。造血干细胞归巢和移植中细胞因子诱导缺陷的分子基础。Exp内科杂志。2001;29:1326-35。
Lambert JF, Liu M, Colvin GA, Dooner M, McAuliffe CI, Becker PS,等。骨髓干细胞的基因表达和移植表型随细胞周期转运而改变。中华医学杂志2003;197:1563-72。
Colvin GA, Dooner MS, Dooner GJ, Sanchez-Guijo FM, Demers DA, Abedi M,等。干细胞连续体:定向分化热点。Exp内科杂志。2007;35:96 - 107。
潘世杰,韦杰斯,李文华,李文华,等。造血干细胞和祖细胞命运调控中增殖和细胞周期基因表达的研究。中华医学杂志2005;202:1599-611。
不确定性下的判断:启发式与偏差。科学。1974;185:1124-31。
Goldberg LR, Dooner MS, Johnson KW, Papa EF, Pereira MG, Del Tatto M,等。小鼠长期多系更新骨髓干细胞是一种循环细胞。白血病。2014;28:813-22。
Wolf NS, Kone A, Priestley GV, Bartelmez SH.通过Hoechst 33342-罗丹明123 FACS序列筛选分离的长期再繁殖原始造血细胞的体内外特性研究。Exp内科杂志。1993;21:614-22。
用Hoechst 33342和罗丹明123染色鉴定造血干细胞。方法Mol Biol. 2004; 263:181-200。
Reddy GP, McAuliffe CI, Pang L, Quesenberry PJ, Bertoncello I. G1/S期进展中Ho(钝)/Rh(钝)干细胞的细胞因子受体库和细胞因子响应性Exp内科杂志。2002;30:792 - 800。
Chang H, Jensen LA, Quesenberry P, Bertoncello I.造血干细胞测定方法的标准化:1998年9月8-9日和1999年7月30日由美国国家心肺和血液研究所在贝赛斯达国立卫生研究院主办的研讨会和工作组会议的总结。Exp内科杂志。2000;28:743-52。
贝尔通塞洛一世,布拉德利TR,霍奇森GS,邓洛普JM。基于罗丹明-123荧光的正常骨髓高增殖潜能集落形成细胞亚群的分辨、富集和组织Exp内科杂志。1991;19:174-8。
Colvin GA, Lambert JF, Carlson JE, McAuliffe CI, Abedi M, Quesenberry PJ。细胞因子培养的小鼠骨髓在模拟微重力条件下与静态培养相比的移植物节律性和细胞周期动力学改变。细胞发育生物学杂志2002;38:343-51。
Goldberg LR, Dooner MS, Papa E, Pereira M, Del Tatto M, Cheng Y,等。分化表位定义造血干细胞,并随着细胞周期的通过而改变。干细胞进展报告2022;18:2351-64。
Dooner GJ, Colvin GA, Dooner MS, Johnson KW, Quesenberry PJ。小鼠造血干细胞基因表达随细胞周期进展的波动。细胞物理学报2008;214:786-95。
Quesenberry PJ, Dooner GJ, Tatto MD, Colvin GA, Johnson K, Dooner ms细胞因子诱导的原始造血干细胞细胞周期进展的细胞周期相关基因表达。干细胞发展2010;19:45 - 60。
Trentin JJ。基质造血诱导微环境(HIM)法测定骨髓干细胞分化。中华病理学杂志。1971;65:621-8。
BI勋爵,Testa NG, Hendry JH。正常小鼠股骨中cfu和CFUc的相对空间分布。血。1975;46:65 - 72。
脾脏集落形成细胞与造血干细胞的关系。血细胞。1978;4:7-25。
Lewis JP, O 'Grady LF, Trobaugh FE Jr.小鼠脾脏造血的研究:脾脏表面形成造血菌落的意义。细胞组织生物学杂志1968;1:101-9。
库里JL,特伦丁JJ。造血脾脏集落研究。一、成长与分化。Dev杂志。1967;15:395 - 413。
Wolf NS, Trentin JJ。研究造血殖民地。五、造血器官基质对多能干细胞分化的影响。中华医学杂志1968;127:205-14。
德克斯特TM,艾伦TD,拉伊塔LG,斯科菲尔德R,勋爵BI。体外造血细胞分化和增殖的刺激。细胞物理杂志,1973;82:461-73。
惠特洛克CA,维特ON。小鼠骨髓B淋巴细胞及其前体的长期培养。美国国家科学研究院。1982; 79:3608-12。
麦卡洛克EA,西米诺维奇L,提尔JE,罗素ES,伯恩斯坦SE。Sl-Sld基因型贫血小鼠造血缺陷基因决定的细胞基础。血。1965;26:399 - 410。
Sharkis SJ, Jedrzejczak WW, Sensenbrenner LL。W/Wv小鼠作为骨髓衰竭模型。临床生物学期刊1984;148:211-8。
尼尔森SK,约翰斯顿HM,科弗代尔JA。移植造血干细胞的空间定位:干细胞龛定位的推论。血。2001;97:2293-9。
谢颖,尹婷,Wiegraebe W,何晓c, Miller D, Stark D,等。利用实时成像检测功能性造血干细胞生态位。大自然。2009;457:97 - 101。
nombella - arrieta C, Pivarnik G, Winkel B, Canty KJ, Harley B, Mahoney JE,等。骨髓微环境中造血干细胞和祖细胞定位及缺氧状态的定量成像。细胞生物学杂志2013;15:533-43。
Kiel MJ, Yilmaz OH, Iwashita T, Yilmaz OH, Terhorst C, Morrison SJ。SLAM家族受体能够区分造血干细胞和祖细胞,并揭示干细胞的内皮龛。细胞。2005;121:1109-21。
周a, Lucas D, Hidalgo A, Mendez-Ferrer S, Hashimoto D, Scheiermann C,等。骨髓CD169+巨噬细胞促进造血干细胞和祖细胞在间充质干细胞龛内的滞留。中华医学杂志2011;208:261-71。
Levesque JP, Helwani FM, Winkler IG。骨内膜“成骨细胞”龛及其在造血干细胞归巢和动员中的作用。白血病。2010;24:1979 - 92。
Niswander LM, Fegan KH, Kingsley PD, McGrath KE, Palis J. SDF-1在稳态和辐射损伤后动态介导巨核细胞生态位占用和血栓形成。血。2014;124:277 - 86。
Khurana S, Melacarne A, Yadak R, Schouteden S, Notelaers T, Pistoni M,等。SMAD信号调节骨髓生态位中CXCL12的表达,影响造血祖细胞的归巢和动员。干细胞。2014;32:3012-22。
Winkler IG, Barbier V, Nowlan B, Jacobsen RN, Forristal CE, Patton JT,等。血管生态位e选择素调节造血干细胞休眠、自我更新和化疗耐药。Nat医学。2012;18:1651-7。
Hooper AT, Butler JM, Nolan DJ, Kranz A, Iida K, Kobayashi M,等。造血系统的植入和重建依赖于vegfr2介导的窦内皮细胞再生。细胞干细胞。2009;4:263-74。
李晓燕,李晓燕。n -钙粘蛋白在骨髓生态位造血干细胞调控中的作用。中国生物医学工程学报2012;
骨桥蛋白:骨和血液之间的桥梁。中华血液学杂志2006;134:467-74。
膜结合干细胞因子是干细胞在骨髓内膜区初始滞留的关键调节因子。Exp内科杂志。2003;31:1284 - 91。
奎森berry PJ, Dooner G, Dooner M, Abedi M.发育生物学:无知的elenchi:干细胞研究中的红鱼。科学。2005;308:1121-2。
Lagasse E, Connors H, al - dhalimy M, Reitsma M, Dohse M, Osborne L,等。纯化的造血干细胞在体内可分化为肝细胞。Nat医学。2000;6:1229-34。
Nilsson SK, Dooner MS, Weier HU, Frenkel B, Lian JB, Stein GS,等。能产生骨的细胞移植自非消融小鼠的全骨髓移植。中华医学杂志1999;189:729-34。
Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li B,等。骨髓细胞再生梗死心肌。大自然。2001;410:701-5。
Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N,等。骨髓是肝脏卵形细胞的潜在来源。科学。1999;284:1168 - 70。
Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM,等。放射诱导骨髓消融后小鼠骨髓细胞衍生肝细胞。肝脏病学。2000;31:235-40。
Abedi MGD, Demers D, Colvin G, Dooner M, Cerny J, Moore B,等。骨髓细胞通过向肌细胞的转分化参与骨骼肌的再生。Exp内科杂志。2003;31:134。
Badiavas EV, Abedi M, Butmarc J, Falanga V, Quesenberry P.骨髓源性细胞参与皮肤创面愈合。细胞生物学杂志,2003;196:245-50。
Aliotta JM, Keaney P, Passero M, Dooner MS, Pimentel J, Greer D,等。肺细胞的骨髓产生:G-CSF、心脏毒素、分级照射剂量和亚群体表型的影响。Exp内科杂志。2006;34:230-41。
Theise ND, Henegariu O, Grove J, Jagirdar J, Kao PN, Crawford JM,等。小鼠放射性肺炎:骨髓肺细胞移植的严重损伤模型。Exp内科杂志。2002;30:1333-8。
赫尔佐格·埃尔,范·阿纳姆J,胡斌,克劳斯DS。骨髓源性肺上皮形成所需的肺损伤阈值。干细胞。2006;24:1986 - 92。
亚伯S,劳比G,博耶C,雷纳德SI,夏普JG。移植的BM和BM侧群细胞在辐照小鼠的肺和肝脏中产生子代。Cytotherapy。2003;5:523-33。
Grove JE, Lutzko C, Priller J, Henegariu O, Theise ND, Kohn DB,等。骨髓源性细胞作为载体,用于向肺上皮细胞输送基因治疗。中华呼吸细胞生物学杂志2002;27:645-51。
石泽凯,久保H,山田M,小林S,沼崎M,上田S,等。弹性蛋白酶诱导的肺气肿后,骨髓来源的细胞有助于肺再生。2月。2004;556:249-52。
Baber SR, Deng W, Master RG, Bunnell BA, Taylor BK, Murthy SN等。气管内给药间充质干细胞可减轻野莨菪碱诱导的肺动脉高压和内皮功能障碍。中华医学杂志2007;292:H1120-1128。
Ortiz LA, Gambelli F, McBride C, Gaupp D, Baddoo M, Kaminski N,等。肺间充质干细胞移植对博莱霉素暴露的反应增强,并改善其纤维化效应。美国国家科学研究院。2003; 100:8407-11。
Kotton DN, Ma BY, Cardoso WV, Sanderson EA, Summer RS, Williams MC,等。作为肺泡上皮祖细胞的骨髓来源细胞。发展。2001;128:5181-8。
金宏,刘涛,陈苏苏,潘淑华。骨髓源性祖细胞在肺纤维化中的作用。中华临床杂志2004;113:243-52。
Loi R, Beckett T, Goncz KK, Suratt BT, Weiss DJ。用成人骨髓来源细胞在体内对囊性纤维化肺上皮细胞的有限修复。美国呼吸危重护理杂志2006;173:171-9。
Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, ortizz - gonzalez XR,等。来自成人骨髓的间充质干细胞的多能性。大自然。2002;418:41-49。
田立杨,野井祖H,竹谷S, Minamino K, Yamaguchi K, Shultz LD,等。一种新的骨髓移植方法治疗和转移肺气肿从正常小鼠到Tsk小鼠,反之亦然。干细胞。2006;24:2071-7。
Abe S, Boyer C,刘旭,温福强,Kobayashi T,方强,等。来自循环的细胞有助于肺损伤的修复。美国呼吸危重护理杂志2004;170:1158-63。
布鲁西亚EM,齐格勒EC,普莱斯JE,韦纳S,伊根ME,克劳斯DS。新生小鼠骨髓移植后多器官供者源性上皮细胞的植入。干细胞。2006;24:2299 - 308。
郭志强,李志强,李志强,等。用单一骨髓干细胞进行多器官、多谱系移植。细胞。2001;105:369 - 77。
Kassmer SH, Jin H, Zhang PX, Bruscia EM, Heydari K, Lee JH,等。小鼠骨髓中非常小的胚胎样干细胞分化为肺上皮细胞。干细胞。2013;31:2759 - 66。
Kucia M, Wysoczynski M, Ratajczak J, Ratajczak MZ。骨髓中非常小的胚胎样(VSEL)干细胞的鉴定。细胞组织决议2008;331:125-34。
Theise ND。干细胞可塑性:回顾十年,描绘未来。Exp内科杂志。2010;38:529-39。
Dooner MS, Aliotta JM, Pimentel J, Dooner GJ, Abedi M, Colvin G,等。骨髓细胞向肺细胞的转化潜能随细胞因子诱导的细胞周期而波动。干细胞发展2008;17:207-19。
Aliotta JM, Lee D, Puente N, Faradyan S, Sears EH, Amaral A,等。祖细胞/干细胞命运的决定:细胞周期和微泡的相互作用动力学。干细胞发展2012;21:1627-38。
Aliotta JM, Sanchez-Guijo FM, Dooner GJ, Johnson KW, Dooner MS, Greer KA,等。骨髓细胞基因表达的改变,蛋白质的产生,和肺源性微泡移植到肺:一种新的表型调节机制。干细胞。2007;25:2245-56。
Aliotta JM, Pereira M, Li M, Amaral A, Sorokina A, Dooner MS,等。肺源性微泡诱导骨髓细胞稳定命运的改变。1.中国生物医学工程杂志,2012;
Bjornson CR, Rietze RL, Reynolds BA, Magli MC, Vescovi AL.把大脑变成血液:成体神经干细胞在体内采用的造血命运。科学。1999;283:534-7。
Morshead CM, Benveniste P, Iscove NN, van der Kooy D.造血能力是神经干细胞的一种罕见特性,可能依赖于遗传和表观遗传的改变。Nat医学。2002;8:268 - 73。
王晓燕,王晓燕,王晓燕。小鼠造血干细胞的体内动力学研究。血。2000;96:3399 - 405。
Muller-Sieburg CE, Cho RH, Thoman M, Adkins B, Sieburg HB。造血干细胞自我更新和分化的确定性调节。血。2002;100:1302-9。
体内造血干细胞发育的克隆分析。微生物免疫学杂志1992;177:41-57。
Jordan CT, Lemischka IR。小鼠长期造血的克隆和系统分析。基因Dev。1990;4:220-32。
Guenechea G, Gan OI, Dorrell C, Dick JE。不同种类的人类干细胞,其增殖和自我更新潜能不同。Nat Immunol。2001;2:75 - 82。
内田N, Dykstra B, Lyons KJ, Leung FY, Eaves CJ。纯化的造血干细胞在体外被刺激分裂前后体内再生活性不同,动力学相同。Exp内科杂志。2003;31:1338-47。
Morita Y, Ema H, Nakauchi H.最原始造血干细胞室的异质性和层次。中华医学杂志2010;207:1173-82。
Colvin GA, Berz D, Liu L, Dooner MS, Dooner G, Pascual S,等。非周期和周期同步小鼠造血干/祖细胞的异质性。细胞物理学报2010;222:57-65。
基于脾脏集落形成细胞生长的干细胞增殖的随机模型。美国国家科学研究院。1964; 51:29-36。
张鹏,李旭,潘晨,郑曦,胡斌,谢锐,等。单细胞RNA测序追踪星状细胞异质性的新视角。干细胞研究。2022;13:39。
小鼠骨髓细胞的体外生长。生物医学杂志1966;44:287-99。
正常“肥大”细胞在组织培养中的克隆。细胞物理学报,1965;66:319-24。
阿克斯拉德,铃木,史瑞夫。红细胞生成祖细胞数量的调节。纽约:冷泉港出版社,1978年。
Nakeff A, Dicke KA, Noord van MJ。小鼠骨髓琼脂培养巨核细胞。Ser Haematol。1975;8:4-21。
胎儿肝母细胞集落:红系祖细胞的来源。Exp内科杂志。1988;16:748-51。
Johnson GR, Dresch C, Metcalf D.速度沉降分离证实了人中性粒细胞、巨噬细胞和嗜酸性粒细胞祖细胞的异质性。血。1977;50:823-31。
细胞毒性淋巴细胞的t细胞祖细胞体外线性剂量反应测定的一些要求。J免疫学方法。1978; 19:369 - 85。
JM, Howard MC, Shortman K.抗原启动的b淋巴细胞分化。8未引物CBA小鼠对4-羟基-3-碘-5-硝基苯乙酸聚合细菌鞭毛蛋白抗原过继免疫反应中抗体形成细胞祖细胞的沉降速度和浮力密度表征中华医学杂志1976;143:1220-38。
布拉德利主力,霍奇森主力。小鼠骨髓中原始巨噬细胞祖细胞的检测。血。1979;54:1446-50。
田田,田田J,小川M.小鼠造血集落在可变组合中表达多谱系的单细胞起源。美国国家科学研究院。1983; 80:6689 - 93。
Caplan AI。发育中的肢体中肌肉、软骨和骨骼的分子和细胞分化临床生物学期刊1986;217B: 307-18。
蒋勇,vessen B, Lenvik T, Blackstad M, Reyes M, Verfaillie CM。多能祖细胞可以从出生后的小鼠骨髓、肌肉和大脑中分离出来。Exp内科杂志。2002;30:896 - 904。
D 'Ippolito G, Diabira S, Howard GA, Menei P, Roos BA, Schiller PC。骨髓分离的成人多系诱导(迈阿密)细胞,是一种独特的出生后青年和老年人类细胞群,具有广泛的扩展和分化潜力。细胞科学,2004;117:2971-81。
Kogler G, Sensken S, Airey JA, Trapp T, Muschen M, Feldhahn N,等。一种具有内在多能分化潜能的胎盘脐带血人体细胞干细胞。中华医学杂志2004;200:123-35。
Ratajczak MZ, Zuba-Surma EK, Machalinski B, Ratajczak J, Kucia M.非常小的胚胎样(VSEL)干细胞:从成人器官中纯化、表征和生物学意义。干细胞修订版2008;4:89-99。夏天
Potten CS。胃肠道上皮干细胞:数量、特征和死亡。生物学杂志1998;353:821-30。
瓦特调频。表皮干细胞:标记、模式和干细胞命运的控制。生物学杂志1998;353:831-7。
艾莉森M,萨拉夫c。肝干细胞。J乙醇。1998;29:676 - 82。
人神经干细胞:分离、扩增和移植。大脑病理学研究。1999;9:499 - 513。
王晓燕,王晓燕,王晓燕。胚胎干细胞中神经元前体细胞和有丝分裂后神经元的体外培养。Dev机制。1996;59:89 - 102。
赵立龙,段文敏,雷耶斯M, Keene CD, Verfaillie CM, Low WC。人骨髓干细胞移植到大鼠缺血脑后,表现出神经表型并改善神经功能缺损。实验神经。2002;174:11-20。
孙杰,Ramos A, Chapman B, Johnnidis JB, Le L, Ho YJ,等。原生造血的克隆动力学。大自然。2014;514:322-7。
突变选择与癌症的自然史。大自然。1975;255:197 - 200。
Kiel MJ, He S, Ashkenazi R, Gentry SN, Teta M, Kushner JA,等。造血干细胞不对称分离染色体或保留BrdU。大自然。2007;449:238-42。
Karpowicz P, Morshead C, Kam A, Jervis E, Ramunas J, Cheng V,等。支持不死链假说:神经干细胞在体外不对称分配DNA。细胞生物学杂志,2005;170:721-32。
小Merok, Lansita JA, Tunstead JR, Sherley JL。细胞中含有不朽DNA链的染色体共分离,其周期与不对称干细胞动力学。实用癌症杂志2002;62:6791-5。
康博·乔丹,卡拉索夫AO,兰多TA。干细胞及其子代分裂过程中非随机模板链分离和非对称命运决定的高发生率。公共科学图书馆杂志。2007;5:e102。
胚胎干细胞分化:生物学和医学新时代的出现。基因Dev。2005;19:1129-55。
史勇,井上红,吴景春,山中顺。诱导多能干细胞技术的十年进展。Nat Rev Drug discovery . 2017; 16:115-30。
Aliotta JM, Pereira M, Johnson KW, de Paz N, Dooner MS, Puente N,等。微囊进入骨髓细胞通过直接传递mRNA和诱导转录介导mRNA的组织特异性变化。Exp内科杂志。2010;38:233-45。
Quesenberry PJ。干细胞的蓝色。Exp内科杂志。1991;19:725-8。
小川勇,杨晓燕,陈晓燕。干细胞在体外培养中的随机特性。临床生物学期刊1985;184:11-19。
苏田娇,苏田田,小川美。配对祖细胞连续复制培养小鼠造血干细胞的分化分析。血。1984;64:393-9。
脐带血中的造血集落形成细胞具有广泛的能力,可产生单核和多能造血祖细胞。中华临床杂志1982;70:1324-8。
田丽娟,王晓燕,王晓燕。小鼠成对祖细胞造血菌落分化的研究。美国国家科学研究院。1984; 81:2520-4。
Dooner MS, Stewart C, Deng Y, Papa E, Pereira M, Del Tatto M,等。日常节律影响肺源性细胞外泡调节骨髓细胞表型的能力。《公共科学图书馆•综合》。2018;13:e0207444。
D 'Hondt L, McAuliffe C, Damon J, Reilly J, Carlson J, Dooner M,等。骨髓可移植性的昼夜变化。细胞物理学报2004;200:63-70。
周文华,周文华。昼夜节律对造血干细胞的影响。血液内科杂志2009;16:35 - 42。
王晓燕,王晓燕,王晓燕,等。昼夜节律对造血干细胞释放的影响。大自然。2008;452:442-7。
Batsali AK, Georgopoulou A, Mavroudi I, Matheakakis A, Pontikoglou CG, Papadaki HA。骨髓间充质干细胞衍生的细胞外囊泡(MSC-EVs)在正常和异常造血中的作用及其治疗潜力。9.中华临床杂志。2020;
Goodell MA, Rando TA。干细胞和健康衰老科学。2015;350:1199 - 204。
Sameri S, Samadi P, Dehghan R, Salem E, Fayazi N, Amini R.干细胞衰老与疾病的研究进展。Curr Stem Cell Res Ther 2020; 15:362-78。
资金
本研究得到NIH/NHLBI K08 HL118117, NIH/NIGMS, 1 P20 GM119943和NIDDK, R01DK112808的支持。
作者信息
作者和联系
贡献
PJQ写了初版的手稿,编辑并批准了最终版本的手稿。SW、MSD和LRG参与了稿件格式的设计、修改和定稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
奎森贝里,p.j.,温,S,戈德堡,L.R.et al。万能干细胞。白血病(2022)。https://doi.org/10.1038/s41375-022-01715-w
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41375-022-01715-w