文摘
急性髓系白血病(AML)是一个主要的造血系统恶性肿瘤的特点是不成熟的积累和异常分化的骨髓细胞在骨髓。在体内和体外模型,我们表明,植物homeodomain手指基因6 (PHF6)中扮演一个重要的角色在骨髓白血病细胞凋亡和增殖。Phf6不足可能会推迟RUNX1-ETO9a和老鼠MLL-AF9-induced AML的进展。PHF6损耗NF-κB信号通路的抑制干扰PHF6-p50复杂,部分抑制核易位p50抑制BCL2的表达。治疗vegf骨髓白血病细胞中PHF6 NF-κB抑制剂(bay11 - 7082)显著增加细胞凋亡,减少他们的扩散。综上所述,与PHF6作为一个肿瘤抑制所有的报道,我们发现在骨髓白血病PHF6也是一个pro-oncogenic作用,从而可能成为治疗骨髓白血病患者的治疗目标。
介绍
急性髓系白血病(AML)是一个主要的造血系统恶性肿瘤的特点是不成熟的不受控制的膨胀髓细胞(1]。年轻患者的5年生存率是40 - 50%,而5年期OS利率不到15%的患者年龄超过60岁(2,3]。大部分的努力一直致力于解释背后的分子事件AML变换,与目标识别特定的治疗目标和发展新的和更有效的药物。大约一半的AML患者随机染色体易位,包括染色体平衡易位收益或损失(4,5,6]。四个金属氧化物半导体t常见的易位是11 q23处/混合血统白血病(MLL)融合蛋白,t(15、17) /白血病,发票(16)/核心绑定因素(CBF) b-MYH11和t (8; 21) / RUNX1-ETO [7]。这些基因变化导致不可逆的功能缺陷与白血病生成相关的关键基因。临床白血病生成的遗传证据从小鼠模型和实验数据表明,一个以上的合作事件被要求开发AML [8,9]。
表观遗传失调是引起白血病的复发事件(10]。当表观遗传监管者的表达改变,它会刺激致癌转录编程,对AML过程很重要。大量的证据表明,这些表观遗传的抑制各种aml敏感监管机构。例如,抑制家庭故事homeodomain因素MEIS2延迟RUNX1-ETO-positive白血病细胞的生长(11]。79年3组蛋白赖氨酸甲基转移酶的失活Dot1l MLL translocation-associated基因的差别导致了对这些基因的表达(12,13]。此外,精氨酸甲基转移酶的抑制PRMT1减少白血病几个致癌融合蛋白的潜力,如MLL-EEN和MLL-GAS7 [14,15]。值得注意的是,这些表观遗传因素协调调节基因表达在正常骨髓形成而导致AML起始和进展,从而提供一个潜在的治疗选择。
植物homeodomain手指基因6 (PHF6),是一个高度保守的表观遗传转录监管机构,在神经发育和造血作用中扮演关键角色。这是首次发现突变在Borjeson-Forssman-Lehmann综合症患者(bfl) [16]。此外,bfl已报告开发所有疾病的患者(17]。后,体细胞突变PHF6被报道在成人原发性t病例的38% (18)和16 - 55%的混合表型急性白血病(19,20.]。小鼠模型的实验数据显示,在所有PHF6起着抑制作用引起白血病(21,22,23]。有趣的是,PHF6突变发生在较小程度上,在急性髓系白血病(aml)的3%,和3%的高档b细胞淋巴瘤(24,25,26]。而Mousa等人和de罗阿JD等人的研究表明,PHF6的表达调节AML患者,表明它可能参与AML的发展(27,28),完全的功能角色(s)的人类骨髓白血病PHF6仍然未知。
在当前的研究中,我们发现PHF6是必不可少的白血病干细胞的自我更新能力的维护(lsc)但可有可无的造血干细胞(hsc)体内。白血病细胞的生存是敏感PHF6损耗在RUNX1-ETO9a (RE9a)和MLL-AF9 MA9 AML小鼠模型和人类AML细胞株。我们的数据支持,包含RUNX1-ETO9a AML和MLL-AF9融合蛋白都是依赖PHF6函数,这PHF6可能是一个潜在LSC-directed治疗AML的目标。
方法
代的AML老鼠和移植
Phf6条件删除老鼠执行如前所述[22]。RE9a-driven小鼠模型,RE9a-GFP肖建教授提供的逆转录病毒载体是善良的阳光。我们使用E14.5胎儿肝细胞和执行Na男人的方法等。29日]。MA9-driven小鼠模型,骨髓血统负(林−)细胞Vav1-Cre; Phf6fl / y或Phf6fl / y雄性老鼠MA9-GFP逆转录病毒的感染和建造AML老鼠高的方法等。30.]。所有的雄性老鼠重达20 - 30 g和年龄在6 - 8周。动物被安置在特定的无菌动物的实验血液学国家重点实验室(SKLEH),研究所血液学和血液疾病的医院。所有实验老鼠实验动物许可证批准程序使用(syxk2020 - 0003)。所有的努力都是老鼠的痛苦降到最低。
核易位检测
PHF6 KD Kasumi-1和K562细胞预处理的饥饿中被离心机到幻灯片的治疗Cell-TAK(美国纽约康宁)。100 ng / mL TNF-α(美国新泽西州Peprotech)添加到细胞2 h。PBS和固定的细胞被洗15分钟4%的甲醛。细胞膜在PBS permeabilized 0.1% Triton 15分钟,和被2% BSA在PBS 45分钟。细胞治疗与anti-p65或anti-p50单克隆抗体(稀释,1∶CST,波士顿,MA,美国)在4°C的过夜。洗后用0.5% BSA在PBS三次,这些细胞被沾Alexa萤石647/594/488山羊anti-rabbit免疫球蛋白(稀释,1:50 0,表达载体、钙、美国)。幻灯片被孵化与DAPI(美国CA BioLegend) 5分钟,观察显微镜(美国马萨诸塞州UltraVIEW VOX, Perkinelmer)。
NF-κB抑制剂实验
在体外实验中,7×104/毫升Kasumi-1和K562细胞治疗4μM bay11 - 7082(美国新泽西州多国评价)或2‰DMSO溶液培养基,然后检查白血病细胞的凋亡和增殖。在体内实验中,5×106PHF6 OE Kasumi-1或控制细胞被移植到老鼠NSG辐照与200年cGy通过尾静脉注射。一个月后,两组的老鼠获得10毫克/公斤bay11 - 7082三次腹腔注射10天。从北京购买的NSG老鼠HFK生物技术和年龄在4 - 6周。
结果
PHF6 AML细胞的生长需要但可有可无的正常造血作用
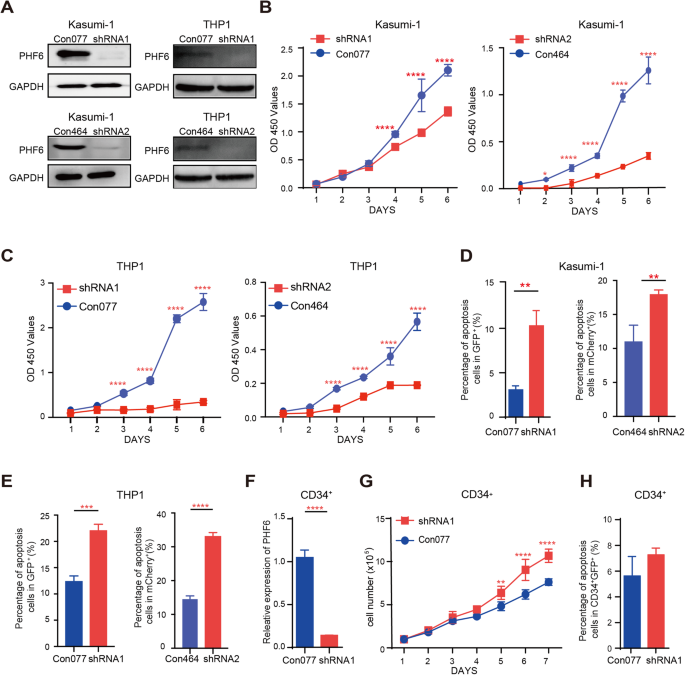
在AML调查PHF6的潜在作用,我们分析了PHF6表达和总生存期的关系。AML患者高PHF6表达不利预后比AML患者低PHF6表达式(p= 0.0329)根据患者的生存时间超过一年的癌症基因组图谱AML的数据集(补充图。1)。然而,我们没有发现明显区别AML患者和正常人的骨髓细胞(补充图。1 b, C)。进一步确认是否PHF6骨髓白血病发展是真正功能相关,vegf在Kasumi-1 PHF6我们首先K562细胞(补充图。1 d)。我们发现表达PHF6 (PHF6 OE)增加Kasumi-1和K562细胞的生长(补充图。1 e),减少Kasumi-1细胞的凋亡而对K562细胞没有影响(补充图。1 f)。此外,我们撞倒PHF6 (PHF6 KD)由两个独立的骨髓细胞株anti-PHF6成分(无花果。1和补充图。1克)。PHF6 KD显著降低Kasumi-1的增长,THP1和K562细胞(图1 b, C和补充图。1 h),并促进细胞凋亡(无花果。1 d, E和补充图。1我)。此外,我们进行了氯氟化碳分析确定影响clonogenicity。PHF6 KD也减少了殖民地Kasumi-1和THP1细胞的数量(补充图。1 j, K)。这些结果表明,PHF6可能涉及骨髓白血病起始和进展。
此外,我们撞倒PHF6 CD34+脐带血细胞和调查的角色PHF6造血作用(无花果。1 f)。我们发现PHF6 KD增加了CD34+脐带血细胞增殖和对细胞凋亡(图几乎没有影响。1 g H)。分析clonogenicity PHF6 KD CD34+,我们进行了氯氟化碳化验,发现PHF6 KD细胞的总菌落数比对照组增加。增加CD34的主要类型+细胞衍生殖民地CFU-E和BFU-E。它表明PHF6 KD提升CD34+细胞增殖和分化红细胞细胞体外(补充图。2)。此外,我们生成的Vav1-Cre; Phf6fl / y(VC Phf6,PHF6在血液细胞)和淘汰赛Phf6fl / y(Phf6 WT)老鼠和发现Phf6删除没有影响的数量BM LT-HSCs, ST-HSCs和MPP细胞体内(补充图。2 b, C)。然而,Phf6缺乏肝星状细胞造血再生能力强得多Phf6 WT肝星状细胞在竞争激烈的骨髓移植试验(补充图。二维)。值得注意的是,VC Phf6和Phf6 WT老鼠几乎没有显示任何疾病症状或病理表型PB, BM和脾脏(补充图。2 e)。这些结果表明,PHF6骨髓白血病细胞的增殖是至关重要的,但对正常造血可有可无的。
删除Phf6减少白血病进展RE9a——MA9-driven AML小鼠模型
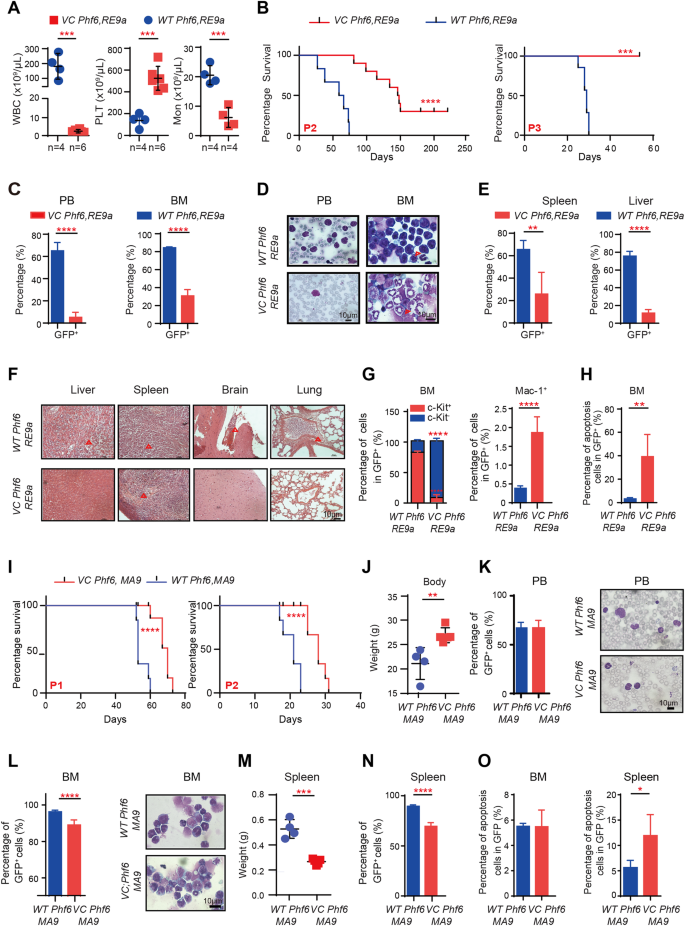
确定Phf6删除在体内白血病生成的影响,我们利用两个tha小鼠模型t表示RUNX1-ETO9a (RE9a)或MLL-AF9 (MA9)造血细胞。我们林排序- - - - - -细胞E14.5胎儿肝细胞或骨髓VC Phf6或Phf6fl / y雄性老鼠与RE9a-GFP病毒或MA9-GFP病毒转染。相等数量的绿色荧光蛋白+细胞被连续地移植到男性接受者建立两个AML小鼠模型(补充图。3)。我们分析两组,当一个群体的表型成为垂死挣扎。所有Phf6fl / y,RE9a(WT Phf6, RE9a老鼠迅速死于白血病的特征是显著增加白细胞计数和PB与PLT减少数量Vav1-Cre; Phf6fl / y,RE9a(VC Phf6 RE9a)老鼠一段3(图。2)。所有人的存活时间VC Phf6, RE9a老鼠明显超过的WT Phf6, RE9a老鼠在通道1到3(无花果。2 b和补充图。3 b)。中位数的生存WT Phf6, RE9a是62.5天,147天VC Phf6, RE9a通道2。值得注意的是,VC Phf6, RE9a老鼠表现出温和的疾病症状多WT Phf6, RE9a老鼠,包括降低GFP的计数+白血病细胞在PB和BM(无花果。2 c, D),更高的身体的重量和更低的脾脏和肝脏重量(补充图。3 c)。GFP的百分比+白血病细胞和骨髓浸润的程度在肝、脾、脑和肺也减少VC Phf6, RE9a老鼠比WT Phf6, RE9a老鼠(图。2 e, F)。此外,GFP的百分比+c - kit+细胞明显减少,而Mac-1的百分比+细胞在大英博物馆的增加VC Phf6, RE9a老鼠与相比WT Phf6, RE9a老鼠(图。2 g),这表明Phf6 KO促进了RE9a-induced白血病细胞的分化。此外,我们发现Phf6 KO促进了绿色荧光蛋白+白血病细胞凋亡和阻止细胞周期阶段G0(无花果。2 h和补充图。3 d)。这些结果表明,Phf6体内缺乏推迟了RE9a-induced AML进展。
一个PLT白细胞,单核细胞(星期一)数PB的常规血液测试。Bkaplan meier的生存曲线VC Phf6, RE9a和WT Phf6, RE9aAML老鼠通道2到3(生存率较p< 0.005,每组n≥5)。C绿色荧光蛋白的比例+细胞在PB和BMVC Phf6, RE9a和WT Phf6, RE9aAML老鼠。DWright-Giemsa PB细胞和BM细胞的染色。E绿色荧光蛋白的比例+细胞在脾脏和肝脏VC Phf6, RE9a和WT Phf6, RE9aAML老鼠。F他染色的脾、肝、肺、脑的VC Phf6, RE9a和WT Phf6, RE9aAML老鼠。红色的三角形表示白血病细胞浸润区。GGFP的百分比+c - kit+和Mac-1+BM的细胞VC Phf6, RE9a和WT Phf6, RE9aAML老鼠。H凋亡的比例在BM AML细胞VC Phf6, RE9a和WT Phf6, RE9a老鼠。我kaplan meier的生存曲线VC Phf6, MA9和WT Phf6, MA9AML老鼠在通道1和2(生存率较p< 0.005,n每组)≥5。J身体的重量VC Phf6, MA9和WT Phf6, MA9AML老鼠。KGFP的百分比+细胞在PB和Wright-Giemsa PB细胞的染色。lGFP的百分比+细胞在骨髓和Wright-Giemsa BM细胞的染色。米,N重量和GFP的百分比+脾细胞中VC Phf6, MA9和WT Phf6, MA9AML老鼠。O凋亡的比例在BM AML细胞和脾脏VC Phf6, MA9和WT Phf6, MA9老鼠。数据被表示为平均±标准差。
我们进一步观察到在MA9-induced Phf6 AML进展的作用。符合RE9a-induced AML小鼠模型,生存时间Vav1-Cre; Phf6fl / y,MA9(VC Phf6, MA9老鼠是超过的Phf6fl / y,MA9(WT Phf6, MA9(图)老鼠。2我)。中位数的生存WT Phf6, MA9是21天,28天VC Phf6, MA9通道2。身体的重量VC Phf6, MA9高于对照组小鼠(无花果。2 j)。GFP的百分比+白血病细胞在PB是相等的WT Phf6, MA9和VC Phf6, MA9AML老鼠(图。2 k)。GFP的百分比+白血病细胞的显著降低了BMVC Phf6, MA9与相比WT Phf6, MA9老鼠(图。2 l和补充图。3 e)。此外,体重和GFP+白血病细胞脾被减少VC Phf6, MA9老鼠比WT Phf6, MA9老鼠(图。2 m, N)。此外,Phf6删除导致更多的GFP+白血病细胞凋亡在脾而不是BMVC Phf6, MA9(无花果。2 o)。综上所述,这些研究结果进一步证明了Phf6是必不可少的MA9-induced aml,表明潜在的通用Phf6 aml的激活作用。
的损失Phf6减少LSC计数和受损LSC自我更新
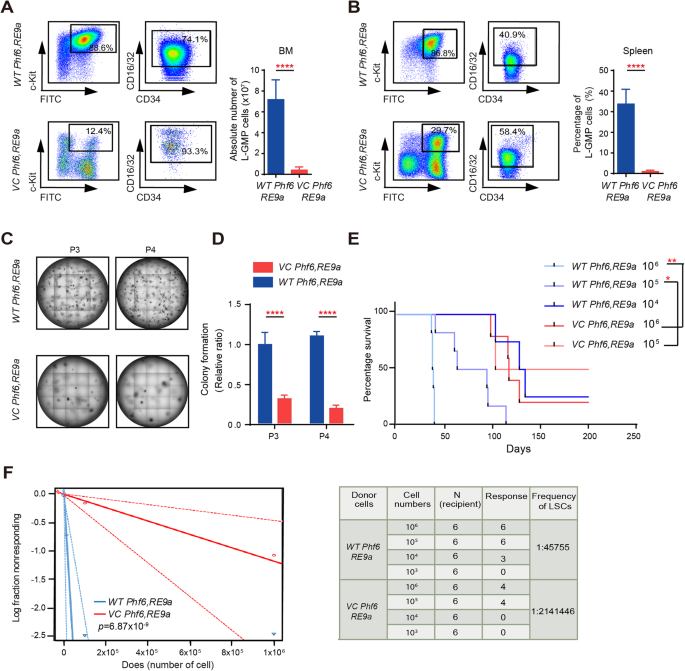
L-GMP细胞(林- - - - - -c - kit+本来就- - - - - -CD16/32+)被定义为lsc AML小鼠模型。确定的结果Phf6损失维护RE9a MA9-transformed lsc体内,我们的L-GMPs特征两个AML小鼠模型当AML老鼠成为垂死挣扎。我们发现数量或BM lsc的比例减少,脾脏和肝脏VC Phf6, RE9a老鼠与相比WT Phf6, RE9a老鼠(图。3 a, B和补充图。4 a、B)。然后执行串行种植化验检查损失的影响Phf6lsc体外自我更新能力,发现VC Phf6, RE9a胎儿肝细胞引起殖民地少于60%WT Phf6, RE9a第三和第四回合的胎儿肝细胞移植化验(无花果。3 c, D和补充图。4摄氏度)。与RE9a-induced AML小鼠模型一致,L-GMPs在BM和脾脏的百分比VC Phf6, MA9低于吗WT Phf6, MA9(补充图。4 d, E)。在连续种植化验,殖民地的数量VC Phf6, MA9BM细胞也减少了相比与控制细胞(补充图。4 f)。
一个L-GMPs (GFP的绝对数量+CD34+CD16/32+在BM)VC Phf6, RE9a和WT Phf6, RE9aAML老鼠。B。L-GMPs在脾脏的百分比VC Phf6, RE9a和WT Phf6, RE9aAML老鼠。C删除Phf6RE9a-expressing胎儿肝细胞的自我更新能力下降在连续种植化验。D殖民地的数量从3000年第三和第四RE9a-expressing细胞生成电镀。Ekaplan meier的生存曲线VC Phf6, RE9a和WT Phf6, RE9a小鼠白血病细胞的不同稀释试验(生存率较p<0.05,n每组)= 6。F的损失Phf6显著减少白血病干细胞的频率极限稀释测定。log-fraction情节(左面板)显示限制稀释试验的结果采用不同稀释的白血病细胞VC Phf6, RE9a和WT Phf6, RE9a体内(右面板)。数据被表示为平均±标准差。
量化功能lsc体内,我们执行极端限制稀释与AML细胞移植化验VC Phf6, RE9a或WT Phf6, RE9a老鼠。收件人为4个月post-transplantation老鼠生存的监控。收件人老鼠收到WT Phf6, RE9aAML细胞发达AML具有更短的延迟与小鼠相比VC Phf6, RE9a细胞(图。3 e)。由ELDA软件,lsc的频率降低了47-fold受体小鼠移植VC Phf6, RE9aAML细胞与控制老鼠(无花果。3 f)。总之,这些数据表明损失Phf6有效地推迟了AML过程削弱lsc的自我更新能力。
缺乏Phf6促进了由抑制NF-κB AML细胞凋亡信号通路
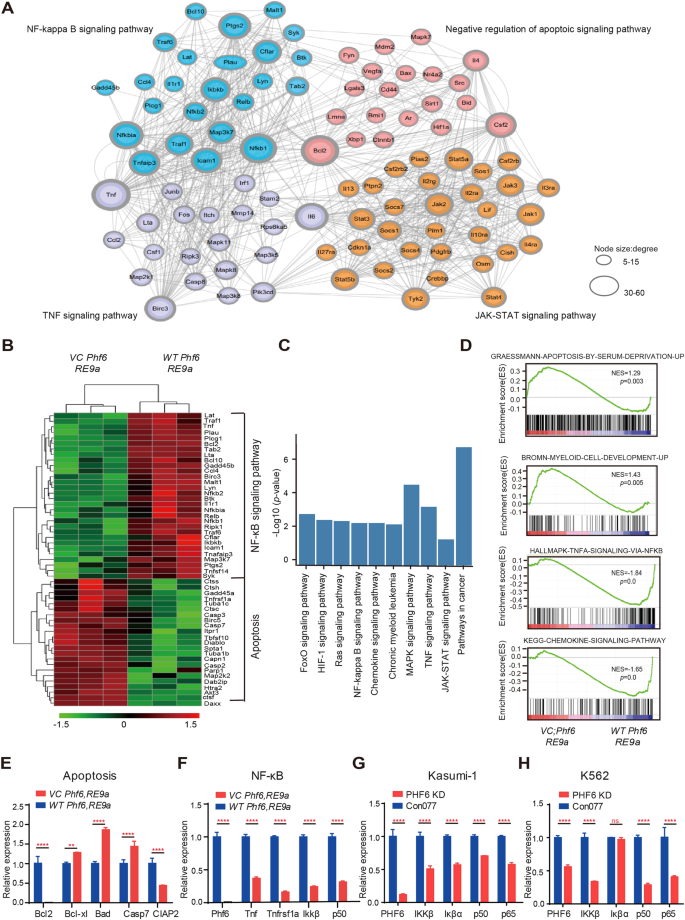
探索潜在的分子机制Phf6损失推迟AML进展,我们的转录概况进行了分析VC Phf6, RE9a和WT Phf6, RE9a通过RNA-sequencing AML细胞。它显示一个独特的基因表达特征VC Phf6, RE9a细胞(870个基因调节和961个基因表达下调;p< 0.05,补充图。5)。差异表达基因细胞凋亡明显富集,NF-κB, TNFαJAK-STAT信号通路(图4)。23 apoptosis-related基因调节,30 NF-κB-related基因表达下调Phf6KO白血病细胞(图4 b)。去KEGG分析表明,leukemogenesis-related途径表达下调,如ERK JAK-STAT, NF-κB, RAS信号通路et al .(图。4摄氏度和补充图。5 b)。髓细胞发展和homeostasis-related通路调节VC Phf6, RE9a细胞(补充图。5 c, D)。GSEA显示upregulation髓细胞和细胞凋亡的发展基因,TNFα-NF-κB和chemokine-regulated差别和对这些基因VC Phf6, RE9a细胞(图。4 d)。我们进一步验证发现抗凋亡基因Bcl2和CIap2 apoptosis-related基因表达下调,而基因促进细胞凋亡和Casp7调节不好VC Phf6, RE9a细胞(图。4 e)。值得注意的是,Phf6损失抑制NF-κB信号通路,降低Tnf的mRNA表达验证,Ikkβp50VC Phf6, RE9aAML细胞相比WT Phf6, RE9aAML细胞(图。4 f)。此外,我们还证实,PHF6 shRNA1减少KD的mRNA的表达NF-κB Kasumi-1和K562细胞(图中相关基因。4 g H)。因此,它建议Phf6损耗可能促进NF-κB AML细胞通过阻断细胞凋亡信号通路。
一个基因相互作用分析显示显著改变基因表达模式,参加了NF-κB信号通路,TNFα信号通路,JAK-STAT信号通路和凋亡信号通路VC Phf6, RE9aAML细胞相比WT Phf6, RE9aAML细胞。Bapoptosis-related热图和NF-κB相关基因。C表达下调KEGG分析信号通路VC Phf6, RE9aAML细胞相比WT Phf6, RE9aAML细胞。D基因集富集分析(GSEA)VC Phf6, RE9aAML细胞和WT Phf6, RE9aAML细胞。E,F验证apoptosis-related和NF-κB-related基因的表达VC Phf6, RE9a和WT Phf6, RE9aAML细胞。G,H在PHF6 KD Kasumi-1 NF-κB相关基因的表达和PHF6 KD K562细胞。数据被表示为平均±标准差。
损耗的PHF6抑制NF-κB活动扰乱PHF6-p50转录复杂和阻塞p50核易位
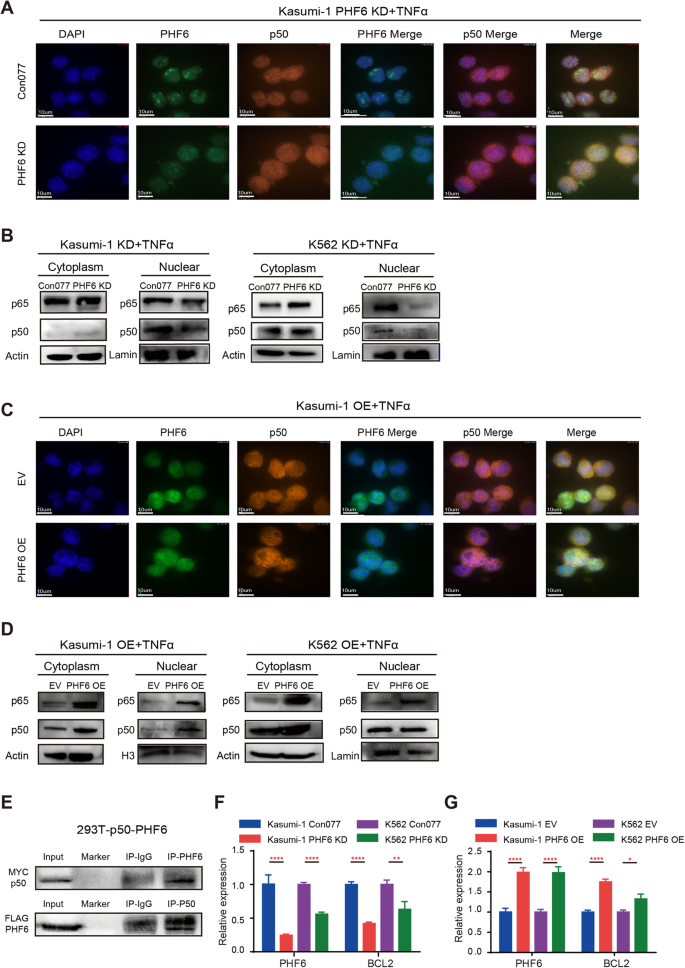
调查机制PHF6 NF-κB监管活动,我们评估的表达NF-κB相关因素在PHF6 KD shRNA1骨髓白血病细胞和控制细胞的免疫印迹分析。我们发现的表达p-IKKβ/ IKKβp50和p-p65 / p65没有改变PHF6 KD Kasumi-1和K562细胞相比,各自控制的存在与否TNFα(补充图。5 e, F)。的表达p-IκBα/ IκBαPHF6 KD Kasumi-1细胞略高于控制细胞,而类似于PHF6 KD K562细胞和控制细胞(补充图。5 e, F)。自核易位p50和p65直接调节NF-κB下游靶基因,我们进一步评估核易位的p50和p65 PHF6 KD骨髓白血病细胞免疫荧光响应TNFα治疗。我们发现p50易位到成功Kasumi-1和K562控制细胞的细胞核,细胞质的虽然保留PHF6 KD Kasumi-1和K562细胞治疗后的TNFα(无花果。5和补充图。6 a、B)。我们没有观察到任何差异在核易位的p65 PHF6 KD TNFα治疗后骨髓白血病细胞和控制细胞(补充图。6摄氏度)。值得注意的是,整体的p50相似PHF6 KD骨髓白血病细胞和控制细胞在TNFα的存在与否,而核p50和p65 PHF6 KD Kasumi-1 TNFα治疗后明显下降,分别与控制细胞K562细胞相比(图5 b)。此外,我们发现PHF6 OE导致更多p50转移从细胞质细胞核TNFα的刺激下。在这个过程中,PHF6陪同p50进入细胞核,最终硝唑PHF6 OE Kasumi-1和K562细胞的细胞核(无花果。5度和补充图。7 a、B)。免疫印迹分析还表明,PHF6 OE诱导更多的p50易位到细胞核Kasumi-1细胞K562细胞和p65易位到细胞核(无花果。5 d)。这些数据表明,PHF6监管通过核易位p50 NF-κB活动。
一个核易位p50(橙色)PHF6 KD Kasumi-1 TNFα刺激后细胞免疫细胞化学鉴定。细胞核被确定使用DAPI(蓝色)。规模的酒吧、10μm Kasumi-1细胞。数据代表三个独立的实验。Bp50和p65蛋白表达的细胞核和细胞质PHF6 KD Kasumi-1和TNFαPHF6 KD K562细胞的存在。这些细胞被刺激100 ng / ml TNFα2 h。C的协同定位PHF6(绿色)和p50(橙色)PHF6 OE Kasumi-1 TNFα刺激后细胞免疫细胞化学测定。细胞核被确定使用DAPI(蓝色)。规模的酒吧、10μm Kasumi-1细胞。Dp50和p65蛋白表达的细胞核和细胞质分数PHF6 OE Kasumi-1和TNFαPHF6 OE K562细胞的存在。EPHF6-FLAG和p50-MYC在293 T细胞(293 t-p50-phf6细胞)。上面板,Co-IP进行标记抗体。p50是293年由MYC抗体t-p50-phf6细胞。较低的面板,执行Co-IP MYC抗体。PHF6是293年由标记抗体t-p50-phf6细胞。F的mRNA表达PHF6和BCL2 PHF6 KD Kasumi-1和PHF6 KD K562细胞。G的mRNA表达PHF6和BCL2 PHF6 OE Kasumi-1和PHF6 OE K562细胞。数据被表示为平均±标准差。
进一步调查是否PHF6直接绑定p50和监管p50的功能,我们建造293 t-p50-phf6细胞,PHF6-FLAG(携带3 xflag-ha标记)和p50-MYC(携带6 xhis-myc标签)过表达(补充图。7 c)。Co-immunoprecipitation实验证实的物理交互PHF6 p50相互地(图。5 e)。据报道,p50直接绑定BCL2基因和促进了mRNA转录的bcl - 2 (31日]。这样我们测量的mRNA表达BCL2 PHF6 KD细胞,PHF6 OE细胞和控制细胞。我们发现BCL2减少PHF6 KD Kasumi-1 PHF6 KD K562细胞相比,控制细胞(无花果。5 f)。一致,BCL2增加PHF6 OE Kasumi-1 PHF6 OE K562细胞相比,控制细胞(无花果。5克)。这些数据表明,PHF6缺乏阻止NF-κB信号通路通过扰乱PHF6-p50转录复杂,部分抑制p50核易位。
抑制NF-κB会抑制PHF6 OE-induced AML进展
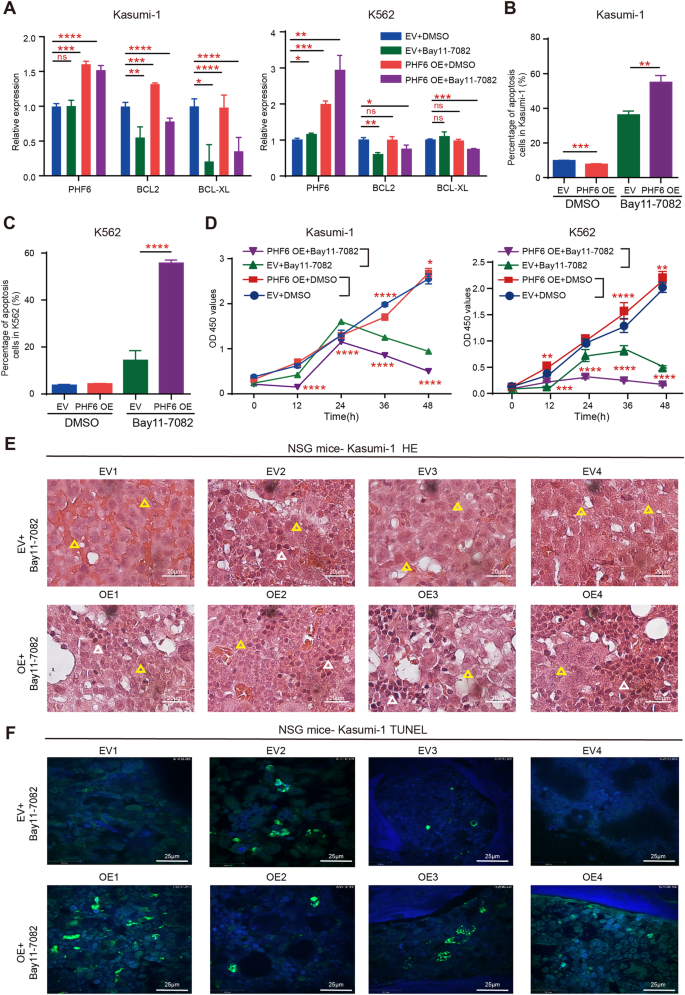
确定抑制NF-κB可以延迟PHF6 OE AML细胞的过度增殖,我们对待PHF6 OE骨髓白血病细胞bay11 - 7082(选择性NF-κB抑制剂)。我们发现bay11 - 7082有效减少的mRNA表达BCL2和BCL-XL PHF6 OE Kasumi-1和K562细胞与细胞治疗相比DMSO(无花果。6),这表明bay11 - 7082抑制NF-κB信号通路的活性。凋亡的比例PHF6 OE Kasumi-1和K562细胞远高于细胞治疗DMSO(无花果。6 b, C)。此外,我们发现bay11 - 7082显著抑制体外PHF6 OE Kasumi-1和K562细胞生长(图6 d)。
一个的mRNA表达BCL2 BCL-XL PHF6 OE Kasumi-1, PHF6 OE K562和控制细胞(EV)治疗后bay11 - 7082(4μM)或DMSO溶液。B,C凋亡细胞的比例PHF6 OE Kasumi-1, PHF6 OE K562和控制细胞治疗后bay11 - 7082或DMSO溶液。DPHF6 OE Kasumi-1的扩散,PHF6 OE K562和控制细胞治疗后bay11 - 7082或DMSO溶液。E,F组织学染色苏木精和伊红(他)(黄色三角形代表Kasumi-1细胞,白色三角形代表骨髓细胞,放大,100×)和TUNEL染色(绿色代表TUNEL,蓝色代表DAPI,放大,60×)在BM NSG小鼠移植PHF6 OE Kasumi-1或控制细胞(EV),和接受bay11 - 7082。数据被表示为平均±标准差。
接下来,我们评估了NF-κB抑制剂的抗白血病疗效PHF6 OE AML细胞体内。我们将PHF6 OE Kasumi-1或控制细胞移植到200 cgy辐照NSG老鼠和治疗这些老鼠bay11 - 7082一个月后。肿瘤负荷量化使用BM的苏木精和伊红染色(他)。bay11 - 7082治疗后三次10天,老鼠的道与PHF6 OE Kasumi-1细胞表现出轻微的渗透人类AML细胞(黄色箭头)在BM比老鼠的道与控制细胞(无花果。6 e和补充图。7 d),这表明bay11 - 7082可以部分救援PHF6 OE Kasumi-1体内细胞的过度增殖。此外,我们发现,细胞凋亡增加BM的老鼠道PHF6 OE Kasumi-1细胞比老鼠的道与控制细胞TUNEL (TdT-mediated dUTP缺口末端标记)染色(图6 f)。这些结果表明,治疗NF-κB抑制剂可以减少的发展PHF6 OE-induced AML通过促进体内白血病细胞凋亡。
讨论
AML是一个主要的造血系统恶性肿瘤的特点是不受控制的扩张不成熟的髓细胞(1]。骨髓性白血病表现出发育编程由特异表达基因和表观遗传变化。理解底层机制是白血病cells-targeted治疗制剂的开发成功的先决条件。在这项研究中,我们表明,PHF6发挥了pro-oncogenic作用引起的骨髓白血病发展RUNX1-ETO9a MLL-AF9老鼠,虽然PHF6不是必不可少的正常造血作用,表明它可能是一个有吸引力的药物靶标。
PHF6是守恒的表观遗传监管机构扮演重要的角色在造血和白血病生成(16,32,33]。温多夫等人表明损失Phf6导致小鼠肝星状细胞的扩张,但没有观察到髓系祖细胞的数量的差异,淋巴祖细胞或b细胞前体23]。虽然PHF6突变通常发生在白血病患者(18,24,27),PHF6缺乏单独并不足以诱导白血病变换(34]。据报道,Phf6损失可以显著加速t开发由co-mutation JAK3M511I或异常表达TLX3,暗示PHF6作为一个肿瘤抑制t [21,23]。有趣的是,PHF6变异率明显低于b和t AML患者相比,患者(24,35),它在所有角色相比,PHF6似乎发挥pro-oncogenic作用在b和AML。枯竭Phf6显著减少白血病细胞的生长Em-Myc b小鼠模型和长时间的生存bcr - abl诱导b体内小鼠模型(35,36]。Mousa等人确定PHF6调节AML患者(28,37]。在与他们的研究结果一致,我们发现高水平的PHF6预测预后不利对于AML患者,和促进骨髓白血病细胞的生长(图1和补充图。1)。这些独立的研究表明PHF6 lineage-specific角色在血液恶性肿瘤,并可能通过不同的信号通路在不同恶性肿瘤。
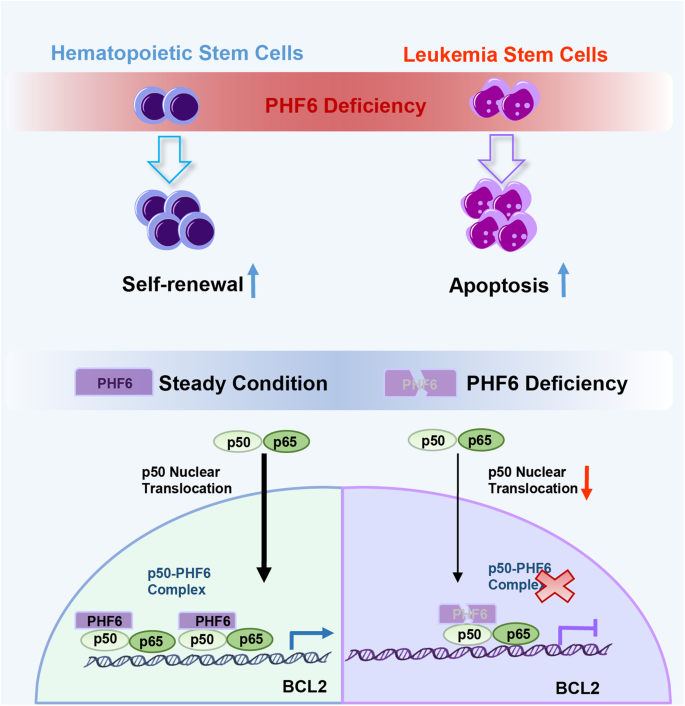
在我们的研究中,我们发现,过度的PHF6 Kasumi-1细胞RUNX1-ETO突变的bcr - abl1突变和K562细胞加速细胞的生长。另一方面,删除Phf6延迟AML的恶化RE9a和MA9小鼠模型,作为压倒一切的Phf6受损Kasumi-1和THP1细胞的生长。它建议高PHF6表达式可以播放一般的配角的骨髓白血病亚型。我们推测PHF6 AML的可能导致白血病生成额外的信号通路,不限于RE9a——或者MA9-pathways我们调查研究。值得注意的是,我们的mRNA分析分析表明Phf6损失apoptosis-related信号通路的激活和抑制NF-κB AML细胞信号通路(图4)。据报道,NF-κB持续激活在大多数急性髓系白血病,有助于抗白血病细胞凋亡(38,39,40]。与此一致的是,我们发现PHF6损耗增加通过抑制NF-κB AML细胞的细胞凋亡信号通路。规范NF-κB通路的激活导致退化的IκBα顺序磷酸化,泛素化,和proteasome-mediated蛋白质水解释放p50-p65异质二聚体,把原子核和绑定到特定的共识序列NF-κB目标基因的启动子内(例如,BCL2或BCL-XL) (41]。在目前的研究中,我们表明,PHF6可以直接绑定p50和促进p50核易位,从而增加BCL2的表达和抑制细胞凋亡的AML细胞(图。7),强调的一个新的功能方面PHF6 AML细胞。
AML保持了lsc池具有自我更新能力和其他干细胞属性对白血病治疗的抵抗(很重要42]。在这里,我们发现删除Phf6受损lsc在AML的增殖和自我更新,从而推迟白血病生成。据报道,NF-κB信号是活跃在lsc超过正常的肝星状细胞(40,43]。我们的研究表明,高水平的PHF6可以激活NF-κB异常的信号,而发挥抗凋亡和proliferation-promoting效果通过bcl - 2和BCL-XL(无花果。6)。PHF6赋予的增殖优势和NF-κB可能导致pre-leukemia细胞的克隆进化导致白血病的转换。此外,PHF6过度表达骨髓白血病细胞更敏感NF-κB抑制剂(bay11 - 7082)比其他细胞,表明NF-κB信号通路可能是一个新的抑制目标治疗骨髓白血病患者PHF6高表达。
总之,我们的研究发现一个意想不到的aml PHF6引起白血病的作用。我们需要证明PHF6骨髓白血病细胞生存和通过NF-κB信号通路LSC自我更新。AML细胞敏感PHF6基因丢失,而缺乏PHF6几乎没有影响正常的造血作用。我们的研究表明,通过阻断抑制PHF6 NF-κB信号通路将会是一个潜在的靶向治疗策略对AML患者。
数据可用性
RNA-sequencing数据集生成可用的在这个研究基因表达综合数据库下加入GSE205133数量。
引用
Estey E,多恩h .急性髓系白血病。《柳叶刀》杂志。2006;368:1894 - 907。
卡西迪年代,赛义德·巴。急性髓系白血病药物市场。Nat牧师药物。2016;15:527-8。
Kantarjian嗯,Kadia TM, DiNardo CD,韦尔奇,Ravandi f .急性髓系白血病:2021年治疗和研究前景和安德森的方法。癌症。2021;127:1186 - 207。
Grimwade D, Mrozek k .诊断和预后的价值在急性髓系白血病细胞遗传学。内科杂志杂志中国北部。2011;25:1135 - 61。
那些时光D, Mrozek K, Marcucci G, Nicolet Maharry KS,贝克尔H,惠特曼SP, et al .预后意义的欧洲LeukemiaNet标准化系统报告细胞遗传学和分子改变成人急性髓系白血病(aml)。肿瘤防治杂志。2012;30:4515-23。
Grimwade D,山RK,穆斯林AV,沃克H,一样地年代,戈德斯通啊,et al .细化在急性髓系白血病细胞遗传学分类:染色体异常罕见的预后意义重复测定5876名年轻的成年患者在英国医学研究理事会试验。血。2010;116:354 - 65。
古铁雷斯,Romero-Oliva足总。表观遗传变化:急性骨髓性白血病生成一个共同的主题。J内科杂志杂志。2013;6:57。
Grisolano杰,奥尼尔J,凯恩J, Tomasson MH。一个激活受体酪氨酸激酶,TEL / PDGFbetaR,配合AML1 /埃托奥在小鼠诱导急性髓系白血病。《美国国家科学院刊。2003;100:9506-11。
Schessl C, Rawat VP, Cusan M, Deshpande,科尔TM, Rosten点,et al . AML1-ETO融合基因和长度FLT3突变在诱导小鼠急性白血病进行协作。中国Investig。2005; 115:2159 - 68。
Rodriguez-Paredes M, Esteller M .癌症肿瘤表观遗传学达到主流。Nat医学。2011;17:330-9。
菜NM, Klappacher J,奥斯瓦尔德F, Mulaw MA Mandoli,泰尔VN, et al . MEIS2 AML1-ETO-positive AML的致癌的伴侣。细胞众议员16:498 2016;507年。
朱Bernt公里,N, Sinha盟,Vempati年代,Faber J, Krivtsov AV, et al . MLL-rearranged白血病是依赖于异常DOT1L H3K79甲基化。癌细胞。2011;20:66 - 78。
Daigle SR, Olhava EJ、Therkelsen CA maj CR,嘲笑CJ,歌J, et al。混合血统的选择性杀死白血病细胞有效的小分子DOT1L抑制剂。癌细胞。2011;20:53 - 65。
张N, Fung TK, Zeisig BB,福尔摩斯K,美国莱恩JK, Mowen KA,等。针对异常的表观遗传网络由PRMT1 KDM4C急性髓系白血病。癌细胞。2016;29:32-48。
张N,陈LC,汤普森,佳毫升,所以连续波。蛋白质arginine-methyltransferase-dependent肿瘤形成。Nat细胞杂志。2007;9:1208-15。
公里,特纳G,克尔英航Mathews KD,肖马,Gedeon AK, et al .突变PHF6 Borjeson-Forssman-Lehmann综合症有关。Nat麝猫。2002;32:661-5。
曹国伟MM,托德•马Kontny U,近地小行星K,沙利文MJ,猎人AG)、et al . t细胞急性淋巴细胞白血病与Borjeson-Forssman-Lehmann综合症由于PHF6的突变。Pediatr血液癌症。2010;55:722-4。
范Vlierberghe P, Palomero T, Khiabanian H, Van der Meulen J,卡斯蒂略,范·罗伊N, et al。PHF6突变在T细胞急性淋巴细胞白血病。Nat麝猫。2010;42:338-42。
肖W,巴拉米,莱文M, Farnhoud N,帕斯托雷F, Getta BM, et al . PHF6和DNMT3A变异丰富独特的子组的混合与T-lineage分化表型急性白血病。血液放置2018;2:3526-39。
亚历山大结核病顾Z,雅克布奇,迪克森K,崔JK,徐B, et al。混合表型的遗传基础和细胞的急性白血病。大自然。2018;562:373-9。
麦克蕾嗯,Garnham AL,胡锦涛Y, Witkowski MT, Corbett妈,Dixon MP, et AL . PHF6调节造血干细胞和祖细胞及其与表达TLX3加强损失导致白血病。血。2019;133:1729-41。
郭元,王X,侯年代,T,局域网Y,杨年代,et al . PHF6和JAK3突变驾驶T细胞急性淋巴细胞白血病发展合作。白血病。2022;36:370 - 82。
温多夫AA,奎因SA, Rashkovan M, Madubata CJ, Ambesi-Impiombato, Litzow先生,et al . Phf6损失提高造血干细胞自我更新驱动肿瘤起始和白血病干细胞在所有活动。癌症。2019;9:436-51。
范Vlierberghe P, Patel J,躲开啊,Lobry C, Hedvat简历,尹浩然,Balbin。PHF6突变成人急性髓系白血病。白血病。2011;25:130-4。
Mori T,经营着Y, Makishima H, Sanada M, Shiozawa Y,今敏,et al .体细胞PHF6突变与各种髓系肿瘤1760例。白血病。2016;30:2270-3。
Lejman M, Zawitkowska J, Styka B, Babicz M, Winnicka D, Zaucha-Prazmo, et al .微阵列测试作为一种有效的工具来重新定义超二倍体的儿科B细胞前体急性淋巴细胞白血病患者。Leuk杂志2019;83:106163。
de罗阿JD, van den Heuvel-Eibrink MM, van de Rijdt NK, Verboon LJ,德哈斯V, Trka J, et al . PHF6突变儿科急性髓系白血病。Br J Haematol。2016; 175:967 - 71。
没有,配料的M, Assem MM, Dawood公里,奥斯曼a表达分析一些急性骨髓leukemia-associated标记来评估他们的诊断/预测的潜力。麝猫杂志。2021;44。
刘人N,谭Y,太阳XJ, F,程G,格林布拉特SM, et al . Caspase-3控制AML1-ETO-driven白血病生成通过自噬在ULK1-dependent调制方式。血。2017;129:2782 - 92。
高,高J,李米,郑Y, Y,王张H, et al . Rheb1促进肿瘤进展通过mTORC1 MLL-AF9-initiated小鼠急性髓系白血病(aml)。J内科杂志杂志。2016;36。
Paz-Priel我Ghosal AK Kowalski J,弗里德曼广告。C / EBPalpha或C / EBPalpha癌基因蛋白调节的内在和外在的凋亡通路通过直接与NF-kappaB p50绑定到bcl - 2和翻转基因启动子。白血病。2009;23:365 - 74。
感伤恋歌的议员,Hamiche Klaholz基点。洞察卑微的人染色质重构复杂的结构和功能。细胞摩尔生命科学。2015;72:2491 - 507。
托德•马Ivanochko D,皮科特DJ。PHF6度分离:染色质适配器蛋白质的多方面的角色。基因。2015;6:325-52。
宫城,Sroczynska P,加藤Y, Nakajima-Takagi Y,大岛渚M, Rizq O, et al . chromatin-binding蛋白Phf6限制造血干细胞的自我更新。血。2019;133:2495 - 506。
米查姆CE、劳顿LN、Soto-Feliciano YM, Pritchard JR Joughin英航ehrenberg T,等。公司体内功能丧失的屏幕识别Phf6 lineage-specific调节器的白血病细胞生长。基因Dev。2015; 29:483-8。
Soto-Feliciano YM, Bartlebaugh期刊,刘Y, Sanchez-Rivera FJ, Bhutkar,温特劳布,et al . PHF6调节表型可塑性通过染色质组织内lineage-specific基因。基因Dev。2017; 31:973 - 89。
kurz JH,温伯格OK。PHF6血液恶性肿瘤中的突变。肿瘤防治杂志。2021;11:704471。
鲍姆加特纳B,韦伯M, Quirling M,费舍尔C,页面年代,尹浩然,亚当。增加IkappaB激酶活性与激活在急性骨髓NF-kappaB爆炸有关。白血病。2002;16:2062 - 71。
Frelin C,伊伯特V, Griessinger E, Peyron AC,白色法衣N,菲利普·P等。针对NF-kappaB激活通过药物抑制IKK2-induced人类急性骨髓白血病细胞的细胞凋亡。血。2005;105:804-11。
博斯曼MC, Schuringa JJ, Vellenga大肠本构NF-kappaB AML激活:原因和治疗策略。暴击牧师杂志内科杂志。2016;98:35-44。
布劳恩T,卡瓦略G,法布尔C, Grosjean J, Fenaux P,获得G .针对NF-kappaB血液恶性肿瘤。细胞死亡是不同的。2006;13:748-58。
山下式M, Dellorusso PV,奥尔森OC, Passegue大肠特异表达造血的骨髓leukaemogenesis干细胞的行为。Nat癌症。2020年,牧师20:365 - 82。
Kagoya Y,主管Yoshimi Kataoka K,中川M,熊野K, Arai年代,et al。NF-kappaB和tnf促进leukemia-initiating细胞之间的正反馈能力。中国Investig。2014; 124:528-42。
资金
这项工作是支持的资金从中国科技部(2022 yfa1103300 WPY YJC),中国国家自然科学基金(XMW 82270153和82070169,81970149和82150710556 WPY);中国医学科学院医学科学创新基金,CIFMS (2021 - i2m WPY - 1 - 040),和海河实验室的细胞生态系统创新基金(22 hhxbss00037 WPY YJC)。
作者信息
作者和联系
贡献
WPY XMW构思项目,监督研究和修正。SBH、TXG XMW设计和执行大部分的实验,和修改后的文章中写道。YJL后,SY, FZ、AZF问,和WZY辅助实验和数据分析,YJC, ELJ, TC, xj贡献研究设计、试剂分享和讨论。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
侯,S。,Wang, X., Guo, T.et al。PHF6维护通过调节NF-κB信号通路急性髓系白血病。白血病(2023)。https://doi.org/10.1038/s41375 - 023 - 01953 - 6
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41375 - 023 - 01953 - 6