最近发表在自然Alex Cagan, Adrian Baez-Ortega及其同事发现,许多哺乳动物物种在生命结束时呈现出类似的体细胞突变负荷。突变负担与寿命和体重无关,只在物种间发生相对较小的倍数变化。1这些数据可能表明突变负担可以预测死亡率。
早在70年前,研究人员就假设癌症和衰老是由体细胞突变的积累引起的。2虽然复发性癌症驱动基因的体细胞突变明显促进致癌,但由于小突变克隆的巨大异质性,研究体细胞突变和组织嵌合对衰老和年龄相关疾病的影响仍然具有挑战性。随着最近DNA测序技术的进步,关于体细胞突变进化的长期问题现在可以解决了。
流行病学家理查德·皮托发现了逻辑与生物现实之间的不一致,被称为皮托悖论。他指出,如果体细胞突变以线性速度发展,而突变预测癌症,那么拥有更多细胞的大型动物,因此可能获得更多突变,应该比小型动物死得早。然而,事实并非如此。3.
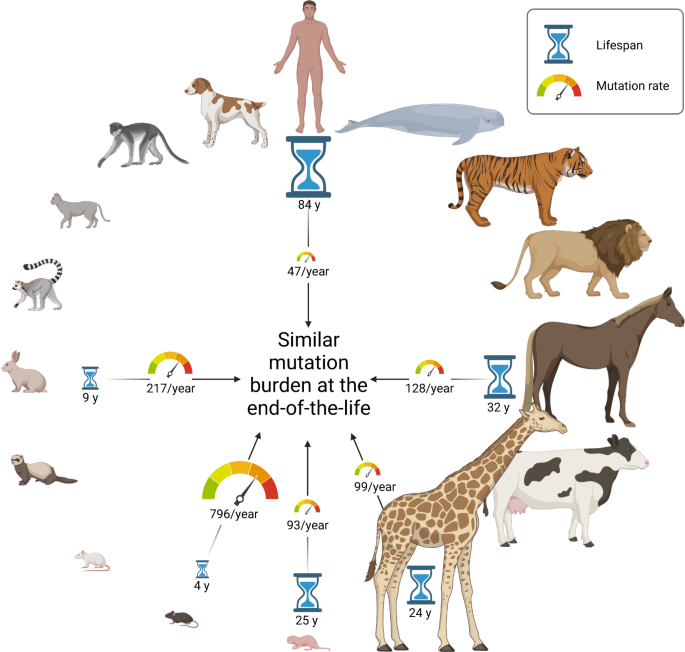
卡根等人提供的实验数据部分解释了皮托的悖论——只有通过今天的技术才能实现。1作者比较了16种哺乳动物的微解剖单结肠隐窝的全基因组测序分析。鉴于其保守的解剖状态和克隆起源,该组织适合于研究自然发生的体细胞突变率。事实上,作者证实,在一个物种内,突变积累是随着时间线性增加的,就像之前在人类中证明的那样。4然而,相对突变率是物种依赖的,在物种之间有很大的差异。跨物种的三种一致的COSMIC突变特征(相当于人类SBS1、5和18)出现了突变。重要的是,作者证明了在16种哺乳动物中,体细胞突变率与寿命成反比。1).这可以通过比较短寿小鼠(约3年)每年的高突变率和长寿裸鼹鼠(>25年)的缓慢突变率来说明。这项研究的另一个引人注目的方面是,像老鼠、长颈鹿和人类这样不同的物种,它们的寿命和体型都不同,但在生命结束时出现的体细胞突变数量相似。体细胞突变负荷的差异仅为3倍左右,而在本研究中,物种间的体重差异为3.9万倍。实际上,当突变的临界丰度发展时,生命的停车计时器将显示“时间过期”。长寿哺乳动物的缓慢突变率表明控制体细胞突变的发展可以限制癌症风险。这也解释了为什么哺乳动物终生癌症发病率相似,因为尽管它们的体重和寿命有很大差异,但需要几个驱动突变才能发展成恶性转化。然而,其他细胞内禀和环境因素影响了癌症的发展,这里就不讨论了。
突变率与寿命呈负相关。Cagan et al。1通过克隆结肠隐窝的全基因组测序比较,证明在16个不同物种的哺乳动物中,体细胞突变的突变率(速度计)与寿命(沙漏)呈负相关。然而,这些物种在生命结束时的突变负担是高度相似的。这一观察结果在很大程度上与各自的体重无关。这个图是用BioRender生成的
作者报告说,对于三种类型的突变特征以及编码区和线粒体DNA的突变模式,突变率和寿命保持着很强的反相关关系,这表明没有单一的生物过程(DNA修复途径可能在物种之间不同)控制着这种现象。因此,总的突变负荷比单个突变过程与寿命的相关性更好。
细胞和有机体老化的原因仍然令人困惑。这项研究证明了哺乳动物在生命结束时也有类似的突变负担。获得性突变会导致细胞、器官和整个机体的衰老和功能障碍吗?那么突变率将是生命时钟的起搏器,因此突变阈值将限制寿命。然而,对某些遗传缺陷DNA修复机制导致更高体细胞突变率的个体的观察并没有显示出明显的早衰迹象。5或者,某种突变负担可能在没有经验检测到的生理负选择压力影响的情况下是可以容忍的,而且可能突变率随着寿命的推移而进化。寿命较短的动物可以容忍较高的突变率,因此,为了保持低突变率,可以减少对广泛修复机制的重视。
除了癌症之外,我们对获得性体细胞突变引起(而不是与之相关)与年龄相关疾病的可能性仍然知之甚少。虽然从衰老过程的角度来看,突变积累对细胞功能和存活的直接后果似乎不太可能,但涉及身体对器官功能受损的反应的细胞间相互作用可能会受到影响。由血干细胞中血癌相关基因的体细胞突变引起的免疫细胞功能障碍,即克隆造血,已经引起了医学上的兴趣。虽然这些突变在干细胞/祖细胞室中提供了竞争优势,但它们也会导致免疫细胞的有害功能变化,对心血管疾病的进展产生负面影响,从而在有机体相互作用中影响人类衰老。衰老是一个多因素和复杂的过程,不仅仅是由单个细胞中体细胞突变的积累所主导。端粒缩短、蛋白质聚集和表观遗传改变的比率同样可以预测死亡率。在多细胞生物中,某些细胞类型的体细胞突变可能会影响网络的稳定性,并对生物造成不可预测的破坏性力量。
当考虑到Cagan等人的研究时,许多后续问题就会浮出水面。在不同物种中决定和控制突变率的分子过程是什么?延长寿命的选择压力是什么?对于一个特定的物种,所有组织中体细胞突变的积累是否遵循相同的趋势?这篇手稿支持了关于老鼠是否是一种合适的模式生物的讨论。对于本研究的数据,小鼠非常符合衰老和疾病的模型,但DNA完整性的控制可能在人和小鼠之间存在差异。
Cagan等人的研究是一个里程碑式的研究,它为如何不仅看待人类健康和疾病,而且看待哺乳动物的整个生命提供了一个新的框架。
参考文献
卡根,A.等。在哺乳动物中,体细胞突变率随寿命的变化而变化。自然604, 517 - 524(2022)。
诱发癌症机制的新理论。Br。j .癌症7, 68 - 72(1953)。
文森特,欧等人。哺乳动物的癌症风险。自然601, 263 - 267(2022)。
Lee-Six, H.等人。正常结直肠上皮细胞体细胞突变的景观。自然574, 532 - 537(2019)。
罗宾逊,p.s.等。由于DNA聚合酶缺陷,正常人细胞体细胞突变负担增加。Nat,麝猫。53, 1434 - 1442(2021)。
资金
由Projekt DEAL支持和组织的开放获取资金。
作者信息
作者和联系
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
克里默,阿伯普兰尔普,W.T. &里格尔,M.A.时间到了:突变率和寿命。Sig trans导管目标Ther7282(2022)。https://doi.org/10.1038/s41392-022-01122-8
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41392-022-01122-8