亲爱的编辑器gydF4y2Ba,gydF4y2Ba
近年来,免疫疗法的快速发展为肺鳞状细胞癌(LUSC)患者带来了生存益处,这些患者的治疗选择很少。然而,仍有部分患者存在免疫治疗耐药,这是整体人群获益率低和疾病进展的根本原因,是亟待解决的问题。除肿瘤突变负荷外,肿瘤免疫微环境(TIME)以CD8浸润为特征gydF4y2Ba+gydF4y2Ba肿瘤浸润淋巴细胞(TILs)和PD-L1表达与免疫检查点抑制剂(ICIs)的疗效相关。在我们之前的研究中,我们已经证明了银屑病素,也被称为S100钙结合蛋白A7 (S100A7),不仅通过激活LUSC中的p-Erk途径和食管鳞状细胞癌(ESCC)中的p-Erk和p-FAK途径加速肿瘤进展,而且还通过促进ESCC中的血管生成和M2巨噬细胞浸润来重塑肿瘤微环境。gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba然而,S100A7在LUSC的TIME和免疫治疗疗效中的作用尚不明确。gydF4y2Ba
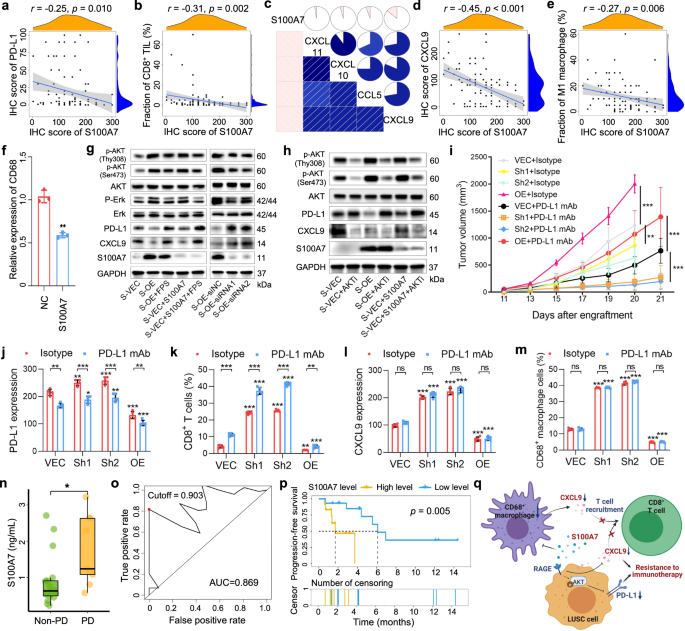
本研究收集了来自中国医学科学院肿瘤医院和研究所的102例LUSC切除标本,基于CD8确定S100A7表达与TIME的相关性gydF4y2Ba+gydF4y2BaTILs浸润和PD-L1的免疫组化表达。结果表明,S100A7的表达与PD-L1的表达(gydF4y2BargydF4y2Ba=−0.25,gydF4y2BapgydF4y2Ba= 0.010;无花果。gydF4y2Ba1gydF4y2Ba)和CD8gydF4y2Ba+gydF4y2BaTILs渗透(gydF4y2BargydF4y2Ba=−0.31,gydF4y2BapgydF4y2Ba= 0.002;无花果。gydF4y2Ba1 bgydF4y2Ba).一些趋化因子包括CCL5, CXCL9, CXCL10和CXCL11已被证明驱动CD8的浸润gydF4y2Ba+gydF4y2Ba尖。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba考虑到这一点,我们利用癌症基因组图谱(TCGA)数据库中LUSC样本的转录组数据研究了S100A7的表达与这些趋化因子之间的关系。S100A7与CXCL9表达呈负相关(gydF4y2BargydF4y2Ba=−0.14,gydF4y2BapgydF4y2Ba= 0.002;无花果。gydF4y2Ba1 cgydF4y2Ba和补充图。gydF4y2Ba印地gydF4y2Ba).基于LUSC样本的转录组数据,应用CIBERSORT计算了22个免疫细胞的个体分数,并分析了它们与S100A7表达的关系。除了与CD8有关gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BargydF4y2Ba=−0.21,gydF4y2BapgydF4y2Ba< 0.001), S100A7表达与M1巨噬细胞浸润呈负相关(gydF4y2BargydF4y2Ba=−0.17,gydF4y2BapgydF4y2Ba< 0.001)(补充图。gydF4y2Ba就是S1cgydF4y2Ba).随后的免疫组化研究进一步证实了S100A7表达与CXCL9表达(gydF4y2BargydF4y2Ba=−0.45,gydF4y2BapgydF4y2Ba< 0.001;无花果。gydF4y2Ba1 dgydF4y2Ba)和CD68gydF4y2Ba+gydF4y2BaM1巨噬细胞浸润(gydF4y2BargydF4y2Ba=−0.27,gydF4y2BapgydF4y2Ba= 0.006;无花果。gydF4y2Ba1 egydF4y2Ba)。接下来,我们通过RT-qPCR检测在存在或不存在S100A7蛋白的情况下,IFN-γ和LPS诱导的pma活化的THP1细胞中M1巨噬细胞特异性标记物(CD68)的表达,我们的分析显示,在添加S100A7蛋白的巨噬细胞中,CD68的表达显著降低(图。gydF4y2Ba1 fgydF4y2Ba).以上结果提示S100A7抑制M1巨噬细胞极化。有趣的是,许多研究已经确定了CD68gydF4y2Ba+gydF4y2Ba巨噬细胞是CXCL9的主要来源。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba
S100A7对LUSC TIME特征及免疫治疗疗效的影响。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba免疫组化分析S100A7和gydF4y2Ba一个gydF4y2BaPD-L1表达式,gydF4y2BabgydF4y2BaCD8gydF4y2Ba+gydF4y2Ba直到渗透,gydF4y2BadgydF4y2BaCXCL9表达式,和gydF4y2BaegydF4y2BaLUSC患者肿瘤标本中M1巨噬细胞浸润。gydF4y2BacgydF4y2Ba基于皮尔逊的交叉相关图gydF4y2BargydF4y2BaTCGA数据集的LUSC样本中S100A7、CXCL9、CXCL10和CXCL11的表达值。gydF4y2BafgydF4y2Ba在S100A7蛋白存在或不存在的情况下,IFN-γ和LPS诱导pma活化的THP1细胞CD68表达。NC组:PMA + IFN-γ + LPS;S100A7组:PMA + IFN-γ + LPS + S100A7。gydF4y2BaggydF4y2Ba而且gydF4y2BahgydF4y2BaWestern blot分析不同处理H226细胞S100A7、PD-L1和CXCL9的表达及激酶信号通路。以GAPDH表达作为加载对照。S-VEC:对照H226细胞;S-OE:过表达s100a7的H226细胞。FPS: RAGE-specific inhibitor (FPS- zm1);S100A7:重组人S100A7蛋白;AKTi: akt特异性抑制剂(MK-2206 2HCL)。gydF4y2Ba我gydF4y2Ba小鼠承载控制(VEC)、s100a7a敲低(Sh1和Sh2)和s100a7a过表达(OE) KLN205细胞(gydF4y2BangydF4y2Ba= 5)用同型对照或抗pd - l1单克隆抗体(抗pd - l1单抗)治疗。同种型对照组小鼠由于肿瘤结节太大,在第20天用二氧化碳窒息法处死以获取肿瘤进行免疫组化分析。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba免疫组化分析gydF4y2BajgydF4y2BaPD-L1表达式,gydF4y2BakgydF4y2BaCD8gydF4y2Ba+gydF4y2BaT细胞浸润,gydF4y2BalgydF4y2BaCXCL9表达式,和gydF4y2Ba米gydF4y2BaCD68gydF4y2Ba+gydF4y2Ba各组巨噬细胞浸润情况。gydF4y2BangydF4y2Ba进展性疾病(PD)患者与非PD患者血浆S100A7基线水平的分布。gydF4y2BaogydF4y2Ba接受抗pd -1免疫治疗的LUSC患者无进展生存(PFS)基线血浆S100A7水平的ROC分析。gydF4y2BapgydF4y2Ba基于基线血浆S100A7水平的抗pd -1免疫治疗的LUSC患者PFS Kaplan-Meier生存曲线gydF4y2Ba问gydF4y2Ba研究的图形摘要。图形摘要是由BioRender.com创建的。ns:gydF4y2BapgydF4y2Ba> 0.05;*gydF4y2BapgydF4y2Ba< 0.05gydF4y2Ba;gydF4y2Ba**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001gydF4y2Ba
鉴于CXCL9在肿瘤细胞中也被发现(补充图。gydF4y2BaS2gydF4y2Ba),通过RT-qPCR和western blotting检测CXCL9在对照组和过表达s100a7的LUSC细胞中的表达。结果显示,S100A7,无论是内源性产生的还是外源性添加到H226细胞中,都会降低CXCL9的表达,而S100A7沉默或用晚期糖基化终产物受体(RAGE)抑制剂(FPS-ZM1)处理会增加CXCL9的表达(图2)。gydF4y2Ba1克gydF4y2Ba和补充图。gydF4y2BaS3f ggydF4y2Ba).进一步的通路研究表明,AKT抑制剂可轻微减弱CXCL9的表达(图。gydF4y2Ba1 hgydF4y2Ba和补充图。gydF4y2BaS3hgydF4y2Ba).前期研究表明S100A7可以通过RAGE发挥其功能,促进下游信号通路的激活。gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba在我们的研究中,S100A7蛋白的过表达或外源性导入均可激活p-Erk和p-AKT通路(图2)。gydF4y2Ba1克gydF4y2Ba).此外,我们还观察到pd - l1的表达水平被S100A7明显地解除调控(图。gydF4y2Ba1克gydF4y2Ba和补充图。gydF4y2BaS3cgydF4y2Ba).先前的研究报道,激活p-Erk信号通路会增加PD-L1的表达。gydF4y2Ba5gydF4y2Ba值得注意的是,我们的研究表明,通过敲除S100A7或使用RAGE或AKT抑制剂治疗,PD-L1的表达可以部分消除。gydF4y2Ba1 g hgydF4y2Ba和补充图。gydF4y2BaS3c-egydF4y2Ba).基于这些发现,我们推测S100A7过表达不仅通过激活p-AKT通路降低PD-L1水平,还通过下调CD68的浸润抑制肿瘤微环境中趋化因子CXCL9的分泌gydF4y2Ba+gydF4y2Ba肿瘤细胞中的巨噬细胞和CXCL9水平。这些机制进一步下调了CD8的浸润gydF4y2Ba+gydF4y2BaTILs,反过来又建立了免疫抑制TIME,主要抵抗ICIs。gydF4y2Ba
考虑到S100A7表达与免疫抑制时间之间的关系,我们希望确定在LUSC中观察到的S100A7失调对免疫治疗反应的影响。为此,我们在后续实验中使用了具有人类S100A7小鼠同源物的小鼠模型,S100A7a(补充图)。gydF4y2BaS4gydF4y2Ba而且gydF4y2BaS5agydF4y2Ba).与载体对照相比,抗pd - l1抑制剂在s100a7a敲低组的抗肿瘤作用更强(gydF4y2BapgydF4y2Ba< 0.001;无花果。gydF4y2Ba1我gydF4y2Ba和补充图。gydF4y2BaS5cgydF4y2Ba).同时,与我们之前的结果一致,在缺乏抗pd - l1抑制剂的情况下,敲除S100A7a会降低肿瘤结节的生长能力(gydF4y2BapgydF4y2Ba< 0.001;无花果。gydF4y2Ba1我gydF4y2Ba和补充图。gydF4y2BaS5bgydF4y2Ba).免疫组化研究显示PD-L1和CXCL9表达升高,CD8升高gydF4y2Ba+gydF4y2BaT细胞和CD68gydF4y2Ba+gydF4y2Bas100a7a敲除小鼠肿瘤标本中巨噬细胞浸润(图;gydF4y2Ba1 j-mgydF4y2Ba).更重要的是,在s100a7a过表达小鼠中使用抗PD-L1药物并没有引起PD-L1表达和CD8的更显著变化gydF4y2Ba+gydF4y2BaT细胞浸润与其他组比较(图;gydF4y2Ba1 j, kgydF4y2Ba).gydF4y2Ba
根据之前的报道,S100A7可以在细胞外分泌,并在血浆中检测到,gydF4y2Ba2gydF4y2Ba纳入了27例接受ICIs治疗的LUSC患者队列,以调查S100A7基线血浆水平与ICIs疗效之间的关系(补充表)gydF4y2BaS1gydF4y2Ba).在进展性疾病的LUSC患者中观察到较高的S100A7基线血浆水平(gydF4y2BapgydF4y2Ba= 0.039;无花果。gydF4y2Ba1 ngydF4y2Ba).计算受试者工作特征(ROC)曲线下面积,分析基线血浆S100A7水平对免疫治疗应答的预测能力,其值为0.869(图。gydF4y2Ba1阿gydF4y2Ba).然后,我们根据ROC曲线计算出的最佳截断值(截断值= 0.903;无花果。gydF4y2Ba1阿gydF4y2Ba).在我们的分析中,我们发现较高的S100A7基线血浆水平与较差的无进展生存率显著相关(gydF4y2BapgydF4y2Ba= 0.005;无花果。gydF4y2Ba1便士gydF4y2Ba).此外,单因素和多因素Cox回归分析显示,S100A7基线血浆水平是一个独立的预后因素(补充表gydF4y2BaS3gydF4y2Ba).gydF4y2Ba
综上所述,我们证明了S100A7的上调可能导致ICIs耐药,这是由于通过激活p-AKT通路导致PD-L1表达降低和CD8降低的免疫抑制时间重构所致gydF4y2Ba+gydF4y2BaTILs通过下调CXCL9表达浸润(图;gydF4y2Ba1问gydF4y2Ba).我们还证实,靶向抑制S100A7可能通过产生炎症表型来增强ICIs的疗效,然而,抗S100A7抑制剂的缺乏限制了我们的临床应用。最后,我们确定了基线血浆中S100A7水平的预测能力,这可以进一步指导ICIs在LUSC患者中的使用。然而,小样本量的局限性应该得到承认,因此在未来的大规模研究中进一步验证这一生物标志物是有必要的。gydF4y2Ba
数据可用性gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Lu, Z.等。tgfbeta诱导的lncRNA TBILA通过顺式调节HGAL和激活S100A7/JAB1信号,促进非小细胞肺癌在体外和体内的进展。gydF4y2Ba癌症。gydF4y2Ba432gydF4y2Ba, 156-168(2018)。gydF4y2Ba
Lu, Z.等。S100A7作为食管鳞状细胞癌的潜在诊断和预后生物标志物,促进M2巨噬细胞浸润和血管生成。gydF4y2Ba中国。Transl。地中海。gydF4y2Ba11gydF4y2Ba, e459(2021)。gydF4y2Ba
豪斯,i.g.等人。巨噬细胞来源的CXCL9和CXCL10是免疫检查点阻断后抗肿瘤免疫反应所必需的。gydF4y2Ba中国。癌症Res。gydF4y2Ba26gydF4y2Ba, 487-504(2020)。gydF4y2Ba
德永等人。CXCL9, CXCL10, CXCL11/CXCR3轴用于免疫激活——新型癌症治疗的靶点。gydF4y2Ba癌症治疗。牧师。gydF4y2Ba63gydF4y2Ba, 40-47(2018)。gydF4y2Ba
科埃略,m.a.等人。致癌RAS信号通路通过稳定PD-L1 mRNA促进肿瘤免疫抵抗。gydF4y2Ba免疫力gydF4y2Ba47gydF4y2Ba, 1083 - 1099。e1086 (2017).
确认gydF4y2Ba
我们非常感谢在这项研究中使用的标本捐赠者。国家自然科学基金(no . 32170923,82103011),北京市自然科学基金(no . 7214248),中国科学院医学科学创新基金(no . 2021-I2M-1-050),中国科协青年精英科学家资助计划(no . 2019QNRC001),北京市新星科技计划(no . Z191100001119049)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
C.M.L、S.F.Z和z.l.l设计了这项研究,进行了实验,分析了数据,并撰写了手稿。Z.Y.W, S.H.W, X.L.F和y.w进行了实验并分析了数据。J.H.和N.S.构思并设计了这项研究,并撰写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
道德声明gydF4y2Ba
研究方案经中国医学科学院肿瘤医院与研究所伦理委员会(中国北京)批准,批准号为20/242-2438。所有具有LUSC的FFPE样品均在知情同意的情况下获得。gydF4y2Ba
发表同意书gydF4y2Ba
手稿经所有作者同意,可以发表。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘聪,郑寿,卢哲。gydF4y2Baet al。gydF4y2BaS100A7通过增强肺鳞状细胞癌的免疫抑制肿瘤微环境来减弱免疫治疗。gydF4y2BaSig trans导管目标ThergydF4y2Ba7gydF4y2Ba, 368(2022)。https://doi.org/10.1038/s41392-022-01196-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41392-022-01196-4gydF4y2Ba