亲爱的编辑器gydF4y2Ba,gydF4y2Ba
越来越多的证据表明,USP28可能是癌症治疗的靶点gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。为了鉴定其抑制剂,我们筛选了10万个合成化合物库,发现3个先导化合物CT1001-1003显示出显著的抑制活性(补充图。gydF4y2Ba1gydF4y2Ba).对这些化合物的优化得到了一种更强的抑制剂CT1018(补充图)。gydF4y2Ba1 bgydF4y2Ba).CT1018与CT1002几乎相同,除了它在3个氨基上是半甲基化的。有趣的是,完全甲基化3-氨基(CT1038,补充图。gydF4y2Ba1 cgydF4y2Ba)几乎杀死了抑制活性,并用乙基取代甲基(CT1047,补充图。gydF4y2Ba1 cgydF4y2Ba)也导致了一种较弱的抑制剂。这些结果表明,3-氨基的半甲基化对抑制活性至关重要。然而,CT1018在基于细胞的检测中是不活跃的。继续优化得到了CT1073和CT1113(图。gydF4y2Ba1gydF4y2Ba).这两种化合物对USP28以及密切相关的USP25都是有效的(补充图。gydF4y2Ba1 fgydF4y2Ba).3氨基半甲基化的重要性对于CT1073来说也是如此,因为它的未甲基化版本CT1008是一种弱得多的抑制剂(补充图)。gydF4y2Ba1 dgydF4y2Ba).CT1113含有一个手性中心,一个对映体比另一个对映体更有效(补充图。gydF4y2Ba1 egydF4y2Ba).这些化合物的特异性可以通过CT1073或CT1113对其他去泛素酶和SENP1缺乏高达10 μM的活性来证明。gydF4y2Ba1克gydF4y2Ba).此外,我们用SPR仪测量了抑制剂与USP25/28之间的相互作用动力学。如补充图所示。gydF4y2Ba1 h,我gydF4y2Ba, CT1073和CT1113对USP25和USP28有相似的KDs。gydF4y2Ba
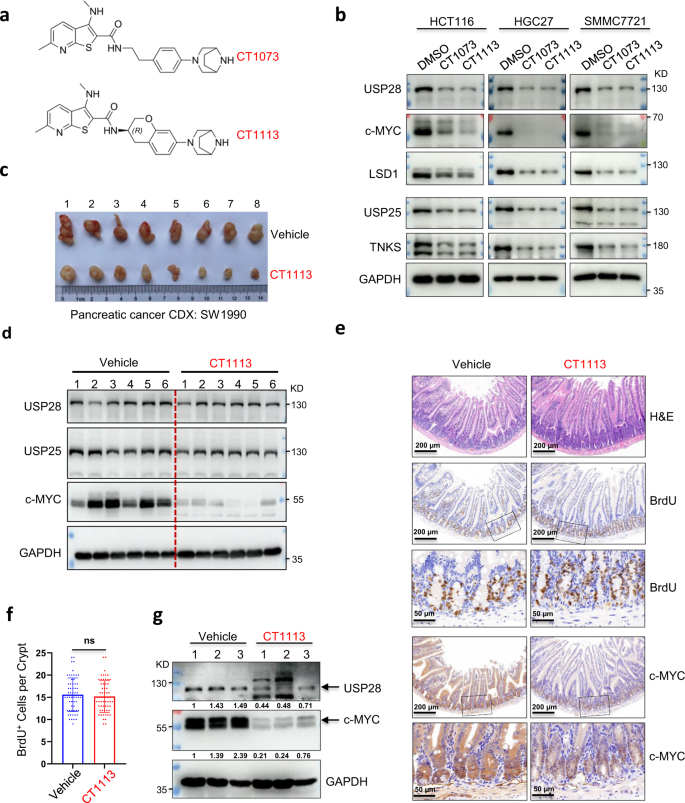
鉴定USP28抑制剂。gydF4y2Ba一个gydF4y2BaCT1073和CT1113的化学结构。gydF4y2BabgydF4y2BaWestern blotting分析500 nM CT1073或CT1113处理24小时的细胞中指示蛋白。gydF4y2BacgydF4y2BaCT1113在SW1990细胞接种Balb/c裸鼠胰腺癌CDX模型中的作用(gydF4y2BangydF4y2Ba= 8只/组)。展示了肿瘤的照片。gydF4y2BadgydF4y2Ba肿瘤样本的Western blotting分析gydF4y2BacgydF4y2Ba。gydF4y2BaegydF4y2Ba对照组和CT1113处理动物小肠苏木精和伊红(H&E)染色和免疫组化染色(gydF4y2BangydF4y2Ba每组3只)。gydF4y2BafgydF4y2Ba。BrdU掺入的定量。肠隐窝中的BrdU阳性细胞(gydF4y2BaegydF4y2Ba)被统计和绘制。学生的gydF4y2Bat -gydF4y2Ba试验:n.s.:无显著性差异。gydF4y2BaggydF4y2BaWestern blotting分析对照组和ct1113处理小鼠肠道中USP28和c-MYC水平。这些数字是USP28或c-MYC相对于GAPDH的带强度,与对照组的样本1相比进一步归一化gydF4y2Ba
接下来,我们对USP25/28抑制剂进行了各种基于细胞的检测。首先,我们研究了它们抑制细胞dub的有效性。c-MYC是USP28最显著的底物gydF4y2Ba5gydF4y2Ba。如补充图所示。gydF4y2Ba2gydF4y2BaCT1073和CT1113都能够在不同的癌细胞系中显著降低c-MYC水平,并且在治疗后1-2小时内发生降低。正如预期的那样,MYC-MAX靶基因的表达在处理过的细胞中被极大地抑制(补充图。gydF4y2Ba2 bgydF4y2Ba).随着处理时间的延长,我们可以看到USP28和USP25本身及其底物LSD1和Tankyrase (TNKS)的水平急剧下降(图2)。gydF4y2Ba1 bgydF4y2Ba).在环己亚胺追逐实验中,我们可以清楚地看到CT1073处理c-MYC的不稳定(补充图。gydF4y2Ba2 c, dgydF4y2Ba),进一步的泛素化试验表明CT1073或CT1113处理导致c-MYC蛋白的泛素化更多(补充图。gydF4y2Ba2 e, fgydF4y2Ba)和更多的Tankyrase泛素化(补充图。gydF4y2Ba2 ggydF4y2Ba).正如预期的那样,CT1073处理均缩短了LSD1和TNKS的半衰期。gydF4y2Ba2 h,我gydF4y2Ba),而由CT1073或CT113处理引起的c-MYC、LSD1和TNKS的不稳定可以被蛋白酶体抑制剂MG132逆转(补充图。gydF4y2Ba2 jgydF4y2Ba).此外,我们还检测了CT1113对p53和CHK2蛋白水平的影响。观察到这两种蛋白质没有明显的不稳定(补充图。gydF4y2Ba2 kgydF4y2Ba).总之,这些数据表明我们开发的USP25/28抑制剂对细胞有效。gydF4y2Ba
接下来我们确定了ECgydF4y2Ba50gydF4y2BaCT1073和CT1113对多种肿瘤细胞系增殖或细胞活力的抑制作用。如补充图所示。gydF4y2Ba3gydF4y2Ba这两种化合物在抑制这些细胞增殖方面都非常有效。ct1073处理的癌细胞的终末表型为凋亡(补充图;gydF4y2Ba3 bgydF4y2Ba)或细胞周期阻滞(补充图。gydF4y2Ba3 cgydF4y2Ba).有趣的是,细胞周期阻滞发生在G2期甚至S期(补充图。gydF4y2Ba3 cgydF4y2Ba).这些结果表明,大多数(如果不是全部的话)癌细胞需要gydF4y2BaUSP25gydF4y2Ba和/或gydF4y2BaUSP28gydF4y2Ba增殖和/或存活。为了从基因上验证这一点,我们减少了gydF4y2BaUSP25gydF4y2Ba,gydF4y2BaUSP28gydF4y2Ba,或两者都在选定的癌细胞系中。在T47D中,两者的消耗gydF4y2BaUSP25gydF4y2Ba或gydF4y2BaUSP28gydF4y2Ba在一定程度上抑制了增殖,但两者的消耗导致了增殖的阻断和最终的细胞死亡(补充图。gydF4y2Ba3 dgydF4y2Ba).在A549中,消耗gydF4y2BaUSP25gydF4y2Ba或gydF4y2BaUSP28gydF4y2Ba而双重耗竭则导致细胞死亡(补充图。gydF4y2Ba3 dgydF4y2Ba).此外,我们表达过度了gydF4y2BaUSP25gydF4y2Ba而且gydF4y2BaUSP28gydF4y2Ba,在HCT116细胞中单独或一起。的过度表达gydF4y2BaUSP25gydF4y2Ba或gydF4y2BaUSP28gydF4y2Ba单独表达CT1113并不会显著改变细胞对CT1113的敏感性,但两者同时过表达会降低细胞对CT1113的敏感性(补充图。gydF4y2Ba3 egydF4y2Ba),增加ECgydF4y2Ba50gydF4y2Ba从表达gfp的对照组细胞的65 nM到表达gfp的对照组细胞的92 nMgydF4y2BaUSP25/28gydF4y2Ba过度的细胞。这些数据表明,CT1113的抗增殖作用在很大程度上是一种靶向效应,尽管潜在的脱靶效应的贡献不能完全排除。gydF4y2Ba
接下来,我们想要证明它们在体内的有效性。CT1073不能口服,而且在小鼠体内代谢不稳定,很可能是因为它含有一种容易水解的酰胺键。CT1113(无花果。gydF4y2Ba1gydF4y2Ba)对酰胺键进行修饰以克服这一问题,并用于体内抗肿瘤研究。我们首先对由SW1990形成的异种移植瘤进行了测试,SW1990是一种人类胰腺癌细胞系。如图所示。gydF4y2Ba1 cgydF4y2Ba和补充图。gydF4y2Ba4gydF4y2Ba, CT1113治疗可显著抑制肿瘤生长。该化合物还导致MYC水平下降(图。gydF4y2Ba1 dgydF4y2Ba).Ki67染色显示CT1113处理后肿瘤的增殖明显低于对照(补充图)。gydF4y2Ba4 bgydF4y2Ba).处理过的动物看起来正常,除了它们似乎没有像对照组动物那样消耗那么多的食物,这可能是它们体重下降的原因(补充图)。gydF4y2Ba4摄氏度gydF4y2Ba).接下来,我们使用结肠癌细胞系HCT116在结肠癌CDX模型上测试CT1113。观察到类似的疗效(补充图。gydF4y2Ba4 dgydF4y2Ba).总之,这些体内实验结果表明,USP25/28抑制剂CT1113是一种强抗肿瘤药物。gydF4y2Ba
由于c-MYC对正常细胞的增殖也很重要,我们想检查CT1113对小鼠增殖组织的影响,特别是被证明依赖的肠道gydF4y2BaMYCgydF4y2Ba对再生gydF4y2Ba6gydF4y2Ba。正常C57BL/6小鼠给予CT1113 21天,恢复21天(补充图。gydF4y2Ba5gydF4y2Ba).在给药方案结束时,动物没有表现出任何明显的毒性迹象,尽管它们的体重在给药结束时下降了约10%(补充图。gydF4y2Ba5 bgydF4y2Ba),正如我们在荷瘤裸鼠中看到的那样(补充图。gydF4y2Ba4摄氏度gydF4y2Ba).然而,在停止CT1113给药后,体重迅速回升(补充图。gydF4y2Ba5 bgydF4y2Ba).主要器官组织学检查也未见明显变化。在肠道中,经ct1113处理的小鼠与对照组小鼠的绒毛难以区分(图11)。gydF4y2Ba1 egydF4y2Ba).令人惊讶的是,CT1113处理完全没有中断隐窝中的增殖(通过BrdU掺入测量)(图11)。gydF4y2Ba1 e, fgydF4y2Ba).c-MYC免疫组化染色显示对照中c-MYC表达非常强,但在ct1113处理的肠道中c-MYC表达大大降低(图。gydF4y2Ba1 egydF4y2Ba),与western blotting分析结果一致(图;gydF4y2Ba1克gydF4y2Ba).然而,c-MYC的表达在隐窝中持续存在(图。gydF4y2Ba1 egydF4y2Ba),表明在USP28抑制的情况下,干细胞仍能维持c-MYC的表达。这一结果解释了CT1113处理未破坏隐窝的增殖。此外,在睾丸中,CT1113管理没有引起组织学组织的任何畸变,也没有引起精原细胞的增殖(补充图。gydF4y2Ba5度gydF4y2Ba).gydF4y2Ba
总之,我们发现了一类有效的USP25/28抑制剂,显示出广泛的抗肿瘤活性。gydF4y2Ba
数据可用性gydF4y2Ba
所有数据均可根据合理要求从通讯作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
王,J.等。去泛素酶USP28稳定RecQ家族解旋酶的表达,维持三阴性乳腺癌细胞的活力。gydF4y2Ba生物。化学。gydF4y2Ba298gydF4y2Ba, 101443(2022)。gydF4y2Ba
Diefenbacher, m.e.等人。去泛素酶USP28控制肠道稳态并促进结直肠癌。gydF4y2Baj .中国。投资。gydF4y2Ba124gydF4y2Ba, 3407-3418(2014)。gydF4y2Ba
Prieto-Garcia, C.等人。鳞状癌细胞需要通过USP28维持Np63蛋白的稳定性。gydF4y2BaEMBO Mol. Med。gydF4y2Ba12gydF4y2Ba, e11101(2020)。gydF4y2Ba
Sun, X,等。USP28去泛素化TCF7L2调控Wnt信号通路在肝癌中的作用gydF4y2Ba癌症科学gydF4y2Ba。(2022)。gydF4y2Ba
波波夫,N.等。泛素特异性蛋白酶USP28是MYC稳定所必需的。gydF4y2Ba细胞生物学。gydF4y2Ba9gydF4y2Ba, 765-774(2007)。gydF4y2Ba
苏切克,L.等。模拟Myc抑制作为癌症疗法。gydF4y2Ba自然gydF4y2Ba455gydF4y2Ba, 679-683(2008)。gydF4y2Ba
确认gydF4y2Ba
感谢清华大学制药技术中心对合成化合物库筛选的帮助。国家自然科学基金项目(81773032)、国家重点研发计划项目(2018YFA0507500)资助。部分工作得到了Chaser Therapeutics公司研发项目的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
j.p和K.J:概念、方法论和调查。X.S.和L.W.:方法论与调查。J.W.和X.X:调查和验证。X.T:资源。t.l.:概念和资源。ct:方法论与资源。P.Z:概念化、方法论、监督和写作-初稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
所有作者都阅读并批准了手稿的最终版本。作者宣称他们之间没有利益冲突。gydF4y2Ba
道德gydF4y2Ba
所有动物实验均按照浙江大学附属第一医院动物关爱使用委员会批准的指导原则进行。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
彭俊,姜凯,孙鑫,孙晓明。gydF4y2Baet al。gydF4y2Ba鉴定一类具有广谱抗癌活性的强效USP25/28抑制剂。gydF4y2BaSig trans导管目标ThergydF4y2Ba7gydF4y2Ba, 393(2022)。https://doi.org/10.1038/s41392-022-01209-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41392-022-01209-2gydF4y2Ba