摘要gydF4y2Ba
马蹄蝠携带许多与sars相关的冠状病毒,但没有明显的疾病症状。蝙蝠肠道类器官是一种独特的蝙蝠肠道上皮模型,可以直接与人类肠道类器官进行比较。我们试图通过比较蝙蝠和人类类器官的先天免疫来揭示蝙蝠对冠状病毒耐受的细胞机制。我们对培养基进行了优化,使蝙蝠肠道类器官连续传代一年以上。ifn和ifn刺激基因在蝙蝠类器官中的基础表达水平高于人类同类器官。值得注意的是,在Poly(I:C)刺激下,蝙蝠类器官比人类类器官表现出更快速、更强大和更持久的抗病毒防御。TLR3和RLR可能是介导蝙蝠和人类肠道类器官抗病毒反应的保守通路。蝙蝠类器官对一种蝙蝠冠状病毒CoV-HKU4的易感性,但对一种人类来源的肠道病毒EV-71的耐药性表明,蝙蝠类器官充分再现了蝙蝠对某些病毒的真实易感性。重要的是,在SARS-CoV-2或CoV-HKU4感染后的早期阶段,蝙蝠类器官中TLR3/RLR的抑制显著促进了病毒的生长。总的来说,抗病毒基因较高的基础表达,特别是对先天免疫反应的更快和更强的诱导,使蝙蝠细胞能够在感染的早期阶段抑制病毒的传播。gydF4y2Ba
介绍gydF4y2Ba
蝙蝠是与人类疾病相关的多种病毒的天然宿主,包括冠状病毒、丝状病毒、溶血病毒和亨尼帕病毒。在过去的二十年里,发生了几次冠状病毒疾病的爆发,包括SARS、中东呼吸综合征和目前的COVID-19大流行,gydF4y2Ba1gydF4y2Ba所有这些都与蝙蝠传播的冠状病毒的外溢有关。在蝙蝠身上发现与sars相关的冠状病毒,点燃了人们对蝙蝠体内病毒的热情搜寻。gydF4y2Ba2 gydF4y2Ba因此,蝙蝠已被确定为各种冠状病毒最丰富的来源,包括蝙蝠冠状病毒,其中一些与感染人类或其他动物的病毒密切相关。gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba然而,除了溶血病毒外,蝙蝠似乎还携带病毒或以无症状或无症状的方式与病毒共存。gydF4y2Ba6gydF4y2Ba蝙蝠可以无症状地携带多种冠状病毒,这一事实引发了一个有趣的问题,即为什么冠状病毒会在人类和蝙蝠中导致不同的表现。大多数人类RNA病毒感染的一个共同特征是免疫驱动的发病机制;病毒感染引起的异常免疫反应导致组织损伤和疾病症状。gydF4y2Ba7gydF4y2Ba对于蝙蝠对病毒的耐受性,一般提出了两种非排他性的观点:蝙蝠可能对病毒传播建立了有效的耐受性,或者蝙蝠通过成功控制病毒复制来保持适应性。gydF4y2Ba
对蝙蝠免疫的先验知识通常通过三种主要方法获得,即比较基因组学和转录组学分析、蝙蝠细胞系的体外研究和蝙蝠的实验性感染。虽然蝙蝠的先天免疫系统和适应性免疫系统的基本组成部分是保守的,gydF4y2Ba8gydF4y2Ba比较基因组学研究揭示了蝙蝠之间的显著差异。在一些蝙蝠物种中,用于识别DNA病毒和受损自身DNA的炎性体途径中的PYHIN家族基因、杀伤细胞免疫球蛋白样受体(KIR)和杀伤细胞凝集素样受体(KLR)丢失或显著减少。gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba此外,还记录了IFN基因的收缩或扩增、APOBEC3基因的扩增、特定基因的阳性选择以及必需蛋白结构域的差异。gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba对蝙蝠基因组的广泛研究为进一步研究提供了基因组证据和假设。尽管如此,基因表达谱,特别是病毒感染时的基因表达动力学,可能决定疾病的表现和结果。事实上,在蝙蝠细胞系和蝙蝠免疫细胞中分析了蝙蝠对病毒的免疫防御和细胞与病毒的相互作用。gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba这些研究集中在对蝙蝠细胞炎症反应减弱的普遍认识上。gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba另一方面,蝙蝠细胞系组成性地表达ifn和ifn刺激基因(ISGs),gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba其基础转录水平高于人和小鼠细胞系。gydF4y2Ba
蝙蝠衍生的细胞系为蝙蝠细胞生物学对病毒感染的反应提供了见解。然而,与人类细胞系类似,这些蝙蝠细胞系可能不是研究病毒与宿主相互作用的良好模型,因为体外培养的细胞系很难模拟体内的原生细胞。第三种方法是在蝙蝠中进行实验性感染,这涉及到重大挑战,特别是在研究那些对人类致命的病毒方面。为了研究目的,已经建立了几个圈养的蝙蝠群落,gydF4y2Ba17gydF4y2Ba然而,大多数实验室并不容易获得。因此,迫切需要一种与生物学相关的蝙蝠细胞体外模型。动物冠状病毒通常表现为肠道感染。gydF4y2Ba18gydF4y2Ba与sars相关的冠状病毒仅在马蹄蝠的肛门拭子中检测到,gydF4y2Ba2 gydF4y2Ba说明这些病毒具有肠性肠上皮细胞是肠道微生物的入口和主要感染部位。然而,在类器官技术出现之前,几乎没有一个可靠的方案可以在体外培养和扩增原代上皮细胞。人类肠道类器官是第一个由成体干细胞衍生的类器官,它忠实地模拟了人类肠道上皮的形态和功能属性。gydF4y2Ba19gydF4y2Ba这些长期可扩展且具有生理活性的人类肠道类器官已成为研究肠道微生物感染的热门工具。gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba与动物的冠状病毒感染类似,人类冠状病毒感染也涉及胃肠道,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba虽然呼吸道症状可能更明显。我们和其他人利用人类肠道类器官研究MERS-CoV和SARS-CoV-2肠道感染。gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba此外,我们从中国马蹄蝠中建立了第一个蝙蝠肠道类器官,并在这些蝙蝠类器官中证明了SARS-CoV-2的生产性感染。gydF4y2Ba24gydF4y2Ba
冠状病毒在人和动物中表现出肠性;肠上皮细胞处于病毒侵袭的第一线。这些上皮细胞对特定病毒的敏感性决定了病毒对宿主和组织的趋向性。同时,上皮细胞在病毒感染时引发先天免疫反应,随后引发一系列宿主反应来抵抗病毒入侵并维持体内平衡。gydF4y2Ba22gydF4y2Ba因此,病毒与宿主肠上皮细胞的相互作用在很大程度上决定了病毒在宿主体内的趋向性、病毒的发病机制和疾病表现。然而,缺乏强大的体外模型严重阻碍了对肠上皮细胞中病毒-宿主相互作用和病毒诱导发病机制的研究。在此,我们利用实验室建立的独特的蝙蝠肠道类器官培养体系,对蝙蝠和人类肠道类器官进行了比较研究,旨在揭示类器官中的细胞反应,揭示蝙蝠无症状寄主病毒的生物学基础。gydF4y2Ba
结果gydF4y2Ba
蝙蝠肠道类器官的优化与表征gydF4y2Ba
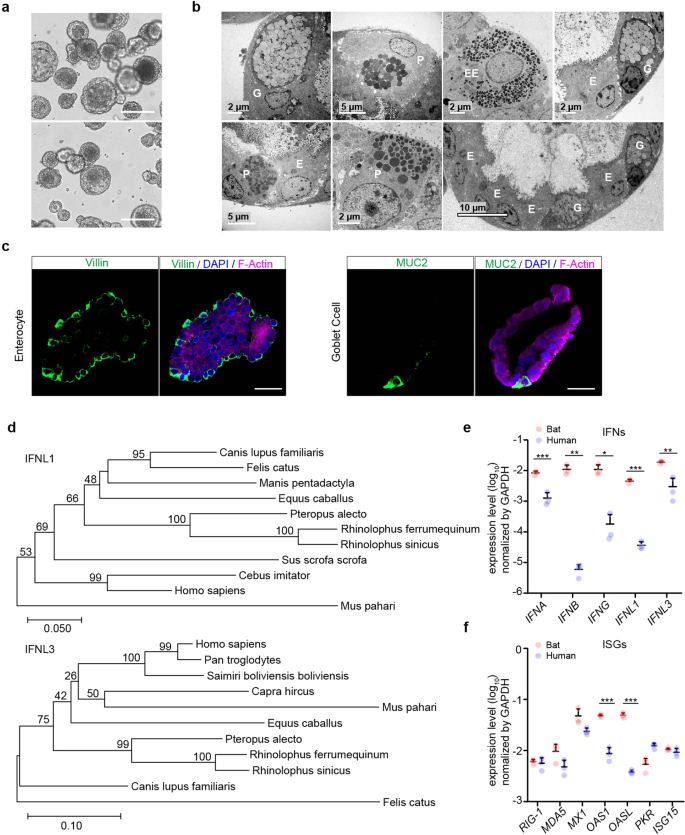
肠道类器官来源于马蹄铁蝙蝠,建立率如我们之前报道的那样完美gydF4y2Ba24gydF4y2Ba在添加Wnt3a条件培养基的培养基中连续传代3个月左右。我们通过优化培养基的组成,延长了蝙蝠肠道类器官的膨胀性,获得了更多稳定的蝙蝠类器官用于实验,减少了活蝙蝠的使用。据报道,新一代替代Wnt激动剂比Wnt3a条件培养基更有效地支持人类肠道类器官的生长。gydF4y2Ba28gydF4y2Ba因此,我们改用改良的培养基(补充表)gydF4y2Ba1gydF4y2Ba),其中Wnt替代物取代了原始的Wnt3a条件培养基。添加Wnt替代物可显著延长蝙蝠肠道类器官的扩张,持续时间超过一年。我们常规地维持了3个蝙蝠类器官系,这些类器官系来源于3只马蹄蝠(gydF4y2BaRhinolophus sinicusgydF4y2Ba),每隔7天传代一次,进行日常实验(图2)。gydF4y2Ba1gydF4y2Ba)。透射电镜显示,蝙蝠肠道类器官主要由肠细胞、杯状细胞、潘氏细胞和肠内分泌细胞组成(图2)。gydF4y2Ba1 bgydF4y2Ba);杯状细胞,尤其是肠细胞,是蝙蝠肠道类器官的优势细胞群(图右下面板)。gydF4y2Ba1 bgydF4y2Ba),这与先前在人类肠道类器官中的许多研究一致。gydF4y2Ba19gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba由于缺乏针对蝙蝠蛋白的特异性抗体,我们使用了针对人类类似物的细胞型特异性抗体。利用人细胞型特异性抗体进行免疫染色,证实了蝙蝠肠道类器官中存在MUC2 +杯状细胞和丰富的绒毛蛋白+肠细胞(图2)。gydF4y2Ba1 cgydF4y2Ba)。因此,优化后的蝙蝠肠道类器官具有长期可膨胀性,并忠实地模拟了蝙蝠肠道上皮。蝙蝠和人类肠道类器官的可比细胞组成提供了一种独特的生物活性模型系统,使蝙蝠和人类肠道上皮细胞在体外的类似比较成为可能。gydF4y2Ba
优化后的蝙蝠肠道类器官的鉴定及抗病毒基因基础表达的检测。gydF4y2Ba一个gydF4y2Ba优化后的蝙蝠肠道类器官传代后第7天的显微照片(放大×100)。标尺,100 μm。gydF4y2BabgydF4y2Ba透射电镜显示了蝙蝠肠道类器官的吸收性肠细胞(E)、Paneath细胞(P)、杯状细胞(G)和肠内分泌细胞(EE)的超微结构形态。gydF4y2BacgydF4y2Ba固定蝙蝠肠道类器官,免疫染色标记绒毛蛋白+(绿色)肠细胞和MUC2 +(绿色)杯状细胞。细胞核和肌动蛋白丝分别用DAPI(蓝色)和Phalloidin-647(紫色)反染。比例尺,20µm。gydF4y2BadgydF4y2Ba基于马蹄铁蝙蝠(gydF4y2BaRhinolophus sinicusgydF4y2Ba)gydF4y2BaIFNL1gydF4y2Ba和gydF4y2BaIFNL3gydF4y2Ba其他翼目物种和哺乳动物的ORF cdna。引导值(%)显示在每个分支上,分支长度的比例显示在树的底部。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Bagapdh -标准化IFN基因表达水平(gydF4y2BaegydF4y2Ba)和isg (gydF4y2BafgydF4y2Ba)在蝙蝠和人类肠道类器官中。数据代表来自蝙蝠和人类供体的类器官的代表性实验的平均值和标准差,gydF4y2BangydF4y2Ba= 3。双尾未配对学生的gydF4y2BatgydF4y2Ba测试gydF4y2Ba
检测蝙蝠肠道类器官中抗病毒基因的基础表达gydF4y2Ba
III型干扰素(IFN)是人类和小鼠肠道粘膜免疫的主要参与者。gydF4y2Ba29gydF4y2Ba病毒感染后,IFN lambda-1 (IFNL1)和IFNL3在人肠道类器官中被高度诱导。gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba我们首先使用RACE PCR确定了马蹄蝠III型ifn的序列。中国马蹄蝠的基因组长序列(gydF4y2BaRhinolophus sinicus)gydF4y2Ba可在GenBank Bioproject数据库中公开获取(登录号:PRJNA294852)。在中国马蹄蝠的基因组中,对IFNL1和IFNL3等类似的人类基因序列进行了blast搜索。用匹配的序列设计RACE PCR引物(补充表)gydF4y2Ba2 gydF4y2Ba)来检测部分序列。然后用提取的蝙蝠肠道类器官的RNA进行5′和3′RACE PCR检测。我们在近缘种蝙蝠中获得了两个与干扰素-1样和干扰素-3样基因高度同源的序列gydF4y2BaRhinolophus ferrumenguinumgydF4y2Ba,分别命名为IFNL1和IFNL3。与其他哺乳动物的ifnl比较表明,IFNL1和IFNL3是gydF4y2BaRhinolophus sinicusgydF4y2Ba和的相同吗gydF4y2BaRhinolophus ferrumequinumgydF4y2Ba99%是同源的gydF4y2Ba狐阿勒克图gydF4y2Ba(无花果。gydF4y2Ba1 dgydF4y2Ba)。gydF4y2Ba
我们还采用相同的方法设计了qPCR引物,并检测了蝙蝠肠道类器官的先天免疫基因。我们检查了ifn和几种已报道的isg的基础水平gydF4y2Ba15gydF4y2Ba并将其与用相同方法培养的人类类器官进行比较(图2)。gydF4y2Ba1 egydF4y2Ba)。我们发现蝙蝠类器官表达所有三种类型的ifn,比人类类器官高1-3个对数单位。几种isg,如OAS1和OASL,在蝙蝠类器官中的含量约为人类同类的10倍,而其他isg,如MX1和MDA5,在蝙蝠细胞中是ifn诱导的。gydF4y2Ba16gydF4y2Ba在蝙蝠类器官中表达更高(图2)。gydF4y2Ba1 fgydF4y2Ba)。总体而言,ifn和一些isg的基础表达水平在蝙蝠肠道类器官中显著高于人类同类器官。gydF4y2Ba
与人类类器官相比,蝙蝠类器官对Poly(I:C)治疗产生更强的抗病毒反应gydF4y2Ba
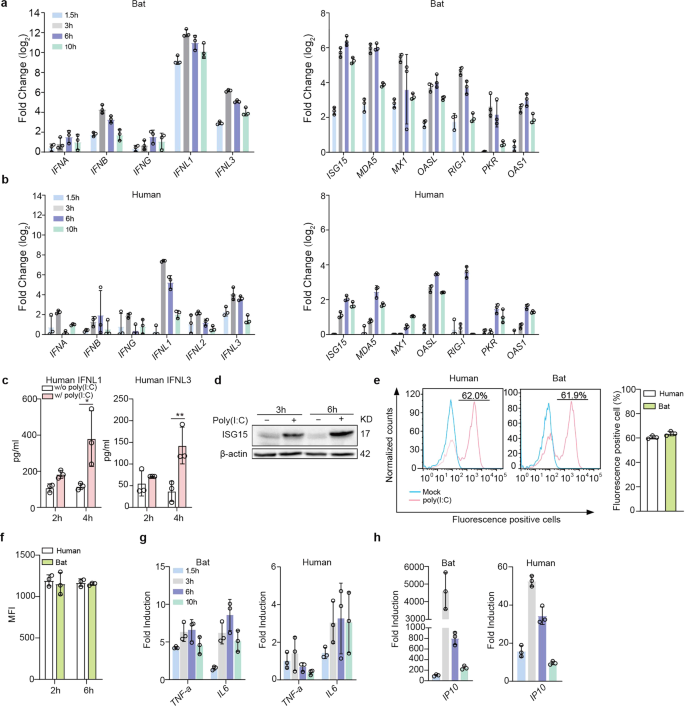
然后,我们分析了在蝙蝠和人类肠道类器官中抗病毒反应的诱导。Poly(I:C)是一种合成病毒模拟物,通过与TLR3和MDA5结合,诱导人肠道细胞和肠道类器官的先天免疫。gydF4y2Ba30.gydF4y2Ba人类肠细胞上的模式识别受体。gydF4y2Ba31gydF4y2Ba首先,我们测试了Poly(I:C)递送到蝙蝠肠道类器官的条件,以诱导细胞反应。我们发现,在机械剪切后,用10µg/ml Poly(I:C)孵育蝙蝠类器官,持续有效地诱导抗病毒基因(补充图2)。gydF4y2Ba1gydF4y2Ba)。然后,我们将剪切后的10µg/ml Poly(I:C)与蝙蝠和人类肠道类器官平行孵育,并检测蝙蝠和人类肠道类器官中抗病毒基因的表达水平相对于模拟处理的类器官。Poly(I:C)刺激后,III型IFN,特别是IFNL1在蝙蝠类器官中被高度诱导,而I型和II型IFN,包括IFN-α (IFNA), -β (IFNB)和-γ (IFNG),被适度诱导,其强度远低于IFNL1和IFNL3(图3)。gydF4y2Ba2gydF4y2Ba),这与之前关于III型干扰素在人和小鼠粘膜免疫中起主要作用的发现非常一致。gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba与ifn相比,包括ISG15、MX1和MDA5在内的几个isg高度上调,但略有延迟(图2)。gydF4y2Ba2gydF4y2Ba)。人类肠道类器官显示出类似的免疫激活概况。然而,在蝙蝠类器官中,III型ifn和isg的诱导比在人类同类器官中更快、更有效,持续时间也更长(图2)。gydF4y2Ba2 bgydF4y2Ba)。在比较不同供体的蝙蝠和人类肠道类器官的多项实验中,我们观察到蝙蝠类器官更活跃、更持久地诱导抗病毒防御。gydF4y2Ba2 gydF4y2Ba)。通过ELISA验证Poly(I:C)处理的人肠道类器官分泌人IFNL1和IFNL3(图3)。gydF4y2Ba2摄氏度gydF4y2Ba), Western blotting显示Poly(I:C)诱导的人ISG15上调(图2)。gydF4y2Ba二维gydF4y2Ba及补充图gydF4y2Ba6gydF4y2Ba)。蝙蝠类器官的先天免疫激活程度高于人类类器官是固有的,因为通过流式细胞术分析发现,蝙蝠和人类类器官对荧光素标记聚(I:C)的摄取相当。荧光素标记Poly(I:C)孵育后,蝙蝠和人肠道类器官中荧光素阳性细胞的比例和荧光强度相当(图2)。gydF4y2Ba2 gydF4y2Bae,gydF4y2BafgydF4y2Ba及补充图gydF4y2Ba3 gydF4y2Ba和gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
蝙蝠类器官对Poly(I:C)治疗产生了更强的抗病毒反应。将蝙蝠和人类肠道类器官进行机械剪切,并用10 μg/ml Poly(I:C)或DMSO模拟处理。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba诱导ifn(左)和isg(右)在蝙蝠肠道类器官(gydF4y2Ba一个gydF4y2Ba)和人类肠道类器官(gydF4y2BabgydF4y2Ba)在Poly(I:C)处理后的指定小时内。结果显示,与模拟处理的类器官相比,处理后的类器官中gapdh标准化表达水平变化了log2倍。数据代表来自蝙蝠和人类供体的类器官的代表性实验的平均值和标准差,gydF4y2BangydF4y2Ba= 3。gydF4y2BacgydF4y2Ba将经处理或模拟处理的人肠道类器官在指定时间内的培养基应用ELISA检测IFNL1和IFNL3的浓度。数据表示在一个人类类器官系列中具有代表性的实验的平均值和标准差,n = 3。双尾未配对学生的gydF4y2BatgydF4y2Ba测试。gydF4y2BadgydF4y2Ba在处理后指定时间收集Poly(I:C)处理或模拟处理的人肠道类器官,并进行Western blot检测人ISG15。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba将蝙蝠和人肠道类器官剪短,用10 μg/ml Poly(I:C)荧光素三次孵育,孵育2 h和6 h。然后将类器官分离并应用流式细胞术检测处理后2 h的百分比(gydF4y2BaegydF4y2Ba)和平均荧光强度(MFI,gydF4y2BafgydF4y2Ba)处理后2和6小时荧光素阳性细胞。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba诱导TNF-a和il - 6 (gydF4y2BaggydF4y2Ba)及IP10 (gydF4y2BahgydF4y2Ba)在治疗后的指定小时内在蝙蝠和人类肠道类器官中。结果显示,Poly(I:C)处理的类器官中gapdh归一化表达水平相对于模拟处理的类器官发生了成倍的变化。数据代表来自蝙蝠和人类供体的类器官的代表性实验的平均值和标准差,gydF4y2BangydF4y2Ba= 3gydF4y2Ba
Poly(I:C)是TLR3和MDA5的双重激动剂。gydF4y2Ba30.gydF4y2Ba除了IFN的诱导外,TLR3或MDA5的激活也通过NF-κB信号传导导致促炎细胞因子的产生。我们检测了促炎细胞因子,发现IL6和TNF-α在蝙蝠肠道类器官中被诱导(左图,图2)。gydF4y2Ba2 ggydF4y2Ba)。值得注意的是,Poly(I:C)处理后,IP10迅速而显著地诱导(左图,图2)。gydF4y2Ba2 hgydF4y2Ba)。人类肠道类器官表现出类似的诱导动力学,但其量级远低于蝙蝠类器官(右图,图2)。gydF4y2Ba2 gydF4y2Ba克,gydF4y2BahgydF4y2Ba)。gydF4y2Ba
TLR3和RLR信号通路介导蝙蝠和人类类器官的抗病毒反应gydF4y2Ba
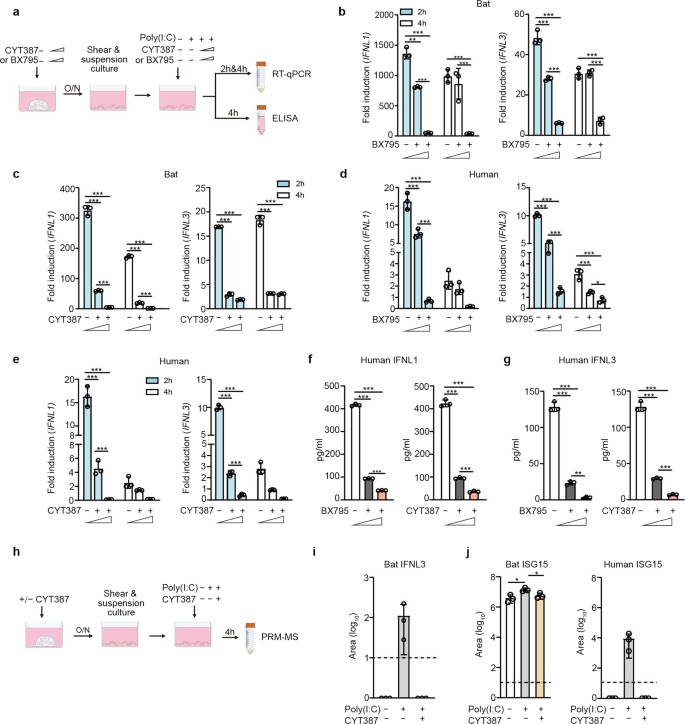
我们进一步阐明了蝙蝠类器官中介导免疫激活的信号通路。如前所述,Poly(I:C)是TLR3和MDA5的合成激动剂。BX795是TBK1/IKKε的催化抑制剂,TBK1/IKKε是TLR3和RLR途径中的激酶。CYT387是一种有效的TBK1/IKKε抑制剂,也能抑制JAK1和JAK2。gydF4y2Ba32gydF4y2BaJAK/STAT通路中的Janus激酶介导IFN信号传导。我们首先确定了两种抑制剂的适当浓度,以排除潜在的细胞毒性干扰,使蝙蝠和人类类器官的读数混淆(补充图2)。gydF4y2Ba4 gydF4y2Ba)。用BX795或CYT387或DMSO预处理蝙蝠和人类肠道类器官,以最小的细胞毒性浓度过夜,然后进行Poly(I:C)刺激或模拟刺激,并进一步用初始浓度的BX795或CYT387或DMSO孵育(图2)。gydF4y2Ba3gydF4y2Ba)。与模拟刺激相比,我们在Poly(I:C)刺激后2和4小时检测了类器官中IFNL1和IFNL3的诱导情况。BX795抑制Poly(I:C)诱导的蝙蝠IFNL1和IFNL3呈剂量依赖性。gydF4y2Ba3 bgydF4y2Ba)。CYT387似乎对Poly(I:C)触发的蝙蝠类器官中IFNL1和IFNL3的诱导具有更强的抑制作用。gydF4y2Ba3 cgydF4y2Ba)。同样,BX795(图1)gydF4y2Ba3 dgydF4y2Ba)和CYT387(图3)。gydF4y2Ba3 egydF4y2Ba)处理消除了Poly(I:C)刺激的人类肠道类器官中IFNL1和IFNL3的上调。同样,Poly(I:C)刺激人类类器官中IFNL1和IFNL3产生的强度低于蝙蝠肠道类器官。此外,Poly(I:C)触发IFNL1(图2)。gydF4y2Ba3 fgydF4y2Ba)和IFNL3(图3)。gydF4y2Ba3 ggydF4y2Ba随着BX795和CYT387浓度的增加,人类器官的分泌呈剂量依赖性下降。gydF4y2Ba
TLR3和RLR信号通路介导蝙蝠和人类类器官的抗病毒反应。gydF4y2Ba一个gydF4y2Ba示意图概述了面板的实验过程gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba。用BX795(0、0.1和1 μM)或CYT387(0、0.1和1 μg/ml)预处理蝙蝠和人肠道类器官过夜。机械剪切后,加入或不加入10 μg/ml Poly(I:C)、初始浓度BX795或CYT387孵育类器官。在Poly(I:C)处理后的指定小时,收获类器官并进行RT-qPCR检测蝙蝠和人类IFNL1和IFNL3的mRNA表达水平;采用人类器官无细胞培养基进行ELISA检测IFNL1和IFNL3。数据代表来自蝙蝠和人类供体的类器官的代表性实验的平均值和标准差,gydF4y2BangydF4y2Ba= 3。采用Tukey多重比较检验的普通单因素方差分析。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaBX795对蝙蝠肠道类器官中IFNL1(左)和IFNL3(右)的诱导作用(gydF4y2BabgydF4y2Ba)及CYT387 (gydF4y2BacgydF4y2Ba)。结果显示,Poly(I:C)处理的类器官中gapdh归一化表达水平相对于模拟处理的类器官发生了成倍的变化。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2BaBX795对人肠道类器官IFNL1和IFNL3的诱导作用(gydF4y2BadgydF4y2Ba)及CYT387 (gydF4y2BaegydF4y2Ba)。IFNL1 (gydF4y2BafgydF4y2Ba)及IFNL3 (gydF4y2BaggydF4y2Ba)刺激后4小时人体类器官的分泌。gydF4y2BahgydF4y2Ba示意图描述了面板的实验过程gydF4y2Ba我gydF4y2Ba和gydF4y2BajgydF4y2Ba。用1 μg/ml CYT387或DMSO预处理蝙蝠和人肠道类器官过夜。机械剪切后,类器官与1 μg/ml CYT387或DMSO(含或不含10 μg/ml Poly(I:C))孵育4 h。然后收集无细胞培养基,用PRM-MS分析蝙蝠IFNL3 (gydF4y2Ba我gydF4y2Ba)及蝙蝠和人类的ISG15 (gydF4y2BajgydF4y2Ba)。虚线表示检测限。数据代表来自蝙蝠和人类供体的类器官的代表性实验的平均值和标准差,gydF4y2BangydF4y2Ba= 3。双尾未配对学生的gydF4y2BatgydF4y2Ba测试gydF4y2Ba
我们开发了一种平行反应监测质谱(PRM-MS)方法,用于在存在或不存在CYT387和Poly(I:C)处理的蝙蝠和人类类器官培养基中靶向定量蝙蝠IFNL3蛋白和ISG15蛋白。gydF4y2Ba3 hgydF4y2Ba),原因是缺乏检测蝙蝠蛋白质的特异性抗体。结果证实Poly(I:C)触发了蝙蝠类器官中IFNL3的分泌,而CYT387处理使其无效(图3)。gydF4y2Ba3我gydF4y2Ba)。然而,我们未能通过PRM-MS检测到蝙蝠IFNL1,尽管qPCR检测显示比IFNL3诱导更高。我们推断,鉴定失败可能与技术问题有关,而不是蝙蝠类器官中缺乏IFNL1蛋白。我们还通过PRM-MS检测了蝙蝠和人类类器官中ISG15的分泌。Poly(I:C)处理的蝙蝠类器官分泌的蝙蝠ISG15显著高于模拟处理的类器官,显著低于Poly(I:C) + CYT387双重处理的类器官(图1)。gydF4y2Ba3 jgydF4y2Ba(左面板)。人类器官分泌的ISG15仅在Poly(I:C)处理的类器官中检测到,在模拟处理的类器官和Poly(I:C) + CYT387双重处理的类器官中均低于检测限(图2)。gydF4y2Ba3 jgydF4y2Ba(右面板)。因此,CYT387处理大大抑制了Poly(I:C)刺激的蝙蝠和人类ISG15的产生(图1)。gydF4y2Ba3 jgydF4y2Ba)。在这里,我们必须选择特异性和不同的肽来量化人和蝙蝠的ISG15,这可能导致目标肽的检测限和动态范围不同。因此,直接比较蝙蝠和人类ISG15的丰度及其诱导程度是有偏差的。总之,BX795和CYT387使Poly(I:C)触发的ifnl和ISG在蝙蝠和人肠道类器官中的诱导作用无效,提示TLR3和RLR信号通路可能是介导蝙蝠和人肠道上皮细胞抗病毒反应的保守通路。gydF4y2Ba
蝙蝠肠道类器官概括了蝙蝠对病毒的易感性gydF4y2Ba
鉴于蝙蝠肠道类器官模拟了蝙蝠肠道上皮,我们推测蝙蝠肠道类器官可能能够再现蝙蝠肠道细胞对冠状病毒的真实易感性。尽管发现了许多蝙蝠冠状病毒,但只有几种病毒已成功地从分子工程病毒中分离和培养或繁殖。gydF4y2Ba5gydF4y2Ba,gydF4y2Ba33gydF4y2Ba一种C β冠状病毒gydF4y2BaTylonycteris pachypusgydF4y2Ba冠状病毒HKU4 (CoV-HKU4)是一种可培养的蝙蝠冠状病毒,可能是因为它使用人DPP4作为其细胞受体。gydF4y2Ba34gydF4y2Ba相反,肠病毒71型(EV-71)的宿主范围有限;人类是唯一已知的自然宿主。我们推测蝙蝠肠道类器官可能对CoV-HKU4敏感,但对EV-71不敏感。为此,我们在蝙蝠肠道类器官中检测了CoV-HKU4和EV-71。如图所示。gydF4y2Ba4gydF4y2Ba, CoV-HKU4接种后病毒基因拷贝数和病毒滴度显著增加。接种后48 h,培养基中感染性病毒粒子增加3 log以上。相比之下,无论蝙蝠类器官暴露于高剂量或低剂量的EV-71接种物中,我们都没有观察到任何病毒繁殖的迹象。gydF4y2Ba4 bgydF4y2Ba)。在高MOI接种(MOI为1)后,病毒载量甚至在感染后逐渐下降,表明蝙蝠类器官对人源肠道病毒不允许。EV-71在人类肠道类器官中接种作为阳性对照,并显示出强劲的病毒繁殖(图2)。gydF4y2Ba4 gydF4y2Bac,gydF4y2BadgydF4y2Ba),与之前的报告一致。gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba值得注意的是,CoV-HKU4也可以在人类肠道类器官中复制(图2)。gydF4y2Ba4 egydF4y2Ba),这与之前在人类DPP4转基因小鼠中发现的生产性感染相呼应。gydF4y2Ba35gydF4y2Ba免疫荧光染色证实了CoV-HKU4在蝙蝠和人肠道类器官中的感染(图2)。gydF4y2Ba4 fgydF4y2Ba)使用抗CoV-HKU4核衣壳蛋白(NP)的血清。gydF4y2Ba
蝙蝠肠道类器官复制了蝙蝠对冠状病毒的易感性。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba在蝙蝠肠道类器官接种CoV-HKU4 (gydF4y2Ba一个gydF4y2Ba), ev-71 (gydF4y2BabgydF4y2Ba)和人类肠道类器官接种EV-71 (gydF4y2BacgydF4y2Ba),收获培养基,用RT-qPCR检测病毒载量,用TCID50测定病毒滴度。数据表示代表性实验中的均值和标准差,gydF4y2BangydF4y2Ba= 3。双尾未配对学生的gydF4y2BatgydF4y2Ba测试。gydF4y2BadgydF4y2Ba对感染EV-71和模拟感染的人肠道类器官进行固定和免疫染色,以鉴定病毒蛋白VP1阳性(绿色)细胞。细胞核和肌动蛋白丝分别用DAPI(蓝色)和Phalloidin-647(紫色)反染。比例尺,20µm。gydF4y2BaegydF4y2Ba人肠道类器官接种CoV-HKU4后,于指定时间收获培养基,进行病毒载量检测和病毒滴定。数据表示代表性实验中的均值和标准差,gydF4y2BangydF4y2Ba= 3。双尾未配对学生的gydF4y2BatgydF4y2Ba测试。gydF4y2BafgydF4y2Ba对感染CoV-HKU4或模拟感染的蝙蝠和人肠道类器官进行固定和免疫染色,以鉴定CoV-HKU4 NP阳性(绿色)细胞。比例尺,20µm。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba在人类和蝙蝠肠道类器官接种WT SARS-CoV-2和Omicron变体后的指定小时,收获培养基,用于病毒载量检测和病毒滴定。数据表示代表性实验中的均值和标准差,gydF4y2BangydF4y2Ba= 3。采用Tukey多重比较检验的普通单因素方差分析。gydF4y2Ba我gydF4y2Ba对感染SARS-CoV-2和模拟感染的蝙蝠和人肠道类器官进行固定和免疫标记,以鉴定SARS-CoV-2 NP阳性(绿色)细胞。比例尺,20µmgydF4y2Ba
在马蹄蝠粪便中鉴定出一种与SARS-CoV-2具有96%同源性的蝙蝠冠状病毒RaTG13gydF4y2BaRhinolophus亲近种gydF4y2Ba。gydF4y2Ba1gydF4y2Ba与大多数蝙蝠病毒相似,RaTG13没有被分离培养。在没有活的RaTG13病毒的情况下,我们测试了SARS-CoV-2,发现来自马蹄蝙蝠的肠道类器官对SARS-CoV-2病毒(包括祖先菌株(WT)和2021年底出现的更具传染性的Omicron变体)都是允许的。然而,SARS-CoV-2病毒在人类肠道类器官中复制更为活跃(图2)。gydF4y2Ba4 ggydF4y2Ba)高于蝙蝠类器官(图2)。gydF4y2Ba4 hgydF4y2Ba)。数字gydF4y2Ba4 hgydF4y2Ba显示了接种1次MOI后在蝙蝠类器官中的复制动力学。接种MOI为0.1(与接种人类类器官的MOI相同)后,病毒在蝙蝠类器官中几乎没有复制(数据未显示)。有趣的是,在蝙蝠和人类类器官中,传染性更强的Omicron变体似乎比祖先WT病毒具有更高的复制适应性。免疫荧光染色证实WT菌株和Omicron变体在人类肠道类器官中的感染比蝙蝠更有生产力(图2)。gydF4y2Ba4我gydF4y2Ba)。总体而言,蝙蝠肠道类器官对一种蝙蝠冠状病毒和一种人类独家来源的肠道病毒的明显亲和性表明,蝙蝠肠道类器官再现了活蝙蝠对特定病毒的真实易感性。SARS-CoV-2在蝙蝠肠道类器官中的复制进一步支持了蝙蝠类器官作为蝙蝠肠道上皮在蝙蝠肠道中表型复制病毒嗜性的体外相关性。gydF4y2Ba
我们还测量了病毒诱导的人类和蝙蝠肠道类器官的先天免疫反应。在SARS-CoV-2接种后48 h,我们采集人和蝙蝠类器官,检测抗病毒基因和促炎细胞因子的反激活。III型干扰素在sars - cov -2感染的人类类器官中被高度诱导。gydF4y2Ba5gydF4y2Ba),这与我们之前的观察结果一致gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba以及Poly(I:C)处理后的活化情况(图2)。gydF4y2Ba2 bgydF4y2Ba)。ISGs、TNF-α和IP10表现出与Poly(I:C)处理的人类器官相似的诱导谱(补充图2)。gydF4y2Ba5gydF4y2Ba)。然而,我们没有观察到这些先天免疫基因在感染SARS-CoV-2后在蝙蝠类器官中有显著的诱导作用(数据未显示)。我们认为,这可能与蝙蝠类器官中病毒复制效率较低有关。gydF4y2Ba4 gydF4y2Ba克,gydF4y2BahgydF4y2Ba)。gydF4y2Ba
CYT387治疗促进蝙蝠类器官早期病毒传播gydF4y2Ba
既然蝙蝠肠道类器官比人类具有更高的基础抗病毒防御水平,并且在Poly(I:C)处理下产生了更积极的免疫诱导,那么对蝙蝠和人类类器官中宿主抗病毒防御的扰动可能对病毒生长的影响不同。基于如图所示,CYT387比BX795具有更强的免疫抑制作用。gydF4y2Ba3 gydF4y2Ba我们用CYT387处理蝙蝠和人类类器官,并评估病毒感染期间钝化免疫激活的影响。用CYT387或DMSO预处理过夜后,用SARS-CoV-2接种蝙蝠和人的类器官,然后用CYT387和DMSO的初始浓度孵育。我们通过检测培养基中的病毒载量和病毒滴度来监测病毒的生长。如图所示。gydF4y2Ba5gydF4y2Ba结果显示,CYT387在感染蝙蝠类器官后8小时显著增强病毒的生长,而CYT387在感染人类类器官后48小时才增强病毒的生长。gydF4y2Ba5 bgydF4y2Ba)。我们对CoV-HKU4进行了类似的实验,因为人和蝙蝠的肠道类器官都能持续复制CoV-HKU4。结果重现了CYT387在感染早期在蝙蝠类器官中授权的病毒生长的显著促进(图2)。gydF4y2Ba5度gydF4y2Ba)。然而,cyt387介导的病毒在人类器官中对CoV-HKU4的增强并不像在蝙蝠类器官中那样显著(图2)。gydF4y2Ba5 dgydF4y2Ba)。总体而言,结果表明蝙蝠类器官具有更强大的抗病毒机制,能够在感染的早期阶段立即控制病毒复制。gydF4y2Ba
在病毒生长的早期阶段,CYT387处理增强了病毒在蝙蝠肠道类器官中的复制。用1 μg/ml CYT387或DMSO预处理蝙蝠和人肠道类器官过夜。接种WT SARS-CoV-2或CoV-HKU4后,用1 μg/ml CYT387或DMSO孵育预处理过的蝙蝠和人类器官。在感染后的指定时间点,收集无细胞培养基,进行病毒载量检测和病毒滴定。数据表示每条类器官线的平均值和标准差;gydF4y2BangydF4y2Ba= 3。采用Tukey多重比较检验的普通单因素方差分析。处理和模拟处理的蝙蝠类器官中SARS-CoV-2的病毒载量和病毒滴度(gydF4y2Ba一个gydF4y2Ba)和人体类器官(gydF4y2BabgydF4y2Ba)。CoV-HKU4在处理和模拟处理的蝙蝠类器官中的病毒载量和病毒滴度(gydF4y2BacgydF4y2Ba)和人体类器官(gydF4y2BadgydF4y2Ba)gydF4y2Ba
讨论gydF4y2Ba
几个世纪以来,蝙蝠一直与传染病联系在一起。越来越多的证据表明,蝙蝠是各种冠状病毒最丰富的来源,其中一些冠状病毒与人类和其他哺乳动物的重大疾病有关,gydF4y2Ba18gydF4y2Ba包括正在进行的COVID-19大流行。gydF4y2Ba1gydF4y2Ba然而,即使在实验中感染了冠状病毒,蝙蝠也没有疾病迹象。gydF4y2Ba36gydF4y2Ba人们已经付出了巨大努力,探索蝙蝠能够以无病方式携带各种病毒,特别是对人类致病的冠状病毒的生物学机制。对蝙蝠的比较基因组研究揭示了免疫相关基因的缺失,以及抗病毒基因的扩增或收缩。gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba37gydF4y2Ba在蝙蝠细胞系或蝙蝠原代免疫细胞中的研究表明,与人类和小鼠细胞相比,ifn和isg的基础表达水平更高,并且抑制了促炎反应。gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba
冠状病毒在动物和人类中表现出肠道亲和性,包括由马蹄蝠携带的与sars相关的冠状病毒gydF4y2Ba2 gydF4y2Ba以及人类冠状病毒,如SARS-CoV、MERS-CoV和SARS-CoV-2。gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba38gydF4y2Ba肠上皮细胞是肠道病毒的入口和原发感染部位。病毒在这些上皮细胞中感染和复制的能力决定了它的宿主和组织趋向性;同时,被感染的上皮细胞引发的先天免疫反应协调了宿主防御的级联反应,以抵抗入侵的病毒并维持止血。由于受感染的上皮细胞释放炎症信号,免疫细胞随后在军备竞赛中被招募。然而,大多数关于宿主对微生物感染反应的知识都是从造血免疫细胞或其衍生细胞(如单核细胞衍生的巨噬细胞)的研究中收集的,这主要是由于这些细胞的培养相对容易获得和方法成熟。了解粘膜上皮细胞(入侵病毒的主要目标)的宿主反应的瓶颈是缺乏用于常规实验的原代上皮细胞。在常规黏附培养下,原代上皮细胞体外增殖能力有限,最终进入衰老,称为Hayflick极限。gydF4y2Ba39gydF4y2Ba许多细胞系,包括一些蝙蝠细胞系,都是从肾脏或肺等原代组织中衍生出来的。gydF4y2Ba12gydF4y2Ba除上皮细胞外,在常规贴壁单层培养下,源组织本身含有多种具有可变复制能力的细胞类型。此外,在获得细胞系的过程中,从天然组织中提取的细胞经历了一系列的生物学改变,以适应并在培养板的塑料表面上生长。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba因此,细胞系的最终衍生代表了适应和改变细胞的存活。由此产生的细胞系总是同质的,在细胞特性和生物学功能方面与体内上皮细胞非常不同。类器官技术的进步为这个长期存在的障碍提供了一个极好的解决方案。第一个成体干细胞衍生的类器官——人类肠道类器官,忠实地模拟了人类肠道上皮细胞的形态和功能属性。gydF4y2Ba19gydF4y2Ba,gydF4y2Ba42gydF4y2Ba因此成为研究病毒-宿主相互作用的流行工具。gydF4y2Ba20.gydF4y2Ba
我们之前从中国马蹄蝠中建立了蝙蝠肠道类器官,这些器官大量携带sars相关冠状病毒。gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba24gydF4y2Ba蝙蝠肠道类器官在蝙蝠肠道黏膜中含有四种主要的上皮细胞类型,并连续繁殖3个月左右。在本研究中,我们发现改良的培养基显著提高了蝙蝠肠道类器官的膨胀性,并且可以连续传代一年以上。我们现在每7天常规传代一次蝙蝠类器官,传代比例为1:3~5。gydF4y2Ba1gydF4y2Ba)。优化后的蝙蝠类器官的细胞组成与人类肠道类器官相当,为日常实验提供了非常稳定的来源,并产生了足够数量的蝙蝠肠上皮细胞。此外,我们有人类肠道类器官进行比较研究。这些肠道类器官代表了一种独特的、具有生物活性的模型系统,可以对蝙蝠和人类肠道上皮细胞进行类似的比较,从而揭示细胞免疫的潜在差异。gydF4y2Ba
蝙蝠和人类类器官的比较表明,蝙蝠类器官确实比人类类器官显示出更高的ifn和一些isg的基础水平(图2)。gydF4y2Ba1gydF4y2Bae,gydF4y2BafgydF4y2Ba),如先前在蝙蝠原代免疫细胞和蝙蝠细胞系中报道的那样。gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba值得注意的是,我们发现ifn和isg在蝙蝠和人类类器官中对Poly(I:C)刺激的诱导是不同的。gydF4y2Ba2 gydF4y2Ba)。蝙蝠类器官引发了更强烈的抗病毒反应。在所有IFN分子中,IFNL3,尤其是IFNL1被高度诱导,其强度明显高于I型和II型IFN(图2)。gydF4y2Ba2gydF4y2Ba)。结果表明,III型ifn是蝙蝠粘膜免疫的主要参与者,与先前在人类肠道类器官和实验小鼠肠道中的发现相似。gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba值得注意的是,在蝙蝠类器官中,由III型ifn牵头的抗病毒防御在速度和稳健性方面优于人类同类(图2)。gydF4y2Ba2 bgydF4y2Ba)。Poly(I:C)刺激也触发了蝙蝠类器官中isg和促炎细胞因子和趋化因子如IP10、IL6和TNF-α的诱导,其强度高于人类类器官(图2)。gydF4y2Ba2 gydF4y2Bag, h)。考虑到Poly(I:C)在两个物种的类器官中具有可比性,这是蝙蝠和人类类器官之间的无偏比较。gydF4y2Ba2 gydF4y2Bae,gydF4y2BafgydF4y2Ba及补充图gydF4y2Ba3 gydF4y2Ba)。然而,先前在蝙蝠细胞系中的研究表明,转录抑制因子cRel抑制Poly(I:C)诱导的TNF-α激活,而不像人类细胞系那样高度诱导TNF-α。gydF4y2Ba43gydF4y2Ba也有记录表明,cRel在其他蝙蝠物种中经历了积极的选择,gydF4y2Ba9gydF4y2Ba这表明它可能是一种减轻炎症的常见机制。在这里,我们的结果揭示了一个独特的模式TNF-α诱导蝙蝠肠道类器官从马蹄蝙蝠。我们将进一步研究促炎细胞因子的激活是否在其他蝙蝠物种的类器官中起作用。gydF4y2Ba
从马蹄蝠粪便中鉴定出一种与SARS-CoV-2基因组序列同源度达96%的蝙蝠冠状病毒RaTG13gydF4y2BaRhinolophus亲近种gydF4y2Ba。gydF4y2Ba1gydF4y2Ba没有活的RaTG13病毒,我们发现肠道类器官来源于马蹄铁蝙蝠gydF4y2BaRhinolophus sinicusgydF4y2Ba允许SARS-CoV-2并持续活跃的病毒生长,这可能归因于SARS-CoV-2对马蹄蝠ACE2的利用以及SARS-CoV-2与RaTG13的高度同源性。gydF4y2Ba1gydF4y2Ba我们推测这些蝙蝠肠道类器官可能在真实的马蹄蝙蝠中复制了sars相关冠状病毒的宿主和组织嗜性。在这里,我们提供了进一步的证据,证明蝙蝠肠道类器官充分模拟了蝙蝠对病毒的容忍度。蝙蝠肠道类器官对蝙蝠β冠状病毒CoV-HKU4敏感,但对EV-71(一种完全来自人类的肠道病毒)有抗性(图2)。gydF4y2Ba4 gydF4y2Ba)。因此,蝙蝠肠道类器官可以作为蝙蝠肠道上皮的体外相关性,用于表型复制宿主和蝙蝠病毒的组织趋向性,并为蝙蝠是否是人畜共患病毒的天然宿主提供直接的湿实验室证据。然而,对蝙蝠细胞系的研究表明,它们对埃博拉病毒的容纳性与真正的宿主亲和性无关。被测试的细胞系来自埃及gydF4y2BarousettegydF4y2Ba蝙蝠持续活跃地复制埃博拉病毒,埃及人对此感到震惊gydF4y2BarousettegydF4y2Ba蝙蝠实际上是难熔的。gydF4y2Ba44gydF4y2Ba这些结果提醒我们要谨慎对待蝙蝠细胞系的生物学相关性;永生化的蝙蝠细胞系可能与体内细胞有很大的不同。有趣的是,我们发现蝙蝠传播的乙型冠状病毒CoV-HKU4在人类肠道类器官中复制,这与它使用人类DPP4作为受体一致。之后,我们将在我们的人类呼吸类器官中测试CoV-HKU4,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba第一个成体干细胞衍生的人类呼吸类器官,以评估CoV-HKU4的人畜共患潜力。gydF4y2Ba
Poly(I:C)刺激后,蝙蝠肠道类器官比人类肠道类器官产生更快的抗病毒防御,且强度更高。使用两种合成抑制剂,我们发现蝙蝠和人类肠道类器官可能具有相似的TLR3和RLR途径来引发抗病毒免疫,因为这两种抑制剂有效地抑制了Poly(I:C)触发的蝙蝠和人类类器官中III型ifn和ISGs的诱导(图2)。gydF4y2Ba3 gydF4y2Ba)。SARS-CoV-2感染在人类肠道类器官中引发了类似的抗病毒和促炎基因诱导谱(补充图2)。gydF4y2Ba5gydF4y2Ba)与Poly(I:C)刺激所见的相似。然而,通过RT-qPCR检测,sars - cov -2感染的蝙蝠类器官未显示出明显的先天免疫基因诱导。我们将此归因于蝙蝠类器官中病毒复制效率较低。病毒载量/滴度的绝对读数和病毒载量/滴度随时间的增量在蝙蝠类器官中比在人类类器官中低(图2)。gydF4y2Ba4 gydF4y2Ba克,gydF4y2BahgydF4y2Ba)。在低增殖感染中,大多数未感染细胞仍未受到刺激;细胞反应可能在一小部分感染细胞中被触发,但在整批类器官的RT-qPCR检测中被掩盖。这实际上是我们比较人类和蝙蝠类器官中Poly(I:C)触发的先天免疫的基本原理,即,将病毒模拟物合并到这两种类器官中。然而,在蝙蝠类器官中无法证明病毒诱导的宿主反应确实是该研究的一个局限性。因此,我们可能需要在之后进行单细胞测序,以进行深入的调查,以检测蝙蝠类器官中潜在的免疫激活。同样,我们无法提供数据来证明TLR3/RLR信号参与病毒感染的蝙蝠和人类类器官的免疫激活,正如Poly(I:C)刺激实验所显示的那样。gydF4y2Ba3 gydF4y2Ba)。这需要我们在未来的研究中填补这一空白。gydF4y2Ba
尽管如此,在感染的早期阶段,TLR3/RLR抑制剂CYT387确实比人类同类药物更显著地增强了蝙蝠对SARS-CoV-2和CoV-HKU4的类器官感染(图2)。gydF4y2Ba5gydF4y2Ba)。也就是说,CYT387对病毒生长的增强充分再现了Poly(I:C)刺激后在蝙蝠类器官中表现出的更快速、更有效的抗病毒防御诱导。总的来说,结果表明,与人类细胞相比,抗病毒基因的较高基础表达,特别是更快和更有效地诱导抗病毒反应,使蝙蝠细胞能够立即对病毒感染作出反应,这限制了病毒感染,而不是预防病毒感染。更有效的宿主防御使蝙蝠细胞在感染的早期阶段具有抑制病毒传播的优势,这可能在很大程度上避免了病毒引起的炎症和人类冠状病毒感染中常见的免疫病理。Ahn等人展示了令人信服的证据,证明蝙蝠免疫细胞对RNA病毒的反应中nlrp3介导的炎症受到抑制。gydF4y2Ba13gydF4y2Ba因此,进一步研究蝙蝠免疫细胞和蝙蝠肠道类器官之间的相互作用是必要的。gydF4y2Ba
材料与方法gydF4y2Ba
蝙蝠和人类肠道类器官的建立和维持gydF4y2Ba
在香港大学/医院管理局香港西区院系机构检讨委员会(CULATR 5431-20)及香港特别行政区政府渔农自然护理署的伦理批准下,采购马蹄蝠用于肠道类器官的衍生。蝙蝠肠道类器官的来源如前所述。gydF4y2Ba24gydF4y2Ba简而言之,我们在蝙蝠被腹腔麻醉安乐死后采集蝙蝠的肠道。用冷PBS洗涤后,将肠道组织切成小块,然后用2 mg/ml胶原酶(Sigma Aldrich)在37°C下消化30分钟,然后用玻璃巴斯德移液管(Drummond)剪切,并用100 μm细胞滤器(FALCON)过滤。将得到的单细胞在200 g离心3分钟后成球,在冷基质(生长因子还原基底膜基质,康宁)中重悬,并将40µl细胞悬液分散在24孔板的孔中。将Matrigel聚合成液滴后,分散500µl培养基(补充表)gydF4y2Ba1gydF4y2Ba),并将类器官在含5% CO的加湿培养箱中保持在37°CgydF4y2Ba2 gydF4y2Ba。每7 d传代一次蝙蝠肠道类器官,传代比例为1:3-5,每隔一天补加培养基。使用Nikon Eclipse TS100倒置常规显微镜获得类器官的显微照片。在香港大学/医院管理局香港西区联网(UW21-695)机构检讨委员会批准后,曾从不同的供体衍生出多种人类肠道类器官。gydF4y2Ba26gydF4y2Ba
表达Wnt代物的稳定细胞系的构建gydF4y2Ba
汉斯·克莱弗斯教授和克里斯托弗·加西亚教授好心地提供了一个带Fc标签的编码Wnt替代物的质粒。如前所述,建立了表达Wnt代物的稳定细胞系。gydF4y2Ba48gydF4y2Ba我们使用人lgG1 Fc ELISA试剂盒(Thermo Fisher Scientific, BMS2092)测量培养基中Wnt代物的浓度。维持人类lgG1 Fc最高表达的稳定细胞系来生产Wnt替代条件培养基。在HEK 293 STF细胞(ATCC, CRL-3249)中检测Wnt代物和Wnt3a条件培养基的活性。然后将Wnt替代条件培养基补充到培养蝙蝠肠道类器官的培养基中,培养量与Wnt3a条件培养基的活性相当。gydF4y2Ba
马蹄蝠IFNL1和IFNL3全长cDNA序列的扩增gydF4y2Ba
使用RNeasy试剂盒(Qiagen, 74106)从蝙蝠肠道类器官中提取总RNA,并使用GeneRacer™试剂盒(Thermo Fisher Scientific, L150201)对cDNA末端进行5 '和3 '快速扩增(RACE)。为了获得5 '和3 '序列,我们使用基因特异性引物扩增了第一链cDNA(补充表)gydF4y2Ba2 gydF4y2Ba)和GeneRacer™5 '和3 '引物。纯化后将扩增子克隆到PCR中gydF4y2Ba®gydF4y2Ba4-TOPOgydF4y2Ba®gydF4y2Ba用于测序的载体。每个扩增子共测序20个菌落。用ApE DNA软件对序列进行比对分析。我们已将这两个基因的cDNA序列存入GenBank,登录号为OM937883和OM937884。gydF4y2Ba
聚(I:C)刺激和抑制实验gydF4y2Ba
使用玻璃巴斯德移液管剪切蝙蝠和人类类器官,并在含有10µg/ml Poly(I:C) (InvivoGen, tlrl- pic5)或DMSO的基础培养基(Advanced DMEM/F-12 (Gibco)中添加1% HEPES, 1% GlutaMAX和1%青霉素/链霉素)中孵育。在处理后的指定时间点,收集处理过或模拟处理过的类器官并进行RT-qPCR检测和Western blot。收集无细胞培养基,进行ELISA和PRM-MS检测。对于途径抑制实验,在基础培养基中,用1µg/ml或0.1µg/ml CYT 387 (InvivoGen, in -cy87)或1µM或0.1µM BX795 (InvivoGen, tlrl-bx7)预处理蝙蝠和人肠道类器官,或用0.1% DMSO模拟处理过夜。随后,机械剪切类器官,用或不加10µg/ml Poly(I:C)和初始浓度的抑制剂在悬浮板中孵育。在指定时间点采集类器官,RT-qPCR检测抗病毒基因的表达水平。收获无细胞培养基,应用于ELISA和PRM-MS。gydF4y2Ba
RT-qPCR, western blot, ELISAgydF4y2Ba
将蝙蝠和人类肠道类器官进行裂解,使用RNeasy试剂盒提取总RNA,然后使用PrimeScript RT-PCR试剂盒(Takara, PR014B)和寡核苷酸(dT)引物进行反转录。利用LightCycler 480 SYBR Green I Master Mix (Roche)和LC480 thermocycler (Roche)检测细胞基因mRNA表达水平。数据分析采用δ - δ Ct法。qPCR引物列于补充表gydF4y2Ba2 gydF4y2Ba。gydF4y2Ba
在Western blot中,人肠道类器官在含有蛋白酶抑制剂的RIPA缓冲液中裂解(Roche)。裂解物在12% SDS-PAGE中分离,然后转移到0.22µm PVDF膜(Bio-Rad)上。用5%脱脂牛奶(Bio-Rad)封闭过夜后,膜与抗isg15抗体(Thermo Fisher Scientific, MA5-15029)在室温下孵育2小时,然后与酶标二抗孵育,并用immobilon crescendo western HRP底物(Millipore)检测。从处理过的和模拟处理过的人肠道类器官中收集无细胞培养基,使用ELISA试剂盒(R&D Systems, DY7246, D28B00)测定人IFNL1和IFNL3的含量。gydF4y2Ba
平行反应监测-质谱分析gydF4y2Ba
通过丙酮沉淀过夜从蝙蝠和人类类器官中收集无细胞培养基,并在50 mM TEABC / 8 M尿素中重悬。然后用50 mM TCEP在55°C下处理30分钟,然后用55 mM IAA在黑暗中烷基化30分钟。缓冲液交换在10 kDa过滤器(Millipore)中进行,然后在50 mM TEABC(酶:蛋白比为1:100)中37°C胰酶消化18 h。样品用C18自旋尖端(Thermo)脱盐,然后在timsTOF柔性质谱仪(Bruker)上进行质谱分析。使用25cm × 75 μm × 1.6 μm C18色谱柱(IonOpticks),按照制造商的建议设置45分钟的梯度(0.2%甲酸水溶液和99.8%乙腈含0.2%甲酸)。默认的DDA短周期时间设置用于库构建。使用Maxquant (v2.0.3.1)在human UniProt数据库或内部bat数据库中搜索DDA数据文件。然后选择鉴定出的人ISG15 (LTQTVAHLK)、蝙蝠ISG15 (IAQETGVPAFQQR)和蝙蝠IFNL3 (llldlk)的肽段,在Skyline软件(版本21.2)中建立靶向质谱检测的PRM方法。然后,在100 mS的循环时间内,使用相同的纳米olc梯度,仅扫描具有特定CCS值的目标m/z前体,再次通过靶向PRM测定分析色氨酸消化的样品。然后Skyline对数据进行分析。 Only peptides with Peak Found Ratio of 100% were considered as identified and their total area of MS1 was calculated and exported by Skyline.
免疫荧光染色,流式细胞术,透射电镜gydF4y2Ba
病毒接种和模拟类器官固定后,使用自制的SARS-CoV-2 NP抗体进行免疫荧光染色。gydF4y2Ba25gydF4y2Ba或CoV-HKU4 NP或EV-71 VP1gydF4y2Ba26gydF4y2Ba山羊抗兔IgG Alexa Fluor 488 (A-11034, Invitrogen)或山羊抗小鼠IgG Alexa Fluor 488 (A-11001, Invitrogen)二抗标记病毒感染细胞。用抗villin (Abcam, ab201989)和抗muc2 (Thermo Fisher Scientific, MA5-12345)分别对蝙蝠肠道类器官进行染色,鉴定肠细胞和杯状细胞。细胞核和肌动蛋白丝分别用DAPI (Thermo Fisher Scientific)和Phalloidin-647 (Sigma-Aldrich)反染色。染色后,用延长™玻璃抗褪色贴片剂(Invitrogen)将类器官整体贴片在玻璃载玻片上。使用卡尔蔡司LSM 800共聚焦显微镜获得共聚焦图像。将蝙蝠和人肠道类器官剪切后,用10 μg/ml聚(I:C)荧光素(InvivoGen)孵育2 h,进行流式细胞术分析。收集类器官,用10µM EDTA (Thermo Fisher Scientific)消化,制成单细胞悬液,流式细胞术检测BD LSR Fortessa中荧光素阳性细胞的百分比。采用FlowJo软件进行数据处理。用2.5%戊二醛和1%锇连续固定后,将蝙蝠肠道类器官包埋在树脂中进行透射电镜观察。超薄切片用醋酸铀酰染色,在Philips CM 100透射电镜下观察。gydF4y2Ba
病毒感染和检测gydF4y2Ba
SARS-CoV-2祖先株HKU-001a (WT, GenBank登录号MT230904)和Omicron变体(B.1.1.529;GenBank OM212473)在VeroE6/TMPRSS2细胞中增殖,并用斑块法滴定。临床分离株EV-71 (GenBank登录号DQ341368.1)在RD细胞中繁殖和滴定,如我们之前所述。gydF4y2Ba26gydF4y2BaCoV-HKU4 (GenBank登录号PRJNA251999)在Caco-2细胞中繁殖和滴定。gydF4y2Ba49gydF4y2Ba将蝙蝠和人类类器官机械剪切,并与SARS-CoV-2或CoV-HKU4或EV-71在指定的MOI下在37°C下孵育2小时。洗涤后,将类器官重新嵌入基质中,然后在基础培养基中保存。接种后指定小时,收获无细胞培养基,使用MiniBEST病毒RNA/DNA提取试剂盒(Takara)进行RNA提取,一步RT-qPCR检测病毒载量(病毒基因拷贝数)(quantiinova Probe RT-PCR试剂盒,Qiagen,引物见补充表)gydF4y2Ba2 gydF4y2Ba),并用TCID50法进行病毒滴定,如前所述。gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba1µg/ml CYT387预处理或模拟处理过夜后,剪切蝙蝠和人类类器官,在悬浮板中接种SARS-CoV-2或CoV-HKU4病毒。接种后,在1µg/ml CYT387存在或不存在的条件下孵育类器官。在接种后的指定时间点,收集无细胞培养基,进行病毒载量检测和TCID50测定。为了检测sars - cov -2感染的人类和蝙蝠类器官的细胞反应,我们在接种2或模拟接种的MOI后48小时收获类器官。将类器官应用于RNA提取和RT-qPCR检测,检测上述相关免疫基因的诱导。gydF4y2Ba
数据分析gydF4y2Ba
采用GraphPad Prism 9.0进行统计学分析。使用学生t检验或方差分析检验来确定统计显著性,如图图例所示。*gydF4y2BapgydF4y2Ba≤0.05,**gydF4y2BapgydF4y2Ba≤0.01,***gydF4y2BapgydF4y2Ba≤0.001。gydF4y2Ba
数据可用性gydF4y2Ba
本文中报告的所有数据将根据要求由主要联系人共享。本文没有报告原始代码。重新分析本文中报告的数据所需的任何其他信息均可根据要求提供。gydF4y2Ba
参考文献gydF4y2Ba
周,P.等。与一种可能来源于蝙蝠的新型冠状病毒有关的肺炎暴发。gydF4y2Ba自然gydF4y2Ba579gydF4y2Ba, 270-273(2020)。gydF4y2Ba
刘世凯等。中华马蹄蝠体内的严重急性呼吸综合征冠状病毒样病毒gydF4y2Ba自然科学进展。美国gydF4y2Ba102gydF4y2Ba, 14040-14045(2005)。gydF4y2Ba
李伟,等。蝙蝠是类sars冠状病毒的天然宿主。gydF4y2Ba科学gydF4y2Ba310gydF4y2Ba, 676-679(2005)。gydF4y2Ba
崔军,李峰,史志林,致病性冠状病毒的起源和进化。gydF4y2BaNat Rev. MicrobiolgydF4y2Ba17gydF4y2Ba, 181-192(2019)。gydF4y2Ba
通用电气,X.-Y。et al。一种使用ACE2受体的蝙蝠sars样冠状病毒的分离和特性gydF4y2Ba自然gydF4y2Ba503gydF4y2Ba, 535-538(2013)。gydF4y2Ba
欧文,a.t.,安,M, Goh, G,安德森,D. E.和王,L. F.从宿主防御蝙蝠的教训,一个独特的病毒储存库。gydF4y2Ba自然gydF4y2Ba589gydF4y2Ba, 363-370(2021)。gydF4y2Ba
周杰等。中东呼吸综合征冠状病毒的活跃复制和人巨噬细胞中炎症细胞因子和趋化因子的异常诱导:发病机制的意义gydF4y2Baj .感染。说。gydF4y2Ba209gydF4y2Ba中文信息学报,1331-1342(2014)。gydF4y2Ba
李,A. K.等。埃及褐蝠从头转录组重建与注释。gydF4y2BaBMC基因组学gydF4y2Ba16gydF4y2Ba, 1033(2015)。gydF4y2Ba
Zhang, G.等。蝙蝠基因组的比较分析提供了对飞行和免疫进化的洞察。gydF4y2Ba科学gydF4y2Ba339gydF4y2Ba, 456-460(2013)。gydF4y2Ba
杰布等人。六个参考质量的基因组揭示了蝙蝠适应的进化。gydF4y2Ba自然gydF4y2Ba583gydF4y2Ba, 578-584(2020)。gydF4y2Ba
周,P.等。蝙蝠I型IFN基因座的收缩和IFN- α的异常组成表达。gydF4y2Ba自然科学进展。美国gydF4y2Ba113gydF4y2Ba中文信息学报,2696-2701(2016)。gydF4y2Ba
周,P.等。翼类蝙蝠III型ifn的不同表达模式为其在抗病毒免疫中的不同作用提供了证据。gydF4y2Baj . Immunol。gydF4y2Ba186gydF4y2Ba中文信息学报,3138-3147(2011)。gydF4y2Ba
Ahn, M.等人。抑制nlrp3介导的蝙蝠炎症及其对特殊病毒宿主的影响。gydF4y2BaNat。MicrobiolgydF4y2Ba4 gydF4y2Ba, 789-799(2019)。gydF4y2Ba
哦,g,等等。caspase-1和il -1 β的互补调节揭示了蝙蝠炎症抑制的其他机制。gydF4y2Ba自然科学进展。美国gydF4y2Ba117gydF4y2Ba中文信息学报,28939-28949(2020)。gydF4y2Ba
Zhou, P., cowld, C., Wang, L. F. & Baker, M. L. Bat Mx1和Oas1,但Pkr不受蝙蝠干扰素和病毒感染的高度诱导。gydF4y2BaDev. Comp. immuno1gydF4y2Ba40gydF4y2Ba, 240-247(2013)。gydF4y2Ba
肖,A. E.等。I型干扰素反应的多物种比较揭示了哺乳动物先天免疫系统的基本特性。gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba15gydF4y2Ba, e2004086(2017)。gydF4y2Ba
王丽芳,Gamage, a.m, Chan, w.o.y, Hiller, M. & Teeling, E. C.解码蝙蝠免疫:需要一个协调的研究方法。gydF4y2BaNat, Rev. immuno1。gydF4y2Ba21gydF4y2Ba, 269-271(2021)。gydF4y2Ba
周,P.等。由一种与hku2相关的蝙蝠源冠状病毒引起的致命猪急性腹泻综合征。gydF4y2Ba自然gydF4y2Ba556gydF4y2Ba, 255-258(2018)。gydF4y2Ba
佐藤,t。来自人类结肠、腺瘤、腺癌和巴雷特上皮的上皮类器官的长期扩张。gydF4y2Ba胃肠病学gydF4y2Ba141gydF4y2Ba, 1762-1772(2011)。gydF4y2Ba
Ettayebi, K.等。人诺如病毒在干细胞衍生的人肠道中的复制。gydF4y2Ba科学gydF4y2Ba353gydF4y2Ba中文信息学报,1387-1393(2016)。gydF4y2Ba
Good, C, Wells, A. I. & Coyne, C. B. III型干扰素信号传导限制肠病毒71杯状细胞感染。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Ba, eaau4255(2019)。gydF4y2Ba
Kayisoglu, o。定位特异性细胞身份,而不是暴露于胃肠道微生物群,定义了肠上皮中许多先天免疫信号级联反应。gydF4y2Ba肠道gydF4y2Ba70gydF4y2Ba, 687-697(2021)。gydF4y2Ba
李,C.等。人类冠状病毒对宿主热休克蛋白90的依赖性揭示了抗病毒靶点。gydF4y2Ba紧急情况。微生物感染。gydF4y2Ba9gydF4y2Ba中文信息学报,2663-2672(2020)。gydF4y2Ba
周杰等。SARS-CoV-2感染蝙蝠和人类肠道类器官的研究。gydF4y2BaNat,地中海。gydF4y2Ba26gydF4y2Ba科学通报,1077-1083(2020)。gydF4y2Ba
周杰等。人类肠道是中东呼吸综合征冠状病毒的另一种感染途径。gydF4y2Ba科学。睡觉。gydF4y2Ba3 gydF4y2Ba, eaao4966(2017)。gydF4y2Ba
赵旭,等。人类肠道类器官概括了肠道病毒和冠状病毒的肠道感染。gydF4y2Ba干细胞代表gydF4y2Ba16gydF4y2Ba, 493-504(2021)。gydF4y2Ba
拉米斯等人。SARS-CoV-2可有效感染人类肠道细胞。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, 50-54(2020)。gydF4y2Ba
Miao, Y.等。新一代代糖支持类器官生长和去卷曲多效性。gydF4y2Ba干细胞gydF4y2Ba27gydF4y2Ba, 840 - 851。e846(2020).
Lazear, H. M., Nice, T. J. & Diamond, M. S.干扰素:屏障表面及其外的免疫功能。gydF4y2Ba免疫力gydF4y2Ba43gydF4y2Ba, 15-28(2015)。gydF4y2Ba
库马尔,H., Koyama, S., Ishii, K. J., Kawai, T.和Akira, S.前沿:IPS-1和trif依赖通路在聚羧酸增强抗体产生和细胞毒性T细胞反应中的合作。gydF4y2Baj . Immunol。gydF4y2Ba180gydF4y2Ba, 683-687(2008)。gydF4y2Ba
斯坦弗,M. L.等。TLR3的不对称分布导致人肠上皮细胞的极化免疫反应。gydF4y2BaNat。MicrobiolgydF4y2Ba。gydF4y2Ba5gydF4y2Ba中文信息学报,181-191(2019)。gydF4y2Ba
特纳,J. W.等。CYT387是一种新的JAK2抑制剂,在小鼠骨髓增殖性肿瘤中诱导血液学反应并使炎症细胞因子正常化。gydF4y2Ba血gydF4y2Ba115gydF4y2Ba, 532 - 5240(2010)。gydF4y2Ba
Menachery, v.d.等。一种类似sars的蝙蝠冠状病毒传播群显示出人类出现的可能性。gydF4y2BaNat,地中海。gydF4y2Ba21gydF4y2Ba中文信息学报,1508-1513(2015)。gydF4y2Ba
罗,C. M.等。在中国南方发现与中东呼吸综合征冠状病毒使用相同受体的新型蝙蝠冠状病毒。gydF4y2BaJ性研究gydF4y2Ba92gydF4y2Ba, e00116-18(2018)。gydF4y2Ba
刘顺权等。中国南方蝙蝠新型冠状病毒支持中国马蹄蝠作为潜在新型冠状病毒的重要储存库。gydF4y2Ba病毒gydF4y2Ba11gydF4y2Ba, 423(2019)。gydF4y2Ba
明斯特,V. J.等。中东呼吸综合征冠状病毒在牙买加果蝠中的复制和脱落。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 21878(2016)。gydF4y2Ba
Ahn, M., Cui, J., Irving, A. T. & Wang, L. F.蝙蝠中PYHIN基因家族的独特缺失:对炎症小体感知的影响。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 21722(2016)。gydF4y2Ba
梁文强等。严重急性呼吸综合征相关冠状病毒感染累及肠道gydF4y2Ba胃肠病学gydF4y2Ba125gydF4y2Ba, 1011-1017(2003)。gydF4y2Ba
Hayflick, L. & Moorhead, P. S.人类二倍体细胞株的连续培养。gydF4y2BaExp. Cell ResgydF4y2Ba25gydF4y2Ba, 585-621(1961)。gydF4y2Ba
Fujii, M. & Sato, T.体细胞衍生的类器官作为人类上皮组织和疾病的原型。gydF4y2BaNat。板牙。gydF4y2Ba20.gydF4y2Ba, 156-169(2021)。gydF4y2Ba
吉列,j.p.等人。重新定义已建立的癌细胞系与临床抗癌耐药机制研究的相关性。gydF4y2Ba自然科学进展。美国gydF4y2Ba108gydF4y2Ba, 18708-18713(2011)。gydF4y2Ba
佐藤,t。单个Lgr5干细胞在体外没有间充质生态位的情况下构建隐窝绒毛结构。gydF4y2Ba自然gydF4y2Ba459gydF4y2Ba, 262-265(2009)。gydF4y2Ba
Banerjee, A., Rapin, N., Bollinger, T. & Misra, V.蝙蝠炎症基因表达的缺乏:转录抑制因子的独特作用。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 2232(2017)。gydF4y2Ba
Kuzmin, I. V.等。蝙蝠和人类细胞对丝状病毒的先天免疫反应:共性和区别。gydF4y2BaJ性研究gydF4y2Ba91gydF4y2Ba, e02471-16(2017)。gydF4y2Ba
李,C.等。建立人肺类器官及近端分化生成成熟气道类器官。gydF4y2Ba木星gydF4y2Ba, e63684(2022)。gydF4y2Ba
周杰等。分化的人气道类器官评估新发流感病毒的传染性。gydF4y2Ba自然科学进展。美国gydF4y2Ba115gydF4y2Ba, 6822-6827(2018)。gydF4y2Ba
邱,m.c.等。人鼻类器官模型SARS-CoV-2上呼吸道感染并概括新发变异的差异传染性gydF4y2BamBiogydF4y2Ba13gydF4y2Ba, e0194422(2022)。gydF4y2Ba
Reeves, P. J. GPCR表达重组细胞系的构建。gydF4y2Ba方法Mol. Biol;gydF4y2Ba2268gydF4y2Ba, 43-60(2021)。gydF4y2Ba
刘顺权等。从使用DPP4并感染人类DPP4转基因小鼠的小竹蝙蝠中分离mers相关冠状病毒gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 216(2021)。gydF4y2Ba
Wang, D.等。SPINK6抑制人气道丝氨酸蛋白酶,限制流感病毒激活。gydF4y2BaEMBO Mol. Med。gydF4y2Ba14gydF4y2Ba, e14485(2022)。gydF4y2Ba
赵旭,等。c型凝集素受体和RIG -i样受体的激活有助于中东呼吸综合征冠状病毒感染巨噬细胞的促炎反应gydF4y2Baj .感染。说。gydF4y2Ba221gydF4y2Ba科学通报,647-659(2020)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Christopher Garcia教授(斯坦福大学)和Hans Clevers教授(Hubrecht研究所)分享Wnt替代质粒。我们感谢香港大学李嘉诚医学院全景科学中心和电子显微镜组在共聚焦成像、流式细胞术和电子显微镜方面的协助。本研究部分由香港特别行政区政府食物及卫生局卫生及医学研究基金(HMRF, 17161272和19180392)资助J.Z.;香港特别行政区政府研究资助局的一般研究基金(GRF, 17105420)、合作研究基金(CRF, C7042-21G)及主题研究计划(TbRS, T11-709/21-N);香港特别行政区政府创新科技署Health@InnoHKgydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
j.z., s.j.和K.Y.Y.设计了这项研究。张晓亮、张志亮、张志文、张志明、张志辉、张永元进行了实验。江志强、许立良、张志强、张志强和张志强对数据进行了分析和解释。j - pc和r。l。提供了抗体。L.Z.和Z.C.进行了PRM-MS。Y.S.进行了序列分析。J.Z.和K.Y.Y.提供了资金支持。j.z., S.J.和K.Y.Y.写了手稿。所有作者都已阅读并批准了本文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
补充信息gydF4y2Ba
41392 _2022_1247_moesm1_esm.docxgydF4y2Ba
类似的比较揭示了蝙蝠类器官免疫抑制后抗病毒防御增强和病毒感染增强gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘晓,李翀,万忠。gydF4y2Baet al。gydF4y2Ba类似的比较揭示了蝙蝠类器官免疫抑制后抗病毒防御增强和病毒感染增强。gydF4y2Ba信号传导目标gydF4y2Ba7gydF4y2Ba, 392(2022)。https://doi.org/10.1038/s41392-022-01247-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41392-022-01247-wgydF4y2Ba