摘要
甲烷养菌氧化大部分甲烷(CH4)在自然和人为生态系统中产生。这些微生物通常生活在土壤表面附近,必须经常适应温度变化。虽然许多环境研究已经解决了温度对CH的影响4氧化和甲烷菌群,很少有关于这些影响的生理调节的知识。我们研究了热适应Methylobacter这是一个广泛的,丰富的,对环境重要的甲烷营养属。增长和CH的比较4在三个属的成员在不同温度下的氧化动力学表明,温度对多少CH有强烈的影响4来支持不同CH的生长4浓度。然而,温度效应在不同物种之间有很大差异,这表明甲烷营养群落的组成方式影响着温度效应4吸收。为了更广泛地了解热适应机制,我们进行了一个转录组学实验Methylobacter tundripaludumSV96T.我们观察到,在不同温度下,糖原和蛋白质生物合成转录本丰度的变化与细胞糖原和核糖体浓度的关系。我们的数据也证明了CH的转录调节4氧化,氧化磷酸化,膜脂肪酸饱和,细胞壁组成,和温度之间的胞外多糖。此外,我们观察到在m . tundripaludumSV96T不同温度下的细胞大小。我们认为热适应在Methylobacter中枢代谢、蛋白质生物合成、细胞壁和储存的转录调节结果。适应导致CH的巨大变化4消耗和生长效率,但物种之间有很大差异。因此,我们的研究表明,对温度变化的生理调整可以在很大程度上影响环境CH4摄取速率和考虑甲烷营养生物生理学可能对准确预测变暖对CH的影响至关重要4排放。
简介
唯一已知的生物CH4水槽是利用CH的甲烷养菌4作为一种能源和碳源[1,2].好氧甲烷养菌属于γ -变形菌门、α -变形菌门和疣菌门。这些细菌存在于土壤、湿地、水、稻田、垃圾填埋场、污水和沉积物中,消耗地下生物源或热源CH4或者直接从空气中获取气体[3.].甲烷养菌氧化CH4使用细胞质可溶性甲烷单加氧酶或膜结合颗粒甲烷单加氧酶(sMMO或pMMO),并通过核酮糖单磷酸途径、丝氨酸途径或Calvin-Benson-Bassham循环固定碳[3.].
γ变形菌属的成员Methylobacter在许多生态系统中,包括泥炭土壤、苔原、池塘、湖泊、冰下沉积物、湖泊沉积物、稻田和垃圾填埋场中,已被确定为最丰富和最活跃的甲烷养菌[4,5,6,7,8,9,10,11].这些环境是全球甲烷(CH4)排放,负责431 Tg CH4年-1(自下向上估计1978-2019年全球平均值)[12].高排放的生态系统通常有高溶解的CH4浓度(>100µM) [13,14,15,16],意思是Methylobacter这些物种经常暴露在CH环境中,并且可能已经适应了CH环境4饱和吸收。
土壤既有稳定的温度,也有受昼夜循环、天气变化和季节驱动的较大温度波动,并取决于土壤类型、深度、纬度和海拔[17,18,19,20.].温度变化对土壤CH的影响很大4氧化率已被观察到,例如,从垃圾填埋场的强烈温度响应[21]及海洋沉积物[22]对多年冻土的不同响应[23]和轻微的大气CH影响4森林土壤中的浓度[24]或高CH4泥炭的浓度[25].甲烷养菌的温度响应与土壤类型和CH有关4浓度(26].此外,CH4氧化已经被观察到比CH更敏感的温度4活动层冻原土壤的生产,但这种温度敏感性的潜在细胞机制尚未被研究[23].尽管微生物的热适应(也称为热适应和热适应)显然很重要[27,28]),我们还不清楚甲烷养菌如何对温度变化进行生理调节,以及这与底物周转和生长之间的关系。
细菌对温度的反应发生在许多层面,例如影响酶氨基酸组成的基因变化[29]、影响细胞结构、代谢潜能或酶动力学的水平基因转移[30.]、膜脂肪酸组成的改变[31],以及基因表达模式或调控网络的改变[32].例如,在对短期冷休克的反应中,一些细菌适应DNA曲率,并有利于冷反应转录本的翻译[33].细菌细胞也被证明生长到更大的尺寸,并维持更大的细胞内ATP池,以弥补低温下的动力学限制[34,35].一些研究表明,碳和储能聚合物的积累可以在微生物的热驯化中发挥作用,例如,低温(<10°C)缺氧泥炭中聚羟基烷酸(PHA)储存的转录上调[36], PHA在高温(30-37℃)下的积累以甲烷富营养化为主Methylocystis[37],糖原的储存作为低温下的生存机制大肠杆菌[38].
细菌对包括温度在内的变化条件的细胞反应的核心是遗传信息处理机制[39],包括DNA到RNA的转录和RNA到蛋白质的翻译。核糖体调谐是通过研究大肠杆菌作为一种主要的细胞工具,以优化生长速度和生理状态,以应对外部条件的变化,包括温度(例如,[40,41])。最近,对土壤微生物对长期变暖的响应的研究表明,在较高温度下的较高生长速度伴随着核糖体数量的减少[42],证实了蛋白质生物合成机制的调节是自然界中一种重要的热适应机制。然而,到目前为止,我们对核糖体调节热驯化的认识主要局限于对模式生物的研究大肠杆菌.
由于有相当大的CH4摄取,包括消耗高达90%的产生的CH4在湿地[43]和大气CH4土壤的吸收[44],甲烷养菌是最重要的CH之一4-地球上的碳汇[45].由于这些微生物经常暴露在土壤表层的温度变化中,它们的生理调节方式可能对全球CH产生显著影响4骑自行车。根据他们频繁的检测报告[3.],属的成员Methylobacter可能对生物CH4下沉。然而,我们对温度对甲烷营养生物生理的影响的认识是非常有限的。
在这里,我们研究了如何Methylobacter适应不同的温度和CH4相对生长和CH的浓度4用三种菌株进行氧化动力学实验Methylobacter物种。此外,为了了解哪些细胞机制被调节以适应热适应,我们对其中一个菌株进行了一系列的温度实验,包括转录组学和细胞大小和细胞含量的测量,Methylobacter tundripaludumSV96T.
结果与讨论
环境分布Methylobacter温度对生长和CH的影响4三氧化动力学Methylobacter菌株
通过筛选地球微生物组计划(EMP)中可用的数据[46],我们观察到广泛分布的Methylobacter类16S rRNA基因序列(图S1),占所有23,813个筛选EMP样本的17%(补充数据集(SD) A:表A1),并包括1355个独特地理位置中的256个(SD A:表A2).Methylobacter-like序列在淡水中最为常见(占数据库中所有淡水样本的64%)(SD A:表A3.),在淡水中亦最为丰富(SD A:表A1).据此,会员Methylobacter在环境研究中经常观察到[3.]和类型菌株种类m . tundripaludum(SV96T) [47]在湿地、湖泊和其他高ch中很常见4环境(4,5,6,7,48].高丰度和全球分布Methylobacter在淡水环境中,表明CH在全球范围内具有重要作用4因为这些是CH的热点4占人类和天然CH总量的42%4排放(49].
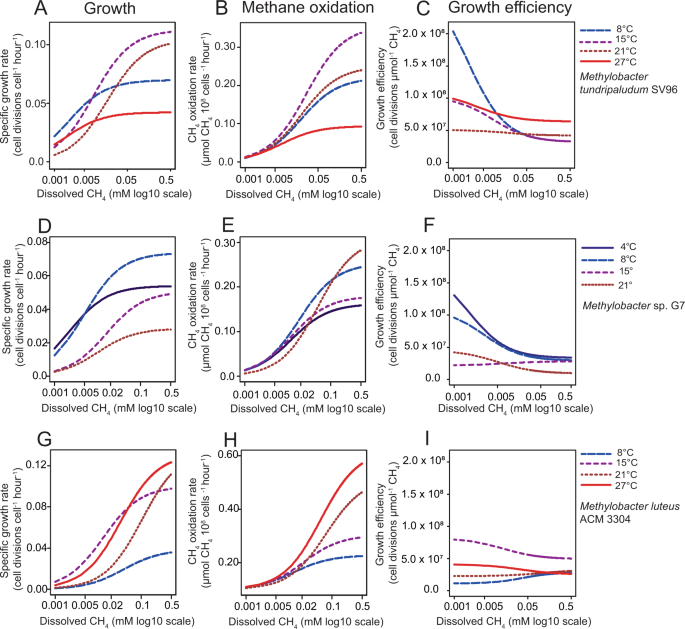
目的:研究热驯化对植物生长和CH的影响4我们比较了这些环境重要微生物的生长动力学和CH4三种不同的氧化动力学Methylobacter菌株,Methylobacter tundripaludumSV96T,Methylobactersp. G7,以及m .危害ACM 3304T(见图S2实验设置)。
Methylobacter tundripaludumSV96T源于北极泥炭,其生长温度范围表明耐冷性,生长最佳温度为15至25°C [47].其系统发育pmoA基因(编码pMMO β亚基的常见标记基因)将该菌株置于与大多数特征菌株不同的分支中Methylobacter物种,包括Methylobacter危害而且Methylobacter whittebury(无花果。3.),正如先前使用系统基因组学所显示的[50].在实验中m . tundripaludumSV96T,我们比较了growth和CH4在8、15、21和27°C之间,7种溶解CH的氧化Michaels-Menten动力学4浓度由0.003毫米至0.25毫米不等(n= 84次孵育,每次孵育4次时间点测量)。在CH4-吸收饱和度(V马克斯(应用):“app”,表示元胞V马克斯),比生长在15°C时最快,其次是21°C、8°C和27°C。1,图S4B:表B1).在CH4浓度低于~0.005 μ M时,8°C下的比生长速率高于其他温度(图2)。1,图S4).CH4氧化速率也随温度和CH的变化而变化4浓度(图。1 bB:表B2).在CH4-摄取饱和度,最高细胞CH4消费率(V马克斯(应用))分别在15℃、21℃、8℃和27℃时被检测到。1 b图S4B:表B2).在低CH4浓度(低于0.005 μ M)时,我们只观察到CH的微小差异4温度之间的消耗。因此,生长效率(每个CH的细胞分裂数4分子氧化,用四参数物流曲线建模)48°C和15°C时的饱和度远低于21°C和27°C时(图2)。1 cB:表B3.).生长效率随CH的降低而增加4在所有温度下,其浓度在8℃时增幅最大,其次分别为15℃、27℃和21℃。这个观察,在高CH4在高温(21和27°C)下生长效率最高,而在低CH条件下4浓度最高的生长效率在低温(8和15°C)下被发现,这意味着细胞资源分配的巨大变化,因此CH4由于温度和CH的变化而消耗4浓度。这也与一个提出的模型不一致,在该模型中,快速和缓慢的增长被认为是低效的,而最高的效率是在中等增长率下获得的[51].
生长动力学,CH4不同温度下氧化动力学和生长效率m . tundripaludumSV96T(一个,B,C),Methylobactersp. G7 (D,E,F),Methylobacter危害ACM 3304T(G,H,我).一个不同溶解CH时特定生长速率(每细胞每小时分裂)的Michaelis-Menten动力学模型4浓度和不同的温度(8,15,21和27°C)m . tundripaludumSV96T.的x-axis采用log10刻度,以更好地解决低浓度和高浓度温度之间的差异。各模型的数据、个别参数和统计数据见图S4和SD B,表B1.BCH的Michaelis-Menten动力学模型4不同溶解CH的每个细胞的氧化率4浓度和温度(8,15,21和27°C)。各模型的数据、个别参数和统计数据见图S4和SD B,表B2.标准误差和p为系数估计值,以及生长和CH的残留标准误差4氧化模型采用非线性回归估计,应用Michaelis-Menten函数(见材料和方法部分“生理测量的统计学”)。C每µmol CH的细胞分裂数4在不同溶解的CH下氧化4浓度和温度。生长效率估计值是根据(一个)及(B)将具体增长率预测除以CH4氧化率预测,以获得每µmol CH的细胞分裂4氧化了。四参数物流曲线(剂量-反应模型)拟合得到的商数。的p不同温度下剂量-响应模型的四个参数(min、max、inflection和hill)的值如图S所示4和SD B,表B3..D- - - - - -F与(相同)一个- - - - - -C),除了Methylobactersp. G7在4,8,15和21°C孵育。数据和个别模型见图S5和SD B,表B5B6B7.G- - - - - -我与(相同)一个- - - - - -C).Methylobacter危害ACM 3304T在同样的温度下孵化m . tundripaludumSV96T.数据和个别模型见图S6和SD B,表B8B9B10.9个数字中的每一个都是基于84个孵育,每次孵育有4-5个时间点测量。
MethylobacterG7与…密切相关m . tundripaludumSV96T,pmoA基因系统发育将这些菌株置于同一支系(图S3.).它起源于靠近斯瓦尔巴群岛朗伊尔城(78°13′00″N 15°38′00″E)的G7煤矿内的生物膜。Methylobactersp. G7迄今尚未作为一个新物种发表,但其基因身份为m . tundripaludumSV96T(94.4%pmoA而16s rRNA基因为98.9%)与不同的磷脂脂肪酸(PLFA)谱相比较m . tundripaludumSV96T(SD B: Table B .4)暗示它可能代表一部小说Methylobacter物种。这个实验Methylobactersp. G7的设立方式与for相同m . tundripaludumSV96T(n= 84)。然而,该菌株在27℃时不能生长,因此这些实验分别在4、8、15和21℃进行。增长率最高的MethylobacterCH下的sp. G74饱和度分别为8°C、4°C、15°C和21°C。1 d,图S5B:表B5).最高的CH4CH下的氧化速率4在21°C和8°C,其次是15°C和4°C(图2)。1 e,图S5B:表B6).这表明在4℃时生长效率最高,其次是8℃、15℃和21℃4浓度饱和(图;1 f,图S5B:表B7),与的相对m . tundripaludumSV96T(无花果。1 c).然而,像m . tundripaludumSV96T的生长效率Methylobacter随着CH的降低,G7显著升高4浓度。
Methylobacter危害是一种中温物种,与其他两株菌株分开聚集(图S3.),并可在淡水、海洋沉积物、污水及堆填区等中找到[48,52].m .危害ACM 3304T具有与其他两种菌株不同的PLFA剖面(补充数据集B, Table B4).实验(n84)与…m .危害ACM 3304T(原本与污水隔离[3.])表现出最高的细胞分裂和CH4CH下氧化速率427°C的饱和度,其次是21°C, 15°C和8°C(图。1G和H,图S6表B8和B9).CH下生长效率最高4在15°C时观察饱和度(图;1我,图S6B:表B10),其次是21°、8°和27°C。我们观察到,随着CH的改变,生长效率只有很小的变化4浓度m .危害ACM 3304T,除了在15°C时生长效率有较大的提高外,我们几乎没有看到随温度的变化,证实了的热驯化策略m .危害ACM 3304T与其他两种菌株有很大不同。但温度对CH的影响较大4每个细胞的消耗对所有三个菌株都是相同的(图。1b e h).
通过比较三者的增长效率Methylobacter我们可以证明热驯化如何影响CH4吸收速率。例如,我们看到大量额外的CH4被消耗m . tundripaludumSV96T15°C和8°C,以支持较高CH的生长4浓度,相对于21和27°C。与其他温度相比,在21°C时也是如此Methylobactersp. G7(图;1B和E).从生理上讲,最大限度地提高生长速度是低效的,例如,在需要更多蛋白质来加快生长速度的情况下[40],但当资源充足时,这种策略是有益的。另一方面,m . tundripaludumSV96T而且Methylobactersp. G7都进化出了适应策略,其中最有效的生长发生在低温和低CH4浓度(无花果。1C和F).高效增长意味着低CH4因此,我们的结果表明,由于自然界的温度变化,从低效生长到高效生长的转变可以导致较低的CH4氧化速率,反之亦然。为m .危害ACM 3304T,温度对CH的影响4相对于其他温度,15°C的生长效率更高。这意味着温度从25°C下降到15°C将减小a的大小m .危害ACM 3304T主导CH4在每个细胞的基础上,大量的下沉,不是因为菌株不能在温度下工作,而是因为它生长得更有效。这进一步说明一个品系的竞争力与其CH并不一定相关4消费。因此,当CH4产量通常会随着温度的升高而增加[53],我们的数据证明CH4由于生理原因,氧化速率可能并不总是相关的,这可能解释了温度对CH影响的一些不同观察结果4环境研究中的氧化现象(例如,[23,25])。
细胞大小及RNA和DNA含量m . tundripaludumSV96T
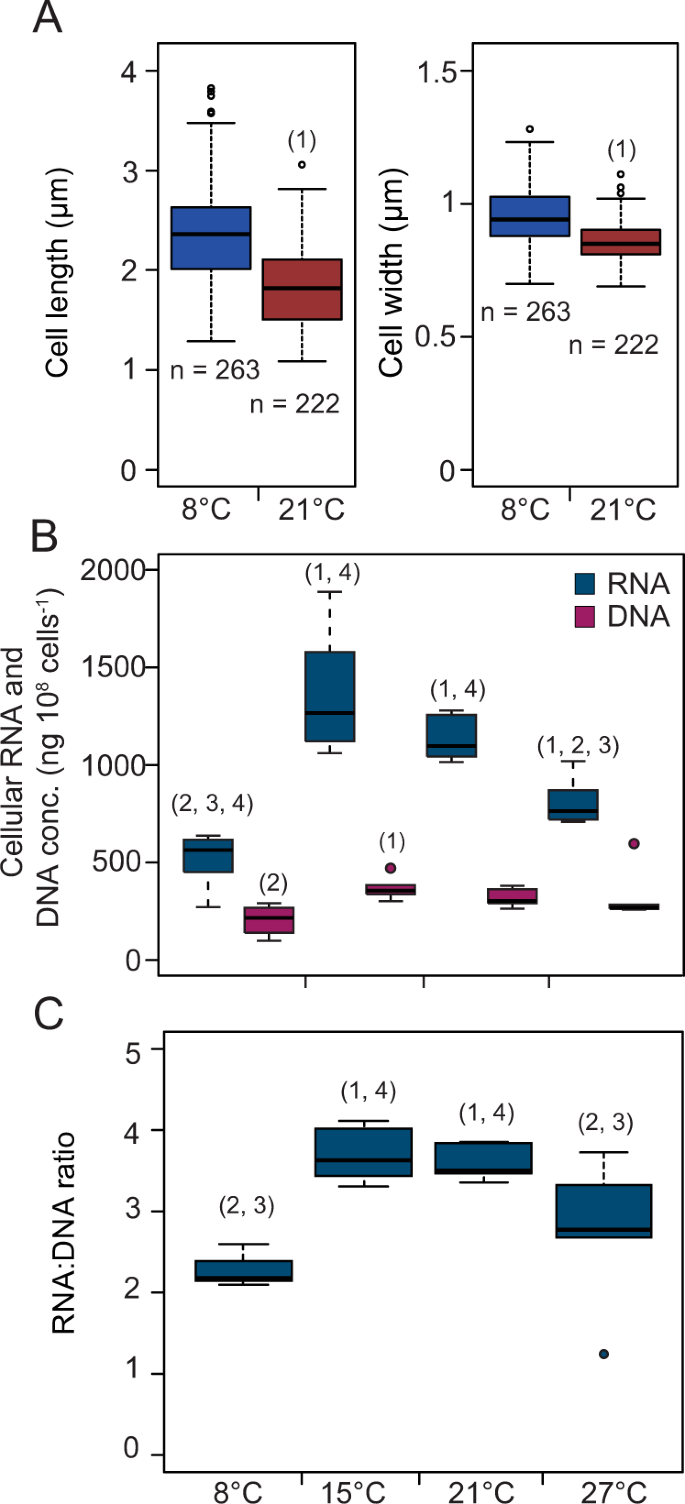
我们把注意力转向m . tundripaludumSV96T用于更深入地研究与热适应有关的细胞机制。几十年来,人们对包括藻类和细菌在内的微生物进行了观察,这些微生物的大小随着温度的变化而变化(例如,[54,55])。对于8°C和20°C的温度,我们测试了这是否也是如此m . tundripaludumSV96T.我们观察到轻微但显著的宽度下降(平均5%,n= 222-263)和长度(平均10%,n= 222-263)。2).然而,尽管细胞大小存在差异,但我们并没有看到培养物的光密度有一致的差异,这可能是由于光密度测量中低百分比变化和技术可变性的结合。
在(一个),箱线图显示了8 - 20°C之间细胞长度(左)和细胞宽度(右)的差异。在(B),箱形图显示了植物中RNA和DNA的浓度m . tundripaludumSV96T细胞。在(C),箱形图显示RNA:DNA的比值。均值之间的差异采用未配对的单尾方法进行评估t测试。显著差异(p< 0.05,使用Benjamini-Hochberg方法的多重测试校正)到8°C(1), 15°C(2), 21°C(3)和27°C(4)的个别方框上方用数字表示。相关数据见SD B: Table B12.
然后,我们准备在8、15、21和27°C和饱和CH下进行转录组学实验4浓度(>0.1 mM溶解CH4)在指数增长期间。生长实验(图S7一个, SD B,表B11),以测试在这些条件下是否能观察到与生长动力学实验相同的温度响应(图。1图S4).生长实验结果显示,8°C和27°C的生长速率无显著差异(0.035和0.038细胞分裂)−1h−115℃和21℃时,细胞分裂率分别为0.085和0.095−1h−1分别)。虽然这些速率低于生长动力学实验的模型预测(生长V马克斯(应用): 0.0699和0.0612细胞分裂细胞−1h−18°C和27°C时,细胞分裂率分别为0.1128和0.1044−1h−1在15°C和21°C时),不同温度下的速率之比相似。这证实了温度反应是一致的,因此在实验之间具有可比性,因此我们继续从培养的细胞中提取转录组学的总核酸。在RNA纯化之前,我们测量了RNA和DNA的数量。每10个DNA数量8细胞在不同温度之间没有显著差异(p> 0.08),而RNA数量在所有温度之间存在显著差异(p< 0.05), 21和15°C除外(p= 0.06), 15°C和21°C时RNA含量最高,27°C和8°C时RNA含量次之。2 bB:表B12).相应的,RNA与DNA的比例m . tundripaludumSV96T在8°C、15°C、21°C和27°C时,其平均值分别为2.3、3.7、3.6和2.8。2摄氏度B:表B12)和RNA:DNA的比例在8°C和27°C时明显低于15°C和21°C时(p< 0.05)。细胞总RNA的变化反映了核糖体RNA (rRNA)的变化,因为大多数细菌RNA是rRNA (82-90%) [56].核糖体RNA可构成高达20%的细胞干重[57]和核糖体蛋白质占总蛋白质的20-40% [40].因此,调节细胞核糖体浓度是优化生长速率的关键因素大肠杆菌[40].我们的研究结果表明m . tundripaludumSV96T在允许生长的温度范围的较高一端(27°C)和较低一端(8°C)降低其细胞rRNA浓度,同时在最佳范围(15和21°C)保持相似的浓度。同样,在大肠杆菌,细胞核糖体浓度在生长最佳温度附近保持不变,但在较高和较低的温度下下降,因为一些资源被转移到其他生理过程,包括应激反应,这些过程是在次最佳条件下维持高生长速率所必需的[58].
中枢碳和能量代谢
确定除了rRNA之外,哪些生理成分在热适应中被调节m . tundripaludumSV96T,我们对不同温度下的3个mRNA富集转录组进行测序(图S2),共得到12个mRNA文库。rRNA缺失后,mRNA的比例从30到99%不等,留下220万到1530万个mRNA reads与rRNA对齐m . tundripaludumSV96T基因组(SD B: Table B .13).
我们观察到编码pMMO和甲醇脱氢酶的基因在15°、21°和27°C与8°C相比出现了上调(上调或基因表达增加指转录数显著增加)(图。3.C:表C1).高氧化率(V马克斯(应用))在8°C(图S4尽管pMMO低表达(图;3.)和在此温度下每个细胞的核糖体更少(图。2 b)相对于21°C和27°C(图S4),建议m . tundripaludumSV96T可携带低温适应的pMMO。高pMMO表达组合(图;3.)和高细胞核糖体含量(图;2)对应的细胞CH值最高4氧化速率(V马克斯(应用)= 0.36 μ mol CH4108细胞−1h−1(图S .4).然而,在21°C时,与15°C时相似的高核糖体含量和pMMO表达导致细胞V低得多马克斯(应用)(无花果。4),亦支持适合低温环境的pMMO。也许高温下低效率的pMMO是pMMO基因在高于8℃温度下整体较高表达的原因之一。
热图显示在8、15、21和27°C时转录组中转录本相对丰度的变化。色度反映了z-评分归一化相对丰度,黑色是相对丰度最低,其次是灰色、黄色、橙色和红色,对应于相对丰度的增加。显著差异(p转录本相对丰度< 0.05)在每张热图右侧的正方形图中显示,紫色表示从左向右分别在15°C和8°C、21°C或27°C之间存在显著差异。橙色表示8°C与21°C和27°C之间有显著差异。深蓝色表示21°C和27°C之间的显著差异。所有p使用Wald检验估计值,在DESeq2中实现,并使用Benjamini Hochberg校正(调整错误发现率)对多次测试进行校正。代谢途径中的紫色箭头表示在15°C时上调,这意味着至少有一种编码负责催化这一途径步骤所代表的反应的酶的基因在15°C时比在其他两种或三种温度下表达显著更高。热图旁边的数字为SD中对应的基因C: Table C1以及对应的代谢步骤如图所示。所有的调整p值,归一化计数,基因组id(一个唯一的标识符,允许跟踪每个基因到基因组注释中可用https://mage.genoscope.cns.fr/microscope),基因的完整蛋白质名称和E.C.编号载于SD C:表C1.
我们观察到在15°C时nadh生成的四氢甲蝶呤(H4MPT)通路,用于C1在甲醛氧化过程中转化为CO2(无花果。3.).这可能意味着更高的节能率。然而,氧化磷酸化在15°C没有一致的上调(图。3.).相反,我们观察到在不同温度下,具有相同功能的不同酶系统的基因表达增加(例如,NADH脱氢酶复合体I的NUO和NQR版本)。同工酶,具有不同氨基酸序列的酶,催化相同的反应,以前被认为是微生物热驯化的重要组成部分[27,59].然而,具有氧化磷酸化作用的不同功能相似但非同源酶系统的离散功能作用通常不被很好地理解[60].
在15°C时,我们也观察到大量来自CH的基因上调4通过核酮糖单磷酸途径(RuMP)果糖二磷酸分支1 (FBP 1)进行核苷酸生物合成的氧化(图。3.).考虑到核苷酸是RNA的主要组成部分,这与15°C的高细胞RNA含量相匹配(图2)。2 b).
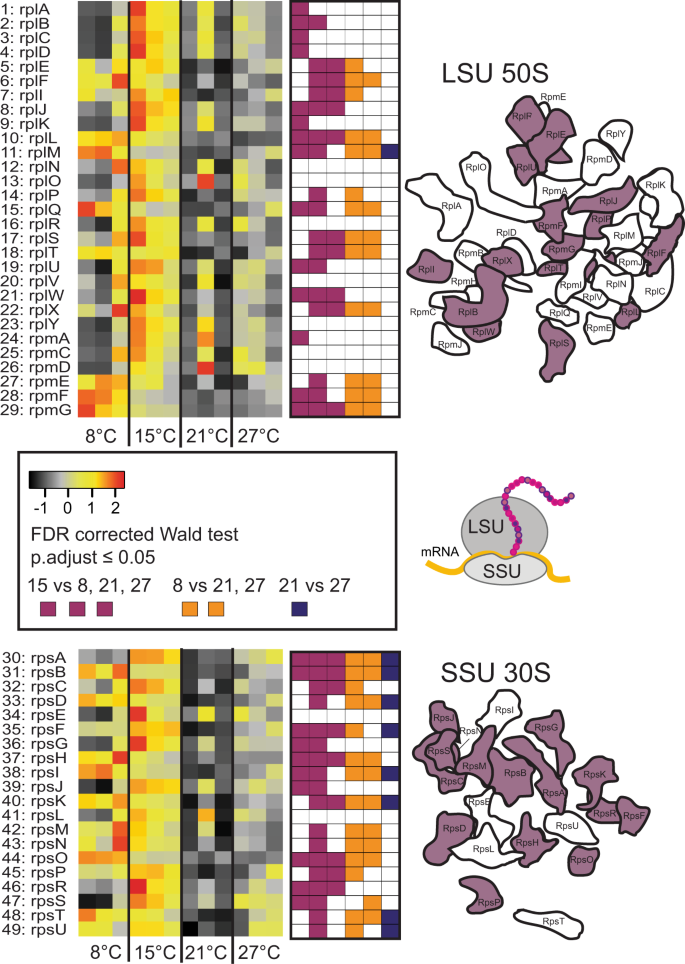
核苷酸的生物合成、转录和翻译
核苷酸生物合成途径分别从三羧酸循环和RuMP接收前体2- oxo -戊二酸和d -核酮糖- 5p。我们观察到,在这两种前体的核苷酸生物合成所需的46个途径步骤中,有30个在15°C下上调,与RuMP上调核苷酸生物合成相匹配(图S .)8C:表C2).在编码dna定向RNA聚合酶的基因中,只有β亚基,rpoB(α;rpoA,β”;rpoC,β;rpoB)在15°C时上调(图S9C:表C3.).组成RNA降解体的四种酶中的三种的基因;RNase E,烯醇化酶和Pnpase(多核苷酸磷酸化酶);在15°C时也上调(图S9).只有一个基因编码依赖ATP的RNA解旋酶(rhlB),在15°C时上调(尽管与8°C无关),rhlE不是。此外,编码蛋白质折叠酶的基因(groE,groL,dnaK)在15°C时上调(图S9).在15°C下,这些对转录、RNA降解和蛋白质折叠的投资增加与小亚基(SSU)和大亚基(LSU)核糖体蛋白基因的整体上调相匹配,在15°C下,29个LSU蛋白中有15个和19个SSU蛋白中有14个的表达显著升高(图2)。4C:表C4).在15°C相对于其他温度下,许多单个氨基酸生物合成途径步骤的基因上调(79步中的43步)进一步支持了这一点(图S10C:表C5).这些发现与之前对基因翻译、氨基酸生物合成、核苷酸代谢和蛋白质代谢的转录调节的观察结果一致大肠杆菌暴露在不断变化的温度下[61,62].这些基因的上调m . tundripaludumSV96T仅在15°C下观察(图。4,年代8,年代9,年代10),而在15°C和21°C时发现了相似的细胞rRNA浓度(图。2).因此,似乎要在15°C和21°C保持相似的细胞rRNA浓度和相似的生长速率,细胞必须以不同的方式调整其基因表达。在这种情况下,重要的是要注意,蛋白质生物合成机制基因在15°C的整体上调也并不意味着我们在15°C发现了最高的蛋白质合成速率。原因是所有的合成速度,包括核糖体和蛋白质的合成,都直接受到温度的影响[58].然而,这确实意味着在15°C下,相对于在没有上调的情况下,在15°C下获得的蛋白质生物合成速率更高。这种催化补偿是有代价的。这可能是CH下生长效率较低的原因之一4饱和度在15°C,相对于21°C(图。1和S4).也许在15°C和21°C时,相似的细胞rRNA浓度和生长速率只是由于细胞CH的增加4在15°C的温度下消耗更多的蛋白质生物合成。低温下的催化补偿也被观察到,例如,在ATP合成和CO的上调2RuBisCO在细菌和植物中的固定[34,63],并被认为是细菌对土壤变暖的反应的一部分[42].
热图显示在8、15、21和27°C时转录组中转录本相对丰度的变化。色度反映了z-评分归一化相对丰度,黑色是相对丰度最低,其次是灰色、黄色、橙色和红色,对应于相对丰度的增加。显著差异(p转录本相对丰度< 0.05)在每张热图右侧的方图中显示,紫色表示从左向右分别在15°C与8°C、21°C和27°C之间存在显著差异。橙色表示8°C与21°C和27°C之间有显著差异。深蓝色表示21°C和27°C之间的显著差异。所有p使用Wald检验估计值,在DESeq2中实现,并使用Benjamini Hochberg校正(调整错误发现率)对多次测试进行校正。热图右侧核糖体蛋白可视化中紫色的核糖体蛋白表明编码这些蛋白的基因在15℃下的表达明显高于其他两种或三种温度下。核糖体蛋白概述修改自[74].所有的调整p值,归一化计数,基因组id(一个唯一的标识符,允许跟踪每个基因到基因组注释中可用https://mage.genoscope.cns.fr/microscope),蛋白质全名见SD C:表C4.Rpl和rpm:大核糖体亚单位蛋白;Rps:小核糖体亚单位蛋白。核糖体漫画部分基于先前的插图[42].热图旁边的数字为SD中对应的基因C: Table C4.
糖原存储
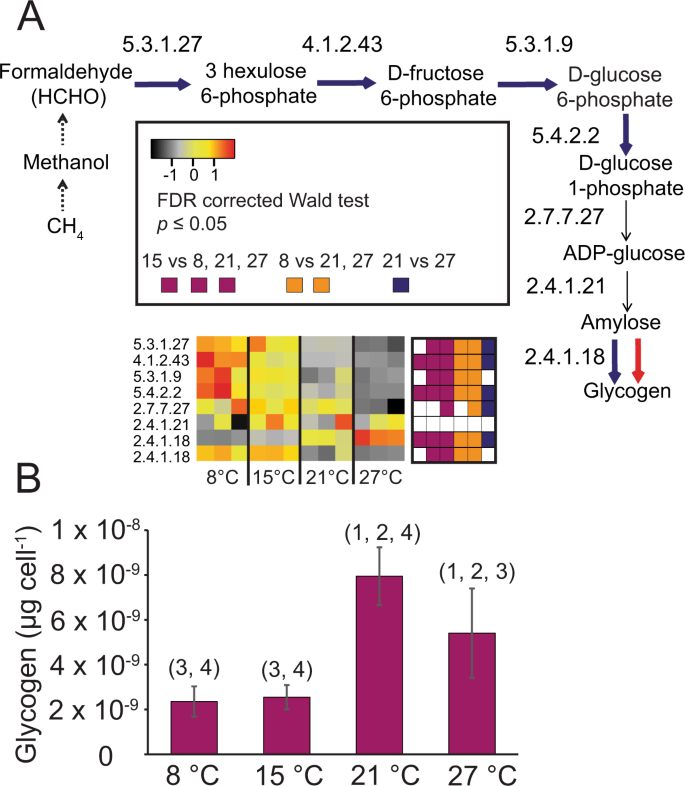
已知有几种细菌储存多余的碳和能量,例如糖原或PHA [64],而温度对储存的影响已在之前观察到[37].的转录组m . tundripaludumSV96T对于碳储存途径基因,我们确定了从CH开始的所有步骤4氧化,通过初始步骤的RuMP-FBP(图;3.),到糖原合成(图。5C:表C6).从甲醛开始,在8°C和15°C下,产生糖原所需的8个步骤中的6个的基因被上调(图。5).然而,对于由1,4-葡聚糖分支酶(EC: 2.4.1.18)催化的从直链淀粉到糖原的最后一步,我们计算了两个基因副本。这些拷贝以与温度相反的模式表达(图2)。5),表明这是糖原合成的重要调节步骤。这也使我们质疑表达模式是否真的意味着糖原合成在低温下上调。因此,在后续实验中,在指数期(与转录组学中收获的细胞的生理状态相同)收获细胞,以测量细胞糖原。我们可以发现,细胞在21°C时积累的糖原浓度最高,其次是27°C、15°C和8°C(图2)。5 bB:表B14).因此,我们的测量结果只匹配了编码1,4- α -葡聚糖分支酶的一个基因拷贝的转录模式,而不是该途径中基因的整体表达模式(图4)。5).
糖原合成的基因表达(一个),以及每个细胞的糖原累积量(B)m . tundripaludumSV96T.热图(一个)表明在8、15、21和27℃时,转录组中转录本的相对丰度发生了变化。色度反映了z-评分归一化相对丰度,黑色是相对丰度最低,其次是灰色、黄色、橙色和红色,对应于相对丰度的增加。显著差异(p转录本相对丰度< 0.05)在每张热图右侧的方图中显示,紫色表示从左向右分别在15°C与8°C、21°C和27°C之间存在显著差异。橙色表示8°C与21°C和27°C之间有显著差异。深蓝色表示21°C和27°C之间的显著差异。所有p值用Wald检验估计,在DESeq2中实现,并使用Benjamini Hochberg校正(调整错误发现率)对多次测试进行校正。蓝色箭头表明,编码负责催化该途径步骤所代表的反应的酶的基因中至少有一个在8°C下的表达明显高于在其他两种或三种温度下的表达。红色箭头表示在27℃时表达显著增加。所有的调整p值,归一化计数,基因组id(一个唯一的标识符,允许跟踪每个基因到基因组注释中可用https://mage.genoscope.cns.fr/microscope),蛋白质全名见SD C:表C6.柱状图(B)显示在指数培养状态下每个细胞的µg糖原,由已知细胞数量的细胞裂解液估计。考虑到不完全裂解的可能性,这些数字可能是保守估计。误差条表示标准偏差。柱状以上的数字表示与其他柱状有显著差异(p< 0.05)。
生长、细胞膜、细胞壁和胞外多糖的调节
在观察了几个中心细胞机制对不同温度的调整后,我们调查了那些与生长最直接相关的功能。FtsZ是参与细菌细胞分裂的关键细胞骨架蛋白,在分裂位点形成收缩结构z环[65,66].FtsZ及相关蛋白的相对基因表达模式反映了不同温度下培养物的生长速度,15℃和21℃表达量相近,8℃和27℃表达量较低(图S .)11C:表C7).这进一步对应于15°C和21°C下细胞壁合成基因的上调(图S12个一个C:表C8).在27°C时,我们观察到胞外多糖基因的强烈上调(图S12个一个C:表C8).作为m . tundripaludumSV96T生长温度不得高于30°C [47],这些反应可能反映了在高温下生存所需的调整。胞外多糖表达的增加通常与次优条件有关,包括超出生长最佳范围的温度[67,68]并可作为微生物的低温保护剂[69].外多糖还被认为通过加强细胞的结构完整性来保护细胞免受高温的影响[69].相反,脂肪酸去饱和以增加膜流动性是暴露在低温下的细菌的常见反应,例如,[31,70].相应的,我们观察到脂肪酸去饱和酶显著上调(desA)在8°C和15°C,相对于21°C和27°C(图S12 bC:表C8).
热适应的影响
在本研究中,我们展示了广泛分布的甲烷营养菌属的三个成员不同的热适应策略Methylobacter.我们还证明了温度对生长和CH的影响4消费量取决于CH4浓度,还有CH4氧化速率与温度和生长无关。这意味着在某些情况下,较高的温度可以导致更有效地生长甲烷养菌,从而氧化更少的CH4每个单元格随时间变化。如果这种甲烷养菌的生长应进一步受到例如养分或氧气限制的抑制,则升高温度可能导致CH降低4在一些生态系统中,氧化率很高,尽管微生物本身更适应更高的温度。这些反直觉的见解可以解释为什么温度对CH有影响4自然界中的氧化率变化很大。此外,我们还对CH热驯化背后的生理调节提供了见解4氧化而生长,专注于m . tundripaludumSV96T.这些生理调节包括细胞大小、蛋白质生物合成机制、糖原储存、细胞分裂和胞外多糖表达的变化。
考虑到全球气温变化的规模,包括日、季节和长期气候变化,甲烷养菌的热驯化可能对全球CH产生相当大的影响4骑自行车。我们证明了温度对CH4消耗与不同菌株在热适应过程中如何调整其生理直接相关。此外,热适应策略和温度对CH的影响存在较大差异4菌株之间的消耗也表明,群落的变化可能对生物CH的大小产生重大影响4下沉。
材料与方法
文化
在种群培养维护、预培养和实验过程中,m . tundripaludumSV96T[47),Methylobactersp. G7(未发表),以及Methylobacter危害ACM 3304T[71]在pH为6.8的微量硝酸盐盐(NMS)培养基中培养[72](参见[73]用于微量元素溶液)。看到补充信息(SI)方法部分,小节“文化”的更多信息。
适应环境
在驯化过程中,将细胞培养在NMS培养基中,空气浓度为~80%,CH浓度为~20%4(100% CH4在8、15、21和27°C (m . tundripaludumSV96T而且m .危害ACM 3304T),或4、8、15及21℃(Methylobacter(图S . G72).培养物的驯化时间通常超过10代(7-12天)。在驯化和实验期间,培养物以50转/分钟的速度在水平位置摇晃。在150 rpm转速下进行了一些控制实验,以测试对传质限制的影响。有关更多信息,请参阅SI方法小节“适应”。
振动速度和传质限制
由于底物溶解度低,消耗气体的菌株可以经历传质限制。参见SI方法,小节“震动速度和传质限制”。,以了解更多关于我们如何解释传质限制的信息。
细胞生长实验
从驯化指数相的样本m . tundripaludumSV96T培养(75 ml),密度为1-3 × 107细胞毫升−1每个温度22毫升转移到三个125毫升的玻璃瓶中。然后准备瓶顶空间的80%空气和20% CH4压力为1.3 atm。这导致溶解的CH为0.36-0.51 mM4,视温度而定,高于CH的阈值4饱和的m . tundripaludumSV96T在这个密度(0.1 mM CH4;无花果。4 b).在8、15、21和27°C和50 rpm的条件下孵育瓶子(图S2)或150转(图S2 e)长达36小时。参见SD B:表B11B16每个实验的孵育时间和采样时间点。在时间零和各自的采样间隔,将300 μ L细胞悬液(一式两份)转移到Nunclon Delta Surface plate (Thermo Scientific, Waltham, MA, USA),并在600 nm(稀释的NMS介质为空白)下测量光密度(Spectra Max 250 microplate reader, Molecular Devices, San José, CA, USA)。用于光密度测量(OD600),从测量值中减去空白。
CH4氧化动力学和生长动力学
密度为5 × 10的驯化指数相培养的子样品7细胞毫升−1用125 mL玻璃瓶(21.6 mL)对CH4七种不同CH的氧化速率和生长速率4浓度和四种不同的温度(8、15、21和27°C)m .危害ACM 3304T而且m . tundripaludumSV96T4、8、15、21℃Methylobactersp。七国集团(G7))。七个CH中的每一个我们都用了三个等分4浓度,每个温度总共21瓶。在四种温度下,每个菌株总共有84瓶(图S2A, B, C, F, G).对于每个温度,每个CH制备两个阴性对照(无细胞培养基),装在125 mL玻璃瓶中4浓度(每个菌株共56个阴性对照)。阴性对照均未显示非生物性CH4消耗或泄漏。生成7个不同的CH4浓度,七体积(200µL;600µL;1、5毫升;3毫升;6毫升;12毫升;15毫升)100% CH4使用塑料注射器(BD Plastipak, Franklin Lakes, NJ, USA)和无菌0.5 × 16毫米针头(BD Microlance, Franklin Lakes, NJ, USA)从多层聚丙烯气囊(RESTEK, Bad Homburd vor der Höhe, Germany)中注射。CH的最终顶空浓度4在1000到130,000 p.p.m.v.之间,而CH的溶解浓度4范围在1.5到260µM之间,也取决于温度。然后,通过注入额外的空气量,将瓶中的气体压力调整到20°C下的总顶空压力~1.3 atm。参见SI方法,小节“CH”4氧化动力学和生长动力学”以获取更多信息。
糖原量化
细胞在20% CH条件下驯化培养4在空气中如上所述。5个复制瓶,20ml培养物和20% CH4在空气中,每温度在黑暗中摇50转,5瓶,起始细胞浓度为~1 × 107细胞毫升−15个密度为~1 × 108细胞毫升-1.在15°C和21°C下培养48小时足以达到高密度指数生长阶段,在27°C和8°C下分别需要60和90小时才能达到相同的细胞密度。在收获过程中,从密集培养物中抽取2ml培养物进行糖原测量,从稀释培养物中抽取10ml培养物进行糖原测量。样品按照制造商的建议进行处理(糖原测定试剂盒,ab65620, Abcam, Cambridge, UK)。糖原定量使用平板阅读器(GloMax Explorer, Promega, Madison, WI, USA)。更多信息请参见SI方法小节“糖原定量”。
OD600到单元数的转换和单元大小
为了使速率与细胞数归一化,使用与光密度(OD)相关的标准曲线600)到细胞数量的变化:m . tundripaludumSV96T,m .危害ACM 3304T而且Methylobacter对于尺寸估计,使用Carl Zeiss AxioObserver Z1与100倍物镜和Bright-Field进行可视化,并使用AxioVision SE64 Rel 4.9.1软件中提供的尺寸估计工具进行测量。如前所述,通过将培养物驯化至8和21°C来制备用于大小估计的培养物,然后进行培养至指数阶段并收获用于大小估计。有关更多信息,请参阅SI方法,小节“OD600到细胞数的转换和细胞大小”。
计算
在指数增长期间,具体增长率计算为光密度对时间的自然对数的斜率。CH的混合比例4和有限公司2通过与认证标准的比较计算。大量的顶空和溶解的CH4及CO总量2由CH在不同温度下的混合比例计算4和有限公司2利用亨利定律,假设一个理想状态,知道环境压力,温度,瓶顶空间体积,顶空间压力,液体体积,以及气体各自的温度依赖性溶解度常数。所有计算都考虑了去除气体和液体进行测量。我们计算了CH4氧化和一氧化碳2线性模型斜率的产量拟合到实验期间测量的浓度,并调整到培养细胞的数量。生长效率是通过乘以特定的生长(细胞分裂细胞−1h−1)率108然后除以CH4氧化速率(µmol CH4氧化108细胞−1h−1)以每µmol CH给予细胞分裂4氧化了。用于估计生长效率的数据是非线性Michaelis-Menten回归模型中每个测量时间点的预测值。有关具体增长率的估计,CH4CH的氧化和生长效率4饱和,V马克斯(应用)使用从Michaelis-Menten动力学模型预测的值(见下文V马克斯(应用)估计)。有关更多信息,请参阅SI方法小节“计算”。
生理数据统计
参见SI方法小节“生理数据的统计”,以获得所使用方法的完整描述。
RNA和DNA提取,测序
六种文化m . tundripaludumSV96T在8°C、15°C、21°C或27°C的温度下进行驯化。驯化后,将培养物培养到足够的细胞密度,以指数期生长提取。在8°和27°C下培养36小时,在15°和21°C下培养16小时,然后收集RNA和DNA提取。更多信息请参见SI方法,小节“RNA和DNA提取和测序”。
计算分析
参见SI方法小节“计算分析”,以获得用于分析转录组的方法的完整描述。
地图
请参阅SI方法小节“地图”以获得所使用方法的完整描述。
数据可用性
本研究的RNA-seq数据已存入NCBI短读档案(SRA),项目编号PRJNA390985。12个数据集各自的实验标识号见SD B: Table B13.RNA-seq预处理、基因表达分析、统计测试、建模和R中的可视化脚本在线提供(“来自甲基杆菌属的甲烷养菌的热驯化”,https://doi.org/10.18710/Z1QF8WDataverseNO)。生理数据在SD b中提供。处理和归一化的转录本计数和差异基因表达分析的统计数据在SD C中提供。
参考文献
Hanson RS, Hanson TE。Methanotrophic细菌。微生物学,1996;60:439-71。
杨志伟,陈志伟,陈志伟,等。好氧甲烷养菌的多样性与系统发育。In: Kalyuzhnaya MG, Xing X-H。编辑器。甲烷生物催化:为可持续发展铺平道路。湛:施普林格国际出版;2018.17-42页。
以pmoA为分子标记评价培养和未培养好氧甲烷菌的多样性和生境偏好。前沿微生物,2015;6:1346。
杨晓明,陈晓明,杨晓明,杨晓明,杨晓明。高北极地区泥炭土壤有机碳转化过程中微生物的研究进展。《中国日报》2013;7:299-311。
马蒂诺C,怀特LG,格里尔CW。加拿大高纬度北极地区土壤甲烷营养细菌多样性和活性的稳定同位素探测分析。应用环境微生物学。2010;76:5773-84。
何瑞,吴乐,王志强,王志强,等。使用稳定同位素探测在北极湖泊沉积物中功能活性好氧甲烷养菌的鉴定。环境科学学报。2012;14:1403-19。
diesel M, Broemsen ELJE, Cameron KA, King GM, Achberger A, Choquette K,等。格陵兰冰盖西部边缘下甲烷循环的分子和生物地球化学证据。Isme j . 2014; 8:2305-16。
Luke C, Frenzel P, Ho A, Fiantis D, Schad P, Schneider B,等。甲烷氧化细菌的宏观生态学:细菌的多样性pmoA热带和亚热带稻田的基因型。环境微生物学报。2014;16:72-83。
桑德I,巴斯维肯D,特兰维克LJ。温带湖泊中上层甲烷氧化细菌的丰度、活性和群落结构。应用环境微生物学。2005;71:6746-52。
Meyer-Dombard DAR, Bogner JE, Malas J.垃圾填埋场微生物学和生态学综述:对“下一代”技术现代化的呼吁。前沿微生物,2020;11:11 127。
Smith GJ, Angle JC, Solden LM, Borton MA, Morin TH, Daly RA,等。属的成员Methylobacter推断淡水湿地含氧土壤中甲烷氧化的主要原因。mBio。2018; 9: e00815 - 00818。
Rosentreter JA, Borges AV, Deemer BR, Holgerson MA,刘s,宋c,等。全球甲烷排放量的一半来自高度可变的水生生态系统来源。地理学报。2021;14:225-30。
马伟伟,李志强,李志强,李志强。亚北极泥炭地热喀斯特湖泊的高甲烷排放。海洋科学进展。2016;61:S150-S164。
Abdalla M, Hastings A, Truu J, Espenberg M, Mander Ü, Smith P.北部泥炭地甲烷排放:管理影响的回顾和对未来管理选择的影响。生态环境学报。2016;6:7080-102。
Rainer EM, Seppey CVW, Tveit AT, Svenning MM.甲烷营养种群和CH4高北极泥炭的氧化势因草食引起的植被变化而改变。中国生物医学工程学报(英文版)。
Angle JC, Morin TH, Solden LM, narwe AB, Smith GJ, Borton MA,等。含氧土壤甲烷生成是湿地甲烷排放的重要组成部分。Nat Commun. 2017;8:1567。
Raney PA, Fridley JD, Leopold DJ。湿地小气候特征与植物群落变化湿地。2014;34:43-53。
魏伟民,杨晓东,杨晓东,杨晓东,杨晓东。挪威斯瓦尔巴群岛高北极永久冻土年地表能量收支研究。冰冻圈。2009;3:245 - 63。
刘霞,罗涛。藏东南色金拉山区两个对比树带界线交错带土壤温度和水分时空变异特征。南极北极,2011;43:229-38。
林志伟,李志伟。土壤温度的水平和垂直变化。geoosci Data J. 2017; 4:40-46。
王晓明,王晓明,王晓明,等。北方垃圾填埋场表层土壤甲烷氧化对温度和水分的响应。土壤生物化学。2007;39:1156-64。
李娟,徐旭,刘超,吴楠,孙智,何霞,等。海洋环境中活性甲烷养菌及其对温度的响应:实验研究。海洋科学学报,2021;9:1261。
郑杰,杨震,顾波,伍尔schleger SD, Graham DE.温度和土壤特征对北极苔原甲烷生成和氧化的影响。Biogeosciences。2018;15:6621-35。
王格明,阿达姆森。温度对森林土壤和甲烷营养菌纯培养中甲烷消耗的影响Methylomonas rubra.应用环境微生物学。1992;58:2758-63。
Rainer EM, Seppey CVW, Hammer C, Svenning MM, Tveit AT。地上草食对北极土壤甲烷养菌对增加CH响应的影响4浓度和温度。微生物。2021;9:2080。
Whalen SC, Reeburgh WS。CH的湿度和温度敏感性4北方土壤中的氧化。土壤生物学。1996;28:1271-81。
布拉德福德。变暖土壤中分解者群落的热适应。《前沿微生物》2013;4:333。
Hochachka PW。生化适应:生理进化的机制和过程。在:Somero GN,编辑。牛津:牛津大学出版社;2002.
Siddiqui KS, Poljak A, Guilhaus M, De Francisci D, Curmi PM, Feller G,等。赖氨酸与精氨酸在酶冷适应中的作用:将赖氨酸修饰为高精氨酸稳定冷适应α -淀粉酶Pseudoalteramonas haloplanktis.蛋白质。2006;64:486 - 501。
洛佩斯-加西亚P,齐万诺维奇Y,德尚P,莫雷拉D.细菌基因输入和中温适应。科技导刊。2015;13:447-56。
Marr AG, Ingraham JL。温度对大肠杆菌脂肪酸组成的影响。细菌学杂志。1962;84:1260-7。
Yamaguchi-Shinozaki K, Shinozaki K.细胞对脱水和冷胁迫的应答和耐受性的转录调节网络。植物学报。2006;57:781-803。
李志刚,李志刚。基因表达与环境变化的关系:从快速反应到进化适应。Nat Rev Genet, 2008; 9:583-93。
阿马托P,克里斯特纳BC。低温和冰冻条件下的能量代谢响应Psychrobacter cryohalolentis.应用环境微生物学。2009;
韦贝WJ,谢尔登WM,波默罗伊LR。细菌在寒冷中生长:增强底物需求的证据。应用环境微生物学。1992;58:359-64。
李志强,李志强,李志强。气候变暖对北极泥炭菌群甲烷产量的影响。美国国家科学研究院。2015; 112: e2507 - 2516。
Pérez R, Cantera S, Bordel S, García-Encina PA, Muñoz R.培养富集过程中温度对甲烷化聚羟基烷酸生产的影响。2019; 140:144-51。
王敏,刘强,康旭,朱智,杨辉,席旭,等。glgBXCAP操纵子单基因突变导致的糖原代谢障碍改变了患者的生存率大肠杆菌在各种环境压力下。前沿微生物。2020;11:588099。
兰刚,涂勇。细菌信息处理:记忆、计算和统计物理:一个关键问题综述。2016; 79:052601-052601。
博斯德里兹,D,莫伦娜,B,布鲁格曼。快速生长的细菌如何强有力地调整它们的核糖体浓度,以接近生长速率的最大化。Febs j . 2015; 282:2029-44。
Ryals J, Little R, Bremer H. RNA合成参数的温度依赖性大肠杆菌.《细菌杂志》,1982;151:879-87。
Söllinger A, Séneca J, Dahl MB, Motleleng LL, Prommer J, Verbruggen E,等。细菌蛋白质生物合成机制的下调,以应对数周、数年和数十年的土壤变暖。科学通报2022;8:eabm3230。
Esson KC, Lin X, Kumaresan D, Chanton JP, Murrell JC, Kostka JE。在酸性北方泥炭沼泽中,α -和γ -变形菌甲烷养菌共同支配着活跃的甲烷氧化群落。应用环境微生物学。2016;82:2363-71。
Tveit AT, Hestnes AG, Robinson SL, Schintlmeister A, Dedysh SN, Jehmlich N,等。广泛分布的土壤细菌,氧化大气中的甲烷。美国国家科学研究院。2019; 116:8515-24。
Bodelier PLE, Pérez G, Veraart AJ,克劳斯SMB(2019)。甲烷营养生物生态学、环境分布与功能。在:李EY编辑。甲烷养菌:微生物学基础与生物技术应用。湛:施普林格国际出版;2019.1-38页。
Thompson LR, Sanders JG, McDonald D, Amir A, Ladau J, Locey KJ,等。公共目录揭示了地球上多尺度微生物的多样性。大自然。2017;551:457 - 63。
Wartiainen I, Hestnes AG, McDonald IR, Svenning MM。Methylobacter tundripaludumsp. nov.,一种来自挪威斯瓦尔巴群岛(78°N)北极湿地土壤的甲烷氧化细菌。国际微生物学报,2006;56:109-13。
雷迪KR, Rai RK,绿色SJ, Chetri JK。温度对垃圾填埋场表层土壤甲烷氧化及群落组成的影响中国生物医学工程学报。2019;46:1283-95。
朱勇,Purdy KJ, Eyice Ö,沈L, Harpenslager SF, Yvon-Durocher G,等。实验变暖引起的淡水甲烷排放不成比例的增加。气候变化。2020;10:685-90。
李国强,李国强,李国强。γ变形菌门甲烷养菌(Gammaproteobacterial Methanotrophs)的系统基因组学分析Methylococcales)要求在属和种层面重新划分成员。前沿微生物,2018;9:3162。
利普森哒。微生物生长速率和产量之间的复杂关系及其对生态系统过程的影响。前沿微生物,2015;6:615。
鲍曼JP。这个家庭Methylococcaceae.在:罗森博格E,德隆EF,洛里S,斯塔克布兰特E,汤普森F,编辑。原核生物:γ -变形菌门。柏林,海德堡:施普林格柏林海德堡;2014.411 - 40页。
Yvon-Durocher G, Allen AP, Bastviken D, Conrad R, Gudasz C, St-Pierre A,等。甲烷通量在微生物和生态系统尺度上表现出一致的温度依赖性。大自然。2014;507:488 - 91。
Skau LF, Andersen T, Thrane JE, Hessen DO。生长、化学计量和细胞大小;裸植体对温度和养分的响应。PeerJ。2017; 5: e3743。
李志刚,李志刚,李志刚。温度对尺寸和形状的影响大肠杆菌细胞。《微生物学》,1982;131:235-40。
Blazewicz SJ, Barnard RL, Daly RA, Firestone MK.评估rRNA作为环境群落中微生物活性的指标:局限性和用途。Isme j . 2013; 7:2061-8。
范梅泽J, Ludwig J, Nieß A, siemmann - herzberg M.量化核糖体动力学大肠杆菌使用荧光。FEMS微生物学杂志2017;364:fnx055。
Mairet F, Gouzé J-L, de Jong H.微生物生长规律的最优蛋白质组分配和温度依赖性。npj系统生物学应用。2021;7:14。
德国DP, Chacon SS, Allison SD。底物浓度和酶的分配会影响微生物分解的速度。生态。2011;92:1471 - 80。
Hreha TN, Foreman S, Duran-Pinedo A, Morris AR, Diaz-Rodriguez P, Jones JA,等。铜绿假单胞菌的三种NADH脱氢酶:它们在能量代谢中的作用和与毒力的联系。PLOS ONE。2021; 16: e0244142。
松本勇,村上勇,张志刚,张志刚,张志刚。细菌生长速率协调转录组重组研究。中国生物医学工程学报,2013;
加吉尔M,卡普尔V,胡W-S。转录反应大肠杆菌到温度转换。生物技术,2005;21:689-99。
Holaday AS, Martindale W, Alred R, Brooks AL, Leegood RC。低温胁迫下植物叶片碳代谢酶活性的变化植物科学学报。1992;98:1105-14。
威尔金森摩根富林明。细菌中能量储存化合物的问题。Exp Cell res 1959; 7:111-30。
李志刚,李志刚。细菌细胞分裂:环的循环。细胞。1997;88:581-4。
Männik J, Walker BE, Männik J.细胞周期依赖性的FtsZ调控大肠杆菌在生长缓慢的条件下。微生物学杂志,2018;
乳酸菌杂多糖。微生物学,1999;23:153-77。
Poli A, Anzelmo G, Nicolaus B.来自极端海洋生境的细菌胞外多糖:生产,表征和生物活性。3月药物。2010;8:179 - 802。
李志强,王志强,王志强,等。一种冰川细菌高产出低温保护胞外多糖。前沿微生物。2020;10:3096。
Gounot。细菌在低温下的生命:生理方面和生物技术意义。中国生物医学工程学报。1991;21(2):366 - 366。
李志强,李志强,李志强,李志强。中国产甲烷养菌的分类研究Methylobactergen. nov.,修订甲基球菌属,验证Methylosinus而且Methylocystis物种,以及家族的提议Methylococcaceae只包括I类甲烷养菌。中国生物医学工程学报。1993;43(3):339 - 339。
Whittenbury R, Phillips KC, Wilkinson JF。甲烷利用细菌的富集、分离及一些性质。中华微生物学杂志。1970;61:205-18。
芬尼格·n·贝奥巴赫通根über das Schwärmen von着色菌属okenii.Arch für微生物生物学。1962;42:90-5。
Feliciano JR, Seixas AMM, Pita T, Leitão JH。植物rna结合蛋白的比较基因组学和进化分析伯克cenocepaciaJ2315和其他成员不过复杂。基因。2020;11:231。
确认
这项工作得到了挪威研究委员会FRIPRO Mobility资助项目Time & Energy 251027/RU的支持,由欧洲研究委员会(ERC)根据玛丽居里资助协议no 608695共同资助。特罗姆瑟研究基金会启动资助项目“冷中的细胞17_SG_ATT”和挪威研究委员会青年研究人员资助项目“生活在空气中的315129”。计算是在uninet Sigma2提供的资源上进行的——挪威国家高性能计算和数据存储基础设施,编号为:NN9639K和NS9593K。我们感谢Tilman Schmider在图形设计方面的帮助。
作者信息
作者及隶属关系
贡献
ATT和MMS构想了这项研究。ATT根据所有作者的输入设计实验。AD和AGH维持了培养。EMR、AD、AGH进行实验。ATT分析了数据并创建了图表。AS分析了来自地球微生物组项目的16s rRNA基因数据,并根据ATT的输入创建了地图和相关图表。ATT使用AS的文本和所有作者的评论撰写了这篇论文。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Tveit, a.t., Söllinger, A., Rainer, E.M.et al。该属甲烷养菌的热驯化Methylobacter.ISME J(2023)。https://doi.org/10.1038/s41396-023-01363-7
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41396-023-01363-7