摘要gydF4y2Ba
Rett综合征(RTT)是一种严重的神经发育障碍,主要由x连锁基因的杂合性功能丧失突变引起gydF4y2BaMECP2gydF4y2Ba这是一个全球性的转录调控因子。MECP2甲基- cpg结合域(MBD)的突变破坏了它与甲基化DNA的相互作用。在这里,我们调查小说的影响gydF4y2BaMECP2gydF4y2Ba与重症患者相比,非典型RTT保留言语患者MBD中L124W错义突变gydF4y2BaMECP2gydF4y2Ba零突变。由于结合动力学降低,L124W蛋白破坏异色色中心的能力有限。我们分离了两对等基因WT和L124W诱导多能干细胞。L124W诱导的兴奋性神经元表达稳定蛋白,输入电阻增加,电压门控钠降低gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流,他们的神经元形态局限于降低树突的复杂性。三对等基因的gydF4y2BaMECP2gydF4y2BaNull神经元具有预期的更为极端的形态和电生理表型。我们检查了L124W和的发展和成熟gydF4y2BaMECP2gydF4y2Ba使用微电极阵列的无兴奋性神经网络活动。与等基因对照组相比,L124W神经元的同步网络爆发频率增加gydF4y2BaMECP2gydF4y2Ba零神经元的同步网络突发频率显著降低,网络突发持续时间短暂延长。一个生物驱动的计算神经网络模型表明,观察到的网络动力学变化是由内在Na的变化解释的gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba单个神经元的电流。我们的多水平结果表明,RTT兴奋性神经元表现出广泛的形态学,电生理和电路表型,这取决于严重程度gydF4y2BaMECP2gydF4y2Ba突变。gydF4y2Ba
简介gydF4y2Ba
Rett综合征(RTT)是一种罕见的影响女性的神经发育障碍,主要是由基因中的杂合性功能丧失突变引起的gydF4y2BaMECP2gydF4y2Ba[gydF4y2Ba1gydF4y2Ba].RTT的特点是早期发育退化,导致小头畸形、语言和运动技能丧失、手部定型、步态异常,在某些情况下还会出现类似自闭症的行为、自主神经功能障碍和癫痫[gydF4y2Ba2gydF4y2Ba].gydF4y2BaMECP2gydF4y2Ba是一个X连锁基因,在女性细胞中经历X染色体失活(XCI),导致野生型(WT)和突变型的镶嵌表达gydF4y2BaMECP2gydF4y2BaRTT个体中可能改变非随机XCI症状表现的等位基因[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].虽然gydF4y2BaMECP2gydF4y2BamRNA普遍表达,MECP2蛋白在神经元中最为丰富[gydF4y2Ba5gydF4y2Ba],它结合甲基化DNA,作为全球转录调节因子抑制或激活基因[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].大量RTT患者相关gydF4y2BaMECP2gydF4y2Ba错义突变映射到甲基结合域(MBD),并破坏了MECP2正常功能所需的与DNA的相互作用[gydF4y2Ba7gydF4y2Ba].一些MBD错义突变的功能后果是它们破坏了异染色质凝聚物,而这些凝聚物被预测在RTT的疾病通路中发挥作用[gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
人类干细胞来源的RTT神经元模型已经证实了许多细胞表型观察gydF4y2BaMecp2gydF4y2Ba小鼠模型与经典RTT患者[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].在这些研究中,WT和gydF4y2BaMECP2gydF4y2Ba点突变或零突变的ESCs和iPSCs分别分化为神经祖细胞(Neural proitor Cells, NPCs)和电活性皮层神经元。他们发现,当MECP2功能障碍时,RTT神经元的形态会受到影响,表现为胞体面积、树突长度、分支复杂性和兴奋性突触数量的减少。在膜片钳实验中研究RTT神经元电生理特性[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba],他们表现出响应电流脉冲的动作电位数量减少,钙瞬态减少,自发或微型兴奋性突触后电流(mEPSC)频率降低。这些研究一致表明,经典的RTT神经元尺寸减小,树突分支,兴奋性和兴奋性神经传递受损,共同提示神经元成熟缺陷。gydF4y2Ba
在小鼠皮层切片和海马培养的电生理学研究中已经表明gydF4y2BaMecp2gydF4y2Ba神经元的mEPSC振幅或频率降低[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].这意味着兴奋性神经元活性的降低和由MECP2调节的活性依赖基因表达的改变[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]可能改变回路成熟动态,并有助于观察到的RTT表型。这些变化是如何转化为发育中的人脑神经元网络的活动模式的,目前还鲜有文献记载。最近使用诱导兴奋性神经元与星形胶质细胞在微电极阵列(MEAs)上共培养的方法,现在可以评估同步网络活性的发展,以及神经发育障碍中电路是如何受到影响的[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].在早期大脑发育期间观察到的神经元网络的早期同步性活动模式可能受到单个神经元中已识别的变化的影响,影响的程度取决于其严重程度gydF4y2BaMECP2gydF4y2Ba突变。预测体内电路改变的模拟模型已经迅速发展,并为预测体外人类电路变化提供了令人兴奋的机会,例如发育过程中同步活动模式的变化[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
在这项工作中,我们使用多层方法(分子-细胞-网络-建模)来比较来自严重经典的ipsc衍生的兴奋性神经元的表型gydF4y2BaMECP2gydF4y2Ba零突变的非典型RTT患者保留言语变异。这种变体被描述为较温和的RTT形式,患者的诊断标准包括手刻板印象,手技能轻度减少,允许相当好的手技能,使用单个单词或复杂短语的语言恢复,正常的头围,以及轻度的智力障碍[gydF4y2Ba26gydF4y2Ba].我们报告了在非典型患者中MECP2 MBD在L124W (c.371 T > G)处出现的一种新的错义突变,该突变对MECP2异染色质关联具有未知的分子影响。我们比较了非典型L124W和严重感染的L124WgydF4y2BaMECP2gydF4y2Ba无兴奋性神经元及其各自的等基因对照。我们研究了蛋白表达水平、单神经元结构和电生理特征(如输入电阻、电压门控钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流、动作电位放电和兴奋性突触功能),以及使用MEA记录的神经元网络动力学。研究结果被整合到神经元的计算网络模型中。我们的结果揭示了一系列rtt相关的异染色质结合,神经元形态,电生理和电路表型取决于gydF4y2BaMECP2gydF4y2Ba变异程度。计算模型模拟进一步表明,观察到的RTT网络动态变化可能归因于单个神经元内禀适应电流的变化。gydF4y2Ba
结果gydF4y2Ba
MECP2 L124W蛋白对异染色质的破坏有限gydF4y2Ba
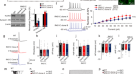
MECP2已知在染色质结构中发挥作用[gydF4y2Ba27gydF4y2Ba].该结构结晶的人WT MECP2与MBD结合gydF4y2Ba脑源性神经营养因子gydF4y2Ba启动子(gydF4y2Ba28gydF4y2Ba]证明了L124映射的位置在接近R106的3D(图。gydF4y2Ba1gydF4y2Ba).根据RettBASE [gydF4y2Ba29gydF4y2Ba,一个病人的数据库gydF4y2BaMECP2gydF4y2Ba这两个残基在典型Rett综合征患者中分别突变为L124F和R106W。当这两种变体在小鼠细胞中以GFP融合的形式表达时,它们破坏了异色染色中心[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].为了研究与保留言语非典型RTT患者相关的新型L124W MBD错意突变是否与L124F和R106W类似地破坏异染色质,我们评估了其相对于WT的结合和聚类染色体中心的能力(而不是不能表达为融合蛋白的无效MECP2变体)。简而言之,我们在C2C12小鼠成肌细胞中过度表达Mecp2 - gfp融合,这些细胞具有低水平的内源性Mecp2。在荧光强度相似的细胞中,用共聚焦显微镜测量GFP与DAPI标记色中心的共定位。WT显示出明显形成的色心簇,如预期的GFP和DAPI高度共定位,而R106W和L124F显示出完全中断的色心簇和模糊的GFP和DAPI共定位(图1)。gydF4y2Ba1 bgydF4y2Ba).相比之下,新的L124W突变显示出有限的异染色质破坏,其特征是不受染色中心数量影响和染色中心尺寸减小(图2)。gydF4y2Ba1 b, CgydF4y2Ba).L124W也比WT在细胞核中分布得更多,通过Pearson相关系数(PCC)测量显示GFP与DAPI的共定位减少(图。gydF4y2Ba1 b, CgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaMECP2 MBD三维结构建模L124W点相对于R106W的突变位置。人体MECP2-MBD晶体结构使用PyMol分子图形系统(PDB登录代码:3C2I)显示MBD结合在甲基化双链DNA序列gydF4y2Ba脑源性神经营养因子gydF4y2Ba启动子。gydF4y2BaBgydF4y2Ba用DAPI(蓝色)和GFP(绿色)染色的C2C12小鼠成肌细胞过表达WT-GFP和突变MECP2-GFP融合蛋白的代表图像。比例尺= 2 μm。gydF4y2BaCgydF4y2Ba用Pearson相关系数(PCC)定量相对色心大小、数量和重叠。gydF4y2BangydF4y2Ba=每个条件3孔测量15个细胞。gydF4y2BaDgydF4y2BaC2C12小鼠细胞中GFP的FRAP时间过程及WT-GFP和L124W-GFP定量荧光强度的代表图像。比例尺= 2 μm。gydF4y2BaEgydF4y2BaWT-GFP和L124W-GFP半衰期和流动分数的定量。gydF4y2BangydF4y2Ba= 5个细胞测量从3孔每个条件。gydF4y2BaFgydF4y2Ba位置示意图gydF4y2BaMECP2gydF4y2Ba本研究中使用的iPSC/ESC系的突变。红线表示缺失的位置,红色箭头表示基因中CLT点突变或PGPC14空移码突变的位置。黑色箭头表示蛋白中早期终止密码子的PGPC14 null位置。绿色为MECP2蛋白的甲基结合域,蓝色为MECP2蛋白的转录抑制域。gydF4y2BaGgydF4y2Ba多态雄激素受体基因座在X活性(XgydF4y2Ba一个gydF4y2Ba)或X不活跃(XgydF4y2Ba我gydF4y2Ba)的内切酶消化和未消化的gDNA样本从WT和gydF4y2BaMECP2gydF4y2Ba突变的iPSC系。gydF4y2BaHgydF4y2BaCLT WT或c.371 T > G (p.L124W) cDNA的Sanger测序gydF4y2BaMECP2gydF4y2BaiPSC克隆中活性X染色体限制性表达引起的突变。gydF4y2Ba我gydF4y2Ba等基因数字化印迹gydF4y2BaNgn2gydF4y2Ba在等基因L124W中,利用毛细管western技术定量MECP2蛋白水平gydF4y2BaNgn2gydF4y2Ba神经元归一化为β-肌动蛋白。gydF4y2BaJgydF4y2BaWes毛细管蛋白检测6周龄PGPC14 WT和null中MECP2蛋白gydF4y2BaNgn2gydF4y2Ba神经元,与4周大的d3-4 WT和缺失的npc衍生神经元相比。所有数据均以均值+/−SEM表示,n/ n =样品数/复制批次数。用Student 's评价统计学意义gydF4y2BatgydF4y2Ba-test或Mann-Whitney检验,视情况而定,见图(gydF4y2BaCgydF4y2Ba,gydF4y2BaEgydF4y2Ba而且gydF4y2Ba我gydF4y2Ba).nsgydF4y2BapgydF4y2Ba> 0.05, *gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01。gydF4y2Ba
为了探索L124W蛋白的结合动力学,利用荧光漂白后荧光恢复(FRAP)活体成像研究MECP2蛋白的流动性[gydF4y2Ba32gydF4y2Ba].在C2C12细胞中,WT和L124W的MECP2-GFP融合蛋白均过表达,在单色中心焦点光漂白后,随着时间的推移,L124W的MECP2-GFP融合蛋白信号比WT恢复得更快(图2)。gydF4y2Ba1 dgydF4y2Ba).L124W具有更短的半衰期和更大的可用未结合的可移动部分来恢复漂白信号,这表明它降低了与异染色质的结合动力学(图。gydF4y2Ba1 egydF4y2Ba).结合色中心聚类的部分损伤,这些结果表明,由于结合动力学降低,L124W相对于L124F和R106W突变对MECP2异染色质凝聚物的影响有限。gydF4y2Ba
MECP2 L124W iPSCs的生成gydF4y2BaNgn2gydF4y2Ba-衍生兴奋性神经元gydF4y2Ba
由于遗传背景和修饰基因的差异导致了RTT表型的严重程度[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba],使用与突变细胞同时重编程的等基因WT细胞或通过基因编辑从同一iPSC系衍生的疾病建模策略,为与受影响细胞进行比较提供了最精确的控制。等基因对照的使用解决了在不同WT对照中观察到的变异性,特别是在网络电路研究的背景下[gydF4y2Ba35gydF4y2Ba],并且通过比较同一MEA板中不同孔中的等基因细胞对,可以进一步解决变异问题。通过利用女性体细胞中的XCI,我们和其他人通过一次重编程实验生成了RTT干细胞系的等基因对。如下所述,我们首先生成了携带L124W错义突变的等基因人类iPSC。作为对照,我们选择gydF4y2BaMECP2gydF4y2BaNull细胞包括来自d1 -4患者的等基因系[gydF4y2Ba10gydF4y2Ba]和纯合子gydF4y2BaMECP2gydF4y2Ba人ESC基因WIBR3基因编辑得到的零线[gydF4y2Ba13gydF4y2Ba不能重新激活WT等位基因(图。gydF4y2Ba1 fgydF4y2Ba).我们还生成了第三个gydF4y2BaMECP2gydF4y2Ba使用基因编辑PGPC14健康对照iPSC系的空等基因对,因为全基因组测序显示它没有与神经疾病相关的已知基因组变异[gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
我们从携带杂合子的非典型RTT患者(CLT)中生成iPSCsgydF4y2BaMECP2gydF4y2Bac.371 T > G变异导致L124W氨基酸改变。使用仙台病毒从患者成纤维细胞中重新编程iPSCs, STR分析证实这些系来自成纤维细胞。这些系首先通过雄激素受体(AR)内切酶消化试验评估XCI状态,以确定活性X染色体上完全偏向WT或L124W等位基因的等基因系(XgydF4y2Ba一个gydF4y2Ba),以雄性系作为对照,以完全消化未甲基化的XgydF4y2Ba一个gydF4y2Ba(无花果。gydF4y2Ba1克gydF4y2Ba).这些CLT等基因细胞系的术语是CLT- wt和CLT- l124w。两行XgydF4y2Ba一个gydF4y2BaCLT-WT (C4和C17)和X的两行gydF4y2Ba一个gydF4y2Ba获得CLT-L124W (C1和C2),核型为正常46XX(图;gydF4y2BaS1AgydF4y2Ba).经OCT4、NANOG、SSEA-4和TRA-1-60阳性染色,iPSC细胞系显示出多能性。gydF4y2Ba印地gydF4y2Ba),自发分化为3胚层(图;gydF4y2Ba就是S1CgydF4y2Ba)和RNA-seq和Pluritest分析确定的多能细胞表达谱[gydF4y2Ba37gydF4y2Ba(图。gydF4y2BaS1DgydF4y2Ba).在进行多能性表征后,限制了X的mRNA表达gydF4y2Ba一个gydF4y2Ba通过对L124W变异的cDNA测序再次确认了等位基因(图。gydF4y2Ba1 hgydF4y2Ba).这样,失活的X染色体(XgydF4y2Ba我gydF4y2Ba)不会受到侵蚀[gydF4y2Ba38gydF4y2Ba]发生在iPSC分离早期的两个时间点,以及在细胞系分化为神经元之前的完全表征之后。gydF4y2Ba
为了检测兴奋性皮层神经元中L124W蛋白的水平,我们使用了快速诱导gydF4y2BaNeurogenin-2gydF4y2Ba(gydF4y2BaNgn2gydF4y2Ba)过表达式协议[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba(图。gydF4y2BaS1EgydF4y2Ba).简而言之,WT和RTT iPSCs/ESCs是用tet诱导的转导的gydF4y2BaNgn2-purogydF4y2Ba慢病毒载体,用强力霉素诱导过表达8天,在GDNF和BDNF存在的情况下,用嘌呤霉素选择,在兴奋性神经元重新沉积和成熟之前,用Ara-C消除分裂细胞。如预期,MECP2毛细管蛋白检测6周龄gydF4y2BaNgn2gydF4y2Ba神经元提取物在d3-4和WIBR3零系中显示MECP2蛋白缺失,但在等基因CLT-WT和CLT-L124W系中MECP2蛋白水平相似(图3)。gydF4y2Ba1我gydF4y2Ba).我们得出结论,L124W突变蛋白在CLT-L124W细胞中存在并以不变的水平产生。gydF4y2Ba
当我们继续评估CLT、d3-4和WIBR3神经元的神经元活动时,我们使用CRISPR/Cas9基因编辑分离出一个新细胞gydF4y2BaMECP2gydF4y2Ba零线。我们将indels引入加拿大个人基因组计划先前鉴定的健康对照女性PGPC14 iPSC系[gydF4y2Ba36gydF4y2Ba].PGPC14 iPSCs与Cas9和gRNA共转染gydF4y2BaMECP2gydF4y2Ba.筛选的克隆核型正常(图。gydF4y2BaS1FgydF4y2Ba),并发现标志物多能性标记阳性(图。gydF4y2BaS1GgydF4y2Ba).cDNA测序发现了1 bp的插入(c.217_218insC)gydF4y2BaMECP2gydF4y2BaX上的3号外显子gydF4y2Ba一个gydF4y2Ba(无花果。gydF4y2BaS1HgydF4y2Ba),导致MBD早期的移码和过早截断蛋白(p.Val74Cysfs*16)。gydF4y2Ba1 fgydF4y2Ba).一代的gydF4y2BaNgn2gydF4y2Ba免疫细胞化学检测神经元和蛋白质(图;gydF4y2BaS1IgydF4y2Ba),毛细血管(图;gydF4y2Ba1 jgydF4y2Ba)和常规western blot(图;gydF4y2BaS1JgydF4y2Ba)表明PGPC14 indel神经元是gydF4y2BaMECP2gydF4y2Banull,与由NPC衍生神经元生成的d3-4 null样本相比,两者都没有重新激活XgydF4y2Ba我gydF4y2Ba产生WT蛋白。与d3-4细胞系相比,PGPC14亲本细胞表现出强大的分化为许多细胞类型,并被用于后续的神经元形态和电路实验。gydF4y2Ba
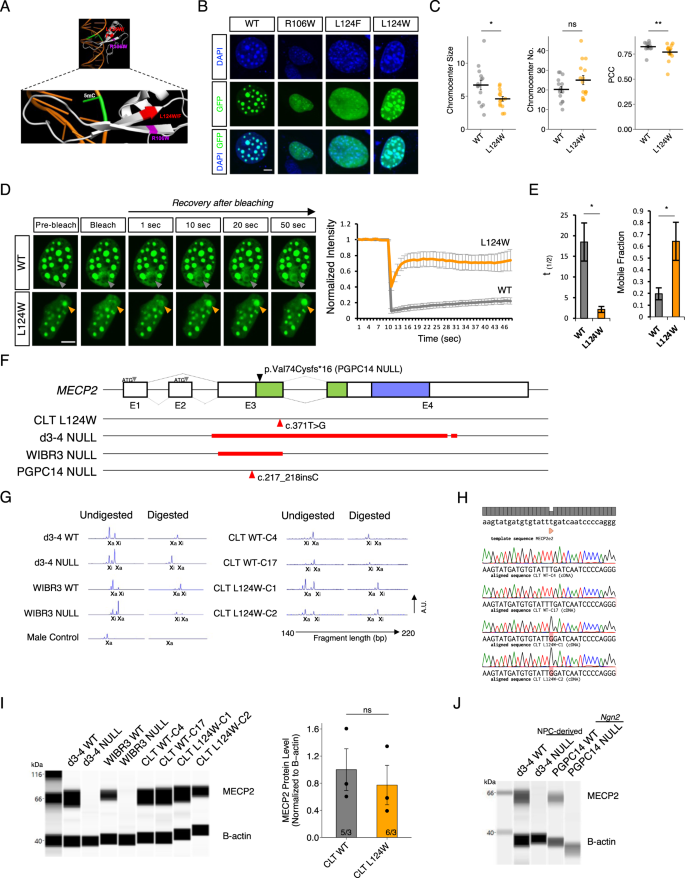
RTTgydF4y2BaNgn2gydF4y2Ba神经元在固有的膜特性和兴奋性突触功能方面表现出一系列的改变gydF4y2Ba
来验证gydF4y2BaNgn2gydF4y2Ba作为RTT的合适细胞模型,我们检测了它们的电生理特征,并首先确定在已知的兴奋性神经元中是否存在可检测到的差异gydF4y2BaMECP2gydF4y2Ba无相关表型。我们进行了全细胞膜片钳记录,以研究4-5周龄小鼠的内在膜特性gydF4y2BaNgn2gydF4y2Ba等基因d3-4和WIBR3神经元gydF4y2BaMECP2gydF4y2Ba与小鼠星形胶质细胞共培养的空系。我们寻找了先前报道的小鼠ipsc衍生神经元和人类RTT神经元电生理特征的改变,这些神经元通常通过npc_期分化[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].的确,相对于等基因对照gydF4y2BaMECP2gydF4y2Ba空神经元表现出去极化的静息膜电位,更高的输入电阻和降低的细胞电容(图。gydF4y2Ba2 a - cgydF4y2Ba),与之前在RTT ipsc衍生神经元上的发现一致。接下来我们评估了gydF4y2BaMECP2gydF4y2Ba正如先前在RTT神经元中报道的那样,零突变神经元的活性膜特性发生了改变[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].电压门控钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba在电压箝位条件下,通过从−70 mV的标准化保持电位去极化电压阶跃来诱发电流。我们发现NagydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba与它们各自的等基因WT相比,d3-4和WIBR3缺失神经元的电流减弱。gydF4y2Ba二维gydF4y2Ba).考虑到电生理特征的改变,gydF4y2BaMECP2gydF4y2BaNull神经元被认为在动作电位发射中有功能障碍。因此,我们进行了全细胞电流钳记录来研究动作电位的特征,通过在电流钳模式下记录并在WT和WT中注入一系列从−5pa到100pa的电流步骤来获得动作电位gydF4y2BaMECP2gydF4y2Ba空神经元(图。gydF4y2Ba2 egydF4y2Ba&gydF4y2BaS2A-EgydF4y2Ba).大多数动作电位参数在各组间无显著差异(图2)。gydF4y2BaS2A-EgydF4y2Ba)时,观察到动作电位产生障碍gydF4y2BaMECP2gydF4y2Ba空神经元与相应WT对照组的比较(图。gydF4y2Ba2 egydF4y2Ba).总之,这些发现表明gydF4y2BaMECP2gydF4y2Ba引起电生理特性的改变和动作电位激发的不足,进而影响神经元网络的功能。接下来,我们通过记录6周大鼠的mEPSCs来检测突触传递gydF4y2BaNgn2gydF4y2BaWT和gydF4y2BaMECP2gydF4y2Bad3-4和WIBR3的缺失神经元。我们观察到AMPAR-mEPSC的振幅和频率降低gydF4y2BaMECP2gydF4y2Ba空神经元(图;gydF4y2Ba2 fgydF4y2Ba),这与先前关于RTT ipsc衍生皮层神经元低活性的报道一致[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].综合来看,这些数据表明gydF4y2BaMECP2gydF4y2Ba零gydF4y2BaNgn2gydF4y2Ba神经元再现了已知的rtt相关兴奋性突触表型。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba散点图显示静息膜电位的所有数据点(gydF4y2Ba一个gydF4y2Ba),输入电阻(gydF4y2BaBgydF4y2Ba),电池电容(gydF4y2BaCgydF4y2Ba),电压门控NagydF4y2Ba+gydF4y2Ba电流测量在−10 mV (gydF4y2BaDgydF4y2Ba,顶部),电压门控KgydF4y2Ba+gydF4y2Ba电流测量为+60 mV (gydF4y2BaDgydF4y2Ba(底部)4-5周大gydF4y2BaNgn2gydF4y2BaWT神经元(gydF4y2BangydF4y2Ba= 66, 42, 99)和RTT从d3-4 (gydF4y2BangydF4y2Ba= 58), wibr3 (gydF4y2BangydF4y2Ba= 55), CLT (gydF4y2BangydF4y2Ba= 100)。该图还显示了平均静息膜电位,输入电阻,电池电容,NagydF4y2Ba+gydF4y2Ba电流和KgydF4y2Ba+gydF4y2Ba电流。gydF4y2BaEgydF4y2Ba左:4-5周大鼠诱发动作电位的代表性痕迹gydF4y2BaNgn2gydF4y2BaWT和RTT神经元来自d3-4, WIBR3和CLT。图描述了在4-5周龄内由+ 5pa到+ 100pa的一系列电流步骤在1秒内触发的诱发动作电位的数量gydF4y2BaNgn2gydF4y2BaWT神经元(gydF4y2BangydF4y2Ba= 66, 42, 99)和RTT从d3-4 (gydF4y2BangydF4y2Ba= 58), wibr3 (gydF4y2BangydF4y2Ba= 55), CLT (gydF4y2BangydF4y2Ba= 100)。gydF4y2BaFgydF4y2Ba上图为典型的6周大的mEPSCsgydF4y2BaNgn2gydF4y2BaWT和RTT神经元来自d3-4, WIBR3和CLT。插图显示左侧神经元的平均mEPSCs。底部,散点图显示了mEPSCs的振幅和频率的所有数据点。图中还显示了6周龄mEPSCs的平均振幅和频率gydF4y2BaNgn2gydF4y2BaWT神经元(gydF4y2BangydF4y2Ba= 56, 58, 68)和RTT从d3-4 (gydF4y2BangydF4y2Ba= 62), wibr3 (gydF4y2BangydF4y2Ba= 44)及CLT (gydF4y2BangydF4y2Ba= 78)。所有数据均以均数+/−SEM表示。2系等基因WT和2系CLT L124W数据合并。用Student 's评价统计学意义gydF4y2BatgydF4y2Ba-test或Mann-Whitney检验,视情况而定,在面板(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba而且gydF4y2BaFgydF4y2Ba),并采用双向重复测量方差分析,然后在面板中进行事后检验(gydF4y2BaEgydF4y2Ba).*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2Ba
基于L124W MECP2蛋白对异染色质凝聚物的有限破坏,我们预测CLT L124WgydF4y2BaNgn2gydF4y2Ba与等基因WT神经元相比,神经元具有更温和的细胞表型。在CLT L124W神经元中,输入电阻大于CLT WT神经元。然而,CLT L124W神经元的静息膜电位和细胞电容均与CLT WT神经元不同(图2)。gydF4y2Ba2 a - cgydF4y2Ba).电压门控钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2BaCLT L124W神经元的电流小于CLT WT神经元的电流(图2)。gydF4y2Ba二维gydF4y2Ba).然而,CLT L124W并没有表现出射击动作电位的不足(图2)。gydF4y2Ba2 egydF4y2Ba).接下来,当检查CLT WT神经元和CLT L124W的兴奋性神经传递时gydF4y2BaNgn2gydF4y2BaCLT L124W神经元的AMPAR-mEPSC振幅和频率均与CLT WT神经元不同(图2)。gydF4y2Ba2 fgydF4y2Ba).因此,从CLT WT和CLT L124W录音gydF4y2BaNgn2gydF4y2Ba神经元表现出输入电阻增加和电压门控钠受损gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba突变神经元中的电流。输入电阻和钠损伤的增加幅度较大gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流也观察到gydF4y2BaMECP2gydF4y2Ba零神经元。除了与CLT L124W神经元共享的核心表型子集外,gydF4y2BaMECP2gydF4y2Ba与等基因对照相比,缺失神经元在静息膜电位、细胞电容、动作电位激发和兴奋性突触功能方面表现出差异。gydF4y2Ba
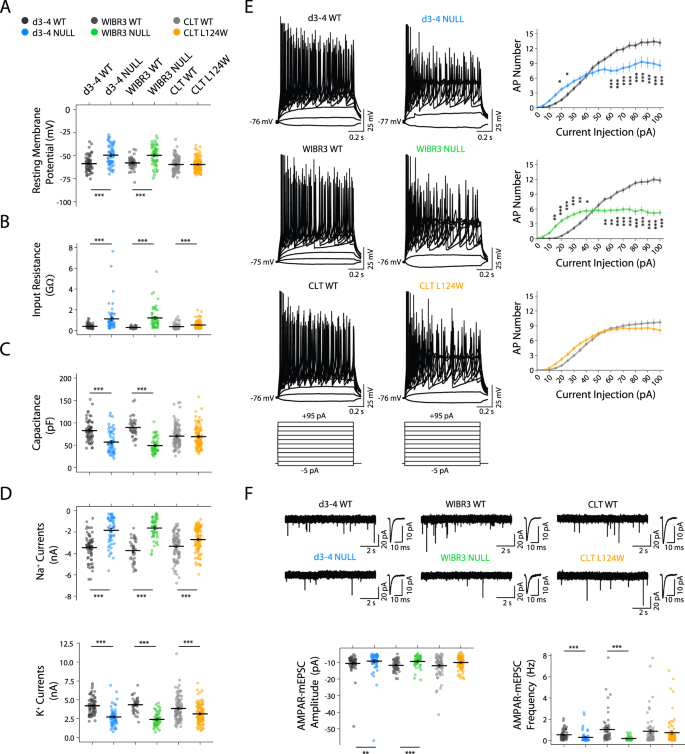
RTT中神经元大小、复杂性和兴奋性突触密度的改变gydF4y2BaNgn2gydF4y2Ba神经元gydF4y2Ba
减小尺寸和复杂性已被确定为使用人类npc衍生皮质神经元的经典RTT的突出形态特征[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].对形态测量进行评估gydF4y2BaNgn2gydF4y2Ba在3-5个独立实验中,将6周大的神经元与小鼠星形胶质细胞共培养的神经元稀疏地标记为GFP。固定细胞进行DAPI、GFP和MAP2染色,共聚焦显微镜捕获的图像显示所有基因型的细胞密度相似(图2)。gydF4y2Ba3gydF4y2Ba).由两名对基因型不可见的观察者进行Soma区域和树突追踪。正如预期的那样,gydF4y2BaMECP2gydF4y2Banull (d3-4, WIBR3和PGPC14)神经元的平均胞体面积和总树突长度减少,概括了已知的经典rtt相关表型,涉及小头畸形(图3)。gydF4y2Ba3 b, CgydF4y2Ba).相比之下,CLT L124W错义神经元的胞体面积和树突长度没有变化。gydF4y2Ba3 b, CgydF4y2Ba),与保留语音变异非典型RTT的正常头围一致,与我们的发现电容没有变化一致。gydF4y2Ba
一个gydF4y2Ba6周龄WT和RTT的代表性图像gydF4y2BaNgn2gydF4y2Ba与小鼠星形胶质细胞共培养的神经元,带有GFP稀疏标记(绿色),泛神经元标记MAP2(品红)和DAPI(蓝色)。比例尺bar = 100µm。gydF4y2BaBgydF4y2Ba体细胞区神经元量化,(gydF4y2BaCgydF4y2Ba)枝晶总长度,和(gydF4y2BaDgydF4y2Ba单个神经元的复杂度(从体细胞开始增加10µm)。gydF4y2BaEgydF4y2Ba6周龄WT和RTT的代表性图像gydF4y2BaNgn2gydF4y2Ba与小鼠星形胶质细胞共培养的神经元,标记为突触前和突触后标记SYN1(洋红色)和HOMER1(绿色),沿MAP2标记的树突定量突触密度(蓝色)。比例尺bar = 5µm。所有数据在图中以mean +/−SEM表示(gydF4y2BaBgydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba).表示n/ n =神经元总数/复制批次数(每批每个细胞系4-6孔),图中(gydF4y2BaEgydF4y2Ba) n/ n =树突段总数/复制批次数(每批每个细胞系4孔)。2系等基因WT和2系CLT L124W数据合并。用Student 's评价统计学意义gydF4y2BatgydF4y2Ba-test或Mann Whitney test,视情况而定,在Panel (gydF4y2BaBgydF4y2Ba- - - - - -gydF4y2BaEgydF4y2Ba).*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2Ba
然而,对CLT L124W神经元的Sholl分析显示,相对于WT, L124W神经元的分支复杂性降低,类似于CLT L124W神经元的分支复杂性降低gydF4y2BaMECP2gydF4y2Ba相对于WT的空神经元(图。gydF4y2Ba3 dgydF4y2Ba&gydF4y2BaS3AgydF4y2Ba).为了研究突触的变化,基于突触前SYN1和突触后HOMER1点沿树突MAP2信号的共定位来量化兴奋性突触密度。d3-4, WIBR3和PGPC14gydF4y2BaMECP2gydF4y2Ba与相应的等基因对照相比,缺失神经元的SYN1/HOMER1密度降低。另一方面,CLT L124W神经元相对于WT没有表现出明显的变化(图。gydF4y2Ba3 egydF4y2Ba).综上所述,CLT L124W神经元仅显示出与L124W神经元共享的树突复杂性变化的核心子集gydF4y2BaMECP2gydF4y2Banull神经元,与L124W蛋白异染色质关联和兴奋性神经元活性中发现的更有限的突变依赖表型一致。gydF4y2Ba
RTT中异常的网络电路gydF4y2BaNgn2gydF4y2Ba神经元的文化gydF4y2Ba
在发育过程中,单个神经元相互连接形成神经元网络,产生同步活动的独特模式。这种模式在形成发育中的大脑网络结构和功能方面起着关键作用[gydF4y2Ba42gydF4y2Ba].通过观察单个神经元水平上功能和形态特征的改变,我们确定RTT培养中集成神经回路活动是否会受到干扰。等基因WT和RTTgydF4y2BaNgn2gydF4y2Ba神经元(WIBR3, PGPC14和CLT-L124W)与小鼠星形胶质细胞共培养在12孔的MEA板上,每孔8 × 8网格中有64个通道(Axion Biosystems)。gydF4y2BaS4AgydF4y2Ba).每个板块都是由一个独立的微分衍生出来的gydF4y2BaNgn2gydF4y2Ba-诱导的iPSCs/ESCs,每个等基因型包含3-6个孔作为技术重复。时间零点是神经元和星形胶质细胞被镀在一起共培养的日子,从第3周到第7周,每周收集5分钟的细胞外记录。gydF4y2Ba
随着时间的推移,我们在多个电极上观察到高频神经活动的出现,这与之前的实验中观察到的情况相似[gydF4y2Ba21gydF4y2Ba].使用Axion软件检测的动作电位的栅格图显示了WIBR3、PGPC14和CLT等基因对在多个电极上的同步爆发。gydF4y2Ba4gydF4y2Ba).正如预期的那样,我们检测到不同WT线的发射机制的变异性(图2)。gydF4y2Ba4gydF4y2Ba),尽管电极上的电池密度相当(图。gydF4y2BaS4AgydF4y2Ba).这与已发表的指南一致,该指南报告了10个不同控制线的变异性,并强调了使用等基因控制评估人类干细胞衍生神经网络中疾病相关表型变化的重要性[gydF4y2Ba35gydF4y2Ba].具有活动信号的电极数量随着记录时间的推移而增加,这可能是网络内新连接发展的结果,但活动电极的数量在板与板之间存在差异(图2)。gydF4y2BaS4BgydF4y2Ba).如果MEA板上至少有一条线在一段时间内达到了64个活跃电极中至少32个的截止点,以减少变异性,则对MEA板进行分析。有了这个分界点,我们就可以包括那些网络活性强的板块,而排除那些细胞粘附性差的板块。此外,在最终时间点,用AMPAR拮抗剂CNXQ处理神经元,显示峰值活性被消除(图2)。gydF4y2Ba自己gydF4y2Ba).这就支持了突触传递与网络活动模式有关。gydF4y2Ba
一个gydF4y2Ba来自WT和RTT自发动作电位峰值的代表性300 s MEA栅格图(黑线)gydF4y2BaNgn2gydF4y2Ba神经元在小鼠星形胶质细胞上共培养5周,通过64个电极通道网格检测。插图(圆形窗口)是所选区域的放大图,显示同步网络爆发事件中跨多个通道的峰值。gydF4y2BaBgydF4y2BaMEA活度的量化表现为加权平均发射速率下RTT相对于WT的对数倍变化,(gydF4y2BaCgydF4y2Ba)网络突发频率,以及(gydF4y2BaDgydF4y2Ba)网络突发持续时间。WIBR3 6个复制板,PGPC14 4个复制板,CLT等基因对6个复制板,每个板每个基因型分析2-6个活性孔。所有数据均以mean +/−SEM, *表示gydF4y2BapgydF4y2Ba< 0.05。2系等基因WT和2系CLT L124W数据合并。用Student 's评价统计学意义gydF4y2BatgydF4y2Ba-test或Mann-Whitney检验,视情况而定,在面板(gydF4y2BaBgydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba).*gydF4y2BapgydF4y2Ba< 0.05。gydF4y2Ba
基于CLT L124W神经元的轻度电生理和形态差异,我们预测测量网络活动的变量也有类似的微小变化。为了解释板块间成熟动力学的差异[gydF4y2Ba21gydF4y2Ba]我们将RTT值的折叠变化归一化为一个平板内各自的WT等基因值。我们检测了6个CLT等基因神经元的生物复制板,每个板上有4个CLT系的3个孔。累计,CLT L124WgydF4y2BaNgn2gydF4y2Ba相对于WT,神经元在加权平均放电速率(定义为每孔活跃电极数归一化后的活跃电极平均放电速率)上没有表现出显著差异(图2)。gydF4y2Ba4 bgydF4y2Ba,对吧)。在较晚的时间点,网络突发频率增加,网络突发持续时间减少(图2)。gydF4y2Ba4 c, DgydF4y2Ba,对吧)。上述网络指标的绝对值如图所示。gydF4y2BaS4B-DgydF4y2Ba,在爆发间隔、同步性或其他指标上未观察到其他差异。gydF4y2Ba
检测电路缺陷gydF4y2BaMECP2gydF4y2Ba然后,我们检测了WIBR3的6个生物复制MEA板和PGPC14等基因对的4个生物复制MEA板,每个板上有6孔等基因WT和null。RTT值显示为相对于WT基线的对数倍变化(由虚线表示的标准化WT水平)。加权平均射速没有一致的变化gydF4y2BaMECP2gydF4y2Ba相对于WT的空神经元(图。gydF4y2Ba4 bgydF4y2Ba而且gydF4y2BaS4DgydF4y2Ba).然而,gydF4y2BaMECP2gydF4y2Ba零网络爆发的频率相对于WT在4周时间点开始持续下降(图2)。gydF4y2Ba4摄氏度gydF4y2Ba而且gydF4y2BaS4EgydF4y2Ba).随着网络爆发频率的降低,在WIBR3和PGPC14等基因系中,网络爆发持续时间会在第5-6周短暂出现。gydF4y2Ba4 dgydF4y2Ba&gydF4y2BaS4FgydF4y2Ba).与PGPC14空等基因系相比,WIBR3空等基因系的网络爆发特性发生了更大的折叠变化。相比之下,CLT L124W只有较晚的时间点,网络爆发频率增加或网络爆发持续时间减少,这与所显示的不同gydF4y2BaMECP2gydF4y2Ba空网络。gydF4y2Ba
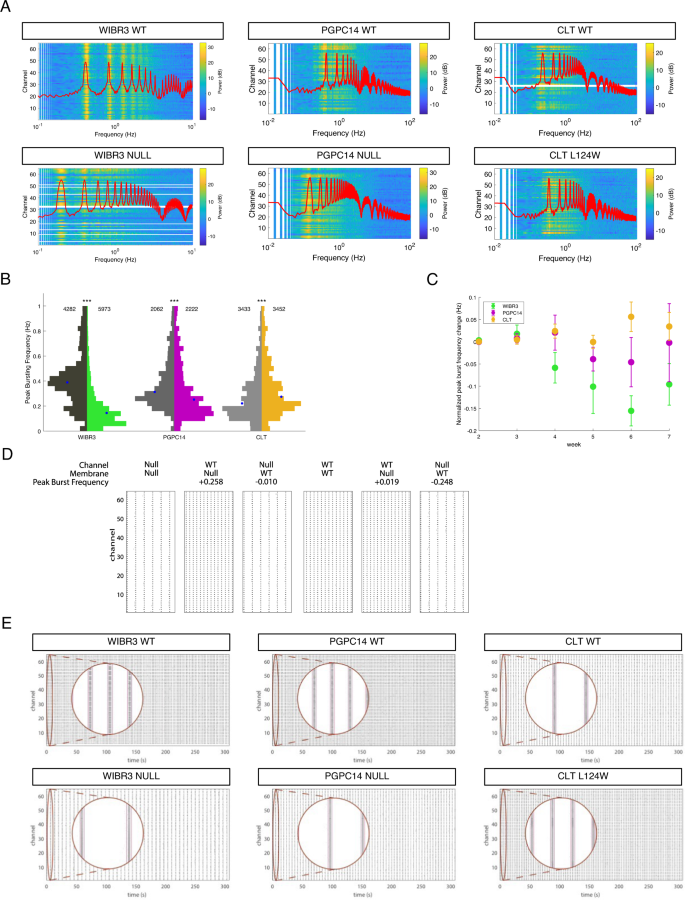
RTT中峰值爆发频率的建模变化gydF4y2BaNgn2gydF4y2Ba神经网络gydF4y2Ba
网络爆发频率的变化捕捉了RTT和WT之间的差异,特别是对于gydF4y2BaMECP2gydF4y2Ba空表型显示更明显的变化,细胞和网络配置文件。为了更好地描述频域的这种变化,并在不同网络表型之间寻找更细微的差异,我们提取了原始spike数据,并对井内每个电极的spike序列进行了功率谱密度(PSD)估计。在所有64个通道中记录的峰值串上直接计算的PSD在这些同步网络爆发频率的热图中显示出清晰的峰值(图2)。gydF4y2Ba5gydF4y2Ba).当峰值爆发频率的分布从第2-7周聚合(图2-7)。gydF4y2Ba5 bgydF4y2Ba而且gydF4y2BaS5AgydF4y2Ba)或归一化到各自的等基因对照(图。gydF4y2Ba5度gydF4y2Ba), WIBR3和PGPC14空值在所有时间点的累积中位峰值爆发频率上都有所降低。CLT L124W的峰值破裂频率略有增加。我们的PSD估计始终与众不同gydF4y2BaMECP2gydF4y2BaWT零点gydF4y2BaNgn2gydF4y2Ba神经网络,并捕获了两者之间的差异gydF4y2Ba方向gydF4y2Ba的峰值爆发频率变化的CLT L124W相比gydF4y2BaMECP2gydF4y2Ba零神经元。gydF4y2Ba
一个gydF4y2Ba记录WT和RTT的穗列功率谱gydF4y2BaNgn2gydF4y2Ba神经元(热图),以及峰值网络模型中1000个模拟神经元的平均功率谱(红线)。实验数据(热图)中的峰值与计算模型(红线)吻合良好。gydF4y2BaBgydF4y2Ba峰值爆发频率分布由WT和RTT的MEA记录汇总gydF4y2BaNgn2gydF4y2Ba2-7周的神经元。WIBR3复制板6个,PGPC14复制板4个,CLT复制板5个,每个板每个基因型分析3-6个活性孔。CLT板17被排除在外,因为在第2-5周内网络爆发不足,且活跃孔数量较少(每个基因型2-3个)。表示所分析电极数,蓝点为中位数。采用Mann Whitney检验评价差异有统计学意义。***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BaCgydF4y2Ba从WIBR3 NULL, PGPC14 NULL和CLT L124W的峰值频率归一化变化gydF4y2BaNgn2gydF4y2Ba2-7周的神经元表现出发育轨迹和突变亚型之间的明显差异。gydF4y2BaDgydF4y2Ba计算辍学实验,以了解如何纳gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba通道值与电容的关系,静息膜电位值有助于频率的变化。变化相对于WIBR3 Null(具有各自的Null通道、电容和静息膜电位值)和WIBR3 WT(具有各自的WT通道、电容和静息膜电位值)。gydF4y2BaEgydF4y2Ba通过计算建模方法生成的跨64个通道的WT和RTT基因型的300 s栅格图。的gydF4y2BaxgydF4y2Ba轴是时间,即gydF4y2BaygydF4y2Ba轴为电极数,黑线为每个通道上的多单元事件(动作电位簇)。插入(圆形窗口)是所选区域的放大。gydF4y2Ba
爆发频率的变化至少有两个不同的起源,一个是单个神经元的内在特性的变化,另一个是网络突触连通性的变化。首先,测试在RTT网络中观察到的峰值突发频率的差异是否基于改变的内在特性的变化(例如电压门控钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流,电容或静息膜电位),我们开发了一种兴奋性spike神经元连接到网络的计算模型,该网络近似于ipsc衍生的培养。由1000个兴奋性自适应整合与发射(AdIF)神经元组成的网络[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba使用膜片钳记录的参数来模拟。我们模拟了随机的网络内连接,连接概率为0.05(导致每个细胞平均有50个突触),以及随机的泊松外部输入(100个突触以20 Hz的频率激增)。该峰值模型显示了鲁棒的网络突发,其特征与网络中的单神经元属性有关。然后,我们用与实验数据相同的方法分析了模拟的尖刺列车。由顶拟合AdIF模拟得到的峰值频率叠加(图中红线)。gydF4y2Ba5gydF4y2Ba)证明了这种峰值gydF4y2Ba适应gydF4y2Ba驱动模型概括了在WIBR3和PGPC14缺失神经元记录中观察到的降低频率。引人注目的是,AdIF模拟也捕捉到了CLT L124W神经元在相反方向上的影响,其中网络峰值频率增加。该模型显示了Na的变化gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流、电容或静息膜电位,或它们的组合,足以解释网络峰值爆发频率的差异。gydF4y2Ba
接下来,我们探讨了RTT和WT网络之间网络/突触连通性的系统性差异是否会导致观察到的爆发频率差异。为此,我们研究了阈值下自适应值(4到10 nS)和连接概率(0.05到0.35)范围内的WIBR3网络模型。在这个范围内,网络突发频率随着RTT神经元网络中典型的连接概率的降低而增加[gydF4y2Ba45gydF4y2Ba],而阈下自适应值的影响较小(图;gydF4y2BaS5BgydF4y2Ba).连接概率对爆发频率的影响与实验数据中观察到的相反,这表明突触连接概率的变化并不能解释我们的观察结果。该控制模拟与驱动观测到的爆发频率变化的本禀自适应电流一致。gydF4y2Ba
最后,确定Na的贡献gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2BaRTT中驱动峰值爆发频率模式中相对于膜电容的电流和静息电位特性,我们通过将WIBR3零值替换为它们的等基因WT值来进行退出模拟。如图所示。gydF4y2Ba5 dgydF4y2Ba,用空值模拟给出了代表性的30秒持续时间内低频率的爆发。当空NagydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba将自适应电流表示的信道值去掉,代之以WT值,仿真预测突发频率得到挽救。相反,当零膜值(电容和静息膜电位)被删除并被WT值取代时,频率没有实质性的变化。倒数模拟,其中WT值被删除并被空值取代,也预测它只是空NagydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba驱动缓慢爆发频率的通道电流。300s时的仿真模型(图;gydF4y2Ba5 egydF4y2Ba)与实验电路结果相一致gydF4y2BaMECP2gydF4y2Banull和CLT L124W神经元,表明gydF4y2BaMECP2gydF4y2Ba零爆发频率由实验验证的Na变化驱动gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流。gydF4y2Ba
讨论gydF4y2Ba
在这项研究中,我们定义了一个广泛的表型谱gydF4y2BaMECP2gydF4y2Ba通过体外模拟非典型和经典RTT神经元,研究异染色质结合、神经元形态、电生理特性和网络连通性的突变依赖变化。我们调查了一本小说的影响gydF4y2BaMECP2gydF4y2BaL124W MBD与三种经典异型比较gydF4y2BaMECP2gydF4y2Ba等基因诱导的兴奋性神经元中的null。我们的研究结果揭示了这两种类型的核心功能和形态表型,以及null神经元表现出的更广泛的附加损伤(总结在表中gydF4y2Ba1gydF4y2Ba).非典型RTT的核心表型包括输入电阻增加,电压门控钠受损gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流,降低树状晶的复杂性。gydF4y2BaMECP2gydF4y2BaNull神经元始终表现出相同的核心表型以及去极化的静息膜电位,细胞电容降低伴随体面积、树突长度和兴奋性突触密度的减小,并且兴奋性突触传输中断。L124W和null神经元在神经元网络爆发频率和持续时间模式上都表现出相同的核心表型,但这些变化方向相反。使用来自patch-clamp记录的参数的仿真建模复制了L124W中网络爆发频率的增加和null神经元中频率的降低。对空神经元的dropout模拟预测网络爆发频率的变化是由Na驱动的gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba通道电流。因此,gydF4y2BaMECP2gydF4y2Banull表型包括已知的rtt相关变化,验证了我们的诱导神经元模型,并揭示了对兴奋性突触活动和网络电路发展的新见解。gydF4y2Ba
L124W分子、细胞和网络核心表型gydF4y2Ba
L124W MECP2蛋白的非典型rtt相关表型由小鼠细胞染色质结合部分中断和诱导神经元蛋白水平稳定不变的证据支持。染色中心检测最近被用于证明MECP2是异染色质凝聚体的一个组成部分,预计在RTT的疾病途径中发挥作用,而MBD错义突变通常会损害这种活性[gydF4y2Ba8gydF4y2Ba].这种机制可能改变了神经元中L124W MECP2抑制的一组基因。我们排除的一个潜在的实验人为因素是CLT L124W iPSCs中的XCI侵蚀。总的来说,L124W变体代表了MECP2 MBD突变的一个亚型,与之前对L124F、R106W和其他MBD错义变体的研究中发现的更混乱的异染色质相比,它保留了部分功能[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
我们发现CLT L124W神经元在树突复杂性和内在特性方面表现出了与WT相似的核心表型变化。重要的是,CLT L124W神经元表现出了输入电阻的增加。由于较高的输入电阻,给定的退极化电流将产生较大的膜电位变化。因此,输入电阻的增加解释了我们的发现,与相应的对照相比,所有突变体中唤起动作电位所需的去极化电流都较低(图2)。gydF4y2Ba2 egydF4y2Ba).从这一结果我们得出结论,RTT神经元具有增加的兴奋性,因为它们有更大的机会触发动作电位与给定的去极化电流。最近一项关于R106W错读iPSC衍生神经元的研究也发现,与MECP2敲除神经元相比,R106W错读iPSC衍生神经元在一些形态学特征和电生理特性上的响应是渐变的,并且没有检测到敲除神经元中明显的突触功能变化[gydF4y2Ba46gydF4y2Ba].在我们的例子中,我们也检查了NagydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流在CLT L124W和gydF4y2BaMECP2gydF4y2Ba我们发现,与WT相比,突变神经元在长时间的电流注入下,动作电位的持续激发受到限制,因此我们得出结论,NagydF4y2Ba+gydF4y2Ba电流大于K的减小gydF4y2Ba+gydF4y2Ba电流(无花果。gydF4y2Ba2 egydF4y2Ba).此外,我们使用MEA进行的网络电路研究揭示了一个核心表型,即网络爆发频率和持续时间发生了变化,而CLT L124W和L124W的这种变化方向相反gydF4y2BaMECP2gydF4y2Ba零神经元被成功地建立了计算模型。gydF4y2Ba
在非典型RTT神经元中减轻细胞和网络表型的修饰基因的潜在作用,可以在未来通过对已知变体的全基因组测序,并通过在活性中产生零突变来检查gydF4y2BaMECP2gydF4y2BaCLT L124W iPSC系的等位基因,以检测它们的表型是否比在三株中观察到的一致表型更温和gydF4y2BaMECP2gydF4y2Ba零突变体。我们也认识到L124W可能对其他类型的细胞有功能性影响。例如,RTT星形胶质细胞已被证明对WT和突变神经元发挥非细胞自主作用[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].由于在我们的兴奋性神经元模型中不存在抑制,在单层或类器官中共培养CLT L124W星形胶质细胞与谷氨酸能和gaba能神经元可以探索这些信号在单个神经元和网络活动中的潜在相互作用[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].gydF4y2Ba
MECP2gydF4y2Ba空全表型和RTT网络建模gydF4y2Ba
的gydF4y2BaMECP2gydF4y2Banull full表型包括较小的体细胞大小和树突长度,突触数量减少,AMPAR-mEPSC振幅和频率降低。重要的是,我们观察到稳健的网络爆发表型gydF4y2BaMECP2gydF4y2Ba零神经元。多单元峰值模式的变化表明,网络范围内的事件发生频率较低,并且有延长的突发序列gydF4y2BaMECP2gydF4y2Ba在分子方面,当MECP2蛋白完全丢失时,所有辅助因子与任何MECP2结构域的相互作用都将被取消。预计该结果将影响由MECP2结合直接调控的每个基因的转录,并且可能对miRNA加工产生额外的影响,这些影响将影响mRNA的稳定性,剪接产生替代异构体,以及蛋白质翻译的强烈减少。这些后一种途径,结合对直接转录靶标的更严重的影响,可能会在与L124W神经元的方向不同的回路中产生复杂的结果。gydF4y2Ba
的gydF4y2BaMECP2gydF4y2Ba零回路表型与Kleefstra综合征诱导的兴奋性神经培养与啮齿动物星形胶质细胞共培养中观察到的网络爆发的降低率和增加持续时间相似,其中这些变化被发现是由上调的gydF4y2BaNgydF4y2Ba-甲基- d -天冬氨酸受体亚基gydF4y2BaGRIN1gydF4y2Ba表达式[gydF4y2Ba22gydF4y2Ba].等基因WT和的局部场电位MEA记录中高度扰动的rtt相关振荡网络活性表型gydF4y2BaMECP2gydF4y2Ba敲除ipsc衍生的皮质类器官显示完全没有网络事件[gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
对网络动态变化的一种可能解释是神经元内在特性的变化,这可能会影响它们产生爆发模式的能力。我们的峰值网络模型研究了这个问题。模型模拟表明,RTT零网络爆发频率的变化可能是由去极化Na失活等神经元适应电流介导的gydF4y2Ba+gydF4y2Ba电流和活性依赖(即钙依赖)激活慢超极化KgydF4y2Ba+gydF4y2Ba渠道(gydF4y2Ba43gydF4y2Ba,gydF4y2Ba52gydF4y2Ba],它们可能是MECP2的下游靶点[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].这是由K的减小所支持的gydF4y2Ba+gydF4y2BaRTT神经元中可见的电流(图;gydF4y2Ba2gydF4y2Ba).我们之前也发现gydF4y2BaMECP2gydF4y2Ba来自npc的空神经元改变了K蛋白水平gydF4y2Ba+gydF4y2Ba通道和AMPA受体[gydF4y2Ba54gydF4y2Ba].最后,计算模拟支持了内在Na发生变化的假设gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba电流是观测到的脉冲频率变化的驱动变量。因为已知这些电流在形成神经元兴奋性、增益和对感觉输入的反应方面至关重要,这些变化可能在皮层功能中发挥重要作用[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
意义gydF4y2Ba
总之,我们使用多级方法鉴定了一系列rtt相关表型,这些表型与等基因人类干细胞来源的兴奋性神经元的形态和功能有关,这些神经元含有一种新的L124W错义或gydF4y2BaMECP2gydF4y2Ba零突变。我们在L124W MECP2中证实了轻度异染色质相关表型,该表型在具有保留言语变异的非典型RTT患者中发生突变。我们在非典型RTT神经元中定义了一组核心的细胞和网络表型,并确定了null神经元中存在的其他突触和形态表型。对于非典型神经元和无效神经元,观察到网络爆发频率和持续时间的变化,但方向相反。我们的模拟证明了spike模型用于分析干细胞衍生的RTT神经元网络的变化,这些模拟可以应用于其他神经精神疾病状态的研究。网络爆发频率的显著变化体现在gydF4y2BaMECP2gydF4y2Banull神经元提供了一种潜在的可筛选表型,用于测试候选化合物,以挽救rtt相关的变化,在这种体外试验中缓解疾病。完全拯救可能需要校正蛋白质翻译调节,从而校正钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba在核心表型中发现通道电流缺陷。gydF4y2Ba
方法gydF4y2Ba
蛋白模型、显色中心和FRAP分析gydF4y2Ba
使用PyMol分子图形系统(PDB登录代码:3C2I)对人MECP2-MBD的晶体结构进行了描述,显示MBD结合在甲基化的双链DNA序列上gydF4y2Ba脑源性神经营养因子gydF4y2Ba启动子,指示点突变位置。所有色心成像和图像分析均如前所述[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba56gydF4y2Ba]使用斐济粒子分析插件。FRAP延时成像是用一系列帧(512 × 512像素)的共聚焦延时图像,在488 nm激光激发下以0.05透射率成像,记录漂白后gfp标记的蛋白。在漂白前至少记录9帧FRAP检测帧,在1000µs漂白后用405 nm激光线以100%透射率记录一帧,在相同的时间间隔记录90帧漂白后帧。gydF4y2Ba
伦理和iPSC重新编程gydF4y2Ba
在加拿大卫生研究院干细胞监督委员会和患病儿童医院(reb# 1000050639)和加州大学圣地亚哥分校(irb# 14123ZF)的研究伦理委员会的批准下,对iPSCs进行了重新编程。现有iPSC线路列于表中gydF4y2BaS1gydF4y2Ba.gydF4y2Ba
CLT iPSC系在获得知情同意后由成纤维细胞生成。皮肤活检后,从皮肤小切口收集成纤维细胞,组织在含4%青霉素/链霉素(Gibco)的PBS 1x中清洗。随后,用针将组织分成小块,并在培养基(DMEM/F12, 15% FBS, 1% MEM NEAA, 1% l -谷氨酰胺和1%青霉素/链霉素)中镀上。1个月后,成纤维细胞从组织中迁移。在达到高度融合度后,将细胞膨胀或冷冻为原液[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba].成纤维细胞使用仙台病毒(Invitrogen)在无饲料条件下使用Matrigel(康宁)和mTeSR1 (STEMCELL Technologies)重新编程。菌落开始生长后,人工采摘菌落,在无饲料的基质涂层培养皿中扩展,并用CryoStore (STEMCELL Technologies)冷冻。支原体污染常规检查。gydF4y2Ba
iPSC/ESC培养和维护gydF4y2Ba
人类iPSC/ESCs(表gydF4y2BaS1gydF4y2Ba)保存在mTeSR1或StemMACS iPS-Brew XF (Miltenyi Biotec)培养基中涂有Matrigel的培养皿中,并添加1%青霉素/链霉素。每周用ReLeSR (STEMCELL Technologies)对iPSCs进行传代,除传代后一天外,每天更换培养基。使用Accutase (Innovative Cell Technologies)和含有10 μM rho相关激酶(ROCK)抑制剂(Y-27632, STEMCELL Technologies)的培养基进行任何单细胞分离。常规支原体检测。gydF4y2Ba
核型分析gydF4y2Ba
iPSC核型分型和标准g带染色体分析(400带分辨率)由患儿医院应用基因组学中心(tcg)进行。gydF4y2Ba
多能性分析gydF4y2Ba
固定iPSC菌落,用多能标记OCT4、NANOG、SSEA4和TRA-1-60染色。在胚状体形成和自发的3胚层分化16天后,固定并染色α-SMA、AFP和β- iii -微管蛋白。为了评估iPSCs的基因表达谱,按照制造商的协议,使用RNA PureLink RNA迷你试剂盒(Life Technologies)从6孔板的1个融合孔中提取RNA。样本被送到患儿医院的tcg进行生物分析仪评估,并在Illumina HiSeq 2500上进行配对端2 × 125测序,深度为15 M reads。生成的FASTQ文件被上传到gydF4y2Bawww.pluritest.orggydF4y2Ba用于分析[gydF4y2Ba37gydF4y2Ba].可以通过GEO登录GSE148435找到文件。gydF4y2Ba
XCI化验gydF4y2Ba
雄激素受体(AR)测定如前所述[gydF4y2Ba10gydF4y2Ba].简而言之,来自iPSCs/ESCs的400 ng基因组DNA被CpG甲基化敏感限制性内切酶消化gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2Ba铁道gydF4y2BaI是6h。使用Platinum Taq DNA Polymerase High Fidelity (Invitrogen)和AR基因引物(带FAM标签)扩增2 μL消化酶(表2)gydF4y2BaS2gydF4y2Ba).男性样本作为对照,以确认完全消化。电泳是在病童医院用TCAG进行的。使用PeakScanner(赛默飞世尔科学公司)对痕迹进行分析。来识别gydF4y2BaMECP2gydF4y2Ba等位基因在活性X染色体上表达,从iPSCs中分离RNA,用SuperScript III (Invitrogen)逆转录成cDNA。引物侧翼的变异区域(表gydF4y2BaS2gydF4y2Ba)使用Platinum Taq DNA聚合酶高保真度或Q5高保真DNA聚合酶(New England BioLabs)进行扩增,然后按照OneShot TOP10 (Thermo Fisher Scientific)或Max Efficiency DH5α (Invitrogen)的TOPO TA克隆试剂盒(Invitrogen)或Zero Blunt TOPO克隆试剂盒(Invitrogen)进行克隆gydF4y2Ba大肠杆菌gydF4y2Ba菌株。在LB培养基(MP Biomedicals)中培养,用Quick Plasmid MiniPrep Kit (Invitrogen)提取DNA。样品在tcg中进行Sanger测序,并与WT对齐gydF4y2BaMECP2gydF4y2Ba模板使用benchling.com。gydF4y2Ba
CRISPR/Cas9基因编辑gydF4y2Ba
的gydF4y2BaMECP2gydF4y2Ba使用先前描述的基因编辑策略产生Indel突变[gydF4y2Ba36gydF4y2Ba].简单地说,用寡核苷酸克隆pSpCas9(BB)−2A-Puro (PX459) V2.0 (Addgene #62988)gydF4y2BaMECP2gydF4y2Ba外显子3使用benchling.com CRISPR预测工具(描述在表gydF4y2BaS2gydF4y2Ba).通过转染8 × 10引入引子gydF4y2Ba5gydF4y2Ba使用Neon转染系统(ThermoFisher)以1500毫伏的一次脉冲30毫秒(转染效率~ 40-70%)转染100 μl尺度的1.5 μg质粒细胞。转染细胞在6孔板的2孔中镀上mTeSR1培养基,补充CloneR (STEMCELL Technologies)以提高细胞存活率。从D2-5开始,每天向mTeSR1培养基中添加嘌呤霉素(0.5 ug/ml),存活的单个菌落生长到D12-18,然后转移到24孔板。分离的克隆进行传代,用快速DNA迷你试剂盒(Zymo)收集gDNA, PCR产物送到患儿医院由tcg进行桑格测序。gydF4y2Ba
慢病毒的产生和转导gydF4y2Ba
FUW-TetO-Ngn2-P2A-EGFP-T2A-puromycingydF4y2Ba而且gydF4y2BaFUW-rtTAgydF4y2BaT. Sudhof [gydF4y2Ba40gydF4y2Ba]并按先前描述的协议打包[gydF4y2Ba59gydF4y2Ba].慢病毒在HEK293T细胞中使用第三代包装系统(gydF4y2BapMDG.2gydF4y2Ba,gydF4y2BapRSV-RevgydF4y2Ba而且gydF4y2BapMDLg / pRREgydF4y2Ba).转染48 h后收集上清中病毒颗粒,过滤浓缩91000 ×gydF4y2BaggydF4y2Ba离心2小时,4°C。对于iPSC转导,使用accutase (Innovative Cell Technologies)获得5 × 10gydF4y2Ba5gydF4y2Ba在mTeSR1中加入10 μM ROCK抑制剂和8 μg/ml polybrene (Sigma)孵育8 h。培养基改为mTeSR1,并保持和扩大转导的iPSCs以获得冷冻库存。gydF4y2Ba
Ngn2gydF4y2Ba神经元直接转换gydF4y2Ba
兴奋性皮层神经元的产生如前所述[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].简单地说,在第0天,用精确酶将iPSCs制成单细胞,并以3 × 10镀膜gydF4y2Ba5gydF4y2Ba-1 × 10gydF4y2Ba6gydF4y2Ba每孔细胞在matrigel涂层的6孔板上,StemMACS iPS-Brew XF介质添加10 μM ROCK抑制剂。第1 - 8天所述所有培养基均含有1倍青霉素/链霉素(Gibco)、1 μg/mL层粘连蛋白(Sigma)、2 μg/mL氢化强力霉素(Sigma)、10 ng/mL BDNF (Peprotech)和10 ng/mL GDNF (Peprotech)。第1天,培养基改为由DMEM/F12 (Gibco)、1x N2 (Gibco)和1x NEAA (Gibco)组成的CM1,并添加10 μM ROCK抑制剂。第2天,培养基改为添加2 ~ 5 μg/mL嘌呤霉素(Sigma)的CM1。第3天,培养基改为由Neurobasal (Gibco)、1x B27 (Gibco)和1x Glutamax (Gibco)组成的CM2,并添加2 ~ 5 μg/mL嘌呤霉素。第4-5天,培养基改为CM2。第6天改为CM2 + 10 μM Ara-C (Sigma)。第8天,停用强力霉素诱导,将神经元重新移植到0.1 mg/ml poly- l -鸟氨酸(PLO) (Sigma)和40 μg/ml层粘连蛋白(Roche或Sigma)覆盖的覆盖物或孔中,CM2中含有BDNF和GDNF,并与P1小鼠星形胶质细胞共培养,每3-4天更换一次培养基,除非下游实验另有说明。gydF4y2Ba
蛋白定量gydF4y2Ba
用放射免疫沉淀试验(RIPA)缓冲液(25 mM Tris-HCl, pH 7.6, 150 mM NaCl, 1% Nonidet P-40, 1%脱氧胆酸钠和0.1% SDS)在冰冷的PBS中洗涤的神经元(未与小鼠星形胶质细胞一起生长)中提取蛋白质。用12 -−230 kDa的Wes分离试剂盒(ProteinSimple)将等效蛋白质块装入毛细血管进行检测。使用Compass for SW软件(ProteinSimple)对MECP2和β-actin进行化学发光多重探测。gydF4y2Ba
膜片钳电生理gydF4y2Ba
电生理记录如先前报道[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].简单地说,全细胞膜片钳记录使用Axopatch 1-D放大器(Molecular Devices, USA),并使用Clampex 9.2软件和DigiData 1200系列接口(Molecular Devices, USA)进行,电流在10 kHz采样,在2 kHz滤波。使用Clampfit 9.2软件(Molecular Devices, USA)离线分析记录。所有电生理实验和数据分析均采用gydF4y2BaNgn2gydF4y2Ba研究人员看不到神经元样本。为了检查膜的内在特性,记录在35mm的组织培养皿中进行,培养皿中充满含有(mM): 140 NaCl, 5.4 KCl, 1 MgCl的细胞外溶液gydF4y2Ba2gydF4y2Ba, 15个HEPES, 2个CaClgydF4y2Ba2gydF4y2Ba, 10葡萄糖,用NaOH调整溶液pH至7.35。膜片钳移液器(5至8 MΩ)从毛细管玻璃(1.5毫米直径;World Precision Instruments, USA)使用P-87移液器(Sutter Instrument Co., USA),并填充细胞内溶液组成(单位:mM): 144 KgydF4y2Ba+gydF4y2Ba-葡萄糖酸盐,10 KCl, 2 Mg-ATP, 2 EGTA, 10 HEPES。用KOH调整溶液pH至7.2。在全细胞电压箝位条件下,在保持膜电位为−70 mV时,通过将膜电位从-80 mV增加到+60 mV,持续400 ms,从而产生电压门控离子电流。在电流箝位条件下,通过注入一系列从- 5pa到100pa(以5pa为增量)的电流步骤,从大约- 75mv的膜电位中诱发动作电位。WT和突变系中一些神经元的数据,增量为10 pA,或最大电流注入小于100 pA,与上述电流注入方案获得的数据合并,因为没有差异。在电流钳中,我们从用K测量的膜电位值中减去16mv的液体结电位gydF4y2Ba+gydF4y2Ba-葡萄糖酸盐细胞内溶液。gydF4y2Ba
为了研究突触功能,在电压钳中记录了人的mEPSCsgydF4y2BaNgn2gydF4y2Ba保持膜电位为- 60 mV的神经元。如上所述,用细胞内溶液填充记录微管。细胞外记录溶液为(单位:mM): 140 NaCl, 1 MgClgydF4y2Ba2gydF4y2Ba, 5.4 KCl, 1.3 CaClgydF4y2Ba2gydF4y2Ba, 25葡萄糖,15 HEPES, 0.003甘氨酸,0.001士的宁,0.01双核碱,0.0005河豚毒素,用NaOH调整pH至7.35。使用Mini Analysis Program (Synaptosoft Inc, USA)离线检测和分析mEPSCs。gydF4y2Ba
神经元稀疏标记gydF4y2Ba
转染神经元gydF4y2BapL-SIN-EF1α-eGFPgydF4y2Ba质粒(Addgene 21320)使用1µg DNA和2µL Lipofectamine 2000 (Thermo Fisher Scientific)每孔24孔板。转染后48小时,神经元在6周固定,并进行MAP2和GFP染色。gydF4y2Ba
免疫细胞化学和成像gydF4y2Ba
在室温下,用4%的甲醛在PBS中固定iPSCs 8 min。生长在12毫米圆形玻璃盖片(Bellco)或24孔μ -板(Ibidi)上的神经元用4%甲醛在0.4 M蔗糖克雷布斯缓冲液中固定8分钟,以保持细胞骨架完整性[gydF4y2Ba60gydF4y2Ba].用0.1% Triton X-100在室温下渗透固定细胞8分钟,并在室温下在ICC缓冲液中封闭至少1小时(10%正常山羊(Cedarlane)或驴(Sigma)血清在含0.05% Tween 20的PBS中)。一抗在ICC缓冲液中稀释,4°C孵育过夜。二抗用0.05%吐温20 PBS稀释,室温孵育1 h。除非另有说明,在室温下用1µg/ml DAPI在PBS中反染色5分钟。如果细胞在盖玻片上,则用分子级水冲洗,然后用延长金抗褪色安装介质(赛默飞世尔)将其安装在玻片上。本研究中使用的一抗详细信息见表gydF4y2BaS3gydF4y2Ba.gydF4y2Ba
iPSC多能性和3胚芽层检测采用徕卡DM14000B荧光显微镜,DFC7000T相机和LAS X软件成像。使用Hamamatsu C9100-13 EM-CDD相机和Volocity软件(Perkin Elmer),在Olympus 1 × 81旋转盘共聚焦显微镜下对神经元进行体/树突追踪成像。用Leica SP8闪电共聚焦/Light Sheet点扫描共聚焦显微镜和LAS X软件对突触进行成像。gydF4y2Ba
图像分析gydF4y2Ba
由两个人使用Imaris (Bitplane)中的纤维示踪器分析盲图像。用半自动化重建稀疏GFP标记神经元的树突来手动追踪Soma,这些神经元与MAP2共染色(3-5个复制批次,每批每个细胞系4-6个覆盖,共= 404个神经元)。人工计算SYN1和HOMER1点沿MAP2树突信号给定长度的重叠突触密度(2个复制批次,每批每个细胞系4个覆盖,共计240个树突片段)。gydF4y2Ba
MEA电镀和记录gydF4y2Ba
12孔CytoView MEA板(Axion Biosystems),每孔64个通道,8 × 8电极栅格,在pH为8.4的硼酸缓冲液中,用过滤灭菌的0.1%聚(乙基亚胺)溶液(Sigma)在室温下涂敷1小时,用水清洗4次,晾干一夜。第8天分化gydF4y2BaNgn2gydF4y2Ba神经元以1 × 10的密度重新播种gydF4y2Ba5gydF4y2BaCM2培养基由BrainPhys (STEMCELL Technologies)、1倍青霉素/链霉素、10 ng/ml BDNF和10 ng/ml GDNF组成,并添加400 μg/ ml层粘连蛋白和10 μM ROCK抑制剂。将细胞滴直接涂抹在每个孔的电极上,在37°C水化孵育1小时,然后缓慢加入添加10 μg/mL层粘连蛋白的CM2培养基。24小时后,2 × 10gydF4y2Ba4gydF4y2BaP1小鼠星形胶质细胞在每个孔的神经元上播种。添加10 μg/mL层粘连蛋白的CM2培养基在前24小时持续更换,从2周开始每周在Maestro MEA平台(Axion Biosystems)上记录两次。每个平板在37°C加热的Maestro设备上孵育5分钟,然后使用AxIS 2.0软件(Axion Biosystems)在12.5 kHz采样频率下使用0.2-3 kHz带通滤波器记录5分钟的自发性神经活动。在电极噪声标准偏差的6倍处检测到峰值。离线分析使用神经测量工具(Axion Biosystems),如果检测到至少5个尖峰/分钟,则认为电极是活跃的。采用泊松意外突发和阈值至少为25%有源电极的包络网络突发算法。在RStudio和MATLAB中完成MEA指标的进一步分析和归一化。gydF4y2Ba
统计分析gydF4y2Ba
在RStudio (v1.1.423)、SigmaPlot、GraphPad Prism或MATLAB中进行分析的统计检验。使用D 'Agostino & Pearson检验来确定数据集的正态性。各等基因对之间的比较采用双向重复测量方差分析,学生的gydF4y2BatgydF4y2Ba,一个样本gydF4y2BatgydF4y2Ba或曼-惠特尼检验(*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2Ba
网络模型gydF4y2Ba
该网络模型由N个自适应漏性集成发射(ADIF)神经元组成。与这里研究的ipsc衍生的生物神经元培养一致,该网络是完全兴奋的。膜电位gydF4y2BaVgydF4y2Ba我gydF4y2Ba的gydF4y2Ba我gydF4y2Ba单位随时间的演变,公式如下:gydF4y2Ba
在哪里gydF4y2BaCgydF4y2Ba米gydF4y2Ba为膜电容,gydF4y2BaggydF4y2BalgydF4y2Ba是泄漏电导,gydF4y2BaEgydF4y2BalgydF4y2Ba是静息膜电位,gydF4y2BaggydF4y2BaegydF4y2Ba兴奋性突触电导是否随时间变化gydF4y2BaEgydF4y2BaegydF4y2Ba是兴奋性反转电位。在第二个方程中,gydF4y2BawgydF4y2Ba是适应变量,gydF4y2BaτgydF4y2BawgydF4y2Ba适应时间是常数吗gydF4y2Ba一个gydF4y2Ba控制次阈值自适应。gydF4y2Ba
神经元的膜电位gydF4y2Ba我gydF4y2Ba超过阈值gydF4y2BaVgydF4y2BathgydF4y2Ba时,神经元发出一个尖峰,出现以下重置条件:gydF4y2Ba
在哪里gydF4y2BaVgydF4y2BargydF4y2Ba重置电位,gydF4y2BawgydF4y2BaegydF4y2Ba是兴奋性突触权重,gydF4y2Ba年代gydF4y2Ba这组神经元是突触后神经元吗gydF4y2Ba我gydF4y2Ba,gydF4y2BabgydF4y2Ba是适应步骤电流。随着传入脉冲引起的初始电导增加,兴奋性突触电导遵循简单的指数衰减:gydF4y2Ba
在哪里gydF4y2BaτgydF4y2BaegydF4y2Ba是兴奋性突触时间常数。的数量gydF4y2BaNgydF4y2Ba= 1000个神经元模拟300秒,代表体外培养记录,在Brian2模拟器中时间步长为0.1 ms [gydF4y2Ba61gydF4y2Ba].神经元随机连接兴奋性突触,连接概率为0.05,模拟网络中平均每个细胞有50个突触。gydF4y2Ba
破裂频率gydF4y2Ba
MEA原始电压信号在12.5 kHz采样频率下测量300 s,巴特沃斯带通在200 Hz和3000 Hz之间滤波。随后使用自适应阈值交叉(阈值设置为6 × Std dev)检测Spike次数,并将其组织成每个电极的Spike序列,然后进一步采样至1khz。使用MATLAB的pwelch()函数估计每个spike序列的功率谱密度(PSD),并以分贝(dB)表示为与同一spike序列随机排列版本的PSD的比值。功率谱为输入时间序列的每个可测量频率提供了一个数值权重。所描述的同步、规则爆发对应于0 ~ 1hz频谱的全局峰值。在此范围之外的全局峰的光谱被发现没有清楚地表现出这种爆发,因此被排除在分析之外。gydF4y2Ba
网络扫描gydF4y2Ba
为确定适应的理想时间常数(gydF4y2BaτgydF4y2BawgydF4y2Ba),扫描二维电容参数空间(gydF4y2BaCgydF4y2Ba米gydF4y2Ba)和神经元膜时间常数(gydF4y2BaτgydF4y2Ba米gydF4y2Ba)在膜片钳记录中观察到的范围内。通过与记录的培养数据相同的方法评估模拟中的峰值爆发频率。null和非典型CLT L124W条件的顶部模拟被确定为与记录数据的平均峰值爆发频率具有最小的绝对差异。gydF4y2Ba
为了解构各种电生理贡献变量对脉冲频率变化的影响,我们进行了计算退出实验。这里我们改变NagydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba电流或电容和静息膜值,基于图中等基因对的报告值。gydF4y2Ba2gydF4y2Ba,在WIBR3 WT和WIBR3零网络中计算峰值突发频率,如前所述。gydF4y2Ba
数据可用性gydF4y2Ba
RNAseq数据集可在GEO接入GSE148435获得。代码可视化电生理学,形态学,MEA分析和仿真建模可在gydF4y2Bahttp://github.com/mullerlab/mok2021gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Amir RE, Van den Veyver IB, Wan M, Tran CQ, Francke U, Zoghbi HY. Rett综合征是由编码甲基cpg结合蛋白2的X-linked MECP2突变引起的。Nat Genet, 1999; 23:185-8。gydF4y2Ba
查鲁尔M, Zoghbi HY. Rett综合征的故事:从临床到神经生物学。神经元。2007;56:422-37。gydF4y2Ba
Archer H, Evans J, Leonard H, Colvin L, Ravine D, Christodoulou J,等。p.R168X或p.T158M MECP2突变Rett综合征患者的临床严重程度与x染色体失活歪斜方向和程度的相关性中华医学杂志2007;44:48 - 52。gydF4y2Ba
Knudsen GP, Neilson TC, Pedersen J, Kerr A, Schwartz M, Hulten M,等。Rett综合征患者及其母亲的X染色体失活倾向增加。Eur J Hum Genet: EJHG。2006; 14:1189 - 94。gydF4y2Ba
斯基恩PJ,伊林沃思RS,韦伯S,科尔AR,詹姆斯KD,特纳DJ等。神经元MeCP2在组蛋白-八聚体水平附近表达,并全面改变染色质状态。生物化学学报。2010;37:457-68。gydF4y2Ba
Ip JPK, Mellios N, Sur M. Rett综合征:对遗传,分子和电路机制的见解。神经科学,2018;19:368-82。gydF4y2Ba
蒂洛森R Bird A.大脑中MeCP2功能的分子基础。中国生物医学工程学报(英文版);gydF4y2Ba
李聪,科菲EL, Dall 'Agnese A, Hannett NM,唐X, Henninger JE,等。MeCP2连接异染色质冷凝物和神经发育疾病。自然2020;586:440-4。gydF4y2Ba
Ananiev G, Williams EC,李华,常强。Rett综合征患者诱导多能干细胞(iPSC)野生型和突变型等基因对的体外疾病模型。PLoS ONE。2011; 6: e25255。gydF4y2Ba
张AY, Horvath LM, Grafodatskaya D, Pasceri P, Weksberg R, Hotta A,等。通过x染色体失活分离mecp2缺失的Rett综合征患者hiPS细胞及等基因对照Hum Mol Genet, 2011; 20:2103-15。gydF4y2Ba
张伟,刘志刚,张志强,张志强,等。MECP2e1亚型突变影响Rett综合征患者iPS细胞神经元的形态和功能。神经生物学杂志2015;76:37-45。gydF4y2Ba
金凯,许淑丽,朴英华。Rett综合征患者诱导多能干细胞的神经元成熟缺陷。美国国家科学研究院。2011; 108:14169 - 74。gydF4y2Ba
李勇,王华,马菲特,程伟,Orlando DA, Loven J,等。人胚胎干细胞来源的Rett综合征神经元的整体转录和翻译抑制。细胞干细胞。2013;13:446-58。gydF4y2Ba
马凯涛,杨文杰,杨文杰,等。利用人诱导多能干细胞的神经发育和治疗Rett综合征的模型。细胞。2010;143:527-39。gydF4y2Ba
唐旭,Drotar J, Li K, Clairmont CD, Brumm AS, Sullins AJ,等。KCC2基因表达的药理学增强对人Rett综合征神经元和Mecp2突变小鼠有治疗作用。中国医学科学。2019;11:eaau0164。gydF4y2Ba
郭淑娟,郭志强,刘志强,等。mecp2调控的miRNAs通过对ERK和AKT信号的不同影响控制早期人类神经发生。摩尔精神病学。2018;23:1051-65。gydF4y2Ba
Dani VS, Chang Q, Maffei A, Turrigiano GG, Jaenisch R, Nelson SB. Rett综合征小鼠模型中兴奋和抑制平衡的改变导致皮层活性降低。美国国家科学研究院。2005; 102:12560-5。gydF4y2Ba
Nelson ED, kalavalali ET, Monteggia LM。mecp2依赖的转录抑制调节兴奋性神经传递。生物学报。2006;16:10 10 - 6。gydF4y2Ba
陈伟伟,张强,林勇,Meissner A, West AE, Griffith EC,等。BDNF转录的解除抑制涉及MeCP2的钙依赖性磷酸化。科学。2003;302:885-9。gydF4y2Ba
科恩,盖贝尔,赫姆伯格,哈钦森,萨达卡,伊伯特,等。全基因组活动依赖的MeCP2磷酸化调节神经系统的发育和功能。神经元。2011;72:72 - 85。gydF4y2Ba
孙淑娟,王志强,王志强,等。来自自闭症患者的CNTN5(−)(/+)或EHMT2(−)(/+)人类ipsc衍生神经元发展出过度活跃的神经元网络。eLife。2019; 8: e40092。gydF4y2Ba
Frega M, Linda K, Keller JM, Gumus-Akay G, Mossink B, van Rhijn JR,等。由增强的NMDAR信号介导的Kleefstra综合征模型中的神经元网络功能障碍。国家公共。2019;10:4928。gydF4y2Ba
Nageshappa S, Carromeu C, Trujillo CA, Mesci P, espuni - camacho I, Pasciuto E,等。人类MECP2复制模型中神经元网络的改变和拯救。摩尔精神病学,2016;21:178-88。gydF4y2Ba
Trujillo CA, Adams JW, negrees PD, Carromeu C, Tejwani L, Acab A,等。人类MECP2-KO神经元和皮质类器官中突触和网络病理的药理学逆转。EMBO Mol医学。2021;13:e12523。gydF4y2Ba
王晓明,王晓明,王晓明,王晓明。神经发育障碍诱导多能干细胞模型中神经元功能表型的研究。杂志(巴塞尔)。2022; 11:316。gydF4y2Ba
Renieri A, Mari F, Mencarelli MA, Scala E, Ariani F, Longo I,等。Rett综合征Zappella变异(保留言语变异)的诊断标准。大脑开发,2009;31:208-16。gydF4y2Ba
george PT, Horowitz-Scherer RA, Adkins N, Woodcock CL, Wade PA, Hansen JC。染色质压缩由人MeCP2。在没有DNA甲基化的情况下,新型次级染色质结构的组装。中国生物化学杂志,2003;gydF4y2Ba
Ho KL, McNae IW, Schmiedeberg L, Klose RJ, Bird AP, Walkinshaw MD. MeCP2与DNA的结合依赖于甲基- cpg的水合作用。化学学报,2008;29:525-31。gydF4y2Ba
Krishnaraj R, Ho G, Christodoulou J. RettBASE: Rett综合征数据库更新。胡姆穆特,2017;38:922-31。gydF4y2Ba
阿加瓦尔,贝克尔,乔斯特,哈斯,塔库尔BK,布雷罗,等。MeCP2 Rett突变影响大规模染色质组织。Hum Mol Genet, 2011; 20:4187-95。gydF4y2Ba
工藤S,野村Y, Segawa M,藤田N,中尾M, Schanen C,等。甲基CpG结合域携带错义突变的MeCP2残馀功能的异质性中华医学杂志2003;40:487-93。gydF4y2Ba
谢赫·提,Ausio J, Faghfoury H, Silver J, Lane JB, Eubanks JH,等。从功能到表型:MECP2错义突变男性的DNA结合和聚类受损与临床严重程度相关。科学代表2016;6:38590。gydF4y2Ba
Buchovecky CM, Turley SD, Brown HM, Kyle SM, McDonald JG, Liu B,等。Mecp2突变小鼠的抑制筛选与Rett综合征中的胆固醇代谢有关。Nat Genet, 2013; 45:1013-20。gydF4y2Ba
Scala E, Longo I, Ottimo F, Speciale C, Sampieri K, Katzaki E,等。Rett综合征MECP2缺失与基因型-表型相关性中国医学杂志,2007;gydF4y2Ba
Mossink B, Verboven AHA, van Hugte EJH, Klein Gunnewiek TM, Parodi G, Linda K,等。微电极阵列上的人类神经元网络是一种非常强大的工具,可以在体外研究疾病特异性基因型-表型相关性。干细胞代表2021;16:2182-96。gydF4y2Ba
刘娟,刘志刚,刘志刚,王伟,等。控制iPSC系的精确健康资源,用于多功能多谱系分化。干细胞报告2019;13:11 126 - 41。gydF4y2Ba
Muller FJ, Schuldt BM, Williams R, Mason D, Altun G, Papapetrou EP,等。人类细胞多能性的生物信息学分析。Nat Methods. 2011; 8:315-7。gydF4y2Ba
Mekhoubad S, Bock C, de Boer AS, Kiskinis E, Meissner A, Eggan K.剂量补偿侵蚀影响人类iPSC疾病建模。细胞干细胞。2012;10:595-609。gydF4y2Ba
Deneault E, White SH, Rodrigues DC, Ross PJ, Faheem M, Zaslavsky K,等。基因编辑对自闭症易感基因的完全破坏主要降低了等基因人类神经元的功能连通性。干细胞代表2018;11:1211-25。gydF4y2Ba
张勇,白超,韩勇,Ahlenius H,张震,昌达生,等。从人多能干细胞中快速单步诱导功能神经元。神经元。2013;78:785 - 98。gydF4y2Ba
Farra N, Zhang WB, Pasceri P, Eubanks JH, Salter MW, Ellis J. Rett综合征诱导的多能干细胞来源的神经元揭示了新的神经生理变化。Mol精神病学,2012;17:1261-71。gydF4y2Ba
神经语法:细胞组装,突触体和读卡器。神经元。2010;68:362 - 85。gydF4y2Ba
自适应指数积分-放电模型对神经元活动的有效描述。神经生理学杂志,2005;94:3637-42。gydF4y2Ba
李志强,李志强,李志强,等。适应电流对神经元峰值阈值、增益和变异性的影响。神经生理学杂志,2014;gydF4y2Ba
高芬D,周志军。Rett综合征的神经回路基础。Front Biol(北京)。2012; 7:428-35。gydF4y2Ba
陈旭,韩旭,Blanchi B,管伟,葛伟,于玉春,等。Rett综合征的分级和泛神经疾病表型与功能性MeCP2的剂量相关。蛋白质细胞。2021;12:639-52。gydF4y2Ba
李志强,李志强,李志强。mecp2缺失神经胶质细胞对神经元树突形态的非细胞自主影响。神经科学。2009;12:31 - 7。gydF4y2Ba
Williams EC,钟X, Mohamed A,李锐,刘勇,董强,等。Rett综合征患者特异性iPSCs分化的突变星形胶质细胞对野生型神经元有不良影响。胡姆·摩尔·热奈。2014;23:2968-80。gydF4y2Ba
Mossink B, van Rhijn JR, Wang S, Linda K, Vitale MR, Zöller JEM,等。Cadherin-13是人类干细胞衍生神经元网络中gaba能调节的关键调节因子。摩尔精神病学,2022;27:1-18。gydF4y2Ba
高锐,陈志强,陈志强,等。从皮质类器官中产生的复杂振荡波模拟了早期人类大脑网络的发展。《细胞干细胞》2019;25:558-69.e7。gydF4y2Ba
Samarasinghe RA, Miranda OA, Buth JE, Mitchell S, fernando I, Watanabe M,等。人脑类器官中神经振荡和癫痫样改变的鉴定。神经科学。2021;24:1488-500。gydF4y2Ba
王志强,王志强,王志强,等。神经递质对新皮层神经元活性和兴奋性的影响。大脑皮层。1993;3:387-98。gydF4y2Ba
Schmunk G, Gargus JJ。自闭症谱系障碍中的通道病发病机制。《前热内》2013;4:222。gydF4y2Ba
Rodrigues DC, Mufteev M, Weatheritt RJ, Djuric U, Ha KCH, Ross PJ,等。核糖体接合的改变影响Rett综合征神经发育和泛素化的关键基因集。Cell rep 2020; 30:4179-96.e11。gydF4y2Ba
Gutkin B, Zeldenrust F.峰频适应。Scholarpedia。2014;9:30643。gydF4y2Ba
谢赫·提,德·帕兹AM,阿赫塔尔·S,奥西奥·J,文森特·JB。MeCP2_E1 n端修饰影响其降解速率,并被Ala2Val Rett突变破坏。胡姆·摩尔·热内,2017;26:4132-41。gydF4y2Ba
Fernandes IR, Russo FB, Pignatari GC, Evangelinellis MM, Tavolari S, Muotri AR,等。成纤维细胞来源:我们从哪里可以得到它们?Cytotechnology。2016;68:223-8。gydF4y2Ba
Beltrao-Braga PC, Pignatari GC, Maiorka PC, Oliveira NA, Lizier NF, Wenceslau CV,等。从人未成熟牙髓干细胞无饲料来源诱导多能干细胞。细胞移植,2011;20:1707-19。gydF4y2Ba
霍塔A,张AY,法拉N,加查K,张文文,帕塞里P,等。人诱导多能干细胞的EOS慢病毒载体选择系统。Nat protocol . 2009; 4:1828-44。gydF4y2Ba
Kwiatkowski AV, Rubinson DA, Dent EW, Edward van Veen J, Leslie JD, Zhang J,等。Ena/VASP是发育中的皮层神经细胞发生所必需的。神经元。2007;56:441-55。gydF4y2Ba
Goodman D, Brette R. Brian: python神经网络的模拟器。前沿神经信息。2008;2:5。gydF4y2Ba
确认gydF4y2Ba
我们感谢非典型病人家属的参与;Lyndon Duong, Milad Khaki和Fraser McCready的初步MEA计算研究;Janice Hicks的技术支持;云力为慈祥赠予WIBR3 WT和NULL细胞;用于核型和测序的TCAG;以及病童成像设备。gydF4y2Ba
资金gydF4y2Ba
本研究由多伦多大学Col Harland Sanders Rett综合征研究基金(给JE)、SFARI(研究资助#514918给JE和JM-T)、CIHR (MOP-133423给JE和MWS;ERARE团队资助ERT161303(到乙脑),CIHR基金会资助(FDN-154336到MWS),安大略省大脑研究所(POND网络到乙脑),McLaughlin中心加速器资助(到乙脑),John Evans领导基金和安大略省研究基金(到乙脑),加拿大儿童疾病干细胞模型研究主席(到乙脑),Beta Sigma Phi国际捐赠基金(到乙脑),通过加拿大第一研究卓越基金(到GB, KP, LM, JM-T)在西部大学进行大脑扫描,美国国立卫生研究院(NIH)授予# R01MH108528, R01MH109885和R01MH1000175(给ARM)和安大略省雷特综合征协会(给JBV)。培训生支持由NSERC研究生奖学金-博士(PGS-D)奖学金(KP)和resacomp (LCD)提供。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
RSM、WZ、TIS、IRF、ARM、JBV、MWS和JE概念化并设计实验。RSM、WZ、TIS、IRF、LCD、MRH、DCR、MM、WW、AP、JL进行实验分析。KP、RSM、GB、LM和JM-T对模拟进行了概念化、设计、执行和分析。ARM、LM、JBV、JM-T、MWS和JE监督并获得资助。RSM, WZ, TIS, KP, IRF, GB, JM-T, LM和JE撰写了论文。所有作者对论文进行了修改和批准。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
ARM是TISMOO的联合创始人之一,并拥有TISMOO的股权,TISMOO是一家致力于遗传分析和脑类器官建模的公司,专注于为自闭症谱系障碍和其他遗传性神经疾病定制的治疗应用。该协议的条款已由加州大学圣地亚哥分校根据其利益冲突政策进行了审查和批准。在准备这篇手稿期间,MRH成为STEMCELL技术公司的员工。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
莫淑芬,张伟,谢赫,T.I.gydF4y2Baet al。gydF4y2Ba与Rett综合征相关的人类干细胞来源的兴奋性神经元的广谱神经元和网络表型gydF4y2BaMECP2gydF4y2Ba突变。gydF4y2BaTransl精神病学gydF4y2Ba12gydF4y2Ba, 450(2022)。https://doi.org/10.1038/s41398-022-02216-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41398-022-02216-1gydF4y2Ba