摘要
抗抑郁药物反应的基因结构尚不清楚。多基因风险评分(PRS)、安慰剂反应的探索和子量表的使用可能提供见解。在这里,我们使用临床量表(包括亚量表和自我报告评估)调查了相关复杂特征的PRSs与对vortioxetine治疗和安慰剂的反应之间的关系。我们收集了一份接受vortioxetine治疗的重度抑郁症(MDD)患者的临床测试样本(N= 907)或安慰剂(N= 455)来自7个随机双盲临床试验。同时,我们从一项基于网络的观察性研究中获得了vortioxetine治疗患者的数据(N= 642)。抗抑郁药物反应、精神障碍和症状特征的PRSs是使用来自强大的全基因组关联研究(GWAS)的汇总统计数据得出的。在每两个试验样本和经验中进行了PRSs和治疗反应之间的关联检验p-values进行了评估。在临床试验样本中,没有PRSs与Bonferroni校正后vortioxetine治疗或安慰剂的反应显著相关。然而,临床评估的治疗反应PRS名义上与vortioxetine治疗和安慰剂反应相关,通过几个次要结局量表(HAM-A的改善,HAM-A精神焦虑亚量表,CPFQ和PDQ), (P≤0.026)。此外,较高的主观幸福感(P≤0.033)和较低的凹陷PRS (P= 0.01)名义上与较高的安慰剂反应相关。在自我报告的测试样本中,较高的精神分裂症PRS与较差的自我报告反应显著相关(P= 0.0001)。确定的PRSs解释了安慰剂和治疗反应中方差的低比例(1.2-5.3%)。尽管结果有限,但我们认为,随着更多功能强大且表型相似的GWAS碱基可用,PRS关联作为治疗反应的预测因子具有不可弥补的潜力。
介绍
第二代抗抑郁药,如选择性血清素再摄取抑制剂(SSRIs),是治疗重度抑郁症(MDD)的一线治疗药物。尽管这些药物比安慰剂更有效,但在治疗的前6-12周内,约50%的患者没有得到缓解,超过30%的患者没有反应[1,2].对于无反应的患者,寻找有效治疗方法的过程可能很长,延误康复,并对个人和社会造成沉重负担[3.,4].重度抑郁症是全世界致残的主要原因,并在普通人群中呈现出日益增长的流行趋势[5,6,7,8,9开发更多个性化的治疗方案来改善结果是至关重要的。
基于5151个个体的密集单核苷酸多态性(SNP)芯片数据,临床评估MDD缓解的SNP遗传率估计为13.2% [10].然而,从候选基因研究中没有可靠地复制出预测抗抑郁药物反应的变异[11]或全基因组关联研究[10,12].这很可能是由于可用的样本量有限,临床试验设计的差异,包括各种药物、患者诊断和临床终点,以及治疗反应的复杂多基因结构。
与其关注预测抗抑郁药物反应的个体变异,另一种方法是通过多基因风险评分(PRS)将遗传位点的信息结合起来,PRS是与给定个体的某个特征相关的风险等位基因的加权总和[13].最近的一些研究探讨了抗抑郁药物治疗反应与精神障碍和人格特征的PRSs之间的关系。较高的注意力缺陷多动障碍(ADHD) PRS与较高的治疗性抑郁症风险相关[14].此外,为MDD制定更高的PRS [12,14,15,16]、精神分裂症[12,16,17]和神经质[14,15,16]显示出与较差的治疗反应或抗抑郁治疗耐药性有名义上的关联。最近的一项研究提出了临床评估抗抑郁药物反应的最大GWAS [10].使用一个独立的队列,该研究发现抗抑郁药物反应和抗抑郁药物缓解的PRS名义上有显著的关联,这是根据他们自己的GWAS汇总统计数据计算出来的。此外,他们还将这一宝贵的数据资源发布给其他人使用。
目前文献的一个局限性是安慰剂反应尚未在PRS背景下进行研究。这对于能够开发对特定治疗反应的遗传预测因子,而不是非特异性反应,以及个性化治疗决策是必要的。因此,研究MDD患者安慰剂反应的遗传学可以确定药物疗效和安慰剂反应的遗传学基础的潜在差异和相似之处。进一步的问题是,在抑郁症严重程度的特定症状领域,如焦虑和认知缺陷,是否存在反应的遗传预测因子,这可以用于进一步的个性化治疗。
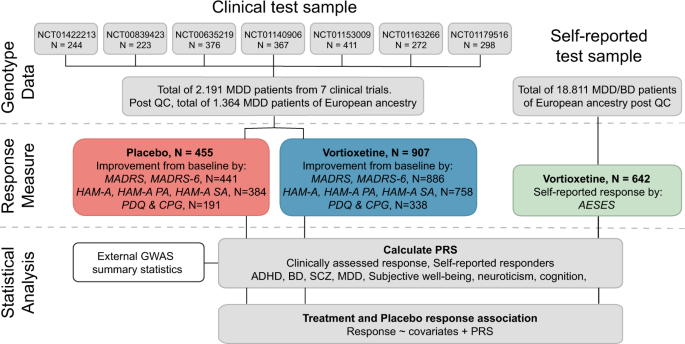
基于此,本研究的目的是通过汇总临床试验数据评估PRSs与安慰剂和抗抑郁药物治疗反应的相关性,并测试其对23andMe公司进行的基于网络调查的现实数据的泛化性。[18].我们使用深层临床测试样本(Nvortioxetine和安慰剂治疗患者的自我报告测试样本(vortioxetine治疗患者的自我报告测试样本)(N= 642)。Vortioxetine是一种被批准用于治疗重度抑郁症的抗抑郁药,除了抗抑郁外,它还具有抗焦虑作用,减少认知障碍[19].在临床试验样本中,vortioxetine和安慰剂反应由7个随机、双盲、安慰剂对照临床试验的MDD患者的几个临床量表和亚量表测量。使用测试样本和利用最近发表的GWAS抗抑郁治疗反应(自我报告反应,临床评估反应),精神障碍(多动症,双相情感障碍,精神分裂症和重度抑郁症)和症状特征(主观幸福感,神经质和认知)的总结统计数据,我们调查了以下问题:(1)在我们的自我报告和临床测试样本中,自我报告的治疗应答者或临床评估的治疗应答者的PRS是否与vortioxetine应答相关?(2)治疗反应PRS与vortioxetine反应的相关性是否大于与疾病或症状特征的相关性?(3)在临床试验样本中,治疗反应、疾病或症状特征的PRS与安慰剂反应相关吗?它与观察到的vortioxetine反应的PRS相关性如何?
方法和材料
临床试验样本
患者与试验设计
临床试验样本包括来自7个评估vortioxetine疗效的随机、双盲、安慰剂对照临床试验的MDD患者,见表1.患者分别接受vortioxetine(2.5、5、10、15或20 mg/day)、文拉法辛XL (25 mg/day)、度洛西汀(60 mg/day)或安慰剂治疗6或8周。患者经DSM-IV-TR临床诊断为重度抑郁症[20.].他们目前处于持续时间≥3个月的抑郁发作中,并有蒙哥马利-Åsberg抑郁评定量表[21] (MADRS)基线随访时总分≥26分。在所有7项临床试验的共同排除标准中,包括当前除重度抑郁症以外的精神疾病,在基线前或研究期间两周内服用精神药物,以及有显著的自杀风险。
本研究依据《赫尔辛基宣言》进行,使用伪匿名的人类生物材料和临床数据。在参与之前,所有患者都提供了参与的书面知情同意,包括对探索性遗传研究的同意。
抗抑郁药物反应的测量
在临床试验样本中,使用一个主要反应结局和五个次要反应结局评估治疗反应。主要结局是MADRS测量的抑郁症状较基线的总体改善(较基线变化*(−1))[21].结果被量化为改善,因此更高的值意味着更好的反应。次要结果为基线的总体改善;抑郁症状用MADRS-6亚量表测量;以汉密尔顿焦虑评定量表(HAM-A)衡量的焦虑症状[22]和HAM-A精神焦虑(PA)和HAM-A躯体焦虑(SA)亚量表。最后一个次要结果是通过感知缺陷问卷(PDQ)测量的认知功能障碍相对基线改善(相对基线改变*(−1))[23]或麻省总医院认知及身体功能问卷[24].因此,涡替西汀和安慰剂反应被称为MADRS改善、MADRS-6改善、HAM-A改善、HAM-A PA改善、HAM-A SA改善以及PDQ和CPFQ改善。量表和子量表的详细描述在补充材料中提供一个.
除研究NCT00839423持续6周外,其余患者均治疗8周。因为从开始治疗到临床医生能够可靠地检测到治疗是否有效大约需要4周的时间[25],只有至少接受了4周治疗的患者被纳入分析。对于资料缺失的患者,采用最后一次观察结转的方法。数字1提供方法的流程图。
临床试验样本包括来自7个随机、双盲、安慰剂对照临床试验的2191名基因型MDD患者,他们接受vortioxetine或安慰剂治疗。907例vortioxetine治疗的患者和455例安慰剂治疗的欧洲遗传血统患者通过了基因分型质量控制(QC)。使用不同的临床量表和亚量表对反应进行量化,得出vortioxetine组和安慰剂组均有6个反应指标。患有抑郁症或双相情感障碍的欧洲血统参与者的自我报告测试样本基于AESES问卷确定了642名vortioxetine治疗的参与者。在统计分析中,计算了两个样本中每个人的治疗反应、疾病和症状特征的PRSs。评估了Vortioxetine和安慰剂反应与这些PRSs的相关性。
SNP基因分型与质量控制(QC)
在临床测试样本中,在基线时采集血液样本并存储在Lundbeck生物样本库中。使用Illumina Omni5Exome4 v1.1 SNP阵列对来自2191个个体的样本分三批进行基因分型。使用GenomeStudio (v2011.1)进行聚类基因型调用。
基本QC在PLINK 2.0中进行[26].首先,每个基因型批次都进行了QC,包括去除缺失低于0.02的个体,并将所有snp转化为hg19正向链。即使在将所有snp转化为正向链后,我们在与1000个基因组阶段3参考面板合并时也观察到翻转错误。因此,如果snp不在参考组中,且其等位基因频率与参考组的绝对差异大于0.25,则将其删除。最后,将三个批次进行合并,只保留了欧洲血统分数> 95%的个体,使用admix [27].
然后,我们对样本进行进一步的QC,以去除以下一个或多个snp:小等位基因频率(MAF) < 0.01,缺失> 0.02,Hardy-Weinberg (HWE)p-value < 0.00001。我们删除了缺失> 0.02的个体,这是一对IBD > 0.25或k1 = > 0.3或k2 = > 0.3,其中>与使用Eigensoft计算的每个主成分(PCs)的平均值相差6个标准差(SD) [28],或者杂合度评分为>,与均值相差4个标准差。共有2.166.166个snp和1.364个欧洲血统的个体通过QC。对欧洲血统的限制造成了最大的个人损失。PCs在后续分析中作为协变量,基于基因分型SNPs并使用Eigensoft计算。
数据使用密歇根输入服务器的Docker版本输入到1000个基因组阶段3参考面板[29].采用PLINK 2.0进行imputation后QC,去除MAF < 0.01的SNPs,缺失> 0.02,imputation评分(R[2]) < = 0.3,重复和非常染色体snp。最后一组8,316,717个snp被纳入分析。
在临床测试样本中,使用Plink v2对安慰剂和vortioxetine反应的六项测量中的每一项进行全基因组关联测试,使用线性模型并调整性别、年龄和PC1-PC8。剂量也被纳入vortioxetine反应组的协变量。使用LD评分回归(LDSC),生成的汇总统计数据用于计算6种安慰剂和沃替西汀反应结果的SNP遗传力和遗传相关性[30.].在全基因组复杂性状分析(GCTA)中,使用GREML从个体水平数据计算SNP遗传力[31)软件。详见补充资料B.
自报检测样本
自我报告的样本来自23andMe公司的一项观察性研究,名为AFFECT研究[18]对18811名欧洲参与者进行了调查,这些参与者由医疗专业人员自我报告诊断为抑郁症或双相情感障碍,并获得了药物状态数据。这项研究包括642名欧洲遗传血统的研究参与者,他们在过去五年内接受了vortioxetine,并将反应从0(完全没有)到4(很大)进行了评估。参与者被诊断患有重度抑郁症(N= 419)或双相情感障碍(N= 254),是美国公民。样本通过23andMe标准化管道进行基因分型、分阶段和赋值,并作为抗抑郁药疗效和副作用(AESES)问卷的一部分获得vortioxetine治疗反应[32].在本分析中使用了常染色体和X染色体上大约901万个高质量基因分型和估算snp。
基础GWAS汇总统计QC
公开的9种不同表型的GWAS统计数据被用作计算本研究中使用的prs的基础。表型为自我报告的治疗应答者[17],临床评估治疗效果(改善百分比)[10], MDD [33]、双相情感障碍[34]、精神分裂症[35], adhd [36]、主观幸福感[37]、神经质[38],以及一般认知功能[39].基本汇总统计数据的概述见补充资料表S1.QC通过去除;MAF < 1%和INFO < 0.8的snp, MHC区域内的snp,重复的和不明确的snp。
临床试验样本的多基因风险评分
多基因风险评分(prs)是使用PRSice v2.3.5的9个GWAS基础汇总统计数据的加性模型来计算的[40].PRSs标准化后的均值为零,标准差为1。使用window = 250 kb和r2= 0.1去除LD中的snpp-value阈值(pTs),取值范围为0.000001 ~ 1。在临床试验样本中,使用线性回归评估了每个pT的PRSs与6种vortioxetine和安慰剂反应措施之间的相关性,并对性别、年龄和PC1-PC8进行了调整。剂量也被纳入vortioxetine治疗患者的协变量。我们观察到基线症状严重程度与任何结果测量之间没有显著相关性(见补充材料)B).因此,基线症状严重程度未作为协变量纳入PRS关联分析。确定了导致最具预测性的PRS的pT。我们通过使用10000个排列计算最具预测性的PRS的经验p值来控制第一类误差。我们共进行了108项试验(2*(治疗组)*9(基础GWAS)*6(缓解结局测量)),并使用Bonferroni校正进行多项试验控制(0.05/108 = 0.00046)。当描述这项研究的结果时,名义上的显著性意味着经验p-值< 0.05,未达到Bonferroni显著性阈值。
自报告样本的多基因风险评分
自我报告样本的PRS分析如上所述。在对11例患者的性别、年龄、基因型阵列、诊断和5例患者进行调整的同时,进行了自我报告的vortioxetine反应指标与9个GWAS汇总统计数据的prs之间的相关性检验。PRS也使用10,000排列测试和经验进行p-values被报告。由于自我报告的测试样本只包括vortioxetine治疗的患者和一种表型,Bonferroni校正后的显著性阈值为0.0056(0.05/9 = 0.0056)。
结果
测试样品特性
临床试验样本包括1364名具有欧洲遗传血统的抑郁症患者。907例接受vortioxetine治疗,457例接受安慰剂治疗。人口统计数据和基线特征见表1和“补充资料表”S4.临床试验样本69.4%为女性,平均年龄为45.1岁(SD = 12.6)。患者中度至重度抑郁,平均基线MADRS评分为32.2 (SD = 3.8)。基线时,综合研究后,安慰剂和vortioxetine在人口统计学或临床特征上没有临床相关差异。总体而言,与安慰剂治疗的患者相比,vortioxetine治疗的患者在所有量表和亚量表上均表现出更大的基线平均改善(补充材料表)S5).
自我报告的测试样本包括642名欧洲遗传血统的研究参与者,他们在过去五年内接受了vortioxetine。样本80.8%为女性,年龄18-50岁(平均(SD) = 35.2(7.9))。研究参与者中度抑郁,平均基线PROMIS抑郁t评分[21,41] (SD = 8.61)。
预期中,未观察到vortioxetine反应或安慰剂反应的显著全基因组关联、基于snp的遗传力或遗传相关性,见补充材料B和补充材料图。S1- - - - - -S4.
治疗反应PRSs与vortioxetine反应的相关性
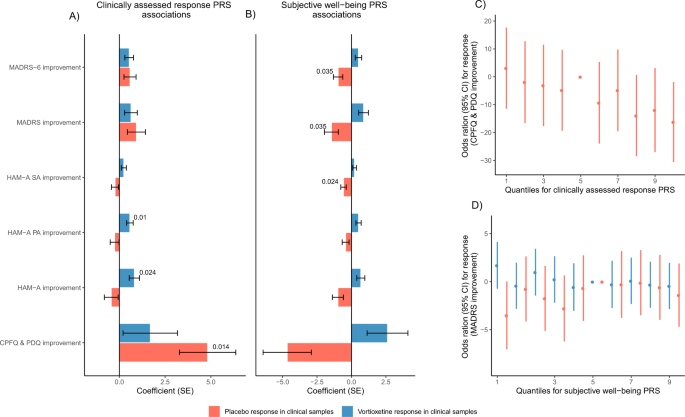
在我们的临床和自我报告的测试样本中,我们调查了自我报告的治疗应答者和临床评估的治疗应答者的PRS是否与vortioxetine应答相关。PRS与经验的关联p-value低于0.05,见表2.所有PRS协会均列于补充资料表C并在补充材料图中可视化。S8,S9.我们对不同样本量的测试样本进行了PRS分析,以评估我们的结果,详见补充材料B.
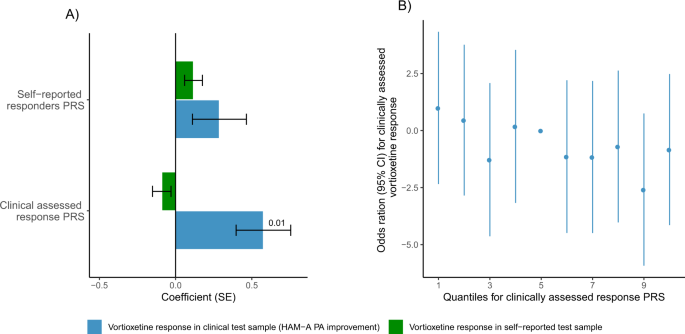
对于临床试验样本中接受vortioxetine治疗的患者,在多次测试后没有显著相关性。较高的临床评估应答PRS名义上与焦虑症状的改善相关(HAM-A改善:pT = 0.0001, beta (SE) = 0.82(0.28), emp。p-value = 0.026和HAM-A PA改善:pT = 0.0001, beta (SE) = 0.58 (0.18), emp。p-value = 0.014),见图。2 a, B.在临床试验样本中,评估vortioxetine反应的所有6个反应指标均显示同一方向的名义关联,见图。4.在自我报告的测试样本中,无论是自我报告的治疗应答者PRS还是临床评估的治疗应答者PRS都与自我报告的沃替西汀治疗应答无关。
疾病和症状特征PRSs与vortioxetine反应的关系
接下来,我们研究了一种疾病的PRSs和症状特征是否与治疗反应相关。在临床和自我报告的测试样本中,针对多动症、双相情感障碍、精神分裂症、重度抑郁症、主观幸福感、神经质和认知的PRS与vortioxetine反应的相关性进行了测试。
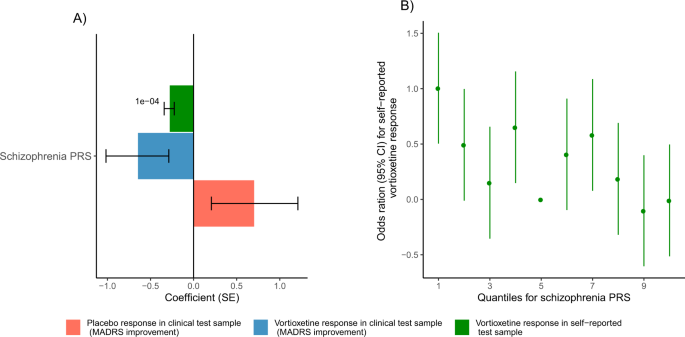
在自我报告的测试样本中,精神分裂症PRS与自我报告的vortioxetine反应显著相关(pT = 0.0001, beta (SE) =−0.28 (0.06),emp。p-value = 0.0001),其中较高的精神分裂症PRS与较差的vortioxetine反应相关,见图。3 a, B.在临床试验样本中,与经验性无关p数值< 0.05。然而,在临床试验样本中,我们观察到与先前发现方向相同的效应量,其中精神分裂症PRS较高与MADRS改善测量的vortioxetine反应较差相关(pT = 1, beta (SE) =−0.55 (0.36),emp。p值= 0.39)和MADRS-6改进(pT = 0.001,β(SE) =−0.41 (0.24),emp。p-value = 0.31),见图。3.
治疗反应、疾病和症状特征PRSs与安慰剂反应的关系
最后,我们调查了相关复杂性状的PRSs是否与安慰剂反应相关,以及与临床试验样本中观察到的vortioxetine反应的相关性相比,潜在的相关性如何。
临床评估反应、MDD和主观幸福感的PRS在名义上与安慰剂反应相关。p-value < 0.05,表2).更高的临床评估应答PRS名义上与更好的安慰剂应答相关(CPFQ和PDQ改善:pT = 0.1, beta (SE) = 4.82 (1.54), emp。p-value = 0.004),见图。4.综上所述,临床试验样本中vortioxetine反应最显著的关联也被发现与临床评估反应PRS(表2)2,无花果。2).此外,更高的MDD PRS名义上与更好的安慰剂反应相关(HAM-A SA改善pT = 0.00005, beta (SE) =−0.54 (0.19),emp。p-value = 0.011)。相比之下,较高的MDD PRS提示临床试验样本在6个响应措施中的4个中vortioxetine响应更好,见补充材料图。S8.最后,在以下措施中,较高的主观幸福感PRS与较差的安慰剂反应存在名义上的关联;MADRS改进(pT = 0.001,β(SE) =−1.45 (0.50),emp。p值= 0.031),MADRS-6改进(pT = 0.001,β(SE) =−0.97 (0.34),emp。p值= 0.033)和HAM-A SA改进(pT = 0.005,β(SE) =−0.57 (0.20),emp。p-value = 0.028)。有趣的是,在临床测试样本中,接受vortioxetine治疗的患者的主观幸福感PRS始终显示相反的趋势,其中更高的PRS与更好的治疗反应相关,见图。4 b、D.
讨论
在这项研究中,我们收集了七个随机、双盲、安慰剂对照临床试验的遗传和临床数据,这些试验评估了vortioxetine的疗效,结果为阳性。通过该临床测试样本和vortioxetine治疗患者的自我报告测试样本,我们调查了PRS与vortioxetine和安慰剂反应的关系,使用临床量表、临床亚量表和自我报告评估。
在我们的临床试验样本中,Bonferroni校正后无显著相关性。在我们的临床测试样本中,临床评估反应PRS名义上与vortioxetine改善焦虑症状相关。我们观察到,在评估临床vortioxetine在HAM-A PA亚量表上的治疗反应时,与HAM-A总分相比,有更强的相关性。在自我报告的治疗样本中,我们发现较高的精神分裂症PRS与较差的自我报告反应相关。此外,我们发现较高的主观幸福感PRS和较低的抑郁PRS与较高的安慰剂反应有名义上的关联。
在我们的研究中,vortioxetine治疗患者临床评估治疗反应的最佳预测因子是来自GWAS汇总统计基础的临床评估反应PRS,样本量为5218人[10].自我报告的应答者PRS [17]显示与临床评估的vortioxetine患者无相关性,即使该PRS来自更大样本量(12,537个个体)的基础GWAS。在最近发表的一项研究中,临床评估缓解的PRS与临床评估的治疗反应有名义上的相关性[10].有趣的是,在自我报告反应的队列中,临床评估缓解的PRS与治疗难治性抑郁症队列(定义为处方至少一种抗抑郁药的个体)之间没有观察到相关性[10].这表明治疗反应PRS可用于预测治疗反应。
在自我报告的测试样本中,我们报告了较高的精神分裂症PRS与较差的自我报告vortioxetine治疗反应之间的显著相关性。这与之前的研究结果一致[10,12,17].
基于大规模GWAS汇总统计(N范围从55,374到500,199),我们没有观察到临床评估vortioxetine反应与疾病或症状特征PRS之间的任何关联,这一事实强调了使用与靶标更相关的治疗反应PRS预测器时获得的权力,尽管权力较低(N= 5218),参见补充材料中一系列相关性的功率计算B.虽然探索治疗反应与疾病PRSs之间的关联有助于重要的学习,但我们需要更多高质量的治疗反应数据来构建有用的预测模型。我们相信,随着评估抗抑郁药物治疗反应的更大规模GWAS总结统计数据的发展,它们将在临床试验中提供更相关的治疗反应预测指标。希望从长远来看,它们可以减轻治疗策略,使患者能够更快地接受治疗,并获得最大的成功机会。
据我们所知,这是第一次在临床试验中对抑郁症患者的安慰剂反应进行基因评估。对于接受安慰剂治疗的患者,较高的主观幸福感PRS名义上与较差的安慰剂反应相关,由MADRS, MADRS-6和HAM-A SA测量。我们还观察到,MDD的高PRS在名义上与更好的安慰剂反应相关(CPFQ和PDQ改善),这与主观幸福感与MDD呈负遗传相关的事实一致[37].这与之前的研究一致,即MDD的PRS较高[12,14,15,16与较差的治疗反应有名义上的关联。名义上的PRS与安慰剂应答的关联应该在本论文之外进一步探索,因为识别预测安慰剂应答的遗传变量有助于从临床试验中筛选出高安慰剂应答者,并有助于改善对真实治疗应答的预测。
我们在分析中纳入了HAM-A SA和HAM-A PA等子量表,它们评估了整个量表中的症状子集。子量表可以通过调查更多的临床中间反应结果来潜在地提高检测能力,并帮助指出哪些症状驱动信号的方向。事实上,我们观察到,临床评估反应的PRS与由HAM-A量表测量的vortioxetine治疗反应之间的关联是由HAM-A PA亚量表驱动的。我们的结果还表明,使用子量表可以帮助识别较弱的关联,而当与整个量表进行关联测试时,没有发现这种关联。例如,对于安慰剂治疗的患者,重度抑郁症的PRSs和主观幸福感名义上与HAM-A SA亚量表相关,但与整个HAM-A量表无关。
我们的研究有局限性。尽管已经收集了表型深,均质的临床测试样本,结果强调需要更大的样本量。功率计算表明样本量足以进行大多数关联测试,见补充材料部分B.对于PRS的关联具有实证意义p-value < 0.05,解释方差在1.2-5.3%范围内。这与之前调查PRS与抗抑郁药物反应相关性的研究一致[13,15,19,22,23].PRS解释的低治疗反应方差可能是由于我们的基础GWAS样本量不足,效应量估计存在误差,以及基础样本和测试样本之间不可避免的差异。此外,使用常见遗传变异的加性模型计算PRSs。因此,我们还没有探索治疗反应是否受到罕见变异或与常见变异的其他潜在相互作用的影响。当前阶段解释的方差量限制了对个体水平和临床效用的解释。此外,在目前的研究中只有p-values已被调整。prs所解释的方差可能会受到过拟合的影响,因为所解释的方差是未经调整的。因此,需要更大的样本来重复这些发现,这样的分析可以确定PRS和治疗反应之间的可靠关系。
总之,我们的研究结果表明,在几种反应指标中,治疗反应的临床PRS作为临床治疗反应的预测指标最有潜力。这是第一个揭示PRSs和安慰剂反应之间名义上的联系的研究。我们的研究结果表明,包括安慰剂组、不同的临床量表和子量表可以帮助确定抗抑郁药物反应特异性的遗传基础。有了这些多基因预测因子的差异,该研究强调了临床和观察性治疗反应的重要方面。重要的是,由PRS关联解释的方差仍然很低,这限制了临床应用和个体水平上预测的效用。下一步是获得更多功能强大且表型相似的GWAS碱基,以揭示PRSs与抗抑郁治疗和安慰剂反应的全部潜力。最后,本研究为今后临床遗传学研究提供了有用的数据资源。
数据可用性
GWAS汇总统计数据将根据要求与通讯作者共享。
参考文献
第二代抗抑郁药在成人抑郁症药物治疗中的比较效果。In:第二代抗抑郁药在成人抑郁症治疗中的有效性;2011.https://doi.org/10.1016/s0924 - 9338 (12) 75269 - 0.
Cipriani A, Furukawa TA, Salanti G, Chaimani A, Atkinson LZ, Ogawa Y,等。21种抗抑郁药物急性治疗成人重度抑郁症的比较疗效和可接受性:系统综述和网络荟萃分析《柳叶刀》杂志。2018;391:1357 - 66。
Romera I, Perez V, Menchón JM, Delgado-Cohen H, Polavieja P, Gilaberte I.重度抑郁症发作部分缓解与完全缓解患者的社会和职业功能障碍。为期六个月的前瞻性流行病学研究。《欧洲精神病学》2010;25:58-65。
Rosa AR, Reinares M, Michalak EE, Bonnin CM, Sole B, Franco C,等。双相情感障碍患者情绪状态下的功能损害和残疾。《价值疗愈》2010;13:984-8。
凯斯勒RC,韦特TC,德姆勒O,沃尔特斯EE。国家共病调查复制12个月DSM-IV疾病的患病率、严重程度和共病。Arch Gen Psychiatry 2005; 62:617-27。
Greenberg PE, Fournier AA, Sisitsky T, Simes M, Berman R, Koenigsberg SH,等。美国成人重度抑郁症患者的经济负担(2010年和2018年)药物经济学。2021;39:653 - 65。
格林伯格PE,富尼埃AA,西西茨基T,派克CT,凯斯勒RC。美国成人重度抑郁症患者的经济负担(2005年和2010年)。中华临床精神病学杂志。2015;76:155-62。
Moussavi S, Chatterji S, Verdes E, Tandon A, Patel V, Ustun B.抑郁症、慢性病和健康衰退:世界卫生调查的结果。《柳叶刀》杂志。2007;370:851-8。
Hardeveld F, Spijker J, De Graaf R, Hendriks SM, Licht CMM, Nolen WA,等。重性抑郁症在不同治疗环境下的复发:来自NESDA研究的结果。《情感失调》,2013;
Pain O, Hodgson K, Trubetskoy V, Ripke S, Marshe VS, Adams MJ,等。确定抗抑郁药物反应的共同遗传基础。生物精神病学全球开放科学2021;2:115-26。
Fabbri C, Porcelli S, Serretti A.从药物遗传学到药物基因组学:抗抑郁药物治疗的个性化。《精神病学杂志》2014;59:62-75。
Wigmore EM, Hafferty JD, Hall LS, Howard DM, Clarke TK, Fabbri C,等。使用卫生服务处方数据和与GENDEP的meta分析,在基于人群的队列中进行抗抑郁药物治疗耐药性的全基因组关联研究。药物基因组学杂志2020;20:329-41。
Lewis CM, Vassos E.多基因风险评分:从研究工具到临床仪器。基因组医学2020;12:1219。
Fabbri C, Hagenaars SP, John C, Williams AT, Shrine N, mole L,等。在两个英国队列中使用初级保健记录的难治性抑郁症的遗传和临床特征。摩尔精神病学,2021;26:3363-73。
Ward J, Graham N, Strawbridge RJ, Ferguson A, Jenkins G,陈w,等。重性抑郁障碍和神经质的多基因风险评分作为抗抑郁药物反应的预测因素:三个治疗队列的meta分析PLoS ONE。2018; 13: e0203896
范内利,范内德蒂,卡斯珀,邹哈尔,苏瑞,蒙哥马利,等。精神分裂症的高多基因风险评分可能提示重度抑郁症的治疗无应答。神经-精神药理学生物精神病学。2021;108:110170。
李群生,田晨,Hinds D, Agee M, Alipanahi B, Auton A,等。抗抑郁药类反应和治疗抵抗性抑郁症的全基因组关联研究。翻译精神病学2020;10:649。
Dalby M, Vitezic M, Plath N, Hammer-Helmich L,蒋勇,田晨,等。在AFFECT研究中,情绪障碍的特征是:美国一个大型的、纵向的、表型丰富的遗传队列。翻译精神病学,2022;12:1-10。
De Diego-Adeliño J, Crespo JM, Mora F, Neyra A, Iborra P, Gutiérrez-Rojas L,等。沃替西汀治疗重度抑郁症:从作用机制到临床研究。最新综述。专家意见书,2021;21:1-18。
美国精神病学协会精神障碍诊断和统计手册(第4版,修订),作者,华盛顿特区(2000年)。
Montgomery SA, Asberg M.一种新的抑郁量表,旨在对变化敏感。中华精神病学杂志。1979;134:382-9。
通过等级对焦虑状态的评估。中华医学精神病学杂志1959;32:50-5。
Sullivan MJL, Edgley K, Dehoux E.多发性硬化症的调查。第一部分:感知认知问题与补偿策略的使用。陈建平。1990;4:99-105。
王晓明,王晓明,王晓明,等。认知功能量表的信度和效度分析。心理,2009;78:91-97。
国家精神卫生合作中心(联合王国)。慢性身体健康问题成人抑郁症:治疗和管理。莱斯特(英国):英国心理学会(英国);2010.https://pubmed.ncbi.nlm.nih.gov/22259826.
张cc,周cc, Tellier LCAM, Vattikuti S, Purcell SM, Lee JJ。第二代PLINK:迎接更大、更丰富数据集的挑战。Gigascience。2015;4。
李志强,李志强,李志强。基于快速模型的非亲缘个体祖先估计。Genome res 2009; 19:1655-64。
Price AL, Patterson NJ, Plenge RM, Weinblatt ME, Shadick NA, Reich D.主成分分析校正全基因组关联研究中的分层。Nat Genet, 2006; 38:904-9。
达斯,傅瑞尔,肖恩尔,西多尔,洛克,邝,等。下一代基因型植入服务和方法。Nat Genet, 2016; 48:1284-7。
杨杰,李志强,李志强,等。LD评分回归在全基因组关联研究中区分混杂和多基因性。Nat Genet. 2015; 47:291-5。
杨杰,Benyamin B, McEvoy BP, Gordon S, Henders AK, Nyholt DR,等。常见的snp解释了人类身高遗传的很大一部分。Nat Genet, 2010; 42:565-9。
李qs,田c, Seabrook GR, Drevets WC, Narayan VA. 23andMe抗抑郁药疗效调查数据分析:安非他酮反应中的昼夜节律和神经可塑性。《翻译精神病学》2016;6:e889。
Howard DM, Adams MJ, Clarke TK, Hafferty JD, Gibson J, Shirali M,等。抑郁症的全基因组元分析确定了102个独立的变体,并强调了前额叶大脑区域的重要性。神经科学。2019;22:343-52。
马林斯,j,欧康奈尔,k, Coombes B,科尔曼JRI,乔Z,等。对4万多例双相情感障碍病例的全基因组关联研究为潜在生物学提供了新的见解。Nat Genet, 2021; 53:817-29。
PG的联合TSWG, Ripke S, Walters JTR, O 'Donovan MC.绘制基因组位点优先排序基因,并暗示精神分裂症中的突触生物学。medRxiv2020;https://doi.org/10.1101/2020.09.12.20192922.
Demontis D, Walters RK, Martin J, Mattheisen M, Als TD, Agerbo E,等。发现第一个注意力缺陷/多动障碍全基因组显著风险位点。Nat Genet, 2019; 51:63-75。
Okbay A, Baselmans BM, De Neve JE, Turley P, Nivard MG, Fontana MA,等。通过全基因组分析确定了与主观幸福感、抑郁症状和神经质相关的遗传变异。Nat Genet, 2016; 48:624-33。
奈格尔M, Jansen PR, Stringer S, Watanabe K, De Leeuw CA, Bryois J,等。对449,484个个体的神经质全基因组关联研究的元分析确定了新的遗传位点和途径。Nat Genet, 2018; 50:920-7。
Davies G, Lam M, Harris SE, Trampush JW, Luciano M, Hill WD,等。对300,486名个体的研究确定了148个影响一般认知功能的独立遗传位点。Nat Commun. 2018;9:201。
Choi SW, O 'Reilly PF. price -2:生物库规模数据的多基因风险评分软件。Gigascience。2019;8:2091。
Pilkonis PA, Choi SW, Reise SP, Stover AM, Riley WT, Cella D.从患者报告的结果测量信息系统(PROMIS®)中测量情绪困扰的项目库:抑郁,焦虑和愤怒。评估。2011;18:263 - 83。
确认
出于开放获取的目的,本文已在创作共同许可(CC-BY)下发表。本研究由英国医学研究理事会资助。MC_A656_5QD30_2135),莫兹利慈善(no.;666号)和威康信托(Wellcome Trust)。094849/Z/10/Z)赠款给OH和伦敦南部国家卫生研究所生物医学研究中心以及莫兹利国民保健服务基金会信托基金和伦敦国王学院。AKN由丹麦创新基金资助。8053 - 00004 - a)。本文仅代表作者个人观点,不一定代表H Lundbeck A/s、NHS/NIHR或卫生部。
作者信息
作者及隶属关系
贡献
AKN负责数据分析,并撰写初稿。MD和AKN对基因分型数据进行质量控制和归责。MD, AF, IM, MV和AA构思了这项研究,监督数据分析,并帮助撰写和解释结果。OH指导对临床研究设计的理解,并提供临床观点。所有作者均已投稿并已批准最终稿。
相应的作者
道德声明
相互竞争的利益
该试验由武田制药有限公司和H. Lundbeck A/S合作进行。AKN, AF, MV, MD均由H. Lundbeck A/S公司提供。OH是H. Lundbeck a /S的兼职雇员及股东。OH已从Angellini、Autifony、Biogen、Boehringer-Ingelheim、Eli Lilly、Heptares、Global Medical Education、Invicro、jansen、Lundbeck、Neurocrine、Otsuka、Sunovion、Recordati、Roche和Viatris/ Mylan组织的研究人员发起的研究资助和/或参加咨询/演讲会议。OH拥有使用多巴胺能成像的专利。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Nøhr, a.k., Forsingdal, A., Moltke, I。et al。抗抑郁药物治疗和安慰剂反应的多基因异质性。Transl精神病学12, 456(2022)。https://doi.org/10.1038/s41398-022-02221-4
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41398-022-02221-4