摘要
多发性骨髓瘤(MM)是一种在生命晚期发生的获得性恶性浆细胞疾病。尽管所有年龄、种族和民族的无进展和总体生存期都有所改善,但仍有一部分患者预后不佳,被标记为高风险疾病。尽管在临床应用中有几个经过验证的风险分层系统,但对NDMM风险的统一方法仍然难以捉摸。虽然我们试图在诊断时捕捉风险,但现实是许多重要的预后特征仍然不明确,因为一些根据诊断时的基因组谱被定义为低风险的患者早期复发。确定高风险疾病的定义至关重要,以便采用适应风险的治疗方法。明确诊断风险对于有效设计未来临床试验和指导日常实践中需要哪些临床数据非常重要。这篇综述论文的目的是总结和比较各种已建立的风险分层系统,超越R-ISS和国际骨髓瘤工作组的风险分层,以评估特定的分子和细胞遗传学异常及其如何独立影响预后。此外,我们从最近的全基因组/外显子组测序以及基因表达数据中探索了大量新的基因组信息,并回顾了影响结果的已知临床因素,如疾病负担和早期复发,以及患者相关因素,如种族。最后,我们提供了一个关于开发新的高风险模型系统的展望,以及我们如何理解共发生、致癌依赖和互斥突变。
简介
在过去的20年里,随着新疗法的出现以及高剂量美法兰和自体干细胞移植(ASCT)的越来越多的使用,多发性骨髓瘤(MM)患者的5年和10年总生存率(OS)在所有年龄、种族和民族群体中都有所提高[1].这些益处在高风险疾病的修订国际分期系统(R-ISS) III期患者中更为缓和,仅实现24%的5年无进展生存期(PFS)和40%的5年OS [2].在诊断时识别高危患者是至关重要的,以便摆脱适应患者生理/实际年龄和合并症的治疗,而是建立适应风险的治疗方法。
尽管在常规临床使用中有几个经过验证的风险分层系统,但对NDMM风险的统一方法仍然难以捉摸。这是我们迅速扩大评估基因组水平数据的能力以及不断扩大的患者水平临床数据的直接结果。诊断时准确评估风险非常重要,原因有很多,包括但不限于:
- 1.
首次治疗可获得最长的缓解期,因此首次缓解的持续时间是影响患者预后的最重要因素之一
- 2.
准确定义临床试验登记风险
- 3.
确定在实践中应常规获取哪些临床数据以定义风险。
如表中所述,目前使用的各种风险分层系统存在显著的异质性1.虽然我们试图在诊断时捕捉风险,但现实是许多重要的预后特征仍然不明确,因为一些根据诊断时的基因组谱被定义为低风险的患者早期复发。这篇综述论文的目的是总结和比较各种已建立的风险分层系统,并超越R-ISS和国际骨髓瘤工作组(IMWG)的风险分层,以评估特定的分子和细胞遗传学异常及其如何独立影响预后。我们从最近的全基因组/-外显子组测序以及基因表达谱数据中探索了丰富的新基因组信息,并回顾了影响结果的已知临床因素,如疾病负担和早期复发以及患者相关因素。最后,我们提供了一个关于开发新的高风险模型系统的展望,以及我们如何理解共发生、致癌依赖和互斥突变。
一般风险分层系统
国际分期系统(ISS)是最早验证的NDMM患者风险分层方法之一[3.].ISS是一种基于血清β升高预测风险的生物分期系统2-微球蛋白(β2M)和血清白蛋白下降。随着ISS的发展,通过间期荧光原位杂交(iFISH)检测染色体异常(CA)已成为危险分层MM患者的护理标准。某些高危改变包括del(17p)、易位t(4;14)和易位t(14;16)已被证实[4].2014年,IMWG发布了一份更新的风险分层,重点是将ISS与某些高危iFISH改变(t(4;14)、del17p13和+1q21)相结合,区分高风险和标准风险患者[5].
R-ISS结合了iFISH变化、血清乳酸脱氢酶(LDH)和ISS特征,是最广泛认可的NDMM患者风险分层工具[2].R-ISS是一种简单但临床有用的系统,可以预测NDMM的OS和PFS。虽然它包含了重要的基因组标记,包括t(4;14), t(14;16)和del17p,但它不包括1q增益/扩增,这是一个越来越重要的预后标记[6],或TP53突变数据。重要的是,为了达到R-ISS III期,患者还必须是ISS III,生物标志物β2M升高到≥5.5 mg/L。尽管存在高危的iFISH改变,但仍有相当一部分患者将处于R-ISS I或II期。在Corre等人最近的一份报告中[7在评估NDMM患者中del(17p)和TP53突变时,73%的del(17p)患者和52%的TP53双等位基因失活患者不属于国际分期系统(ISS)−3,因此不属于R-ISS 3亚组。此外,β2M可能确实是高风险疾病的生物学制造者,但可能是固有的高风险基因组特征驱动了这一点,Bolli等人发现1q扩增与更高的β2M相关[8].最后,R-ISS和IMWG都没有重视细胞遗传学的发现。Intergrouped french - ophone Du Myelome (IFM)最近的一份报告显示,基于某些高风险病变(如del(17p), del(1p32),增益1q, t(4;14)和21三体症)的加权细胞遗传学风险分层可能具有更准确地对患者进行风险分层的能力[9].不幸的是,本研究中包括的绝大多数患者没有接受现代诱导方案的治疗。这在评估NDMM预后评分时带来了一个经常的挑战,因为快速发展的治疗环境和缺乏对当前使用的风险分层系统的治疗调整。
R-ISS之外:分子亚群和细胞遗传学异常
除了传统的分期系统外,MM中还有一些公认的高风险特征,预示着糟糕的结果。这些特征包括其他分子亚群(主要是进入免疫球蛋白重链位点和拷贝数异常(CNAs)的易位)以及基于下一代测序的新的和正在出现的结构、突变和拷贝数驱动因素。MM可能仅由肿瘤细胞的一个子集携带染色体畸变,个别病例的细胞遗传学异质性反映了细胞遗传学定义的异常浆细胞克隆的共存。克隆大小的替代标记可以包括FISH检测到的含有特定细胞遗传异常的细胞的百分比。尽管欧洲骨髓瘤网络(EMN)推荐了相对保守的截断值,融合或分离探针为10%,数值异常为20%(类似的截断值用于R-ISS分期系统),但到目前为止还没有应用统一的截断值,而且不同中心使用的截断值不一致。
已建立的分子亚群:易位到免疫球蛋白重链位点
大多数位于14q32的免疫球蛋白重链位点易位在超过40%的NDMM患者中可见[4,6].在B细胞中,14q32的IgH位点具有转录活性,假定的癌基因转位到该区域及其随后的异常表达被认为是大多数B细胞恶性肿瘤发病机制中的一个重要事件,包括MM [10].有几种已知的14q32与非随机伴侣的易位,包括更常见的t(4;14)和t(11;14)易位(30%的MM患者)和不常见的(⩽5%的患者)t(14;16), t(6;14), t(8;14), t(14;20)易位[10].每个易位亚组都与D组细胞周期蛋白的调控直接相关,如t(11;14)(细胞周期蛋白D1)和t(6;14)(细胞周期蛋白D3),或间接相关,如t(4;14)或MAF易位组,包括t(14;20)和t(14;16) [11].这些易位最终导致癌基因的上调,包括d型细胞周期蛋白(细胞周期蛋白D1, D2和D3), MAF家族成员(MafA, MafB和c-Maf), c-MYC,骨髓瘤SET结构域蛋白(MMSET)和成纤维细胞生长因子受体3 (FGFR3),并已被证明影响患者预后。
不良
MAF易位组包括t(14;16)和t(14;20),两者在MM中都很少见,但被认为与不良预后有关。这种不良结果的机制被认为与MAF上调的后果有关,包括上调cyclin D2及其对细胞相互作用和凋亡抵抗的影响[11].t(4;14)易位导致MMSET基因突变,该基因已知具有组蛋白甲基转移酶活性,在MM发生的早期被解除调控[12].t(8;14)和MYC畸变/易位导致MYC癌基因上调。14q32易位和说明风险的cna的患病率、发病机制和相关文献各不相同,列于表中2.
已建立的分子亚群:拷贝数异常
额外的拷贝数增减经常发生,最常见的是del 13q(59%)、+1q(40%)、del14q(39%)、del6q(33%)、del1p(30%)和del17p(8%)。表格2概述了CNAs的主要特征,特别注意下面的1q增益/扩增和del(17p),因为这些可能代表NDMM中最有害的基因组变化。
1q放大(v增益)
CKS1B基因在染色体1q21区(1q+)的增益/扩增是MM中最常见的继发性遗传异常之一,在约三分之一的NDMM患者中可见[7].CKS1B是细胞生长和分裂的必需蛋白,是周期蛋白激酶亚基1蛋白家族的成员。它在骨髓中普遍表达,与p27kip1-Cdk/cyclin复合物相关,并作为p27依赖skp2泛素化的辅助因子[13].CKS1B的扩增导致p27的更大降解,Cdk/cyclin复合物的激活,以及通过促进G1/S转变的细胞周期上调,并在细胞周期进展和MM细胞存活中发挥关键作用。
NDMM患者存在多种1q状态,包括二倍体、1q增益(1q 3个拷贝)、1q扩增(1q≥4个拷贝)。增益和扩增对预后的不同影响仍有待完全阐明,但任何额外的1q拷贝都已被证明会导致较差的结果。拷贝数对长期结果的影响是可变的,但≥4个拷贝或扩增通常导致最糟糕的PFS和OS [6].虽然许多人假设del(17p)/TP53突变是预后最重要的驱动因素,但最近从FORTE试验中更新的1q扩增数据对此提出了质疑,强化治疗方法改善了所有组的结果,除了那些1q扩增的组[14].
德尔(p) 17日
跨越TP53基因的染色体17p缺失的细胞遗传学分析通常由针对17p的iFISH探针进行,而不是单独探测TP53。尽管del17p在MM中的临床相关性已得到证实,但del17p促进侵袭性疾病生物学的确切机制尚不清楚。与其他肿瘤类型一样,MM中的TP53突变分布在整个基因中,许多突变发生在dna结合域内[15].缺失区域的长度可以从几兆到缺失整个17号染色体的短臂。TP53基因位于最小缺失区域(0.25 MB),这表明它是17p13区域的关键基因。然而,缺失事件通常涉及多个基因,TP53与Eif5a和Alox15b一起缺失会导致更严重的疾病[15].目前尚不清楚TP53以外的基因是如何参与肿瘤发生的。在某些情况下,TP53错义突变可能导致更糟糕的结果,因为它们产生突变的TP53蛋白,不仅导致正常TP53功能的丧失,而且还导致致癌功能的增加[16].从骨髓瘤基因组计划(MGP)中,Walker等人证明TP53缺失是最常见的异常(8%),其次是突变(~6%)和双等位基因失活(~4%)。值得注意的是,TP53突变已被确定为MM的驱动突变,是少数具有预后能力的驱动突变之一[17].
早期研究表明,一个等位基因的缺失和第二个等位基因的突变之间存在关联,这可能导致P53功能完全失活[18].单、双等位基因del(17p)与TP53突变状态的关系有待进一步研究3.总结双等位基因与单基因功能不全的已知预后。此外,如何定义del(17p)阳性检测仍存在争议,癌症克隆分数(CCF)阳性率因截点而异。已知的CCF影响也总结在表中3..
使用不同的阈值/ ccf,不同大小的数据集,以及不同的治疗方案,导致del17p的预后报告不一致。无论如何,当检测到del(17p)是普遍不利的。R-ISS、IMWG和mSMART分期系统以及骨髓瘤基因组计划的全基因组/-外显子组测序数据[6]以及IMWG compass研究[19]都清楚地显示了del(17p)患者的不良结果。当结合RNA改变和基因表达谱时,它仍然可以预测PFS和OS。
超二倍体、四倍体和三体
低二倍体核型或高单倍体核型与NDMM不良预后相关。四倍体是与OS显著缩短相关的独立标记[20.].尽管人们普遍认为高危险骨髓瘤(HD-MM)具有保护作用,但有一些高风险病变常与标准危险患者同时发生[2178%的IgL-MYC易位与HD-MM同时发生就是一个例子[22].此外,在HD-MM中,21三体患者预后较差[23尽管这是有争议的,并受到越来越多的挑战。
传统的iFISH风险分层的挑战和适用性
IMWG共识声明将临床iFISH描述为检测ca的标准方法,R-ISS分期系统遵循相同的方法。然而,R-ISS在定义阳性细胞遗传学异常时存在不一致性,并且数值畸变的截止水平不相同,范围为8 - 20%,免疫球蛋白重链易位的截止水平为10 - 15%。此外,在常规临床实践中,存在更多的异质性,一些实验室没有进行所需的纯化或双重染色,与R-ISS数据一样,不同机构的检出限和阳性阈值不同。这种异质性可能会限制R-ISS和IMWG分期系统的实用性,特别是在多个机构的数据协作后应用时。最近,广泛收集的MM基因组数据被用于进一步阐明NDMM患者的风险,但他们也未能逃脱这一挑战。例如,compass研究(NCT01454297)为MM的基因组学和结果研究提供了一个前所未有的平台,但少数批评之一源于细胞遗传学分析的异质性。在对排名前十的招聘网站的审计中,发现本地数据提取与中央审计之间存在显著不一致,在使用的FISH探针、计数的细胞数量和排序技术方面存在差异[24].值得注意的是,传统的FISH研究相当昂贵,进一步推动了该领域从传统的FISH研究转向下一代测序工具。
具有下一代测序测试的Seq-FISH可以同时检测临床FISH检测到的拷贝数异常和易位,以及无法检测到的基因突变。从compass研究中,Goldsmith等人通过全基因组测序(WGS)长插入数据调用Seq-FISH技术确定了672例患者,他们有足够的数据通过全基因组测序(WGS)长插入数据计算R-ISS, Seq-FISH阳性检测CNA的阈值为20%。R-ISS-NGS导致患者从I期显著重新分布到II期。与R-ISS分期模式相比,R-ISS- ngs分期II和III与更糟糕的PFS和OS相关[24].此外,Miller等人对同样来自compass研究的339例患者进行了评估,发现Seq-FISH识别了几乎所有易位,以及临床FISH遗漏的30个易位[25].因此,Seq-FISH验证了R-ISS的预后能力,并提高了识别ca的敏感性和可重复性。然而,就像下面详细描述的基因表达谱一样,考虑到常规临床实践所需的实验室经验和能力以及周转时间,临床应用仍然具有挑战性。
理解共发生、致癌依赖和互斥突变
随着越来越多的样本在MM中测序,基因组标记之间的共发性或癌基因依赖性被越来越多地描述[6,26].这使得对特定细胞遗传学异常影响的准确评估变得困难,特别是当这些异常被孤立地考虑时,或者当它们是罕见事件时,如t(8;14)或t(14;16)。在我们有能力进行全基因组测序之前,已知的致癌依赖的数量是有限的。然而,骨髓瘤基因组计划和CoMMpass项目等大型数据集提高了我们对共发事件的认识。这些不良预后因素的共同分离强调了调整潜在混杂因素的必要性,并应导致改善NDMM患者的风险分层。此外,了解肿瘤的生物学以及特定的相互依赖功能及其对类似通路的潜在依赖可能会导致确定新的治疗靶点。
全基因组/外显子组测序
下一代测序(NGS)技术已经允许识别RNA转录本表达、基因组结构变异(易位、缺失、插入、倒置)、单核苷酸变异、杂合性损失以及影响整个染色体、染色体段和单个基因的拷贝数异常。数十种骨髓瘤驱动基因已被确定,其中最常见的出现在RAS和NF-kB家族[27].嗜色菌病是一种导致大规模聚集性基因组重排的基因组事件,是最近才被描述的一种新兴的高风险特征。随着新技术使全外显子组和全基因组测序更容易获得和更便宜,完成MM患者更全面的基因组分析的能力正日益成为现实。这重新强调了识别和预测驱动突变和其他基因变异的重要性,这可能会提高患者的期望,并最终取得治疗进展。
MGP, compass研究,以及Bolli等人发表的美国和欧洲中心合作完成的工作。[8扩展了我们对MM发生的基因组环境的认识,并重要地确定了导致不良结果的新风险因素。在审查这些数据后,可以安全地得出以下结论:
del(17p)/TP53突变和+1q扩增是不良预后的重要驱动因素
许多新的驱动因子和致癌基因仍有待探索
驱动基因负担和整体体细胞错义突变导致不良预后
基因组簇存在并决定预后
某些导致“双重打击”基因型的基因组配对决定了令人沮丧的结果。
表格4总结了最近报道的全基因组/-外显子组测序的大型患者数据集中的关键发现。
RNA和基因表达谱
考虑到基于dna的检测,如全基因组测序,能够识别个体病变和全球基因组不稳定性的标记,并最终预后,这并不奇怪,几个GEP评分系统的开发和现在的验证已经显示出强大的预后价值。大多数研究已将GEP标记确定为独立的预后因素,尽管其与临床和iFISH/细胞遗传学危险因素存在重叠[28,29,30.].HOVON-65/GMMG-HD4临床试验研究人员和阿肯色大学医学科学(UAMS)研究人员报告了一项92 [30.]和70个基因特征[28],分别能够在独立队列中识别不良结果。虽然已经开发了多种其他的GEP [31],只有两个成熟的临床试验:MMprofiler (EMC92/SYK92)和MyPRS (UAMS GEP70)。
EMC92 / SKY92 / MMprofiler
该GEP最初是从HOVON-65/GMMG-HD4试验中新诊断的MM患者中开发的(n= 290) [30.].生成了92个基因的预后特征(emc92 -基因特征),高危定义为OS小于2年(290例患者中63例- 21.7%),形成了高危人群和标准风险人群的两级系统。然后在几个前期MM患者队列中验证了EMC92,包括总治疗(TT)2(19.4%高风险),TT3(16.2%高风险)和MRC-IX(20.2%高风险)。在训练集和MRC-IX验证集中进行了多变量分析,结果显示,除了EMC92签名外,del(17p)和β2M也是HOVON-65/GMMG-HD4的独立预测因子。SYK92 MMprofiler将继续在其他NDMM患者中进行验证,包括接受预先KRD诱导和不接受ASCT巩固的患者[32];29];特别是在老年非移植患者中[33].
UAMS GEP70或MyPRS
在最早的一项GEP研究中,Shaughnessy等人报道了532名NDMM患者的70基因评分系统[28].训练组和验证组分别接受美国国立卫生研究院(NIH)赞助的UARK 98-026和UARK 03-033临床试验的治疗。两种方案均采用以化疗为基础的诱导方案,随后采用以melphalone为基础的串联自体移植,巩固化疗和维持治疗。他们确定了一个高危组,包括13.4%的患者,表现出明显较低的无事件生存率(EFS)(P= 0.001;HR为4.51)和OS (P= 0.001;HR为5.16)。在OS和EFS控制ISS风险和高风险易位的多变量分析中,高危UAMS GEP70评分保留其显著性(HR = 4.1;P= 0.001)。34].
GEP的黄金时段准备好了吗?
尽管越来越多的证据表明其预后价值,应用于常规临床护理仍然具有挑战性。对于普遍的适应性没有共识,也没有得到FDA的验证。Chng等人试图通过检查来自三个公开的GEP数据集的患者来评估MM的最佳GEP [35].他们评估了9个非冗余组合的GEP配置文件,构建了所有可能的多个签名组合(最多9个完整签名),并对每个组合进行了生存分析。他们在九个系统中证明了可重复性,因此GEP可以捕获核心生物学,而不是随机方法人工制品的结果。他们表明,与其他签名或组合相比,EMC92+HZDCD组合提供了更高的性能。其他人已经证明SYK92 [36]或将EMC92与ISS(简称EMC92-ISS)组合为最佳系统[37].随着治疗前景的迅速变化,重新验证将是必要的。获取克隆内容和进化仍然是一个挑战,需要更新的高通量技术以及更新的生物信息学方法来从生成的大量数据中识别意义。许多尚未解决的问题仍然存在,如不同的GEP相互关系,多个系统的使用,以及组合优于组合的可能性。然而,靶向NGS方法允许在一种技术中评估所有拷贝数变化、IGH易位和复发突变。因此,从长远来看,这项技术可能具有显著的优势。35,36,37].
R-ISS之外:高危临床特征
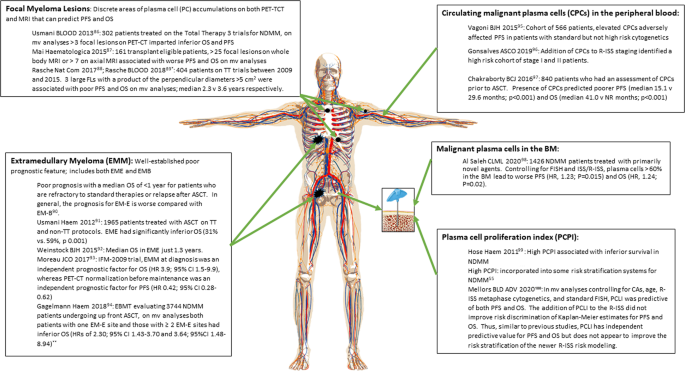
在NDMM患者中,临床和生物学特征具有基因组学之外的预后价值。肿瘤负荷决定了风险,并被纳入原始ISS分期系统[3.].随后,骨髓和外周血中的恶性浆细胞也被证明是预后因素。浆细胞增殖指数(PCPI)是浆细胞增殖活性的衡量指标,已表明中期细胞遗传学异常与骨髓瘤细胞快速增殖和最终临床结果之间存在关联[38].局灶性骨髓瘤病变和髓外疾病也被证明可以预测临床结果。然而,关于基因组学对这些高风险生物和疾病负担相关风险因素的潜在混淆仍然存在问题。疾病负担和患者相关因素描述的风险概述在图中。1.
*大FLs(直径>2.5 cm)与HiR驱动突变的位点特异性丰富相关,与它们是耐药和治疗失败的关键介质一致[86,87,88,89,90,91,92,93,94,95,96,97,98,99,One hundred.].**某些EME部位似乎预后较差,3年PFS因受累器官而异:肾脏(59.5%)、皮肤(20.1%)、淋巴结(37.6%)、中枢神经系统(47.9%)、肺/呼吸道(44.4%)、胃肠道/肝脏(22.5%)、脾脏、卵巢和睾丸(60.0%)。BM骨髓,CA细胞遗传学异常,CPCs循环浆细胞,EBMT欧洲血液和骨髓移植学会,EME髓外骨髓瘤,骨性外(源于血行扩散,仅累及软组织,NDMM发生率为1.7-3.5%90EMB髓外骨髓瘤,是骨旁或骨旁浆细胞瘤(由邻近骨骼的肿瘤肿块组成,起源于局灶性骨骼病变,NDMM发病率6-34.4%90)、EMM髓外骨髓瘤、FL局灶性病变、HR危险比、ISS国际分期系统、MRI磁共振成像、MV多元、NDMM新诊断多发性骨髓瘤、NR未达、OS总生存、PC浆细胞、pcp浆细胞增殖指数、PET-CT 18氟-葡萄糖发射体层摄影、PFS无进展生存、R-ISS修订国际分期系统、TT总治疗。
危险因子
除了风险分层系统、基因组特征和疾病负担外,其他不可改变的患者相关因素也会影响MM的预后。临床虚弱和老年评估已被证明会影响MM的预后,但由于临床时间限制,其常规使用在很大程度上受到限制。在最近的系统回顾和荟萃分析中,日常生活活动评分≤4的患者死亡HR显著增加(合并HR = 1.576;95% ci, 1.051-2.102) [39].此外,被归类为虚弱的患者比健康的患者有更高的死亡风险(合并HR = 2.169;95% ci, 1.002-2.336)。值得注意的是,尽管基因组风险可能与患者相关因素密切相关。P= 0.0012)。尽管WHO表现状态与较短的生存期独立相关,但与TP53缺失的关联提示与遗传和临床特征存在相互关系[40].
越来越多的证据表明,社会经济学和获得护理的机会直接影响患者的预后。一些研究表明,少数民族或种族背景的患者比非西班牙裔白人(nHws)更不可能接受ASCT作为MM的治疗,并且移植的转诊可能会延迟。然而,当获得同等机会时,少数族裔与接受ASCT的nHws患者的结果相似[41].在临床试验中,少数民族和种族的MM患者往往代表性不足。Pulte等人进行了一项荟萃分析,评估了最近5项使用新型药物的临床试验的患者,并没有发现基于种族的结果差异。因为在人口水平上,西班牙裔和非洲裔美国患者从新药物中获益最少。这些结果表明,少数族裔患者不太可能得到适当的治疗[42].为了进一步验证这一点,最近退伍军人管理局的一项经验表明,在获得平等机会的情况下,AA患者的中位OS为5.07年(95% CI, 4.70-5.44年),而白人退伍军人的中位OS为4.52年(95% CI, 4.38-4.65年)P< 0.001) [43].
疾病的生物学胜过一切
对初始治疗的反应和达到较长的初始缓解时间可能最终是NDMM患者最重要的预后因素。有明确的数据表明,实现最小残留疾病(MRD)阴性的深度缓解可以优于高风险生物学特征,而未能实现深度缓解的标准风险患者情况更糟,可能确实是高风险[44].下面,我们将简要回顾原发性难治性骨髓瘤和早期复发骨髓瘤的数据,但将放弃对MRD及其对结果的影响的深入回顾,因为这一主题在最近的几篇综述和荟萃分析中已被广泛报道。
符合移植条件和不符合移植条件的患者对标准三联诱导治疗的有效率均在85-90%之间[45因此原发性难治性骨髓瘤并不常见。不幸的是,尽管二线治疗得到了改善,但即使采用新的诱导治疗,这些患者的预后仍然很差。对于诱导失败后进行ASCT的患者,早在2010年Gertz等人就表明,在ASCT之前,基于IMID的诱导至少不能达到部分缓解(PR)会导致更短的OS (73.5 vs. 30.4个月)和PFS (22.1 vs. 13.1个月;P< 0.001)自移植时起[46].Lee等人的研究结果显示,对新型方案(大多数为硼替佐米)难治性患者的预后更差,ASCT后的中位PFS为4.7个月,中位OS为11.6个月[47].尽管在不符合移植条件或推迟移植的患者中有有限的数据,但同样的模式仍然成立。例如,在梅奥诊所对采用新型诱导方案治疗的患者进行的最新分析中,原发性难治性患者的中位生存期仅为3.6年对7.9年(P< 0.001) [48].
早期复发可能反映了在最初的风险评估中没有捕捉到的潜在高风险疾病生物学,无论细胞遗传学风险如何,都会导致较差的结果。Durie等人首先表明,生存的潜在主要预测因素是进展时间[49]梅奥诊所是第一个描述强化治疗后早期复发的不良预后影响的机构[50].在国际血液和骨髓移植研究中心(CIBMTR)对2001年至2013年接受ASCT的3256名NDMM患者的分析中,ASCT后24个月内复发的患者比例稳定在35-38%。早期复发组从复发时起的OS显著低于早期复发组,4年OS为30%比41% (P< 0.001) (51].ASCT后1年内复发会导致更糟糕的结果,如kast炎等。研究表明,297例连续接受一线ASCT的NDMM患者中,43例(14.5%)在12个月内复发,ASCT后的中位生存期为18个月,而>为6年(P<0.001)在晚期复发患者中[51].不幸的是,这些结果并没有太大改善,梅奥诊所的老年队列显示中位OS仅为23.9个月[52].
没有资格接受ASCT的早期复发患者也表现不佳。在511例NDMM患者的队列研究中,Majithia等人发现,在治疗一年内复发的82例(16%)患者中,中位OS相对于NR为21.0个月(P< 0.001)。即使只考虑接受后续治疗的患者,中位生存期为26.7个月(P< 0.001) (53].最后,IFM最近的一份报告显示,即使控制了基因组因素,一线治疗后的早期复发仍会对生存率产生负面影响[7].有趣的是,在这个IFM队列中,大约三分之二的早期复发患者最初被认为不是高风险,因此早期复发超过了基因组风险。
结论:开发新型高危模型及未来发展方向
骨髓瘤研究团体在过去十年中积累了大量NDMM患者的基因组数据。这使得我们对预示NDMM患者预后不良的基因组变化的理解取得了重大进展。不幸的是,我们在阐明NDMM患者高危基因组特征方面的成功并没有转化为定制的治疗方法和改善这些患者的结果。关于高风险特性的最新统一共识早该达成,预计IMWG很快就会达成。表格5概述了我们目前对NDMM患者高危特征的立场。某些特征,如GEP、全基因组测序和PCLI可能不适用于常规临床实践,但始终被证明会导致不良结果。除了传统的FISH之外,需要更全面和常规获得的基因组分析来推进NDMM的风险分层。我们认为任何符合高危栏中列出的任何标准的NDMM患者都是高危患者,并强烈鼓励这些患者参加临床试验。
为了在常规临床护理中适当地对患者进行风险分层,我们建议在开始治疗前进行以下诊断:
血清研究:LDH, β2微球蛋白、白蛋白
影像学:骨骼检查,高级骨成像最好是PET-CT(或全身CT,脊柱和骨盆MRI)
骨髓活检:标准细胞遗传学,iFISH骨髓瘤组,clonoseq MRD ID标本,GEP和PCPI
虚弱/表现状况和护理的社会经济障碍。
MM是一种基因组复杂的疾病,根据每个患者的基因组足迹有不同的临床结果。骨髓瘤从业者的国际合作提高了我们对骨髓瘤风险的生物学理解,并导致了整体治疗效果的改善。展望未来,仍然存在一些挑战,需要持续的大规模合作来克服这些挑战。我们必须开始更加协调一致的努力,通过根据风险量身定制治疗方法,将我们对高风险基因组特征的知识转化为改善的临床结果。需要对iFISH方法进行标准化,重要的是对阳性结果进行定义。我们必须将GEP和可能的PCLI纳入常规临床护理,而不仅仅是在大型学术中心和临床试验中。我们必须更好地将患者相关因素的客观测量纳入我们的风险评估和治疗方法中。最后,我们必须解决骨髓瘤治疗的可及性问题,以克服导致少数族裔MM患者预后较差的社会经济障碍。这些挑战是巨大的,但通过持续的合作,可以及时解决。
数据可用性
本文文件没有独立的数据。
参考文献
柯士达,布里尔I,欧梅尔J,欧梅尔J,戈比K,库马尔S,等。在美国多发性骨髓瘤发病率和生存率的最近趋势按年龄,种族和民族。Bld ad2017; 1:282-7。
帕伦波A, Avet-Loiseau H, Oliva S, Lokhorst H, Goldschmidt H, Rosinol L,等。修订的国际多发性骨髓瘤分期系统:来自国际骨髓瘤工作组的报告。JCO。2015; 33:2863-9。
Greipp P, Miguel J, Duri B, Crowley J, Barlogi B, Blade J等。多发性骨髓瘤国际分期系统。JCO 2005; 23:3412-20。
李志强,李志强,李志强,等。结合染色体畸变t(4;14)和del (17p13)与国际分期系统分类的信息,可以对接受自体干细胞移植的骨髓瘤患者进行分层。Haematologica。2010;95:1150-7。
郑文杰,陈志强,陈志强,等。IMWG关于多发性骨髓瘤危险分层的共识。白血病。2014;28:269 - 77。
沃克尔BA, mavromatis K,沃德尔C, Ashby T,鲍尔M,戴维斯F,等。高风险,双重打击,一组新诊断的骨髓瘤通过基因组分析确定。白血病。2019;22:159 - 70。
Corre J, Perrot A, Caillot D, Belhadj K, Hulin C, Leleu X, et al. del(17p)无TP53突变对强化治疗的新诊断多发性骨髓瘤患者预后不良。血。2021;137:1192-5。
鲍利N, Biancon G, Moarii M, Loo P, Alexandrov L, Martincorena I,等。对多发性骨髓瘤基因组图谱的分析突出了新的预后标志物和疾病亚群。白血病。2018;32:2604-16。
Perrot A, Lauwers-Cances V, Tournay E, Hulin C, Chretien M, Royer B,等。预测多发性骨髓瘤生存的细胞遗传学预后指标的开发和验证。JCO。2019; 37:1657 - 65。
Kaft A, Spencer A.多发性骨髓瘤中的t(4;14)易位和FGFR3过表达:预后意义和当前的临床策略。血癌杂志,2012;2:e89。
罗斯,F, Chiecchio L, Dagrada G, Protheroe R, Stockly D, Harrison C,等。t(14;20)是骨髓瘤的不良预后因素,但在意义不明的单克隆性γ病中与长期稳定的疾病相关。Haematologica。2010;95:1221-5。
吴鹏飞,吴鹏飞,郭志强,等。MMSET是t(4;14)骨髓瘤的关键分子靶点。血癌杂志2013;3:e114。
贾诺思D, Bornstein G, Ko TK, Larsen B, Tyers M, Pagano M,等。细胞周期调节蛋白Cks1是SCF(Skp2)介导的p27泛素化所必需的。细胞生物学杂志2001;3:21 4 - 4。
D 'Agostino M, Ruggeri M, Aquino S, Giuliani N, Arigoni M, Gentile M,等。在forte试验中接受carfilzomi治疗的新诊断多发性骨髓瘤患者中1q增益和扩增的影响。血。2020;136:38-40。
刘勇,陈超,祖哲,Scuoppo C, Rillahan C,高洁,等。与TP53缺失相关的缺失通过p53独立机制驱动癌症。大自然。2016;531:471-5。
鲍彻,米勒,沙尔玛,麦康基,李文塔尔,克里夫佐夫,等。显性负向效应驱动了髓系恶性肿瘤中TP53错义突变的选择。科学。2019;365:599 - 604。
沃克尔·巴,马夫罗马蒂斯·K,沃德尔·C,阿什比·T,鲍尔·M,戴维斯·F,等。新型突变驱动的鉴定揭示了多发性骨髓瘤中的癌基因依赖性。血。2018;132:587 - 97。
Lode L, Eveillard M, Trichet V, Soussi T, Wuilleme S, Richebourg S,等。TP53突变仅与多发性骨髓瘤中的del(17p)相关。Haematologica。2010;95:1973-6。
D'Agostino M, Zaccaria G, Ziccheddu B, Rustad E, Genuardi E, Capra A,等。新一代测序特征的新诊断多发性骨髓瘤患者的早期复发风险临床癌症决议2020;26:4833-41。
李志强,李志强,李志强,等。四倍体与多发性骨髓瘤诊断时预后差有关。美国血液病杂志,2019;94:E117-E120。
郑文杰,Santana-Da´vila R, Van Wier SA, Ahmann G, Jalal S, Bergsagel P,等。多二倍体骨髓瘤的预后因素:13号染色体缺失和IgH易位的影响。白血病。2006;20:807-13。
巴威克BG,奈利P, Bahlis NJ, Nooka A, Dhodapkar M, Jaye D,等。多发性骨髓瘤免疫球蛋白易位预示预后不良。Nat Commun. 2019;10:1911。
克雷蒂安M, Corre J, lauvers - cances V, Magrangeas F, Cleynen A, Yon E,等。了解多二倍体在骨髓瘤预后中的作用:哪些三体真的重要?血。2015;126:2713-9。
Goldsmith S, Fiala M, Dukeman J, Ghobadi A, Stockerl-Goldstein K, Schroeder M,等。修订后的国际多发性骨髓瘤分期系统的下一代基于测序的验证:MMRF compass研究的分析CLML。2019; 19:285-9。
杨晓东,张晓东,张晓东,等。多发性骨髓瘤临床FISH和基于测序的FISH评估的比较:MMRF compass分析血。2016;128:374。
Walker BA, Boyle EM, Wardell CP, Boyle E, Begum D, Dahir N,等。突变谱、拷贝数改变和结局:新诊断骨髓瘤患者的测序研究结果中华临床医学杂志。2015;33:3911-20。
基于分子特征的多发性骨髓瘤个体化治疗。血。2019;133:660 - 75。
肖尼西,詹飞,伯灵顿,黄勇,科拉S,花村I,等。高风险多发性骨髓瘤的有效基因表达模型是由1号染色体上基因的失调控表达定义的。血。2007;109:2276 - 84。
Shah V, Sherborne AL, Johnson DC, Elllis S, Price A, Chowdhury F,等。白血病。2020;34:3091-6。
Kuiper R, Broyl A, knnett Y, Vliet MH, Beers EH, Hold B,等。高风险多发性骨髓瘤的基因表达特征。白血病。2012;26:2406-13。
Szalat R, Avet-Loiseau H, Munshi N.骨髓瘤基因表达谱:准备好了吗?CCR。2016; 22:5434-42。
范弗利特MH, Jasielec J, Dytfeld D, Vij R, Dumee B, Bosman L,等。预后和预测基因表达谱(GEP)标记在卡非佐米、来那度胺和地塞米松(KRd)治疗新诊断的多发性骨髓瘤(NDMM)患者中得到证实。血。2014;124:2141。
Kuiper R, Zweegman S, van Duin M, Vliet M, Beers E, Dumee B,等。R-ISS联合SKY92在老年多发性骨髓瘤患者中的预后和预测性能:HOVON-87/NMSG-18试验Bld ad2020; 4:6298-309。
霍恩斯D,贝克S,萨文德H, Emde M, Bertsch U,昆兹C,等。在GMMG-MM5多中心试验中,多发性骨髓瘤个性化和风险适应治疗策略的前瞻性目标评估和生存的多模式预测中华血液病杂志2019;12:65。
郑文杰,郑廷华,库马尔,Usmani S, Munshi N, Avet-Loiseau H,等。基因特征组合改善多发性骨髓瘤患者的预后分层。白血病。2016;30:1071-8。
van Beers EH, van Vliet MH, Kuiper R, Best L, Anderson K, Chari A,等。SKY92及其联合ISS在一项独立的多发性骨髓瘤患者队列中的预后验证。临床淋巴瘤骨髓瘤。2017;17:55 - 62。
Kuiper R, van Duiin M, van Vliet M, Broijl A, van der Holt B, Jarari L,等。基于基因表达和国际分期系统预测高风险和低风险多发性骨髓瘤血。2015;126:1996 - 2004。
李志强,李志强,李志强,等。细胞遗传学异常预示多发性骨髓瘤高剂量治疗和自体血细胞移植后生存率较差。骨髓移植杂志1999;24:497-503。
李文杰,李志强,李志强,等。老年评估和衰弱评分预测骨髓瘤的死亡率:系统回顾和荟萃分析。CLML。2019; 19:488 - 96。
沙赫V, Johnson D, Sherborne A, Ellis S, Aldridge F, Howard-Reeves J,等。TP53亚克隆拷贝数与多发性骨髓瘤预后相关血。2018;132:2465-9。
王丽娟,王丽娟,王丽娟,等。少数民族多发性骨髓瘤患者的自体造血干细胞移植在平等医疗体系中的应用。中国生物医学杂志,2012;37(3):344 - 344。
Pulte D, Redaniel MT, Brenner H, Jansen L, Jeffreys M.多发性骨髓瘤患者生存的近期改善:种族差异。Leuk淋巴瘤。2014;55:1083-9。
李志强,李志强,李志强,等。弗吉尼亚州的一项研究表明,与患有多发性骨髓瘤的白人患者相比,在获得平等治疗的情况下,非洲裔美国患者的生存率更高。血。2019;133:2615-8。
刘志强,李志强,李志强,等。在多发性骨髓瘤中,深度测序的最小残留疾病负性是一个主要的预后因素。血。2018;132:2456 - 64。
郭文杰,李志强,李志强,等。卡非佐米或硼替佐米联合来那度胺和地塞米松治疗新诊断的多发性骨髓瘤患者,但不打算立即进行自体干细胞移植(ENDURANCE):一项多中心、开放标签、3期随机对照试验《柳叶刀》,2020;21:1317-30。
马志刚,李志刚,李志刚,等。多发性骨髓瘤干细胞移植:沙利度胺或来那度胺诱导反应失败的影响。血。2010;115:2348-53。
李雪,尹志华,申申,赵波,严凯,金勇,等。在多发性骨髓瘤自体干细胞移植中对新药物诱导无效的影响。安血细胞。2014;93:627-34。
马吉希亚N, Rajkumar S, Lacy M, Guadi F, Dispenzieri A, Gertz M,等。原发性难治性多发性骨髓瘤的预后和新疗法的影响。AJH。2015; 90:981-4。
Durie BG, Jacobson J, Barlogie B, Crowley J.骨髓瘤一线治疗的缓解程度不能预测结果:西南肿瘤组化疗试验中时间对进展的重要性。中华临床医学杂志2004;22:1857-63。
Kumar S, Mahmood ST, Lacy MQ, Dispenzieri A, Hayman S, Buadi F,等。多发性骨髓瘤自体sct术后早期复发的影响。《骨髓移植杂志》2008;42:413-20。
kastarthritis E, Roussou M, Eleutherakis-Papaiakovou E, Gavriatopoulou M, Migkou M, Gika D,等。自体骨髓移植术后早期复发与极差的生存率相关,是骨髓瘤患者的超高风险组。CLML。2019; 20:445-52。
库马尔S, Dispenzieri A, Fraser R, Mingwei F, Akpek G, Cornell R,等。自体造血细胞移植后早期复发仍然是多发性骨髓瘤的不良预后因素,但随着时间的推移,预后有所改善。白血病。2018;32:986 - 95。
Majithia N, Rajkumar SV, Lacy MQ, Buadi F, Dispenzieri A, Gertz M,等。在新药物时代,多发性骨髓瘤初始治疗后早期复发预测预后不良。白血病。2016;30:2208-13。
Gonzalez-Calle V, Slack A, Keane N, Luft S, Pearce K, Ketterling R,等。对符合移植条件的多发性骨髓瘤患者的修订国际分期系统(R-ISS)的评估。安·赫马特,2018;98:1453-62。
米哈埃尔,丁力D,罗伊V, Reeder C, Buadi F, Hayman S,等。梅奥诊所。新诊断的症状性多发性骨髓瘤的管理:更新的梅奥骨髓瘤分层和风险适应治疗(mSMART)共识指南2013[发表的更正出现在梅奥临床论文2013;88(7):777]。Mayo临床杂志2013;88:360-76。
李文杰,李志强,李志强,等。t(14;16)在多发性骨髓瘤中的预后影响:一项213例患者的多中心回顾性研究是时候修改修改后的ISS了吗?血。2018;132:4452。
Shah V, Sherborne A, Walker B, Johnson D, Boyle E, Ellis S,等。新诊断骨髓瘤的预后预测:对1905例试验患者分子谱的荟萃分析白血病。2018;32:102-10。
Boyd KD, Ross FM, Chiecchio L, Dagrada G, Konn Z, Tapper W,等。基于共分离不良FISH病变和ISS的骨髓瘤新预后模型:在MRC骨髓瘤IX试验中治疗的患者的分析。白血病。2012;26:349-55。
Avet-Loiseau H, Malard F, Campion L, Magrangeas F, Sebban C, Lioure B,等。易位(14;16)和多发性骨髓瘤:它真的是一个独立的预后因素吗?血。2011;117:2009-11。
陈H, Phillips M, Maganti M, Farooki S, Rodriguez G, Masih-Khan E,等。单中心治疗t(4;14)多发性骨髓瘤患者的经验,无论是否计划一线自体干细胞移植。CLML。2018; 18:225-34。
Walker BA, Wardell CP, Brioli A, Boyle E, Kaiser M, Gegum D,等。8q24易位使MYC与含有超增强子的基因并列,导致骨髓瘤患者过表达和预后不良。《血癌》杂志2014;4:e191。
马志刚,李志刚,李志刚。多发性骨髓瘤的基因组复杂性及其临床意义。中华儿科杂志,2017;14:100-13。
Cleynen A, Samur M, Perrot A, Buisson L, Maheo S, Fulciniti M,等。多发性骨髓瘤中BCL2/BCL2L1比值可变(11;14)。血。2018;132:2278 - 80。
贾格纳特,贾格纳特,瑞夫金,杜丽B,纳朗M, Terebelo H,等。t(11;14)对连接MM登记中新诊断的多发性骨髓瘤(NDMM)患者(pts)结局的影响。JCO。2019年,37:S8032。
Walker B, Wardell C, Murison A, Boyle E, Begum D, Dahir N,等。APOBEC家族突变特征与多发性骨髓瘤易位不良预后相关。Nat community . 2015;6:6997。
Lakshman A, Moustafa M, Rajkumar SV, Dispenzieri A, Gertz M, Buadi F,等。t(11;14)多发性骨髓瘤自然史。白血病。2018;32:131-8。
毛旭,庄娟,赵东,李霞,杜霞,郝敏,等。不明确伙伴的IgH易位与多发性骨髓瘤患者的良好预后相关。欧洲J Hem, 2020; 105:326-34。
Kaufman GP, Gertz MA, Dispenzieri A, Lacy M, Buadi F, Dingli D,等。多发性骨髓瘤早期大剂量治疗后细胞遗传学分类对预后的影响。白血病。2016;30:633-9。
吉丽,亨廷顿,王瑞,扎伊丹,波多尔采夫,戈尔,等。新药物时代多发性骨髓瘤染色体1异常和临床结果。ASCO。2019年,37(增刊):8044。
安刚,李忠,泰依涛,Acharya C,李强,秦X,等。克隆大小对多发性骨髓瘤中荧光原位杂交染色体畸变预后价值的影响。临床癌症决议2015;21:2148-56。
Boyd KD, Ross FM, Walker BA, Wardell C, Tapper W, Chiecchio L,等。骨髓瘤中染色体1p缺失的图谱确定1p12处的FAM46C和1p32.3处的CDKN2C是与不良生存相关区域的基因。临床癌症决议2011;17:7776-84。
Hebraud B, Leleu X, lauvers - cances V, Roussel M, Caillot D, Marit G,等。1p32区缺失是年轻骨髓瘤患者的主要独立预后因素:1195例患者的IFM经验白血病。2014;28:675-9。
邹杰,柯尼斯伯格,阿克曼,弗里茨,达林杰,克罗默,等。13q14缺失在多发性骨髓瘤中仍然是一个独立的不良预后变量,尽管它经常被间期荧光原位杂交检测到。血。2000;95:1925-30。
宾德M,拉杰库马尔SV,凯特林RP, Greipp P, Dispenzieri A, Lacy M,等。新诊断多发性骨髓瘤13号染色体异常和多发性细胞遗传学高危异常的预后意义血癌杂志2017;7:e600。
Tricot G, Barlogie B, Jagannath S, Bracy D, Mattox S, Vesole D,等。多发性骨髓瘤预后不良仅与13号染色体的部分或完全缺失或涉及11q的异常有关,与其他核型异常无关。血。1995;86:4250-6。
济慈JJ,雷曼T,麦克斯韦CA,泰勒B,拉拉特L,曼特M,等。在多发性骨髓瘤中,t(4;14)(p16;q32)是一个不良预后因素,与FGFR3表达无关。血。2003;101:1520-9。
李敏,赵伟,潘波,唐伟,王志刚,萨巴提,等。细胞类型、剂量和突变类型特异性决定突变p53在体内的功能。中华癌症杂志,2012;22:751-64。
Flynt E, Bisht K, Sridharan V, Ortiz M, Towfic F, Thakurta A.多发性骨髓瘤中TP53异常的预后、生物学和靶点。细胞。2020;9:287。
张志刚,张志刚,张志刚,张志刚,等。17p缺失的高亚克隆部分与多发性骨髓瘤的不良预后相关。血。2019;133:1217-21。
孙文杰,田娥,曲萍,陈志强,等。17p缺失和TP53双等位基因失活水平对多发性骨髓瘤的临床结局有显著影响。Haematologica。2017;102:e364-e367。
马文杰,李志强,李志强,等。多发性骨髓瘤的遗传异常和生存:法语群体之间的经验Myélome。血。2007;109:3489 - 95。
梅兹,希尔舍尔,塞金格,霍斯,梅伊,拉布,等。新诊断骨髓瘤17p缺失的基线特征、染色体改变和治疗影响预后。AJH。2016; 91: E473-E477。
Cohen Y, Aranaga A, Gatt M, Lavi N, Ganzel C, Magen H,等。携带17p缺失的高风险新诊断多发性骨髓瘤患者的治疗模式和临床结果:一项观察性多中心回顾性研究AJH。2018; 93:810-5。
李志强,李志强,李志强,等。多发性骨髓瘤合并复发的自然史(17p)。血癌杂志2019;9:1-11。
Miller A, Asmann Y, Cattaneo L, Braggio E,济慈J, Auclair D,等。高体细胞突变和新抗原负担与多发性骨髓瘤无进展生存期降低相关。血癌杂志2017;7:e612。
Usmani S, Mitchell A, Waheed S, Crowley J, Hoering A, Petty N,等。综合治疗治疗多发性骨髓瘤的连续18-氟脱氧葡萄糖发射断层扫描的预后意义血。2013;121:1819-23。
Mai E, Hielscher T, Kloth J, Mai E, Hielscher T, Kloth J,等。一种基于磁共振成像的预后评分系统,用于预测符合移植条件的多发性骨髓瘤患者的预后。Haematologica。2015;100:818-25。
Rasche L, Chavan SS, Stephens OW, Patel P, Tyarenko R, Ashby C,等。多区域测序揭示多发性骨髓瘤的空间基因组异质性。Nat Commun. 2017;8:268。
李志强,李志强,李志强,等。在多发性骨髓瘤中,大灶性病变的存在是一个强有力的独立预后因素。血。2018;132:59 - 66。
Pour L, Sevcikova S, Greslikova H, Kupska R, Majkova P, Zahradova L,等。与骨相关的髓外复发相比,软组织髓外多发性骨髓瘤的预后明显较差。Haematologica。2014;99:360-4。
孙文杰,张志刚,张志刚,张志刚,等。髓外疾病预示着多发性骨髓瘤预后不良,即使在新药物时代,髓外疾病在高风险疾病中也过高。Haematologica。2012;97:1761-7。
Weinstock M, Aljawai Y, Morgan E, Laubach J, Gannon M, Roccaro A,等。干细胞移植患者髓外多发性骨髓瘤的发生率和临床特征。BJH。2015; 169:851-8。
莫罗P, Attal M, Caillot D, Macro M, Karlin L, Garderet L,等。磁共振成像和[(18)f]氟脱氧葡萄糖正电子发射断层扫描在有症状的多发性骨髓瘤患者诊断时和维持治疗前的前瞻性评价纳入IFM/DFCI 2009试验:IMAJEM研究结果中华临床医学杂志,2017;
李文杰,李志强,李志强,等。髓外疾病对接受自体干细胞移植的新诊断多发性骨髓瘤患者的影响:来自EBMT慢性恶性肿瘤工作组的研究Haematologica。2018;103:890-7。
Vagoni D, Travaglini F, Pezzoni V, Ruggieri M, Bigazzi C, Dalsass A,等。新诊断的症状性多发性骨髓瘤中的循环浆细胞可作为标准危险细胞遗传学患者的预后标志物。BJH。2015; 170:523-31。
龚沙伟,李文杰,李文杰,李文杰,等。通过多参数流式细胞术(MFC)定量循环克隆浆细胞(cPCs),对新诊断的多发性骨髓瘤(NDMM)患者(pts)进行R-ISS分级。JCO。2019; 37:8031。
蔡克波提,穆奇塔,库马尔,杰夫莫维奇,布阿迪,丁力,等。在新型药物时代,通过检测自体干细胞移植前循环浆细胞对骨髓瘤进行风险分层。血癌杂志2016;6:e512。
Al Saleh A, Parmar H, Visram A, Muchtar E, Buadi F, Go R,等。增加骨髓浆细胞百分比预测新诊断多发性骨髓瘤患者的预后。CLML。2020; 20:596 - 601。
Hose D, R 'eme T, Hielscher T, Moreaux J, Messner T, Seckinger A,等。在多发性骨髓瘤中,增殖是一个独立的中心预后因素,也是个体化和风险适应治疗的目标。Haematologica。2011;96:87 - 95。
梅勒斯,M Binder, R Ketterline, Greipp P, Baughn L, Peterson J,等。新诊断多发性骨髓瘤的中期细胞遗传学和浆细胞增殖指数的风险分层。Bld ad2020; 4:2236-44。
作者信息
作者及隶属关系
贡献
JZ和KB同样对这份手稿的起草和修订做出了贡献,KB提供了高级编辑意见。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Hagen, P., Zhang J. & Barton, K.新诊断多发性骨髓瘤的高危疾病:超出R-ISS和IMWG的定义。血癌;12, 83(2022)。https://doi.org/10.1038/s41408-022-00679-5
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41408-022-00679-5
这篇文章被引用
对原发性骨髓瘤细胞进行综合小rna测序,发现miR-105-5p是患者生存的预测因子
英国癌症杂志(2022)