急性髓系白血病(Acute myeloid leukemia, AML)是一种死亡率高、预后差的异质性恶性血液肿瘤,尤其适用于新近诊断(ND)和难治性/复发(R/R)患者中具有不良遗传和分子异常的老年/不适合(年龄≥60岁或不适合接受强化化疗的患者)。
氮胞苷(Aza)是一种低甲基化药物,通过抑制恶性表型的基因表达来抑制表观遗传基因沉默。不同药物的Aza联合方案的完全缓解率(CR)不同,如ND型AML中Aza+ midostorin(20.8%)、Aza+Durvalumab(31.3%)、Aza+Pracinostat(46%)、Aza+Venetoclax (66.4%), R/R型AML中Aza+ midostorin(21.4%)、Aza+Nivolumab(22%)、Aza+Venetoclax (37.1%) [1,2,3.,4,5,6,7].
高尖杉酯碱(HHT)是一种天然植物生物碱Cephalotaxus并具有抗白血病作用[8,9].多项研究表明,HHT联合方案对ND慢性髓系白血病或既往治疗失败(伊马替尼,IFNa)的患者是有效和安全的[10,11,12,13].据报道,HHT联合阿糖胞苷、阿柔比星/柔柔比星(HAA/HDA)治疗新生AML的CR高于标准“3 + 7”方案(DA) [8].HAG (HHT,低剂量阿糖胞苷,G-CSF)被称为启动方案,由于其低心脏毒性和良好的耐受性,被首选用于治疗老年/不适合AML。然而,到目前为止,还没有很好地确定在HAG方案中添加Aza的有效性和安全性。
这是一项在中国17家机构进行的多中心单臂二期临床试验。该试验已在ClinicalTrials.gov上注册(NCT04248595)。本研究由东南大学附属中大医院临床研究IEC (2019zdsyl211 - p01)批准,所有患者均提供书面知情同意书。纳入标准:1)根据WHO标准确诊为AML。2)年龄≥60岁或不适合接受强化化疗的患者,且至少有以下共存疾病之一:[1]射血分数为50%或以下的充血性心力衰竭病史,或慢性稳定型心绞痛[2] 1秒内用力呼气量小于65%的慢性呼吸道疾病[3.],东部肿瘤合作组(ECOG)评分为2或3分。3)天冬氨酸和丙氨酸转氨酶浓度<正常上限的2倍,血清胆红素浓度≤35 μmol/L。4)能够理解并提供书面同意。排除标准:1)确诊为急性早幼粒细胞白血病。2) < 18岁。3)与其他非血液肿瘤并存。4)艾滋病毒感染。5)哺乳期或孕妇。6)研究者认为不适合进入试验的其他医学或心理疾病。
在2020年1月至2021年12月期间,共纳入112例患者[中位年龄65岁(24-86岁)],包括72例ND和40例R/R(图2)。S1A).72例ND AML包括56例新生AML[无骨髓增生异常综合征(MDS)、骨髓增生性肿瘤(MPN)或暴露于潜在的白血病因子]和16例继发性AML (s-AML,源于既往的髓系肿瘤)。其中33例患者年龄< 60岁,根据不适合标准入选S1).72例ND AML患者的危险度分为良好危险度(19/72)、中等危险度(31/72)和不良危险度(22/72)。
诱导治疗包括Aza (75 mg/m2联合HAG方案[HHT 1 mg/m²/d,第4 - 17天静脉注射3 h,阿糖胞苷10 mg/m²,第4 - 17天,每12 h, G-CSF 200 μg/m²/d,第4天至WBC > 10 × 109/L(14天HAG计划)(38/112例患者);HHT 1 mg/m²/d,第4 - 10天静脉注射3 h,阿糖胞苷10 mg/m²,第4 - 10天皮下,G-CSF 200 μg/m²/d皮下,第4天至WBC > 10 × 109/L(7天HAG计划)(74/112例患者)。在第一个周期后没有达到CR/CRi(血细胞计数恢复不完全的CR)的患者可以以相同的剂量和时间表接受第二个周期。在第二个周期后未达到CR/CRi的患者退出研究。对纳入的患者进行缓解后治疗,Aza+HAG方案进一步给予4-6个周期或直到疾病进展,其中2人进行了异基因sct(1人55年患有MDS的sAML,另1人41年患有复发的AML)。
详细的程序,临床终点和评估是在线补充方法。使用包括58个基因的靶向白血病外显子序列组对103名患者的基因突变进行了筛查。详细的面板设计、筛选、数据分析;在线补充方法中描述了基因突变与临床反应、复发状态、危险组和其他统计数据的相关性。
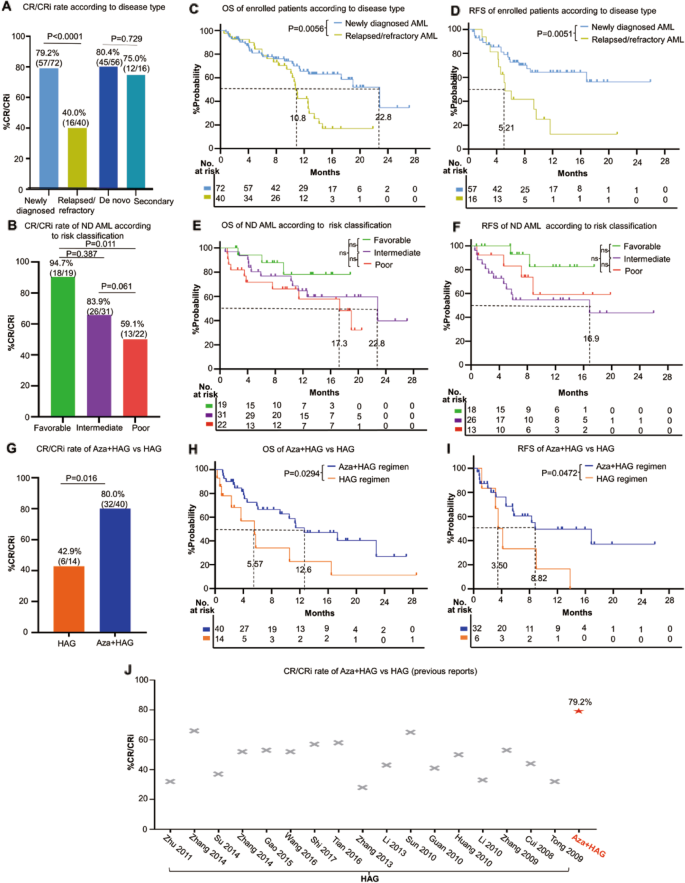
112例患者中,73例(65.2%)在中位时间33.5d内达到CR/CRi。值得注意的是,90.4%(66/73)的CR/CRi是在第1周期Aza+HAG诱导治疗后获得的。Aza+HAG(7天)CR/CRi率(62.2%,46/74)与Aza+HAG(14天)CR/CRi率(71.1%,27/38)差异无统计学意义(P= 0.35)。ND AML的CR/CRi比率为79.2%,R/R AML为40.0%;和sAML(75.0%)获得了与de novo AML(80.4%)相似的高CR率(图。1).在良好、中等或不良风险的患者中,CR/CRi率分别为94.7%、83.9%和59.1%(图2)。1 b).这些数据表明Aza+HAG方案不仅对中等风险的ND de novo AML有效,而且对sAML、低风险、R/R AML的老年/不健康患者也有效。
一个Aza+HAG方案根据不同疾病类型(新诊断AML、复发/难治性AML、新生AML、继发性AML)的CR/CRi率。B新诊断AML患者Aza+HAG方案在不同风险组的CR/CRi率(有利、中等、不良风险[ELN2017])。C,D操作系统(C)及RFS (D) Aza+HAG方案根据疾病类型的变化曲线。E,F操作系统(E)及RFS (F)新诊断AML患者Aza+HAG方案在不同危险组间的变化曲线。(G)接受Aza+HAG方案的入组患者与HAG对照组的CR/CRi率。Aza+HAG组和HAG对照组的患者均来自同一临床研究所(中国南京中大医院),(H,我)操作系统(H)及RFS (我(J)将Aza+HAG方案的CR/CRi率与先前报道的HAG方案的CR/CRi率进行比较(数据来自17项研究,包括453例患者)。
ND AML的中位总生存期(OS)和无复发生存期(RFS)分别为22.8 m,均未达到,长于R/R AML(中位OS 10.8 m,P= 0.0056;RFS中位数5.21米,P= 0.0051)(图1 c, D).与sAML(中位OS 11.3 m)相比,新生AML具有更高的中位OS (22.8 m)和RFS(未达到)。P= 0.01;RFS中位数5.61米,P= 0.0048)(图印地C).在风险良好、中等或较差的患者中,中位OS未达到22.8 m和17.3 m。1 e);中位RFS未达到16.9 m,未达到(图。1 f),分别。这些数据表明,Aza+HAG方案可以获得更好的生存期,特别是对于老年/不健康的新发AML患者。
我们进一步比较了我中心(中大医院)Aza+HAG方案与HAG方案的疗效。两个队列的基线人口学和特征基本平衡(表2)S2).Aza+HAG方案的CR/CRi率(80.0%)显著高于HAG对照组(42.9%)(P= 0.016)(图1克).Aza+HAG方案的中位OS和RFS明显长于HAG对照组(12.6 m vs 5.57 m,P= 0.0294;8.82米vs 3.50米,P= 0.0472)。1 h,我).我们还进行了一项荟萃分析,包括来自17项先前报道的HAG研究的453名老年/不健康AML患者,估计CR/CRi率为47.0%(图2)。1 j而且S2).这些数据表明,将Aza添加到HAG中可以增加老年/不适合AML的临床反应和结局。
最常见的非血液学不良事件为感染(58.0%)。常见的3级及以上非血液学不良事件包括:感染(33.9%)、出血(9.82%)、疲劳(5.36%)、低血钾(3.57%)、心律失常(1.79%)和发热(1.79%)。对于血液学AE,中性粒细胞减少和血小板减少的中位持续时间分别为11 d (IQR, 7-19d)和16d (IQR, 11 - 25d), 10 d (IQR, 6.25-18d), 16d (IQR, 10.25-24.75d), 12d (IQR, 8-21d)和17d (IQR, 12-27d)。在7天和14天的时间表之间没有观察到差异。诱导治疗后4周内早期死亡的比例为1.79%。没有患者因血液学或非血液学毒性而停止诱导治疗S3).这些数据表明,与标准方案中的柔红霉素相比,HHT具有更低的心脏毒性和血液学抑制。
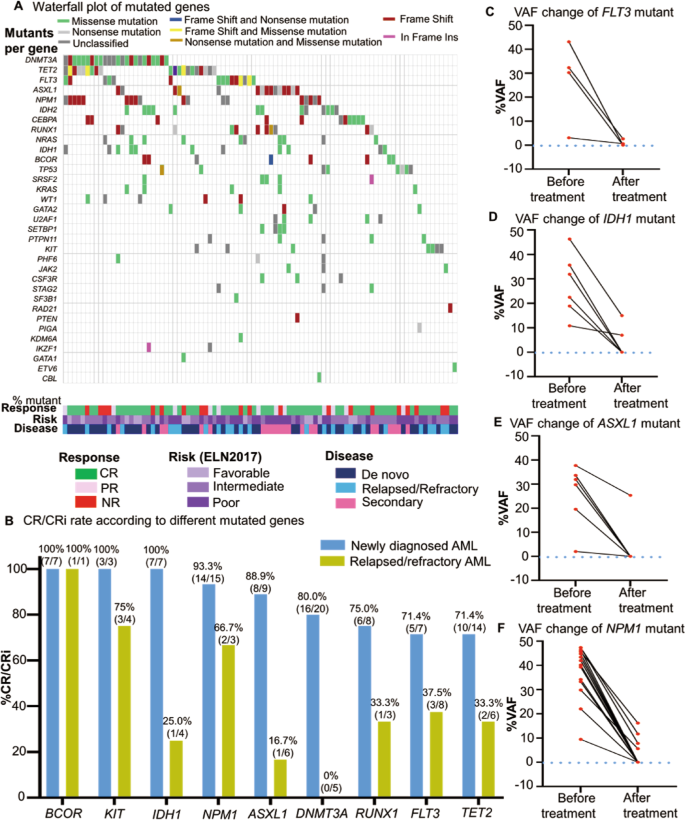
我们在103例患者中检测到228个突变体,涉及33个基因。每位患者的中位突变数为2.21(范围为0-7),87.4%(90/103)的患者有一个以上的基因突变。最常突变的基因是DNMT3A, TET2和NPM1(无花果。2).我们观察到ND突变患者的CR/CRi率较高BCOR(100%, 7/7),工具包(3/3) 100%IDH1(100%, 7/7), NPM1(93.3%, 14/15),ASXL1(88.9%, 8/9), DNMT3A(80。0%, 16/20),RUNX1(75.0%, 6/8),FLT3(71.4%, 5/7)TET2(71.4%, 10/14)(无花果。2 b)(表S4).我们还发现突变体的变异等位基因分数(VAF)显著降低(<0.01%),特别是突变FLT3,IDH1,ASXL1,NPM1(无花果。2氟).患者的OS和RFSFLT3或ASXL1突变组与无突变组相比无劣势倾向FLT3或ASXL1突变(无花果。S3A-D);而患有IDH1突变组在RFS中表现出较好的倾向IDH1野生型(图;S3E F).这些数据表明,该方案可以克服不利的分子异常相关的不良预后。
最近的研究报告了使用Aza plus治疗的患者的CR率IDH1抑制剂Ivosidenib (60.9%) [14在IDH1-突变ND AML或HMA + Venetoclax (71%)IDH1/2 -突变AML [15].本试验显示,在对照组中CR/CRi率高达100%IDH1突变的AML和IDH1突变体在Aza+HAG的第一个周期后显著减少,提示伴有IDH1突变在Aza+HAG治疗后可获得显著的深度和持久缓解。
综上所述,本试验证明Aza+HAG方案是一种高性价比、疗效高、耐受性好的一线治疗老年/不适应AML的方案。该试验为进一步扩大患者进行随机临床对照研究提供了依据,并为临床使用这种新型联合治疗提供了指导意见。
数据可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。
参考文献
Tomlinson BK, Gallogly MM, Kane DM, Metheny L, Lazarus HM, William BM,等。米多斯托林和5-氮胞苷治疗FLT3野生型急性髓性白血病的II期研究临床淋巴瘤骨髓瘤。2020;20:26 26 - 33.e1。
Zeidan AM, Boss I, Beach C, Copeland WB, Thompson E, Fox BA,等。阿扎胞苷联合或不联合durvalumab作为老年AML患者一线治疗的随机2期试验。血书2022;6:2219-29。
Garcia-Manero G, Abaza Y, Takahashi K, Medeiros BC, Arellano M, Khaled SK,等。普拉西诺他联合阿扎胞苷治疗新诊断的急性髓系白血病老年患者:一项2期研究结果《血》2019;3:508-18。
DiNardo CD, Jonas BA, Pullarkat V, Thirman MJ, Garcia JS, Wei AH,等。阿扎胞苷和venetoclax治疗急性髓系白血病。中华医学杂志(英文版);
Cooper BW, kindwell - keller TL, Craig MD, Creger RJ, Hamadani M, William WT,等。米多斯托林和阿扎胞苷在复发和老年AML患者中的I期研究。临床淋巴瘤骨髓瘤。2015;15:428-32.e2。
戴伟,马尼罗,李志强,李志强,等。复发/难治性急性髓系白血病患者对Azacitidine和Nivolumab应答的疗效、安全性和生物标志物:一项非随机、开放标签的II期研究。巨蟹座迪斯科,2019;9:370-83。
张晓东,张晓明,张文杰,等。复发/难治性AML患者venetoclax治疗后反应和生存的临床和分子预测因素。血谕2021;5:1552-64。
金健,王建新,陈芳芳,吴德平,胡娟,周建峰,等。高尖杉酮素诱导方案治疗急性髓系白血病:一项多中心、开放标签、随机、对照的3期临床试验《柳叶刀》2013;14:599-608。
Legha S, Keating M, Picket S, Ajani J, Ewer M, Bodey G.高尖杉酯碱I期临床研究。癌症治疗代表1984;68:1085-91。
Quintás‐Cardama A, Kantarjian H, Garcia‐Manero G, O 'Brien S, Faderl S, Estrov Z,等。既往治疗失败的慢性髓系白血病患者皮下高尖杉酯碱的I/II期研究癌症2007;109:248-55。
Kantarjian HM, Talpaz M, Smith TL, Cortes J, Giles FJ, Rios MB,等。高尖杉酯碱和小剂量阿糖胞苷在晚期慢性粒细胞性白血病治疗中的应用。中华临床杂志2000;18:3513-21。
O 'Brien S, Giles F, Talpaz M, Cortes J, Rios MB, Shan J,等。干扰素- α、阿糖胞苷和高杉酯碱三联治疗的结果,以及在费城染色体阳性慢性粒细胞白血病慢性早期患者的治疗序列中添加伊马替尼的影响。癌症2003;98:888 - 93。
杨晓东,李志强,李志强,等。同时使用高尖杉酯碱和干扰素α治疗慢性期慢性骨髓性白血病患者。癌症2002;94:2024-32。
DiNardo CD, Stein AS, Stein EM, Fathi AT, Frankfurt O, Schuh AC,等。突变异柠檬酸脱氢酶1抑制剂ivosidenib联合阿扎胞苷治疗新诊断急性髓系白血病。中华临床肿瘤学杂志,2020;39:57-65。
DiNardo CD, Pratz K, Pullarkat V, Jonas BA, Arellano M, Becker PS,等。Venetoclax联合地西他滨或氮胞苷治疗初治的老年急性髓系白血病患者。血2019;133:7-17。
确认
国家自然科学基金资助(82070166);江苏省“333”工程(BRA2019103);江苏省卫生健康委医学科研重点项目(ZD2021003);中央高校基本科研业务费项目——江苏省研究生科研实践创新项目(KYCX22_0296, KYCX20_0147);米尔斯坦医学亚裔美国人合作伙伴(MMAAP)基金会血液学研究项目奖(2017年)。
作者信息
作者及隶属关系
贡献
ZG设计临床试验,指导和组织临床试验的实施,指导白血病靶向外显子序列面板,指导实验室实验;YH、JL、QH进行临床试验;JL、YH、QH、YW收集并分析临床资料;JL进行了细胞实验;JZ JZ参与了白血病靶向外显子序列面板的设计,并进行了下一代测序;LZ、ZC、XL、RX、YZ、XY、HX、NS、WZ、ZW、YX、YX、BH、WZ、FM、YC、BD、PS、JX、HT、ZL、BL、YS、HQ、LD招募患者并收集和解释资料;CS给出了数据分析和实验性能的结构建议;CS、ZG、SD、ED、LS撰写、编辑稿件及文献检索。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
李,J,韩,Q,黄,Y。et al。阿扎胞苷联合HAG治疗急性髓系白血病的高效:一项开放标签、单臂、多中心、2期研究血癌;12, 145(2022)。https://doi.org/10.1038/s41408-022-00740-3
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41408-022-00740-3