摘要gydF4y2Ba
唾液酰转移酶ST6GAL1将α2-6连接的唾液酸添加到细胞表面的n -聚糖和分泌的糖蛋白中,与许多人类癌症显著相关。肿瘤源性ST6GAL1促进肿瘤细胞的行为,如侵袭和抵抗细胞应激以及化疗和放疗。正常情况下,ST6GAL1存在于细胞内分泌器中,并在生物合成转运中糖基化新生糖蛋白。然而,ST6GAL1也被释放到细胞外环境中,细胞外重塑细胞表面和分泌的聚糖。ST6GAL1这种非典型外在机制对肿瘤细胞病理生物学的影响尚不清楚。我们假设ST6GAL1的作用是在er -高尔基复合体内细胞自主作用的天然表达的唾液基转移酶和来自细胞外来源的唾液基转移酶的联合作用,以重塑细胞表面聚糖。我们发现shRNA对ST6GAL1固有表达的抑制导致外泌体样囊泡中ST6GAL1货物的减少,以及乳房肿瘤细胞的生长和体外3D培养中的侵袭性行为的减少。细胞外ST6GAL1存在于癌症外泌体或自由可溶性的重组唾液酸转移酶中,通过促进癌细胞增殖和增加侵袭性来弥补内部不足的ST6GAL1。此外,我们提出的证据支持在外泌体样颗粒中存在新颖但尚未被表征的辅因子,这些辅因子可以有效地放大ST6GAL1的外源性作用,突出了以前未知的将该酶与癌症病理生物学联系起来的机制。我们的数据表明,远程来源的细胞外ST6GAL1可以补偿细胞ST6GAL1介导的侵袭性肿瘤细胞增殖和侵袭行为,细胞外ST6GAL1具有巨大的临床潜力,因为这些分子位于细胞外空间,应该是容易接近的靶标。gydF4y2Ba
简介gydF4y2Ba
唾液酰转移酶ST6GAL1介导n -聚糖的α2,6-唾液酰化,与人类癌症显著相关,包括卵巢癌、前列腺癌、胰腺癌、结肠癌、肺癌、结直肠癌、胰腺癌、胃癌、乳腺癌和急性髓系白血病[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].癌症ST6GAL1水平升高通常与肿瘤分级高、转移和患者预后较差相关[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].此外,st6gal1介导的α2,6连接唾液酸化在某些癌症中激活PI3K/AKT、表皮生长因子受体(EGFR)以及细胞生长和增殖[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].此外,st6gal1介导的唾液化可调节细胞表面受体功能,包括整合素、死亡受体、TNFR1,以及促进上皮细胞向间充质转化(EMT)和对化疗和放疗的抵抗[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].这些及相关研究促使人们认为ST6GAL1是一种促进癌症的因子,包括乳腺癌[gydF4y2Ba11gydF4y2Ba].然而,一些报告表明,在最具侵袭性的癌症和最高癌症ST6GAL1的个体中,患者的长期生存率更高[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].这一难题提出了一个问题,即癌症ST6GAL1过表达是否对患者的长期预后有益或最终有害,并强调了对ST6GAL1如何参与癌症进展的不完整的机制理解。正常情况下,发挥功能的ST6GAL1存在于细胞内er -高尔基体分泌复合体中,新生细胞表面和分泌成分的唾液化发生细胞自主。正是在细胞自主的背景下,ST6GAL1参与癌症进展已被解释。gydF4y2Ba
侵袭性乳腺癌是一种高度异质性的疾病,由乳腺上皮细胞中各种不同的细胞内禀遗传改变引起,导致个体患者的疾病表现具有极大的异质性,并主要影响患者的预后和治疗方案[gydF4y2Ba14gydF4y2Ba].目前尚不清楚的癌细胞外在机制也被认为有助于疾病进展和具有不同表现形式的异质基因突变。乳腺癌患者播散的癌细胞中n -聚糖特征升高[gydF4y2Ba15gydF4y2Ba], α2,6连接唾液酸的异质性被认为增强了侵袭性乳腺癌细胞的侵袭性[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
除了典型的细胞内er -高尔基区域外,催化活性的ST6GAL1也存在于细胞外空间和体循环中。这些细胞外糖基转移酶的生理作用很少受到关注,但我们和其他人已经确定细胞外ST6GAL1是造血、炎症细胞产生、B细胞分化和增殖以及抗炎IgG唾液化的有效修饰剂[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].此外,ST6GAL1从癌细胞和健康的非相关来源(如肝脏)释放到细胞外环境[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].我们假设ST6GAL1的作用是细胞内细胞原生ST6GAL1细胞自主作用和细胞外ST6GAL1非细胞自主作用的共同作用。gydF4y2Ba
我们证实癌症ST6GAL1在三阴性乳腺癌(TNBC)的临床标本中表达不同,这些临床标本赋予侵袭性乳腺肿瘤中α2,6-唾液酸的异质性存在。基于在线KM-plotter分析,乳腺癌细胞源性ST6GAL1与侵袭性乳腺癌的转移进展相关,但我们也观察到癌症ST6GAL1 mrna的高表达与TNBC患者良好的无复发生存期(RFS)相关。癌细胞原生ST6GAL1优先与外泌体样颗粒和较小的外泌体样颗粒结合释放。来自ST6GAL1水平高的癌细胞的外泌体样颗粒在原生ST6GAL1表达较少的癌细胞中引起细胞增殖和侵袭性增加。我们的数据进一步表明,癌症外泌体中存在未定义的辅因子,这些辅因子增强了细胞外ST6GAL1的作用。细胞外ST6GAL1和未定义的外泌体辅助因子可以补偿细胞内固有的ST6GAL1表达,并增强癌细胞的侵袭性生长和增殖、癌细胞侵袭、EMT、CSCs(癌症干细胞)转录因子和血清退出应激介导的癌细胞凋亡。我们的数据强调了一种在癌症病理生物学中连接细胞外ST6GAL1的以前未被重视的非细胞自主机制。gydF4y2Ba
材料与方法gydF4y2Ba
细胞和试剂gydF4y2Ba
MCF7、MDA-MB-231 (MDA-231)、BT-474、T-47D、ZR-75-1、E0771和BT-549细胞来源于美国弗吉尼亚州ATCC。LM-2-4细胞由Dr. John Ebos, Roswell Park综合癌症中心(RPCCC)(NY, USA)提供。4T1亲本和转移克隆4T1.2细胞由Cheryl L. Jorcyk教授捐赠,博伊西州立大学(ID, USA)。乳腺癌脑转移克隆MDA-231/BR来自美国贝塞斯达国家癌症研究所的Patricia S. Steeg博士。MCF7细胞在添加0.25%葡萄糖和10%胎牛血清(FBS)的无酚红改良最低必需培养基中培养。BT-474、BT-549、4T1、4T1.2和E0771细胞在含10%胎牛血清的RPMI培养基中培养。T-47D、ZR-75-1、MDA-231、LM-2-4和MDA-231/BR细胞在含10%胎牛血清的DMEM培养基中培养。所有细胞培养基均添加青霉素(100单位/ml)和链霉素(100µg/ml)。所有实验均在对数生长期进行,传代时间不超过6周。这里使用的所有细胞系都经过我们实验室的认证,不含支原体。 Cells were plated 24 h before treatment. Recombinant rat secretory ST6GAL1 enzyme (rST6G) [24gydF4y2Ba]由美国乔治亚州佐治亚大学的凯利·w·莫莱梅博士制作。cmp -唾液酸(CMP-Sia)(MilliporeSigma,马萨诸塞州,美国),DAPI (BioLegend, CA,美国;0.5µg/ml), Crystal Violet (MilliporeSigma, Massachusetts, USA), Matrigel (Biosciences, CA, USA), Cell Counting Kit-8 (CCK-8), WST-8来自Dojindo Molecular Technologies, MD, USA。靶向小鼠ST6GAL1的shRNA (shST6GAL1 #1,在Lau实验室建立并验证;shST6GAL1 #2,西格玛,cat # TRCN0000018819,序列CCGGCGAGAGATTGATAATCATGATCTCGAGATCATGATTATCAATCTCTCGTTTTT;shST6GAL1 #3, Sigma, cat # TRCN0000018821,序列CCGGCCAGATCTGATTCAGCCGAATCTCGAGATTCGGCTGAATCAGATCTGGTTTTT),人ST6GAL1 (shST6GAL1 #1, Sigma, cat # TRCN0000035432,序列CCGGCGTGTGCTACTACTACCAGAACTCGAGTTCTGGTAGTAGTAGCACACGTTTTTG;用shST6Gal1 #2, Sigma, cat # TRCN0000035429,序列CCGGCGCTGCTCTATGAGAAGAATTCTCGAGAATTCTTCTCATAGAGCAGCGTTTTTG)和shControl (pLKO.1)敲除ST6GAL1。Lipofectamine 3000转染试剂(Invitrogen, MA, USA)用于shRNA质粒转染。通过使用抗st6gali山羊多克隆抗体进行免疫印迹验证成功敲除(R&D Systems, MN, USA;猫。 # AF5924) and qPCR analysis.
免疫印迹gydF4y2Ba
如前所述,细胞裂解物用于Western blot分析[gydF4y2Ba25gydF4y2Ba].简单地说,用冰冷的1X PBS清洗细胞两次,并在裂解缓冲液[20 mM Tris (pH 7.4), 20%甘油,150 mM NaCl, 0.5% NP-40, 5 mM正钒酸钠,40 mM β-甘油磷酸,15 mM NaF, 0.5 mM 4-脱氧吡啶多辛,蛋白酶抑制剂鸡尾酒(Sigma)]中用探针声波法裂解细胞。未破碎的细胞在4℃,700 × g离心10 min。用Bradford方法(Bio-Rad, CA, USA)测定蛋白质浓度。每车道装载25 μg蛋白质,用10% SDS-PAGE分离后转移到硝化纤维膜上。膜用5%的阻塞液在1X TBST缓冲液(均来自Bio-Rad)中在室温下阻塞1小时。膜在4°C下与以下一抗(1:10 00稀释)在TBST缓冲液(Bio-Rad)中孵育过夜。膜在室温下用TBST缓冲液彻底清洗,然后用兔或小鼠或山羊二抗(1:5 00 TBST含1%阻断液)孵育(室温下1小时)。膜在室温下彻底清洗,并使用增强化学发光(ECL) western blotting底物(#32106;Pierce/Thermo Fisher Scientific, MA, USA)。 Western blot images were obtained by exposing the membranes to X-ray films (Thermo Fisher Scientific, MA, USA).
western blot检测一抗:β-tubulin、Cytochrome c、Caspase 3 cleaved product、PARP、N-cadherin、E-cadherin、Snail均来自美国MA公司Cell Signaling Technology;TSG101、CD63和GM130来自美国加州Santa Cruz Biotechnology。此外,使用以下二抗进行Western blot分析:过氧化物酶偶联山羊抗兔IgG(#111-035-045)和山羊抗小鼠IgG(#115-035-062)(均来自美国宾夕法尼亚州杰克逊免疫研究实验室)和抗山羊IgG hrp偶联抗体(#HAF109, R&D Systems, Inc.)。锰、美国)。gydF4y2Ba
体外唾液酰转移酶测定gydF4y2Ba
如前所述,使用细胞提取物进行唾液酰转移酶测定[gydF4y2Ba18gydF4y2Ba].简单地说,1.4µl细胞裂解物与受体A (galβ 1,4glcacc - o - bn;多伦多研究化学公司,安大略省,加拿大)的ST6GAL1活性或受体B (galβ 1,3glcacc - o - bn;多伦多研究化学公司,安大略省,加拿大)的ST3GAL6酶活性,底物CMP-SiagydF4y2BaH3gydF4y2Ba在测定缓冲液中(50 mM碳酸钠pH 6.5, 0.5% Triton X-100)。酶反应在37℃下进行1 h。酶促反应后,酶产物(SiagydF4y2BaH3gydF4y2Ba-受体)使用Waters Sep-Pak®C18色谱柱分离。甲醇流动的液体闪烁计数专门计算反应产物的放射性。酶活性以fmol产物/min/mg细胞提取物蛋白计算。gydF4y2Ba
实时聚合酶链反应gydF4y2Ba
实时荧光定量PCR (qPCR)分析如前所述[gydF4y2Ba25gydF4y2Ba].总RNA是用Trizol (Life Technologies, CA, USA)制备的。用脱氧核糖核酸酶处理从RNA中去除DNA污染(Qiagen, MD, USA)。RNA (2 μg)用高容量cDNA Archive kit (Life Technologies)进行逆转录。将cdna稀释10倍(目标基因)和100倍(保守基因甘油醛3-磷酸脱氢酶(GAPDH),在CFX96循环器(Bio-Rad)上用SYBR Green qPCR扩增。基因表达水平由2gydF4y2Ba−(ΔΔCT)gydF4y2Ba方法(gydF4y2Ba26gydF4y2Ba2 .在一些实验中gydF4y2Ba−(ΔCT)gydF4y2Ba方法(gydF4y2Ba27gydF4y2Ba]归一化为GAPDH的表达。本文采用real-time PCR引物。gydF4y2Ba
Human-ST6GAL1-F: 5 ' -GCAAAGATCAGAGTGAAACAG-3 ', human-ST6GAL1-R: 5 ' -CACCTCATCGCAGACATG-3 ';mouse-ST6GAL1-F: 5 ' -CTTGGCCTCCAGACCTAGTAAAGT-3 ', mouse-ST6GAL1-R: 5 ' -TCCCTTTCTTCCACACGCAGATGA-3 ';human-GAPDH-F: 5 ' - CTTAGCACCCCTGGCCAAG, human-GAPDH-R: 5 ' - gatgttctggagagccccg -3 ';mouse-GAPDH-F: 5 ' - tcaccatcttccaggaggga -3 ', mouse-GAPDH-R: 5″- gcattgctgacaatcttgagtgg -3 ';human-Twist1-F: 5 ' -CTCAAGAGGTCGTGCCAATC, human-Twist1-R: 5 ' - cccagtatttttattttctaaaggtgtt -3 ';human-Slug-F: 5 ' - CGAACTGGACACACATACAGTG-3 ', human-Slug-R: 5 ' - ctgaggatctctggttgtggt -3 ';human-Aldh1-F: 5″- AACTCCTCTCACTGCTCTCCACG-3 ', human-Aldh1-R: 5 ' - GTCACCCTCTTCAGATTGCTTTTCC-3 ';human- cmyc - f: 5 ' - CACGAAACTTTGCCCATAGC-3 ', human-cMyc-R: 5 ' - gcaaggagagcctttcagag -3 ';human-Nanog-F: 5 ' -TTT GTG GGC CTGAAG AAA ACT-3 ', human-Nanog-R: 5 ' -AGG GCT GTC CTG AAT AAG CAG-3 ';human-Oct4-F: 5 ' - CCTGAAGCAGAAGAGGATCA-3 ', human-Oct4-R: 5 ' - ccgcagcttacacatgttct -3 '; human-E-Cadherin-F: 5″- CGTGAGCATCCAGGCAGTGGTAGC-3′, human-E-Cadherin-R: 5′- GAGCCGCCGCCGCAGGAAG-3′; human-N-Cadherin-F: 5′-TCAGGCGTCTGTAGAGGCTT-3′, human-N-Cadherin-R: 5′-ATGCACATCCTTCGATAAGACTG-3′; human-Snail-F: 5′-GGCAATTTAACAATGTCTGAAAAGG-3′, human-Snail-R: 5′-GAATAGTTCTGGGAGACACATCG-3′; human-CD44-F: 5′-AGAAGGTGTGGGCAGAAGAA-3′, human-CD44-R: 5′-AAATGCACCATTTCCTGAGA-3′; human- Vimentin-F: 5’AGTCCACTGAGTACCGGAGAC-3′, human- Vimentin-R: 5′- CATTTCACGCATCTGGCGTTC-3″; human-Sox2-F: 5′-GAGCTTTGCAGGAAGTTTGC-3′, human-Sox2-R: 5′-GCAAGAAGCCTCTCCTTGAA-3′.
超离心分离细胞外囊泡gydF4y2Ba
如前所述,ev是从以癌细胞为条件的培养基中分离出来的,并进行了微小的修饰[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].简单地说,融合乳腺癌细胞在无血清培养基中培养48小时。收集上清液,500 ×离心gydF4y2BaggydF4y2Ba在4°C下浸泡20分钟,丢弃细胞。上清液在4℃下10000 × g离心30 min,去除细胞碎片和凋亡小体。最后,上清液在4℃下10万× g超离心90 min,析出ev。用20体积的冰水缓冲液(25 mM HEPES, pH7.0 in 1× PBS)重悬ev,再次离心10万次清洗gydF4y2BaggydF4y2Ba在4°C下放置90分钟。洗净的颗粒(原上清的1/10体积)被指定为外泌体样颗粒。利用ev特异性标记抗体(阳性标记:TSG-101和CD63;通过纳米颗粒跟踪(NanoSight, Wiltshire, UK)和透射电镜(TEM)对外显体样颗粒的大小、数量和形态进行了表征。gydF4y2Ba
纳米颗粒跟踪分析(NTA)gydF4y2Ba
如前所述,[gydF4y2Ba29gydF4y2Ba通过NTA分析外泌体样粒子,使用NanoSight LM10系统(NanoSight, LM10, Malvern Instruments,伍斯特郡,英国)测量外泌体的大小、大小分布和浓度。简单地说,每个外泌体样颗粒样品在含有25 mM HEPES (pH 7.0)缓冲液的PBS中稀释,直到在NanoSight LM10系统的视野中可以追踪到50-100个纳米颗粒。所有测量的测量参数设置也完全相同。在视图捕捉过程中,相机级别设置为14。在视频处理过程中,检测阈值设置为6,屏幕增益设置为8。每个样本录制5个时长为60秒的视频。gydF4y2Ba
透射电子显微镜(TEM)gydF4y2Ba
外泌体样粒子的透射电镜分析如前所述[gydF4y2Ba23gydF4y2Ba].外泌体样颗粒用2.5%戊二醛在0.1 M碳酸钠缓冲液中固定。样品在栅格上孵育,用2%醋酸铀酰负染色。在Philips/FEI T-12透射电子显微镜上成像,并用NIH ImageJ软件进行分析。gydF4y2Ba
rST6G和外泌体样粒子对细胞的处理gydF4y2Ba
治疗前一天,细胞以50%的汇合度播种,并在全血清培养基中培养。然后,用无血清培养基洗涤细胞两次,用重组rST6G(1-2µg/ml)±CMP-Sia处理一些实验或等效载体,如图/图例所示。向细胞中添加外显体样颗粒(1-2µg/处理),加入或不加入rST6G预孵育(室温下5分钟),如图所示。处理结束后,进行细胞增殖、3D球体试验、Western blots和qPCR分析。gydF4y2Ba
细胞增殖试验gydF4y2Ba
细胞增殖试验如所述进行[gydF4y2Ba30.gydF4y2Ba].简单地说,在治疗前一天,细胞在96孔组织培养板上的全血清培养基中培养。第二天,细胞在无血清培养基中清洗两次,并进行治疗,如图/图例所示。加入WST-8试剂,37℃孵育1 h,测定细胞生长;在450nm处用背景相减法测定吸光度。gydF4y2Ba
三维入侵试验gydF4y2Ba
癌细胞球形实验在三维细胞培养环境中进行[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].简单地说,20,000个细胞在DMEM F12培养基(Gibco-Thermo Fisher Scientific, NY, USA)中培养,在超低附着24孔板(VWR)中分别替换20 ng/ml人EGF (Pepro Tech, NJ, USA)、人FGF和1× B27 (Gibco-Thermo Fisher Scientific),并在1-2µg/ml rST6G、CMP-Sia或等效对照物中培养24小时。此外,在一些实验中,细胞在含有或不含rST6G的1-2µg自身或源细胞外泌体样颗粒中生长,如图/图例所示。然后,将细胞与BD Matrigel (Biosciences, CA, USA)在DMEM F12-Growth Factors培养基中(2:3比例)充分混合,并镀在超低附着板上。最后,肿瘤细胞球状体用rST6G或外显体样颗粒或等效载体对照处理,如图/图例所示,再持续三天。使用尼康Eclipse Ti-U倒置相位对比显微镜(尼康仪器公司,NY, USA)在×10放大倍率下对5个随机选择的三维球体成像。使用ImageJ软件(美国国立卫生研究院,MD, USA)分析侵袭性肿瘤细胞侵袭表型。三维椭球体入侵被量化为每个椭球体内凸/突起的平均数量(gydF4y2BangydF4y2Ba= 5 - 10)。此外,在一些实验中,椭球体入侵被量化为每个椭球体内凸/突起的平均长度(µm) (gydF4y2BangydF4y2Ba= 5 - 10)。gydF4y2Ba
免疫荧光gydF4y2Ba
将细胞培养在13毫米的无菌载玻片上,在含5% fbs的培养基中,以50%的汇合度过夜。在一些实验中,细胞用4%多聚甲醛在37℃下固定10 min;在多聚甲醛固定前,细胞用无血清培养基洗涤两次,并用外泌体样颗粒±rST6G或等效的载体对照处理,如图/附图所示。首先,用0.1%的Triton X-100 (Sigma)在室温(RT)下渗透载玻片5分钟。然后,用1× PBS冲洗载玻片,1% BSA (Sigma)在rt下堵塞1小时。用TBS-T (0.1% Tween 20)短暂冲洗后,用直接fitc偶联的sna -凝集素孵育载玻片[gydF4y2Ba35gydF4y2Ba] (Sambucus nigra agglutinin, Vector Laboratories, CA, USA), 1:500稀释于含TBS-T的1% BSA中,rt中轻度摇晃2小时。最后,用TBS-T大量清洗载玻片,并用DAPI染色(BioLegend, CA, USA)。使用ZOE荧光细胞成像仪(Bio-Rad)固定曝光时间和参数获取图像,并进行处理。对斐济/ImageJ软件(NIH)处理的图像进行评估,其中有两个生物重复的四个视场[gydF4y2Ba36gydF4y2Ba].sna -凝集素染色表示为平均像素亮度(仅FITC染色)/每张图像dapi染色核数=每个细胞的平均荧光强度(MFI) [gydF4y2Ba37gydF4y2Ba].gydF4y2Ba
免疫组化检测ST6GAL1gydF4y2Ba
经机构审查委员会批准(RPCCC, BDR # 074516),我们从RPCCC的BDDR中获得了去识别的TNBC临床标本。如前所述,在一个个体的TNBC组织切片中,用免疫组化方法评估ST6GAL1的表达[gydF4y2Ba18gydF4y2Ba].将组织标本嵌入OCT化合物中(Leica Microsystems, Wetzlar, Germany),并制备嵌入组织的冷冻切片。切片在5%的牛血清白蛋白中封闭1小时,用抗st6gal1抗体孵育过夜,然后用抗山羊hrp次级抗体(R&D Biosystems)孵育1小时。然后将组织浸泡在Impact DAB染色(Vector Labs)中120秒,并在水中冲洗3分钟。使用尼康Eclipse E600光学显微镜在200×和630×(插入)放大倍率下获取图像。利用Spot RT3相机和Spot软件对法师进行采集和分析。深棕色(红色箭头)和浅棕色(绿色箭头)的ST6GAL1染色显示为ST6GAL1蛋白的异质性表达模式。gydF4y2Ba
生物信息学分析gydF4y2Ba
转录组数据通过cBioportal从癌症基因组图谱(TCGA)乳腺癌队列中获得[gydF4y2Ba38gydF4y2Ba].ST6GAL1 mRNA的表达水平在乳腺癌(TCGA,gydF4y2BangydF4y2Ba= 1078)和正常健康的乳腺组织(gydF4y2BangydF4y2Ba= 52)。基于免疫组化(ER + HER2-,gydF4y2BangydF4y2Ba= 584;HER2 +,gydF4y2BangydF4y2Ba= 181;TNBC,gydF4y2BangydF4y2Ba= 159)。ST6GAL1 mRNA水平在不同阶段(1期,gydF4y2BangydF4y2Ba= 178;第二阶段,gydF4y2BangydF4y2Ba= 610,第三阶段,gydF4y2BangydF4y2Ba= 245;第四阶段,gydF4y2BangydF4y2Ba= 19)的乳腺癌患者在TCGA队列。gydF4y2Ba
数据来源于国际乳腺癌分子分类协会(METABRIC) (gydF4y2BangydF4y2Ba= 1904)用于验证ST6GAL1 mRNA在亚型、侵袭期和组织学分级中的分布数据[gydF4y2Ba39gydF4y2Ba].在METABRIC队列中,分析了乳腺癌亚型(ER + HER2−,gydF4y2BangydF4y2Ba= 1355;HER2 +,gydF4y2BangydF4y2Ba= 236;TNBC,gydF4y2BangydF4y2Ba= 313),阶段(分期1,gydF4y2BangydF4y2Ba= 475;第二阶段,gydF4y2BangydF4y2Ba= 800,第三阶段,gydF4y2BangydF4y2Ba= 115;第四阶段,gydF4y2BangydF4y2Ba= 9),组织学分级(1级,gydF4y2BangydF4y2Ba= 165;二年级,gydF4y2BangydF4y2Ba= 740;三年级,gydF4y2BangydF4y2Ba= 927)。突变等位基因肿瘤异质性(MATH)评分,肿瘤内异质性的衡量,中位截断(高与低ST6GAL1 mRNA,gydF4y2BangydF4y2Ba= 539/组)通过R/Bioconductor包“maftools”计算;来自大规模队列癌症研究的(MAF)文件的高效分析、可视化和总结(gydF4y2Bahttps://www-biorxiv-org.gate.lib.buffalo.edu/content/early/2016/05/11/052662gydF4y2Ba) [gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
转移标志基因集富集分析(GSEA)gydF4y2Ba
基因集富集分析(GSEA)使用Broad研究所(gydF4y2Bahttp://software.broadinstitute.org/gsea/index.jspgydF4y2Ba) [gydF4y2Ba41gydF4y2Ba].用于GSEA软件的注释基因集集合可在分子特征数据库(MSigDB) (gydF4y2Bahttp://software.broadinstitute.org/gsea/msigdbgydF4y2Ba).GSEA的结果是归一化富集分数(NES),它反映了一个基因集在基因排名列表的顶部或底部被过度代表的程度。使用R软件进行统计分析(gydF4y2Bahttp://www.r-project.org/gydF4y2Ba).统计显著性定义为GSEA软件推荐的错误发现率(FDR)小于25%。gydF4y2Ba
统计分析gydF4y2Ba
定量数据以三个独立重复的平均值±SE表示。我们对包含多个组比较的数据集使用了单向方差分析检验,并对家庭错误率比较使用了Tukey的事后检验。变量之间的关联(例如,基因表达和突变负荷得分)是使用Mann-Whitney确定的gydF4y2BaUgydF4y2Ba测试。采用Kaplan-Meier法结合log-rank检验比较组间生存曲线。所有统计测试均使用GraphPad Prism 8软件进行。gydF4y2BaPgydF4y2Ba< 0.05为有统计学意义(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001)。gydF4y2Ba
结果gydF4y2Ba
ST6GAL1在侵袭性人类乳腺癌中异质表达和升高gydF4y2Ba
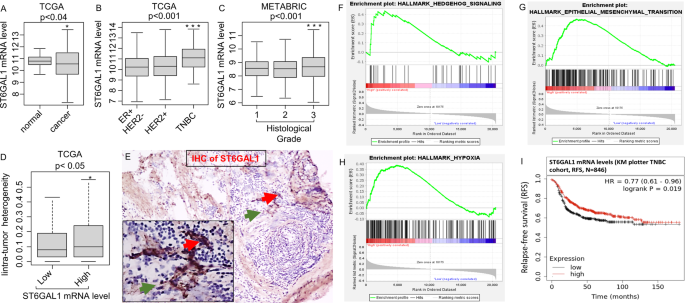
TCGA是两个具有大型乳腺癌患者队列的基因表达数据库之一。尽管与对照组相比,乳腺癌患者中ST6GAL1转录丰度总体上有所降低(图2)。gydF4y2Ba1gydF4y2Ba), TNBC侵袭性癌症与HER2+和ER+亚型相比,ST6GAL1 mRNA水平升高(图2)。gydF4y2Ba1 bgydF4y2Ba).此外,METABARIC队列分析证实,与ER+亚型相比,TNBC和HER2+中ST6GAL1表达显著升高(补充图)。gydF4y2BaS1AgydF4y2Ba).gydF4y2Ba
箱线图显示正常邻近乳腺组织中ST6GAL1基因的高表达评分(gydF4y2BangydF4y2Ba= 117)与TCGA乳腺癌队列乳腺癌患者的比较[gydF4y2Ba64gydF4y2Ba]患有原发肿瘤(gydF4y2BangydF4y2Ba= 979) (gydF4y2Ba一个gydF4y2Ba).学生的gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba= 0.031。免疫组化(IHC)测定TCGA乳腺癌中ST6GAL1高表达评分的箱线图(gydF4y2BaBgydF4y2Ba), METABRIC队列显示诺丁汉病理分级[gydF4y2Ba39gydF4y2Ba) (gydF4y2BaCgydF4y2Ba).所有箱形图都是Tukey类型,并且这些箱形图描述了中位数和四分位间范围。采用单因素方差分析和Tukey检验进行计算gydF4y2BapgydF4y2Ba值。肿瘤内异质性的箱形图[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba]在TCGA乳腺癌队列中按ST6GAL1低评分组和高评分组(gydF4y2BaDgydF4y2Ba).Mann-WhitneygydF4y2BaUgydF4y2Ba采用Kruskal-Wallis检验和Kruskal-Wallis检验计算gydF4y2BapgydF4y2Ba价值。采用中位数截断法将两组进行分组。ST6GAL1的免疫组化;代表(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaEgydF4y2BaTNBC组织切片免疫组化显示抗ST6GAL1抗体(红色箭头较高,绿色箭头较低)。TCGA乳腺癌队列中高ST6GAL1基因集富集试验(GSEA)显示Hedgehog基因富集(gydF4y2BaFgydF4y2Ba), emt (gydF4y2BaGgydF4y2Ba)和缺氧(gydF4y2BaHgydF4y2Ba)的途径。TCGA-BRCA队列归一化富集评分(NES)和错误发现率(FDR)值为:Hedgehog, NES = 1.467799;fdr = 0.161496;Emt, nes = 1.458644;fdr = 0.160286;缺氧,NES = 1.622797, FDR = 0.085881。以FDR为0.25作为GSEA的统计学意义。采用中位数临界值将两组(高ST6GAL1组和低ST6GAL1组)进行分组。gydF4y2Ba我gydF4y2BaKaplan-Meier通过TNBC患者的mRNA来估计无复发生存(RFS)的概率。分析采用在线km -绘图仪[gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
重要的是,ST6GAL1 mRNA水平升高与乳腺癌患者肿瘤级别升高显著相关(图2)。gydF4y2Ba1 cgydF4y2Ba),尽管ST6GAL1的表达似乎与乳腺癌的侵袭期无关(补充图。gydF4y2Ba印地CgydF4y2Ba).重要的是,ST6GAL1 mRNA的升高与乳腺癌患者肿瘤内异质性相关(图2)。gydF4y2Ba1 dgydF4y2Ba).当使用抗ST6GAL1免疫组化(IHC)检测TNBC临床标本时,我们观察到ST6GAL1蛋白的异质性表达(图。gydF4y2Ba1 egydF4y2Ba),与其他临床个案的结果相似[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
总体而言,使用TCGA进行分析(图。gydF4y2Ba1 f-hgydF4y2Ba)和METABRIC队列(补充图;gydF4y2BaS1D-FgydF4y2Ba)揭示了ST6GAL1的升高与癌干性(Hedgehog)、上皮-间充质转化(EMT)和缺氧通路相关基因网络的富集有关。这些数据与ST6GAL1与乳腺癌的侵袭性进展有关的观点一致。矛盾的是,在TNBC患者中观察到一个明显相反的趋势,即较高的ST6GAL1表达也与更好的无复发生存期(RFS)相关(图。gydF4y2Ba1我gydF4y2Ba).gydF4y2Ba
ST6GAL1在乳腺肿瘤细胞中呈异质性表达gydF4y2Ba
ST6GAL1是一种催化活性酶,在糖蛋白的n -链聚糖上构建α2,6-唾液酸部分。为了进一步了解ST6GAL1的表达是如何被调节的,并最终影响癌症中n -聚糖的唾液化,我们检查了一系列乳腺肿瘤细胞系(ER+和TNBC)在mRNA、蛋白质、酶活性和同源酶产物(细胞表面聚糖上的α2,6连接唾液酸)的丰度上的ST6GAL1表达。gydF4y2Ba2gydF4y2Ba面板A, B, C, D, E)。已发表的数据已经表明,各种肿瘤细胞系,包括乳腺癌细胞系,具有不同水平的ST6GAL1蛋白[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
一个gydF4y2Ba通过实时定量PCR (qPCR)检测ER +和TNBC人类和小鼠乳腺癌细胞中ST6GAL1的mRNA水平,归一化至GAPDH (2^-delta Ct)。gydF4y2BaNgydF4y2Ba= 3,数据为均值±标准差。gydF4y2BaBgydF4y2Ba来自不同细胞培养物的总细胞裂解物(gydF4y2Ba一个gydF4y2Ba)用ST6GAL1抗体进行Western blot分析。β-微管蛋白被用作细胞质的特异性标记物,并显示出相同的负载和转移。gydF4y2BaCgydF4y2Ba如前所述,等量的细胞裂解物蛋白质(gydF4y2BaBgydF4y2Ba)用于ST6GAL1酶的测定,如前所述[gydF4y2Ba65gydF4y2Ba].ST6GAL1活性以fmol/min/mg蛋白表达;酶测定分为三次。数据为均数±标准差。gydF4y2BaDgydF4y2Ba固定前,用FITC-(绿色)标记的SNA凝集素和DAPI(蓝色)对细胞核进行免疫染色,对人鼠代表性ER+和TNBC细胞系进行免疫染色。在荧光显微镜下,DAPI和FITC荧光的曝光时间和加权在样品之间保持一致。代表性图片(gydF4y2BaNgydF4y2Ba= 4)显示在50µm的比例尺上。gydF4y2BaEgydF4y2Ba图像在ImageJ中处理;在每个条件下使用相同的参数进行背景减法和每个细胞的MFI计算,每个细胞的平均荧光强度(MFI)用mean±s.d表示。四个视场。gydF4y2Ba
在这里,我们检查了一系列乳腺肿瘤细胞系(ER+和TNBC)。通常观察到ST6GAL1的两种分子形式,较大的50 kDa和较小的42 kDa形式分别代表全长和较小的可溶性催化结构域,已知从其n端胞浆和跨膜锚点蛋白水解释放[gydF4y2Ba18gydF4y2Ba].在检查的乳腺癌细胞组中,人类细胞仅具有较大的50 kDa形式(图2)。gydF4y2Ba2 bgydF4y2Ba).在检测的三种小鼠细胞系(4T1、4T1.2和E0771)中观察到的最大的ST6GAL1形式的电泳迁移率似乎略小于人类细胞中相应的最大的ST6GAL1。目前,这种种在种间电泳迁移率差异的分子基础尚不清楚,推测部分原因可能是ST6GAL1蛋白的糖基化差异。在检测的两个小鼠乳腺癌系(4T1和4T1.2)中,也观察到少量的最低~40 kDa形式,可能是催化释放的可溶性催化结构域。gydF4y2Ba
数字gydF4y2Ba2gydF4y2Ba也说明了ST6GAL1 mRNA和蛋白的水平在细胞系面板内也有很大的变化。用酶法测定了唾液酸从cmp -唾液酸转化为Sia α2,6与Gal(β1,4) glcacc - r结合的过程(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).虽然在检测的细胞系中,高ST6GAL1蛋白与高ST6GAL1催化活性之间存在普遍的一致性,但也观察到一些显著的差异。在人类细胞组中,BT-474具有中等程度的ST6GAL1蛋白存在,但可检测到的酶活性低。小鼠4T1及其转移变体4T1.2具有大致相同的ST6GAL1蛋白水平,但4T1.2的酶活性远远低于4T1。蛋白质和活性水平之间最显著的不一致是在E0771中,其中观察到高酶活性水平,但ST6GAL1蛋白含量适中。此外,MDA-231/BR也具有最高的酶活性,但ST6GAL1蛋白含量适中(对比图2)。gydF4y2Ba2B和CgydF4y2Ba).gydF4y2Ba
细胞表面α2,6- sia结构用SNA,从凝集素gydF4y2BaSambucus黑质gydF4y2Ba(无花果。gydF4y2Ba2D和EgydF4y2Ba).总的来说,观察到的细胞表面SNA反应性与细胞ST6GAL1 mRNA和蛋白表达水平一致。然而,最引人注目的是同一株细胞之间的可变和异质性SNA反应性。这在MDA-231细胞的肺转移变体LM-2-4中最为明显,但在所有检查的细胞系中都存在,其中只有一个细胞子集是SNA+(图2 - 4)。gydF4y2Ba2 d, EgydF4y2Ba).ST6GAL1 mRNA也不完全与观察到的蛋白水平的表达相关(图。gydF4y2Ba2gydF4y2Ba).值得注意的是ZR75-1和LM-2-4;两种细胞系的mRNA水平都处于中等水平,但几乎没有检测到ST6GAL1蛋白或酶活性。这些观察结果与已发表的人类淋巴母细胞瘤细胞系数据一致[gydF4y2Ba18gydF4y2Ba].此外,与人类乳腺癌临床病例一致的是,我们观察到人乳腺肿瘤细胞在稳态培养条件下ST6GAL1转录本的水平非常低(归一化2^-delta CT)。假设人类和小鼠的ST6GAL1引物同样有效,小鼠TNBC 4T1和乳腺癌骨转移4T1.2细胞比ER + E0771细胞具有更高的ST6GAL1转录本(图7)。gydF4y2Ba2gydF4y2Ba,右侧面板)。gydF4y2Ba
总的来说,这些数据描述了ST6GAL1在乳腺癌细胞系中高度可变的表达,但细胞系中可测量的酶活性、ST6GAL1蛋白和mRNA水平之间的不一致可能归因于基因表达、蛋白翻译和细胞内ST6GAL1蛋白寿命的复杂差异动力学尚不清楚,且在很大程度上尚未探索。由于细胞内ST6GAL1的大部分持续释放到全身空间,细胞内蛋白质或可测量的酶活性水平在不同细胞之间可能是高度动态和可变的。其他未知因素,如细胞内ST6GAL1 mRNA的修饰剂和/或蛋白质寿命,也可能起作用。gydF4y2Ba
短暂敲除ST6GAL1可降低乳腺肿瘤细胞的生长和侵袭性gydF4y2Ba
在恶性进展过程中,侵袭性癌细胞通过形成富含肌动蛋白丝、粘附蛋白和用于肿瘤细胞运动和细胞外基质(ECM)降解的蛋白酶的不变性结构增殖并穿透基底膜[gydF4y2Ba43gydF4y2Ba].gydF4y2Ba
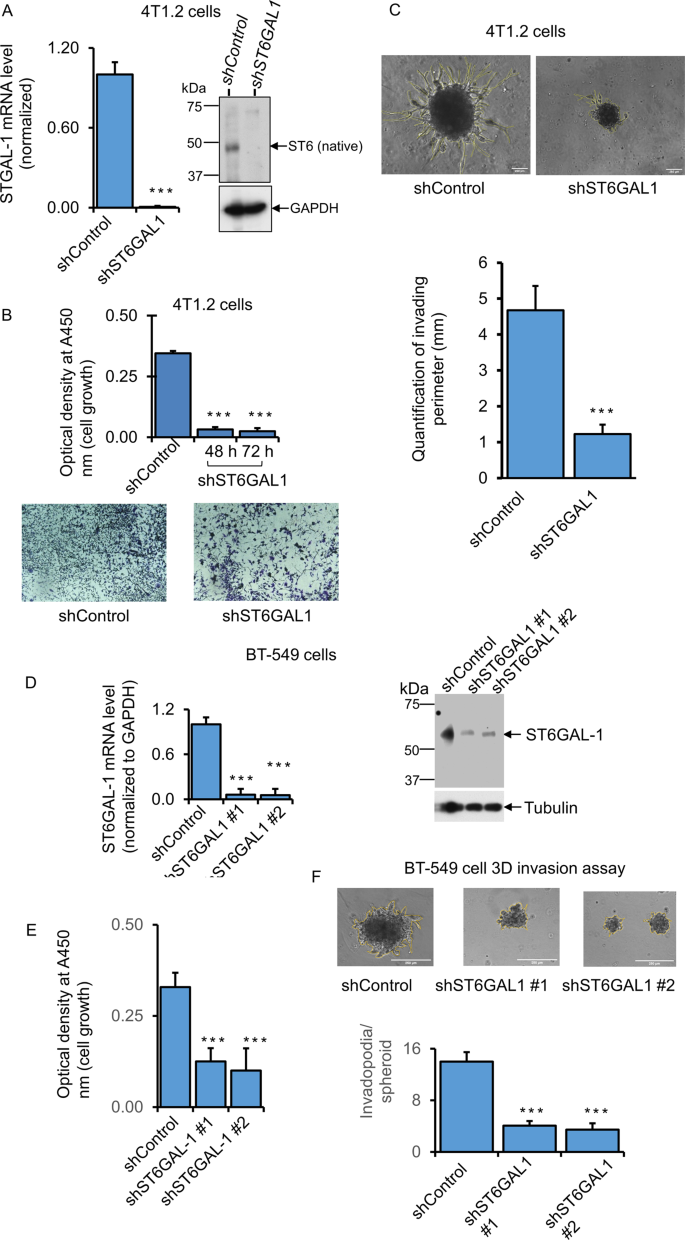
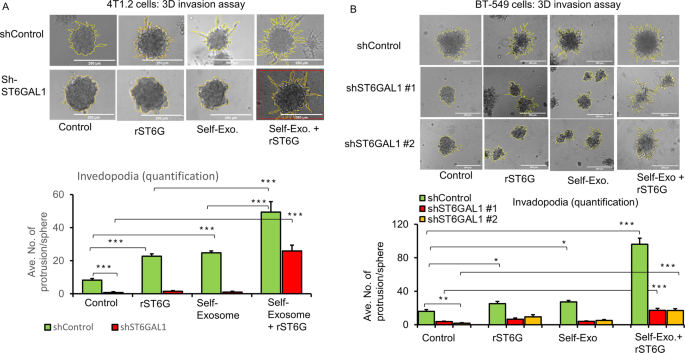
为了评估ST6GAL1表达如何影响侵袭性癌症生长,使用了一种紧密模拟体内环境(包括低氧肿瘤核心)的3D球形培养方法[gydF4y2Ba33gydF4y2Ba].shRNA靶向被用于在几种小鼠和人类乳腺癌细胞系中实现显著的击倒。总结了4T1.2、E0771和BT-549的结果。与随机转染非st6gal1 mRNA的细胞(shControl)相比,在shRNA敲低细胞(shST6GAL1)中监测细胞生长和侵袭特征gydF4y2Ba)gydF4y2Ba.数字gydF4y2Ba3.gydF4y2Ba图A显示,4T1.2细胞shRNA的下调导致ST6GAL1 mRNA和蛋白水平几乎完全降低,同时细胞生长显著降低,且几乎完全衰减。gydF4y2Ba3.gydF4y2Ba面板B, C,分别)。补充图。gydF4y2BaS2gydF4y2Ba图A-E显示E0771细胞的结果。使用了三组针对ST6GAL1 mRNA序列不同位点的导向shrna (shST6GAL#1, shST6GAL#2和shST6GAL#3)。所有这些都能有效降低ST6GAL1 mRNA的表达(补充图。gydF4y2BaS2gydF4y2Ba面板A, C). shST6GAL#1被评价为有效抑制细胞增殖;shST6GAL#2和#3减弱了细胞生长,尽管它们不如#1有效(补充图)。gydF4y2BaS2gydF4y2Ba面板B, E)。#2和#3中ST6GAL1蛋白水平显著降低(补充图。gydF4y2BaS2gydF4y2Ba在E0771细胞中没有测量到侵袭,因为它们在我们的细胞培养中没有形成侵袭性的3D球体。数字gydF4y2Ba3 d-fgydF4y2Ba面板显示BT-549细胞转染shST6GAL#1和shST6GAL#2导向器或随机对照序列(shControl)。与shControl相比,#1和#2引导rna都有效地降低了ST6GAL1 mRNA和蛋白质水平,并同时降低了细胞生长和非复形体的形成(图2)。gydF4y2Ba3D E和FgydF4y2Ba分别)。在大多数情况下,敲除细胞中ST6GAL1 mRNA的降低通常与细胞内ST6GAL1蛋白水平的降低相一致。然而,如前所述,ST6GAL1蛋白在细胞内的基因表达、蛋白质翻译和寿命存在复杂的差异动力学,但人们对其了解和研究甚少。因此,细胞内的ST6GAL1可能是一个短暂的池,并不能真正反映敲除的有效性。gydF4y2Ba
BgydF4y2Ba根据该公司的说明书,用经过验证的shST6GAL1 #1和shControl转染小鼠乳腺癌骨转移4T1.2细胞24小时,使用Lipofectamine P3000试剂(Invitrogen)。将转染shControl和shST6GAL1的5000个细胞置于24孔组织培养板中,在含5%血清的培养基中再培养48 h和72 h,用WST-8试剂检测细胞增殖情况。标化a450nm读数(gydF4y2BangydF4y2Ba= 5)。Dara是均值±s.e。,学生的gydF4y2BatgydF4y2Ba以及,* * *gydF4y2BapgydF4y2Ba< 0.001。4T1.2细胞重复培养48 h进行结晶紫染色(gydF4y2BaBgydF4y2Ba,下面板)。显示了shControl和shST6GAL1的代表性活细胞图像。gydF4y2Ba一个gydF4y2Ba复制培养4T1.2细胞进行SYBR-Green-qPCR,并对ST6GAL1基因进行蛋白分析。将shControl和shST6GAL1样本的ST6GAL1 mRNA水平用饲养基因GAPDH归一化,用Delta-Delta Ct法计算归一化的ST6GAL1水平,gydF4y2BaNgydF4y2Ba= 3,数据为均值±标准差。,学生的gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba< 0.001。ST6GAL1 western blot分析显示有代表性的印迹(gydF4y2BaNgydF4y2Ba= 3), GAPDH用于等负荷的内务控制(gydF4y2Ba一个gydF4y2Ba,右面板)。(gydF4y2BaCgydF4y2Ba2万个转染了shST6GAL1和shControl的4T1.2细胞被转染在12孔低贴壁组织培养板上,与生长因子还原的Matrigel混合72小时,在3D细胞培养环境中获得侵袭性肿瘤细胞侵袭。实验重复三次,显示每种条件下肿瘤细胞侵袭的代表性相位对比图像(×10放大);黄线表示球体主体上的入侵区域。(gydF4y2BaCgydF4y2Ba,下面板)直方图表示入侵区域的量化和突起的平均长度(gydF4y2BaNgydF4y2Ba= 10每条件,比例尺= 250 μ m,数据为±s.e.。,学生的gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BaDgydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba如前所述,用shControl和shST6GAL1 #1 (Sigma Cat# TRCN0000035432)或shST6GAL1 #2 (Sigma Cat# TRCN0000035429)转染人TNBC BT-549细胞。三维细胞入侵实验(gydF4y2BaFgydF4y2Ba,上面板),细胞入侵的量化(gydF4y2BaFgydF4y2Ba,下面板),以及细胞增殖(gydF4y2BaEgydF4y2Ba)进行测定。采用重复培养方法对ST6GAL1进行qPCR和Western blot分析(gydF4y2BaDgydF4y2Ba).qPCR分析用GAPDH归一化基因水平,gydF4y2BaNgydF4y2Ba= 3,数据为±s.e。,学生的gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba< 0.05。实验重复至少三次,并显示有代表性的印迹和图像。在Western blotting中,微管蛋白作为平衡转移的负载控制。侵袭试验直方图数据为均值±标准差。,scale bar 250 µm, one-way ANOVA, and post-hoc test for pair-wise comparison,pgydF4y2Ba< 0.001。gydF4y2Ba
乳腺癌细胞在外泌体样囊泡中释放ST6GAL1gydF4y2Ba
癌细胞释放异源性胞外泡状小颗粒,如外泌体(50 - 120 nm)和外泌体(<50 nm) [gydF4y2Ba23gydF4y2Ba].某些唾液糖蛋白和n -聚糖的富集[gydF4y2Ba44gydF4y2Ba],凝集素[gydF4y2Ba45gydF4y2Ba]和神经氨酸酶[gydF4y2Ba46gydF4y2Ba]已在外泌体中发现,并且外泌体对靶细胞的粘附作用可能至少部分由外泌体聚糖和碳水化合物结合受体介导[gydF4y2Ba47gydF4y2Ba].此外,最近有报道称,包裹ST6GAL1的结肠癌外泌体可传递到靶细胞并参与细胞信号传导[gydF4y2Ba23gydF4y2Ba].在这里,我们研究了乳腺癌细胞是否也将功能性ST6GAL1封装到细胞外囊泡(ev)中。gydF4y2Ba
外泌体样囊泡从4T1.2乳腺癌细胞的融合单分子层中分离出来,在无血清培养基中培养48小时。上清液500 ×离心gydF4y2BaggydF4y2Ba、10000 ×gydF4y2BaggydF4y2Ba, 10万×gydF4y2BaggydF4y2Ba,如上文所述[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].100000×gydF4y2BaggydF4y2Ba微球中EVs标记CD63、Tsg101明显富集,但不表达顺式高尔基基质蛋白GM130和线粒体定位蛋白细胞色素c(图2)。gydF4y2Ba4gydF4y2Ba),与预期的EV制剂一样,不会受到细胞质或线粒体蛋白的大量污染[gydF4y2Ba48gydF4y2Ba].4T1.2 ev货物携带活性ST6GAL1以及至少一种其他唾液酰转移酶ST3GAL6。shST6GAL#1的下调导致外泌体中ST6GAL1降低了4倍,但α2,3-唾液酰转移酶活性的变化可以忽略不计,很可能是ST3GAL6,按EV蛋白浓度归一化测量(图1)。gydF4y2Ba4 bgydF4y2Ba).通过纳米颗粒跟踪分析(NTA)和透射电子显微镜(TEM)图像测量的来自shControl和shST6GAL#1的EV的代表性尺寸分布也显示出来(图2)。gydF4y2Ba4 c, DgydF4y2Ba).补充图gydF4y2BaS3A-FgydF4y2Ba显示ER+ (T47D, ZR-75-1, E0771)和TNBC (BT-549, MDA-231,和4T1.2)癌细胞释放的外泌体大小分布。一般来说,ev在50 ~ 400 nm粒径范围内是一个非均匀的种群。在测试的六种乳腺癌细胞系中,ev的最大主峰范围在86到128纳米之间。ev的浓度也因细胞来源而异。纳米颗粒分泌的细胞系依赖性差异与先前报道的相似[gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
如上所述,用shControl或ShST6GAL1 #1转染4T1.2细胞24 h。细胞在无血清条件培养基中再培养48小时。gydF4y2Ba一个gydF4y2Ba从细胞提取物(左图)和外泌体样颗粒(右图)中提取等量的蛋白质,用所示抗体进行Western blot分析。代表性印迹(gydF4y2BaNgydF4y2Ba3)显示。来自细胞裂解物和外泌体的ST6GAL1在同一凝胶/膜中进行分析,比较它们的分子大小,并在单独的图中显示。等量的外泌体蛋白用于α2,6 n -连接活性(ST6GAL1) (gydF4y2BaBgydF4y2Baα2,3 n -链接活性(ST3GAL6)(B,下图)测定。比活度以fmol/min/µg比积计算,绘制为折叠活性,gydF4y2BangydF4y2Ba= 3,数据为均值±标准差。,学生的gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba< 0.001。NS;不显著。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba纳米粒子跟踪分析(NTA)的尺寸分布和外泌体样粒子的图像,这些图像是ev在NTA特征下录制的视频的截图。外泌体样粒子从shControl (gydF4y2BaCgydF4y2Ba)和shST6GAL1 (gydF4y2BaDgydF4y2Ba)转染4T1.2细胞条件培养基(100倍稀释),NTA检测。(gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba;负染透射电子显微镜(TEM)外泌体样粒子成像。展示代表性图像。比例尺:100 nm。gydF4y2Ba
在4T1.2细胞中敲除ST6GAL1导致外泌体中ST6GAL1显著减少(见图)。gydF4y2Ba4gydF4y2Ba).用透射电镜测量的外泌体形态在shrna敲除样品和shControl样品之间相似(图2)。gydF4y2Ba4 c, DgydF4y2Ba).与对照细胞相比,shST6GAL1中NTA测得的外泌体浓度和外泌体标记蛋白富集(如Tsg101和CD63)略有降低。总的来说,我们的观察指出乳腺癌细胞将ST6GAL1包装成外泌体样结构,释放到细胞外环境中。在外泌体样颗粒中包装和释放的ST6GAL1水平取决于我们小组中的乳腺癌细胞。gydF4y2Ba
癌症外泌体样颗粒可有效扩增外源性ST6GAL1,促进乳腺癌细胞体外增殖和侵袭性gydF4y2Ba
包裹在癌症外泌体内的ST6GAL1可在受体靶细胞表面唾液化并诱导信号通路[gydF4y2Ba23gydF4y2Ba].在这里,我们证明了细胞外ST6GAL1在受体细胞中以增强癌细胞增殖、生长和侵袭行为的形式引起明确的表型后果。gydF4y2Ba
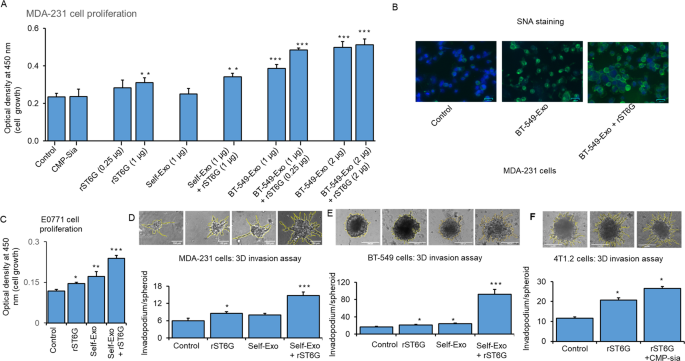
以ST6GAL1-low和细胞表面SNA-dim的人TNBC乳腺癌细胞MDA-231为靶点。在培养基中加入重组的ST6GAL1 (rST6G)而不是自体外泌体,可以促进MDA-231细胞的生长;单独加入ST6GAL1供体底物CMP-Sia对MDA-231的增殖没有任何影响。然而,来自不同培养的MDA-231的自我外泌体和额外的rST6G导致了MDA-231细胞的显著生长。此外,添加从BT-549条件培养基中回收的外泌体(原生st6gal1高水平细胞)可显著提高MDA-231细胞的生长,在BT-549外泌体和rST6G的存在下,MDA-231细胞的生长可进一步增强。当添加的BT-549外泌体增加一倍时,观察到最大的生长。在BT-549外泌体水平增加时,rST6G的额外存在并没有导致MDA-231的更大增长(图5)。gydF4y2Ba5gydF4y2Ba).这些观察结果促进了细胞外或外源性ST6GAL1影响TNBC癌细胞MDA-231生物学的想法。BT-549外泌体的存在也增加了MDA-231细胞表面SNA的反应性;当BT-549外泌体和rST6G同时存在时,SNA信号进一步升高(图5)。gydF4y2Ba5 bgydF4y2Ba),支持了细胞外ST6GAL1以BT-549外泌体包被ST6GAL1以及游离重组酶的形式作用于靶点MDA-231构建α2,6-唾液酸表位的观点。gydF4y2Ba
一个gydF4y2Ba人乳腺癌MDA-231细胞用对照培养基、25µM CMP-Sia、0.25-1µg/ml重组大鼠ST6GAL1蛋白(rST6G)、1 -2µg外泌体样颗粒(BT-549)或1µg自外泌体(MDA-231)处理,作为对照,这些外泌体来自单独培养的加或不加rST6G,在无血清培养基中处理48小时。用WST-8试剂检测细胞增殖。gydF4y2BaNgydF4y2Ba= 3,数据为均值±标准差。,方差分析,事后分析gydF4y2BatgydF4y2Ba以及,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BaBgydF4y2BaMDA-231细胞用对照培养基、1µg外泌体(BT-549)或外泌体颗粒(BT-549)与1µg rST6G混合在无血清培养基中处理20分钟。sna -凝集素染色(绿色),细胞核用DAPI染色(蓝色)。代表性的覆盖图像显示在50微米的尺度。gydF4y2BaCgydF4y2Ba小鼠乳腺癌E0771细胞在无血清培养基中培养,并按指示用对照培养基、1µg rST6G、1µg自外泌体或组合处理48小时。如前所述,测量细胞增殖。小鼠转移性乳腺癌4T1.2 (gydF4y2BaFgydF4y2Ba)、人类乳癌MDA-231 (gydF4y2BaDgydF4y2Ba)和BT-549细胞(gydF4y2BaEgydF4y2Ba)用于三维球体分析,并使用指定的处理,包括仅rST6G。代表性的10倍放大光学显微镜图像显示。直方图是癌细胞侵袭的量化,gydF4y2BangydF4y2Ba= 5;数据为平均值±标准差。,方差分析,事后分析gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba与对照组相比< 0.05。gydF4y2Ba
小鼠E0771细胞具有中等水平的ST6GAL1原生表达(图2)。gydF4y2Ba2gydF4y2Ba)接着被检查。在培养基中添加rST6G以及自外泌体(例如,从单独培养的E0771细胞中分离出的外泌体)后,E0771细胞的增殖水平升高。当E0771外泌体和rST6G同时存在于培养基中时,E0771增殖达到最大值(图2)。gydF4y2Ba5度gydF4y2Ba).rST6G与外泌体的协同作用(见图。gydF4y2Ba5 bgydF4y2BaSNA反应性与图。gydF4y2Ba5度gydF4y2Ba)强烈提示外泌体辅助因子的存在有助于细胞外ST6GAL1介导的靶细胞表面的α2,6-唾液化。gydF4y2Ba
小鼠4T1.2、人MDA-231和BT-549细胞在体外3D培养环境中形成不侵体,用于评估细胞外ST6GAL1如何影响侵袭性癌细胞的侵袭性。在4T1.2细胞中,当培养基中加入rST6G时,非复足型的形成增加了一倍;当CMP-Sia (ST6GAL1的供体底物)也被加入时,非复足体的形成进一步增强。gydF4y2Ba5 fgydF4y2Ba).这一观察结果支持了细胞外st6gal1介导的催化可以驱动体外侵袭性肿瘤行为的观点。人BT-549细胞的非异型体形成被添加自外泌体(从BT-549细胞的单独培养中分离)略微增强,但在外泌体和rST6G存在时,非异型体形成显著增强(图。gydF4y2Ba5 egydF4y2Ba).由于BT-549已经有显著的ST6GAL1原生表达,这一观察结果进一步证实了细胞外ST6GAL1在驱动BT-549生物学方面的能力,以及外泌体中假定存在的辅助因子以增强细胞外ST6GAL1的作用。具有低内源性ST6GAL1的MDA-231细胞进一步证实,自外泌体(从单独的MDA-231细胞培养基中分离出来)和额外的rST6(而不是单独的自外泌体)显著增强MDA-231细胞的3D侵袭性(图。gydF4y2Ba5 dgydF4y2Ba).gydF4y2Ba
细胞外ST6GAL1补偿细胞内固有的ST6GAL1的体外侵袭性gydF4y2Ba
(图。gydF4y2Ba3.gydF4y2Ba),我们发现shRNA敲除原生ST6GAL1表达显著降低了体外畸形形成。内源性ST6GAL1 shRNA敲低(shST6GAL1#1)的4T1.2细胞,与使用不相关RNA序列敲低的对照(shControl)相比,有显著减少的不侵畸形形成。gydF4y2Ba
这里是无花果。gydF4y2Ba6gydF4y2Ba我们提出的证据表明,在具有野生型原生ST6GAL1表达的shControl细胞中,当这些细胞与由平行shControl培养产生的外泌体孵育时,不畸形的形成可以进一步增强。这一观察结果表明,外泌体内容物在促进非膨大中起作用。相比之下,shST6GAL#1外泌体无法在shST6GAL#1球体中恢复非异型体,这意味着外泌体内的ST6GAL1货物是异型体形成的驱动因素。当将shControl或shST6GAL#1培养物暴露于各自的自我外泌体并进一步添加rST6G时,细胞外ST6GAL1在非外植体形成中的突出作用得到证实。在BT-549细胞中,我们观察到细胞外ST6GAL1对不畸形形成的依赖性。gydF4y2Ba6 bgydF4y2Ba).对于BT-549,我们使用两组不同的ST6GAL1敲低rna显示结果。与4T1.2中一样,BT-549外泌体来自野生型(shControl),而不是来自敲除培养,促进了非异型体的形成。重组体ST6GAL1的额外存在进一步推动了不侵畸形的形成。补充图gydF4y2BaS5gydF4y2Ba图A和图B显示,4T1.2细胞和BT-549的shRNA敲除导致ST6GAL1 mRNA和蛋白水平几乎完全降低。另外的乳腺癌细胞4T1和E0771也被检测,结果相似(补充图)。gydF4y2BaS4gydF4y2Ba).综上所述,这些观察结果表明细胞外ST6GAL1在促进侵袭性表型方面的作用,无论是作为外泌体内的包裹物还是作为自由可溶性酶。此外,最重要的是,细胞外ST6GAL1可以从远端来源释放;非细胞自主的ST6GAL1可以弥补ST6GAL1原生表达的缺失。gydF4y2Ba
一个gydF4y2Ba经shControl或小鼠shST6GAL1 #1构建物转染的4T1.2细胞在处理48小时后,通过3D球形细胞培养环境评估细胞的侵袭能力。癌细胞侵袭的代表性图像和定量显示(gydF4y2Ba一个gydF4y2Ba分别为上、下面板)。比例尺250µm,gydF4y2BaNgydF4y2Ba= 5个球体,数据为平均值±标准差。,方差分析,事后分析gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba与各自对照组相比< 0.001。gydF4y2BaBgydF4y2Ba用shControl、人shST6GAL1 #1或shST6GAL1 #2转染的BT-549细胞,分别用对照培养基、自体外泌体颗粒、rST6G或自体外泌体、rST6G组合处理,并进行3D侵袭实验。比例尺250µm (gydF4y2BaBgydF4y2Ba(上图)显示了具有代表性的相位对比显微镜图像。入侵数量的量化(gydF4y2BaBgydF4y2Ba,下面板),gydF4y2BangydF4y2Ba= 5,数据为±s。e,方差分析,事后检验,gydF4y2BapgydF4y2Ba< 0.0001相对于各自的对照。分别培养4T1.2和BT-549细胞,通过qPCR和Western blotting验证ST6GAL1的敲除效率。gydF4y2BaS5gydF4y2Ba面板A,面板B。gydF4y2Ba
细胞外ST6GAL1促进间充质和茎性标记物的表达增强gydF4y2Ba
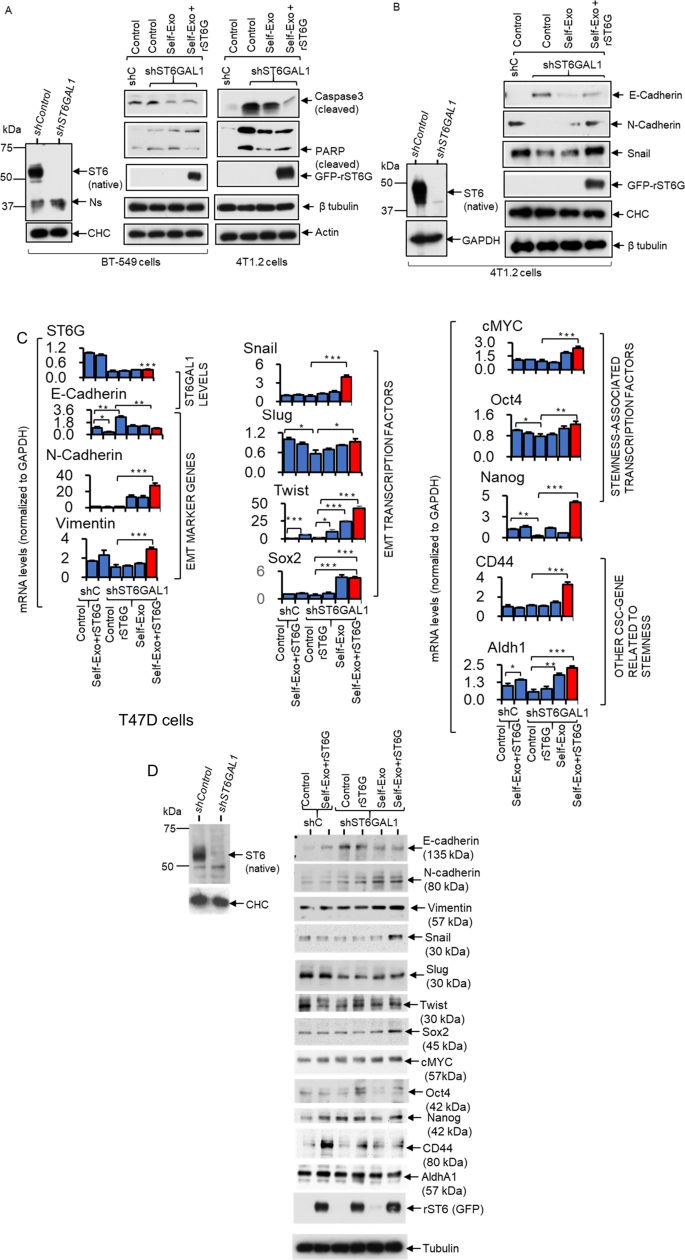
在这里,我们研究了ST6GAL1在乳腺肿瘤细胞上的分子贡献,特别是细胞外间隙中的ST6GAL1。将shST6GAL1敲除的BT-549和4T1.2细胞与各自的shControl进行比较,结果显示血清耗损时caspase 3和PARP激活增加(图2)。gydF4y2Ba7一个gydF4y2Ba),这与ST6GAL1功能不全促进细胞凋亡的观点一致。此外,自我外泌体(带有ST6GAL1货物减少的shST6GAL1外泌体)和额外的rST6G通过显著抑制BT-549和4T1.2中裂解的Caspase 3和PARP表达来补偿内源性ST6GAL1表达的减少,支持细胞外ST6GAL1可以补偿细胞内源性STGAL1并对细胞死亡提供保护的观点(图5)。gydF4y2Ba7一个gydF4y2Ba).细胞外ST6GAL1也补充细胞内的ST6GAL1,驱动间充质和茎性标记物的表达。敲低ST6GAL1的4T1.2细胞E-cadherin(上皮标记物)升高,N-cadherin(间充质标记物)减少,Snail(间充质相关转录因子)和其他间充质干性相关标记物降低(图。gydF4y2Ba7 bgydF4y2Ba和补充图。gydF4y2BaS6gydF4y2Ba).在ST6GAL1下调的T47D细胞中,我们观察到E-cadherin(一种上皮标记物)在mRNA和蛋白水平上的升高(图。gydF4y2Ba7 c, DgydF4y2Ba).自我外泌体和rST6G的加入显著抑制了E-cadherin的表达,N-cadherin的升高,伴随EMT转录因子Slug和Twist的表达升高,以及stem相关的cMYC、Oct4和Nanog。其他与茎干性相关的CSC基因CD44和Aldh1也升高(图。gydF4y2Ba7 c, DgydF4y2Ba和补充图。gydF4y2BaS6gydF4y2Ba).总之,我们的观察结果支持ST6GAL1在促进间充质状态维持方面的作用,ST6GAL1不足促进间充质向上皮性质的转换并降低细胞死亡率。最重要的是,我们的数据显示,细胞外ST6GAL1,不一定是细胞自主起源,可以补充细胞内禀酶,维持间充质表型和存活。gydF4y2Ba
一个gydF4y2Ba经验证的shST6GAL1或对照shRNA转染的BT-549和4T1.2细胞,分别用各自的自外泌体颗粒或与rST6G联合在无血清培养基中处理48小时。gydF4y2BaBgydF4y2Ba分别培养shControl和shST6GAL1 4T1.2细胞。验证的敲除细胞用自外泌体或与rST6G联合处理,如上所示。用细胞提取物与所示抗体进行Western blot分析。用CHC、Tubulin、Actin或GAPDH进行等负荷转移。Western blot检测BT-549和4T1.2细胞中ST6GAL1的表达gydF4y2Ba一个gydF4y2Ba而且gydF4y2BaBgydF4y2Ba,分别。Ns在gydF4y2Ba一个gydF4y2Ba(左图)突出显示一个单一的非特定波段。实验至少重复了三次;展示了具有代表性的印迹。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba用验证过的shST6GAL1或对照shRNA转染的人乳腺癌T47D细胞,用rST6G或与自身外泌体颗粒(shControl外泌体对shControl细胞,shST6GAL1外泌体对shST6GAL1细胞)联合在无血清培养基中处理48小时。采用SYBR-Green qPCR方法对细胞培养物进行标记引物分析。基因水平用GAPH归一化,用delta-delta-Ct法计算。数据为均值±标准差,gydF4y2BangydF4y2Ba= 3,方差分析,事后检验,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01和***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BaDgydF4y2Ba使用单独培养的T47D细胞与指定抗体(包括ST6GAL1)进行Western blot分析,以验证shST6GAL1相对于shControl的敲除效率。微管蛋白或CHC用于等载和转移。实验重复至少三次,并显示有代表性的印迹。gydF4y2Ba
讨论gydF4y2Ba
唾液酰转移酶ST6GAL1修饰聚糖和糖蛋白不仅在癌症进展中很重要[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba50gydF4y2Ba]还能维持癌症干细胞的表型[gydF4y2Ba51gydF4y2Ba].一般来说,ST6GAL1升高和α2,6-唾液酰化失调与恶性肿瘤的增加显著相关,特别是在肺癌、结直肠癌、胰腺癌和乳腺癌中[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].通常,ST6GAL1存在于细胞内的er -高尔基分泌复合体中,细胞自主地唾液化新生细胞表面和分泌成分。然而,很少有人注意到细胞外环境中具有催化活性的ST6GAL1的广泛储存库,但已发表的报告表明,细胞外ST6GAL1是血细胞发育和功能的重要系统调节因子[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].gydF4y2Ba
从我们的观察中可以得出一些重要的结论。首先,这些数据表明了癌细胞ST6GAL1在几种重要的癌细胞表型中的重要性,包括细胞增殖和不侵畸形的形成。总的来说,这与st6gal1介导的α2,6-唾液酸连接聚糖/糖蛋白在肿瘤进展和转移中的已知重要性完全一致[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].gydF4y2Ba
其次,大量小鼠和人类乳腺癌细胞系具有高度异质性的ST6GAL1表达。虽然我们观察到这种异质性与临床乳腺癌一致,但这种异质性如何导致整体恶性肿瘤和癌症进展尚不清楚。乳腺癌是一种异质性疾病[gydF4y2Ba55gydF4y2Ba].TNBC是最具侵略性和转移性的乳腺癌亚型,治疗方案有限。侵袭性转移性疾病导致超过90%的乳腺癌患者死亡[gydF4y2Ba56gydF4y2Ba].因此,了解唾液酰化在侵袭性、侵袭性乳腺癌中的作用具有临床意义。虽然在TCGA乳腺癌队列中,ST6GAL1转录本水平在乳腺肿瘤中低于正常邻近组织,但在癌症患者中,与ER+患者相比,三阴性临床病例中ST6GAL1转录本水平显著升高(图2)。gydF4y2Ba1 a, BgydF4y2Ba、补充图。gydF4y2BaS1AgydF4y2Ba).通过分析TCGA乳腺癌数据,我们发现ST6GAL1转录本与患者乳腺癌的侵袭期无关;然而,它们与更高级别的癌症患者有关(图。gydF4y2Ba1 cgydF4y2Ba和补充图。gydF4y2Ba印地CgydF4y2Ba).与ST6GAL1的促癌作用一致,最近的数据显示,ST6GAL1在转移性胰腺癌细胞模型中上调,并显示与干性、EMT和缺氧途径相关的基因网络富集[gydF4y2Ba9gydF4y2Ba].使用METABRIC和TCGA乳腺癌队列进行的基因富集数据分析表明,较高水平的肿瘤ST6GAL1转录本与包括Hedgehog、EMT和缺氧在内的癌症途径基因集的转移进展有关(图2)。gydF4y2Ba1 f-hgydF4y2Ba和补充图。gydF4y2BaS1D-FgydF4y2Ba).与ST6GAL1对乳腺癌至关重要的观点一致,我们发现在3D细胞培养环境中,用靶向ST6GAL1不同位点的shRNA敲除ST6GAL1显著降低了侵袭性乳腺癌细胞增殖和侵袭性特性(图2)。gydF4y2Ba3.gydF4y2Ba).我们还观察到在TCGA乳腺癌队列中,肿瘤ST6GAL1转录本与乳腺癌患者较高的肿瘤内异质性评分显著相关。gydF4y2Ba1 dgydF4y2Ba).关于肿瘤特异性亚克隆驱动基因突变和拷贝数改变,对肿瘤内异质性了解甚少,被认为与侵袭性癌症有关[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba].ST6GAL1可能只是在侵袭性乳腺癌中提供了另一层异质性。gydF4y2Ba
一般来说,肿瘤细胞中ST6GAL1 mRNA与蛋白之间存在相关性;然而,有一个例外[gydF4y2Ba18gydF4y2Ba].st6gal1基因在肿瘤细胞中的转录调控是复杂的,我们已经注意到,与小鼠乳腺癌细胞相比,人类乳腺肿瘤细胞的st6gal1 mRNA水平较低。在一些实验中,我们也注意到乳腺癌细胞内ST6GAL1蛋白的水平并不总是与mRNA水平相对应。由于大多数ST6GAL1是持续分泌的,mRNA的减少可能主要影响释放的ST6GAL1,而不是保留的酶。事实上,这就是我们在一些shrna介导的st6gal1敲除乳腺癌细胞实验中观察到的。然而,我们认为对释放的ST6GAL1和保留的ST6GAL1之间的动力学关系的研究超出了本文的范围,也没有在这里进行。gydF4y2Ba
第三,乳腺癌细胞释放生物活性外泌体和外显子样颗粒,但来自不同乳腺癌系的颗粒含有大量的ST6GAL1。这与先前的发现相一致,即释放的外泌体颗粒富含α2,6-唾液化糖蛋白[gydF4y2Ba59gydF4y2Ba]和ST6GAL1 [gydF4y2Ba23gydF4y2Ba].早期对结肠癌细胞模型的研究表明,肿瘤细胞释放的外泌体中功能可变的ST6GAL1与源细胞有关[gydF4y2Ba23gydF4y2Ba].本研究还表明,内源性ST6GAL1蛋白释放的外泌体水平较高的肿瘤细胞可以将ST6GAL1转移到低表达的ST6GAL1肿瘤细胞中,增强受体细胞中ST6GAL1介导的细胞信号通路。我们的早期工作表明,肝脏主要释放可溶性ST6GAL1,在循环中发现。在这里,我们的数据表明,某些癌细胞具有显著提高局部细胞外ST6GAL1水平的能力。以重组蛋白(rST6GAL1)的形式与肿瘤细胞释放的外泌体结合,能够影响靶肿瘤细胞并补偿内源性ST6GAL1的功能。第四,外泌体ST6GAL1货物可以弥补细胞原生ST6GAL1表达的不足,从而恢复增殖和不畸形的形成。在TNBC临床标本中,我们观察到ST6GAL1呈异质性表达(图2)。gydF4y2Ba1 egydF4y2Ba),这可能与α2,6-唾液酸连接凝集素的异质性表达有关[gydF4y2Ba11gydF4y2Ba].驱动这种α2,6-唾液酸化异质性的生物学尚不清楚,它如何影响癌症的整体病理生物学也完全未知。这种异质性可能强调了目前的困惑,即为什么ST6GAL1表达被观察到是有益的,但有时对患者的结果有害。使用KM绘图仪进行网络数据分析[gydF4y2Ba60gydF4y2Ba],我们的结果表明肿瘤ST6GAL1 mRNA与TNBC患者良好的无病生存相关(图。gydF4y2Ba1我gydF4y2Ba),提示st6gal1介导的癌症进展的复杂机制,值得进一步涉及肿瘤微环境(TME)的研究。细胞外ST6GAL1弥补细胞原生ST6GAL1表达缺陷的能力可能为理解这种唾液酰转移酶在癌症中的作用提供了一个新的视角。gydF4y2Ba
第五,也是最出乎意料的是,尽管缺乏ST6GAL1货物的癌症外泌体不能促进肿瘤细胞存活、细胞增殖和不变性的形成,但添加可溶性重组ST6GAL1后,这些特性得以恢复(图6)。gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2BaS4gydF4y2Ba).值得注意的是,添加外源的ST6GAL1可以诱导乳腺癌细胞的间充质和CSC表型(图。gydF4y2Ba7gydF4y2Ba和补充图。gydF4y2BaS6gydF4y2Ba).这一观察强烈暗示外泌体中存在促进细胞外ST6GAL1作用的辅因子。虽然这一辅助因子的身份及其作用机制仍有待正式阐明,但早期的一份报告表明,活化的血小板释放囊泡样颗粒,提供细胞外唾液酸转移酶催化所需的唾液酸供体底物[gydF4y2Ba35gydF4y2Ba].gydF4y2Ba
综上所述,我们的数据进一步支持ST6GAL1在乳腺癌进展中的作用。乳腺癌是一种具有多种亚型的异质性疾病。我们使用多个TNBC和ER+细胞系来证实细胞外ST6GAL-1介导的新型信号通路对肿瘤细胞的生存、增殖、侵袭和EMT进展非常重要。正常情况下,ST6GAL1存在于细胞内的er -高尔基体分泌复合体中,其中唾液酰转移酶细胞自主地糖基化新生糖蛋白在生物合成转运。然而,我们的数据表明乳腺癌中存在ST6GAL1功能的细胞外机制通路。目前,尚不清楚内在机制和外在机制是否是多余的途径,或者这些机制是否解决了其他机制无法满足的排他性需求。此外,从机制上还不清楚是外部ST6GAL1需要被靶细胞内化,还是外部ST6GAL1直接作用于靶细胞表面。最近的一项研究巧妙地证明,肿瘤细胞在外泌体囊泡或外泌体小颗粒中分泌ST6GAL1,并能够在结肠癌细胞模型中作为功能性ST6GAL1转移到受体细胞[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
另一方面,其他报道高度提示细胞外ST6GAL1直接唾液酸化靶细胞表面[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].无论细胞外ST6GAL1作用的机制是什么,至少一些生物学功能,即促进细胞增殖和侵袭性,可以通过细胞外ST6GAL1来恢复,而不是充分的细胞原生ST6GAL1表达。虽然我们的数据表明ST6GAL1在驱动侵略性癌细胞行为中的作用,但我们的数据也表明,单个癌细胞细胞自主表达ST6GAL1的内在能力可能不是绝对必要的。最后,还有一种有趣的可能性,即原生表达的癌细胞ST6GAL1需要首先排泄到细胞外空间。gydF4y2Ba
数据可用性gydF4y2Ba
本研究分析了公共数据集。gydF4y2Ba
参考文献gydF4y2Ba
李志强,李志强。糖基化在癌症中的作用机制。癌症杂志。2015;15:540-55。gydF4y2Ba
王志强,王志强,王志强,等。异常糖基化在肿瘤转移中的作用机制。《癌症杂志》2017;31:33 - 35。gydF4y2Ba
王丽娟,王丽娟,王丽娟。ST6GAL1涎基转移酶在肿瘤细胞中表达的调控。糖生物学。2021;31:530-9。gydF4y2Ba
Swindall AF, Londono-Joshi AI, Schultz MJ, Fineberg N, Buchsbaum DJ, Bellis SL. ST6Gal-I蛋白表达在人类上皮性肿瘤中上调,并与正常组织和结肠癌细胞系中的干细胞标志物相关。癌症决议2013;73:2368-78。gydF4y2Ba
谢昌昌,薛玉明,廖文文,陈太生,王瑟,卢普平,等。β -半乳糖苷α 2,6-唾液酰转移酶1的升高以果糖反应的方式促进胰腺癌转移。Oncotarget。2017;8:7691 - 709。gydF4y2Ba
Wichert B, Milde-Langosch K, Galatenko V, Schmalfeldt B, Oliveira-Ferrer L.唾液酰转移酶ST6GAL1在卵巢癌中的预后作用。糖生物学。2018;28:898 - 903。gydF4y2Ba
饶tc, Beggs RR, Ankenbauer KE, Hwang J, Ma VP, Salaita K,等。st6gal - i介导的表皮生长因子受体的唾液化调节细胞机制和增强侵袭。《生物化学杂志》2022;298:101726。gydF4y2Ba
Garnham R, Scott E, Livermore KE, Munkley J. ST6GAL1:癌症的关键参与者。Oncol Lett 2019; 18:983-9。gydF4y2Ba
british CM, Bhalerao N, Silva AD, Chakraborty A, Buchsbaum DJ, Crowley MR,等。糖基转移酶ST6Gal-I促进胰腺癌细胞上皮细胞向间充质细胞转变。生物化学学报。2021;29:100034。gydF4y2Ba
Smithson M, Irwin R, Williams G, Alexander KL, Smythies LE, nearly M,等。涎烯基转移酶ST6GAL-1介导直肠癌化疗耐药。中国生物化学杂志,2022;gydF4y2Ba
Pally D, Pramanik D, Hussain S, Verma S, Srinivas A, Kumar RV,等。2,6连接唾液酸的异质性增强了乳腺癌上皮细胞的侵袭。美国癌症杂志。2021;7:110-25。gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。ST6GAL1基因在人膀胱癌中的表达。BMC Cancer. 2014;14:901。gydF4y2Ba
Kroes RA, He H, Emmett MR, Nilsson CL, Leach FE 3rd, Amster IJ,等。过表达ST6GalNAcV,一种神经节苷特异性的α 2,6-唾液酰转移酶,抑制体内胶质瘤的生长。美国国家科学研究院。2010; 107:12646-51。gydF4y2Ba
卢德F, Tiede S, Christofori G.乳腺癌作为恶性进展中肿瘤异质性和肿瘤细胞可塑性的一个例子。中华肿瘤学杂志,2010;gydF4y2Ba
Saldova R, Reuben JM, Abd Hamid UM, Rudd PM, Cristofanilli M.特异性血清n -聚糖水平可识别循环肿瘤细胞计数较高的乳腺癌患者。安·昂科尔,2011;22:1113-9。gydF4y2Ba
艾恩斯EE,刘jty。系统性ST6Gal-1是小鼠移行B细胞的促生存因子。前沿免疫。2018;9:2150。gydF4y2Ba
ironons EE, Punch PR, Lau JTY。血源性ST6GAL1调节B细胞中免疫球蛋白的产生。前沿免疫。2020;11:617。gydF4y2Ba
艾氏EE, Lee-Sundlov MM,朱y, Neelamegham S, Hoffmeister KM,刘jt。B细胞通过细胞外糖基化依赖机制抑制髓质颗粒生成。Elife。2019;8:e47328。gydF4y2Ba
Dougher CWL, Buffone A Jr, Nemeth MJ, Nasirikenari M, iron EE, Bogner PN,等。血源性唾液酰转移酶ST6Gal-1是颗粒生成的负性全身调节因子。中华生物医学杂志,2017;gydF4y2Ba
Nasirikenari M, Veillon L, Collins CC, Azadi P, Lau JTY。非自体ST6Gal-1唾液酰转移酶对骨髓造血干和祖细胞的重塑。中国生物医学工程学报。2014;29(2):529 - 529。gydF4y2Ba
Nasirikenari M, Segal BH, Ostberg JR, Urbasic A, Lau JT。唾液酰转移酶ST6Gal i靶向缺陷小鼠的颗粒生成特征改变和急性中性粒细胞炎症加重。gydF4y2Ba
Nasirikenari M, Chandrasekaran EV, Matta KL, Segal BH, Bogner PN, Lugade AA,等。ST6Gal-1缺陷小鼠嗜酸性粒细胞谱的改变:P1启动子产生的ST6Gal-1在调节过敏性炎症中的额外作用。中华生物医学杂志,2010;87:457-66。gydF4y2Ba
张强,李伟,杨玉萍,等。外显子中功能物的转移。Cell rep 2019; 27:940-54.e6。gydF4y2Ba
Nasirikenari M, Lugade AA, Neelamegham S, Gao Z, Moremen KW, Bogner PN,等。重组唾液酰转移酶输注减轻感染驱动的急性肺部炎症。前沿免疫。2019;10:48。gydF4y2Ba
Hait NC, Allegood J, Maceyka M, Strub GM, Harikumar KB, Singh SK,等。鞘氨脂-1-磷酸对细胞核组蛋白乙酰化的调控。科学。2009;325:1254-7。gydF4y2Ba
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25:402-8。gydF4y2Ba
Gavrilin MA, Bouakl IJ, Knatz NL, Duncan MD, Hall MW, Gunn JS,等。弗朗西斯菌诱导人单核细胞il -1 β加工和释放所需的内化和吞噬体逃逸。美国国家科学研究院。2006; 103:141-6。gydF4y2Ba
罗博,王志强,王志强,王志强,等。优化细胞培养上清液和人血浆外泌体分离方案。中国生物医学工程学报。2015;gydF4y2Ba
杨艳,Kannisto E, Yu G, Reid ME, Patnaik SK,吴艳。一种免疫生物芯片选择性捕获肿瘤源性外泌体并检测外泌体rna用于癌症诊断。计算机应用技术。2018;10:4375 - 86。gydF4y2Ba
Sarkar S, Maceyka M, Hait NC, Paugh SW, Sankala H, Milstien S,等。鞘氨醇激酶1是MCF-7人乳腺癌细胞迁移、增殖和存活所必需的。FEBS Lett. 2005; 579:5313-7。gydF4y2Ba
卢卡R,阿芙娜M,扎法F,韦奇M,比安奇F,拉法塔G,等。脆性X蛋白结合参与癌症进展和调节转移形成的mrna。EMBO Mol medical . 2013; 5:1523-36。gydF4y2Ba
Berens EB, Holy JM, Riegel AT, Wellstein A.在3D环境下评估癌细胞侵袭的球形试验。中国生物医学工程学报,2015;gydF4y2Ba
徐平,徐平,陈琪,川口T,冈野M,等。鞘氨脂-1-磷酸对核内缺氧诱导因子功能的调节。Faseb j . 2020; 34:4293-310。gydF4y2Ba
麦提A,齐Q,彭X,闫玲,高部K,海特NC。I类组蛋白脱乙酰酶抑制剂通过增强侵袭性人TNBC细胞中肿瘤抑制因子和抗血管生成基因的表达来抑制血管生成拟态。国际肿瘤学杂志。2019;55:16 - 30。gydF4y2Ba
Manhardt CT, Punch PR, Dougher CWL, Lau JTY。在体内,外源性唾液化是由系统触发因素动态调节的。中国生物医学工程学报,2017;gydF4y2Ba
张志刚,张志刚,张志刚,等。斐济:生物图像分析的开源平台。自然科学进展。2012;9:676-82。gydF4y2Ba
潘素波,郭泽克,刘伟林,张志强,等。一种来自口腔病原菌单宁的唾液酸- o -乙酰酯酶(NanS)的特性,该酶通过其同源唾液酸酶NanH增强唾液酸的释放。生物化学学报,2015;gydF4y2Ba
高娟,王志强,王志强,王志强,等。使用cBioPortal对复杂癌症基因组学和临床资料进行综合分析。科学通报。2013;6:pl1。gydF4y2Ba
Curtis C, Shah SP, Chin SF, Turashvili G, Rueda OM, Dunning MJ,等。2000个乳腺肿瘤的基因组和转录组结构揭示了新的亚群。大自然。2012;486:346-52。gydF4y2Ba
罗科JW。突变等位基因肿瘤异质性(MATH)与头颈部鳞状细胞癌。头颈病理性。2015;9:1-5。gydF4y2Ba
Subramanian A, Tamayo P, Mootha VK, Mukherjee S, Ebert BL, Gillette MA,等。基因集富集分析:解释全基因组表达谱的一种基于知识的方法。美国国家科学研究院。2005; 102:15545-50。gydF4y2Ba
Duarte HO, Rodrigues JG, Gomes C, Hensbergen PJ, Ederveen ALH, de Ru AH,等。ST6Gal1以位点特异性的方式靶向ErbB2外畴,并调节胃癌细胞对曲妥珠单抗的敏感性。致癌基因。2021;40:3719 - 733。gydF4y2Ba
癌症侵袭与微环境:可塑性和相互作用。细胞。2011;147:992 - 1009。gydF4y2Ba
Escrevente C, Grammel N, Kandzia S, Zeiser J, Tranfield EM, Conradt HS,等。卵巢癌细胞分泌外泌体中的唾液糖蛋白和n -聚糖。PLoS ONE。2013; 8: e78631。gydF4y2Ba
张志强,张志强,张志强,等。半乳糖凝集素-5结合在大鼠网织细胞外泌体表面,并调节巨噬细胞对囊泡的摄取。血。2010;115:696 - 705。gydF4y2Ba
Paolini L, Orizio F, Busatto S, Radeghieri A, Bresciani R, Bergese P,等。HeLa细胞分泌的外泌体在其表面穿梭于质膜相关的唾液酸酶NEU3。生物化学。2017;56:6401-8。gydF4y2Ba
李志强,李志强,李志强,等。卵巢癌细胞对外泌体的吸收作用。BMC癌症,2011;11:108。gydF4y2Ba
罗特瓦尔J, Hill AF, Hochberg F, Buzas EI, Di Vizio D, Gardiner C,等。细胞外囊泡及其功能定义的最低实验要求:国际细胞外囊泡学会的立场声明。中国生物医学工程学报。2014;gydF4y2Ba
李志刚,李志刚,李志刚。细胞外囊泡功能多样性的研究进展。中国生物医学工程学报(自然科学版)2018;gydF4y2Ba
Costa AF, Campos D, Reis CA, Gomes C.靶向糖基化:癌症药物发现的新途径。癌症,2020;6:757-66。gydF4y2Ba
Schultz MJ, Holdbrooks AT, Chakraborty A, Grizzle WE, Landen CN, Buchsbaum DJ,等。肿瘤相关糖基转移酶ST6Gal-I调节干细胞转录因子并赋予癌症干细胞表型。癌症决议2016;76:3978-88。gydF4y2Ba
Dall 'Olio F, Malagolini N, Trinchera M, Chiricolo M.唾液信号:唾液酰转移酶作为癌症进展的自我燃料循环的引擎。生物化学学报(英文版);2014;gydF4y2Ba
癌症中的高唾液酸化:炎症调节和治疗机会。癌症。2018;10:207-25。gydF4y2Ba
谢涛,徐春春,蔡文峰,龙春春,吴超,吴东东,等。HDAC抑制剂靶向HDAC5,上调microRNA-125a-5p,诱导乳腺癌细胞凋亡。Mol Ther: J Am Soc Gene Ther. 2015; 23:656-66。gydF4y2Ba
金霞,穆平。靶向乳腺癌转移。乳腺癌。2015;9:23-34。gydF4y2Ba
安德斯C,凯里洛杉矶。认识和治疗三阴性乳腺癌。肿瘤学gydF4y2Ba.gydF4y2Ba2008年,22:1233-9;讨论1239 - 40,1243。gydF4y2Ba
王志强,王志强,王志强,等。癌症的免疫图景。免疫力。2019;51:411-2。gydF4y2Ba
邓卓龙,李志强,李志强,李志强,等。描述了2658个人类癌症基因组的肿瘤内遗传异质性。Cell. 2021; 184:2239-54 e39。gydF4y2Ba
张华,Freitas D, Kim HS, Fabijanic K,李忠,陈华,等。通过不对称流场-流分馏鉴定不同的纳米颗粒和细胞外囊泡子集。细胞生物学杂志,2018;20:332-43。gydF4y2Ba
Nagy A, Lanczky A, Menyhart O, Gyorffy B.利用独立数据集的表达数据验证miRNA在肝细胞癌中的预后能力。科学通报2018;8:9227。gydF4y2Ba
Martins AM, Ramos CC, Freitas D, Reis CA.肿瘤细胞外囊泡的糖基化:捕获策略,功能作用和潜在的临床应用。细胞。2021;10:109-33。gydF4y2Ba
潘客PR,艾恩斯EE,曼哈特CT,马拉斯H,刘jty。唾液酰转移酶ST6GAL1可防止辐射诱导的胃肠道损伤。糖生物学。2020;30:446-53。gydF4y2Ba
Lee-Sundlov MM, Ashline DJ, Hanneman AJ, Grozovsky R, Reinhold VN, Hoffmeister KM,等。循环血液和血小板提供糖基转移酶,使细胞外糖基化。糖生物学。2017;27:188 - 98。gydF4y2Ba
癌症基因组图谱N.人类乳腺肿瘤的综合分子图谱。大自然。2012;490:61 - 70。gydF4y2Ba
Lee MM, Nasirikenari M, Manhardt CT, Ashline DJ, Hanneman AJ, Reinhold VN,等。血小板通过提供糖供体底物来支持细胞外唾液化。生物化学学报。2014;289:8742-8。gydF4y2Ba
确认gydF4y2Ba
这项工作得到了拨款R01AI140736和P01HL51333给JL和罗斯威尔公园健康研究公司(HRI)启动基金#714084-01给NCH的支持。我们感谢美国国立卫生研究院(NIH)国家癌症研究所(NCI)对YW的资助,资助编号为R21CA235305。内容完全是作者的责任,并不代表NIH的官方观点。我们感谢国家科学基金会在CBET-1337860资助纳米粒子跟踪分析系统(NanoSight, LM10, Malvern Instruments Ltd)的支持。我们要感谢美国国家癌症研究所(NCI) R01 CA207504(致JZ)。我们也感谢NIH拨款R34 GM134794和R01 GM130915对KWM生产ST6GAL1酶的支持。罗斯威尔公园综合癌症中心的核心设施在这项工作中得到了美国国立卫生研究院国家癌症研究所癌症中心支持基金CA076056的部分支持。我们感谢美国纽约州布法罗布法罗大学雅各布斯医学院首席电子显微镜师Donald MacFarland先生的TEM分析。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
研究概念和设计:NCH和JTYL。数据采集:NCH, AM, RW, VLA, CCH。数据分析与解释:NCH, AM, JTYL, YW, KT, MER, WB, JZ。生物信息学:RW。材料支持:直流、金杜。研究指导:NCH和JTYL。稿件撰写:NCH、JTYL。稿件编辑:所有作者。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
海特,北卡罗来纳州,麦提,A,吴,R。gydF4y2Baet al。gydF4y2Ba细胞外唾液酰转移酶st6gal1在乳腺肿瘤细胞生长和侵袭中的作用。gydF4y2Ba癌症基因ThergydF4y2Ba29gydF4y2Ba, 1662-1675(2022)。https://doi.org/10.1038/s41417-022-00485-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41417-022-00485-ygydF4y2Ba
这篇文章被引用gydF4y2Ba
基于糖基转移酶基因的标记为卵巢癌的预后和免疫治疗反应性预测提供了一个有前途的工具gydF4y2Ba
卵巢研究杂志gydF4y2Ba(2023)gydF4y2Ba
前列腺癌中GALNT7的上调修饰o -糖基化并促进肿瘤生长gydF4y2Ba
致癌基因gydF4y2Ba(2023)gydF4y2Ba