摘要
细胞-细胞黏附的下调和活力的增强是癌细胞转移的前提条件。我们最近的研究表明,由于Arf6和Rac1的激活增强,结直肠癌细胞中紧密连接适配器蛋白Pals1的下调导致细胞迁移、侵袭和转移的增加。我们现在发现,Arf6- gap SMAP1和Pals1在调节Arf6活性和依赖rac1的细胞迁移方面存在冗余。编码SMAP1的基因在微卫星不稳定结直肠癌标本和细胞系中经常被破坏。在表达SMAP1的细胞中,缺失Pals1会导致紧密连接的紊乱形成,但对Arf6活性和细胞迁移没有影响。相反,SMAP1和Pals1的失活导致Arf6/Rac1活性增强,细胞迁移和侵袭增加。此外,通过分析患者队列,我们发现当两种基因都下调时,患者的生存率显著降低,而当两种基因中只有一种表达受到影响时,则相反。综上所述,我们发现SMAP1和Pals1在调节Arf6/Rac1激活方面存在冗余,从而控制结直肠癌细胞的迁移、侵袭和转移。
简介
尽管最近在预防、早期诊断和治疗方面取得了进展,但结直肠癌仍然是最常见的癌症类型之一,也是肿瘤相关死亡的主要原因。威胁生命的结直肠癌进展的一个关键标志是上皮细胞的重编程和去分化,反映在细胞-细胞和细胞-基质粘附接触的下调。这一过程最终导致上皮细胞向间充质转化(EMT),或至少是间充质特征的短暂获得,以及实体肿瘤单细胞的解体及其随后的扩散。随着细胞-细胞黏附接触的下调,顶端-基底极性丧失,因此几种极性调节因子已被确定为肿瘤抑制因子[1].
在上皮细胞中,根尖-基底极性是由两个根尖复合物(PAR/aPKC-和屑状复合物)和它们的基底外侧复合物(盘状大/致死(2)巨幼虫/Scribble模块和激酶Par1和LKB1)之间的严格调节平衡建立和维持的。2].在碎屑(Crb)复合物中,连接蛋白Pals1(与Lin-7 One相关的蛋白)稳定跨膜蛋白Crb(大多数经典上皮中的Crb3),并将其连接到肌凝蛋白调节因子PATJ(与Pals1相关的TJ蛋白)[3.,4,5,6].Crb复合物的缺失会导致培养细胞中紧密连接(TJ)的紊乱或延迟形成[7,8,9,10,11,12]和crb3敲除小鼠在肠和其他上皮组织中显示微绒毛缺陷和顶端膜测定干扰[13,14].
Crb3在过表达能够诱导EMT的转录因子Snail或ZEB1的细胞中下调[15,16,17].相反,敲低Crb3可增强tgf β刺激下蜗牛的表达[18].在小鼠肿瘤模型中,Crb3在p53和Rb缺失时下调,导致EMT增强[7].因此,Crb3似乎是预防EMT的主要看门人。Crb和Pals1除了在细胞极性和细胞-细胞粘附中的作用外,还被发现是Hippo通路的上游调节因子,从而控制细胞增殖、器官大小和干细胞的维持果蝇哺乳动物[18,19,20.,21,22,23,24,25].
肿瘤细胞的迁移和侵袭是由前缘的片状足和丝状足的形成所驱动的,它们是由肌动蛋白细胞骨架的动态重排所形成和破坏的。这一过程中的关键因素之一是小的GTPase Rac1,它通过激活WAVE复合物来增加肌动蛋白丝的伸长和分支,从而增强Arp2/3复合物的活性[26].Rac1本身被各种鸟嘌呤交换因子(gef)激活,包括Tiam1,它将Rac1连接到顶端极性调节因子PAR3 [27].Rac1激活的增加导致细胞迁移和侵袭的增强。因此,Rac1或其gef在包括结直肠癌在内的几种癌症中上调或突变,与患者预后不良相关[28].
除了通过gef和gap (GTPase激活蛋白)调控外,Rac1还可以被另一种小型GTPase ADP-ribosylation factor 6 (Arf6)间接激活[29,30.,31,32,33,34].Arf6参与多种细胞过程,包括囊泡运输、内吞作用和肌动蛋白细胞骨架的调节[35].除了Rac1的激活,Arf6还促进Rac1从核内体循环到质膜[36,37].α4-整合素/Paxillin复合物中Rac1活性的降低抑制了稳定的薄片足的形成,α4-整合素/Paxillin复合物招募Arf GAPs中的git1家族来抑制Arf6活性[38].Arf6也被描述为招募和激活Arf1到质膜沙门氏菌感染,导致增强的波依赖性肌动蛋白聚合和板足底形成[39].Arf6在几种癌症中经常过表达,包括侵袭性乳腺癌、黑色素瘤和胰腺癌,而Arf6的活性正驱使这些肿瘤细胞变得更具侵袭性[34,40,41,42,43,44,45].
在之前的研究中[46],我们发现Pals1在结直肠癌细胞中结合并抑制Arf6。Pals1缺失导致Arf6激活增强,Arf6激活Rac1,导致细胞迁移、侵袭和转移增加。然而,我们现在发现,在其他结直肠癌细胞系中删除Pals1并没有导致增强Arf6/ rac1依赖的细胞迁移。通过研究这些结果之间的差异,我们发现Pals1与Arf6- gap SMAP1冗余作用,以控制Arf6的激活。SMAP1在微卫星不稳定结直肠癌标本和细胞系中经常缺失[47].smap1缺陷细胞中Pals1的缺失或这两种基因的失活使Arf6失去抑制,导致依赖rac1的细胞迁移和侵袭增加。
材料与方法
细胞培养
HCT116/HCT116ΔPals1在DMEM高葡萄糖(4.5 g/L, Sigma-Aldrich)中培养,Caco-2/Caco-2ΔPals1和RKO/RKOΔPals1在DMEM低葡萄糖(1 g/L Sigma-Aldrich)中培养,DLD1和-衍生系和SW48在添加10% FCS和1%抗生素(链霉素/青霉素)的rmi -1640 (Sigma-Aldrich)培养基中培养。所有细胞株在37℃、5% CO下培养2大气和通过每3-4天。用Lipofectamin进行转染TM2000(赛默飞世尔科学公司)或Metafectene®(Biontex)根据制造商的介绍。
为了通过CRISPR/Cas9建立稳定的敲除细胞系,我们将以下引导物与来自px459的Cas9一起转染细胞:Pals1: GCCCTGGAGATTTGGGCACC;SMAP1: GTATCTGTTCTGCTGTCCAT。通过36小时嘌呤霉素筛选去除未转染的细胞,随后生成单细胞克隆,并通过western blot和测序进行高效敲除分析。对于所有细胞系,分析了第二个独立指南(Pals1: ATTAGCCGGATAGTAAAAGG, SMAP1: GTTATCTGTTTTCAGAGCAG),显示了相同的结果。
免疫荧光分析
细胞在盖玻片上生长,用4% PFA在pH为7.4的磷酸盐缓冲液中固定7分钟,或用甲醇在−20℃下固定10分钟。PBS洗涤三次后,细胞用PBS + 2.5%马血清和0.05%皂素(PBSS)或0.1% Triton X-100 (PBST)孵育1 h。随后,在同一溶液中稀释的一抗在RT下加入2小时或在4℃下过夜。用PBST/PBSS洗涤三次后,用二抗(PBSS + HS/PBST + HS稀释1:1000)、DAPI (1:1000, Invitrogen Life Technologies)孵育1小时。最后,封面用PBS清洗并安装在mowiol中。使用以下一抗:小鼠抗pals1 (1:100, Santa Cruz #365411),兔抗pals1 (1:100, Proteintech #17710-1AP),兔抗patj(1:100,在本研究中饲养),小鼠抗patj (1:50, DSHB Hybridoma Product AFFN-INADL-1-3G6),兔抗zo -1 (1:100, Cell Signaling #13663),兔抗e - cadherin (1:100, Cell Signaling #3195),小鼠抗e - cadherin (1:100, Santa Cruz #21791),大鼠抗e - cadherin (1:100, Santa Cruz #59778),豚鼠抗crb3a(1:200,在本研究中饲养),小鼠抗occludin(1:100,在本研究中饲养),小鼠抗occludin(1:100,在本研究中饲养)圣克鲁斯#271842)。
细胞裂解和Western blotting
细胞裂解物用Laemmli缓冲液(用于Western blotting)或tnt缓冲液(下拉实验;150 mM NaCl, 50 mM Tris, 1 mM MgCl2, 1mm CaCl2, 1% Triton X-100, pH 7.5 +蛋白酶抑制剂鸡尾酒)。按照标准程序进行SDS-PAGE和Western blotting。使用以下一抗:小鼠抗pals1 (1:500, Santa Cruz #365411),兔抗pals1 (1:100, Proteintech 17710-1AP),小鼠抗ß- actin (1:500, Santa Cruz #47778),小鼠抗rac (1:50, Santa Cruz #514583),兔抗α- actinin 4 (1:100, Cell Signaling #6487),小鼠抗α- actinin 4 (1:200, Santa Cruz #17829),小鼠抗arf6 (1:50, Santa Cruz #7971),兔抗e - cadherin (1:100, Santa Cruz #7870),小鼠抗smap1 (1:100, Abnova H00060682-B01P)。
伤口愈合试验
12孔细胞用培养-插入(2孔,ibidi)分离至融合。检测从去除插入物开始,并由蔡司观察者Z1拍摄照片。数据用ImageJ进行分析。
Transwell基质侵入试验
将Thincert细胞培养插入物(8µm, Greiner Bio-One)涂覆Cultrex®基底膜提取物(BME,终浓度1 mg/ml,稀释于相应的培养基中)。37°C孵育2小时后,将1.5 ml含10% FCS的DMEM添加到下隔室。将10万个无血清培养基细胞加入上隔室,37°C孵育。随后将上腔室剩余细胞取出,下腔室细胞经PFA固定后用结晶紫染色。为了进行定量,用甲醇从膜上取出细胞,570 nm处用infinite®M200 (Tecan Trading AG) microplate reader测量OD。
G-LISA
细胞在10厘米的培养皿中培养至融合。Rac1 G-LISA活性测定(#BK128, Cytoskeleton Inc.)使用0.5 mg/ml蛋白浓度的细胞裂解液,按照制造商说明进行。G-LISA的结果是用infinite®M200 (Tecan Trading AG)测量OD 490获得的。
基于fret的生物传感器测定Rac1活性
将细胞播种在18孔载玻片上(ibidiµ-Slide 18孔),预涂有基膜提取物(1 mg/ml层粘连蛋白,1 mg/ml纤维连接蛋白,0,9 mg/ml IV胶原蛋白),并用Rac1生物传感器(pTriEx4-Rac1-2G,来自Olivier Pertz, Addgene质粒# 66110)转染[48].作为对照,使用供体转染细胞(mTFP1)和受体转染细胞(Venus)。转染后培养细胞2-3天,在共聚焦显微镜(Leica TCS SP8)下使用FRET敏化发射向导(LAS X软件)进行分析。
统计分析
所有数据均以至少三个独立实验的平均值±标准差表示。GraphPad Prism采用无配对t检验或单因素方差分析(One-way ANOVA): ns > 0.05, *p< 0.05, **p< 0.01, ***p< 0.001。
结果
Pals1缺失导致HCT116细胞的细胞迁移和侵袭增强
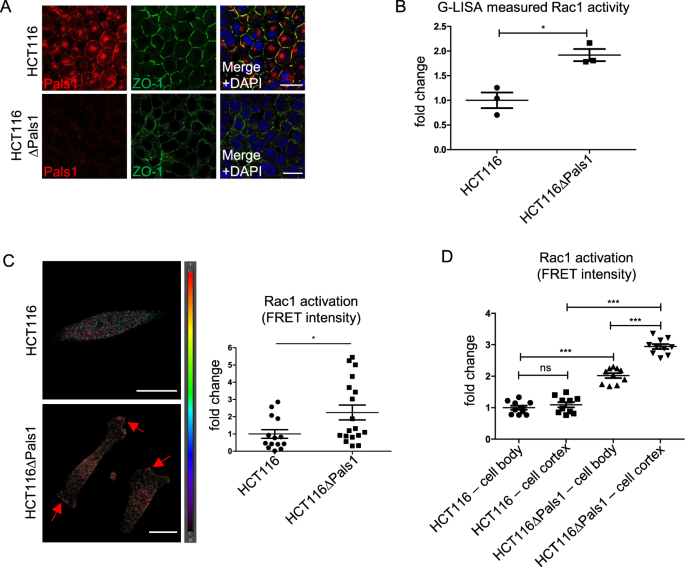
如先前报道[46],在结直肠癌细胞系HCT116中,通过ZO-1染色评估,Pals1的缺失导致了紊乱紧密连接的形成(图1)。1)和Occludin(补充图。1),其典型相互作用伙伴PATJ和Crb3a从细胞-细胞接触中丢失(补充图。1 a, B),增强细胞的集体迁移(补充图。1 c)和增加细胞外基质的侵袭(补充图。1 d).机制上,我们通过GTPase下拉试验证实了Arf6的增强激活(补充图。1 e),从而导致Rac1的激活增加(使用G-LISA测定和基于fret的生物传感器进行量化[48),无花果。1 b, C).值得注意的是,与细胞体相比,pals1缺陷细胞中Rac1激活的增加在细胞皮层更高。1 d).
敲除Pals1不能增强其他结直肠癌细胞系的细胞运动性
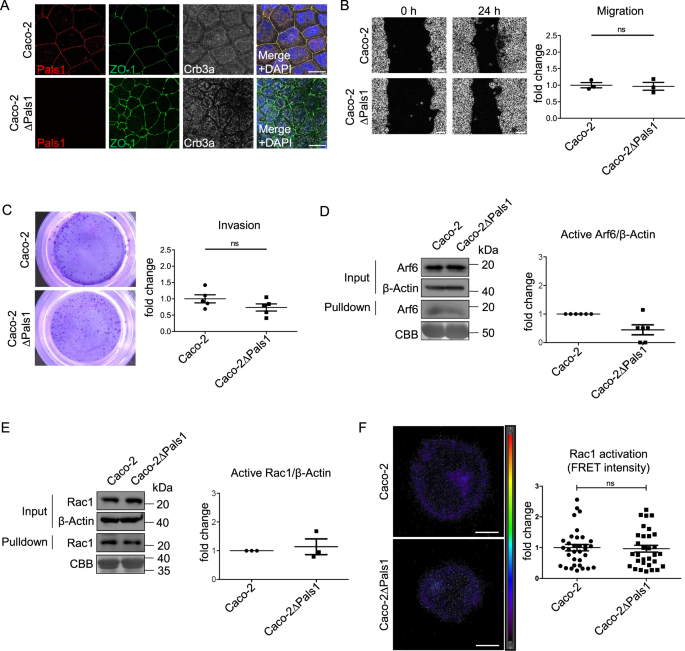
肿瘤通常表现出显著的异质性,这也反映在肿瘤来源的细胞系上。为了阐明我们关于Pals1缺失影响的发现是否适用于其他结直肠癌细胞系,我们在另一个细胞系Caco-2中建立了Pals1敲除。与文献一致,敲除Pals1导致细胞-细胞接触导致Crb3a缺失(图2)。2).然而,与缺乏pals1的HCT116细胞相比,TJ标记物ZO-1和Occludin的皮质定位仅受到轻微影响,但细胞在融合的单分子层内显得更小且形状不规则(图2)。2和补充图。2).与HCT116细胞一样,PATJ在细胞-细胞接触中丢失。2 b).令人惊讶的是,与野生型对照系相比,pals1缺陷Caco-2细胞的二维细胞迁移没有变化,其侵袭性大大降低(图2)。2 b, C).此外,pals1缺失的Caco-2细胞中的Rac1和Arf6活性不受影响,甚至低于肠外细胞系(图2)。2 d-f).
一个Caco-2和Caco-2ΔPals1细胞融合抗体免疫染色。BCaco-2和Caco-2ΔPals1细胞伤口愈合的代表性图像及相应的定量(N= 3)。CCaco-2和Caco-2ΔPals1细胞跨井基质入侵的代表性图像和定量分析(N= 5)。DWestern blot和cbb染色凝胶下拉实验检测Caco-2和Caco-2ΔPals1细胞裂解液中活性Arf6 (N= 6)。EWestern blot和cbb染色凝胶下拉实验检测Caco-2和Caco-2ΔPals1细胞裂解液中活性Rac1 (N= 3)。F生物传感器靶向活性Rac1的FRET信号的代表性图像和定量,转染Caco-2和Caco-2ΔPals1细胞。4次实验结果具有代表性。比例尺A和F为20µm, B为100µm。
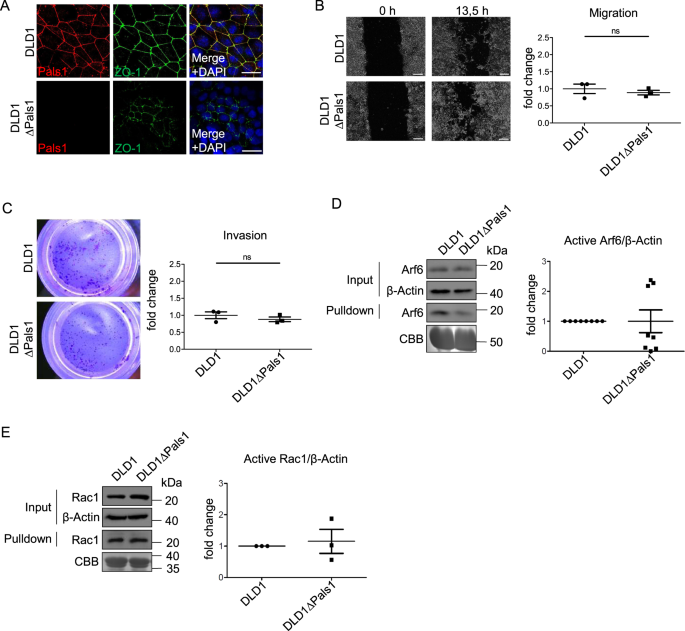
与HCT116相比,Caco-2细胞保留了高度的上皮极化,没有KRAS和PIK3CA突变,而HCT116细胞是这些癌基因的突变体。因此,我们检查了第三个细胞系DLD1,它对KRAS和PIK3CA的突变与HCT116相似,但分化程度低于Caco-2。与HCT116细胞类似,pals1缺陷的DLD1细胞显示皮层ZO-1和Occludin减少,提示TJ形成缺陷,以及不规则的细胞形状(图2)。3和补充图。3).然而,就其运动能力而言,Pals1缺失的DLD1细胞表现与Caco-2∆Pals1细胞相似,细胞迁移和侵袭没有增强,而是略有下降(图1)。3 b, C).这与观察到的Arf6-(图。3 d)和rac1激活(图;3 e)与对照细胞相比,DLD1∆Pals1细胞没有增加。
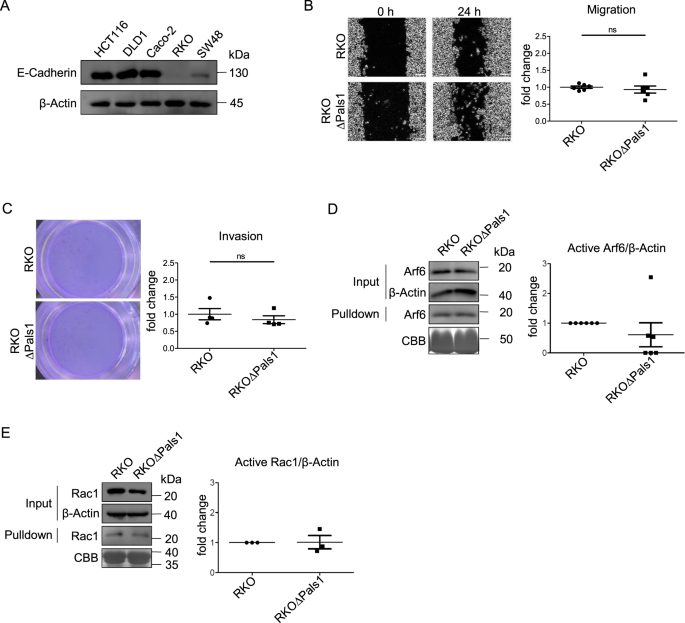
我们推测HCT116的分化程度可能低于Caco-2和DLD1,这也得到了以下观点的支持,即TJ在HCT116细胞中较弱,有时是不连续的,但在DLD1和Caco-2细胞中更强。因此,我们在RKO细胞中重复了我们的实验,RKO细胞不表达可检测的E-Cad水平(图。4),而且似乎根本没有形成细胞与细胞之间的接触(数据未显示)。然而,即使在这种高度去分化的细胞系中,删除Pals1也不能增强细胞的运动性(图1)。4 b, C).再次,RKO细胞中Pals1敲除后,激活的Rac1和Arf6水平没有增加(图2)。4 d, E).因此,与Caco-2、DLD1和RKO相比,在Arf6活性的背景下,HCT116细胞似乎对Pals1缺失敏感。
Pals1通过Arf6- gap SMAP1冗余控制Arf6活性
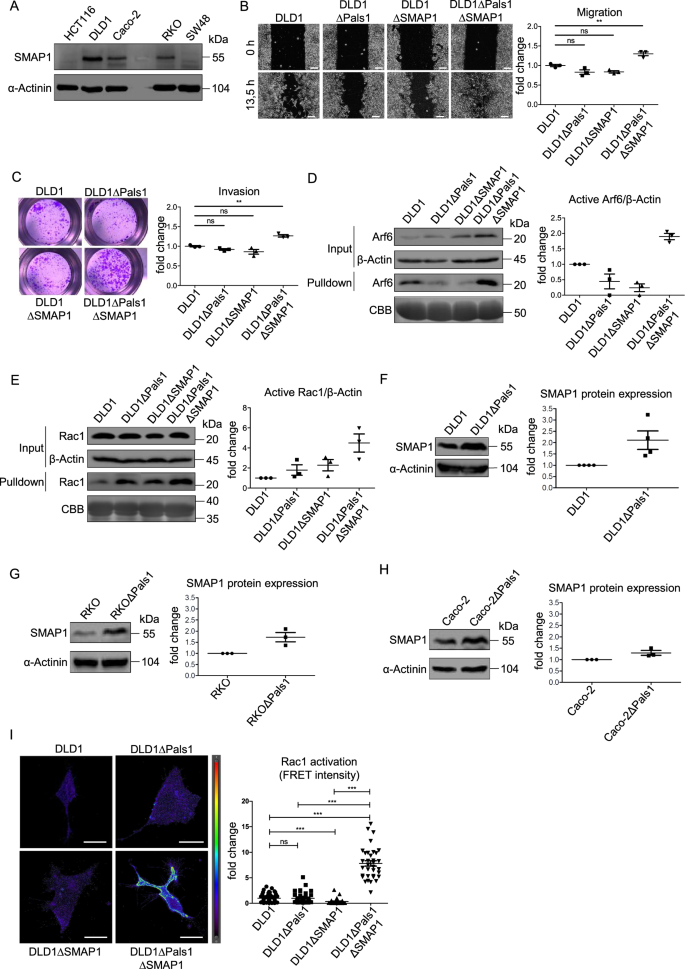
一种解释HCT116和其他结直肠癌细胞系不同迁移行为的可能是,在HCT116细胞中,Arf6对Pals1的调节功能更敏感。值得注意的是,Sangar等人报道,在微卫星不稳定的结直肠癌标本和细胞系中,Arf6-GAP SMAP1的表达经常因腺嘌呤重复序列的缺失或插入而受到干扰,从而导致过早的终止密码子[47].作者还证明HCT116细胞携带SMAP1的纯合截断,而RKO是杂合的,DLD1是SMAP1的野生型。我们证实,Caco-2、DLD1和RKO细胞表达了大量的SMAP1,而在HCT116细胞中没有全长蛋白,只有微弱的降解产物(图2)。5).
一个Western blot分析SMAP1在不同结直肠癌细胞系中的表达。BDLD1、DLD1ΔPals1、DLD1ΔSMAP1和DLD1ΔPals1ΔSMAP1细胞伤口愈合的代表性图像及相应的量化(N= 3)。CDLD1和DLD1ΔPals1细胞transwell基质侵袭的代表性图像和定量分析(N= 3)。DWestern blot和cbb染色凝胶下拉实验检测DLD1、DLD1ΔPals1、DLD1ΔSMAP1和DLD1ΔPals1ΔSMAP1细胞裂解液中活性Arf6 (N= 3)。EWestern blot和cbb染色凝胶下拉实验检测DLD1、DLD1ΔPals1、DLD1ΔSMAP1和DLD1ΔPals1ΔSMAP1细胞裂解液中活性Rac1 (N= 3)。请注意,在输出的Rac1印迹中,在DLD1∆Pals1和DLD∆SMAP1细胞之间切割出一条空通道。F- - - - - -HWestern blot检测野生型和pals1缺失型DLD1中SMAP1的表达F, RKOG,和Caco2H细胞(N> = 3)。我以活性Rac1为目标的生物传感器的FRET信号的代表性图像和定量,在指示的DLD1细胞系中转染。4次实验结果具有代表性。比例尺B为100µm, in为20µm我.
值得注意的是,DLD1∆Pals1和RKO∆Pals1细胞中SMAP1的缺失与HCT116细胞中的发现相似:细胞迁移和侵袭增强(图1)。5 b, C和补充图。4 a、B)以及Arf6和Rac1活性的增加(图。5D E I和补充图。4摄氏度).相反,在DLD1或RKO细胞中单独缺失SMAP1反而会降低细胞活力(图。5 b, C和补充图。4 a、B).值得注意的是,SMAP1在缺乏Pals1的DLD1和RKO细胞中表达上调,而在Caco-2∆Pals1细胞中,SMAP1的表达仅略有增加(图5)。5 f-h),表明敲除Pals1后存在代偿机制。
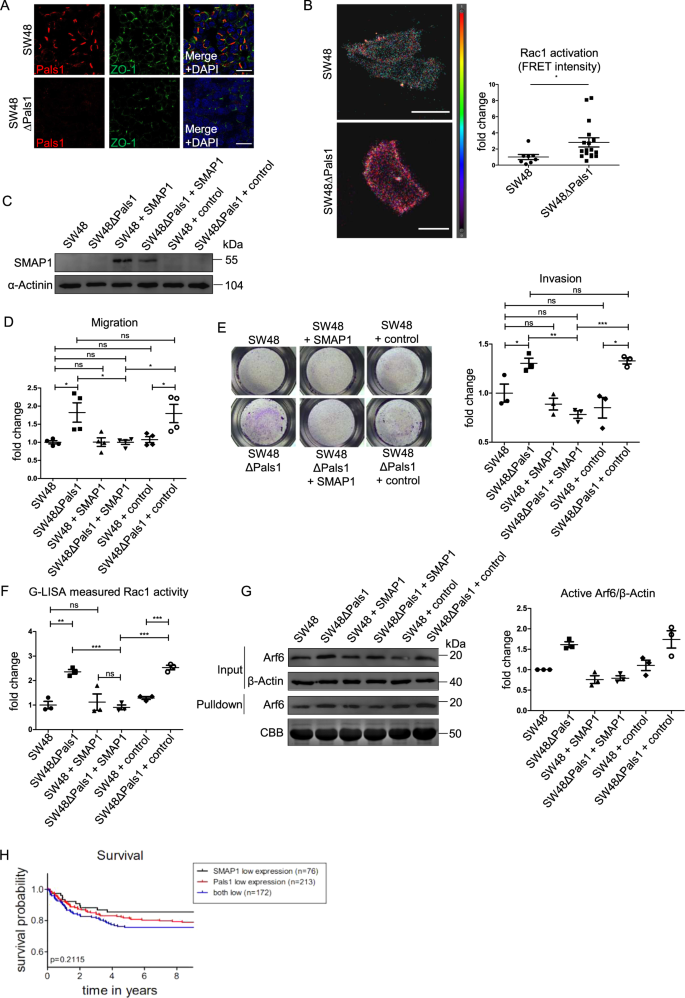
在一个平行的方法中,我们测试了另一个缺乏smap1的结直肠癌细胞系(图。5), SW48,并观察到与HCT116细胞相似的行为:缺失Pals1进一步降低了皮质TJ标记物ZO1(图1)。6)和移位的PATJ和Crb3a从连接(补充图。5).此外,缺乏pals1的SW48细胞表现出增强的细胞迁移(补充图。5 b)和活性Arf6和Rac1水平升高(图。6 b和补充图。5 b, C).
为了进一步支持我们的假设,即SMAP1和Pals1在调节Arf6激活方面具有冗余功能,我们在野生型和Pals1缺陷的SW48细胞中重新表达SMAP1(图2)。6摄氏度).事实上,SMAP1的重新表达减少了pals1缺陷SW48细胞的迁移和侵袭,降低到与野生型细胞株相当的水平。6 d, E).此外,当SMAP1重新表达时,pals1缺陷细胞中增强的Arf6和Rac1激活降低到对照水平(图2)。6做减法).因此,表达SMAP1或Pals1的细胞表现出较低的迁移能力,只有缺乏这两种蛋白的细胞表现出Arf6/Rac1激活增加,迁移/入侵更快。
综上所述,我们从这些实验中得出结论,Pals1与SMAP1冗余地发挥作用,控制活性Arf6的水平,从而控制结直肠癌细胞中rac1介导的细胞迁移。
Pals1和SMAP1下调与结直肠癌不良预后相关
最后,我们检查了所提出的Pals1与SMAP1冗余控制肿瘤细胞迁移/转移的机制是否也反映在患者队列中。的确,总体生存分析显示,与仅有一种基因下调的病例相比,Pals1和SMAP1同时下调的患者生存期降低(图2)。6小时).
讨论
侵袭性癌细胞在远处器官形成转移是肿瘤相关死亡的主要原因。因此,了解导致侵袭和转移增强的分子病理机制是开发新疗法的最重要的先决条件之一。
最近,我们揭示了极性调节因子Pals1通过抑制Arf6控制结直肠癌细胞运动的新功能,而Arf6反过来又控制rac1依赖的板足底形成和肿瘤细胞的迁移/侵袭[46].值得注意的是,对缺乏与其典型复合体伙伴Crb或PATJ相互作用的结构域的Pals1变体的抢救实验表明,Pals1在这种情况下独立于这些蛋白质发挥作用,尽管在所有细胞系中删除Pals1会导致PATJ从细胞-细胞接触中移位。
Pals1在TJ的形成中起着重要作用,在此之前已经有报道称,Pals1的下调已被证明会导致TJ的延迟形成[10]、受干扰的电子cad贩运[49]和培养的哺乳动物细胞接触抑制受损[18].后一个事实可以解释为,在Pals1表达降低的细胞中,转录共激活子YAP的活性增加,导致细胞增殖增强,正如在培养的MDCK细胞和小鼠肾脏中所证明的那样,从而发展出囊性表型[25].所有这些功能作为Crb复合体的一部分被分配给Pals1,因为在小鼠中删除Crb或在培养细胞中下调Crb或PATJ会导致相似的表型[8,11,13,14,23,50,51].
在HCT116细胞中,缺失Pals1增强了细胞的集体迁移,但也使孤立的HCT116细胞更具运动性,而对细胞-细胞接触或组装TJ没有任何影响。在机制上,我们证实了Pals1与Arf6的相互作用独立于其GTP/ gdp结合状态,并且在HCT116细胞中,由于Arf6的转录和翻译/稳定性增强,Pals1缺失时,活跃的Arf6水平增加[46].gtp结合的Arf6已被证明定位于迁移细胞的板足底,过表达具有组成性活性的Arf6足以促进板足底的形成和细胞迁移[52,53].然而,所有报告Arf6结合伙伴对细胞迁移影响的研究都记录了Arf6活性的调节,而不改变Arf6总水平。相比之下,HCT116细胞中缺失Pals1并不影响活性Arf6与总Arf6的比例。然而,由于pals1缺陷细胞中总Arf6水平的增加,活性Arf6的数量也增强了。因此,活跃的Arf6增强了依赖Rac1的细胞迁移和侵袭,这可以通过抑制pals1缺陷细胞中的Arf6或Rac1来平衡[46].在迁移细胞中,内源性Pals1与Arf6共定位于板足底,而不是在细胞-细胞接触处,而且在缺乏Pals1的细胞中,Arf6(和Rac1)在板足底强烈富集的事实表明,Pals1抑制Arf6以控制细胞迁移[46].
值得注意的是,在其他三种结直肠癌细胞系(Caco-2, DLD1和RKO)中,单独删除Pals1不会增加细胞迁移或Arf6/Rac1活性,这是由于Arf6特异性GAP SMAP1的表达。SMAP1在微卫星不稳定结直肠癌标本和细胞系中频繁突变[47].HCT116是SMAP1双等位突变株系之一,而Caco-2、DLD1和RKO是SMAP1突变株系的野生型或杂合型,这解释了这些细胞系敲除Pals1后的不同表型。然而,在DLD1或RKO细胞中,共缺失Pals1和SMAP1,而不是单独缺失SMAP1,可以增强Arf6/Rac1的活性,以及这些细胞系的细胞迁移和侵袭。反之,在SW48∆Pals1细胞(缺乏SMAP1功能)中重新表达SMAP1,可以挽救迁移和侵袭行为,并降低Arf6/Rac1的激活。与DLD1细胞形成适当的TJ并表达高水平的E-Cadherin相反,RKO细胞缺乏E-Cad表达,因此不能组装AJ或TJ。这两个细胞系在删除Pals1和SMAP1后表现相似的事实进一步支持了我们的假设,即Pals1在控制Arf6中的作用独立于其已知的连接功能,例如,将ZO-1定位在TJ。虽然我们在pals1缺陷的HCT116和DLD1细胞中观察到TJ蛋白积累的变化,但co2细胞没有表现出明显的TJ缺陷。需要进一步的实验来解决这个问题,缺失Pals1和SMAP1是否会导致不同细胞系在细胞极化过程中TJ的形成和动态变化,以及这是否可能有助于增强迁移表型。
有趣的是,小鼠中SMAP1的普遍缺失改变了红-髓系祖细胞的囊泡运输,导致骨髓发育异常。偶尔,小鼠也会发生髓系白血病,而没有其他肿瘤表型的报道[54].因此,SMAP1的缺失似乎只影响野生型非转化细胞的一个特殊子集中依赖arf6的过程。这在一定程度上可能是由于其他arf6特异性的功能重叠的gap。
最后,对结直肠癌标本mRNA表达的评估(TCGA项目)显示,如果肿瘤标本的Pals1和SMAP1表达较低,与Pals1或SMAP1表达下调的肿瘤相比,结直肠癌患者的生存预后较差。这些数据表明,本研究揭示的机制可能有助于结直肠癌患者的发病机制。此外,抑制Arf6减少了Pals1/ smap1双缺陷癌细胞的细胞迁移,可能被认为是一种未来治疗结直肠癌患者的方法。
数据可用性
在本研究中产生的数据可在文章及其补充数据文件中获得。
参考文献
Royer C, Lu x。上皮细胞极性:对抗癌症的主要看门人?《细胞死亡差异》,2011;18:1470-7。
Rodriguez-Boulan E, Macara IG。组织和执行上皮极性计划。中国生物医学工程学报。2014;
Sen A, Nagy-Zsver-Vadas Z, Krahn议员。果蝇PATJ通过调节肌球蛋白轻链活性支持粘附结的稳定性。中国生物医学工程学报,2012;
Sen A, Sun R, Krahn议员。在果蝇中,pals1相关紧密连接蛋白的定位和功能受到两个不同的顶端复合物的调控。中国生物化学杂志,2015;29:13224 - 33。
卢MH,马卡罗瓦O,刘佳杰,申k,李S, Laurinec S,等。Maguk蛋白Pals1的功能是一个适配器,连接哺乳动物的同源物“面包屑”和“光盘丢失”。中国生物医学工程学报,2002;
谭波,刘志刚,张志刚,张志刚。哺乳动物碎屑复合体在上皮紧密连接中的作用。Curr Biol, 2020。
马文杰,陈志强,陈志强,陈志强,等。极性决定碎屑在抑制哺乳动物上皮性肿瘤进展中的作用。癌症决议2008;68:4105-15。
刘佳杰,刘志刚,刘志刚。MCF10A细胞紧密结的形成需要多个crumb3区域。中国生物医学工程学报(英文版),2005;
卢明明,范淑娟,刘佳杰,马高利。Crumbs3-Pals1复合体参与哺乳动物上皮细胞极性的建立。中国生物医学工程学报,2003;29(4):344 - 344。
直SW, Shin K, Fogg VC,范S,刘cj, Roh M,等。PALS1表达缺失导致紧密连接和极性缺陷。Mol生物细胞,2004;15:1981-90。
Michel D, Arsanto JP, Massey-Harroche D, Beclin C, wijnhold J, Le Bivic A. PATJ连接并稳定人肠细胞紧密连接的顶端和外侧成分。中国生物医学工程学报(英文版);2005;
lemers C, Michel D, Lane-Guermonprez L, Delgrossi MH, Medina E, Arsanto JP,等。CRB3直接与Par6结合,调节哺乳动物上皮细胞紧密连接的形态发生。Mol Biol Cell, 2004; 15:1324-33。
Charrier LE, Loie E, Laprise P.小鼠碎屑在体内维持上皮组织形态发生。科学通报2015;5:17699。
Whiteman EL, Fan S, Harder JL, Walton KD, Liu CJ, Soofi A,等。面包屑对上皮细胞的正常发育和存活至关重要。中国生物医学工程学报(英文版);2014;34:43-56。
刘佳杰,刘志刚,刘志刚,马戈利斯。转录因子蜗牛抑制Crumbs3的表达并破坏顶端-基部极性复合物。致癌基因。2008;27:3875-9。
郭晓明,张晓明,张晓明,等。转录因子ZEB1 (deltaEF1)通过抑制上皮极性的主要调控因子促进肿瘤细胞去分化。致癌基因。2007;26:6979 - 88。
史德娜,史玛霍弗,王志强,王志强,等。转录抑制因子ZEB1在癌症中促进转移和细胞极性丧失。癌症决议2008;68:537-44。
Varelas X, Samavarchi-Tehrani P, Narimatsu M, Weiss A, Cockburn K, Larsen BG,等。面包屑复合物偶联细胞密度感应到海马依赖的tgf - β - smad通路控制。开发细胞。2010;19:831-44。
赵斌,李林,卢强,王汉林,刘春春,雷强,等。血管生成素是一种抑制YAP癌蛋白的新型Hippo途径成分。基因开发,2011;25:51-63。
陈cl, Gajewski KM, Hamaratoglu F, Bossuyt W, sansore - garcia L, Tao C,等。根尖-基底细胞极性决定因子Crumbs调节果蝇的Hippo信号。美国国家科学研究院。2010; 107:15810-5。
黄俊,洪勇,王志强。面包屑通过ferm结构域蛋白的扩增调控果蝇萨尔瓦多/疣/河马信号。当代生物学,2010;20:582-90。
Grzeschik NA, Parsons LM, Allott ML, Harvey KF, Richardson HE。Lgl, aPKC和Crumbs通过两种不同的机制调节萨尔瓦多/疣/河马通路。《当代生物学》2010;20:573-81。
Szymaniak AD, Mahoney JE, Cardoso WV, Varelas X. crumbs3介导的极性通过河马通路效应子Yap指导气道上皮细胞命运。Dev细胞。2015; 34:283 - 96。
凌晨,郑勇,尹峰,于军,黄军,洪勇,等。根尖跨膜蛋白Crumbs作为肿瘤抑制因子,通过与膨胀体结合调节Hippo信号通路。美国国家科学研究院。2010; 107:10532-7。
Weide T, Vollenbroker B, Schulze U, Djuric I, Edeling M, Bonse J等。Pals1单倍体功能不全导致蛋白尿和囊肿形成。J Am Soc Nephrol。JASN2017.
张志刚,张志刚。导向细胞迁移的研究进展。中国生物医学工程学报,2014;
陈X,马卡拉IG。Par-3通过Rac交换因子Tiam1控制紧密结组件。细胞生物学杂志,2005;7:262-9。
Kazanietz MG, Caloca MJ。Rac GTPase在癌症中的作用:从旧概念到新范式。癌症决议2017;77:5445-51。
Tushir JS, D’souza - schorey C. arf6依赖的ERK和Rac1激活调节上皮小管发育。杨晓明,2007;26:1806-19。
圣蒂LC,卡萨诺瓦JE。ARNO对ARF6的激活通过下游Rac1和磷脂酶的激活刺激上皮细胞迁移。J .细胞生物学杂志,2001;54:599 - 610。
Santy LC, Ravichandran KS, Casanova JE。DOCK180/Elmo复合物将arno介导的Arf6激活与Rac1的下游激活耦合在一起。《生物学报》2005;15:1749-54。
古涛,Eipper BA, Donaldson JG。Arf6将Rac GEF Kalirin招募到质膜,促进Rac激活。BMC细胞生物学,2007;8:29。
胡b, Shi B, Jarzynka MJ, Yiin JJ, D 'Souza-Schorey C,程思宇。adp核糖化因子6通过智商结构域gtp酶激活蛋白1- rac1介导的途径调控胶质瘤细胞的侵袭。癌症决议2009;69:794-801。
Muralidharan-Chari V, Hoover H, Clancy J, Schweitzer J, Suckow MA, Schroeder V,等。adp -核糖基化因子6在体内调节肿瘤的发生和侵袭性。癌症决议2009;69:2201-9。
唐纳森JG,杰克逊CL。ARF家族G蛋白及其调控因子:在膜转运、发育和疾病中的作用。中国生物医学工程学报。2011;12:362-75。
Palamidessi A, Frittoli E, Garre M, Faretta M, Mione M, Testa I,等。Rac的内吞运输是细胞迁移信号空间限制所必需的。细胞。2008;134:135-47。
Zobel M, Disanza A, Senic-Matuglia F, Franco M, Colaluca IN, Confalonieri S,等。NUMB-EFA6B-ARF6循环途径控制顶端受限的细胞突出和间充质运动。中国生物医学工程学报,2018;
王晓明,韩娟,王晓明,等。α - 4整合素-paxillin- arf - gap复合物抑制Rac在迁移细胞前沿的激活。细胞生物学杂志,2005;7:343-52。
Humphreys D, Davidson AC, Hume PJ, Makin LE, Koronakis V. Arf6通过WAVE复合体协调肌动蛋白的组装,这是一种沙门氏菌入侵宿主细胞的机制。美国国家科学研究院。2013; 110:16880-5。
森重M,桥本S,小川E,户田Y,小谷H,广濑M,等。GEP100连接表皮生长因子受体信号通路与Arf6激活诱导乳腺癌侵袭。细胞生物学杂志,2008;10:85-92。
桥本S,小野寺Y,桥本A,田中M,滨口M,山田A,等。Arf6在乳腺癌侵袭性活动中的需求。美国国家科学研究院。2004; 101:6647-52。
Tague SE, Muralidharan V, D’souza - schorey C. ADP-ribosylation factor 6通过激活MEK/ERK信号通路调控肿瘤细胞侵袭。美国国家科学研究院。2004; 101:9671-6。
李敏,吴珊珊,王娟,赖林,梁世永,Franco M,等。EFA6A通过ADP核糖化因子6/细胞外信号调节激酶信号增强胶质瘤细胞侵袭。癌症法案2006;66:1583-90。
刘俊华,Brady SW, Acosta-Alvarez L, Rogers A, Peng J, Sorensen LK,等。小的GTPase ARF6激活黑色素瘤中的PI3K,诱导转移前状态。癌症决议2019;79:2892-908。
桥本S,古川S,桥本A, Tsutaho A,深尾A,坂村Y,等。ARF6和AMAP1是KRAS和TP53突变促进胰腺癌侵袭、PD-L1动态和免疫逃避的主要靶点。美国国家科学研究院。2019; 116:17450-9。
卢特格纳,埃明C,瓦格纳T,哈姆斯J, Guske J,韦伯K,等。Pals1通过抑制Arf6抑制rac1依赖的结直肠癌细胞转移。摩尔癌症。2021;20:74。
杨晓东,张晓东,张晓东,等。小ArfGAP1 (SMAP1),一种新的arf6特异性gtp酶激活蛋白,参与微卫星不稳定性肿瘤发生。致癌基因。2014;33:2758 - 67。
Fritz RD, Menshykau D, Martin K, Reimann A, Pontelli V, Pertz O. srgap2依赖的膜几何形状和缝隙机器人排斥信号整合调节成纤维细胞运动接触抑制。开发技术,2015;
王强,陈晓文,马golis B. PALS1对哺乳动物上皮细胞E-cadherin转运的调控。Mol生物细胞,2007;18:874-85。
毛旭,李鹏,王勇,梁忠,刘杰,李俊,等。CRB3通过激活乳腺上皮细胞的Hippo通路调节接触抑制。细胞死亡,2017;8:e2546。
张志刚,张志刚,张志刚。PATJ调控哺乳动物上皮细胞紧密连接的形成和极性。中国生物医学工程学报,2005;
Riley KN, Maldonado AE, Tellier P, D 'Souza-Schorey C, Herman IM。Betacap73-ARF6相互作用调节体外损伤后的细胞形状和运动。分子生物学杂志,2003;14:4155-61。
苗波,Skidan I,杨娟,尤泽,付旭,Famulok M,等。PITENINs抑制细胞迁移:ARF6的作用。致癌基因。2012;31:4317-32。
今生,谷岸N,田边K,渡边T,船木T,王wf,等。Smap1缺失会干扰受体的运输,使小鼠容易发生骨髓增生异常。中华临床医学杂志。2013;23(3):344 - 344。
确认
这里显示的结果部分基于TCGA研究网络生成的数据:https://www.cancer.gov/tcga.这项工作得到了德国研究基金会(DFG: KR3901/8-1和MPK的SFB1348/A05)和IZKF Münster (Kr-A-031.21)的支持。
资金
由Projekt DEAL启动和组织的开放获取资金。
作者信息
作者及隶属关系
贡献
JH, SML, CE, JG, KW, TW, LS, PN构思并完成了大部分实验并撰写了手稿。MPK构思实验并撰写手稿。
相应的作者
道德声明
利益冲突
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
哈姆斯,Lüttgenau, S.M,埃明,C。et al。Pals1与SMAP1冗余功能抑制Arf6,以防止rac1依赖的结直肠癌细胞迁移和侵袭。癌症基因Ther(2022)。https://doi.org/10.1038/s41417-022-00570-2
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41417-022-00570-2