文摘
许多淋巴恶性肿瘤源自解除原癌基因表达与额外的基因病变的合作。虽然许多这些合作发现了遗传病变及其功能特征,基本患者样本DNA序列数据表明,更多的确实存在。然而,他们的贡献的本质原癌基因驱动便尚未研究。我们认为TFAP4原癌基因驱动的有力抑制淋巴瘤发展之前的全基因组CRISPR淘汰赛屏幕在初级细胞体内(1]。CRISPR TFAP4的删除Eµ-MYC转基因造血干细胞和祖细胞(公司)和移植这些操纵公司致命辐照动物显著加速c-MYC-driven淋巴瘤发展。有趣的是,TFAP4不足Eµ-MYC淋巴瘤所有出现前B细胞B细胞发展阶段。这就促使我们描述前b细胞的转录概况pre-leukaemic小鼠移植Eµ-MYC / Cas9目标公司,并与sgRNAs TFAP4。这一分析显示,TFAP4删除减少表达的几个主监管机构的B细胞分化,如Spi1,SpiB和Pax5,这是TFAP4和MYC的直接目标基因。因此,我们得出这样的结论:损失TFAP4导致一块在早期B细胞发育分化,从而加速c-MYC-driven淋巴瘤发展。
介绍
致癌基因原癌基因是异常高表达在~ 70%的人类癌症2]。值得注意的是,原癌基因通常在几个血液学的恶性肿瘤,如伯基特淋巴瘤(提单),一个B细胞恶性肿瘤的t(8; 14)染色体易位,征服了原癌基因基因的控制下免疫球蛋白重(本)连锁基因增强剂Eµ(3]。的Eµ-MYC转基因小鼠作为提单和其他恶性肿瘤的临床前模型由管制原癌基因的表达。这些老鼠持续表达的人原癌基因鼠的控制之下Eµ增强剂在B细胞发展导致增加B细胞祖细胞的扩张,后来转变成淋巴瘤合作收购后致癌突变(4,5,6]。
因为提单和其他淋巴恶性肿瘤的发展需要额外的遗传或表观遗传变异体与解除合作原癌基因表达式,我们先前着手识别这样的合作在一个公正的全基因组突变体内功能基因筛选[1]。从这个屏幕,我们确定了转录因子TFAP4(也称为AP-4)点击率最高的(1]。TFAP4是基本helix-loop-helix亮氨酸拉链据报道,转录因子激活或抑制靶基因表达在homo-dimerisation [7]。Tfap4表达式本身是直接由原癌基因。TFAP4导致一些原癌基因调控细胞过程,包括细胞增殖、细胞周期控制和细胞衰老,与原癌基因的功能交互包括绑定到相同的基因启动子元素(由黄et al。8])。值得注意的是,TFAP4是至关重要的维持c-MYC-driven增殖和成熟的信号在生发中心B细胞在感染性挑战通过绑定和调节基因启动子(9]。因此,TFAP4代理下游是一个重要的转录因子和/或与原癌基因调节成熟的B淋巴细胞增殖和搞笑类切换。
TFAP4主要被确认为一种致癌基因,已经被影响涉及驾驶tumourigenesis上皮间充质转变,“具备干细胞”和其他细胞过程(8]。在某些人类癌症高水平的TFAP4表达式与不良预后状况(10,11]。然而,这些致癌性质TFAP4固体中发现了癌症,如乳腺癌[12[],结直肠癌患者13,14),胃癌15),神经母细胞瘤(16,17和某些人18,19],TFAP4在血液学的恶性肿瘤中的作用只在一项研究被调查日期(20.]。有趣的是,突变TFAP4病人被发现在9.7%的提单样本(21,22,23]。相反固体癌症(见上图),这些主要是灭活突变,暗示TFAP4具有肿瘤抑制功能。然而,这种类型的分析并不提供机械的见解如何TFAP4缺陷导致c-MYC-driven便。
我们使用Eµ-MYC/Cas9双重转基因小鼠和胎儿肝脏派生公司移植方法调查的肿瘤抑制作用期间TFAP4 c-MYC-driven淋巴瘤发展。我们发现TFAP4损失导致前b细胞恶性转化的阶段,前表面搞笑(sIg)表达式。pre-leukaemic前B细胞的基因表达分析显示,几个重要的转录因子,B细胞分化,也是TFAP4的直接目标和MYC TFAP4缺席时异常减少。这表明TFAP4结合和调控关键基因负责B细胞分化和成熟。在Eµ-MYC转基因B淋巴细胞的损失TFAP4就是说分化导致的扩张迅速扩散前B细胞池变成完全恶性原癌基因驱动的淋巴瘤。
材料和方法
细胞培养和慢病毒生产
食谱HEK293T细胞和培养基Eµ-MYC淋巴瘤细胞系(FMA介质)主要来源于肿瘤辅助表中列出S1(24]。细胞系是常规检测支原体污染。一些sgControl / Eµ-MYC / Cas9以前淋巴瘤细胞株用于实验(1]。慢病毒使用标准生成磷酸钙沉淀方法如前所述[25]。上层清液含慢病毒颗粒收集转染48 - 72 h后,经过0.45µM过滤器之前感染的细胞。
实验小鼠
实验小鼠的护理和饲养是根据指导方针进行了沃尔特和伊莱扎大厅研究所动物伦理委员会。Eµ-MYC转基因(4),Cas9转基因小鼠(k . Rajewsky教授的礼物,马克斯Delbrueck中心,柏林,德国)保持在C57BL / 6-Ly5.2背景。C57BL / 6-Ly5.1和C57BL / 6-Ly5.2老鼠从沃尔特和伊莱扎霍尔研究所获得繁殖设施(丘,维多利亚,澳大利亚)。
造血的大批的致命辐照老鼠
胎儿肝细胞(方法),公司的丰富来源Eµ-MYC /Cas9双转基因胚胎E13.5收获和冻结在90% FCS和10% (v / v) DMSO溶液。之前转导与sgRNA表达向量,方法解冻和培养48 h在方法中(补充表S1)。Twelve-well non-tissue文化对待盘子被涂上一层32µg /毫升retronectin (WEHI) PBS一夜之间在4°C,然后屏蔽2%牛血清白蛋白溶液(# A1595 Sigma-Aldrich)在PBS 37°C为30分钟。病毒上清液补充8µg /毫升聚凝胺是离心机在retronectin涂层板在3500 rpm 2小时32°C。上层清液被删除,取而代之的是方法转导24 h。这些转导细胞被收集,清洗在PBS和注入intra-venously(注射)(供者细胞)的随机分配到致命辐照(2×5.5 Gy, 4 h) 7 - 8周前C57BL / 6-Ly5.1受体小鼠。发表生存被定义为时间从公司移植到动物发达淋巴瘤和被认为已经达到道德端点由经验丰富的动物研究技术人员对捐赠者的身份也不清楚公司用于移植的老鼠。
pre-leukaemic前b细胞的分析
调整的致命辐照小鼠方法进行如上所述,除了从一个胎儿肝细胞转导和注入两个收件人老鼠,老鼠和接受者在3周post-transplantation收获。从这些受体小鼠,收集外周血retro-orbital流血到EDTA包含管和脾脏、胸腺、淋巴结(臂腹股沟,腋窝)和骨髓(股骨和胫骨)收获和加工成单一细胞悬浮液和计算如上所述。红细胞被从外周血和脾脏细胞悬浮液的孵化红细胞清除缓冲区(补充表S1在冰上)5分钟,然后洗两次。细胞悬浊液中孵化的组合fluorochrome-conjugated抗体合适的表面标记(补充表S2)。染色与Propidium碘(PI)被用于死细胞排斥和细胞分析在Fortessa1流式细胞分析仪(正)。
隔离pre-leukaemic前b细胞的rna序列的分析
前b细胞与骨髓移植的受体小鼠3周之前sgTfap4 / Eµ-MYC / Cas9或sgControl / Eµ-MYC / Cas9方法。B细胞从骨髓浓缩所有长骨头的染色鸡尾酒的生物素化的抗体TER119 (Ly76) MAC-1 (M1/70) GR-1冰(RB6-8C5) 20分钟,洗净,然后用MagniSort孵化链霉亲和素-选择珠子(热费希尔科学)根据制造商的协议来消除不想要的髓细胞和红细胞。上层清液转移到新管,清洗,并在100年resuspendedµl fluorochrome-conjugated鸡尾酒的抗体B220 (RA3-6B2), IgM (5.1), c - kit (2 b8)和1×106住pre-leukaemic前b细胞(B220(π-)+sIgM−c - kit−排序)流式细胞仪,离心机,resuspended QIAzol裂解试剂(试剂盒)和存储在−80°C。总RNA提取使用试剂盒miRNeasy迷你工具根据制造商的指示和可选的列DNAase消化。输入100 ng准备使用的总RNA信使RNA RNA样本库和索引使用TruSeq准备工具包(illumina公司)根据制造商的协议。样本测序Illumina公司使用paired-end NextSeq测序。RNA-sequencing中详细分析补充材料。
统计分析
数据给出平均值±标准平均误差(SEM)图的传说中,除非另有说明。执行统计分析使用GraphPad棱镜软件(v9.4.0);两组之间的差异使用学生的决心t测试;韦尔奇的校正应用如果数据不符合正态模型;方差分析测试是用于比较多个组。体外细胞死亡曲线都是日志转换和安装在一个非线性回归模型和使用GraphPad棱镜的IC50派生软件(v9.4.0)。样本大小确定能够观察统计上显著的差异控制老鼠/细胞和转基因小鼠细胞,和实验至少重复三次。
结果
删除的TFAP4公司加速c-MYC-driven便
我们来验证Tfap4作为一个顶级打击从先前的全基因组CRISPR淘汰赛屏幕(1)加速Eµ-MYC诱导便使用独立sgRNAs瞄准Tfap4。为此,我们孤立胎儿肝细胞(方法)(公司的丰富来源能够重建造血的系统[26))Eµ-MYC/Cas9双重转基因胚胎13.5天(E13.5)和独立转导sgRNAs两个目标Tfap4(sgTfap4),积极控制sgRNA瞄准Trp53(sgTrp53)[27)或消极控制sgRNA针对人类荡妇或人类NLRC5(sgControl)。这些sgRNA转导Eµ-MYC/Cas9公司被移植到致命辐照C57BL / 6-Ly5.1受体小鼠淋巴瘤发展被监控(无花果。1)。
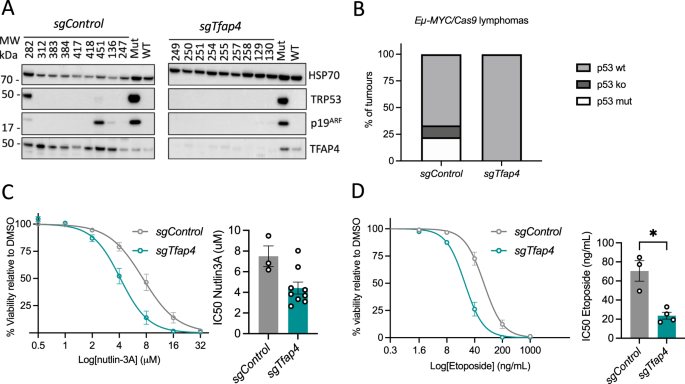
一个造血的重建的示意图表示的致命辐照与捐赠胎儿肝细胞受体小鼠,公司的丰富来源。方法从双重转基因Eµ-MYC / Cas9E13.5捐献胚胎慢病毒转导与向量编码桶形或CFP标记和sgRNAs目标Tfap4(sgTfap4),一个积极的sgRNA瞄准Trp53(sgTrp53)或负面的新控制sgRNA (sgControl)。这些转导捐助方法被移植到致命辐照C57BL / 6-Ly5.1受体小鼠。发表post-transplantation受体小鼠的生存被测量为天。造血的组织和外周血收获来自肿瘤负担受体小鼠进行进一步分析。Bkaplan meier存活曲线显示发表的生存小鼠移植两个向量包含sgTfap4积极的控制sgTrp53或消极sgControl。n表示数量的病鼠/数量的小鼠移植为每个sgRNA转导公司。中位数生存post-transplantation天在括号中表示。* * * *p< 0.0001。
所有收件人老鼠显示特点Eµ-MYC淋巴瘤病理,包括淋巴结肿大,脾脏和胸腺,升高白细胞计数(WBC)和血小板减少症(补充图。1 a, b)。小鼠的移植sgTfap4/Eµ-MYC / Cas9公司开发的淋巴瘤速度稍微放缓比老鼠被移植sgTrp53转导Eµ-MYC / Cas9公司(中位数生存的sgTfap41 = 38.5天;sgTfap42 = 45.5天vs。sgTrp53= 26天),但明显快于小鼠移植sgControl转导Eµ-MYC / Cas9公司(112.5天)(图。1 b)。这个发现确认删除Tfap4明显加速c-MYC-driven便。
TFAP4不足Eµ-MYC淋巴瘤是不选择TRP53缺陷的途径
自~ 25%的淋巴瘤,自发发展Eµ-MYC转基因小鼠显示TRP53通路中的缺陷,我们检查了sgTfap4/Eµ-MYC / Cas9淋巴瘤,TFAP4蛋白质缺席,TRP53通路的异常和比较他们的sgControl / Eµ-MYC / Cas9淋巴瘤(无花果。2)。有趣的是,未发现TRP53通路改变的sgTfap4/Eµ-MYC / Cas9淋巴瘤测试通过免疫印迹TRP53和p19 / ARF蛋白质的水平(高水平的这些突变的蛋白质是一个指标Trp53基因和/或TRP53通路缺陷)(图2 a, B)[28]。这与sgControl / Eµ-MYC / Cas9淋巴瘤细胞株,其中~ 30%表现出TRP53通路使用此分析畸变。评估TRP53通路的功能,我们从主要生成的细胞系sgTfap4/Eµ-MYC / Cas9和sgControl/Eµ-MYC / Cas9淋巴瘤,并演示了通过流式细胞术,他们很容易被nutlin-3A治疗(药物激活TRP53通过阻断其主要负面调节器MDM2 [29日)(图2摄氏度),能损伤dna的化疗药物依托泊苷(无花果。二维),还可以通过激活TRP53[杀死淋巴瘤细胞30.]。总的来说,这些数据表明TFAP4损失减少的选择压力Eµ-MYC淋巴瘤收购TRP53肿瘤抑制基因通路中的缺陷。
一个免疫印迹分析sgTfap4/Eµ-MYC / Cas9和sgControl/Eµ-MYC / Cas9主要淋巴瘤TRP53 p19 / ARF, TFAP4和HSP70(蛋白质加载控制)。污点包括积极的和消极的控制细胞溶解产物突变(狗)和野生型(WT) TRP53。分子量标记所示kDa。B总结图代表的比例sgTfap4/Eµ-MYC / Cas9(n= 9)和sgControl/Eµ-MYC / Cas9(n= 9)淋巴瘤在TRP53通路缺陷为西方墨点法评估TRP53和p19 / ARF。TRP53 wt决定缺乏可检测蛋白表达TRP53和p19 / ARF。TRP53淘汰赛(ko)确定没有检测到TRP53 p19 / ARF的蛋白表达与高表达。突变TRP53被高水平表达TRP53和p19 / ARF的蛋白质。细胞生存能力响应曲线和相应的IC50图表sgTfap4 / Eµ-MYC / Cas9和sgControl / Eµ-MYC / Cas9淋巴瘤细胞株在治疗后24小时显示剂量nutlin-3A (C)或依托泊苷(D)。细胞生存能力是由流式细胞术;活细胞的膜联蛋白V /π双重否定。数据代表比例意味着生存的淋巴瘤细胞株在每个剂量(sgControln= 3,sgTfap4n= 4 - 9日)。数据日志和合身的非线性回归均值±SEM。IC50值计算使用棱镜Graphpad软件。每个点代表一个独立的淋巴瘤细胞株;误差线代表的意思是±SEM。双尾学生的t测试中,*p< 0.05。
TFAP4缺陷不会改变依赖pro-survival bcl - 2家族成员
避免细胞死亡是一种癌症的标志(31日),这通常是通过异常表达的增加pro-survival bcl - 2家族成员(32]。Eµ-MYC淋巴瘤细胞通常依赖于pro-survival bcl - 2家族成员mcl1的持续生存(24,33]。我们检查的反应sgTfap4/Eµ-MYC / Cas9和sgControl/Eµ-MYC / Cas9淋巴瘤细胞株BH3模拟药物abt - 199 / Venetoclax [34]或S63845 [35bcl - 2抑制或mcl1,分别。没有观察之间的细胞生存能力的差异sgTfap4vs。sgControl / Eµ-MYC / Cas9治疗细胞以24小时的治疗这些代理通过流式细胞术(补充图。2 a - c)。这些发现表明,缺乏TFAP4加速c-MYC-driven淋巴瘤发展机制除了改变依赖这些恶性细胞的选择pro-survival bcl - 2蛋白。
TFAP4损害的分化Eµ-MYC转基因在前B阶段B淋巴细胞
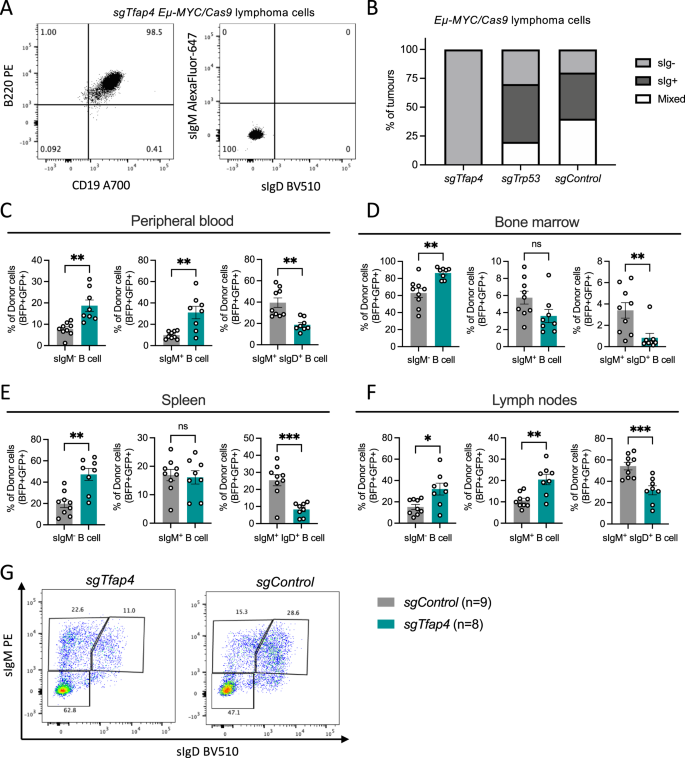
有趣的是,我们发现sgTfap4 / Eµ-MYC / Cas9淋巴瘤细胞系都代表肿瘤Ig -前b细胞表面的同行。相比之下,sgControl以及sgTrp53 Eµ-MYC / Cas9淋巴瘤组成的混合团体-前B淋巴瘤和团体积极B细胞淋巴瘤(无花果。3 a, B)。这表明没有TFAP4驱动器转换在B细胞发育的早期阶段。有助于更好地理解TFAP4如何删除c-MYC-driven淋巴瘤发展,pre-leukaemic分析进行,受体小鼠移植sgTfap4或sgControl转导Eµ-MYC / Cas9公司post-transplantation收获3周,时间点早在便B淋巴细胞时,没有完全改变了。骨髓、脾脏、胸腺、淋巴结和外周血被流式细胞术分析来确定比例的各种B和T淋巴细胞和骨髓细胞的子集。没有观察到的差异之间的造血组织细胞结构sgTfap4 / Eµ-MYC / Cas9与sgControl / Eµ-MYC / Cas9组(补充图。3)。此外,供者细胞携带的贡献Cas9(GFP阳性)和sgRNA(津贴计划”积极)之间的可比性sgTfap4 / Eµ-MYC / Cas9与sgControl/Eµ-MYC / Cas9公司所有造血的移植组组织检查(补充图。3 b)。然而,这些车厢并没有完全由转导捐赠公司衍生细胞。这可以解释,因为:(1)并不是所有的Cas9-GFP供体细胞进行sgRNA-BFP由于感染捐赠公司的效率;(2)不是所有的宿主细胞从受体小鼠的造血的组织清除检查3周post-transplantation供者细胞。后者为T淋巴细胞和粒细胞表现得尤为明显:只有一小部分捐赠这些细胞类型派生(补充图。3 c, d)。因此,评估的影响Tfap4删除在不同的细胞类型,只有sgRNA / Cas9双重表达(桶形+绿色荧光蛋白+)Eµ-MYC细胞被检查。
一个代表B220流式细胞术块表面染色,CD19, IgM IgDsgTfap4 / Eµ-MYC / Cas9淋巴瘤细胞株。B总结图表面Ig染色流式细胞术的细胞系来源于Eµ-MYC / Cas9每个基因型的主要淋巴瘤;sgTfap4(n= 10),sgTrp53(n= 20)和sgControl(n= 5)。团体−代表B220+sIgM−sIgD−淋巴瘤;团体+代表B220+sIgM+/ sIgD+淋巴瘤;和混合表明B220+与sIgM淋巴瘤细胞−和sIgM+淋巴瘤细胞群。致命辐照野生型老鼠重组Eµ-MYC /Cas9方法与一个传导sgTfap4或者一个sgControl向量。在这些移植小鼠造血细胞子集在3周post-transplantation通过流式细胞术分析。捐赠派生(GFP的百分比+桶形+)B细胞子集;sIgM−(B220+sIgM / sIgD−),不成熟sIgM+B细胞(B220+sIgM+sIgD−)和成熟sIgM+/ sIgD+B细胞(B220+sIgM / sIgD+外周血中)(C),骨髓(D)、脾(E),淋巴结(F)的受体小鼠确定。G代表流式细胞术点阴谋检查不同的B细胞的子集,封闭的直播供体淋巴细胞GFP派生而来+桶形+CD45.2+B220+。数据呈现意味着±SEM,每个点代表一个单独的接收鼠标被移植sgTFAP4 / Eµ-MYC / Cas9(n= 8)或sgControl / Eµ-MYC / Cas9(n= 9)方法。未配对的双尾学生的t测试与韦尔奇的校正,*p< 0.05,* * * * * < 0.01,< 0.001。
外周血、骨髓、脾脏和淋巴结显示B细胞室之间的显著差异sgTfap4 / Eµ-MYC / Cas9与sgControl/Eµ-MYC / Cas9公司移植组。我们发现更高比例的表面Ig - pro-B /前b细胞(B220+sIgM−sIgD−)和减少比例的成熟B细胞(B220+团体+)sgTfap4 / Eµ-MYC / Cas9pre-leukaemic接受者老鼠相比sgControl / Eµ-MYC / Cas9同行(图。3 c g)。在外周血和淋巴结sIgM的比例增加+B细胞观察,可能是因为成熟B细胞循环这些外围淋巴组织和骨髓和脾脏相比,B细胞发育和成熟的网站,分别。这种积累pro-B /前b细胞sgTfap4 / Eµ-MYC / Cas9pre-leukaemic接受者与恶性淋巴瘤的immuno-phenotyping一致产生在这些老鼠(无花果。3 a, B)。
TFAP4删除pre-leukaemicEµ-MYC前B细胞无法上调转录项目所需的B细胞分化
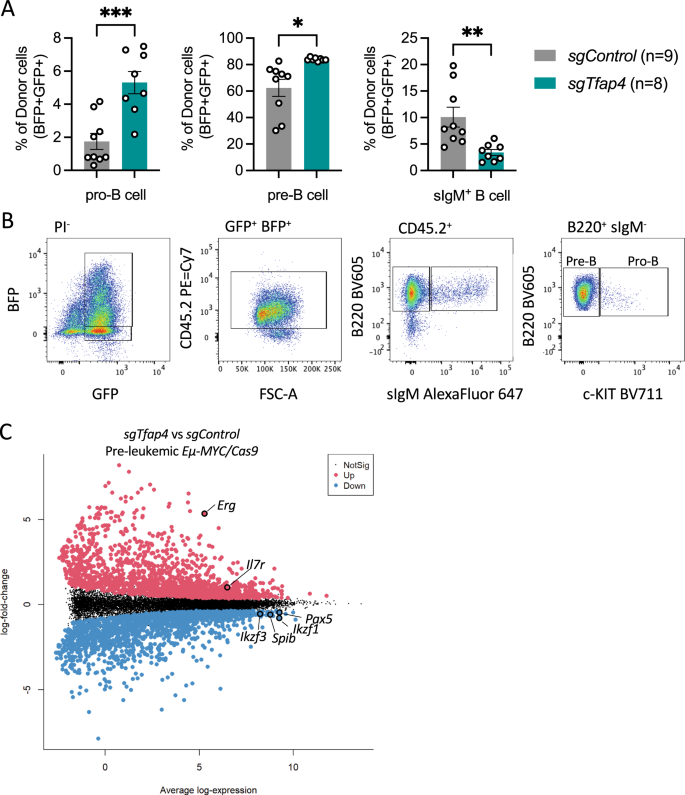
TFAP4转录监管机构,我们下一个试图了解其损失可能会改变细胞信号通路来加速c-MYC-driven淋巴瘤发展。为此我们研究了B细胞在骨髓中子集,B细胞的发展,通过流式细胞术pre-leukaemic接受者老鼠。我们观察到显著减少的百分比捐赠者成熟B细胞(B220派生而来+sIgM+sIgD+)和增加pro-B (B220+sIgM−cKIT+)和前b细胞(B220+sIgM−cKIT−)sgTfap4/Eµ-MYC/ Cas9受体小鼠相比sgControl / Eµ-MYC(图/ Cas9控制收件人老鼠。4)。
致命辐照受体小鼠重组Eµ-MYC / Cas9方法,并与一个向量编码sgTfap4或者一个sgControl,他们在3周post-transplantation pre-leukaemic细胞进行分析。一个在骨髓,pro-B细胞的百分比,前B细胞和成熟B细胞来自供体(GFP+桶形+)方法测定流量仪分析。数据意味着±SEM,每个点代表一个单独的接收鼠标被移植sgTfap4(n= 8)或sgControl(n= 9)转导Eµ-MYC / Cas9方法。未配对的双尾学生的t测试与韦尔奇的校正,*p< 0.05,* * * * * < 0.01,< 0.001。B代表流式细胞术情节示威的控制策略来识别不同的供体(GFP派生而来+桶形+CD45.2+)B细胞在受体小鼠的骨髓子集:pro-B (B220+sIgM−c - kit+),前b (B220+sIgM−c - kit−),不成熟的B (B220+sIgM+)细胞。C平均差情节展示log-fold变化(平均每组)和显著突出的差异表达基因(罗斯福< 0.05),红=上调,蓝=衰减。一些感兴趣的基因标签从RNA-seq分析捐赠pre-leukaemic派生而来Eµ-MYC / Cas9前b细胞(绿色荧光蛋白+桶形+B220+sIgM−c - kit−)sgTfap4 / Eµ-MYC / Cas9(n= 8)或sgControl / Eµ-MYC / Cas9(n= 6)军团与受体小鼠的骨髓。
我们孤立的捐赠者派生pre-leukaemic前b细胞(GFP+桶形+B220+sIgM−cKIT−sg)Tfap4 / Eµ-MYC / Cas9收件人老鼠和sgControl / Eµ-MYC/ Cas9控制同行(图。4 b)和分析他们的转录RNA-sequencing计划。因为完全改变了Eµ-MYC淋巴瘤的单克隆他们只能表达一个搞笑的物种。我们的分析显示,pre-leukaemicsgTfap4 / Eµ-MYC / Cas9和sgControl / Eµ-MYC / Cas9前b细胞表达各种搞笑的记录,确认我们分析没有完全转化的细胞(补充图。4)。缺乏TFAP4明显改变了转录pre-leukaemic的概要文件Eµ-MYC前b细胞(补充图。4 b)。总共有3218个基因之间的差异表达sgTfap4 / Eµ-MYC / Cas9vs。sgControl / Eµ-MYC / Cas9pre-leukaemic前b细胞(图。4摄氏度)。进一步分析发现许多差异表达基因标志设置路径,比如MYC(调节TFAP4 [9])或TRP53(间接受到TFAP4在人类细胞(36,37])通路(补充图。4摄氏度)。
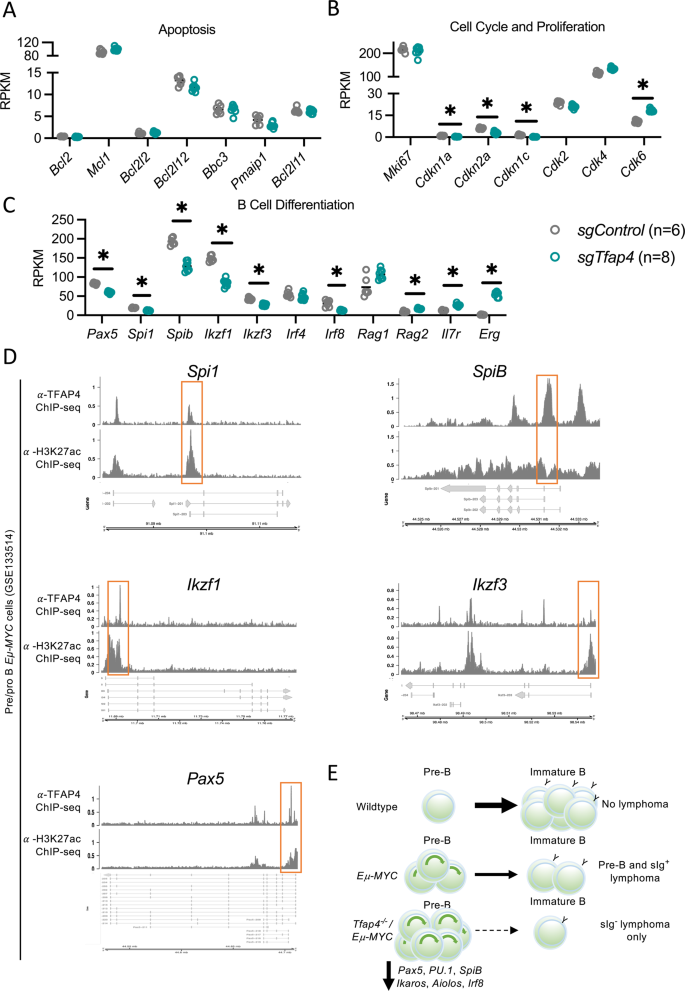
阐明失去TFAP4 c-MYC-driven淋巴瘤发展的贡献我们比较基因的表达在一定的标志癌症通路TFAP4报道规范。符合体外细胞死亡化验使用BH3模拟药物针对bcl - 2或mcl1恶性Eµ-MYC淋巴瘤细胞,我们观察到没有任何的差异表达的基因bcl - 2家族成员(无花果。5)。突变TFAP4已经在某些固体癌症与细胞增殖异常(8]。我们观察到没有表达的差异Mki67(又名Ki67),细胞分裂的一个标志,只有轻微的减少细胞周期基因(Cdkn1、Cdkn2a Cdkn1c)(这些都是已知的目标基因MYC和TFAP4 [38,39)之间的sgTfap4 / Eµ-MYC / Cas9与sgControl / Eµ-MYC / Cas9pre-leukaemic前b细胞(图。5 b)。这表明增加细胞增殖的机制不是失去TFAP4加速c-MYC-driven淋巴瘤发展。
致命辐照受体小鼠移植Eµ-MYC / Cas9方法,并包含一个和一个向量sgTfap4(n= 8)或sgControl(n= 6),这些受体小鼠的pre-leukaemic前b细胞分析在3周post-transplantation RNA-sequencing。相对表达式(每千碱基百万RPKM-reads)选择基因的转录调节细胞凋亡(一个),细胞循环和扩散(B),或者主人转录因子和B细胞分化以及协调员Erg(C)。统计学意义* adj。p< 0.05,罗斯福< 0.05。DSpi1,SpiB,Ikzf1, Ikzf3和Pax5基因组位点覆盖率块anti-TFAP4和anti-H3K27ac(标记的染色质)在pre-leukaemic绑定Eµ-MYCpro /前b细胞。Y设在代表计数每百万(CPM),基因亚型见厚栏表明外显子,橙色盒子绑定。数据从GSE133514访问(20.]。E提出的机制:在野生型小鼠正常B细胞发生发展,即前B细胞分化为成熟的B细胞表面表达IgM。在Eµ-MYC转基因老鼠,原癌基因异常在B细胞谱系造成pro-B /前B细胞的过度增殖和分化部分阻塞,从而产生异常扩大池pre-leukaemic前B细胞和一些团体+B细胞。这些细胞将收购致癌突变,可以与原癌基因表达在肿瘤转换,从而产生前B和B细胞淋巴瘤。TFAP4的缺失Eµ-MYC设置的结果在一个更大的游泳池pre-leukaemic前B细胞产生的差别由于分化的进一步限制对这些转录因子的B细胞分化的关键。这个更大的高度增殖pre-leukaemic前b细胞因此更有可能获得额外的驱动转变成恶性突变表面搞笑−前b细胞淋巴瘤。
我们的immuno-phenotyping pre-leukaemic分析和恶性的Eµ-MYC淋巴瘤细胞显示没有TFAP4导致前B细胞的积累,指示一个街区在B细胞发展的可能原因加速c-MYC-driven便。因此,我们的主基因的表达编码转录监管机构评估B细胞分化。有趣的是,sgTfap4 / Eµ-MYC / Cas9pre-leukaemic前b细胞低水平的表达Pax5,主调节器的B细胞谱系规范(无花果。5度)。此外,我们观察到的减少Spi1(PU.1),SpiB、Irf8 Ikzf1 (伊卡洛斯),Ikzf3(艾俄洛斯),基因协调共同淋巴祖细胞的分化成pro-B前B和不成熟的B细胞(图。5度)[40]。有趣的是,之前报道TFAP4 ChIP-sequencing pre-leukaemic数据集Eµ-MYC赞成/前b细胞(20.]证明直接绑定TFAP4的推动者Ikzf1、Ikzf3 Spi1 SpiB和Pax5基因(图。5 d)。值得注意的是,这些基因(数据不能用于Spi1)也直接MYC目标基因(41]。这些发现表明,缺乏TFAP4损害高度增殖的分化Eµ-MYCpre-leukaemic前B细胞的转录因子通过减少水平B细胞分化(图的关键。5 e)。
讨论
Tfap4直接原癌基因的目标基因,据报道,导致某些原癌基因调控细胞过程,包括细胞凋亡、细胞增殖和细胞衰老42]。感应的Tfap4由原癌基因协调这些流程已经涉及到几种固体癌症肿瘤的转换(8]。这对比我们发现,不是表达而是TFAP4缺失的情况下,通过CRISPR / Cas9介导的删除、加速c-MYC-driven便。在c-MYC-driven淋巴瘤发展的背景下,失去TFAP4不改变细胞凋亡和细胞增殖,基因调节这些过程是不会在缺乏TFAP4 pre-leukaemic前b细胞差异表达。然而,我们观察到的异常表达降低B细胞分化的关键转录因子,包括Ikzf1、Ikzf3 Spi1 SpiB和Pax5。这表明TFAP4缺乏加速淋巴瘤发展影响B细胞分化,代表一个新兴癌症的标志(31日]。值得注意的是,Tfap4删除自己在整个有机体或专门在B淋巴细胞不驱动肿瘤发生。(9,20.]。初步实验删除TFAP4公司和移植到致命辐照动物同样没有造成任何恶性增长(数据未显示)。
最近,Tonc et al。20.)表明,TFAP4经常突变在人类成熟的B细胞恶性肿瘤。此外,他们表明,儿科患者B祖细胞急性淋巴细胞白血病(B)显示TFAP4低/MYC-表达总体存活率相比表现出更糟TFAP4-/ MYC-表达式。此外,本研究发现的损失Tfap4一个等位基因或等位基因,加速c-MYC-driven小鼠淋巴瘤发展。这项工作是由雇佣两个全身Tfap4淘汰赛以及条件Tfap4基因敲除小鼠模型了Eµ-MYC转基因小鼠以及与其他原癌基因驱动淋巴恶性肿瘤的小鼠模型。和我们的研究结果一致,所有肿瘤Tonc等人发现在他们Tfap4−−/Eµ-MYC老鼠pro-B /前b细胞淋巴瘤。然而,他们pre-leukaemic分析使用Tfap4+ /−Eµ-MYC小鼠没有表现出不同的细胞内不同的B细胞的数量(子集20.]。区别他们的发现,我们的观察可能是由于不同的模型系统。在我们的例子中,使用CRISPR / Cas9结果完全删除Tfap4明显的损失TFAP4蛋白质(图。2),而pre-leukaemic细胞Tonc等人研究了保留的一个等位基因Tfap4,尽管其中一些细胞选择失去第二个等位基因,强调有强有力的选择失去Tfap4在c-MYC-driven淋巴瘤发展。尽管不是观察不同比例的B细胞分化的不同阶段的子集pre-leukaemic老鼠,Tonc et al。20.]认为TFAP4限制具备干细胞调节B细胞的原癌基因,因为他们发现的upregulationErgTFAP4的直接目标基因,调节具备干细胞造血的。同时我们也观察到的水平的提高Erg在sgTfap4 / Eµ-MYC / Cas9pre-leukaemic RNA-seq分析前b细胞(图5C),我们指出减少几个主监管机构的B细胞分化。我们观察到异常的表达减少Spi1(PU.1),SpiB,Ikzf1(伊卡洛斯),Ikzf3(艾俄洛斯)sgTfap4 / Eµ-MYC / Cas9pre-leukaemic前b细胞;这些都是直接目标TFAP4和MYC基因(41]。这些基因正常B细胞发展的贡献和影响的缺陷在他们表达特征(审阅彭日成et al。40])。有趣的是,删除Spi1(PU.1)或SpiB影响B细胞分化,老鼠缺乏这些转录监管机构发展B (43,44]。此外,损失Ikzf11(伊卡洛斯)或Ikzf3(艾俄洛斯)与b在小鼠和人类的发展(40,45,46]。Pax5删除已被证明,以防止pro-B以外的B细胞分化细胞阶段(40),其可拆卸的驱动器的发展b由于分化块(47]。因此我们建议TFAP4分化所需的原癌基因过度表达前b细胞的转录调控Spi1,SpiB,Ikzf1, Ikzf3和Pax5。这些基因的激活TFAP4的缺失造成的,结合异常的原癌基因表达、防止正常B细胞分化导致的增加的高度增殖pro-B /前B细胞促进收购致癌病变,配合管制原癌基因表达便(无花果。5 e)。因此,恢复TFAP4表达原癌基因驱动血液癌症,可能改善疾病进展,不通过杀死肿瘤细胞,但通过诱导自我更新前B淋巴瘤细胞池的正常分化为少增生性不成熟/成熟的B细胞,但只有当这些细胞是依赖于持续缺乏TFAP4淋巴瘤不仅维护和淋巴瘤发展。
数据可用性
RNA-sequencing数据已经沉积在NCBI-GEP加入GSE225684数量。
引用
弘水谷,Potts马,邓Y,杜松子酒G, Diepstraten年代,Kueh AJ, et al .全基因组在活的有机体内CRISPR屏幕GATOR1标识为TP53诱导肿瘤抑制基因。bioRxiv。2022年。https://doi.org/10.1101/2022.02.16.480657。
见鬼的履历。MYC道路上癌症。细胞。2012;149:22-35。
Haluska FG, Finver年代,Tsujimoto Y, Croce厘米。t (8;14)染色体易位发生在b细胞恶性肿瘤在V-D-J加入结果错误。大自然。1986;324:158 - 61。
亚当斯JM,哈里斯啊,Pinkert CA,科克兰LM,亚历山大•WS科里年代,等。原癌基因致癌基因的转基因小鼠的免疫球蛋白增强剂诱发淋巴恶性肿瘤。大自然。1985;318:533-8。
兰登王寅,哈里斯啊,科里,亚当斯JM。原癌基因的致癌基因扰乱E-mu-myc转基因小鼠的B淋巴细胞发展。细胞。1986;47:11-8。
哈里斯啊,Pinkert CA,克劳福德M,兰登王寅,Brinster RL,亚当斯JM。E mu-myc转基因老鼠。高发病率的模型自发的早期B细胞淋巴瘤和白血病。J Exp。1988; 167:353 - 71。
Mermod N,威廉姆斯TJ Tjian r .增强器绑定因素AP-4和AP-1一致行动体外转录激活SV40晚。大自然。1988;332:557 - 61。
黄MM,杰森SM, Hermeking H,赵SK。转录因子AP4介导细胞命运决定:分裂,年龄,或死亡。癌症(巴塞尔)。2021;13。
周C, Verbaro DJ, Tonc E, Holmgren M,内堂,尹浩然,报摊。慢性病毒感染的转录因子AP4调和决议通过放大的生发中心B细胞反应。免疫力。2016;45:570 - 82。
胡锦涛BS,赵G,陈于高频,K,董JH, Tan JW。高表达的AP-4预测治疗肝切除术后肝细胞癌预后不佳。肿瘤医学杂志。2013;34:271-6。
杨魏J, P,张T,陈Z,陈W,王林L, et al。超表达的转录因子激活剂结合蛋白4 (TFAP4)预测结直肠癌患者预后不良。经验医学。2017;14:3057 - 61。
陈年代,赵SK。AP4激活细胞迁移和EMT由p53在mda - mb - 231乳腺癌细胞。摩尔细胞。2015;407:57 - 68。
Jaeckel年代,粗铁M, Jackstadt R, Gotz U,穆勒,嘘声,et al . Ap4是肠道肿瘤的形成速率限制通过控制肠道干细胞的体内平衡。Nat Commun。2018; 9:3573。
李施L, Jackstadt R,西门子H, H,基什内尔T, Hermeking H . p53诱导miR-15a /启用和AP4形成一个双重否定反馈回路调节epithelial-mesenchymal过渡,在结直肠癌转移。实用癌症杂志2014;74:532-42。
梁郭刘备B, X, Y, Q,吴,吴L, et al .下调AP-4抑制增殖、诱导细胞周期阻滞和促进人类胃癌细胞凋亡。PLoS ONE。2012;7:e37096。
雪C DM, Gherardi年代,Koach J, Milazzo G,赌博L, et al . MYCN促进神经母细胞瘤恶性肿瘤通过建立监管与转录因子AP4电路。Oncotarget。2016; 7:54937-51。
Banerjee Boboila年代,洛佩兹G, Yu J D, Kadenhe-Chiweshe, Connolly EP, et al .转录因子激活蛋白质综合4是致命的,主调节器MYCN-amplified神经母细胞瘤。致癌基因。2018;37:5451 - 65。
沈黄T,陈QF, Chang, LJ,李W,吴PH值,et al . TFAP4促进肝细胞癌侵袭转移通过激活PI3K / AKT信号通路。Dis标记。2019;2019:7129214。
他W,陈C,蔡问林结核病,林J,赵Y, et al . AP4调制的PI3K / AKT途径促进前列腺癌前列腺癌的扩散和转移通过上调L-plastin。细胞死亡夺去2017;8:e3060-60。
竹内Tonc E, Y,周C,夏Y, Holmgren M,藤井裕久C, et al。意想不到的抑制肿瘤发生的原癌基因通过TFAP4-dependent限制具备干细胞在B淋巴细胞。血。2021;138:2526-38。
Kaymaz Y,欧德CI, Yu H, Otieno是的,Ong 'echa JM, Moormann点,等。全面的转录组和突变分析特有的伯基特淋巴瘤揭示EBV特定类型的差异。摩尔癌症研究杂志2017;15:563 - 76。
Grande BM, Gerhard DS,江泽民,笑容NB,艾布拉姆森JS,亚历山大•结核病等。全基因组发现体细胞编码和非编码基因突变在儿科流行和零星的伯基特淋巴瘤。血。2019;133:1313-24。
罗德洛佩兹C, Kleinheinz K, Aukema SM, M,伯恩哈特SH, Hubschmann D, et al。基因组和转录组的变化是相辅相成的零星的伯基特淋巴瘤的发病机制。Nat Commun。2019; 10:1459。
凯莉GL, Grabow年代,格拉泽SP,菲茨西蒙斯L,奥布里BJ, Okamoto T, et al。针对mcl1杀死MYC-driven老鼠和人类淋巴瘤即使他们承担p53的突变。基因Dev。2014; 28:58 - 70。
赫罗德MJ, van den布兰德J,由J, Reichardt嗯。诱导稳定的集成和可逆的基因沉默的shRNA-encoding慢病毒在转基因老鼠。《美国国家科学院刊。2008;105:18507-12。
Janic,瓦伦特LJ,韦克菲尔德MJ, Di Stefano L,米拉L, Wilcox年代,et al。DNA修复过程是p53-dependent肿瘤抑制的关键调解人。Nat医学。2018;24:947-53。
奥布里BJ,凯利GL, Kueh AJ,布伦南女士,奥康纳L,米拉L,等。一个诱导慢病毒指导RNA平台使tumor-essential基因和肿瘤促进体内突变的识别。细胞众议员2015;10:1422-32。
Eischen厘米,韦伯JD, Roussel MF谢尔CJ,克利夫兰杰。中断myc诱发ARF-Mdm2-p53肿瘤抑制通路的便。基因Dev。1999; 13:2658 - 69。
Vassilev LT, Vu BT,坟墓B, Carvajal D, F Podlaski, Filipovic Z, et al .体内激活p53通路MDM2的小分子拮抗剂。科学。2004;303:844-48。
摩根,哈里斯啊,杰克T,科里s DNA损伤可以通过p53-independent增殖淋巴细胞中诱导细胞死亡机制的制约,bcl - 2。细胞。1994;79:329-39。
Hanahan d .癌症的标志:新维度。癌症。2022;12:31-46。
摩根,哈里斯啊,浴毫升,科里美国小说原始淋巴肿瘤诱导转基因老鼠的合作myc和bcl - 2。大自然。1990;348:331-3。
坎贝尔KJ,浴毫升,特纳ML,范登堡CJ Bouillet P·D,等。高mcl1扰乱淋巴细胞增殖,促进造血干/祖细胞,转化和提高耐药。血。2010;116:3197 - 207。
罗伯茨啊,戴维斯女士,由此JM,卡尔BS, Puvvada SD, Gerecitano摩根富林明,等。针对BCL2 venetoclax在慢性淋巴细胞白血病复发。郑传经地中海J。2016; 374:311-22。
Kotschy, Szlavik Z,穆雷J,戴维森J, Maragno, Le Toumelin-Braizat G, et AL . MCL1抑制剂S63845不同癌症模型中是可容忍的和有效的。大自然。2016;538:477 - 82。
黄问,莱雅德P,曹国伟SH, Quon KC,考德威尔JS, et al。p53监管机构通过全基因组功能分析的识别。《美国国家科学院刊。2004;101:3456 - 61。
Ku WC,赵SK,陈YJ黄HH,吴工作组,陈YJ。互补的定量蛋白质组学表明,转录因子AP-4介导转录镇压HDM2 E-box-dependent复杂地层。摩尔细胞Proteom。2009; 8:2034-50。
Jackstadt R,荣格P, Hermeking h . AP4直接会使p16和p21抑制衰老以及调节转变。细胞死亡夺去2013;4:e775。
荣格P, Menssen,娃D, Hermeking h . AP4编码c-MYC-inducible p21的阻遏。《美国国家科学院刊。2008;105:15046-51。
彭日成SH Carotta年代,纳特SL。转录控制前b细胞发育和预防白血病。咕咕叫顶级Microbiol Immunol。2014; 381:189 - 213。
Sabo,克雷斯TR,裴里荣拉M, de Pretis年代,Gorski MM, Tesi, et al .选择性Myc基因转录调控的细胞增长控制,便。大自然。2014;511:488 - 92。
荣格P Hermeking h . c-MYC-AP4-p21级联。细胞周期。2009;8:982 - 89。
Sokalski公里,李SKH,韦尔奇我Cadieux-Pitre h, Gruca先生,DeKoter RP。删除基因编码PU.1和Spi-B B细胞损害分化和诱导前B细胞急性淋巴细胞白血病。血。2011;118:2801-8。
徐LS, Sokalski公里,Hotke K,克里斯蒂哒,Zarnett O, Piskorz J, et al . B细胞连接蛋白转录调节PU.1和Spi-B小鼠B细胞急性淋巴细胞白血病。J Immunol。2012; 189:3347-54。
米勒Mullighan CG Goorha年代,Radtke我,CB, Coustan-Smith E,道尔顿JD, et al。全基因组分析急性淋巴细胞白血病的基因改变。大自然。2007;446:758 - 64。
张Mullighan CG,苏X, J, Radtke我,菲利普斯LAA,米勒CB, et al .删除IKZF1和急性淋巴细胞白血病预后。郑传经地中海J。2009; 360:470 - 80。
刘GJ, Cimmino L,裘德詹,Y, Witkowski MT,麦肯齐博士et al . Pax5损失强加一个可逆分化块B-progenitor急性淋巴细胞白血病。基因Dev。2014; 28:1337-50。
确认
作者感谢WEHI筛查实验室提供排列甘油sgRNAs库存;美国威尔科克斯博士执行门店;Drs美国纳特和a·凯莉深刻的讨论。我们感谢WEHI Bioservices员工d·福伊尔g .西西里岛舞蹈c Epifanio和c .关贸总协定的动物保健和畜牧业;t . Nikolaou照射的小鼠和ADVIA服务;WEHI核心设施与流式细胞术和生物信息学支持和帮助我们的同事在哈罗德,摩根和凯利实验室与实验寻求建议和支持。这项工作是支持的助学金和奖学金的澳大利亚国家卫生和医学研究委员会(NHMRC)(项目拨款1159658,1159658,1143105,1145728 MJH一样,想法赠款项目授予1113133的奖学金1113133,1156095 MJH),美国白血病和淋巴瘤学会(再保险公司7015 - 18前和MJH),维多利亚癌症委员会的(项目拨款1147328和2021 MJH补助金,1052309和风险格兰特MJH), Phenomics澳大利亚(来自自由克什米尔及MJH)。地图是由澳大利亚政府研究训练计划奖学金由澳大利亚联邦政府提供和墨尔本大学。SM是Uehara纪念基金会和jsp支持的研究补助金活动启动(20 k22854)。这个项目由运营基础设施赠款支持通过澳大利亚政府独立研究所基础设施支持计划(361646和9000220)和维多利亚州政府运营基础设施支持计划。
资金
开放获取资金启用并由胎膜组织及其成员机构。
作者信息
作者和联系
贡献
和MJH构思和设计研究。地图表现和分析实验,从SM贡献,来自自由克什米尔,LT和MP。ALG和CLWS RNA-seq数据的生物信息学分析。地图,手稿和MJH写道。所有作者编辑和促成了手稿。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Potts,硕士,Mizutani, S., Garnham, A.L.et al。删除的转录监管机构TFAP4加速c-MYC-driven便。细胞死亡是不同的30.,1447 - 1456 (2023)。https://doi.org/10.1038/s41418 - 023 - 01145 - w
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41418 - 023 - 01145 - w