摘要
胃癌是世界范围内的高发癌症。大多数患者被诊断为晚期,此时他们的治疗选择有限,预后不良。早期诊断和精确治疗很重要。近年来,利用无创液体活检技术,以其微创、重复采样等优点,实时监测肿瘤发生和复发情况,评估预后和治疗效果的研究也不断涌现。许多研究已经证明了液体活检在GC中的潜力,在循环肿瘤细胞(CTCs)、循环肿瘤DNA (ctDNA)、循环游离DNA (cfDNA)和外泌体的检测方面取得了令人满意的结果。在这篇综述中,我们总结了关于液体活检技术的发展和信息,最近发现的GC液体活检生物标志物,以及正在进行的临床试验,并讨论了液体活检在GC中的挑战和应用前景。
事实
- 1.
液体活检,包括循环肿瘤细胞、循环肿瘤DNA和外泌体rna,是癌症诊断、预后和治疗监测的新靶点。
- 2.
液体活检通过检测表面生物标志物、DNA甲基化和染色体缩写,在癌症诊断和预后方面具有更高的敏感性和特异性。
- 3.
开展了胃癌液体活检的临床试验,并取得了一定进展。
开放式的问题
- 1.
在胃癌患者中应用液体活检的临床标准是什么?
- 2.
胃癌诊断、预后和治疗监测最有效的靶点是什么?
- 3.
是否会有新的检测技术和靶点使液体活检更方便、更经济、更准确?
简介
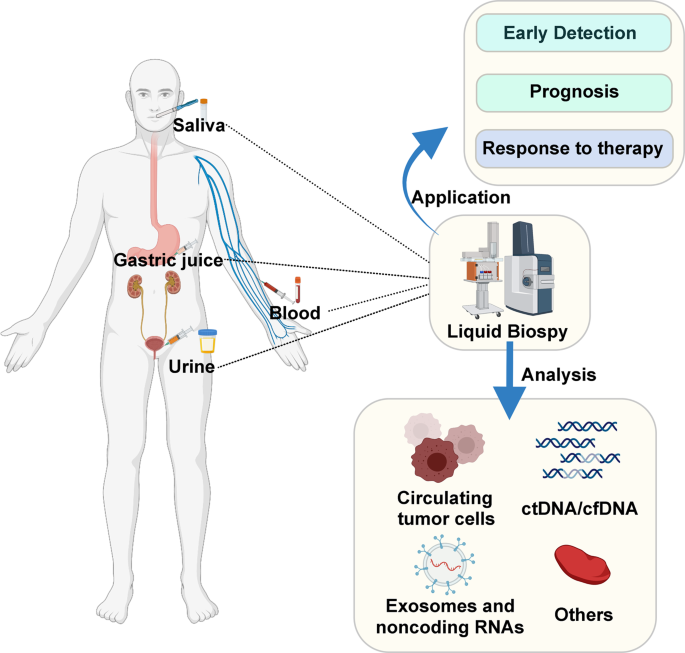
胃癌(GC)是最常见的癌症之一,是全球癌症死亡的第三大原因,全球每年有超过100万患者被诊断患有胃癌[1].目前,GC患者的主要治疗方法是手术和全身化疗;此外,放射治疗、免疫治疗和靶向治疗也逐渐被应用。2],但胃癌患者的5年生存率仍不能令人满意。因此,早期发现GC对GC的治疗和预后起着至关重要的作用[3.].GC的诊断主要基于影像学和病理活检[4].然而,影像学不能用于实时监测肿瘤并使患者暴露于辐射中,病理活检是一种侵入性检查,会给患者带来不适。相比之下,液体活检越来越被认为是GC诊断、治疗和实时监测的工具[5(图。1).液体活检作为一种无创的检测方法,在一定程度上可以取代传统的有创物理活检。尽管它有许多优点,但在分析中也存在一定的局限性和困难。因此,对于不良后果高风险的GC患者来说,一种高灵敏度的新技术是必要的。
近年来,有几篇文章详细总结了液体活检在几种癌症中的作用,如肝细胞癌[6]、胰腺癌[7]、非小细胞肺癌[8]和黑素瘤[9,这导致了癌症领域液体活检研究的增加。然而,在GC领域,液体活检的研究进展相对缓慢,尚未有足够质量的综述文章发表。虽然与GC相关的液体活检的研究还处于早期阶段,但近年来相关研究的数量和质量都有所提高。在这篇综述中,我们主要强调在GC中使用液体活检进行早期发现、预测和治疗反应监测的主要进展。
液体活检的组成及应用
循环肿瘤细胞(CTCs)
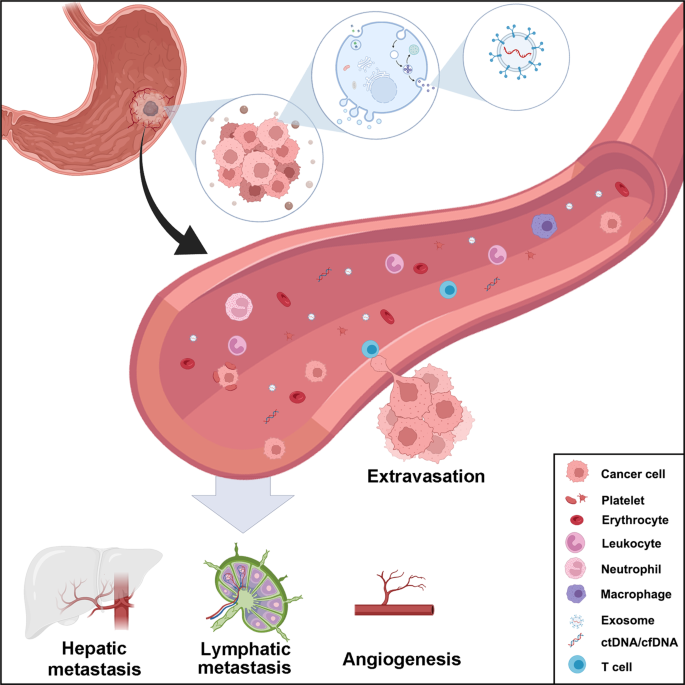
一般来说,ctc是指从原发肿瘤病灶脱落进入外周循环或通过上皮-间充质转化侵入血管的细胞[10(图。2).因此,ctc作为各种癌症的有价值的诊断、预后,甚至治疗反应和耐药性生物标志物而引起了广泛关注[11].这些细胞保存有价值的信息(图。1).ctc作为预后生物标志物在多种肿瘤中的应用已受到广泛关注。首先,测量ctc的数量。据报道,ctc可用于预测生存率和监测术后复发。例如,Pierga等研究表明,每7.5 ml血液中有超过1个CTC的乳腺癌患者无进展生存期(PFS)较短(p< 0.0001),每7.5 ml血液中ctc超过5个的患者总生存期(OS)较短[12].除了CTC的定量外,还可以通过荧光原位杂交(fluorescence In situ hybridization, FISH)检测CTC中的染色体重排,通过基因组测序检测CTC中的遗传变化,通过免疫细胞化学检测CTC蛋白表达[13].根据ctc的特点,临床医生可以选择最合适的治疗方法,治疗反应可以反映在ctc的变化上。在结直肠癌(CRC)中,单个ctc的分子分析显示突变体在患者内部和患者之间存在显著的异质性表皮生长因子受体以及与EGFR抑制相关的其他基因突变的表达,如喀斯特而且PIK3CA突变,这解释了CRC患者对egfr靶向治疗的不同反应率[14].对于去势抵抗性前列腺癌患者,治疗后ctc的数量被发现是比前列腺特异性抗原(PSA)更早用于评估治疗有效性的生物标志物[15].此外,富集的ctc可以体外培养,从而能够基于基因谱和体外ctc的新型药物敏感性测试确定个性化治疗[16].需要开发更多的临床研究和先进的CTC检测和收集技术,以实现CTC应用从实验室到床边的过渡。
通过ctc和细胞表面生物标志物进行GC诊断
由于胃癌的恶性和诊断较晚,早期发现胃癌对患者的成功治疗具有重要价值。只有少数研究集中在应用ctc作为GC的诊断标志物;然而,结果是相当令人惊讶的(表1).Yoon-Kyung Cho说,他们从115名GC患者和31名健康对照中采集了7.5毫升血液,并通过离心微流体系统分离了ctc。2个以上ctc的患者中,97.1%为GC患者,特异性为90.3%。然而,38%的GC患者每7.5 ml中ctc少于2个,这表明该方法的灵敏度有待提高[17].根据之前的一项研究,与健康对照组相比,GC患者中特异性表达了一种GC干细胞生物标志物CD44。因此,基于CD44水平高的ctc诊断GC大大降低了假阴性率。该方法灵敏度达92.3% [18].最近的一项研究表明,蛋白质酪氨酸激酶7 (PTK7),一种首次在结肠癌细胞系中发现的关键膜受体,联合上皮细胞粘附分子(EpCAM)提高了检测胃细胞系样品中CTCs的敏感性。然而,还需要做更多的研究来检验PTK7和EpCAM在血液样本中的效率[19].此外,Huang等人认为ctc与肿瘤的分化、分期等临床病理特征有显著相关性[20.].一般情况下,细胞表面的ctc被EpCAM检测到。然而,在胃癌中,一些具有高侵袭性和转移能力的ctc在细胞表面不表达EpCAM。RUBYchipTM最近开发的CTCs分离技术,根据细胞大小和变形性识别CTCs,大大提高了CTCs的捕获率[21].
通过ctc预测GC患者预后
许多研究表明,ctc是许多癌症最重要的预后生物标志物之一。在许多研究中发现了CTC计数与患者生存时间之间的显著相关性。根据7项涉及4个国家579例GC患者的调查结果,ctc与GC患者的总生存率(OS)差密切相关[22].然而,在不同的研究中,ctc的标准数量是不同的。例如,一项对72名患者的研究发现,血液中有一个以上CTC的患者无病生存期(DFS)较短,(p= 0.001), OS (p= 0.0007)高于无ctc患者[23].相比之下,7.5 mL外周血中CTCs超过5个的GC患者的无复发生存期(RFS)比CTCs少于5个的患者更差[24].此外,有报道称ctc易于聚集,形成循环肿瘤微栓塞(CTM),有利于癌症转移。ctc聚合的越多,操作系统就越差。CTM2的GC患者(由2个CTCs组成)的OS比CTM3-4的GC患者(由3-4个CTCs组成)的OS长近10个月[25].进一步的研究表明,表达特定分子的ctc是胃癌患者预后的潜在生物标志物。例如N-cadherin是与GC复发相关的标志物,根据N-cadherin+ ctc的数量,患者可被表征为具有不同的复发风险[26].同样,癌胚抗原阳性(CEA)细胞较多的胃癌患者极有可能在3年内复发[27].CD44 +细胞常见于远处转移患者的血液或骨髓中,其检测与较短的OS有关[28].CD133和ABCG2是癌症干细胞的生物标志物。发现CD133 +和ABCG2 + ctc上调的GC患者OS更短[29].此外,每7.5 ml血液中TWIST + ctc超过2.5个的GC患者的OS短于TWIST + ctc低于2.5个的患者[30.].此外,Qiu等发现与白细胞簇(CTC-WBC簇)相关的ctc是预测胃癌患者预后更敏感的标志物。CTC-WBC聚类患者的OS较无CTC-WBC聚类患者短[31].此外,ctc的基因组改变似乎也具有预后价值。特别是,每7.5 mL GC患者中存在2个8号染色体非整倍体的ctc,与短PFS和OS相关[32].综上所述,ctc是胃癌预后的重要靶点,值得进一步研究。
通过ctc预测治疗反应
与CTC阴性患者相比,CTC阳性(CTC+)患者治疗后PFS较短,疾病控制率(DCR)较低[22].但是,CTC+的定义还需要进一步明确。根据一项前瞻性研究,在化疗开始后2周和4周,ctc超过4个的患者比ctc少于4个的患者中位PFS和中位OS更低[33].另一项研究表明,化疗6周后,有4个以上ctc的患者的总有效率(ORR)、DCR和PFS明显短于ctc较少的患者[34].尽管如此,其他研究表明,血液中存在5种以上的ctc是预测治疗反应的适当临界值。5个或更多ctc的患者极有可能经历进行性疾病(PD)和较短的PFS [35].GC患者ctc可分为上皮型,表达角蛋白8、18、19和EpCAM;间充质型,表达波形蛋白和TWIST。化疗后间充质型ctc增加表明患者极有可能经历PD [36].
ctc治疗HER2 +胃癌
HER2是一种在部分GC病例中普遍上调的蛋白,被称为HER2+或HER2-放大GC,曲妥珠单抗是HER2 + GC的一线治疗方法[37].由于肿瘤的异质性,当基于组织活检进行诊断时,HER2 + GC可能被误诊为HER2- GC。当这种情况发生时,患者不能接受有效和及时的曲妥珠单抗治疗。据Mishima等报道,一种先进的3D-IF-FISH技术在检测HER2+ CTC时比传统组织活检具有更高的敏感性,通过CTC分析检测出HER2+但通过组织活检检测出HER2-的患者从曲妥珠单抗治疗中获益[38].根据mathita等人的研究,HER2 + ctc是与良好的OS和PFS相关的GC患者的独立预后标志物,无论组织学上HER2状态如何[39].此外,曲妥珠单抗治疗后HER2 + ctc数量减少,耐药时出现反弹。因此,HER2 + ctc的数量是监测曲妥珠单抗治疗有效性的有用工具[40].曲妥珠单抗的先天耐药可能是由PIK3CA突变,而获得性耐药可由突变引起PIK3R1或PIK3C3或者突变HER2.因此,HER2 + CTC患者PFS短且曲妥珠单抗治疗获益甚微就不足为奇了[41].
循环肿瘤DNA (ctDNA)/游离细胞DNA (cfDNA)
在血液中,cfDNA是细胞释放的DNA片段,cfDNA由ctDNA、循环无细胞线粒体DNA和无细胞胎儿DNA组成。ctDNA指源自癌细胞的DNA片段[42].研究证实ctDNA可从原发肿瘤细胞、转移性肿瘤细胞和CTCs中分泌,并可由发生凋亡或坏死的肿瘤细胞主动或被动释放[43].在健康个体中,cfDNA几乎不存在。在恶性肿瘤、慢性炎症和过度细胞死亡的情况下,cfDNA会大量积累。等位基因特异性聚合酶链反应、低变性温度(COLD)扩增、乳液聚合酶链反应和大规模并行测序等技术都是正在开发的cfDNA分析技术[44].ctDNA已经在许多类型的癌症中被检测到。由于其起源,ctDNA包含了原发和转移性肿瘤细胞所具有的所有遗传特征,如突变、扩增、缺失和/或易位。研究表明,cfDNA和/或ctDNA的分析是一种比传统活组织检查或临床使用的正常癌症生物标志物评估更敏感的识别肿瘤特异性遗传变化的方法。的检测率FGFR2由于肿瘤的异质性,ctDNA分析的扩增率高于组织活检,提高了治疗效率[45].通过液体活检评估甲基化cfDNA谱显著提高早期诊断效率。为了将甲基化ctDNA与来源于正常组织的大量cfDNA区分开来,Shen等人开发了无细胞甲基化DNA免疫沉淀和高通量测序(cfMeDIP-seq),该方法仅能在1-10 ng DNA中检测到甲基化cfDNA。cfMeDIP-seq的优点之一是可以使用不同类型的样本,例如尿液和脑脊液[46].Nuzzo等人验证了cfMeDIP-seq作为一种通过患者血液或尿液诊断早期肾细胞癌的方法的敏感性[47].目前,使用非侵入性液体活检来获得甲基化cfDNA已经引起了大量的研究关注,并且已经对不同的癌症进行了研究。例如,Xu等通过比较HCC组织和正常血液白细胞,发现了HCC特异性甲基化标记面板。在来自大型临床队列的cfDNA中验证后,选择10个hcc特异性甲基化标记构建诊断预测模型,诊断特异性(94.3%)和敏感性(85.7%)较高[48].2020年,一个ctDNA甲基化标记cg10673833被发现用于诊断CRC,特异性为86.8%,敏感性为89.7% [49].
通过ctDNA/cfDNA甲基化谱诊断GC
值得注意的是,cfDNA随着GC的进展而增加。当cfDNA阈值为90 ng/ml时,cfDNA诊断GC的敏感性为96.67%,特异性为94.11% [50].Zhong等人通过受试者工作特征(receiver operating characteristic, ROC)分析表明,cfDNA的诊断价值高于CA199、CA125和AFP等传统生物标志物[51].如上所述,甲基化cfDNA和ctDNA是重要的研究课题。最近,基于1781例胃肠道间质(GI)肿瘤及邻近正常组织的甲基化信息进行了全基因组甲基化分析,随后用300个cfDNA进行了验证。结果表明,从血液样本中获得的不同甲基化区域可以区分GI癌症[52].此外,153 cfDNA甲基化生物标志物面板包括DOCK10,CABIN1,KCNQ5在胃癌患者队列中被发现,提供了一种诊断早期胃癌的新方法[53].XAF1发现胃癌患者甲基化水平下调,原因是癌组织(83.2%)的甲基化比例高于癌旁组织学正常组织(27.2%)和健康对照组(0%)。与病理结果一致,有高频率的XAF1GC患者的cfDNA中检测到甲基化(69.8%,202例中141例),88例健康对照组的cfDNA中未检测到甲基化[54].此外,研究发现cfDNA中甲基化肿瘤抑制基因的升高,包括PCDH10,RASSF1A基因,RUNX3,RPRML结果表明,这些基因的甲基化有可能成为一种诊断性生物标志物[55,56,57].此外,甲基化cfDNA和ctDNA可以预测肿瘤的临床病理特征。在一些研究中,伴有淋巴转移、远处转移和TNM晚期的GC患者通常有较高水平的SFRP2(58),APC(59),而SOX17(60甲基化。凌等人发现异常甲基化水平MINT2而且THBS1与腹膜播散和肿瘤进展呈正相关[61,62].
通过ctDNA/cfDNA突变和甲基化谱预测胃癌患者预后
由于ctDNA/cfDNA的半衰期短,它们能够几乎实时地反映肿瘤状态,使其成为GC患者潜在的预后生物标志物[63].术后检测到ctDNA的胃癌患者均发生复发,且这些患者无病生存期(DFS)和OS较短[64].此外,治疗性手术后长片段无细胞DNA水平较高的GC患者RFS和OS较差[65].在40例GC患者的队列中,35例GC患者的血清ctDNA中存在单核苷酸变异和拷贝数改变,这证实了高比例(87.5%)的患者存在基因组改变[66].GC患者的cfDNA水平比健康对照组高44倍,而DNA片段长度随着规模的扩大而变短。cfDNA保留了来自GC组织的体细胞突变,并与较差的生存时间呈正相关[67].Catenacci等人的一项研究表明,大多数胃癌患者(77%)至少有一种基因组改变。结果表明BRAF基因/ FGFR2以及突变ARAF表明生存率较差[68].此外,一项研究表明胃癌患者TP53突变或见过与没有这些改变的患者相比,扩增患者的总生存期更短[69].值得一提的是,cfDNA或ctDNA的甲基化不仅有助于及时检测GC,而且正迅速成为预测患者预后的关键工具;例如甲基化PCDH10,RASSF1A基因,XAF1,SOX17,WIF-1在cfDNA或ctDNA中显示出潜力[54,55,70].一般来说,这些基因的高甲基化预示着不利的结果,如复发,对治疗的反应差,生存时间更差。TIMP-3甲基化在GC组织中上调,并被发现与腹膜转移和TNM分期密切相关。大约一半的GC患者被发现甲基化TIMP-3术前腹膜冲洗和血清样本。甲基化水平较高的患者TIMP-3他们体液中的DFS更短[71].综上所述,ctDNA/cfDNA的规模及遗传或表观遗传变化是预测胃癌患者预后的重要参数。
ctDNA/cfDNA预测治疗效果
治疗后cfDNA或ctDNA的数量可以预测不同肿瘤患者的预后[72].治疗后,GC合并PD患者血浆cfDNA/ctDNA浓度随时间升高;部分缓解患者cfDNA/ctDNA浓度升高;cfDNA/ctDNA在病情稳定的患者中保持稳定[51,72].PD-L1疗法已被批准作为治疗转移性GC的主要免疫疗法,但其在患者中的疗效各不相同。ctDNA可以在一定程度上反映癌症的突变负荷,发现与PD-L1治疗(特别是派姆单抗)的反应显著相关。治疗前ctDNA突变负荷较高的患者ORR为83.3%,而突变负荷较低的患者ORR仅为7.7%。研究还发现,ctDNA减少的患者在治疗六周后PFS延长[73].因此,ctDNA可被视为GC患者的反应和PFS预测因子。此外,循环CD8 + T细胞的染色体可及性是GC患者PD-1阻断治疗的潜在预测因子。Shin等人表明循环CD8 + T细胞染色质结构的开放性与GC患者抗pd -1治疗的良好反应和较长的生存时间有关[74].以ctDNA拷贝数不稳定(copy number instability, CNI)为代表的染色体不稳定性与治疗效果呈负相关。对治疗敏感的患者CNI降低,而对治疗耐药的患者CNI升高[75].综上所述,在治疗前、治疗后或治疗中检测ctDNA的突变和尺度对于评估治疗效果具有很高的价值。
ctDNA/cfDNA预测治疗耐药性
一项研究发现,基因突变的患者TGFBR2,RHOA,PREX2对PD-1抗体治疗具有耐药性,并且这些患者的PFS明显短于那些没有PD-1抗体治疗的患者。此外,结果表明,新产生的突变FOXL2而且RHOA复制数量的变化FGFR2导致先前对PD-1抗体治疗反应良好的患者获得性免疫治疗耐药[76].同步MET放大限制了其有效性FGFR2抑制剂对FGFE2-扩增GC患者[45].met扩增食管胃癌伴新发喀斯特突变和HER2扩增抗MET抑制剂治疗[77].HER2 + cfDNA提示对治疗有良好的缓解率。然而,cooccurringCCNE1cfDNA的扩增与her2靶向治疗耐药相关,而最近才出现HER2放大增加her2靶向治疗的敏感性[78].治疗引起的基因组改变被认为在化疗耐药中起着关键作用。另一方面,在任何治疗开始之前,肿瘤中已经存在的基因组改变可能是对治疗反应的决定因素。
外泌体和非编码rna
近十年来,外泌体在科学研究中备受关注,我们团队也综述了细胞外小泡(EVs)在GC中的作用和应用[79].外泌体是由大型多泡体分泌的小(30-140 nm)膜结合ev,通过融合释放到细胞外环境;此外,它们可以在血液、尿液、脑脊液和其他体液中检测到。许多细胞类型可以释放外泌体,如上皮细胞、造血细胞、神经元细胞、成纤维细胞、脂肪细胞和肿瘤细胞。值得注意的是,外泌体调节和参与生理和病理过程[80].研究表明,正常情况下容易降解的非编码rna,如microRNAs (miRNAs)、环状rna (circRNAs)、长链非编码rna (lncRNAs)等,可以被包装成外泌体,使其在细胞外环境中保持稳定,并在细胞和组织之间传递信号。许多学术研究阐明外泌体rna与上皮-间充质转化、血管生成、转移前小生境的形成、转移、免疫反应和治疗耐药性有关,表明外泌体rna在癌症的发生和发展中发挥重要作用[81].2008年,Li等人证明了miR-21在乳腺癌患者中升高。此外,与miR-21水平较低的乳腺癌患者相比,miR-21水平较高的乳腺癌患者更容易出现临床分期晚期、淋巴结转移和缩短OSmiR-21.因此,miR-21被认为是乳腺癌潜在的预后生物标志物。由于外泌体和外泌体rna易于收集,它们在非侵入性液体活检中作为生物标志物具有显著优势[82].Sun等人基于非小细胞肺癌细胞系和患者的数据,通过计算免疫和lncRNA谱分析,建立了由7个lncRNA组成的肿瘤免疫浸润相关lncRNA特征。这7个lncrna可用于将患者分为免疫热组和免疫冷组。结果显示,免疫热组患者普遍存在免疫检查点基因表达上调,导致OS更长,对免疫检查点抑制剂治疗反应良好,提示其在监测治疗反应中的潜力[83].
通过外泌体非编码RNA诊断胃癌
近年来,出现了大量关于使用外泌体和外泌体rna作为GC诊断生物标志物的文献。一般来说,在这些研究中,采集了GC患者和健康对照组的血液样本,并通过定量逆转录PCR检测外泌体rna水平。GC患者与健康对照之间表达有显著差异的外泌体rna被视为候选外泌体rna。然后,计算这些候选外泌体rna的敏感性、特异性和ROC曲线下面积(AUC)值。那些具有良好价值的外泌体rna被报道为潜在的诊断生物标志物。一些研究使用mirna的组合来提高诊断效率。例如,Roy等人基于194例GC患者的队列确定了环状rna组。该小组在验证和训练阶段均以高敏感性和特异性对健康对照的GC患者进行了诊断。此外,该circRNA面板能够区分早期GC与健康对照,以及GC的组织学类型[84].此外,由外泌体组成的肿瘤mirna面板miR-10a-5p,miR-19b-3p,mir - 215 - 5 - p,miR-18a-5p亦发现[85].关于诊断外泌体rna的详细信息见表2在下面。
通过外泌体非编码rna预测胃癌
许多确定外泌体rna预后价值的研究正在进行中。这些研究大多集中在外泌体rna与生存时间的相关性上。不幸的是,只有少数研究调查了相关性背后的机制。例如,Fan等人揭示了外泌体之间的密切关系PD-L1GC患者OS较差。不利结果的原因是外泌体PD-L1通过减少CD4 + T细胞、CD8 + T细胞和颗粒酶B +细胞的数量来抑制GC患者的免疫状态[86].外泌体rna作为预后生物标志物的细节见表3..
Tumor-educated血小板
肿瘤教育血小板(TEPs)是一种最新的液体活检成分。一方面,TEPs有助于癌细胞生长并逃离免疫系统。血小板显示出来自癌细胞的特殊RNA指纹,据说是受到癌症的教育[87].据Calverley等报道,转移性肺癌患者有197个血小板基因下调[88].此外,在TEPs中不仅有血小板基因的表达,还有癌症相关基因的表达。Nilsson等人发现癌症特异性表皮生长因子受体而且PCA3RNAs在胶质瘤和前列腺癌患者血小板中表达[89].因此,TEPs因其在癌症中的诊断价值而受到了广泛的关注。2015年,Best等人对TEPs进行了泛癌症研究。在mRNA表达谱方面,在多种肿瘤类型中,TEPs与正常对照之间存在显著差异,这些mRNA表达谱在癌症诊断中的准确率为89% [90].
其他资源
液体活检最重要的标本来源是血液。血液活检技术是最早开发出来的,因为它可以广泛应用于临床,对患者的伤害相对较小。研究表明,血液以外的体液也可能是液体活检的重要来源[91].例如,膀胱癌患者可以通过检测频率来与健康对照区分开FGFR3尿液突变[92].头颈部鳞状细胞癌可通过检测唾液中的肿瘤DNA进行诊断[93].在各种原发性或转移性脑癌患者的脑脊液cfDNA中可发现肿瘤突变[94].在气相色谱方面,除血液外,还需要更多的研究探讨体液在气相色谱中的应用。GC细胞在发育过程中释放的神经生长因子刺激唾液腺,导致唾液RNA谱的显著变化,可用于检测GC [95].在唾液细胞外RNA方面,建立了由3个mrna和2个mirna组成的小组,对GC诊断具有较高的可行性;该小组也在294人的队列中得到验证[96].胃液和洗涤液与GC关系最密切,是液体活检必不可少的资源。某些mirna和lncrna的差异表达(包括miR-21,米尔-106年,一个,mir - 129,lncRNA-AA174084)有可能诊断胃癌[97,98,99].在洗胃液中检测到DNA甲基化,GC患者和正常对照组在甲基化谱上有显著差异。MINT甲基化谱诊断GC的敏感性和特异性分别达到90%和96% [One hundred.].GC细胞分泌的物质首先进入血液,最终通过肾脏排出到尿液中。在GC患者的尿液样本中,miR-6807-5p、miR-6856-5p和miR-23-5p在手术后最初高表达并降低,这使它们成为早期检测和监测治疗反应的潜在生物标志物[101,102].此外,血清抗体BRAT1的上调被发现有助于早期发现胃肠道癌症[103].
液体活检在GC中的应用及展望
GC中液体活检的临床研究
gc相关液体活检的临床试验相对广泛,因为它是临床医生共同感兴趣的领域(表2)4).如表所示,大多数液体活检的目的是预测预后和评估治疗效果。其他三项试验旨在通过液体活检实现GC的早期诊断。例如,cfMeDIP-Seq检测不仅用于从健康人中筛选癌症患者,而且还用于区分癌症类型。肿瘤衍生的突变,例如背景而且CTNNA1通常在遗传弥散性GC中检测到,通过下一代测序检测到。为了实现预后预测,大多数临床试验都是在预定的时间间隔内检测GC治疗前后的ctDNA或ctc,以评估与OS、DFS、PFS和RFS的相关性。在治疗评价方面,国内有学者开展了一项针对HER2阳性GC的试验,旨在通过监测来评价HER2靶向治疗HER2在中转站的地位HER2从治疗前到疾病缓解或进展,ctc和cfDNA中的cfDNA扩增和治疗耐药相关基因状态。近年来,免疫治疗研究在包括胃癌在内的许多肿瘤中取得了令人瞩目的成果。为了选择适合免疫治疗的GC患者,一些临床试验通过液体活检评估了免疫治疗的疗效。FoundationOneLiquid由PLATON应用的,提供了微卫星不稳定性(MSI)和肿瘤突变负担等信息,以帮助告知免疫治疗决策。此外,对于msi高的胃/胃食管交界处癌,是否使用tremelimumab和durvalumab作为新辅助治疗或最终治疗,通过临床试验INFINITY进行评估。另一项名为INTEGA的临床试验,比较了HER2 +胃/食管交界处癌患者无化疗免疫治疗与FOLFOX化疗后免疫治疗的疗效。结果表明,早期cfDNA增加与较短的PFS和OS密切相关。此外,曲妥珠单抗耐药是由于HER2突变和表位突变导致曲妥珠单抗耐药丧失。此外,学者们正在评估其他体液,如胃液和腹膜灌洗液,作为GC潜在的液体活检样本的可能性。
GC中液体活检的挑战与展望
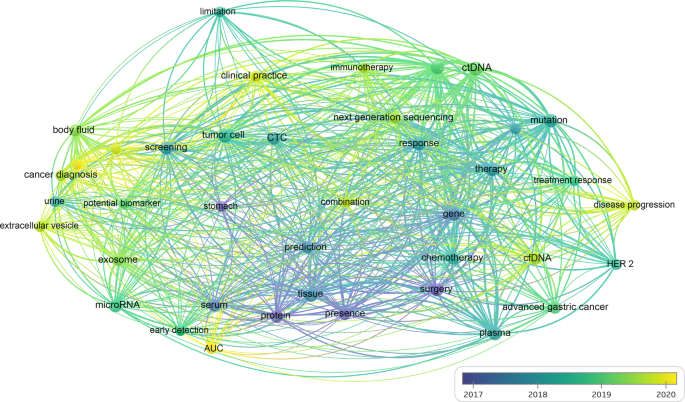
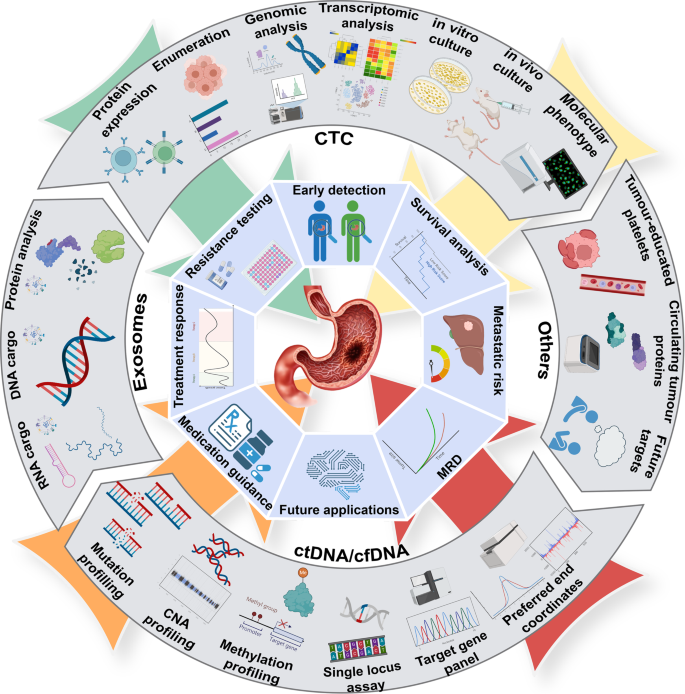
液体活检,特别是ctDNA和CTCs检测,已经引起了很多关注。微创取样、动态监测和对癌症的全面了解是其主要优势。此外,有足够的研究表明,早期和晚期癌症的液体活检对临床决策有影响,特别是当组织活检是次优的或无法获得的。因此,我们对过去五年在Web of Science上发表的文章进行了搜索,并通过文献计量学方法将基于证据的结果可视化。我们以“胃癌”和“液体活检”为关键词绘制网络和时间序列图,分析该领域的发展趋势(图2)。3.).液体活检的应用从诊断和预后转向治疗管理,如化疗和免疫治疗。样本从血浆变成其他体液,如尿液、脑脊液、胃液和唾液。靶点从蛋白质肿瘤标记物发展到循环肿瘤细胞或DNA(CTC/ctDNA),再到循环肿瘤RNA、外泌体RNA和肿瘤诱导血小板。分析方法从定量到基因组或表观基因组分析,再到体外或体内实验(图2)。4).然而,与肺癌、结直肠癌、肝细胞癌等其他癌症相比,GC中液体活检的发展和进展相对缓慢。因此,GC中液体活检技术有很大的发展潜力。
在早期胃癌诊断方面,cfDNA中常见的肿瘤驱动基因突变,如HER2,表皮生长因子受体,拉,TP53,以及cfMeDIP-Seq检测到的表观遗传变异,如hMLH,背景,CDKN2A,H3K27是肿瘤发生的敏感靶点,在临床症状和影像学检查均为阴性时即可发现。因此,含有最常见的基因组畸变和甲基化位点的ctDNA检测能够及时检测到早期GC。
此外,与其他癌症一样,液体活检有望在GC的治疗选择、治疗监测和治疗耐药性三个方面发挥重要的指导作用。首先,某些药物靶向的基因畸变可以通过ctDNA检测。例如,由Cobas EGFR突变测试v2FDA批准的数字PCR检测,非小细胞肺癌患者使用表皮生长因子受体外显子19缺失或外显子21 L858R突变可通过EGFR酪氨酸激酶抑制剂厄洛替尼治疗。此外,PI3Kα抑制剂alpelisib适用于乳腺癌患者PIK3CA检测到的突变PIK3CA RGQ PCR试剂盒.可以预见的是,检测gc相关基因突变的商业检测,HER2,表皮生长因子受体,喀斯特等,被用来帮助医生治疗病人。治疗效果可以通过初治后的CTCs和ctDNA来监测,因为它们代表了肿瘤负担和最小残留疾病。一旦治疗效率意外下降,患者很可能对目前的治疗产生耐药性。ctDNA不仅可以检测已知的耐药机制,如共突变和CNAs,而且还可以通过大基因组检测未知的耐药机制。替代治疗方法可以通过从出现耐药性的患者中分离出的ctc进行测试。根据以往的研究,通过逐步模拟患者肿瘤微环境,制备长期扩增细胞、异种移植物、球状体和类器官来克服耐药性。
对于GC的预后,具有特异性表面标记的ctc值得进一步探讨。治疗前ctc检测可作为基线数据,将患者分为不同组。通过初治后的连续血检,可以预测癌症复发和转移的可能性。
尽管液体活检的探索正在推进,但应用液体活检的挑战不应被低估。CTCs和ctdna数量少,外周循环分布不均匀,极大地限制了液体活检的重现性。此外,液体活检的流程复杂,如样品采集、靶点分离检测、标准物质缺乏等,规范化程度有待提高。此外,液体活检的临床应用迫切需要多中心、更大、更长期的临床试验。
结论
近年来,液体活检受到临床医生的广泛关注。在这篇文章中,更详细地讨论了液体活检的组成部分及其在GC中的作用。在不久的将来,通过液体活检,GC的早期诊断、预后预测和治疗指导将变得更加容易,为管理甚至克服GC提供了新的机会。
参考文献
王晓明,王晓明,王晓明,等。2020年全球癌症统计:GLOBOCAN估计了185个国家的36种癌症的发病率和死亡率。中华癌症杂志。2021;71:209-49。
Joshi SS, Badgwell BD.胃癌目前的治疗和最新进展。中华癌症杂志。2021;71:264-79。
谭mc, Graham DY.胃癌筛查:关注蚂蚁而不是蚁丘。临床胃肠醇肝。2021;19:90 - 1。
Smyth EC, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D,等。胃癌:ESMO临床实践诊断、治疗和随访指南。Ann Oncol. 2016;27: v38-v49。
Salati M, Orsi G, Smyth E, Aprile G, Beretta G, De Vita F,等。胃癌:将小说概念转化为临床实践。癌症治疗Rev. 2019;79:101889。
叶青,凌松,郑松,徐欣。肝细胞癌液体活检:循环肿瘤细胞与循环肿瘤DNA。《Mol Cancer》2019;18:114。
侯杰,李霞,谢鹏鹏。结合液体活检和生物信息学的胰腺癌早期检测和精确预测。摩尔癌症,2021;20:34。
长坂M,乌丁MH, al - hallak MN, Rahman S, Balasubramanian S, Sukari A,等。早期非小细胞肺癌的液体活检治疗监测。摩尔癌症,2021;20:82。
李俊华,李俊华,李志强,李志强。黑素瘤中液体生物标志物的检测与发现。《Mol Cancer》2018;17:8。
潘特尔,史培华。循环肿瘤细胞的生物学研究。致癌基因。2016;35:1216-24。
Kilgour E, Rothwell DG, Brady G, Dive C.基于液体活检的治疗反应和耐药性生物标志物。《癌症杂志》2020;37:485-95。
张志刚,张志刚,张志刚,等。在一项大型前瞻性试验中,在转移性乳腺癌患者一线化疗中,循环肿瘤细胞与血清肿瘤标志物相比具有较高的独立预后和预测价值。安·昂科尔。2012;23:618-24。
沙尔玛,庄瑞,M龙,Pavlovic M,康杨,Ilyas A,等。循环肿瘤细胞分离、培养及下游分子分析。生物技术,2018;36:1063-78。
Gasch C, Bauernhofer T, Pichler M, Langer-Freitag S, Reeh M, Seifert AM,等。结直肠癌患者循环肿瘤细胞表皮生长因子受体状态的异质性及KRAS/PIK3CA突变临床化学。2013;59:252-60。
de Bono JS, Scher HI, Montgomery RB, Parker C, Miller MC, Tissing H,等。循环肿瘤细胞预测转移性去势抵抗性前列腺癌治疗的生存获益。临床癌症决议案2008;14:6302-9。
于敏,巴迪亚A,埃西托N,贝尔萨尼F,麦登MW,唐纳森MC,等。癌症治疗。体外培养循环乳腺肿瘤细胞用于个体化药物敏感性检测。科学。2014;345:216-20。
姜慧敏,金高辉,全洪辉,金德华,全泰,朴德元,等。圆盘实验室检测循环肿瘤细胞在胃癌早期诊断中的作用。科学通报。2017;12:e0180251。
渡边T,奥村T,平野K,山口T, Sekine S,永田T,等。表达肿瘤干细胞标志物CD44的循环肿瘤细胞在胃癌患者中的诊断生物标志物Oncol Lett, 2017; 13:281-8。
李超,杨松,李蓉,龚松,黄敏,孙勇,等。双适体靶向免疫磁性纳米颗粒,准确探索循环肿瘤细胞与胃癌的相关性。ACS应用板机接口。2022;14:7646-58。
黄霞,高鹏,孙娟,陈鑫,宋勇,赵娟,等。胃癌患者循环肿瘤细胞的临床病理和预后意义:一项荟萃分析。国际癌症杂志。2015;136:21-33。
Carneiro A, Piairo P, Teixeira A, Ferreira D, Cotton S, Rodrigues C,等。从晚期胃肠癌患者分离的循环肿瘤细胞中上皮细胞向间充质细胞转变表型的鉴别。细胞。2022;11:376 - 93。
杨超,邹凯,袁智,郭涛,熊斌。CellSearch系统检测胃癌患者循环肿瘤细胞的预后价值:来自meta分析的证据。Onco Targets Ther. 2018; 11:1013-23。
钱超,蔡睿,张伟,王杰,胡霞,张勇,等。中性粒细胞-淋巴细胞比值和循环肿瘤细胞计数预测胃肠道癌患者预后。Front Oncol. 2021;11:710704。
伊藤H,佐藤J,辻野Y,山口N,木村S,高田K,等。胃癌患者循环肿瘤细胞的长期预后影响。世界胃肠杂志。2016;22:10232-41。
陈勇,袁杰,李勇,李旭,杨勇,李俊,等。分析不同大小的循环肿瘤微栓子以追踪晚期胃癌的治疗耐药性和预后。《蜂窝》2021;34:1446-54。
石黑Y,崎滨H,吉田T,市川N,本马S,富井M,等。具有间充质表型的循环肿瘤细胞在胃癌患者中的预后意义:一项前瞻性研究。安外科医生,2021;28:1178-86。
米木Y, Yashiro M,黑田K,大野T, Togano S,增田G,等。循环的cea阳性和epcam阴性肿瘤细胞可能是胃癌患者复发的预测生物标志物。癌症医学2021;10:521-8。
Szczepanik A, Sierzega M, Drabik G, Pituch-Noworolska A, kooodziejczyk P, Zembala M.血液和骨髓中CD44(+)细胞角蛋白阳性肿瘤细胞与胃癌患者预后不良相关。胃癌。2019;22:264-72。
夏鹏,宋春林,刘建峰,王东,徐晓霞。循环CD133(+)细胞对胃癌患者预后的价值。中国生物医学工程学报,2015;
池俊华,金永华,朴世杰,金杜,李文伟,李贝,等。转移性胃癌患者循环肿瘤细胞与TWIST表达的初步研究。中华临床医学杂志2021;10:4481-93。
邱勇,张旭,邓旭,张锐,蔡智,张震,等。循环肿瘤细胞相关白细胞团与胃癌根治术后患者生存不良相关。中华外科杂志。2021;48:1039-45。
李勇,张旭,龚杰,张强,高杰,曹颖,等。循环肿瘤细胞8号染色体非整倍体与晚期胃癌患者预后相关中国癌症杂志2016;28:579-88。
松阪S, Chìn K,小仓M, Suenaga M, Shinozaki E,三岛Y,等。循环肿瘤细胞作为决定晚期胃癌患者化疗反应的替代标志物。中华癌症杂志2010;
李勇,龚杰,张强,卢震,高洁,李勇,等。循环肿瘤细胞动态监测评价晚期胃癌治疗效果。中华癌症杂志,2016;
李SJ,李J, Kim圣公园SH,乔公园,公园y, et al。循环肿瘤细胞是转移性胃癌化疗不良反应的预测因素。中国生物医学杂志。2015;30:e382-6。
李婷婷,刘辉,李普甫,胡玉峰,牟泰,林涛,等。可切除胃癌患者上皮-间充质转移循环肿瘤细胞的评估:与治疗反应的相关性。世界胃肠杂志。2015;21:13259-67。
Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F.胃癌。《柳叶刀》杂志。2020;396:635-48。
三岛Y,松坂S,秦K, Mikuniya M, Minowa S, Takayama T,等。HER2阴性胃癌患者循环肿瘤细胞中HER2扩增的检测目标Oncol 2017; 12:341-51。
Matsushita D, Uenosono Y, Arigami T, Yanagita S,大久保K,木岛T,等。循环肿瘤细胞在her2阴性转移性胃癌曲妥珠单抗治疗中的临床意义Cancer Chemother Pharm, 2021; 87:789-97。
王辉,李波,刘震,龚健,邵林,任杰,等。循环肿瘤DNA HER2拷贝数作为预测和监测曲妥珠单抗在晚期胃癌疗效的生物标志物。中华癌症杂志,2018;
王东升,刘志新,吕玉霞,鲍华,吴霞,曾志林,等。液体活检追踪转移性her2阳性胃癌曲妥珠单抗耐药性肠道。2019;68:1152 - 61。
斯佩曼PT,格雷JW。通过监测循环肿瘤DNA来检测癌症。《医学杂志》2014;20:475 - 5。
stoun M, Maurice P, Vasioukhin V, Lyautey J, Lederrey C, Lefort F,等。循环DNA的起源和机制。中国科学(d辑),2000;
Luke JJ, Oxnard GR, Paweletz CP, Camidge DR, Heymach JV, Solit DB,等。在基因型导向治疗时代,实现血浆基因分型的潜力。中华肿瘤学杂志,2014;29(2):329。
Jogo T, Nakamura Y, Shitara K, Bando H, Yasui H, Esaki T,等。循环肿瘤DNA分析在晚期胃癌中检测到FGFR2扩增和与FGFR抑制剂疗效相关的并发基因组改变。临床癌症决议2021;27:5619-27。
沈淑云,王晓明,王晓明,王晓明。基于cmpp -seq的血浆细胞DNA甲基化谱分析。Nat Protoc 2019; 14:2749-80。
Nuzzo PV, Berchuck JE, Korthauer K, Spisak S, Nassar AH, Abou Alaiwi S,等。血浆和尿液无细胞DNA甲基化组检测肾细胞癌。医学杂志2020;26:1041-3。
徐荣荣,魏伟,Krawczyk M,王伟,罗华,Flagg K,等。循环肿瘤DNA甲基化标志物在肝细胞癌诊断和预后中的应用。清华大学学报(自然科学版)。2017;16:1155-61。
郑魏赵罗H, Q, W, L,咦,李G, et al。循环肿瘤DNA甲基化谱可用于结直肠癌的早期诊断、预后预测和筛查。科学翻译,2020;12:eaax7533。
金凯,申东东,朴明凯,白硕,金涛,金松,等。循环游离DNA在胃癌患者中作为一种有前途的生物标志物:诊断有效性和手术切除后cfDNA的显著降低。Ann surgical treatment res 2014; 86:136-42。
钟勇,范强,周泽,王勇,何凯,陆娟。血浆cfDNA作为评价胃癌化疗疗效的潜在生物标志物。癌症管理决议2020;12:3099-106。
徐杰,李文杰,张文杰,张文杰,等。EpiPanGI Dx:一种用于早期检测胃肠道癌症的无细胞DNA甲基化指纹。临床癌症决议2021;27:6135-44。
任娟,卢鹏,周旭,廖勇,刘旭,李娟,等。胃癌患者循环游离细胞DNA的基因组尺度甲基化分析。临床化学,2022;68:354-64。
凌志强,吕萍,吕XX,于建林,韩娟,应树林,等。循环甲基化XAF1 DNA提示胃癌预后不良。科学通报。2013;8:e67195。
Pimson C, Ekalaksananan T, Pientong C, Promthet S, Putthanachote N, Suwanrungruang K,等。血液样本中PCDH10和RASSF1A基因甲基化异常对胃癌无创诊断和预后评估的影响PeerJ。2016; 4: e2112。
李秀秀,徐宏,西川J,修藤T,藤村H,伊藤S,等。血液自由循环DNA甲基化RUNX3检测对早期胃癌诊断有重要意义。癌症。2020;12:789 - 801。
Alarcón MA, Olivares W, Córdova-Delgado M, Muñoz-Medel M, de Mayo T, Carrasco-Aviño G,等。repmo样基因是一种表观遗传学介导的肿瘤抑制因子,也是胃癌非侵入性检测的候选生物标志物。中国生物化学杂志,2020;21(4):374 - 374。
闫红,陈伟,葛凯,毛霞,李霞,刘伟,等。血浆SFRP2甲基化在胃癌预后中的价值。Dig Dis science 2021; 66:3854-61。
Balgkouranidou I, Matthaios D, Karayiannakis A, Bolanaki H, Michailidis P, Xenidis N,等。APC和RASSF1A启动子甲基化状态在可手术胃癌患者游离循环DNA中的预后作用Mutat Res. 2015; 778:46-51。
Balgkouranidou I, Karayiannakis A, Matthaios D, Bolanaki H, Tripsianis G, Tentes AA,等。可手术胃癌患者游离DNA中SOX17 DNA甲基化的评估与预后变量和生存率的关系。临床化学实验室,2013;51:1505-10。
韩娟,吕萍,于建林,吴玉春,朱霞,洪丽玲,等。循环甲基化MINT2启动子DNA是胃癌潜在的不良预后因素。中国生物医学工程学报(自然科学版);
胡晓霞,凌志忠,洪丽丽,于庆明,李鹏,凌志强。循环甲基化THBS1 dna作为预测胃癌腹膜播散的新标志物。中华临床检验杂志。2021;35:e23936。
Wan JCM, Massie C, Garcia-Corbacho J, Mouliere F, Brenton JD, Caldas C,等。液体活检成熟:实现循环肿瘤DNA。癌症杂志。2017;17:23 - 38。
杨杰,龚毅,林维凯,石勇,管勇,张勇,等。循环肿瘤DNA深度测序检测分子残留病变并预测胃癌复发。细胞死亡,2020;11:346。
Ko K, Kananazawa Y, Yamada T, Kakinuma D, Matsuno K, Ando F,等。甲基化状态和长片段无细胞DNA是胃癌预后的生物标志物。癌症医学2021;10:2003-12。
opopenshaw MR, Mohamed AA, Ottolini B, Fernandez-Garcia D, Richards CJ, Page K,等。循环肿瘤DNA的纵向监测提高了胃食管腺癌的预后和复发检测。中华癌症杂志。2020;123:1271-9。
王志强,王志强,王志强,等。液体活检技术在胃癌诊断中的应用临床胃肠病学杂志。2021;12:e00403。
Maron SB, Joshi SS, Lomnicki S, Oliwa T, Landron S, Johnson J,等。晚期胃食管腺癌(GEC)循环肿瘤DNA (ctDNA)分布及预后意义。中华临床杂志。2018;36:45-5。
李俊,李忠,丁勇,徐勇,朱霞,曹楠,等。循环肿瘤DNA分析中TP53突变和MET扩增预测晚期胃癌患者的疾病进展。PeerJ。2021; 9: e11146。
Karamitrousis EI, Balgkouranidou I, Xenidis N, Amarantidis K, Biziota E, Koukaki T,等。RASSF1A、SOX17和wif1启动子甲基化状态在晚期胃癌患者游离DNA中的预后作用科技癌症治疗。2021;20:1533033820973279。
于建林,吕平,韩娟,朱霞,洪丽玲,朱文文,等。津液中甲基化TIMP-3 DNA是胃癌的独立预后因素。Arch Pathol实验室,2014;138:1466-73。
李娟,姜伟,魏娟,张娟,蔡林,罗敏,等。患者特异性循环肿瘤DNA指纹用于监测多种肿瘤的治疗反应。翻译医学杂志2020;18:293。
金世杰,李志强,李志强,等。转移性胃癌PD-1抑制临床反应的综合分子特征中国医学杂志2018;24:1449-58。
申敏,金贵,金松,沈志华,崔俊,金敏,等。循环CD8(+) T细胞的染色质可达性预测胃癌患者PD-1阻断的治疗反应。Nat Commun. 2021;12:975。
陈震,张超,张明,李波,牛勇,陈林,等。循环肿瘤DNA的染色体不稳定性反映晚期胃癌的治疗反应。细胞死亡,2019;10:697。
金勇,陈德龙,王峰,杨春平,陈XX,尤建强,等。循环肿瘤DNA图谱在免疫检查点抑制剂治疗胃癌患者中的预测作用《Mol Cancer》2020;19:154。
Kwak EL, Ahronian LG, Siravegna G, Mussolin B, Borger DR, Godfrey JT,等。分子异质性和受体共扩增驱动met扩增食管胃癌靶向治疗的耐药性。癌症杂志2015;5:1271-81。
Kim ST, Banks KC, Pectasides E, Kim SY, Kim K, Lanman RB,等。HER2+胃癌患者HER2治疗期间基因组改变对拉帕替尼治疗结果和无细胞基因组格局的影响Ann Oncol, 2018;29:10 - 37。
吴华,付敏,刘杰,崇伟,方震,杜峰,等。小细胞外囊泡在胃癌中的作用及应用。摩尔癌症,2021;20:71。
佩格特尔DM,古尔德SJ。液。生物化学,2019;88:487-514。
谢勇,党伟,张松,岳伟,杨林,翟旭,等。外泌体非编码rna在癌症中的作用。《Mol Cancer》2019;18:37。
闫丽霞,黄晓峰,邵强,黄美美,邓林,吴清良,等。MicroRNA miR-21在人乳腺癌中的过表达与临床分期晚期、淋巴结转移和患者预后不良有关。Rna。2008;14:2348-60。
孙杰,张震,鲍松,闫超,侯鹏,吴楠,等。肿瘤免疫浸润相关lncrna改善非小细胞肺癌患者预后及免疫治疗应答的研究中华免疫杂志2020;8:e000110。
王志刚,王志刚,王志刚,王志刚,等。环状rna作为非侵入性、液体活检生物标志物对胃癌早期检测的诊断效果摩尔癌症,2022;21:42。
Kahroba H, Samadi N, Mostafazadeh M, Hejazi MS, Sadeghi MR, Hashemzadeh S,等。评估胃癌患者血清源性外泌体中作为非侵入性诊断生物标志物的肿瘤肿瘤microrna的存在。Bioimpacts。2022;12:127-38。
范勇,车鑫,曲娟,侯凯,文涛,李震,等。外泌体PD-L1保留免疫抑制活性,与胃癌预后相关。中华外科杂志,2019;26:3745-55。
在' t Veld S, Wurdinger t .肿瘤教育血小板。血。2019;133:2359 - 64。
张志强,张志强,张志强,张志强,等。转移性肺癌血小板基因表达显著下调。中华外科杂志2010;3:227-32。
李志强,李志强,李志强,等。血小板含有肿瘤来源的RNA生物标志物。血。2011;118:3680-3。
Best MG, Sol N, Kooi I, Tannous J, Westerman BA, Rustenburg F,等。肿瘤教育血小板的RNA-Seq使基于血液的泛癌症,多类和分子途径癌症诊断成为可能。《癌症杂志》2015;28:66 - 76。
Siravegna G, Marsoni S, Siena S, Bardelli A.将液体活检纳入癌症管理。中华儿科杂志,2017;14:531-48。
杨晓明,李晓明,陈晓明,等。基于深度测序技术检测膀胱癌患者尿液中FGFR3基因突变的研究。Res Rep Urol. 2012; 4:33-40。
王勇,施普林格S, Mulvey CL, Silliman N, Schaefer J, Sausen M,等。头颈部鳞状细胞癌患者唾液和血浆中体细胞突变和HPV的检测科学翻译,2015;7:293ra104。
潘伟,顾伟,郭伟强,郭伟强。脑脊液中脑肿瘤突变的检测。临床化学。2015;61:514-22。
尿和唾液中的microRNA作为胃肠癌生物标志物的有用性。中华临床医学杂志,2021;26:1431-40。
李峰,Yoshizawa JM, Kim KM, Kanjanapangka J, Grogan TR,王旭,等。用于胃癌无创检测的唾液细胞外RNA生物标志物的发现和验证。临床化学。2018;64:1513-21。
崔玲,张旭,叶刚,郑涛,宋宏,邓宏,等。胃液MicroRNAs作为胃癌筛查的潜在生物标志物。癌症。2013;119:1618-26。
于旭,罗林,吴勇,于旭,刘勇,于旭,等。胃液miR-129作为筛查胃癌的潜在生物标志物《中华医学杂志》2013;30:36。
邵勇,叶敏,姜旭,孙伟,丁旭,刘忠,等。胃液长链非编码RNA作为筛选胃癌的肿瘤标志物。癌症。2014;120:3320-8。
渡边勇,金HS, Castoro RJ,郑W, Estecio MR,近藤K,等。洗胃液DNA甲基化分析对早期胃癌的敏感性和特异性检测。胃肠病学杂志。2009;136:2149-58。
岩崎H,志村T,山田T,奥田Y,夏目石M,北川M,等。一种用于检测胃癌的新型尿microRNA生物标志物面板。《胃肠病杂志》2019;54:1061-9。
高华文,潘春春,赖超,吴长武,方伟林,黄克勤,等。尿液miR-21-5p作为胃癌潜在的非侵入性生物标志物Oncotarget。2017;8:56389 - 97。
胡玲,刘杰,岛田H,伊藤M,杉本K, Hiwasa T,等。血清抗- brat1是一种常见的胃肠肿瘤和动脉粥样硬化的分子生物标志物。Front Oncol. 2022;12:870086。
确认
作者向调查人员和研究实验室道歉,由于篇幅限制,没有引用他们的原始研究。图是用BioRender.com和VOSviewer创建的。
资金
山东省重点研发计划项目(No. 2019JZZY010104;2019号gsf108146;2021号sfgc0502;2021号cxgc011104);山东省台山学者计划专项基金(No.;ts20190978);山东第一医科大学学术推广项目(No. 2019QL021)。
作者信息
作者及隶属关系
贡献
所有作者都帮助完成了这项研究;ZZ和HW参与构思和设计;ZZ和LS参与了论文的起草或对其智力内容进行了批判性的修改;CJ和LL参与了最终审定出版版本的工作。所有作者都同意对工作的各个方面负责。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
由Francesca pentimali教授编辑
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
张震,吴H,崇伟。et al。胃癌液体活检:预测和预后的生物标志物。细胞死亡13, 903(2022)。https://doi.org/10.1038/s41419-022-05350-2
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41419-022-05350-2