摘要
高瘤内神经密度与多种实体肿瘤类型的低生存率、高转移和高复发率相关。近年来的研究表明,癌细胞释放多种神经营养因子和外泌体促进肿瘤神经支配,此外,浸润神经也可通过外泌体和神经递质介导多种肿瘤生物学过程。本文通过建立肿瘤神经支配的基础研究,探讨了肿瘤微环境(TME)中周围神经与肿瘤细胞之间的通讯,并揭示了肿瘤发生过程、血管生成、淋巴管生成和免疫等神经-肿瘤调控机制。最后,我们讨论了“旧药新用”靶向TME通讯的前景方向,明确了一条预防肿瘤恶性能力的新途径。
事实
某些实体瘤的神经支配与预后差有关。
瘤内神经作为恶性因素,在肿瘤发展过程中起着重要作用,其密度决定了肿瘤的恶性程度。
肿瘤中的神经可调节多种生物过程,如血管生成、淋巴管生成、免疫与炎症、成纤维细胞与细胞外基质、DNA修复、癌基因激活等。
此外,肿瘤细胞还参与了肿瘤微环境中的轴突发生、神经发生和神经重编程过程。
靶向神经支配为肿瘤治疗提供了广阔的研究前景。
开放式的问题
如何通过切断实体瘤神经实现临床治疗?
如何靶向神经-肿瘤通讯以预防肿瘤进展?
肿瘤微环境中介导轴突发生、神经发生和神经重编程过程的主要生物分子是什么?
神经药物能否成为临床治疗肿瘤的一种途径?
紧张情绪进入了我们的视野
癌症是一个重大健康问题,对所有社会的影响越来越大。2018年,全球估计有1810万例新发癌症病例和960万例癌症相关死亡[1].实体癌通过原发癌细胞发展,原发癌细胞在生长过程中积累基因突变,通常具有侵袭性/转移性特征。然而,转移可以在不形成原发肿瘤的情况下发生。事实上,原发癌和继发癌的控制机制(分别为增殖和侵袭/转移)是不同的,至少是部分独立的[2,3.].病理生理学在空间和时间上是极其复杂和多变的,在考虑治疗时包括各种因素。这种复杂性在很大程度上是由于癌症的表观遗传性质,这使癌症能够承受不断的变化[4].此外,癌细胞具有相当数量的“干性”;事实上,许多胚胎基因,包括发育调节的剪接变异,都在癌细胞中表达[5,6].不幸的是,由于耐药的出现,最常用的癌症治疗方法有很大的局限性,包括毒性和外周组织损伤等副作用,以及高昂的治疗费用。从初级诊断到临床管理的高级治疗,目前的需求还没有得到满足。因此,人们正在努力确定功能标志物和癌症发展机制,这将有助于早期诊断和有效的长期治疗。
越来越多的证据表明,肿瘤预后与肿瘤内神经浸润有关。这种现象发生在神经支配程度高的器官或组织中,特别是胰腺癌(PRC)(近100%)、头颈癌的80%、前列腺癌(PC)的75%和结直肠癌(CRC)的33% [7].浸润神经的密度与肿瘤转移、发病率和死亡率呈正相关,并已被证明是多种癌症(包括PC)生存预后的独立危险因素[7,8,9,10]、胃癌[11,12]、胆道癌[13]、头颈癌[14,15,16],以及子宫颈癌[17,18].在中国[19,20.], PC [21], gc [22],及CRC [23,24,25,26],浸润神经的密度是与复发风险相关的一个因素。此外,癌症的神经支配可能在促进转移中起着重要的直接作用,因为癌症相关神经可能延伸到中枢神经系统并激活转移的前体[23,27].
在临床研究证据的推动下,新的转化癌症治疗技术正在开发中,以神经和TME之间的相互作用为目标。在这篇综述中,我们综述了癌细胞在调节神经发生中的作用,并描述了神经如何调节TME促进癌症的发展和进展。我们的首要目标是帮助临床医生和研究人员更深入地了解神经-癌症相互作用的机制。
肿瘤进展中神经的简要描述
自16世纪以来,人们观察到神经和血管同时运动,这两种结构都是维持器官所必需的[28].因为癌症需要这些血管和神经来生长和存活,因此推断神经横切可以用来控制癌症的进展。这一假设最初由外科医生验证,他们试图通过横切三叉神经及其附属血管来治疗唇癌[28].虽然神经和血管的横切实现了症状控制(减少溃疡和疼痛),但研究中的所有4名患者最终都需要手术切除其病理组织。尽管取得了这些进展,但直到最近10年,神经在TME中的分子机制和作用仍然是一个悬而未决的问题。尽管去神经在减少肿瘤生长方面的作用已被报道,但癌症-神经相互作用的进展仍然缓慢[29,30.,31,32].与早期研究中观察到的癌-神经倾向不同,这种癌-神经倾向的现象是癌细胞通过神经周围间隙内的淋巴管扩散,是一个直接的相互作用过程[33].有趣的是,一些研究发现神经周围间隙缺乏淋巴管[34,35].这意味着癌细胞在这种情况下在神经周围空间扩散,这可能是一个纯粹的力学概念,因为沿着神经周围鞘,细胞的阻力最小[36,37].
Cancer-nerve监管
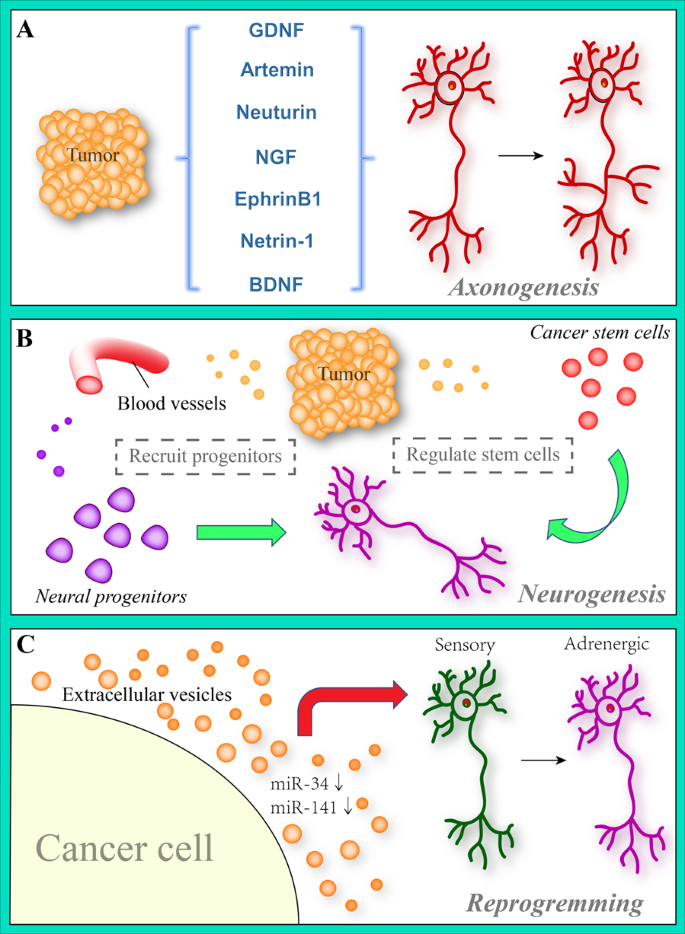
由于肿瘤生长需要增加血管生成,血管密度增加是肿瘤组织中最早观察到的组织学变化之一。先前的研究表明,随着癌症从肿瘤前病变发展到显性癌症,神经密度几乎可以翻一番,达到非肿瘤对照组的水平[38,39].就像电线给电路供电一样,神经可以被认为是向组织提供信息输入。去神经模式阻断了这一信号机制,因此被认为是治疗肿瘤的有效方法(图。1).
癌症相关axonogenesis
共培养实验发现,小鼠背根神经节在前列腺癌细胞上形成凸起,促进神经细胞向癌细胞分化(也观察到癌细胞向神经迁移),缩短癌-神经距离,从而促进癌-神经交联系统的形成[36].器官和组织中轴突的形成增加了神经密度。Ayala等人通过对前列腺的二维和三维重建,发现前列腺癌患者组织中的神经密度和大小明显增加,证实了与癌症相关的神经轴突的形成。轴突发生在前列腺癌前病变中已被观察到,可能是前列腺癌起始的早期事件或关键因素[38].此外,同一研究还发现轴突引导分子信号素是轴突发生中最大、最重要的家族,在研究中发现信号素4 F在DU-145细胞中高表达,并可由这些细胞与PC-12细胞共培养时分泌。它可能通过与神经蛋白酶(NPs)的PDZ (PSD95, disc -large和ZO1)结合域结合序列释放潜在的能力[40].与阴性对照组相比,S4F诱导神经突萌发,神经突长度增加近3倍。另一项研究观察到S4F的小干扰RNA (siRNA)抑制剂减少了神经元过度生长和神经突发芽[38].这是第一次发现癌细胞分泌一种已知的促进轴突发生的嗜神经分子。有趣的是,研究发现CD72和Tim2是与信号素结合的免疫相关分子,尽管其亲和力较低,但仍能促进T细胞的激活和分化[41,42].这表明信号素不仅在轴突发生中具有多种功能,而且还参与免疫系统。
随后的乳腺癌研究也表明乳腺癌细胞促进轴突发生。在n -甲基-n -亚硝基脲(MNU)诱导的乳腺癌大鼠模型中,免疫荧光实验显示,随着神经密度的增加,乳腺癌组织中产生了轴突。有趣的是,在癌组织中检测到感觉神经和交感神经,但未观察到副交感神经[43,44].感觉神经的分布和交感-副交感神经的失调与癌症的发生和发展密切相关。头颈部鳞状细胞癌[45]、胰管腺癌[46]、子宫颈癌[47],以及基底细胞癌[48都表现出对感觉神经的依赖。如前所述,前列腺癌细胞诱导交感神经轴突发生,交感神经激活诱导肾上腺素能受体激活,进而加速肿瘤生长,而瘤内交感神经激活增强细胞对细胞毒性化疗药物的抗性[49,50,51].根据上述研究,癌症相关轴突发生多见于感觉神经和交感神经,癌细胞对副交感神经轴突发生的影响有待进一步研究和探索。这些研究还表明,交感神经信号可能是一个潜在的治疗靶点,与癌症相关的轴突发生也可能推动癌症进展。然而,如何通过它们之间的交互传递信息的问题仍然没有答案。对外泌体的深入研究可能会在这方面提供良好的结果。
Paola等在一项肿瘤细胞调节轴突发生的研究中发现,在体内外泌体释放受损的癌细胞对神经的影响低于对照组,抑制外泌体释放也减弱了肿瘤神经的支配[52].在体外和体内,外泌体中的EphrinB1显著促进轴突发生和肿瘤神经支配,而EphrinB1的缺失没有引起这一现象[52].与hpv阴性癌外泌体相比,高表达ephrinB1的hpv阳性口腔鳞癌外泌体具有更强的轴突发生能力。在结直肠癌细胞系、黑素瘤细胞系和乳腺癌细胞系中也观察到类似的结果(所有三种外泌体都用CD9标记)[52].EphrinB1可激活Eph受体酪氨酸激酶,诱导MAPK信号通路激活[53],但在轴突发生过程中,ephrinb1相关MAPK激活的意义是一个谜。
综合来看,这些结果表明CD9+hpv阳性癌细胞释放的外泌体在体内有更大的促进癌症神经支配的能力[52].来自其他癌细胞系的外泌体在体外也显示出促进轴突发生的证据,这表明在其他实体癌症中,癌症释放的外泌体可能诱导癌症神经支配,从而通过轴突发生提供丰富的血液供应,促进癌症的生长[52].与此一致的是,在之前的几项研究中发现ephrinB1具有血管生成特性[54,55].研究还发现神经与血管具有一定的分布相似性[43].此外,最近的一项研究发现,缺氧诱导的促红细胞生成素(EPO)/EPOR相关的树突棘密度可能通过转录前调节发挥作用,因为海马CA1区锥体神经元中的EPO和EPOR转录本[56].有人提到肿瘤的一个特征就是它的微环境中有很多缺氧区域[57,58],因此,TME中缺氧对轴突发生的调节作用尚不明确,结合上述情况,在一些神经支配的肿瘤中,如PC、CRC等,缺氧可能对轴突发生有很大的影响。
这些研究都表明神经与轴突发生之间存在一定的相关性;然而,不管相关因素的综合作用如何,干扰癌症外泌体的释放或阻断神经对外泌体的反应能力都可能是一种有效的癌症治疗策略。虽然这一概念需要严格的测试,但如果被证明是有效的,它有可能推动重要的临床转变。
癌症驱动神经发生
除了轴突发生的研究外,Ayala等人提出癌细胞可以促进神经发生[38].在前列腺癌中,神经节中神经元数量的增加表明发生了一种神经遗传过程,这是癌症发生和进展的基础[38].然而,值得注意的是,这一过程可能更具有癌症特异性。在健康的前列腺,交感神经损伤后可以再生;研究推测这可能是轴突发生的结果,没有神经发生的证据[59].在前列腺癌中,与正常前列腺组织相比,新形成的自主神经渗透到肿瘤中,分别通过激活-肾上腺素能信号和毒理学胆碱能信号,促进了癌症的发生和发展[60,61].DCX是位于发育中的中枢神经系统和成人神经源区神经前体的典型细胞标记物[62,63,64,65].人前列腺原发癌基质中含有dcx阳性细胞,dcx阳性细胞也表达特定的神经祖细胞标记物,如PSA-NCAM [66]和Internexin [67,68].Mauffrey等人表明,神经祖细胞通过血流从脑室下区的神经源区迁移到癌性和转移性部位,在那里它们分化为成熟的肾上腺素能神经表型[69].前列腺癌患者分为高危组和低危组,其中dcx阳性细胞的密度与癌症侵袭和复发密切相关,dcx阳性祖细胞启动神经发生并可分化为肾上腺素能神经,参与癌症的恶性进展,但如何招募细胞并实现分化的具体机制仍是一个谜[37,69].本研究揭示了中枢神经系统与前列腺癌的相互作用,揭示了中枢神经前体细胞能分化为肾上腺素能神经元的独特迁移和定向,促进了原发肿瘤的发生和转移。同样,在肺腺癌中,这一过程也可以在不引发骨转移的情况下增加骨基质活性,并从远处驱动骨中性粒细胞反应[70].
这些研究说明了癌症如何与远处的器官和组织进行通信,以招募它们所需的细胞,并强调了神经发生的重要性。然而,值得注意的是,癌症也会以同样的方式消耗正常细胞;事实上,一些临床肿瘤学研究已经清楚地表明,接受化疗的患者出现脑神经祖细胞损伤和认知能力下降的风险更大;然而,在未接受化疗的患者中,癌细胞对神经祖细胞的耗竭也可能导致认知障碍[69].这些结果为诊断和监测癌症的发展开辟了一条新的途径,并提示了抑制神经祖细胞向癌细胞迁移和在TME中靶向神经祖细胞的治疗潜力。
除了远程调控,癌症还可以从癌症干细胞中形成新的神经元。卢等人。[71]从胃癌和结直肠癌患者组织中获得癌症干细胞(CSCs),通过皮下注射和腹腔注射构建模型,采用免疫荧光检测,结果显示细胞在体内对神经标志物MAP呈阳性反应,说明部分单克隆CSC细胞在体外可诱导分化为神经细胞,结直肠和胃CSCs中有部分分化的交感神经标记物酪氨酸羟化酶(TH),分化的胃CSCs中有表达副交感神经标记物泡状乙酰胆碱转运体(VaChT)的细胞[71].这些数据表明,人类胃和结直肠CSCs可以产生功能自主神经细胞,这种新的神经细胞的出现部分依赖于CSCs的分化。削弱CSCs产生神经元的能力可以在一定程度上抑制癌症的生长。此外,CSCs转分化为血管内皮的能力可能是癌症血管生成和耐药的机制之一[72].因此,有必要以CSCs向神经元分化为靶点,并在其他方向干扰CSCs的分化,以防止癌症对抗神经/血管治疗的耐药。
癌症诱发神经重新编程
研究发现,外泌体诱导的神经重编程通常在癌症发展过程中被观察到,这表明癌症衍生的细胞外囊泡(EV)在癌症相关的轴突发生中起作用。p53缺失的头颈部癌细胞外泌体可携带多种mirna参与轴突发生,而p53敲除或突变(p53C176F和p53A161s)会增加神经纤维的数量[45].外泌体mirna的RNA测序分析显示,差异表达基因与神经元生长、形态发生、突触发生、分化、干性和突触传递高度相关[45].与TP53-WT相比,它明显增加了TP53-Mut或缺陷OCSCCs中酪氨酸羟化酶(TH,肾上腺素能神经)阳性纤维的密度,而泡状乙酰胆碱转运体(副交感神经)阳性纤维的密度几乎没有变化[45].肾上腺素能神经元的聚集与源于p53缺陷癌细胞的细胞外囊泡有关。此外,多项体内研究表明,瘤内注射p53缺陷ev后可检测到去甲肾上腺素分泌,这表明p53缺陷外泌体可诱导神经重编程,而敲除Rab27A和Rab27B可抑制重编程过程[45].Rab27A和Rab27B是EV释放过程中的关键蛋白[73,74];ev可参与细胞间通讯和TME的调控;因此,干扰这些Rab蛋白将破坏囊泡运输和选择性装载过程,可能为预防癌症的恶性表现提供一种有效途径[75].对ev中miRNAs的测序和分析显示,p53缺失的OCSCC ev中miR-34a和miR-141-5p的表达显著降低,敲除野生型p53细胞ev中miR-34a和miR-141-5p可能导致与p53缺失组相似的结果。然而,miR-141-5p的作用较弱,这表明ev中的miR-34a和miR-141-5p参与了神经重编程过程,而miR-34a发挥了主要作用[45].此外,miR-34a水平的降低不仅促进了感觉神经的神经发生,还诱导了能产生去甲肾上腺素的神经的转分化[45].
前期研究表明miR-34a在间充质干细胞(mesenchymstem cells, MSCs)和CSCs的分化中发挥重要作用[76,77,78].有趣的是,miR-34a在成年哺乳动物大脑中高度表达,并已被证明参与一系列神经发育和神经病理过程。MiR-34a调控神经干细胞/祖细胞分化和神经发生[79].这些结果提示了一种新的潜在机制,肿瘤细胞在微环境中重新编程神经细胞。
在这里,作为延伸,我们注意到miR-34a的敲低不仅诱导了神经重编程,而且还促进了感觉神经发生。根据生理神经分布特征,口腔三叉神经分布广泛,口腔癌相关疼痛是最常见的症状[45,80,81,82].因此,miR-34a可能在抑制神经浸润的基础上,对缓解口腔癌患者癌相关疼痛具有一定意义;但应注意不同类型癌症在生理特征等方面的差异。例如,自主神经在前列腺癌、胰腺癌、乳腺癌等的TME中起主导作用,但在其他癌症中的作用则不太确定[28].
神经在肿瘤生物学中的作用
到目前为止,我们已经总结了邻近神经细胞对癌细胞的调节,但神经对癌症的影响是广泛而复杂的,初步研究神经对癌症生物学的影响是受到临床观察的启发,这些临床观察表明压力和癌症进展之间存在潜在联系[83,84,85].由于外周应激反应系统异常,包括下丘脑-垂体-肾上腺轴和糖皮质激素,以及交感神经-肾上腺轴[86].交感神经系统(SNS)通过局部交感神经系统或肾上腺系统释放儿茶酚胺进入循环系统,调节几乎所有人体器官的功能[86,87,88,89].最近的药物流行病学数据显示,在诊断前服用β -肾上腺素能拮抗剂(也称为β -受体阻滞剂)的癌症患者不良事件减少[90,91,92,93].
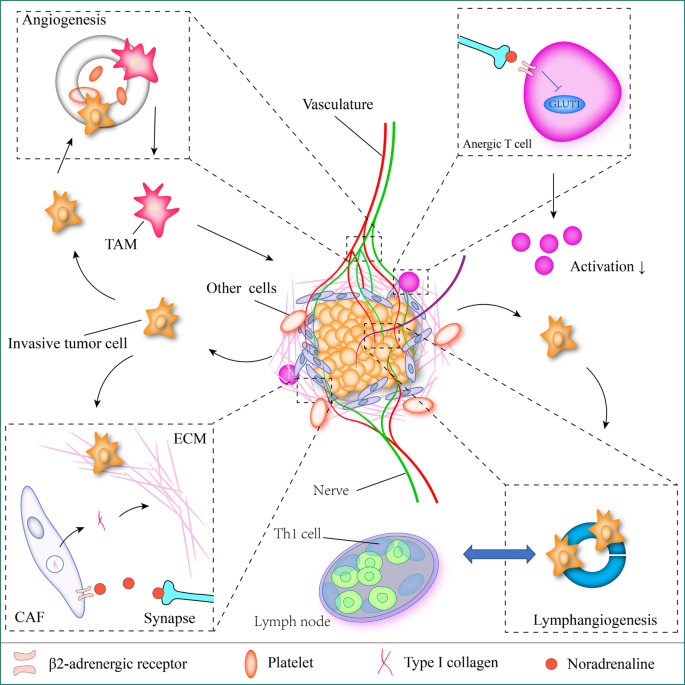
活体动物模型实验分析表明,行为应激可加速各种癌症的进展,包括乳腺癌、前列腺癌、卵巢癌[94,95,96,97]、成神经细胞瘤[98,99],黑素瘤[One hundred.,101]、胰腺癌[102]及某些造血系统癌症(如白血病)[103,104].癌症进展的机制还涉及DNA修复、癌基因激活、血管生成、淋巴管生成、免疫和炎症、成纤维细胞、细胞外基质等(图)。2).中枢神经系统和TME中的神经细胞都能对癌症产生重大影响[105].在本节中,我们将讨论神经对TME的各个组成部分的影响。
血管生成
血管生成,即从现有的血管系统中形成新的血管,是癌症生长所必需的[106].在组织基质组成上,肾上腺素能神经与血管(主要是小动脉和毛细血管)密切相关,神经纤维在组织中有序分布(并列分布),神经和血管网络的连接机制似乎有很深的相似性,轴突引导分子参与了这一共同的调控模型[107,108].最近的一项研究表明,肾上腺素能神经源性去甲肾上腺素在前列腺癌中激活内皮β-肾上腺素能受体信号通路,是促进癌细胞指数增殖的关键因素[39].ADRB2(编码β2-肾上腺素能受体的基因)的缺失通过增强内皮细胞的氧化磷酸化来抑制血管生成。Adrb2与编码细胞色素IV氧化酶组装因子的Cox10共缺失可阻止Adrb2缺失引起的代谢转化,从而挽救前列腺癌的进展[39].神经化学因素,如儿茶酚胺有助于ADRB2的激活,以及内皮细胞环AMP (cAMP)-蛋白激酶A (PKA)信号通路的激活[97],它是通过Notch和自噬等多种途径进行血管生成的关键启动子[109,110].这为靶向cAMP信号预防TME血管生成提供了一种新的策略。在组织发育和癌症进展过程中,内皮细胞通常依赖糖酵解代谢过程进行定向细胞迁移,这对血管生成是必要的[111,112].神经荧光共定位(TH+)和内皮细胞(CD31 .+)在高度前列腺上皮内瘤变组织中显著增加,提示神经细胞与内皮细胞之间物理距离的缩短与前列腺癌恶性能力的增加有关。有趣的是,在肿瘤形成的前18天内,对照组和Adrb2受体敲除组的癌症组织在大小、血管通透性或缺氧方面没有差异,而在18天后,差异显著[39].
Lymphangiogenesis
淋巴系统在免疫功能中起着重要作用,因此可以影响疾病的进程。生理上,淋巴系统通过淋巴管将细胞和溶质从周围的间质液引导至淋巴结,并在淋巴结进行免疫检查,从而维持内部环境的稳定[113,114].此外,淋巴系统通过将免疫细胞从感染部位转移,帮助消除炎症[115].在癌症中,淋巴系统通过提供癌细胞逃逸的途径来促进疾病进展,同时也是促进癌细胞侵袭特性的趋化因子的丰富来源[114,116,117].淋巴系统类似于血管系统,受肾上腺素能神经和SNS纤维高度支配[118].急性SNS活性已被证明可增加淋巴收缩[119,120]和淋巴细胞向淋巴循环的输出量[121].在乳腺癌原位和转基因模型中,应激促进神经系统中去甲肾上腺素的释放,激活癌源性VEGFC的释放,促进淋巴管生成和重塑,并增加气孔细胞中VEGFR3(FLT4)的表达[122].此外,β-肾上腺素能受体信号通路促进COX2的巨噬细胞表达,增加PGE2的分泌,从而激活癌源性VEGFC的释放,促进转移[122].注意到,在淋巴管生成过程中,神经源性儿茶酚胺可能通过炎症信号和VEGFC/FLT4发挥积极作用。与其对血管生成的作用类似,交感神经去支配已被证明可以减少淋巴管的形成,这与减少癌症侵袭有关[123].深入研究发现β -受体阻滞剂降低了淋巴结和远处转移的风险[122,为减少淋巴结转移和远处转移提供了临床治疗方向。
免疫和炎症
淋巴细胞的活化和肿瘤的浸润是宿主抗癌免疫反应的关键组成部分[124].压力会增加淋巴细胞的活化,并产生促炎细胞因子,如白细胞介素-6 (IL-6) [125].应激患者卵巢癌组织中去甲肾上腺素和IL-6的表达水平较非应激患者明显升高(年龄和疾病分期相匹配)[126].体外研究表明,去甲肾上腺素通过作用于β2-肾上腺素能受体信号通路,促进卵巢癌细胞促炎细胞因子IL-6和IL-8的释放[126,127].然而,高度神经支配的组织表现出低水平的活化T辅助细胞[124,128,129].激活β2-肾上腺素能受体可抑制GLUT1表达,降低CD8对葡萄糖的摄取+T细胞,从而抑制其激活,通过免疫抑制导致免疫逃逸,此外,肾上腺素能信号激活损害CD8+t细胞线粒体功能及质量[130].这意味着肾上腺素能信号与T细胞代谢密切相关,并与免疫激活有关。此外,TME中TNF的增加有助于癌症相关巨噬细胞的募集,应激诱导的肾上腺素能神经激活导致乳腺癌异种移植模型瘤内TAM的显著增加[96].有趣的是,无论是TAMs、肿瘤浸润淋巴细胞(TILs),还是表达β2-肾上腺素能受体的髓源性抑制细胞(MDSCs),敲除MDSC ADRB2基因后,乳腺癌转基因小鼠的肿瘤生长都减慢了,血浆免疫抑制分子也减少了[131].因此,TME中神经信号在免疫系统中的作用机制仍需进一步探讨。总之,去神经或取消肾上腺素能信号可能为提高高度神经支配的癌症的免疫治疗反应提供新的途径。
成纤维细胞和细胞外基质
TME的三维结构和组成的变化极大地影响癌症的进展和转移[132,133,134].例如,在许多癌症中,致密的细胞外基质(ECM)沉积是促进性结缔组织反应的一部分,它作为对抗免疫细胞浸润的物理和化学屏障,创造了一种免疫特权环境[133].同时,ECM的组成改变为富含I型胶原蛋白的环境,形成一种血管生成超级聚合物,帮助新血管和神经的迁移[135,136,137,138].此外,尽管ECM密度的增加有助于阻止癌症早期免疫细胞的进入,但在疾病进展的晚期转移阶段,基质金属蛋白酶(MMPs)对ECM的降解允许癌细胞迁移和扩散[139].胶原蛋白重塑是癌症晚期扩散的关键。在PDAC的原位小鼠模型中,应激诱导的肾上腺素能信号通路使间质室中的MMP表达增加了100倍以上,并进一步增加了转移,而用普萘洛尔抑制β-肾上腺素能受体抑制了这种表型[102].类似地,在乳腺癌原位小鼠模型中,间质中的肾上腺素能信号通过肾上腺素能受体增加了胶原蛋白重塑,从而促进了转移,而去甲肾上腺素的减少则抑制了这一过程[140].
DNA修复
β-肾上腺素能信号通路可抑制DNA损伤修复和p53相关凋亡过程[99,141,142,143],提示SNS活性增加可能促进肿瘤起始或染色体不稳定。肾上腺素能信号长期激活可导致ARRB1/ akt介导的MDM2激活[141].MDM2作为E3连接酶,通过与p53相互作用促进p53的快速降解,并抑制其转录[144].肾上腺素能信号通路激活MDM2,促进胸腺和睾丸内p53快速降解,导致受损DNA积累,增加组织染色体畸变的概率;β受体拮抗剂普萘洛尔阻断了这一过程[141].在乳腺癌中也发现了类似的结果,普萘洛尔有效地增加了p53的表达,抑制了癌细胞的生长[145].但值得注意的是,不同组织和细胞的生理状况不同,神经分布也有显著差异,肾上腺素能受体在不同癌细胞中的分布也有自己的特点[28].
癌基因的激活
β-肾上腺素能信号通路刺激多种致癌信号通路,包括Src和HER2(由ERBB2编码)[146].在her2阳性细胞中,β -肾上腺素能受体激活信号换能器和转录激活因子3 (STAT3),而STAT3反过来激活ERBB2启动子以刺激基因转录[147,148].肾上腺素能受体诱导的去甲肾上腺素释放通过ADRB/cAMP/PKA轴使SCR S17磷酸化,并进一步激活Y419磷酸化,导致肿瘤生长[28].有趣的是,在乳腺癌中,另一项研究发现,HER2过表达或ERK信号的持续激活可导致乳腺癌细胞分泌肾上腺素,从而上调β2受体的表达。激活β2受体又能促进HER2 mRNA的表达,增强其启动子活性[147].这种正反馈通路对乳腺癌细胞的增殖和迁移至关重要。
一项有趣的研究发现,神经应激会诱导儿茶酚胺的分泌,儿茶酚胺参与病毒相关的致癌过程[149].在b细胞淋巴瘤和卡波济肉瘤中,β-肾上腺素能信号通路诱导PKA/cAMP反应元件结合蛋白(CREB)信号通路并激活卡波济肉瘤相关人类疱疹病毒8 (HHV8)基因组。病毒基因组上调HHV8的主要调控因子Rta的表达[149].这为了解病毒引起癌症的分子机制提供了依据。
靶向肿瘤神经支配
自上个世纪以来,研究人员一直试图通过外科手术切断神经来阻止肿瘤的生长和转移(表2)1) [48,50,61,94,96,97,98,99,102,104,150,151,152,153,154,155].采用手术或化学方法切断交感肾上腺素能神经可抑制前列腺癌的发生,阻断副交感胆碱能神经信号可减少前列腺癌细胞的扩散[61].同样,迷走神经切开术或真皮感觉神经消融术分别损害胃癌或皮肤癌(非黑色素瘤形式)的发展,[48,155].其他方法,如6-羟基多巴胺(6HODA)和电刺激,也用于阻断神经输入[28,156].但这些技术也存在一些不足,即不同的肿瘤组织具有不同的神经支配方式,如胃、胰腺、乳腺等分泌腺肿瘤,神经支配程度不同[122,157,158因此,靶向神经输入信号在某些特定肿瘤中提供了一种有前途的方法,但在其他肿瘤中还需要进一步的探索。
关于肿瘤生物学中自主神经系统的调控,特别是副交感神经系统的调控,仍有许多问题有待澄清。在靶向治疗时代,放疗和化疗结合辅助治疗策略,如β阻断,可以提供一种高度协同的方法来控制癌症进展(表2) [159,160,161,162,163,164,165,166,167,168,169,170,171,172,173].此外,社会心理因素对肿瘤的影响也不容小觑。长期以来,人们一直怀疑压力、抑郁和社会支持等生物行为会影响癌症的发展和疾病进展,目前正在探索这些影响的分子机制[83].实验室模型的最新发现表明,生物行为可以通过神经内分泌系统直接影响癌细胞的功能活性[97].一项大规模研究调查了4825名受试者的心理因素与肿瘤发生之间的关系,发现慢性心理压力与肿瘤发生的高风险相关[174].有压力的性格、糟糕的应对方式、消极的情绪反应和较差的生活质量与较高的癌症发病率、生存率和癌症死亡率有关[85].慢性和急性压力也是癌症患者复发的预测因素[175].有趣的是,血浆肾上腺素和去甲肾上腺素水平在慢性和急性应激期间显著波动[176].同样,在前列腺癌和卵巢癌的小鼠模型中,压力和焦虑导致组织儿茶酚胺的增加,这激活了ADRB2/cAMP/PKA信号,并促进了肿瘤生长和血管生成[94,97].但需要注意的是,除了神经内分泌激素,外周神经也起着重要作用。研究人员发现,一些癌症组织高度神经支配,这些肿瘤中的神经细胞可以以外泌体的形式释放信号因子,促进肿瘤生长[45].
抗精神病药物的使用是否可以阻止神经应激信号从而抑制肿瘤生长,还有待进一步探索。因为氟西汀是一种抗抑郁药,它对小鼠有抗癌作用[177],但在某些情况下,也可直接作用于肿瘤细胞,促进肿瘤细胞增殖[178].值得一提的是,高血糖、高血脂、高龄、社会支持、压力、抑郁等都会改变神经内分泌系统的活性[83].除了直接激活儿茶酚胺外,最近的研究报道,高脂饮食喂养和棕榈酸可以通过Sp1增加CRC小鼠肿瘤组织中β2AR的表达,cAMP/PKA的激活增加了激素敏感脂肪酶(HSL)的磷酸化,HSL是一种激活FFA的脂肪酶,FFA被用作燃料为癌症生长提供能量,在S552 [179,180].目前,临床前药理研究正在为β-阻滞剂作为临床肿瘤新辅助剂转化为现有治疗策略奠定基础[181].然而,众所周知,β-AR拮抗剂可产生严重的副作用,包括心力衰竭、心动过缓、长期低血糖、支气管痉挛、间歇性跛行、心脏传导阻滞、雷诺现象和神经反应,包括抑郁、疲劳和噩梦[182,183].对于经历心理压力、饮食中含有高脂肪含量或有其他并发症(如糖尿病)的CRC患者,HSL抑制剂可能是βAR拮抗剂的可行替代品[180].
结论及备注
神经信号在癌症发生和发展中的作用被进一步了解后,已成为一种治疗靶点[184,185].随着外科技术的进步和对自主神经解剖学的更深入了解,更精确的去神经手术已经被开发出来。
胰腺癌的化学去神经治疗在减少临床上无法控制的癌痛方面是有效的,但正如作者所述,这种去神经治疗不是永久性的[186].反复注射肉毒毒素可有效治疗小鼠前列腺癌[187];然而,这项研究并没有转化为人类临床成功(NCT01520441);因此,去神经治疗的频率、剂量和持续时间有待进一步研究。在胃癌的临床治疗中,行迷走神经切开术联合胃切除术的患者胃癌复发率低于单行胃切除术的患者[155].提示去神经可以作为一种辅助治疗,提高手术治疗的成功率。
在这篇综述中,我们提出的证据表明,激活重编程信号和再生途径招募神经细胞是癌症发生和发展的重要因素。自主神经和感觉神经群在不同肿瘤组织中的作用可能因原生组织的类型以及原生神经的支配模式而异。随着最近基因工程和成像技术的进步,神经细胞在TME中的作用有了进展;然而,仍有许多问题有待解答。例如;在肿瘤发生的不同阶段,神经发生和轴突发生涉及哪些因素?我们如何在不影响身体其他部位已建立的神经回路的情况下靶向肿瘤特异性通路?神经系统会作为反馈来调节肿瘤的发生和发展吗?新兴技术,如电子药物,可能有助于弥合这一差距,并提供微创工具[188,189,190].综上所述,这些数据表明神经聚集是癌症的一个新特征,多种外科、药理和其他方法干扰TME中的神经信号是一种有前途的癌症治疗新策略。
参考文献
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. 2018年全球癌症统计:全球185个国家36种癌症的发病率和死亡率。中华癌症杂志,2018;
感觉神经元、神经免疫通路和瞬时受体电位香草素1 (TRPV1)通道在乳腺癌转移小鼠模型中的作用。中国癌症杂志。2020;69:307-14。
我们需要重新定义癌症转移和分期的定义吗?乳房病2006;26:3-12。
赵志军,赵志军。组蛋白在癌症中的表观遗传修饰。《基因组生物学》2019;20:245。
Monk M, hold C.人类胚胎基因在癌细胞中重新表达。致癌基因。2001;20:8085 - 91。
Fraser SP, Diss JK, Chioni AM, Mycielska ME, Pan H, Yamaci RF,等。电压门控钠通道表达与人乳腺癌转移的增强。临床癌症杂志2005;11:5381-9。
巴帕特AA, Hostetter G,冯霍夫DD, Han H.神经周围侵犯与胰腺癌相关疼痛。2011; 11:695-707。
Demir IE, Friess H, Ceyhan GO。胰腺癌间质生物学中的神经-癌症相互作用。《前沿物理》2012;3:97。
Deshmukh SD, Willmann JK, Jeffrey RB。胰腺腺癌侵袭胰腺外神经周的途径:三维体积呈现多层螺旋ct成像评估。美国大学学报(自然科学版)。2010;194:668-74。
雷勇,唐磊,谢勇,咸鱼勇,张磊,王鹏,等。金纳米团簇辅助传递NGF siRNA有效治疗胰腺癌。Nat Commun. 2017;8:15130。
邓杰,尤强,高勇,于强,赵鹏,郑勇,等。胃癌神经周围侵犯的预后价值:系统回顾和荟萃分析。PLoS One. 2014;9:e88907。
Espana-Ferrufino A, Lino-Silva LS, Salcedo-Hernandez RA。pT3和pT4胃癌的膜外神经周侵犯。中华病理学杂志,2018;52:79-84。
乌斯塔利奥卢BB, Bilici A, Seker M, Kefeli U, Aydin D, Celik S,等。手术胆囊癌的预后因素。中华胃肠病杂志2019;50:451-7。
郭文杰,徐斌,李志强,等。舌癌伴神经周围侵犯的复发模式。头颈。2018;40:1287-95。
张志刚,张志刚,张志刚。腮腺恶性肿瘤周围神经浸润的研究进展。耳鼻咽喉头颈外科2018;158:1035-41。
Schmitd LB, Scanlon CS, D 'Silva NJ。头颈部癌症的神经周围侵犯。J Dent res 2018; 97:742-50。
崔玲,史勇,张国宁。神经周围侵犯是宫颈癌的预后因素:系统回顾和荟萃分析。《妇产科杂志》2015;292:13-19。
朱勇,张刚,杨勇,崔林,贾松,史勇,等。早期宫颈癌神经周围侵犯及其术后相关性。《科学》2018;15:655 - 61。
谭晓霞,陈志伟,陈志伟,等。神经纤维在嗜神经性癌-胰腺癌和胆管癌肿瘤微环境中的作用。致癌基因。2021;40:899 - 908。
王华,郑强,陆震,王玲,丁玲,夏玲,等。神经系统在癌症中的作用:综述。《细胞死亡迪斯科》2021;7:76。
尹磊,李娟,王娟,蒲涛,魏娟,李强,等。MAOA通过SEMA3C/PlexinA2/NRP1-cMET信号通路促进前列腺癌细胞神经周侵袭。致癌基因。2021;40:1362 - 74。
李志强,李志强,李志强,等。神经周围侵犯对胃癌预后的影响。今日外科,2003;33:95-100。
陈红,刘东,郭玲,程霞,郭娜,史敏。慢性心理应激通过激活肾上腺素能信号修饰转移前小位,促进循环乳腺癌细胞的肺转移定殖。中华病理学杂志。2018;244:49-60。
黄燕,何磊,董东,杨超,梁超,陈晓,等。结直肠癌神经周围侵犯的个体化预测:放射组学预测模型的开发和验证。中国癌症杂志2018;30:40-50。
Kinugasa T, Mizobe T, Shiraiwa S, Akagi Y, Shirouzu K.神经周围侵犯是直肠癌接受治愈性手术患者的预后因素和治疗指标:2000-11年单中心研究数据抗癌决议2017;37:3961-8。
Zare-Bandamiri M, Fararouei M, Zohourinia S, Daneshi N, Dianatinasab M.预测初次治疗后结直肠癌复发的危险因素:一项5年队列研究。中华癌症杂志2017;18:2465-70。
王志强,王志强,王志强,等。神经营养因子artemin影响慢性胰腺炎神经损伤的程度和生长。肠道。2007;56:534-44。
Zahalka AH, Frenette PS.癌症中的神经。癌症,2020;20:143-57。
谢涛,李志强,李志强,李志强。肿瘤细胞与肿瘤细胞相互作用的研究进展。癌症。2020;12:3741。
丁勇,李敏,高勇,卜鹏,Coarfa C, Miles B,等。神经肽Y神经旁分泌对前列腺癌发生和治疗耐药性的调节。前列腺癌。2021;81:58 - 71。
杜beykovskaya Z, Si Y, Chen X, Worthley DL, Renz BW, Urbanska AM,等。神经支配刺激脾TFF2抑制髓细胞扩张和肿瘤。Nat Commun. 2016;7:10517。
杨田,张志刚,大井勇。感觉神经与骨癌的串扰。Curr osteoporosis众议员2018;16:648-56。
彭宁顿,潘提斯,李志强,李志强。根治性前列腺切除术治疗前列腺癌神经周围淋巴侵犯的意义。吴志强。2007;26(1):1 - 7。
张志刚,张志刚,张志刚,等。前列腺神经周围间隙与肿瘤扩散的超微结构研究。中华外科杂志,1980;4:143-8。
罗丹AE,拉尔森DL,罗伯茨DK。前列腺癌侵犯神经周围空间的性质。癌症。1967;20:1772-9。
Ayala GE, Wheeler TM, Shine HD, Schmelz M, Frolov A, Chakraborty S,等。体外背根神经节和人前列腺细胞系的相互作用:重新定义前列腺癌的神经周围侵袭。前列腺癌。2001;49:213-23。
Silverman DA, Martinez VK, Dougherty PM, Myers JN, Calin GA, Amit M.癌症相关神经发生和神经癌症相声。癌症法案2021;81:1431-40。
Ayala GE, Dai H, Powell M, Li R, Ding Y, Wheeler TM,等。前列腺癌中与癌相关的轴突发生和神经发生。临床癌症决议案2008;14:7593-603。
Zahalka AH, Arnal-Estape A, Maryanovich M, Nakahara F, Cruz CD, Finley LWS,等。肾上腺素能神经在前列腺癌中激活血管代谢开关。科学。2017;358:321-6。
王玲,曾华,王萍,Soker S, Mukhopadhyay .神经蛋白酶1介导的血管通透性因子/血管内皮生长因子依赖性内皮细胞迁移。中国生物化学杂志,2003;
熊野高A,丸川S,铃木K,竹原N,渡边C,程e,等。IV类信号量Sema4A增强t细胞活化并与Tim-2相互作用。大自然。2002;419:629-33。
熊野高A,渡边C,李毅,王旭,史伟,荒木华,等。CD72作为CD100中IV类信号的淋巴细胞受体的鉴定:调节B细胞信号的一种新机制。免疫力。2000;13:621-31。
韩华,杨超,张勇,韩超,张刚。血管内皮生长因子介导大鼠乳腺癌轴突发生。Am J Pathol. 2021; 191:515-26。
赵强,杨勇,梁旭,杜刚,刘玲,卢玲,等。乳腺癌神经发生的临床病理意义。BMC Cancer. 2014;14:484。
Amit M,高桥H, Dragomir MP, Lindemann A, gleer - netto FO, Pickering CR,等。p53缺失导致头颈癌患者神经元重编程。大自然。2020;578:449-54。
Saloman JL, Albers KM, Li D, Hartman DJ, Crawford HC, Muha EA,等。在胰腺导管腺癌的遗传模型中,感觉神经元的消融减缓了癌症的起始和进展。自然科学进展(英文版);2016;
Lucido CT, Wynja E, Madeo M, Williamson CS, Schwartz LE, Imblum BA,等。宫颈癌的神经支配由癌源性外泌体介导。妇科肿瘤杂志2019;154:228-35。
Peterson SC, Eberl M, Vagnozzi AN, Belkadi A, Veniaminova NA, Verhaegen ME,等。基底细胞癌优先发生于毛囊和机械感觉壁龛内的干细胞。细胞干细胞。2015;16:400-12。
陈红,张伟,程霞,郭玲,谢松,马艳,等。β 2- ar激活通过上调Sirt1调节p53乙酰化诱导宫颈癌细胞化疗耐药。中国癌症杂志,2017;
吴文杰,李文杰,李文杰,李文杰,等。房屋温度诱导的应激通过β - 2肾上腺素能受体激活驱动小鼠肿瘤模型的治疗耐药性。Nat Commun. 2015;6:6426。
Mravec B, Horvathova L, Hunakova L.癌症的神经生物学:β -肾上腺素能受体信号在各种肿瘤环境中的作用。国际分子生物学杂志2020;21:489。
Madeo M, Colbert PL, Vermeer DW, Lucido CT, Cain JT, Vichaya EG,等。癌症外泌体诱导肿瘤神经支配。Nat Commun. 2018;9:4284。
维米尔PD, Bell M, Lee K, Vermeer DW, wiingbg, Bilal E,等。ErbB2, EphrinB1, Src激酶和PTPN13信号复合物在人类癌症中调控MAP激酶信号。科学通报。2012;7:e30447。
Adams RH, Wilkinson GA, Weiss C, Diella F, Gale NW, Deutsch U,等。ephrinB配体和EphB受体在心血管发育中的作用:动脉/静脉结构域的划分,血管形态发生和新生血管生成。基因工程学报(英文版);1999;
小岛田,张建华,阿扎尔。ephrinB1/EphB1在碱性成纤维细胞生长因子诱导的角膜血管生成中的促血管生成作用。Am J Pathol. 2007; 170:764-73。
Wakhloo D, Scharkowski F, Curto Y, Javed Butt U, Bansal V, Steixner-Kumar AA,等。功能性缺氧通过脑促红细胞生成素促进神经可塑性和神经发生。Nat Commun. 2020;11:1313。
de Heer EC, Jalving M, Harris AL. hif,血管生成和代谢:乳腺癌中难以捉摸的敌人。J clinin Invest, 2020; 130:5074-87。
景霞,杨峰,邵超,魏凯,谢敏,沈华,等。缺氧通过调节肿瘤微环境在肿瘤治疗中的作用。《Mol Cancer》2019;18:157。
Kobayashi T, Kihara K, Hyochi N, Masuda H, Sato K.狗严重损伤交感神经通路投射到前列腺的长期自发再生。BJU国际杂志,2003;91:868-72。
Dobrenis K, Gauthier LR, Barroca V, Magnon C.粒细胞集落刺激因子对神经生长的脱靶效应促进前列腺癌的发展。国际癌症杂志2015;136:982-8。
马农C,霍尔SJ,林杰,薛X,戈贝尔L, Freedland SJ,等。自主神经发育有助于前列腺癌的进展。科学。2013;341:1236361。
Metzdorf J, Hobloss Z, Schlevogt S, Ayzenberg I, Stahlke S, Pedreiturria X,等。Fingolimod治疗辐射引起的神经退行性变。前沿神经科学。2019;13:699。
林强,沈峰,周强,黄鹏,林林,陈敏,等。白介素-1 β通过激活notch信号干扰出生后暴露于脂多糖的大鼠海马神经前体细胞的增殖和分化。美国化学与神经科学杂志2019;
吕震,陈勇,陈勇,刘志强,李志强,等。神经元祖细胞的吞噬活性调节成人神经发生。中国生物医学工程学报。2011;13:1076-83。
小泉H,希金波坦H,潘T,田中T,布林克曼BC,格里森JG。在成人前脑迁移过程中,双皮质蛋白保持双极形态和核易位。神经科学。2006;9:79 - 86。
张娟,焦娟。胚胎和成体神经干细胞与神经发生的分子标记物。生物医学学报。2015;
Kaplan MP, Chin SS, Fliegner KH, Liem RK。α -internexin是一种新型的神经中间纤维蛋白,在发育中的大鼠脑中先于低分子量神经纤维蛋白(NF-L)。中华神经科学杂志。1990;10:2735-48。
Schult D, Holsken A, Buchfelder M, Schlaffer SM, Siegel S, Kreitschmann-Andermahr I,等。神经元中间丝α -internexin在垂体前叶及相关肿瘤中的表达模式。垂体。2015;18:465 - 73。
Mauffrey P, Tchitchek N, Barroca V, Bemelmans美联社,Firlej V, Allory Y, et al。来自中枢神经系统的祖细胞驱动癌症中的神经发生。大自然。2019;569:672-8。
Engblom C, Pfirschke C, Zilionis R, Da Silva Martins J, Bos SA, Courties G,等。成骨细胞远程向肺肿瘤提供促癌的SiglecF(高)中性粒细胞。科学。2017;358:eaal5081。
卢荣,范超,上官伟,刘勇,李勇,尚勇,等。由癌干细胞产生的神经元支持癌症进展。信号传输目标,2017;2:16036。
巴特尔R,安德烈斯E,冈萨雷斯L,隆奇E,伊吉亚A,古铁雷斯-普拉特N,等。p38alpha通过TGF-beta和JNK信号通路调控肿瘤血管生成和间充质-内皮细胞转变。Nat Commun. 2019;10:3071。
Ostrowski M, Carmo NB, Krumeich S, Fanget I, Raposo G, Savina A,等。Rab27a和Rab27b控制外泌体分泌途径的不同步骤。细胞生物学杂志,2010;12:11-13。
Colombo M, Raposo G, Thery C.外泌体和其他细胞外囊泡的生物发生、分泌和细胞间相互作用。中国生物医学工程学报。2014;30:529 - 529。
Kalluri R, LeBleu VS.外泌体的生物学、功能和生物医学应用。科学。2020;367:eaau6977。
刘红,董颖,冯霞,李玲,焦毅,白松,等。miR-34a通过促进大鼠间充质基质细胞成骨分化促进辐照骨缺损大鼠骨再生。《干细胞研究》2019;10:180。
翁玉生,曾海燕,陈亚,沈国平,阿尔哈齐,陈丽敏,等。MCT-1/miR-34a/IL-6/IL-6R信号轴在三阴性乳腺癌中促进EMT进展、癌干性和M2巨噬细胞极化。《Mol Cancer》2019;18:42。
闫欣,唐波,陈波,单燕,杨红,重复性项目:肿瘤B .复制研究:microRNA miR-34a通过直接抑制CD44抑制前列腺癌干细胞和转移。Elife。2019;8:e43511。
蔡曦,唐波。miR-34a在神经生理学和神经病理学中的应用。中华神经科学杂志,2019;67:235-46。
张文杰,张文杰,张文杰,等。周围神经损伤和敏化是口腔癌周围神经侵袭性疼痛的基础。痛苦。2020;161:2592 - 602。
Wirth LJ, Plotkin SR, Emerick KS, Cunnane ME, Faquin WC。马萨诸塞州总医院的病例记录29 - 2012。49岁男性,口腔癌治疗后出现疼痛和脑神经麻痹。中华医学杂志(英文版)2012;
张志刚,张志刚,张志刚。口腔癌的临床特征。《口腔医学杂志》2010;46:414-7。
Antoni MH, Lutgendorf SK, Cole SW, Dhabhar FS, Sephton SE, McDonald PG,等。生物行为因素对肿瘤生物学的影响:途径和机制。癌症。2006;6:240-8。
Armaiz-Pena GN, Cole SW, Lutgendorf SK, Sood AK。神经内分泌对癌症进展的影响。《大脑行为学》,2013;30:S19-25。
张志刚,张志刚,张志刚。压力相关的社会心理因素与癌症的发病率和生存率有关吗?中华医学杂志,2008;5:466-75。
Glaser R, Kiecolt-Glaser JK。压力诱导的免疫功能障碍:对健康的影响。免疫杂志2005;5:243-51。
Chrousos GP, Gold PW。压力和压力系统失调的概念。Overv Phys Behav Homeost JAMA。1992; 267:1244-52。
姜林,苏辉,吴霞,沈辉,金明明,李勇,等。瘦素受体表达神经元Sh2b1支持交感神经系统,预防肥胖和代谢性疾病。Nat Commun. 2020;11:1517。
叶勇,Abu El Haija M, Morgan DA,郭东,宋勇,Frank A,等。内源性大麻素受体1和交感神经系统介导胃分流术的有益代谢作用。Cell代表2020;33:108270。
吴wf,王琳,Spetsieris N, Boukovala M, Efstathiou E, Brossner C,等。雌激素受体和植物雌激素治疗与前列腺中EGFR核易位的抑制有关。中国科学:自然科学,2011;
Caparica R, Bruzzone M, Agostinetto E, De Angelis C, Fede A, Ceppi M,等。β -受体阻滞剂在早期乳腺癌中的应用:系统回顾和荟萃分析ESMO Open. 2021;6:100066。
波泽尔斯基,刘骥,鲍泽,艾贝尔,唐斯,等。肾上腺素能拮抗剂和晚期前列腺癌患者的癌症特异性生存:一项退伍军人管理局队列研究。泌尿学。2021;155:186 - 191。
Oh MS, Guzner A, Wainwright DA, Mohindra NA, Chae YK, Behdad A,等。-受体阻滞剂对免疫检查点抑制剂治疗的非小细胞肺癌患者生存结局的影响临床肺癌。2021;22:e57-e62。
张晓东,张晓东,张晓东,等。行为压力加速了小鼠前列腺癌的发展。中国科学(d辑),2013;
麦登KS,斯普纳MJ,布朗EB。在高表达β - ar的乳腺癌细胞系中,β -肾上腺素能受体(β - ar)通过不同途径调节VEGF和IL-6的产生。乳腺癌治疗。2011;130:747-58。
Sloan EK, Priceman SJ, Cox BF, Yu S, Pimentel MA, Tangkanangnukul V,等。交感神经系统诱发原发性乳腺癌的转移开关。癌症法案2010;70:7042-52。
张志刚,韩丽丽,张志刚,张志刚,等。慢性压力促进卵巢癌小鼠模型肿瘤生长和血管生成。中华医学杂志2006;12:939-44。
Pasquier E, Street J, Pouchy C, Carre M, Gifford AJ, Murray J,等。β -受体阻滞剂通过直接抗肿瘤和抗血管生成机制增加成神经细胞瘤对化疗的反应。中华肿瘤学杂志,2013;
王志强,王志强,王志强,等。肾上腺素能受体拮抗剂普萘洛尔在成神经细胞瘤中的抗肿瘤活性。Oncotarget。2014;5:161 - 72。
Goldfarb Y, Sorski L, Benish M, Levi B, Melamed R, Ben-Eliyahu S.提高术后免疫状态和抵抗癌症转移:免疫刺激和预防过度手术应激反应的联合围手术期方法。Ann外科杂志,2011;253:798-810。
Hasegawa H, Saiki I.心理社会压力通过小鼠β -肾上腺素能激活促进肿瘤发展。中华癌症杂志2002;93:729-35。
Kim-Fuchs C, Le CP, Pimentel MA, Shackleford D, Ferrari D, Angst E,等。慢性压力加速胰腺癌的生长和侵袭:胰腺微环境中β -肾上腺素能信号的关键作用。《大脑行为学》,2014;40:40-7。
林志刚,李志刚,张志刚,张志刚。应激反应是否促进白血病进展?一项动物研究表明,肾上腺素和前列腺素- e2通过降低NK活性发挥作用。科学通报。2011;6:e19246。
Lamkin DM, Sloan EK, Patel AJ, Chiang BS, Pimentel MA, MA JC,等。慢性应激通过肾上腺素能信号增强急性淋巴细胞白血病的进展。脑行为学杂志,2012;26:635-41。
Cole SW, Nagaraja AS, Lutgendorf SK, Green PA, Sood AK。交感神经系统对肿瘤微环境的调节。癌症杂志。2015;15:563-72。
张文杰,张志强,张志强,等。血管生成在细胞增生向瘤变转变过程中的作用。大自然。1989;339:58 - 61。
动脉神经的发育与疾病。科学翻译,2014;6:52 - 9。
卡梅利特。P . Tessier-Lavigne .神经和血管连接的常见机制。大自然。2005;436:193 - 200。
nevetsky PI, Zhao X, Mathivet T, Aspalter IM, Stanchi F, Metzger RJ,等。camp依赖蛋白激酶A (cAMP-dependent protein kinase A, PKA)通过Notch-independent方式调节尖端细胞行为调节血管生成。发展。2016;143:3582 - 90。
赵x, nevetsky P, Stanchi F, Vion AC, Popp O, Zuhlke K,等。内皮细胞PKA活性通过磷酸化ATG16L1限制自噬来调节血管生成。Elife。2019;8:e46380。
De Bock K, Georgiadou M, Schoors S, Kuchnio A, Wong BW, Cantelmo AR,等。pfkfb3驱动糖酵解在血管萌发中的作用。细胞。2013;154:651 - 63。
Schoors S, De Bock K, Cantelmo AR, Georgiadou M, Ghesquiere B, Cauwenberghs S,等。通过PFKFB3阻断部分和短暂的糖酵解减少病理血管生成。Cell Metab. 2014; 19:37-48。
佩特洛娃TV, Koh GY。淋巴管的生物学功能。科学。2020;369:eaax4063。
肿瘤扩散中的淋巴管与免疫治疗的比较。癌症决议2020;80:3463-5。
Bellingan GJ, Caldwell H, Howie SE, Dransfield I, Haslett C.炎症消退过程中炎症巨噬细胞的体内命运:炎症巨噬细胞不会在局部死亡,而是迁移到引流淋巴结。中华免疫杂志,1996;37(2):344 - 344。
胡霞,邓强,马琳,李强,陈勇,廖勇,等。脑膜淋巴管调节脑肿瘤的引流和免疫。Cell Res. 2020; 30:229-43。
Farnsworth RH, Karnezis T, Maciburko SJ, Mueller SN, Stacker SA。淋巴管和趋化因子之间的相互作用。前沿免疫。2019;10:518。
肖克曼,陈志伟,陈志伟,等。自主神经系统在生理和肿瘤引流条件下调节淋巴管功能的独特作用细胞代表2019;27:3305-14。
艾伦JM,麦克海尔NG,鲁尼BM。去甲肾上腺素对离体肠系膜淋巴管收缩力的影响。中华医学杂志。1983;44:H479-486。
麦琼JG,麦克海尔NG,索恩伯里KD。电刺激交感神经链对麻醉绵羊外周血淋巴流动的影响。中华医学杂志。1987;33:23 3 - 33。
麦克海尔NG,索恩伯里KD。交感神经刺激引起麻醉绵羊腘窝淋巴结淋巴细胞输出增加。《物理学报》,1990;25(2):344 - 344。
Le CP, Nowell CJ, Kim-Fuchs C, Botteri E, Hiller JG, Ismail H,等。小鼠慢性应激重塑淋巴血管,促进肿瘤细胞扩散。Nat Commun. 2016;7:10634。
王志刚,王志刚,王志刚。交感神经切除术减少大鼠舌癌的大小和侵袭性。神经科学。2007;149:715-25。
三文鱼H,备注R, Gnjatic S, Merad M.肿瘤免疫的宿主组织决定因子。癌症。2019;19:215-27。
李志强,李志强,李志强,等。慢性应激在物理上可以避免,但在功能上损害先天不变T细胞。Cell代表2021;35:108979。
Cole SW, Arevalo JM, Takahashi R, Sloan EK, Lutgendorf SK, Sood AK,等。人类IL6位点基因-社会环境相互作用的计算鉴定。自然科学进展(英文版),2010;
Shahzad MMK, Arevalo JM, Armaiz-Pena GN, Lu C, Stone RL, Moreno-Smith M,等。应激对FosB和白细胞介素-8 (IL8)驱动的卵巢癌生长和转移的影响。中国生物化学杂志,2018;
Bronte V, Kasic T, Gri G, Gallana K, Borsellino G, Marigo I,等。增强T淋巴细胞浸润人前列腺癌的抗肿瘤反应。中华检验医学杂志2005;201:1257-68。
张志刚,张志刚,张志刚,等。表达fap的癌相关成纤维细胞靶向CXCL12协同抗pd - l1免疫治疗胰腺癌。中国科学:自然科学,2013;
乔g, Bucsek MJ, Winder NM, Chen M, Giridharan T, Olejniczak SH,等。肾上腺素能信号阻断小鼠CD8(+) T细胞代谢重编程激活过程:肾上腺素能应激免疫抑制机制。癌症免疫,2019;68:11-22。
陈敏,陈敏,董波,李丽娟,等。β - 2肾上腺素能受体介导的信号通路对骨髓源性抑制细胞免疫抑制潜能的调控。J clinin Invest, 2019; 129:5537-52。
Jena BC, Mandal M.外泌体在抗癌耐药和肿瘤进展中的新兴作用:对肿瘤-微环境相互作用的洞察。生物化学学报。2021;1875:188488。
Joyce JA, Fearon DT。T细胞排斥、免疫特权和肿瘤微环境。科学。2015;348:74 - 80。
牛勇,林志,万安,孙林,闫松,梁辉,等。功能丧失基因筛查发现ALDOA是肝癌细胞在缺氧条件下生长的重要驱动因素。肝脏病学。2021;73:1461 - 1479。
伯恩斯-考克斯N,艾弗里NC,金格尔JC,贝利AJ。前列腺癌中胶原蛋白代谢的变化:一种可能改变进展的宿主反应。张志强,2001;16:1698 - 701。
Hisasue S, Kato R, Sato Y, Suetomi T, Tabata Y, Tsukamoto T.用可生物降解导管移植和胶原蛋白海绵重建大鼠海绵神经。刘志军。2005;13(3):366 - 366。
Tuxhorn JA, Ayala GE, Smith MJ, Smith VC, Dang TD, Rowley DR.人前列腺癌中的反应性基质:肌成纤维细胞表型的诱导和细胞外基质重塑。临床癌症杂志2002;8:2912-23。
Twardowski T, Fertala A, Orgel JP,圣安东尼奥JD。I型胶原蛋白和胶原模拟物作为促进血管生成的超聚合物。Curr Pharm Des 2007; 13:3608-21。
王志强,王志强,王志强,等。基质金属蛋白酶在肿瘤进展中的新作用。癌症。2002;2:161-74。
斯普纳MJ,伯克KA,道斯RP,布朗EB,麦登KS。抗抑郁药去西帕明和α - 2肾上腺素能受体激活促进与胶原结构改变相关的乳腺肿瘤进展。癌症预防,2013;6:1262-72。
郭志刚,郭志刚,王志刚,王志刚,等。应激反应通路通过β - a2肾上腺受体和β -抑制素-1调节DNA损伤。大自然。2011;477:349-53。
原先生,萨克斯BD,卡隆MG,莱夫科维茨RJ。药物阻断β (2) ar - β - arretin -1信号级联可防止行为应激模型中DNA损伤的积累。细胞周期。2013;12:19 - 24。
李文杰,张志刚,张志刚,等。应激激素通过诱导DNA损伤降低紫杉醇治疗三阴性乳腺癌的疗效。中华癌症杂志,2015;
金俊,于林,陈伟,徐勇,吴敏,Todorova D,等。野生型p53通过诱导puma依赖的氧化磷酸化抑制来促进癌症代谢开关。《癌症杂志》2019;35:191-203。
蒙托亚A,瓦雷拉-拉米雷斯A,迪克森E,帕斯基耶E,托拉比A,阿奎莱拉R,等。肾上腺素能受体拮抗剂普萘洛尔改变晚期乳腺癌的有丝分裂和凋亡信号。生物医学杂志2019;42:155-65。
Armaiz-Pena GN, Allen JK, Cruz A, Stone RL, Nick AM, Lin YG,等。肾上腺素受体激活Src是肿瘤转移的关键开关。Nat Commun. 2013;4:1403。
石敏,刘东,段海,钱林,王林,牛林,等。β - 2肾上腺素能受体和Her2在人类乳腺癌细胞中组成一个正反馈环。乳腺癌治疗。2011;125:351-62。
顾林,刘sk, Loera S, Somlo G, Kane SE。蛋白激酶A激活使人乳腺癌细胞系对曲妥珠单抗产生耐药性。临床癌症决议2009;15:7196-206。
Chang M, Brown HJ, colado - hidalgo A, Arevalo JM, Galic Z, Symensma TL,等。β -肾上腺受体通过pka依赖的病毒RTA控制重新激活卡波西肉瘤相关疱疹病毒的溶解复制。中国病毒学杂志,2005;79:13538-47。
Campbell JP, Karolak MR, Ma Y, Perrien DS, masud -Campbell SK, Penner NL,等。交感神经刺激宿主骨髓基质细胞促进小鼠乳腺癌骨转移。公共科学图书馆。2012;10:e1001363。
林强,王芳,杨锐,郑霞,高红,张鹏。慢性约束应激对人大肠癌小鼠生长的影响。公共科学学报,2013;8:e61435。
Palm D, Lang K, Niggemann B, Drell TLT, Masur K, Zaenker KS,等。BALB/c裸鼠中去甲肾上腺素驱动的PC-3人前列腺癌细胞转移发展被β -受体阻滞剂抑制。国际癌症杂志。2006;118:2744-9。
潘文杰,张文杰,张文杰,等。普萘洛尔增强化疗药物的抗血管生成作用和抗肿瘤疗效:在乳腺癌治疗中的意义。Oncotarget。2011;2:797 - 809。
Renz BW, Takahashi R, Tanaka T, Macchini M, Hayakawa Y, Dantes Z等。beta2肾上腺素能-神经营养素前馈环促进胰腺癌。癌症细胞。2018;33:75-90。
赵cm,早川Y, Kodama Y, Muthupalani S, Westphalen CB, Andersen GT,等。去神经抑制胃肿瘤的发生。科学翻译,2014;6:250ra115。
索enen H, Tranzer JP。6-羟基多巴胺选择性破坏肾上腺素能神经末梢的化学交感神经切除术。Naunyn Schmiedebergs Arch Exp Pathol Pharmakol. 1968; 261:271-88。
早川Y, Sakitani K, Konishi M, Asfaha S,新仓R,富田H,等。神经生长因子通过异常胆碱能信号通路促进胃肿瘤的发生。《癌症杂志》2017;31:21-34。
Schuller HM, Al-Wadei HA, Ullah MF, Plummer HK 3。神经心理应激反应对胰腺癌的调节:干预的新目标。致癌作用。2012;33:191-6。
阿萨亚格,李志强,李志强,等。前列腺癌患者诊断后使用β -受体阻滞剂与死亡风险的关系。中华癌症杂志。2014;50:2838-45。
Aydiner A, Ciftci R, Karabulut S, Kilic L. β -受体阻滞剂治疗能否提高转移性非小细胞肺癌患者的生存期?中华癌症杂志2013;14:6109-14。
Barron TI, Connolly RM, Sharp L, Bennett K, Visvanathan K. β受体阻滞剂与乳腺癌死亡率:一项基于人群的研究。中华临床医学杂志,2011;29:2635-44。
Botteri E, Munzone E, Rotmensz N, Cipolla C, De Giorgi V, Santillo B,等。受体阻滞剂治疗绝经后三阴性乳腺癌的疗效。乳腺癌治疗。2013;140:567-75。
Cardwell CR, Coleman HG, Murray LJ, O 'Sullivan JM, Powe DG。-受体阻滞剂的使用与前列腺癌的生存:英国临床实践研究数据链队列中的嵌套病例对照研究癌症流行病学,2014;38:279-85。
De Giorgi V, Gandini S, Grazzini M, Benemei S, Marchionni N, Geppetti P. β -阻滞剂和其他抗高血压药物对黑色素瘤复发和死亡风险的影响Mayo临床杂志2013;88:1196-203。
De Giorgi V, Grazzini M, Gandini S, Benemei S, Lotti T, Marchionni N,等。β -受体阻滞剂治疗和减少厚黑色素瘤患者的疾病进展。2011; 171:779-81。
戴亚兹·艾斯,卡兰·拜,李俊杰。受体阻滞剂对上皮性卵巢癌生存率的影响。妇科杂志2012;127:375-8。
Grytli HH, Fagerland MW, Fossa SD, Tasken KA。-受体阻滞剂的使用与前列腺癌特异性生存的相关性:一项3561例高危或转移性前列腺癌患者的队列研究欧洲,2014;65:635-41。
Grytli HH, Fagerland MW, Fossa SD, Tasken KA, Haheim LL。在接受雄激素剥夺治疗的前列腺癌患者中,β -受体阻滞剂的使用与前列腺癌特异性生存率相关。前列腺癌。2013;73:250-60。
Lemeshow S, Sorensen HT, Phillips G, Yang EV, Antonsen S, Riis AH,等。乙型阻滞剂与丹麦恶性黑色素瘤患者的生存:一项基于人群的队列研究。癌症流行病学生物标记,2011;20:2273-9。
波泽尔斯基,刘骥,鲍泽,艾贝尔,唐斯,等。肾上腺素能拮抗剂和晚期前列腺癌患者的癌症特异性生存:一项退伍军人管理局队列研究。泌尿学。2021;155:186 - 91。
Powe DG, Voss MJ, Zanker KS, Habashy HO, Green AR, Ellis IO,等。受体阻滞剂药物治疗可减少乳腺癌的继发性癌症形成,提高癌症特异性生存率。Oncotarget。2010;1:628-38。
王慧敏,廖志祥,Komaki R, Welsh JW, O 'Reilly MS,常建勇,等。非小细胞肺癌患者在接受明确放疗治疗时,附带使用β -受体阻滞剂可改善生存结局。《中国日报》,2013;24:12 - 9。
Watkins JL, Thaker PH, Nick AM, Ramondetta LM, Kumar S, Urbauer DL,等。选择性和非选择性β -受体阻滞剂对卵巢癌患者生存期的临床影响癌症。2015;121:3444-51。
Penninx BW, Guralnik JM, Pahor M, Ferrucci L, Cerhan JR, Wallace RB,等。老年人的长期抑郁情绪和癌症风险。中华肿瘤学杂志,1998;30(2):388 - 388。
慢性和急性应激对原发性乳腺癌患者复发的预测。病人教育杂志1999;37:265-72。
Schmidt C, Kraft K.重症监护患者慢性和急性应激期间β -内啡肽和儿茶酚胺浓度。欧洲医学杂志1996;1:528-32。
徐立林,涂洪峰,徐富峰,岳甫,蒋伟文。氟西汀对肝细胞癌和非小细胞肺癌承载动物模型抗肿瘤进展的有益作用Biomed Pharmacother, 2020;126:110054。
雷斌,徐磊,张旭,彭伟,唐强,冯晨。氟西汀和阿米替林对人乳腺癌细胞增殖的影响及其分子机制。环境毒理学制药,2021;83:103586。
法蒂玛,胡霞,龚荣荣,黄超,陈敏,黄海霞,等。棕榈酸是一种参与疾病发展的细胞内信号分子。中国生物医学工程学报,2019;
法蒂玛,胡霞,黄超,张伟,蔡杰,黄敏,等。高脂饲粮和棕榈酸以依赖beta2ar的方式促进CRC生长。细胞死亡,2019;10:711。
科尔西南,苏德AK。分子途径:β -肾上腺素能信号在癌症。临床癌症决议案2012;18:120 - 6。
Albouaini K, Andron M, Alahmar A, Egred M.乙型阻滞剂在慢性阻塞性肺疾病和伴随心血管疾病患者中的应用中华医学杂志,2007;2:535-40。
Frishman WH。肾上腺素受体阻滞剂。不良反应和药物相互作用。高血压。1988;11:II21-29。
陈东,阿亚拉·葛。支配前列腺癌。中华外科杂志,2018;
李志强,陈志强,陈志强,等。肿瘤神经扩散机制的研究进展。癌症,2016;16:399-408。
Lillemoe KD, Cameron JL, Kaufman HS, Yeo CJ, Pitt HA, Sauter PK.不可切除胰腺癌患者的化学内脏切除术。前瞻性随机试验。安外科,1993;217:447-55。
Coarfa C, Florentin D, Putluri N, Ding Y, Au J, He D,等。神经微环境对前列腺癌的影响。前列腺癌。2018;78:128-39。
斯皮策数控。神经递质交换吗?没有惊喜。神经元。2015;86:1131-44。
杨B, Slonimsky JD, Birren SJ。由p75受体介导的交感神经递质释放特性的快速开关。神经科学。2002;5:539-45。
Yamamori T, Fukada K, Aebersold R, Korsching S, Fann MJ, Patterson PH.心脏细胞胆碱能神经元分化因子与白血病抑制因子相同。科学。1989;246:1412-6。
确认
本研究由国家自然科学基金项目(No. 81472302/No.)资助。81871983 /不。82003040),辽宁省自然科学基金项目(2020-BS-103),中国博士后科学基金项目(2020M681016),辽宁省新辽英才萃花计划项目(XLYC1902050),中国医科大学青年英才萃花计划项目。
作者信息
作者及隶属关系
贡献
所有作者都参与并阅读了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
发表同意书
所有作者都同意发表。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
李,某某,彭,某某,杨,S。et al。靶向肿瘤神经支配:前提、承诺和挑战。细胞死亡发现。8, 131(2022)。https://doi.org/10.1038/s41420-022-00930-9
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41420-022-00930-9
这篇文章被引用
肿瘤微环境:癌症有效治疗的障碍或机遇
生物医学科学杂志(2022)
神经免疫串扰及其对癌症治疗和研究的影响
发现肿瘤(2022)