文摘
核内蛋白1 (NUPR1)是一个转录coregulator被卷入各种癌症的发展。此外,从头合成脂肪酸在肝细胞癌(HCC)中起着关键作用的发展。然而,目前已知NUPR1在肝细胞癌中的作用。在这项研究中,进行了生物信息学分析分析表达水平,预后价值和丰富NUPR1通路的肝脏肝细胞癌(LIHC)。我们发现NUPR1显著调节相比,人类肝癌细胞与正常肝细胞从TCGA LIHC患者组和我们的病人。kaplan meier和COX比例风险发展模型分析表明,高表达的NUPR1 LIHC患者的不良预后相关。CCK-8、EdU和集落形成试验探讨了NUPR1对肝癌细胞的增殖的影响,然后伤口愈合transwell迁移进行了分析评估NUPR1对细胞迁移的影响。此外,皮下异种移植模型建立了研究肿瘤的生长。结果表明,NUPR1超表达与高度增殖和激进的表型。此外,NUPR1击倒明显抑制肝癌细胞增殖和迁移体外,阻碍体内肿瘤发生。 Mechanistically, endogenous NUPR1 could interact with sterol regulatory element binding protein 1 (SREBP1) and upregulated lipogenic gene expression of fatty acid synthase (FASN), resulting in the accumulation of lipid content. Moreover, pharmacological or genetic blockade of the NUPR1-SREBP1/FASN pathway enhanced anticancer activity in vitro and in vivo. Overall, we identified a novel function of NUPR1 in regulating hepatocellular carcinoma progression via modulation of SREBP1-mediated de novo lipogenesis. Targeting NUPR1-SREBP1/FASN pathway may be a therapeutic alternative for hepatocellular carcinoma.
介绍
肝细胞癌(HCC)是第六个最常见癌症和癌症相关死亡的第三大原因在世界范围内,随着发病率和一些有效的治疗选择1]。大多数HCC发生在慢性肝脏疾病的设置,如感染B型肝炎或C型和非酒精性脂肪肝(2]。肝脏是一个中心代谢器官在人体,已经建立了在合成中发挥核心作用,存储和脂质退化。越来越多的证据表明,脂质代谢改变人类肝脏肿瘤、移植脂肪从头合成,以确保增殖细胞获得额外的脂质膜生物起源、能源,信号和转录后修饰脂质分子(3,4]。此外,异常表达和活动参与脂肪酸的从头合成的关键酶,如脂肪酸合成酶(FASN)和stearoyl-CoA desaturase 1 (SCD1),已确定为肝癌发展(5]。甾醇反应元件结合蛋白1 (SREBP1),主转录因子脂肪从头合成和脂质稳态,据报道诱导肿瘤细胞的脂肪生成的重组,并提供一个关键致癌信号和肿瘤代谢之间的联系(6]。前体的乳沟SREBP1收益率成熟SREBP1 (mSREBP1)产品。一旦成熟,活跃SREBP1把原子核和transactivates目标基因的表达,如FASN和SCD1 [7]。然而,SREBP1需要额外co-regulatory转录因子调节正常启动子(8]。
核内蛋白1 (NUPR1 / p8 / COM1)是一个转录coregulator和多功能跟压力蛋白,它的作用在几个最近引起人们的重视protumorigenic过程在不同癌症类型,包括细胞生长、迁移、入侵、耐药性,ferroptosis、血管生成和线粒体呼吸9,10,11]。表达升高NUPR1一直与高脂肪饮食有关,和有人建议NUPR1可以防止组织细胞损伤在肥胖和高脂肪饮食的背景下(12,13]。鉴于肝脏是最重要的器官参与脂质合成和代谢和NUPR1与脂质代谢相关,我们试图检查是否NUPR1可能影响肝癌进展通过改变脂质代谢。
在目前的研究中,我们发现NUPR1可以与mSREBP1交互,表明NUPR1充当co-regulatory SREBP1的转录因子。此外,我们发现NUPR1可以促进肝癌细胞的恶性可能通过促进核易位SREBP1和transactivating目标基因的转录活性形式FASN SCD1,导致脂质积累。此外,药物或基因的封锁NUPR1-SREBP1 / FASN途径增强体内和体外抗癌活动。
结果
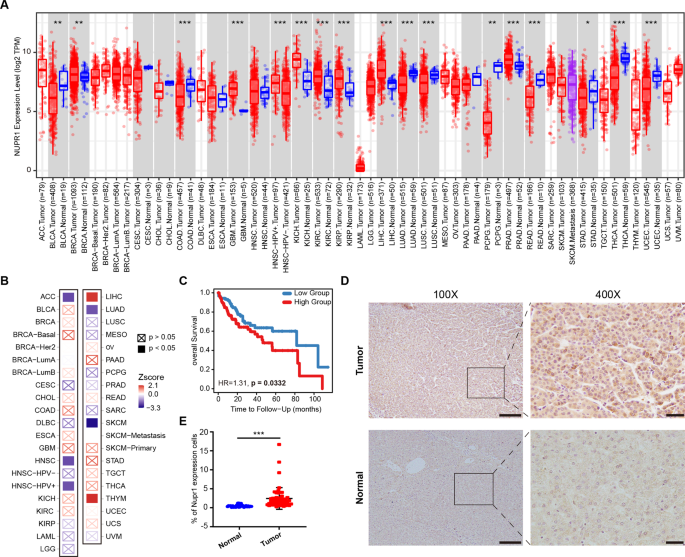
NUPR1在LIHC组织和调节与贫穷的生存
初步调查NUPR1转录表达水平的癌症,我们分析一个TCGA pan-cancer队列。我们发现NUPR1被调节以多种癌症类型,包括LIHC(肝脏肝细胞癌(HCC)), BRCA(乳腺浸润性癌),“绿带运动”(多形性成胶质细胞瘤),KICH(肾chromophobe) KIRC(肾肾透明细胞癌),KIRP(肾肾乳头状细胞癌)和马(前列腺腺癌(图)。1)。经过临床阶段,分层Cox比例风险模型被用来评估的重要性NUPR1对病人的结果。我们发现NUPR1 LIHC的危险因素和THYM(胸腺瘤(图)。1 b)。此外,kaplan meier曲线表明,NUPR1表达式与LIHC病人生存,随着10年期总体存活率低表达组明显优于高表达组(p= 0.033无花果。1 c)。进一步证实我们的研究结果的临床意义,我们分析了NUPR1表达组织从LIHC病人,这表明NUPR1的表达在肿瘤组织与正常组织相比显著增加(图1 d, E)。这些结果提供了令人信服的证据表明NUPR1可能与LIHC进展。
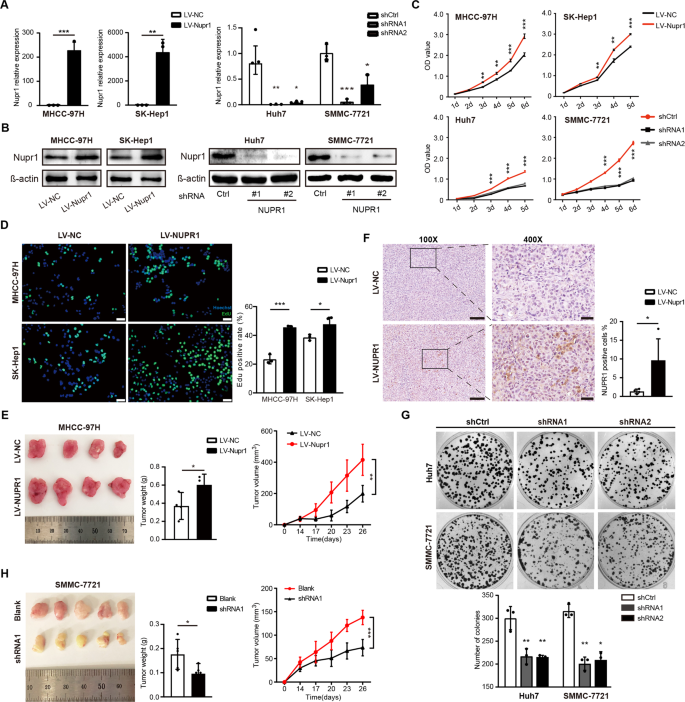
NUPR1促进肝癌细胞体外增殖和诱导体内肿瘤的生长
演示的作用NUPR1在肝癌细胞的生长和迁移,我们过表达NUPR1 mhcc - 97 h和SK-Hep1细胞株和稳定撞倒了NUPR1 Huh7和smmc - 7721细胞系基于他们的表达内源性NUPR1(补充图。1)[14]。这些效率NUPR1超表达向量(LV-NUPR1)和shrna首次评估中存在(无花果。2)。然后稳定免疫印迹进行确认过的NUPR1 mhcc - 97 h和SK-Hep1细胞的差别,对这些Huh7和smmc - 7721细胞,分别(无花果。2 b和补充图。1 b, C)。随后,CCK-8、EdU和集落形成试验探讨了NUPR1对肝癌细胞增殖的影响。如无花果所示。2摄氏度,NUPR1 overexpressing肝癌细胞表现出显著增强的增殖率。同样,在EdU化验,NUPR1 upregulation增加的百分比EdU阳性细胞(图。二维)。此外,表达下调NUPR1表达显著抑制Huh7和smmc - 7721细胞的增殖导致更少的殖民地(图。2 c、G)。mhcc - 97 h细胞与LV NC / LV-NUPR1和smmc - 7721细胞与空白/ shRNA1皮下注入BALB / c裸小鼠。NUPR1超表达显著增加肿瘤体积和重量的异种移植小鼠模型(无花果。2 e),而NUPR1击倒抑制肿瘤生长(图2 h)。NUPR1超表达在异种移植肿瘤样本进一步证明了包含IHC(无花果。2 f)。总的来说,这些发现表明,NUPR1可以促进肝癌细胞的增殖和肿瘤生长在体外和体内。
一个,B超表达效率和可拆卸的人类NUPR1存在试验验证了(a)和免疫印迹(b)和β-actin作为内部控制。C异常NUPR1表达对细胞增殖的影响肝癌细胞中检测到CCK8化验。Dmhcc - 97 h的扩散能力和SK-Hep1细胞过表达NUPR1被EdU化验发现,规模20µm酒吧代表。ENUPR1对肝癌的影响体内异种移植肿瘤的生长。左:代表图像的肿瘤在裸小鼠皮下注射后mhcc - 97 h细胞与LV-NUPR1 LV-NC (n= 4)。中间:列散点图的异种移植肿瘤重量。右:肿瘤生长曲线绘制使用异种移植肿瘤体积数据。FNUPR1表达mhcc - 97 h异种移植肿瘤通过免疫组织化学方法检测(左面板,规模100酒吧µm面板,酒吧规模20µm)。G集落形成的图像和统计分析显示Huh7和sh-NUPR1转染smmc - 7721。H裸鼠异种移植增长注入smmc - 7721和smmc - 7721 - shnupr1 (n= 5)。肿瘤照片(左),肿瘤重量(中间)和肿瘤生长曲线(右)。
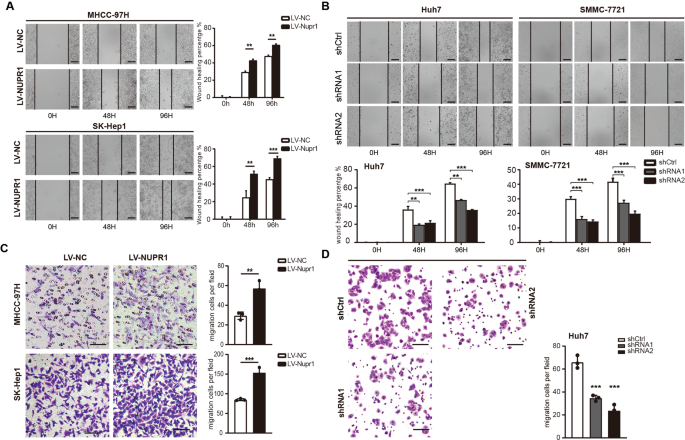
NUPR1促进肝癌细胞的迁移
伤口愈合和transwell迁移进行了分析评估NUPR1对细胞迁移的影响。细胞划痕试验表明NUPR1超表达显著增强伤口差距关闭mhcc - 97 h和SK-Hep1细胞相比,对照组(无花果。3)。击倒Huh7 NUPR1显著抑制这些变化的smmc - 7721细胞(图。3 b)。与此同时,在transwell迁移试验,NUPR1 overexpressing肿瘤细胞(mhcc - 97 hLV-NUPR1,57.00±4.359,SK-Hep1LV-NUPR1,153.3±7.126)表现出一个侵入性表型明显多于控制细胞(mhcc - 97 hLV-NC,29.33±2.186,SK-Hep1LV-NC(85.00±1.528)p< 0.01)(图3 c)。然而,NUPR1击倒抑制Huh7细胞的迁移能力(无花果。3 d)。这些发现表明,NUPR1在肝癌细胞有刺激对细胞迁移的影响。
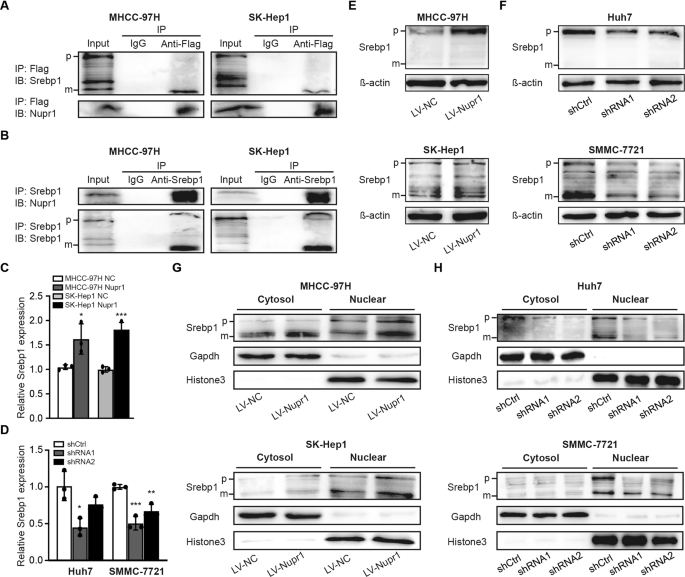
NUPR1与mSREBP1 mSREBP1和诱发核条目
上述实验结果表明NUPR1与肝癌细胞增殖和侵略性的表型。进一步探索潜在的分子机制,我们收集人类RNA-seq TCGA数据从数据库LIHC项目。差异表达基因调节高NUPR1表达式和低表达组之间受到KEGG通路富集分析。我们发现一个强大的协会之间NUPR1和非酒精脂肪肝(hsa04932)以及胆固醇代谢(hsa04979)(补充表1)[15]。它建立了转录coregulators可以身体与转录因子相互作用,调节靶基因的转录因子的一个常见子集(16]。因此,我们试图确定直接绑定合作伙伴NUPR1 mhcc - 97 h和SK-Hep1细胞转染Flag-tagged NUPR1 co-immunoprecipitation。重要的是,我们发现mSREBP1 NUPR1-interacting蛋白质。除此之外,需要额外的co-regulatory转录因子在所有SREBP-regulated启动子研究。如无花果所示。4,我们执行anti-Flag免疫沉淀反应之后,免疫印迹和anti-SREBP1发现一群的活跃的成熟形式SREBP1 (mSREBP1)。免疫沉淀反应的内生SREBP1 NUPR1进行免疫印迹(无花果。4 b)。上述免疫沉淀反应化验证明NUPR1之间的交互和mSREBP1 mhcc - 97 h和SK-Hep1细胞。
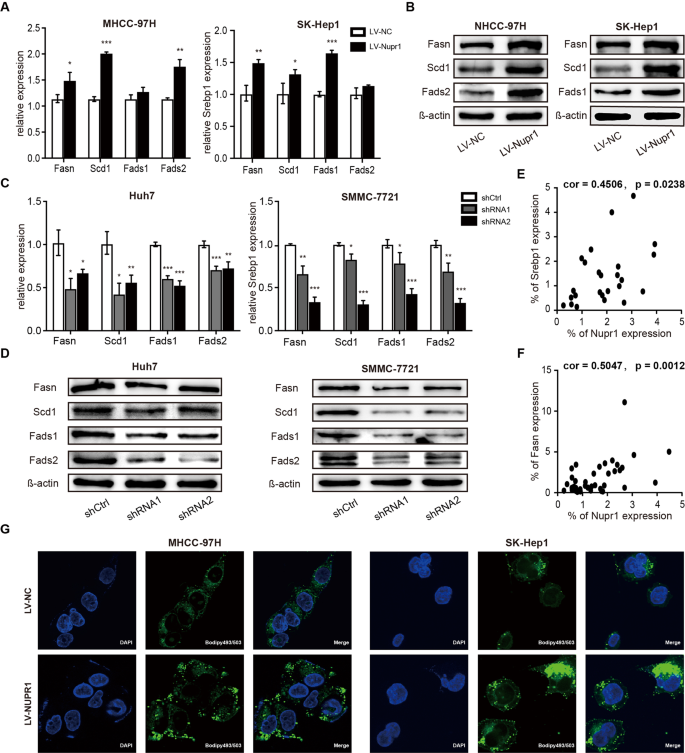
同时,我们分析了影响NUPR1 SREBP1及其表达的亚细胞定位。的存在和免疫印迹结果表明,过度NUPR1显著调节SREBP1表达式mhcc - 97 h和SK-Hep1细胞与对照组相比(图4 c, E),而下调NUPR1减少SREBP1表达式(无花果。4 d, F)。此外,细胞分离和免疫印迹NUPR1证明过度增加核表达SREBP1 mhcc - 97 h和SK-Hep1细胞(图4 g),而击倒NUPR1减少核本地化mSREBP1(无花果。4 h)。此外,我们还观察到一个连接NUPR1通过免疫组织化学方法和SREBP1 HCC患者样本(包含IHC)(软木= 0.4506,p= 0.0233,无花果。5 e)。综上所述,这些实验证明NUPR1 SREBP1表达增加,核本地化,可以绑定到mSREBP1,暗示NUPR1转录coregulator SREBP1。
NUPR1调节脂肪生成酶和脂质含量在肝细胞
增加核SREBP1蛋白质与mRNA水平升高有关的已知SREBP1目标基因参与脂肪酸的生物合成。因此,我们评估了脂肪acid-metabolizing酶表达的细胞系。如无花果所示。5的信使rna表达水平FASN, SCD1和脂肪酸desaturase 2 (FADS2)显著增加NUPR1 overexpressing mhcc - 97 h细胞,和转录水平的FASN SCD1和脂肪酸desaturase 1 (FADS1)调节NUPR1 overexpressing SK-Hep1细胞,随后经免疫印迹(图。5 b)。此外,NUPR1击倒mRNA和蛋白水平的差别导致了重大的对这些FASN, SCD1, FADS1 FADS2,相比新成分控制Huh7和smmc - 7721细胞(图。5 c, D)。此外,从包含IHC HCC患者样本结果显示积极和显著的相关性NUPR1和FASN(软木= 0.5047,p= 0.0012,无花果。5 f)。除了upregulation SREBP1及其目标基因,NUPR1过度也诱导肝癌细胞中脂滴的积累(无花果。5克)。这些结果表明,NUPR1可能作为转录coregulator SREBP1,因此提升相关靶基因的表达,导致细胞内脂滴的积累。
通过加强SREBP1 NUPR1促进肝癌细胞的恶性肿瘤/ FASN-mediated脂肪从头合成
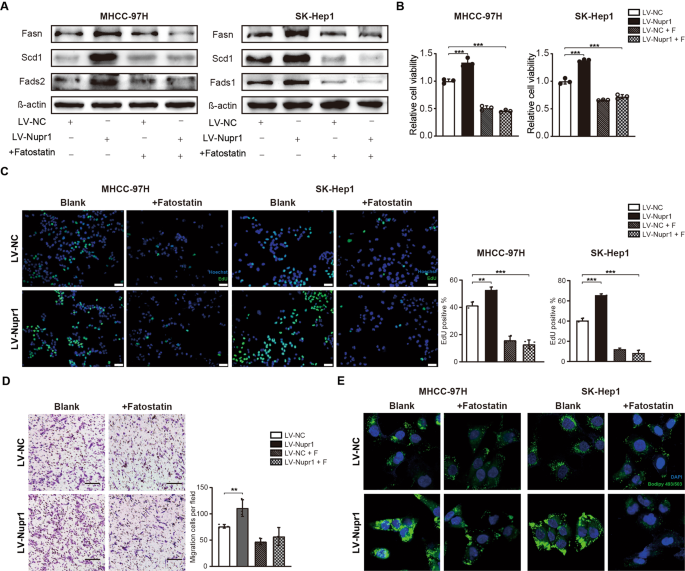
Fatostatin,特定抑制剂,如激活,据报道在多种癌症类型(具有抗肿瘤活性17]。正如所料,NUPR1超表达量可以抑制脂肪生成的酶诱导表达co-incubation 20μM Fatostatin mhcc - 97 h和SK-Hep1细胞(图。6)。此外,迅速引起的细胞增殖率NUPR1过度也可能被逆转药物抑制SREBP1(无花果。6 b, C)。的迁移能力NUPR1-overexpressing mhcc - 97 h细胞治疗Fatostatin也降低与对照组相比(图。6 d)。此外,肝细胞处理Fatostatin展出减少脂滴堆积(无花果。6 e)。总的来说,这些结果证实NUPR1 overexpression-induced细胞增殖,迁移和脂滴堆积SREBP1抑制体外可以逆转。
一个mhcc - 97 h和NUPR1 SK-Hep1细胞过度使用20μM fatostatin 48 h之前收集细胞溶解产物。分析了脂肪生成酶的蛋白表达蛋白免疫印迹。B影响LV-NUPR1 fatostatin或co-transfected LV-NUPR1和fatostatin mhcc - 97 h的扩散和SK-Hep1细胞被CCK8分析评估。Cmhcc - 97 h和SK-Hep1转染LV-NC和LV-NUPR1 fatostatin对待对扩散的影响被埃杜分析评估,酒吧代表20µm规模。DTranswell迁移分析被用来detecte mhcc - 97 h的migrative能力细胞与LV-NUPR1 fatostatin或co-transfected LV-NUPR1 fatostatin,酒吧代表50µm规模。E肝癌细胞转染与LV-NUPR1 fatostatin或co-transfected LV-NUPR1和fatostatin沾Bodipy 493/503和共焦显微镜获得的图像。
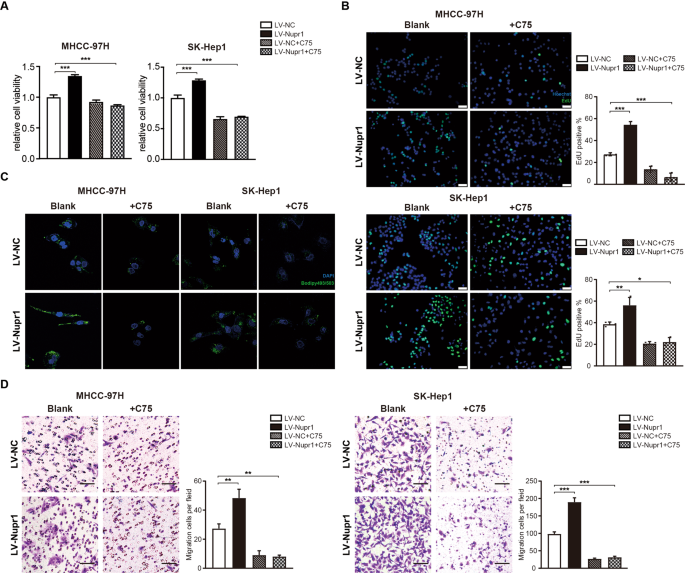
上面的实验显示NUPR1对调节的影响肝癌细胞的恶性表型是依赖SREBP1表达式。由于FASN SREBP1的关键目标基因,我们假设抑制FASN也可以反向NUPR1-induced变化。FASN C75,不可逆抑制剂,用于进一步研究FASN的角色NUPR1-mediated肝癌细胞恶性表型CCK8和transwell紧随其后迁移化验。正如所料,NUPR1 overexpression-induced细胞增殖可以逆转的政府50μM C75(无花果。7 a、B)。同样,移民迁移实验显示能力降低C75治疗(无花果。7 d)。如无花果所示。7 c,脂滴堆积也降低肝癌细胞与FASN抑制后。这些观察暗示NUPR1促进肝癌细胞的增殖和迁移的转录活性形式移植SREBP1,粘住FASN表达式和促进脂质积累。
一个,BLV-NUPR1、FASN抑制剂C75(50μM)或co-transfected LV-NUPR1和C75 mhcc - 97 h的扩散和SK-Hep1细胞被CCK8评估分析(a)和EdU,分析规模酒吧代表20µm (b)。C肝癌细胞转染与LV-NUPR1 C75或co-transfected LV-NUPR1和C75沾Bodipy 493/503和共焦显微镜获得的图像。DTranswell迁移分析被用来detecte mhcc - 97 h的migrative能力和LV-NUPR1 SK-Hep1细胞,C75或co-transfected LV-NUPR1 C75,酒吧代表25µm规模。
讨论
NUPR1 stress-inducible核蛋白质对细胞压力和癌症启动特性和开发属性。目前的研究表明,NUPR1促进肝癌细胞生长和迁移导致肝细胞癌进展,符合出版的文献。上下文中的表达升高NUPR1高脂肪饮食曾被报道。最近的研究表明NUPR1保护组织免受细胞损伤在肥胖和高脂肪饮食的背景下(13]。综上所述,这些研究结果强烈支持NUPR1和脂质代谢之间的关系。鉴于NUPR1高度表达高脂肪饮食和参与肝细胞癌发病机制后,我们试图阐明可能在HCC NUPR1和脂质代谢之间的关系。
在目前的研究中,小说的角色NUPR1在LIHC曾发现进展。NUPR1显示在肝脏肿瘤组织和LIHC患者的不良预后相关。有趣的是,我们发现NUPR1和SREBP1之间的相互作用。鉴于NUPR1属于染色质remodelers HMG家族的转录辅因子的活动,它可以作为转录coregulator发挥重要作用。在随后的实验中,我们发现NUPR1促进肝癌细胞增殖和迁移通过促进核易位SREBP1和transactivating目标基因的转录活性形式如FASN促进脂肪生成。药物或基因的封锁NUPR1-SREBP1 / FASN途径增强抗癌活性在体外和体内。这些结果表明,NUPR1起着促进的作用,增强SREBP1-mediated表达FASN在肝癌细胞和脂肪从头合成。虽然NUPR1据报道在肿瘤的发生和发展,所知甚少的潜在机制(s)的规定由NUPR1癌症细胞的脂质代谢。
人们普遍认为积极增殖细胞,特别是肿瘤细胞,增加脂质要求,依赖从头合成。一个增强脂肪从头合成在癌细胞一直以来被认为是恶性肿瘤的重要特征(18]。在这方面,表达升高SREBP1已经观察到在很多类型的癌症和与攻击性和恶性表型(19,20.]。更重要的是,需要额外的co-regulatory转录因子SREBP-regulated推动者。越来越多的证据表明,SREBP1的成熟和核易位是由各种各样的蛋白质,蛋白质-蛋白质之间的关系与表观遗传修饰,优雅地将细胞外信号,如胰岛素,或细胞内的信号,如氧化应激、脂类的生物合成调节的转录活动SREBP1 [21,22]。高度增殖细胞,肿瘤相关FASN是必要的膜脂质生产和脂滴形成支持增加增殖和代谢23]。不饱和脂肪是一种脂肪酸和至少一个双键的脂肪酸链,可以催化脂肪酸desaturases。不饱和脂肪酸是细胞膜的磷脂的重要组成部分,有助于维持膜流动性24]。有充分的证据表明,增加脂质不饱和现象是一种针对癌症的代谢标记干细胞参与肿瘤恶化和不饱和脂肪酸(25,26]。Borrello等人指出,NUPR1保护肝脏免受lipotoxicity通过调节脂肪酸代谢(27]。在我们的研究中,所扮演的角色NUPR1脂肪酸代谢的监管机构证实。虽然取得了相当大的努力,以确定脂肪生成的酶调控的机制,目前尚不清楚如何调节异常脂肪酸影响细胞命运的癌症。
先前的研究已经表明,抑制NUPR1 zzw - 115,一个强大的NUPR1抑制剂,产生一种强大的抗癌效果在HCC在体外和体内28]。更重要的是,我们表明,高NUPR1-expressing显示肝细胞癌细胞增殖能力强在体外和体内,而NUPR1击倒抑制肿瘤生长在皮下异种移植模型中。我们还发现肝细胞癌细胞NUPR1较高的表达水平表现出更具有攻击性的表型。集体,NUPR1是一种很有前途的治疗肝癌的目标和zzw - 115在治疗肝癌有巨大的临床应用前景。
然而,这项研究有一些局限性。首先,底层机制NUPR1在肝癌细胞的脂质代谢并没有澄清目前的研究。此外,它应该承担记住几个脂肪酸desaturases可能由NUPR1监管,而不饱和脂肪酸的特定角色没有调查。此外,功能富集分析显示NUPR1与非酒精脂肪肝,肝细胞癌的主要危险因素。然而,NUPR1的功能性意义在非酒精脂肪肝没有解决。这项研究的另一个限制是NUPR1表达主要在周围的地区炎性浸润或纤维母细胞渗透基于我们包含IHC染色结果。此外,NUPR1报道中发挥至关重要的作用在肝脏的纤维化,胰腺和肾脏15,29日,30.]。NUPR1之间可能存在一种密切的关系和慢性肝炎和肝癌微环境恶化。进一步的研究是必要的调查具体的潜在机制。
结论
总之,我们的研究结果提供了新的见解NUPR1功能和描述一个假定的机制增加肝癌细胞增殖和迁移通过调节脂质合成。重要的是,NUPR1对肝癌病人是一个非常有前途的治疗目标。
材料和方法
生物信息学分析
首先,我们比较NUPR1表达肿瘤与正常组织之间跨不同癌症类型使用公开可用的在线肿瘤免疫评估资源2.0(2.0定时器)数据库,综合资源从癌症基因组图谱(TCGA)。随后,我们探索NUPR1表达式之间的关系和临床结果LIHC病人使用Cox比例风险模型,使用定时器2.0调整临床阶段。此外,我们将LIHC样本分成三组根据他们NUPR1表达式(程度上四分位数;四分位范围;下四分位数),将上四分位数之间的10年总生存期组(高集团)和下四分位数集团(集团)低。至于富集分析,我们收集人类LIHC RNA-seq TCGA数据从数据库LIHC项目并将肿瘤样本分成三组根据他们NUPR1度表达式(上四分位数、高组;四分位范围;下四分位数,低组)。高NUPR1之间的差异表达调节基因表达和低表达组受到京都基因和基因组百科全书(KEGG)使用R包clusterProfiler通路富集分析。
患者样本
Formalin-fixed石蜡包埋标本,包括主癌标本(n= 50)和相应的非正常组织标本用于包含IHC收集从肝癌病人。所有临床标本来自南方医院接受手术和病理证实为肝细胞癌。所有实验中人体组织都符合赫尔辛基宣言的原则和制度审查委员会批准南方医院(表1)。
免疫组织化学检测
组织与10%福尔马林溶液固定和嵌入石蜡。5µm-thick部分被削减和烤60分钟60°C。然后,组织部分与二甲苯deparaffinized,患者分级乙醇,然后带到蒸馏水。为抗原检索,部分被淹没在柠檬酸缓冲(pH值6.0)在压力锅在高压下5分钟。内源性过氧化物被3%的过氧化氢,5%牛血清白蛋白在PBS溶液添加为30分钟块在室温下非特异性结合,其次是初级抗体NUPR1(1:15 0稀释,Proteintech,北京,中国;15056 - 1 - ap)孵化一夜之间在4°C。第二天,组织部分与PBS清洗三次,孵化与二次抗体60分钟再洗。疣状后轻拍工具包(MXB生物技术),部分与苏木精复染色、脱水和密封。
细胞培养和病毒感染
mhcc - 97 h, SK-Hep-1 Huh7和smmc - 7721细胞系得到写明ATCC和细胞从身份验证通过STR分析和物种进行身份验证。杜尔贝科修改鹰的培养基培养细胞(DMEM)含10%胎牛血清(的边后卫)37°C公司5%2。体内植入前细胞通道,贴壁细胞用0.25%胰蛋白酶收获。慢病毒表达的NUPR1 (LV-NUPR1)和NUPR1成分设计、合成了wzbio(山东、中国)。慢病毒转导的细胞系培养在24-well板块包含0.5毫升的DMEM培养基补充5毫克/毫升聚凝胺(σ,中国上海)和20µl病毒集中。12 h后感染,细胞被洗了,可以恢复之前的24小时任何进一步的过程。
免疫印迹分析
溶解肿瘤细胞总蛋白提取得到的里帕裂解缓冲(Beyotime P0013B)含有磷酸酯酶和蛋白酶抑制剂(南方,CW2200S和CW2383S)。由布拉德福德蛋白质含量进行了分析测定(Sigma-Aldrich)。样本size-fractionated通过sds - page,然后转移到聚乙烯二氟化物膜。一夜之间,屁股被孵化在4°C主要抗体,紧随其后的是二级抗体山羊anti-rabbit或anti-mouse免疫球蛋白。核和细胞质分数使用核和胞质蛋白提取分离设备(Beyotime P0028)根据制造商的指示。
Co-immunoprecipitation
蛋白质免疫沉淀反应,细胞(1×107)过表达Flag-tagged NUPR1收获,溶解产物样品含2000μg总蛋白质的免疫沉淀反应4μl M2-Flag(σ)或SREBP1(圣克鲁斯生物技术)分别在4°C一夜之间,其次是孵化与40个μl蛋白质A / G +琼脂糖珠(圣克鲁斯生物技术)在4°C 4 h。珠子被清洗和煮40µl加载缓冲区,然后西方墨点法进行了使用SREBP1 (Proteintech, 14088 - 1 - ap)或anti-NUPR1 (Proteintech, 15056 - 1 - ap)。输入图中使用的蛋白质。4约280µg和8μl用于IP。
RNA孤立存在
培养细胞总RNA分离使用试剂盒试剂(精确的生物技术,AG21102)根据制造商的协议。然后总RNA反转录成互补DNA使用中存在的Evo M-MLV RT预混料(精确的生物技术,AG11706)。对数据分析,基因表达是规范化和beta-actin表示为相对表达式,由阈值确定周期(CT)随着褶皱变化= 2-Δ(ΔCT),ΔCT= CT NUPR1−CTβ-actin和Δ(ΔCT) =ΔCTtumor-ΔCT正常的。引物序列提供了补充表2。
细胞增殖实验
对细胞生存能力检测,细胞计数Kit-8 (CCK8)和5-ethynyl-2′脱氧尿苷(EdU)化验进行根据制造商的协议。细胞被播种在96井的密度板1×103细胞/好,在一个10%的边后卫DMEM培养基培养。CCK8试剂(Dojindo、东京、日本)添加和孵化2 h每天一次连续6或7天。EdU染色进行使用EdU标签工具包(Ribobio C10310-1)。细胞集落形成能力是衡量平板集落形成试验。细胞(1000或500个细胞/ /)被镀成6-well盘子和培养2周。殖民地是用4%多聚甲醛固定,使用0.1%结晶紫染色图像J软件解决方案和计算。药物治疗后细胞生存能力评估在以下HCC肿瘤细胞系:mhcc - 97 h和SK-Hep1。细胞被播种在96 -孔板(4000个细胞/)的第一天。一夜之间文化后,细胞中取代Fatostatin(20μM,多国评价,hy - 14452)或C75(50μM,多国评价,hy - 12364)第二天。48 h后药物治疗,CCK8或EdU用于测量细胞的生存能力,和细胞生存能力率与对照组比较。
Transwell迁移分析
细胞与胰蛋白酶消化,离心机,并与PBS洗两次。细胞的浓度调整到5×105细胞在无血清培养基/毫升。transwell室8.0μm (SK-Hep1 Huh7和smmc - 7721)或12.0μm (mhcc - 97 h)毛孔被插入到24-well盘子,200μl细胞悬液中添加transwell室。700年μl中含有20%的边后卫在众议院增加。SK-Hep1, Huh7和smmc - 7721细胞培养10 h和mhcc - 97 h细胞培养72 h在37°C的5%股份2。孵化后,钱伯斯和PBS洗两次,然后用4%多聚甲醛固定30分钟,20分钟0.1%结晶紫染色,洗两次与PBS。Transwell室使用倒置显微镜拍摄的结果。
细胞划痕测试
细胞被播种在6-well板10%的边后卫的媒介。细胞融合增长到90%时,整个细胞单层抓了10µl吸管提示创建一个统一的伤口游离。碎片被轻轻洗PBS和细胞无血清培养系统中。胞外区域的长度是监控和拍照在0,使用光学显微镜48和96 h。数据表示为一个百分比的初始长度在时间为零。
Bodipy染色,显微镜
大多数肝脂质是储存在肝细胞胞质脂滴,三酰甘油和胆甾醇酯组成的中性脂质仓库。因此,BODIPY 493/503的中性脂质仓库是用来检测mhcc - 97 h和SK-Hep1细胞(31日]。细胞生长在一个共焦培养皿(巢)和孵化72 h。然后与PBS和4%多聚甲醛固定细胞被洗。随后,这些细胞被孵化2µM BODIPY (Glpbio)染色溶液,然后用PBS洗了三遍。细胞核与DAPI染色和细胞激光共焦显微镜下观察。
BALB / c-nude小鼠肿瘤发生的实验
我们创建了一个老鼠皮下注射新型癌症诱导的mhcc - 97 h (LV-NC和LV-NUPR1)细胞或smmc - 7721 (smmc - 7721和smmc - 7721 shNUPR1-1)细胞。有没有雄性BALB / c裸小鼠购买形成广东医学实验动物中心,广东,中国。老鼠被随机分配到两组。总共5×106细胞悬浮在100µl PBS和皮下注入BALB / c裸小鼠的右翼。裸体小鼠的肿瘤发生观察每3天。老鼠牺牲后28天注射,异种移植是解剖,拍照,加权,中性缓冲福尔马林固定,随后分析了包含IHC。动物程序南方医院的机构审查委员会批准。
统计分析
统计软件GraphPad棱镜在这项研究中被用来评估数据。一个未配对的双尾的学生t测试是用来比较两组,对比分析了多个组通过单向方差分析Dunnett事后测试。相关分析是评估使用皮尔逊相关系数。一个p值< 0.05在统计学上意义重大。误差在所有数字代表均值±SD。*p< 0.05;* *p< 0.01;* * *p< 0.001;“ns”不重要。
数据可用性
可获得的一些原始数据直接从TCGA公开(https://portal.gdc.cancer.gov/projects/TCGA-LIHC)和TIMER2.0 (http://timer.cistrome.org/)数据库,进一步询问可以针对相应的作者。
引用
唱H, Ferlay J, Siegel R, Laversanne M, Soerjomataram我Jemal,等。2020年全球癌症统计数据:Globocan估计36癌症的发病率和死亡率全球185个国家。CA:中国癌症。2021;71:209-49。
Llovet J,凯利R,维拉纽瓦,信号,Pikarsky E, Roayaie年代,et al .肝细胞癌。Nat牧师说的。2021;6。
Satriano L, Lewinska M,罗德里格斯P,平庸的J,安徒生J .原发性肝癌代谢重组:原因和后果。Nat牧师杂志。2019;16:748 - 66。
Schulze Currie E, A, Zechner R,沃尔特T, Farese R细胞脂肪酸代谢和癌症。细胞金属底座。2013;18:153 - 61。
李L,格瓦拉L, Tharp K,公园H, Pilo M,曹D, et al。微分要求脂肪从头合成在胆管癌和肝细胞癌的老鼠和人类。肝脏病学(巴尔的摩。Md)。2016;63:1900-13。
刘王H, Humbatova A, Y,秦W,李米,Cesarato N, et al . srebf1突变,编码甾醇监管元素绑定转录因子1,导致常染色体显性ifap综合症。J哼麝猫。2020;107:34-45。
金正日J, Sarraf P,赖特M,姚明K,穆勒E,塘鹅G, et al。营养和胰岛素调节脂肪酸合成酶和通过add1 / srebp1瘦素基因表达。中国Investig。1998; 101:1-9。
Dooley K, Millinder年代,奥斯本t固醇调节3-hydroxy-3-methylglutaryl-coenzyme合成酶基因通过直接固醇调节元件结合蛋白之间的相互作用和三聚物的ccaat-binding因子/核因子y。J生物化学杂志。1998;273:1349-56。
艾玛,Iovanna J, Bachvarov D, Puleio R,洛里亚G, Augello G, et al . Nupr1,肝癌的新目标:暗示在控制细胞生长、迁移、入侵和索拉非尼阻力。细胞死亡夺去2016;7:e2269。
陈C,吴年代,林Y,气H,林年代,叶C, et al。核诱导蛋白1通过甲状腺激素增强血小板源生长因子介导的血管生成在肝癌。开展。2019;9:2361 - 79。
刘J,歌X,旷F,张问,谢Y,康R, et al。Nupr1 ferroptosis是一个重要的抑制因子。Nat Commun。2021; 12:647。
谭L, Yammani r . Nupr1调节palmitate-induced人类关节软骨细胞凋亡。Biosci众议员2019;39:BSR20181473。
路径G, Mehana, Pilz我,Alt M,鲍曼J,我大梁,et al。Nupr1保留胰腺的胰岛素分泌β-cells炎症期间压力由多个小剂量链脲霉素和高脂肪饮食。是杂志性金属底座。2020;319:E338-44。
Augello G,艾玛M, Azzolina Puleio R, Condorelli L, Cusimano, et al . nupr1 / p73轴在肝细胞癌对索拉非尼抵抗。癌症。2021;519:250 - 62。
杉原Nagahara R, Matono T, T, Matsuki Y, Yamane M, Okamoto T,等。基因表达激活因子的分析3 /核内蛋白1轴非酒精性脂肪肝小鼠模型。地中海Yonago学报。2019;62:36-46。
转录coregulators Stallcup M,母肉鸡c Gene-specific行动的促进生理可塑性:证据生理coregulator代码。生物化学科学。2020;趋势45:497 - 510。
陈M,张军,Sampieri K, Clohessy J,门德斯L, Gonzalez-Billalabeitia E, et al。一个异常srebp-dependent脂肪生成的项目促进转移性前列腺癌。Nat麝猫。2018;50:206-18。
Bechmann L, Hannivoort R, Gerken G, Hotamisligil G,特劳纳米,Canbay a .肝脂质和糖代谢的相互作用在肝脏疾病。J乙醇。2012;56:952 - 64。
加尔布雷斯L,梁H,艾哈迈德。脂质在晚期前列腺癌途径放松管制。药物杂志》2018;131:177 - 84。
杨J,堆栈m .脂质调节蛋白作为潜在的治疗靶点在肥胖妇女卵巢癌。癌症。2020;12:3469。
小平Z, Fajun y srebp-mediated调节基因的表达。保盛吴吴李Hsueh。2012; 28:287 - 94。
李L, L,风扇H, Y,徐W,张L, et al . pkd3 srebp1促进细胞增长的相互作用通过移植脂肪生成在前列腺癌细胞。J癌症。2019;10:6395 - 404。
巴克利D,杜克G,豪雅T,奥法雷尔M, Wagman,麦克洛克W, et al .脂肪酸合酶——现代肿瘤细胞生物学见解古典肿瘤学的目标。杂志。2017;177:23-31。
布兰诺r .不饱和酸对膜结构的影响和酶动力学。食物脂质研究》1984;23:69 - 96。
李J, Condello年代,Thomes-Pepin J,马X, Y夏,赫尔利T, et al。脂质稀释是一个代谢标记和卵巢癌干细胞的治疗目标。细胞的干细胞。2017;20:303 e305——14.。
沈Ubellacker J, Tasdogan,拉梅什V, B,米切尔E,尹浩然,Martin-Sandoval。淋巴保护从ferroptosis转移的黑素瘤细胞。大自然。2020;585:113-8。
特蕾莎修女Borrello M,丽塔艾玛M, Listi,无论是M, Coslet年代,Augello G, et al。Nupr1保护肝脏免受lipotoxic伤改善内质网应激反应。美国实验生物学学会联合会J:出版联盟是社会Exp杂志。2021;35:e21395。
周局域网W, Santofimia-Castano P,夏Y, Z,黄C,夫琅禾费N, et al。针对nupr1与小的化合物zzw - 115治疗肝细胞癌是一种有效的策略。癌症。2020;486:8-17。
黄C, Iovanna J, Santofimia-Castano p .针对纤维化:这座桥连接胰腺炎和胰腺癌。Int J摩尔Sci . 2021; 22:4970。
周R,廖J, Cai D,田问黄E,陆T, et al。Nupr1介导肾纤维化通过激活成纤维细胞和促进epithelial-mesenchymal过渡。美国实验生物学学会联合会J:出版联盟是社会Exp杂志。2021;35:e21381。
邱B,西蒙·m·Bodipy 493/503的中性脂质滴染色显微镜和流式细胞术定量。Bio-protocol。2016;6:e1912。
确认
我们感激地承认的贡献的肝胆的南方医院的手术,和TCGA和定时器数据库。
资金
这项研究得到了国家自然科学基金(81872470和81872470),中国广东省医学科学研究基金会(没有A2020563)和总统基金会的南方医院、南方医科大学(没有2019 b009)。
作者信息
作者和联系
贡献
这些作者的贡献同样:Y-JW Y-QZ Z-XW。这些作者共同监督这项工作:码和Y-ZZ。这些作者收集的生物参数:LY, Y-WX K-LC。这些作者回顾了纸:Y-LZ YL和W-JL。所有作者造成了纸和批准提交的版本。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
伦理批准
所有的程序都按照我们的制度准则和南方医院伦理委员会批准。
同意出版
实验使用的手术标本,从患者获得书面知情同意是根据医院的伦理准则。
额外的信息
出版商的注意施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
王,Y。,Zhang, Y., Wang, Z.et al。相互作用的转录coregulator NUPR1通过upregulation SREBP1促进肝癌进展的脂肪生成。细胞死亡。8431 (2022)。https://doi.org/10.1038/s41420 - 022 - 01213 - z
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41420 - 022 - 01213 - z