在肿瘤中诱导免疫原性细胞死亡有望刺激抗肿瘤免疫。最近的一项研究发表在自然报道称,一种先前被证明可以诱导Z-DNA形成的小分子激活zbp1依赖的细胞死亡,并使肿瘤对基于免疫检查点封锁的免疫治疗敏感.
通过免疫检查点封锁(ICB)进行癌症免疫治疗在个别病例中取得了显著成功;然而,这些仍然局限于一小部分患者。因此,迫切需要新的方法来增强抗肿瘤免疫。在小鼠模型中,诱导肿瘤细胞的免疫原性细胞死亡,如坏死,被证明与ICB协同诱导抗肿瘤免疫反应。1RNA编辑酶腺苷脱氨酶作用于RNA 1 (ADAR1)已成为一种新的检查点,赋予ICB治疗的耐药性。2ADAR1催化RNA中的腺苷-肌苷(a -I)编辑,阻止长双链RNA (dsRNA)的形成,dsRNA激活胞质RNA传感器黑色素瘤分化相关蛋白5 (MDA5)诱导I型干扰素(IFN)反应。ifn诱导的ADAR1p150亚型具有Zα结构域,可识别具有左旋双螺旋结构的核酸,称为z -核酸(Z-NAs),包括Z-RNA和Z-DNA。哺乳动物中已知的唯一其他含有Zα结构域的蛋白质是ifn诱导蛋白z - dna结合蛋白1 (ZBP1),它已成为Z-NA传感器,诱导细胞死亡、抗病毒免疫和炎症。3.这提出了ADAR1p150可能通过抑制Z-NAs的积累来抑制zbp1介导的细胞死亡的可能性,这一机制可能有助于ICB治疗耐药性。
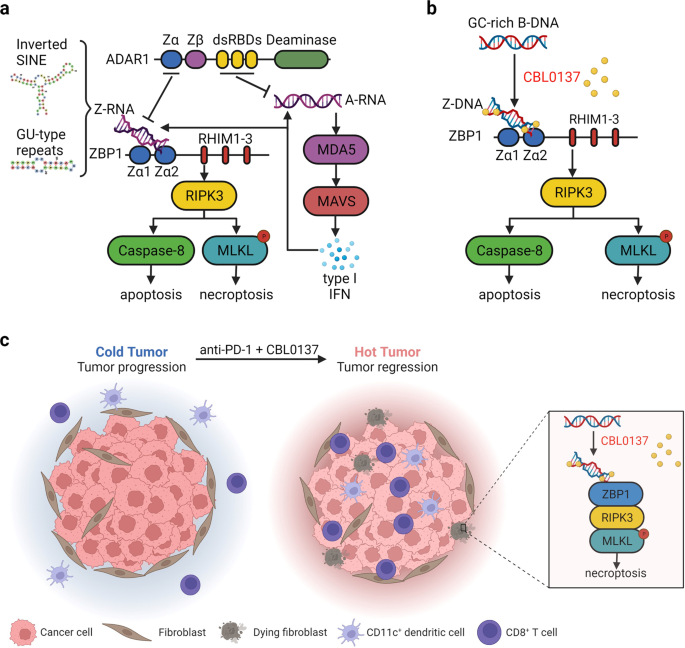
张等人最近的一项研究。4在自然ADAR1阻止z - rna的积累激活ZBP1,而ZBP1激活小分子诱导Z-DNA形成可以克服对ICB的耐药性。使用针对Z-DNA的单克隆抗体(克隆Z22,由同一组验证,也用于检测Z-RNA5),作者观察到在ADAR1缺陷的细胞中,逐渐增加的核Z-NA染色对RNase敏感,但对DNase处理不敏感,这表明Z-RNA在缺乏ADAR1的情况下积累。有趣的是,Z-RNA的积累依赖于I型IFN信号,并被I型IFN信号增强。1).通过测序来自ifn β处理的adar1敲除细胞的z22免疫沉淀RNA,作者确定了两类内源性Z-RNA来源,它们都定位于干扰素刺激基因(ISGs)的3 ' -未翻译区(utr)。一类是由反向短穿插核元件(SINEs)衍生的dsrna,它们是ADAR1的首选编辑底物(图1)。1).另一类是能够折叠成哑铃形状的gu型简单重复序列,显示出很少的编辑证据(图2)。1).基于催化无活性或Zα突变体ADAR1p150的重组实验,作者得出结论,ADAR1通过编辑依赖和-独立机制抑制Z-RNA的积累。利用Z22抗体,作者发现内源性Z-RNA与ZBP1共定位,并在adar1敲除细胞中富集ZBP1的下拉,这表明Z-RNA是ZBP1的配体。此外,IFNβ处理在ADAR1缺陷的细胞中引发了zbp1介导的快速凋亡和坏死,这表明ADAR1的缺失导致Z-RNA积累激活zbp1介导的细胞死亡(图。1).这些结果表明,zbp1介导的细胞死亡可能有助于先前报道的观察,即肿瘤细胞中ADAR1的丢失克服了对ICB的耐药性。事实上,最近的一项研究表明,骨髓细胞特异性ADAR1敲除可以以zbp1依赖的方式抑制肿瘤的发生,这表明肿瘤微环境中zbp1介导的ADAR1缺陷髓系细胞的死亡可能通过刺激抗肿瘤免疫来发挥抗肿瘤作用。6
一个ADAR1阻止I型ifn介导的dsRNA的积累,包括A-RNA和Z-RNA。定位于isg3’-UTRs的未编辑的倒置sin和gu型简单重复序列代表了两类主要的Z-RNA,它们激活ZBP1,导致细胞凋亡和坏死。bCBL0137促进细胞核内DNA的b - z转变,进而激活zbp1介导的凋亡和坏死。cCBL0137在肿瘤间质成纤维细胞中触发zbp1依赖的细胞死亡,可能是坏死,这与抗pd -1治疗协同作用,诱导肿瘤消退。面板c改编自Biorender.com(2022)的“冷与热肿瘤”,检索自https://app.biorender.com/biorender-templates.该图是由Biorender.com创建的。: DG2426M4R2)。
Zhang等人随后寻找能够诱导Z-NA形成并激活zbp1介导的细胞死亡的小分子。在筛选中,他们确定了CBL0137,这是一种先前显示能在细胞核中诱导稳健Z-NA形成的化合物。7与ADAR1缺失相反,CBL0137诱导的核Z22抗体染色对DNase敏感,但对RNase处理不敏感,认为这对应于Z-DNA(图2)。1 b).与ADAR1缺失类似,cbl0137处理的细胞中Z-DNA的积累导致zbp1介导的细胞凋亡和坏死(图2)。1 b).值得注意的是,在免疫沉淀实验中,富集ZBP1的DNA序列与cbl0137处理的细胞中富集z22的DNA序列大量重叠,且主要定位于L1Md A和L1Md T长穿插核元件(LINEs)的5’-UTRs,表明这些序列容易形成Z-DNA激活ZBP1。使用CBL0137作为触发zbp1依赖性细胞死亡的工具,作者使用同基因小鼠黑色素瘤模型检测了其潜在的抗肿瘤作用。瘤内注射CBL0137可诱导肿瘤微环境细胞中Z-DNA的形成,包括浸润成纤维细胞。此外,CBL0137处理触发了野生型(WT)肿瘤间质成纤维细胞的MLKL磷酸化,但没有Zbp1- / -老鼠。作者进一步表明,CBL0137和抗pd -1抗体联合治疗,而不是单独使用任何一种药物,可诱导WT中的肿瘤消退Zbp1- / -小鼠B16-F10和YUMMER1.7黑色素瘤模型。在机制上,作者可以证明CBL0137联合抗pd -1诱导活化CD8的募集+T细胞和CD11c+在体内,树突状细胞进入肿瘤以增强ICB反应,这取决于ZBP1在宿主细胞中的表达(图2)。1 c).有趣的是,瘤内注射CBL0137联合抗pd -1在B16-OVA肿瘤模型中引发了异位效应,这表明激活肿瘤微环境细胞中的ZBP1可以诱导对肿瘤细胞的强适应性免疫应答。基于这些发现,作者得出结论,CBL0137在肿瘤间质成纤维细胞中诱导的zbp1依赖性坏死逆转了小鼠黑色素瘤模型中对ICB的耐药性。1 c).然而,坏死在cbl0137诱导的抗肿瘤免疫中的功能作用在本文中尚未得到正式证明。尽管细胞培养试验以及肿瘤成纤维细胞中磷酸化MLKL的检测支持ZBP1可能通过诱导坏死来触发抗肿瘤免疫,但在MLKL缺陷小鼠中进行的功能研究,这是证明坏死作用的金标准,没有进行。因此,坏死是否参与了这种抗肿瘤反应还有待实验证明。
总之,Zhang和同事们发现CBL0137是一种诱导zbp1介导的细胞死亡的小分子,并表明当注射到肿瘤中时,它与ICB协同作用诱导肿瘤消退。在小鼠模型中的这些有希望的结果值得进一步研究,以评估CBL0137是否可以克服人类癌症对ICB的耐药性。
参考文献
斯奈德,A. G.等。科学。Immunol。4, eaaw2004(2019)。
伊什祖卡,J. J.等。自然565, 43-48(2019)。
焦,H.等。自然580, 391-395(2020)。
张,T.等。自然606, 594-602(2022)。
张,T.等。细胞180, 1115 - 1129。e13(2020)。
Karki, R.等人。细胞的代表。37, 109858(2021)。
萨芬娜,A.等。核酸测定。45, 1925-1945(2017)。
作者信息
作者及隶属关系
相应的作者
权利和权限
关于本文
引用本文
Jiao, H., Pasparakis, M.诱导Z-DNA克服免疫检查点封锁抗性。细胞Res32, 871-872(2022)。https://doi.org/10.1038/s41422-022-00705-y
发表:
发行日期:
DOI:https://doi.org/10.1038/s41422-022-00705-y