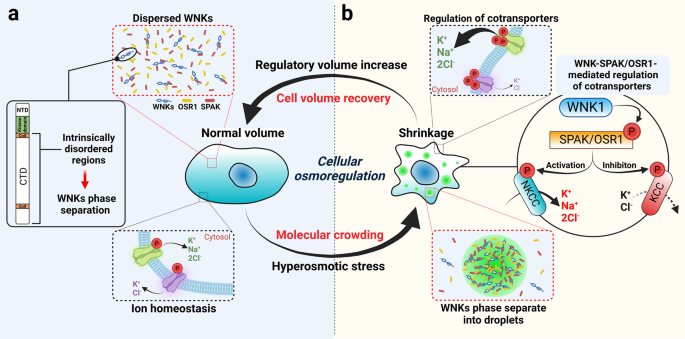
细胞收缩,这发生在高渗环境,导致快速反弹的响应恢复细胞体积和离子浓度。在最近的一项研究发表在细胞,Boyd-Shiwarski等人确定WNK1,已知稳态调节的细胞体积,分子拥挤传感器,并演示如何通过细胞shrinkage-dependent WNK1有助于细胞体积恢复相分离。
细胞迅速适应不断变化的渗透条件来维持体内平衡,防止细胞死亡。一些这方面的需求是由WNK(没有赖氨酸(K))蛋白激酶渗透压力应对正常细胞体积和离子组成。WNKs(人类WNKs 1 - 4)很大,主要非结构蛋白,除了N-termini附近的激酶结构域和几个小域和卷曲螺旋区域。WNK1(> 2000残留物)是哺乳动物的组织中广泛表达,是一个重要的基因在小鼠和细胞(见depmap.org)。因为某些功能突变导致高血压,它作为人类疾病基因研究。WNKs 2 - 4表现出更tissue-restricted表达式和有重叠和独特的功能。OSR1(氧化应激反应(1)和SPAK (STE20 / SPS1-related脯氨酸/ alanine-rich激酶)直接下游效应器WNKs激酶。通过trans-autophosphorylation渗透压力激活WNK1。1OSR1 SPAK相互作用和由WNKs激活,反过来,调节下游目标,如离子转运蛋白和渠道维护离子体内平衡和细胞体积。2
一个长期存在的难题已经WNK激酶调节的矛盾的性质。近20年来它一直知道WNK1激活了高渗和低渗的压力。3矛盾越来越明显时WNK1激酶活性氯被发现被绑定到其激酶结构域。4低渗引起胞内氯低。这产生一个简单的机制WNK1和氯经激酶活性部位激活。然而,高渗条件导致水离开细胞,胞内氯离子浓度上升由于减少细胞体积。高氯应该抑制WNK1激酶活性,而是WNK1激活促进监管体积增加。这些和其他的发现表明WNK1有两个截然不同的激活机制。一个可能的解释如何WNK1被激活在这些条件下来自LRRC8A氯通道的研究。p38 / MSK1 pathway-dependent磷酸化LRRC8A促进细胞在高渗条件下氯流出。作者认为LRRC8A只能防止过度增加氯优化WNK1激活,指出胞内氯由于高渗压力仍在升高。5
在最近的一篇论文细胞,Boyd-Shiwarski等人发现机制相WNK1高渗条件下激活。6他们发现WNK1的传感器分子拥挤造成的细胞收缩(无花果。1)。拥挤,水射流引起的细胞,诱发WNK1相分离。分离的分子冷凝membraneless包含蛋白质和其他分子细胞内细胞器。细胞利用相分离或隔离特定分子进入细胞内的水滴,产生集中的分子内的冷凝物的快速自适应对环境变化的反应。7这些分离的冷凝物可以作为物理平台通过诱导激酶和衬底连接距离增加磷酸化和细胞内信号的控制。8由于这个原因,在过去的十年里,相分离越来越多地被看作是细胞内的分子基础空间组织动力学和信号。冷凝物从事一系列基本的生物过程管理的组织和功能调节细胞。尽管冷凝形成细胞内仍不完全理解,内在无序区域(idr)的蛋白质有助于建立相分离。WNKs含有激酶域附近N-termini随后扩展段低序列,通常定义为无法折叠成二级或三级结构,经常发现在印尼盾。这些无序区域参与WNK1相分离。
一个在正常情况下,WNK1广泛地本地化,经常与点状的外表,整个胞质。b高渗压力诱发细胞收缩,从而增加分子拥挤。Boyd-Shiwarski等人提出的机制是细胞内的WNK1浓度的增加导致其相分离。WNK1活化增加,其下游效应器激酶,OSR1 SPAK,还与WNK1 colocalize从而提高WNK信号转运蛋白,从而导致监管体积增加。随着成交量复苏,WNK1的浓度减少,存在于滴,和信号减少。创建BioRender.com。
的细胞研究建立在作者的果断先前的研究显示,越来越多的高渗压力应用到细胞,WNK1形成乳剂液滴在几秒钟内。直到最近membraneless目前尚不清楚这些斑点状的结构。9puncta数量迅速增加然后开始下降,而尺寸保持稳定,个别puncta合并,荧光光漂白发生后迅速复苏,在高浓度的WNK1旋节线分解(分层为网络式网络)发生。所有这些观察与相分离相一致。SPAK、OSR1 WNK3所有与乳剂WNK1表明液滴可能集中WNK通路组件来增强信号。
Boyd-Shiwarski等人发现两个地区位于c端WNK1导致激酶结构域的相分离行为,都发现印尼盾的主要蛋白质。两个coiled-coils发现在这些区域似乎也导致相分离,尽管规模较小。的片段WNK1只包含n端和激酶结构域未能相分离。只包含一个片段一个condensation-prone地区和一个卷曲螺旋相分离,但不是近以及完整的蛋白质,这意味着有效相分离需要多价的交互。这三个片段的冷凝行为追踪SPAK / OSR1的程度和转运蛋白NKCC1激活,证据表明,相分离增强WNK通路信号。他们还发现crowding-induced相分离WNKs可能是一个古老的保护机制。果蝇WNK表现同样和WNKs存在于生物一样遥远秀丽隐杆线虫都有大型c端IDR地区尽管c端低地区的序列发散的。
提出的机制迄今为止解释WNK1激活高渗条件下(LRCC8A-mediated氯射流和WNK1相分离)并不是相互排斥的。事实上,都可能造成协同促进监管体积增加。
WNK1相独立的倾向,已注意到在低水平在等压的条件下,提出了许多的问题和区域调查。SPAK / OSR1如何激活在冷凝与质膜转运蛋白吗?额外的生物大分子或转录后修饰可能是必需的,补充,或抑制WNK1相分离?SPAK / OSR1二聚,WNK1包含四个结合位点的激酶提高关于脚手架WNKs之间和下游激酶之间和其他基质。10WNK搭建复合物可以相分离更普遍的影响?什么其他进程可能被WNK分子受封存冷凝物吗?Boyd-Shiwarski等人的作品代表了优雅的一步对我们理解WNK信号。
引用
Thastrup, j . o . et al。物化学。J。441年,325 - 337 (2012)。
盖格农,k B。,England, R. & Delpire, E.点。j .杂志。细胞杂志。290年C134-C142 (2006)。
Lenertz l . y . et al。生物。化学。280年,26653 - 26658 (2005)。
Piala, a . t . et al。科学。信号。7ra41 (2014)。
塞拉,s . a . et al。Proc。国家的。学会科学。美国118年e2025013118 (2021)。
Boyd-Shiwarski, c . r . et al。细胞185年,4488 - 4506。e20 (2022)。
情况下,l . B。,Ditlev, J. A. & Rosen, M. K.为基础。启Biophys。48,465 - 494 (2019)。
唱,d . et al。摩尔。细胞82年,3693 - 3711。e10汽油(2022)。
森古普塔,s . et al。生物。化学。287年,37868 - 37879 (2012)。
泰勒,c . a . et al。生物化学54,5063 - 5071 (2015)。
确认
从作者的相关研究实验室是由格兰特I1243从韦尔奇基金会(M.H.C.)。
作者信息
作者和联系
相应的作者
权利和权限
关于这篇文章
引用这篇文章
荣格,居。,Taylor, C.A. & Cobb, M.H. Crank up the volume: Osmotic stress induces WNK1 phase separation.细胞Res(2022)。https://doi.org/10.1038/s41422 - 022 - 00763 - 2
发表:
DOI:https://doi.org/10.1038/s41422 - 022 - 00763 - 2