SARS-CoV-2病毒复发的定义是:在出院或康复的个体中,通过标准逆转录聚合酶链反应(RT-PCR)连续两次以上检测到病毒基因组核糖核酸(RNA)阴性,可靠地检测到成熟病毒或病毒产物,这引起了公众对传播风险的担忧,并值得探索其潜在机制。目前,根据病毒来源、浓度和传播风险,记录的病毒复发可分为三类。(1) SARS-CoV-2反弹。这一观察结果首先在直接抗病毒药物(DAAs)的临床应用中得到广泛注意,如paxlovid和molnupiravir,这两种fda批准的药物用于治疗可能出现严重症状的COVID-19患者。完成5天药物摄入的个体会出现RNA反弹[1,2,3.,4,5].由于病毒反弹发生在一些关键的政治家和科学家身上,它引起了人们对抗病毒有效性和未来药物选择的高度关注。(2) SARS-CoV-2 rna复检阳性。自先祖SARS-CoV-2转代以来,出院患者病毒RNA复检呈阳性[6]到新的变体[7未来可能会随着SARS-CoV-2的进化而继续。由于其传播风险极低,在世界范围内往往被忽视。(3)新型冠状病毒再感染。由于丧失病毒特异性免疫能力或逐渐衰弱,一些康复的人容易受到第二次或第三次感染[8].再次感染确认依赖于将最初感染(大多数不可用)的病毒基因组序列与第二次感染对齐,这在技术上具有挑战性,因此被排除在下面的讨论之外。
SARS-CoV-2病毒rna阳性复测与病毒反弹有几个方面的区别(图2)。1模拟).鉴于祖先的SARS-CoV-2滴度要低得多[9],只包括Delta和Omicron感染作比较。
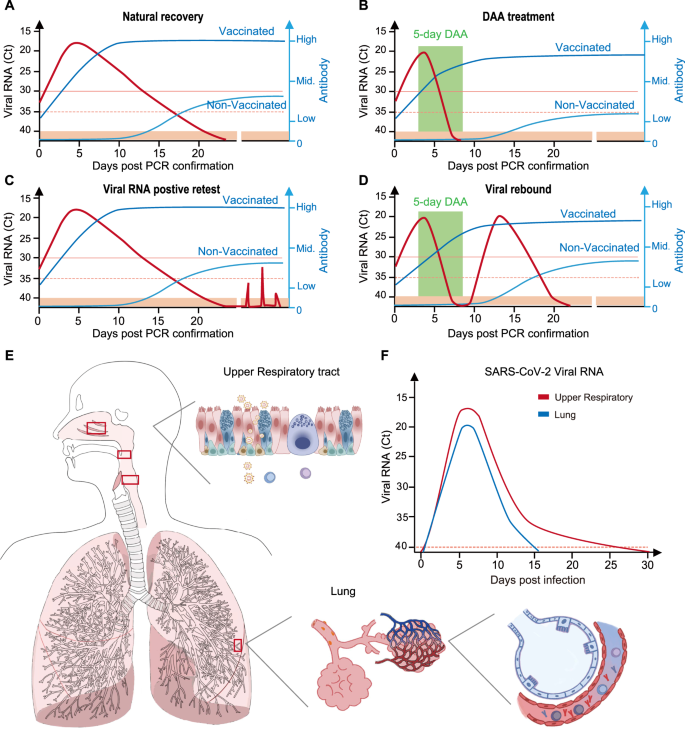
SARS-CoV-2病毒特异性抗体RNA滴度在不同临床结局中的动力学一个接种疫苗或未接种疫苗人群的自然恢复。B接受直接作用抗病毒(DAA)治疗的个人,如paxlovid和molnupiravir。C进行病毒rna阳性复检的个体。D接受DAA治疗的个体SARS-CoV-2病毒反弹。E图示肺和上呼吸道粘膜表面的微环境。F在接种疫苗者或服用治疗性抗体或抗病毒药物的个体中,SARS-CoV-2病毒RNA在肺部和上呼吸道之间的变化。一个- - - - - -D红线是SARS-CoV-2病毒RNA。蓝线,病毒特异性抗体。接种疫苗,在感染前接受全剂量疫苗的sars - cov -2感染者。未接种疫苗、未接种疫苗的人感染SARS-CoV-2。周期阈值,Ct = 30,分离活SARS-CoV-2病毒的截止时间。Ct = 35,患者出院和非感染性阶段的截止日期。Ct = 40,为病毒RNA的检测限
首先是病毒基因组RNA浓度和感染风险
病毒rna复测阳性和病毒反弹均显示在初始感染中病毒浓度相等[1,2,3.,5,7(图。1与c, b与d相比)。然而,在非抗病毒治疗的Delta变异感染个体中,病毒RNA的阳性复检比首次住院期间低约10万倍[7].有趣的是,重新检测病毒RNA的动力学是一种“昙花一现”,它是不规则和不可预测的短暂出现。病毒RNA可间歇性出现长达数月[7(图。1 c).然而,还没有从残留的病毒样本中培养出病毒,下一代测序显示病毒基因组是不完整的。通过流行病学追踪密切接触者,未发现发生传播。因此,复测病毒RNA阳性与社区感染能力极低有关[7].
在病毒反弹中,病毒载量等于初始感染[1,2,3.,4,5,10(图。1 d).重要的是,病毒反弹的动力学与常规和完整的急性感染发作几乎相同,从突然上升到峰值水平(中位周期阈值,Ct = 19)开始,以延迟的病毒下降结束[1,4,5,10].对于高病毒滴度,病毒反弹的个体仍然会释放传染性病毒。事实上,活病毒可以从反弹体中培养出来[10,11].然而,由于缺乏流行病学信息,病毒反弹是否会导致社区传播尚不清楚,现实世界中的传染性值得进一步研究。
二是症状严重程度和临床表现
最后测定复发时间和免疫状态
典型的SARS-CoV-2感染通常发生在2-3周内,包括早期潜伏期、急性加重期、短暂平台期和显著延长下降至不可检测阶段[12(图。1).这一过程在免疫控制能力成熟之前为宿主免疫系统提供了足够的抗原暴露时间。病毒rna阳性复检发生在自然恢复期后,此时病毒特异性免疫反应已形成[7],这可能需要几个月的时间。产生非常高滴度的病毒特异性抗体和细胞毒性细胞免疫应答,这两者都能对病毒复制产生强烈的免疫控制,并在部分免疫功能低下的个体中阻止病毒复制到高滴度。相比之下,paxlovid和molnupiravir等直接抗病毒药物(DAAs)由于其抑制病毒复制的能力强,可大幅度抑制病毒RNA,并将整个感染病程显著缩短至10天以内(< 5天感染+ 5天DAA治疗)[13(图。1 b, D).然而,这一时间过程不允许反应缓慢的个体完全病毒特异性免疫成熟。在备份能力完全开发之前突然退出密钥控制器,将不可避免地导致残余病毒反弹。在反弹期,病毒反弹到与初始阶段相似的滴度,这表明抑制性免疫反应尚未形成[1,4,5,10].然而,病毒特异性免疫在初始感染和反弹发作中的真实状态尚不清楚,需要进一步研究。简而言之,病毒在体内出现的一定时间似乎是产生病毒特异性免疫反应和抗病毒能力反弹所必需的。
由于世界各国对COVID-19患者治疗的政策不同,直接比较病毒反弹和病毒RNA复测阳性之间的发生频率是不合适的。然而,这些现象促使研究人员研究其潜在机制。1)病毒基因组存在于哪里?2)为什么宿主免疫系统不能完全清除SARS-CoV-2病毒RNA?3)哪种措施可以促进病毒RNA的清除?
单细胞测序技术已被用于确定SARS-CoV-2的嵌套生态位。在细胞培养感染模型中,发现一小部分高表达DDIT3的鼻上皮细胞持续高水平的病毒复制长达四周,即使存在强大的抗病毒反应。这表明一些独特的细胞类型为病毒提供了庇护[14仅凭先天免疫系统无法清除它。因此,病毒特异性适应性免疫被认为是病毒清除的关键。
有效的免疫反应能防止病毒复发吗?SARS-CoV-2突破性感染及时召回疫苗启动的记忆免疫细胞,产生高滴度的病毒特异性抗体和t细胞免疫反应[12,15],有助于限制肺部病毒,缓解肺炎,加快临床康复。然而,与未接种疫苗的患者相比,接种疫苗不能降低病毒滴度峰值(NC), NC发生在高浓度病毒特异性抗体产生之前,这表明有效免疫建立的时间至关重要。出乎意料的是,同样的病毒rna阳性复测频率已被注意到与Delta突破感染[7],即使存在高浓度的病毒特异性抗体。此外,在评估中和抗体(BRII-196/198)对抗Delta变异感染的临床有效性时,尽管抗体在血液中存在长达3个月,但在有中和抗体和没有中和抗体的患者中,病毒rna阳性复检的频率相似(《医学病毒学杂志》正在修订中)。
外周血中的病毒特异性免疫反应有效地保护肺部免受SARS-CoV-2的攻击,但几乎无助于上呼吸道中的残余病毒RNA清除。我们假设,上呼吸道和下呼吸道之间的病毒特异性粘膜免疫脱钩(或延迟)导致前者频繁复发SARS-CoV-2,但显著减轻了肺损伤(图2)。1 e, F).除了本身产生的粘膜免疫反应外,下呼吸道还可以通过气体交换过程从血液中获得源源不断的细胞因子、抗体、免疫细胞和抗病毒药物到肺泡。下呼吸道可以形成强大的屏障,通过血液和组织特异性免疫反应提供足够的病毒抑制力,限制新冠病毒的复制和扩张。相比之下,上呼吸道表面是一个与血液相对隔离的独特解剖部位。鼻粘膜主要负责捕获小的外来颗粒和湿润吸入的空气。因此,为了避免频繁的炎症,鼻粘膜中的免疫反应对外来刺激不产生反应。鼻粘膜表面从外周血中获得的物质严重不足以弥补无效的局部抗病毒能力。缺乏足够的病毒特异性免疫反应将导致病毒在某些特定细胞内徘徊[14,16]和偶尔在上呼吸道发现(图;1 f).
与大剂量抗体和细胞因子相比,小剂量DAA化学物质能更好地从血液渗透到鼻黏膜,并能积累到足够的浓度来抑制SARS-COV-2的复制。通常情况下,五天的DAA治疗,借助病毒特异性粘膜免疫反应,足以清除所有病毒[13].在停用DAA后,增强的病毒特异性粘膜免疫系统起作用。然而,当黏膜无法在患有共病、免疫抑制、器官移植或其他免疫组成条件的个体中集结免疫力量时,单独的DAA在消除SARS-CoV-2方面效果较差。在这方面,当宿主免疫不起作用时,DAA的退出将使残留病毒复活(图。1 d).理论上,将治疗过程延长到脆弱个体的自然感染周期,将为延迟的病毒特异性免疫反应的成熟留下足够的时间,从而避免病毒反弹。
高滴度的新变异增加了病毒RNA复发的可能性。加强上呼吸道腔室的病毒特异性粘膜免疫似乎对消除SARS-CoV-2和避免病毒反弹至关重要。由于几乎所有符合条件的人群都接种了疫苗,应鼓励能够引起强烈上呼吸道粘膜免疫反应的新一代SARS-COV-2疫苗。也应考虑向上呼吸道黏膜输送足够的抗病毒化学物质和中和抗体,或至少包括在内,治疗过程应延长至黏膜建立其防御能力。
参考文献
戴毅,李KA, Nathanson AB, Leonelli AT, Petros BA, Brock-Fisher T,等。经Nirmatrelvir-Ritonavir治疗和未治疗的mrna免疫个体中严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)感染的病毒动力学medRxiv。2022.08.04.22278378(2022)。
王玲,杨娟,苏红,石玲,陈波,张松。2022年1 - 6月,Paxlovid和Molnupiravir治疗后,COVID-19出现反弹。medRxiv。2022.06.21.22276724(2022)。
从阳性到阴性再到阳性——为什么COVID-19在一些服用paxlovid的患者中反弹的谜团。《美国医学协会杂志》上。2022; 327:2380-2。
Anderson AS, Caubel P, Rusnak JM,调查者E-HT。尼马特韦-利托那韦与病毒载量反弹英国医学杂志。2022;37:10 47 - 9。
陈志强,陈志强,陈志强,等。尼马特韦联合利托那韦治疗后SARS-CoV-2感染的反弹。英国医学杂志。2022;387:1045-7。
胡峰,陈峰,欧志,范强,谭霞,王勇,等。针对SARS-CoV-2受体结合域的特异性体液免疫反应受损与病毒在胃肠道中的持久性和周期性脱落有关。细胞分子免疫杂志2020;17:1119-25。
李玲,唐娟,谢震,甘青,唐刚,胡忠,等。出院后间断复检病毒RNA阳性的SARS-CoV-2 Delta变异感染者的特征Natl science Rev. 2022;在网上,https://doi.org/10.1093/nsr/nwac141.
杜家强、洪耀文、叶德杰、朱伟文、陈文敏、谭锐等。2019冠状病毒病(COVID-19):经全基因组测序证实,系统发育不同的严重急性呼吸综合征冠状病毒2株再次感染。临床感染杂志;
王勇,陈锐,胡峰,兰勇,杨震,杨震,等。广州地区新型SARS-CoV-2型Delta VOC的传播、病毒动力学和临床特征EClinicalMedicine。2021; 40:101129。
张志刚,张志刚,张志刚,张志刚,等。nirmatrelvir-ritonavir治疗COVID-19后病毒学反弹的特征。临床感染病。2022;在网上,https://doi.org/10.1093/cid/ciac512.
Carlin AF, Clark AE, Chaillon A, Garretson AF, Bray W, Porrachia M,等。nirmatrelvir/ritonavir治疗后COVID-19复发的病毒学和免疫学特征Res Sq. 2022;预印,https://doi.org/10.21203/rs.3.rs-1662783/v1.
范强,史俊,杨勇,唐刚,姜敏,李娟,等。突破性Delta SARS-CoV-2感染疫苗接种个体的临床特征和免疫谱变化Nat common . 2022;13:3979。
Saravolatz LD, Depcinski S & Sharma M. Molnupiravir和Nirmatrelvir-Ritonavir:口服COVID抗病毒药物。临床感染病。2022;在网上,https://doi.org/10.1093/cid/ciac180.
贾马志AM,谭ks,陈永勇,刘杰,谭长泉,等。人鼻上皮细胞在体外持续感染SARS-CoV-2,尽管引发了长时间的抗病毒反应。mBio。2022; 13: e0343621。
Servellita V, Syed AM, Morris MK, Brazer N, Saldhi P, Garcia-Knight M,等。来自SARS-CoV-2 Omicron和Delta变体的疫苗突破感染中的中和免疫。细胞。2022;185:1539 e1535——48.。
安俊华,金俊,洪世平,崔世善,杨明梅,朱玉生,等。在新冠肺炎早期,鼻纤毛细胞是SARS-CoV-2复制的主要靶点。中国临床医学杂志。2021;31:e148517。
确认
本工作由广州实验室应急重点项目(No.;EKPG21-29、EKPG21-31)和广东省新型冠状病毒肺炎疫情防控应急基金(No. 2022A1111090002)。
作者信息
作者及隶属关系
贡献
FL写了手稿,XZ准备了数据。XT讨论了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
权利和权限
关于本文
引用本文
郑霞,唐霞,李峰。分隔的上呼吸道黏膜需要时间来聚集足够的免疫力量来清除SARS-CoV-2。细胞Mol免疫(2022)。https://doi.org/10.1038/s41423-022-00931-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41423-022-00931-9