摘要
我们在此报告一个巴基斯坦的近亲家庭,有多个常染色体隐性遗传先天性白内障(arCC)患者。排除分析建立了与22q染色体的连锁,Sanger测序结合基于pcr的染色体行走发现了一个大的纯合基因组缺失。我们的数据表明,这种删除导致CRYBB2-CRYBB2P1融合,由外显子1-5组成CRYBB2第6外显子CRYBB2P1后者携带C. 463 C > T (p.Gln155*)突变,与arCC有关。
根据Cat-Map数据库(https://cat-map.wustl.edu)中发现38个突变CRYBB2与常染色体显性白内障有关。CRYBB2和它的假基因CRYBB2P1位于22号染色体上,相距近250 kb1.改变NM_000496.3:c。463. C > T [p.(Gln155*)] variation from the pseudogene toCRYBB2据报道,在不同的种族背景中分离为常染色体显性性状(https://cat-map.wustl.edu).
一个家庭(PKCC212)被纳入一个合作研究,以调查arCC的遗传基础。机构审查委员会(IRB)获得了约翰霍普金斯大学医学院(巴尔的摩,MD)、国家卫生研究院(Bethesda, MD)和国家分子生物学卓越中心(拉合尔,巴基斯坦)的批准。本研究按照《赫尔辛基宣言》完成,所有参与者在入组前签署知情同意书。
在莱顿·拉赫马图拉慈善信托医院(巴基斯坦拉合尔)进行了眼科检查,包括裂隙灯显微镜检查。从所有受试者中抽取约10毫升血液,储存在50毫升含20毫米EDTA的Sterilin Falcon试管中。提取基因组DNA,使用多态短串联重复序列(STR)标记和Sanger测序对报道的arCC基因/位点进行排除分析,如所述2,3..
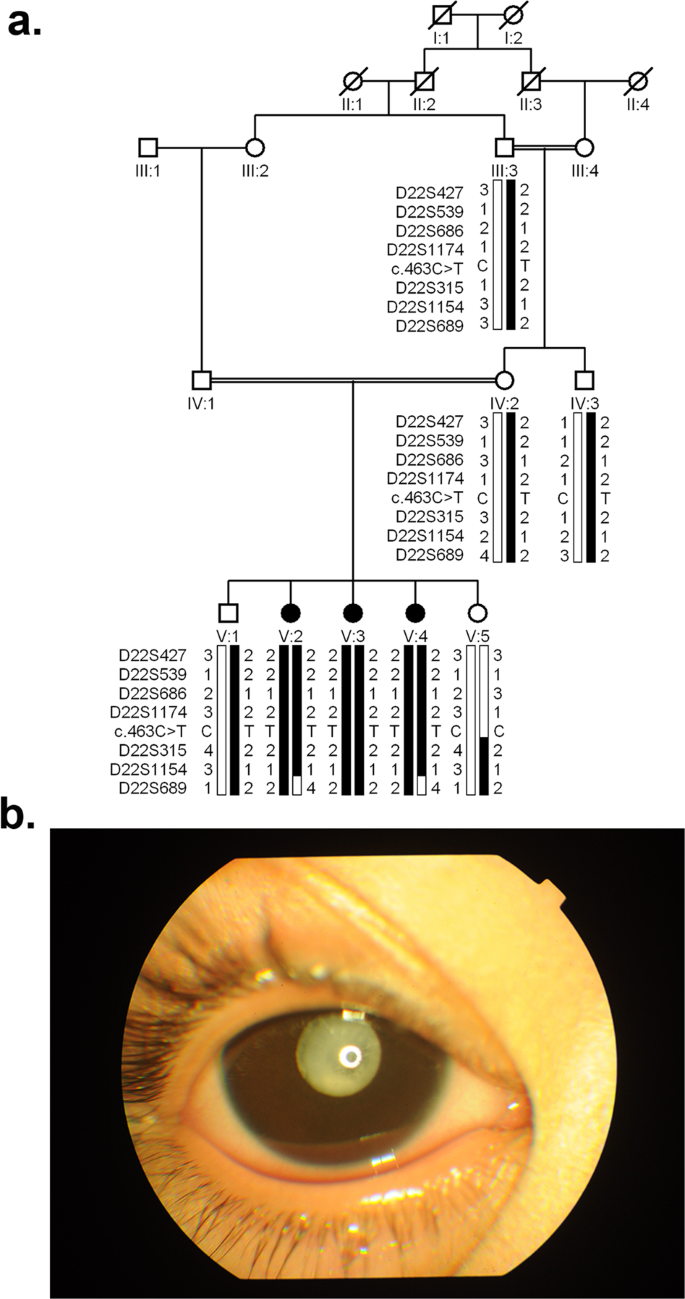
共有8个个体被纳入研究(图。1).眼科检查的医疗记录证实,所有三个受影响的人都患有双侧核白内障;在进入研究之前,除V:3外,所有受影响的个体都接受了手术治疗(图5)。1 b).重要的是,未受影响的家庭成员双侧晶状体无混浊。如补充图所示。1而且2未受影响者IV:3(年龄,41岁)和V:1(年龄,16岁)均无白内障症状。
排除分析证实与染色体22q11.23连锁,标记D22S315的最大两点LOD评分为2.51(补充表1).Sanger测序排除了致病性变异的可能性CRYBA4、CRYBB1 CRYBB3的前4个编码外显子(2-5)CRYBB2.的外显子6特异性引物对CRYBB2未能扩增,表明基因组缺失和/或重排。我们设计引物对来放大两者之间的区域CRYBB2而且LRP5L(BB2_LRP),外显子2LRP5L(LRP5L_Ex2),内含子3LRP5L(LRP5L_Int3)和的区域CRYBB2P1(BB2P1_Int)(补充表2).PCR未能扩增出受感染个体的上述所有区域,但从未受影响个体的基因组DNA中获得PCR产物,即III:3, IV:2, IV:3, V:1,和V:5(补充图。3.),表明存在大量基因组缺失。
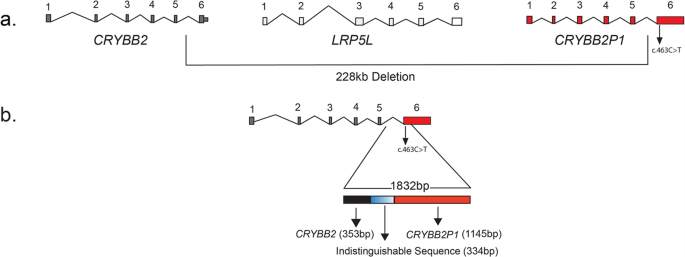
为了确定缺失的程度,我们检测了正向引物退火后的PCR产物CRYBB2并对底漆进行反向退火处理CRYBB2P1(补充表2;BB2Int5_BB2P1Ex6),理论上可以放大一个约230 kb的区域,chr22:25230131-25459788 (GRCh38/Hg38)。然而,我们在所有三个受影响的个体中获得了约1800 bp(后来通过DNA测序确定为1832 bp)的PCR产物(补充图。4),表明基因组缺失消除了PKCC212成员中含有该缺失的近228 kb DNA。
对1832 bp扩增的PCR片段进行Sanger测序,得到353 bp的CRYBB2和1145年的CRYBB2P1,而334 bp序列由于两者之间的序列相似性较高而难以区分CRYBB2而且CRYBB2P1(无花果。2和补充数据1).此外,我们还发现了C .463 C > T变异在6号外显子上CRYBB2-CRYBB2P1,这导致PKCC212家族中谷氨酰胺155 (p.Gln155*)的停止密码子提前出现(补充图5).所有三个受影响的个体都是纯合子的变异,而未受影响的个体是杂合子或纯合子的野生型等位基因(图。1a).这一缺失在96名未受影响的巴基斯坦后裔和24名未受影响的沙特后裔中不存在,他们接受了检查以排除白内障的存在。
综上所述,上述数据表明内含子5的CRYBB2与内含子5融合CRYBB2P1,形成了一个杂交体CRYBB2-CRYBB2P1由前五个外显子和内含子的一部分组成的基因CRYBB2的内含子5、外显子6的其余部分和的3 ' UTRCRYBB2P1(无花果。2).
一个在PKCC212中发现了22q染色体228 kb的基因组缺失。bPKCC212基因的缺失去除PKCC212基因的外显子6CRYBB2(ENST00000651629.1),LRP5 L的前5个外显子CRYBB2假基因(CRYBB2P1).引物对BB2Int5_BB2P1Ex6的扩增结果2)鉴定出22q染色体的1832-bp片段。在这个1832-bp的区域中,有353和1145 bp与CRYBB2而且CRYBB2P1分别;334bp仍然无法区分,由于压倒性的相似CRYBB2而且CRYBB2P1.注意:CRYBB2P1转录本NR_ 033733.1和NR_ 033734.1分别由5个和6个外显子组成。外显子4和5CRYBB2P1转录本NR_ 033733.1和NR_ 033734.1同源于CRYBB2外显子6携带p.Gln155*突变。注:转录本根据基因组参考联盟人类Build 38补丁版本12 (GRCh38.p12)汇编。
接下来,我们通过下一代测序对PKCC212的三个受影响个体V:2、V:3和V:4的外显子体进行了研究。全外显子组文库制备和受影响个体的下一代测序由诺福根公司(Davis, USA)进行商业操作。外显子组数据的质量控制分析显示>99%的reads为150个碱基对,95%的测序数据产生了30分或以上的PHRED评分。高通量测序结果是每个样本有48 - 6600万个对端reads,约48 - 6600万个reads(总reads的99.8%)被唯一映射到人类基因组(GRCh38.p13),代表所有三个外显子体的平均112×到152×覆盖率(补充表)3.).Lasergene Genomics Suite (DNASTAR, Madison, WI, USA)用于参考导向基因组比对和外显子组数据的变异调用/注释。对端原始reads与人类基因组(GRCh38.p13)对齐,并使用DNASTAR (Madison, WI, USA)专有软件(SeqMan NGen & ArrayStar Ver. 12)和默认参数对映射的reads进行进一步处理,以进行变体调用和注释。如所述,严格的标准用于从潜在的因果变量中过滤假阳性结果3..
我们首先检查了外显子组数据集中22q染色体上的连锁区间,特别是228-kb的缺失。检测连锁区间的所有变异(测序深度≥5 reads);然而,我们没有发现任何起源于的外显子CRYBB2或LRP5L(补充资料2,3.,4).为了排除除在连锁区间内或PKCC212中负责白内障表型的外显子组中其他地方的染色体22q缺失以外的致病变异的可能性,通过先前用于识别突变的方法系统地过滤了三个外显子组中存在的所有变异PEX53..然而,个体V:2, V:3,和V:4的外显子体中没有变异证明了白内障发生的标准(补充图。6).
基因转换导致C .463 C > T (p.Gln155*)变异从假基因转移CRYBB2P1第6外显子CRYBB2在多个白内障家族中都有报道,并表现为常染色体显性特征4,5,6,7,8.相反,我们的数据暗示了一个包含第6外显子的基因组缺失CRYBB2,LRP5L,最CRYBB2P1负责PKCC212中的arCC。融合导致白内障发生的确切病理机制CRYBB2而且CRYBB2P1仍不清楚。值得注意的是,3'UTR的混合CRYBB2来源于未转录和/或翻译的假基因,因此极有可能缺乏保护新生mRNA免遭降解的能力9.鉴于3'UTR在保护mRNA免受降解方面的重要性,人们很容易推测杂交的mRNACRYBB2(包括C .463 C > T (p.Gln155*)突变)不稳定并被降解。这将导致杂合载体中只有野生型mRNA存在。我们进一步推测单一功能CRYBB2杂合子携带者中的等位基因足以维持晶状体的透明度。相反,突变等位基因纯合的个体完全缺乏功能CRYBB2,导致无效表型和先天性白内障。
最近,Sun等人报道了一种新的致病性突变LRP5L(C .107 C > G, p.P36R)属于先天性膜性白内障家族10.尽管同时删除的可能性LRP5L参与了PKCC212中白内障的发生,鉴于gnomAD数据库中存在空等位基因(https://gnomad.broadinstitute.org).
HGV数据库
本数据报告的相关数据保存在人类基因组变异数据库https://doi.org/10.6084/m9.figshare.hgv.3216.
参考文献
人类结晶蛋白基因家族。嗡嗡声。基因组学626(2012)。
汗,S. Y.等。在巴基斯坦近亲家庭中,PDE6A的剪接位点突变与视网膜色素变性有关。摩尔。粘度21871(2015)。
阿里,M.等。PEX5的一个错义等位基因是导致PTS2货物蛋白导入过氧化物酶体缺陷的原因。嗡嗡声。麝猫。140, 649 - 666(2021)。
利特,M.等。常染色体显性天蓝色白内障与人类β -结晶蛋白基因CRYBB2的链终止突变有关。嗡嗡声。摩尔,麝猫。6, 665 - 668(1997)。
吉尔,D.等。柯普克样白内障的遗传异质性:染色体22q11.2上CRYBB2的突变。投资。角膜切削。粘度科学。41, 159 - 165(2000)。
Vanita et al。常染色体显性白内障的一种独特形式由β -结晶蛋白B2及其假基因之间的基因转换解释。j .地中海,麝猫。38, 392 - 396(2001)。
Yao, K.等。一个中国家庭CRYBB2突变引起的进行性多态先天性白内障。摩尔。粘度11, 758 - 763(2005)。
贝特曼,J. B.等。一个智利常染色体显性白内障家族中β - b2 (CRYBB2)基因转换突变。眼科学114, 425 - 432(2007)。
Grzybowska, E., wilczyzynska, A. & Siedlecki, J. 3 ' utr的调节功能。物化学。Biophys。Commun >,288, 291 - 295(2001)。
孙,L.等。LRP5L中的新突变P36R通过抑制层粘连蛋白γ - 1和c-MAF导致先天性膜性白内障。graef拱门。中国。角膜切削实验。258, 2737 - 2751(2020)。
科恩等人。纯合子CRYBB1缺失突变是常染色体隐性遗传性先天性白内障的基础。投资。角膜切削。粘度科学。48, 2208 - 2213(2007)。
Riazuddin, S. A.等。两个巴基斯坦家族常染色体隐性白内障相关的betab3 -晶体蛋白突变。角膜切削投资。粘度科学。46, 2100 - 2106(2005)。
确认
作者感谢所有家庭成员参与本研究。该研究部分得到了哈立德国王眼科专科医院-约翰霍普金斯大学合作基金(S.A.R.)和国家眼科研究所基金1R01EY022714 (S.A.R.)的支持。
作者信息
作者和联系
贡献
b.i.、f.k.、n.s.、s.y.k.、b.r.、s.r.、j.f.h.和S.A.R.构思并设计了实验。s.r.、J.F.H和S.A.R.贡献了试剂、材料和分析工具。b.i.、F.K、n.s.、S.Y.K、B.R和m.a.n进行了实验。我,F.K B.R。,M.A.N, T.A.Q, S.R, J.F.H,重点招募受试者。我,F.K。,S.Y.K B.R。S.R, J.F.R,重点分析了数据。我,F.K。n ., B.R。S.Y.K, B.F。M.A.N, T.A.Q, S.R, J.F.H,重点写的手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
Irum, B., Kabir, F., Shoshany, N.。et al。基因组缺失包含CRYBB2-CRYBB2P1常染色体隐性遗传性先天性白内障。哼基因组Var931(2022)。https://doi.org/10.1038/s41439-022-00208-7
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1038/s41439-022-00208-7