摘要gydF4y2Ba
耐药是对表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)(包括奥西替尼)获得性耐药的基础,其机制尚不清楚。在这里,我们显示当axl低表达时gydF4y2Ba表皮生长因子受体gydF4y2Ba突变型肺癌(gydF4y2Ba表皮生长因子受体gydF4y2Bamutl - lc细胞比高表达axl的细胞对奥希替尼更敏感gydF4y2Ba表皮生长因子受体gydF4y2Bamut-LC细胞,一小部分出现了奥西替尼耐受性。这种耐受性是由胰岛素样生长因子-1受体(IGF-1R)的表达增加和磷酸化介导的,其转录因子FOXA1的诱导引起。在奥西替尼存在的情况下,IGF-1R维持与EGFR和适配蛋白(包括Gab1和IRS1)的关联,并恢复生存信号。在AXL-low-expressinggydF4y2Ba表皮生长因子受体gydF4y2Bamut-LC细胞来源的异种移植物和患者来源的异种移植物模型,短暂的IGF-1R抑制联合持续的奥西替尼治疗即使在停止奥西替尼治疗后也能根除肿瘤并防止再生。这些结果表明,耐受信号的最佳抑制联合奥西替尼可能显著改善预后gydF4y2Ba表皮生长因子受体gydF4y2Bamut-LC。gydF4y2Ba
介绍gydF4y2Ba
肺癌是全球癌症相关死亡的主要原因,非小细胞肺癌(NSCLC)占肺癌的85%。免疫检查点抑制剂,包括抗程序性死亡1 (PD-1)抗体和抗程序性死亡配体1 (PD-L1)抗体,已被批准用于治疗晚期非小细胞肺癌,并已被证明可以治愈晚期非小细胞肺癌患者gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba。ICIs的治疗潜力鼓励了新型药物治疗的发展,这将显著改善晚期非小细胞肺癌的预后。gydF4y2Ba
奥西替尼是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),可选择性抑制突变gydF4y2Ba表皮生长因子受体gydF4y2Ba(例如,gydF4y2Ba表皮生长因子受体gydF4y2Ba外显子19缺失,L858R和T790M),并保留野生型EGFRgydF4y2Ba3 gydF4y2Ba。奥西替尼对t790m阳性患者有效gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC患者对经典型EGFR-TKIs(包括吉非替尼和厄洛替尼)难治gydF4y2Ba4gydF4y2Ba。此外,奥西替尼作为一线治疗时比吉非替尼和厄洛替尼更有效gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌gydF4y2Ba5gydF4y2Ba。然而,几乎所有的患者都会因获得性奥希替尼耐药而复发。关于对奥西替尼获得性耐药,几种机制包括耐药突变gydF4y2Ba表皮生长因子受体gydF4y2Ba(C797S / C796D),gydF4y2Ba见过gydF4y2Ba扩增,以及其他驱动癌基因的出现(gydF4y2Ba喀斯特gydF4y2Ba突变,gydF4y2BaBRAFgydF4y2Ba突变,gydF4y2Ba受潮湿腐烂gydF4y2Ba融合等)已经在gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌患者,不论有无gydF4y2Ba表皮生长因子受体gydF4y2Ba-T790M突变gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba。考虑到这个事实gydF4y2Ba表皮生长因子受体gydF4y2Ba-T790M突变发生在大量人群中(60-70%)gydF4y2Ba表皮生长因子受体gydF4y2Ba对第一代EGFR-TKIs吉非替尼和厄洛替尼获得耐药性的-突变肺癌患者gydF4y2Ba10gydF4y2Ba,这些观察结果表明,奥西替尼耐药机制更加多样化,因此获得性奥西替尼耐药可能更难控制。最近的研究发现,一小部分细胞作为持久性细胞适应EGFR-TKIs的初始治疗,这是获得性耐药病变的基础gydF4y2Ba11gydF4y2Ba。通过阐明EGFR-TKIs初始治疗后的适应机制,我们可以开发新的起始疗法来根除肿瘤细胞,从而进一步改善晚期肿瘤的预后gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC通过防止获得性耐药的发展。gydF4y2Ba
在此之前,我们报道了axl高表达gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌,一小部分肿瘤细胞通过恢复与EGFR和HER3相关的AXL的生存信号而对奥西替尼产生耐受性,并且奥西替尼和AXL抑制剂联合治疗阻止了对奥西替尼获得性耐药的发展gydF4y2Ba12gydF4y2Ba。另一方面,即使在axl低表达的gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌中,一小部分肿瘤细胞对奥西替尼持续存在并发展为获得性耐药肿瘤。然而,潜在的机制仍然未知。gydF4y2Ba
在本研究中,我们研究了axl低表达对奥希替尼耐受的机制gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系来源的异种移植物(CDX)和患者来源的异种移植物(PDX)。我们观察到,axl低表达的细胞表现出磷酸化胰岛素样生长因子受体1 (IGF-1R)水平的增加,并通过恢复与EGFR相关的IGF-1R的生存信号而对奥西替尼暴露产生耐受性。在axl低表达的CDX和PDX模型中,IGF-1R抑制剂与连续奥西替尼的短暂联合可根除肿瘤细胞并阻止其再生gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌。gydF4y2Ba
结果gydF4y2Ba
奥西替尼增加AXL-low肿瘤细胞的磷酸化igf - 1rgydF4y2Ba
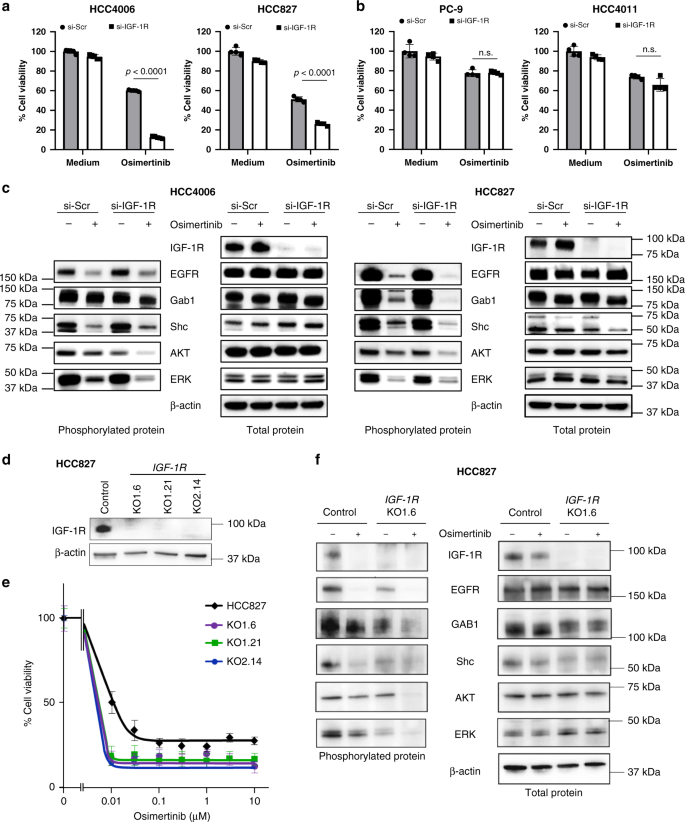
在第一组实验中,我们比较了axl高表达(PC-9、PC-9/GXR和HCC4011)和axl低表达(HCC4006、HCC827和H3255)的患者对奥西替尼的敏感性。gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系(图2)gydF4y2Ba1 a, bgydF4y2Ba)。而奥西替尼抑制了所有细胞的生存能力gydF4y2Ba表皮生长因子受体gydF4y2Ba以剂量依赖的方式测试,axl低表达的肿瘤细胞系的IC50(半最大抑制浓度)值低于axl高表达的肿瘤细胞系。这些结果与我们之前的研究一致,表明axl低表达gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞比高表达axl的细胞对奥希替尼更敏感gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞。然而,不管AXL的表达如何,一小群肿瘤细胞在暴露于1 μmol/L奥西替尼72小时后仍然存活,这表明这些群体对奥西替尼具有耐受性。gydF4y2Ba
一个gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞(2 × 10gydF4y2Ba3 gydF4y2Ba每孔(96孔板)以指定浓度与奥希替尼孵育72小时。使用细胞计数试剂盒评估细胞活力。条形图表示重复培养的sd值。数据以均数±标准差表示。gydF4y2BabgydF4y2Ba溶菌产物的gydF4y2Ba表皮生长因子受体gydF4y2Bawestern blotting分析-突变的NSCLC细胞株。所示数据是三个独立实验的代表性数据。gydF4y2BacgydF4y2Ba免疫组织化学测定细胞质AXL蛋白表达水平与奥西替尼治疗反应的相关性gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC样本来自29例患者。gydF4y2BadgydF4y2Ba奥西替尼治疗后与基线相比肿瘤大小的变化gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌患者gydF4y2BangydF4y2Ba= 6)和AXL-high (gydF4y2BangydF4y2Ba= 23)表达。数据用均数和标准差表示。gydF4y2BapgydF4y2Ba价值提供(双面学生)gydF4y2BatgydF4y2Ba以及)。gydF4y2BaegydF4y2Ba人酪氨酸激酶磷酸化阵列分析gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞系在存在或不存在奥西替尼的情况下(30 nmol/L用于HCC4006和H3255细胞);1 μmol/L (PC-9细胞)作用72 h。圆圈表示IGF-1R。gydF4y2BafgydF4y2Ba表皮生长因子受体-gydF4y2Ba用奥西替尼(HCC4006和H3255细胞为30 nmol/L, HCC827细胞为300 nmol/L)处理突变的NSCLC细胞株指定时间,并用western blotting分析裂解物。所示数据是三个独立实验的代表性数据。gydF4y2Ba
接下来,我们回顾性地评估了AXL表达与奥西替尼作为一线治疗的临床疗效之间的相关性gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌。使用免疫组化(IHC)染色评估egfr - tki治疗前肿瘤样本细胞质中AXL的表达,并将AXL的表达分为非常高(3+)、高(2+)、低(1+)和无(0)表达(补充图)gydF4y2Ba1gydF4y2Ba)。在29个国家中gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC肿瘤标本中AXL高表达(2+ ~ 3+)和低表达(无1+)的分别有6例(21%)和23例(79%)。axl低表达患者对奥希替尼的有效率(16/23;70%)高于axl高表达组(3/6;50%),特别是在AXL评分为3+的患者中,对奥西替尼治疗无反应(0/2;0%)(图。gydF4y2Ba1 cgydF4y2Ba)。此外,与axl -高表达患者相比,axl -低表达患者的奥西替尼更有显著的肿瘤缩小趋势(gydF4y2BapgydF4y2Ba= 0.094)(图。gydF4y2Ba1 dgydF4y2Ba)。值得注意的是,无论肿瘤中AXL的表达如何,在这29例患者中,奥西替尼治疗没有达到完全缓解,这表明即使在应答者中,奥西替尼治疗的小肿瘤仍然是残留病变。这些结果与细胞系实验结果一致,虽然axl低表达gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌对奥西替尼高度敏感,获得耐药后经常发生耐药。gydF4y2Ba
为了阐明奥西替尼耐受的机制,我们对axl低表达(HCC4006和H3255)和axl高表达(PC-9)进行了受体酪氨酸激酶(RTK)阵列分析。gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系用或不用奥希替尼处理72小时。在49个rtk中,暴露于奥西替尼后,axl低表达的肿瘤细胞系中IGF-1R磷酸化增加,而axl高表达的肿瘤细胞系中则没有磷酸化(图2)。gydF4y2Ba1 egydF4y2Ba)。Western blot分析显示,当评估gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞系表达不同水平的IGF-1R蛋白,与axl -高表达的肿瘤细胞系相比,axl -低表达的肿瘤细胞报告了更高水平的磷酸化IGF-1R (pIGF-1R)。gydF4y2Ba1 bgydF4y2Ba)。与RTK阵列的结果一致,暴露于奥西替尼72小时可增强axl低表达肿瘤细胞系(HCC4006、HCC827和H3255)中的pIGF-1R(图2)。gydF4y2Ba1 fgydF4y2Ba)。有趣的是,虽然IGF-1R磷酸化最初被抑制了3-24小时,但与对照相比,暴露于奥西替尼72小时后,IGF-1R蛋白表达以及IGF-1R磷酸化都有所增加。流式细胞分析证实,在奥西替尼处理的HCC4006细胞中,IGF-1R蛋白表达增加,而在PC-9细胞中则没有。gydF4y2Ba2gydF4y2Ba)。RTK阵列显示,奥西替尼似乎增加了H3255细胞中MET和HCC4006细胞中FGFR3的磷酸化。然而,在western blotting后,我们检测到在H3255或HCC4006细胞中,奥西替尼处理72小时后,磷酸化MET或FGFR3没有明显的增加。gydF4y2Ba3gydF4y2Ba)。我们使用MTT法进一步评估MET抑制剂(克唑替尼)和FGFR抑制剂(BGJ398)分别对H3255和HCC4006细胞中奥西替尼敏感性的影响。虽然克唑替尼和BGJ398分别抑制了H3255和HCC4006细胞中MET和FGFR3的磷酸化,但克唑替尼和BGJ398都没有显著影响H3255和HCC4006细胞对奥西替尼的敏感性(补充图)。gydF4y2Ba3中gydF4y2Ba)。这些结果表明MET和FGFR3不太可能在介导奥西替尼敏感性中起主要作用gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的肺癌细胞至少在我们的实验条件下进行了测试。gydF4y2Ba
接下来,我们评估了16例axl低表达(无至1+)患者的pIGF-1R表达与奥西替尼作为一线治疗的临床疗效之间的相关性gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌。在egfr - tki治疗前的肿瘤样本中,使用免疫组化染色评估pIGF-1R的表达,并将pIGF-1R的表达分为非常高(3+)、高(2+)、低(1+)和无(0)表达(补充图)。gydF4y2Ba4gydF4y2Ba)。在16例标本中,5例(31%)和11例(69%)分别出现高表达(2+ ~ 3+)和低表达(无表达~ 1+)。在pigf - 1r高表达的患者中,奥希替尼的有效率为100% (5/5);然而,在pigf - 1r低表达的患者中,有效率为73%(8/11)。gydF4y2Ba4 bgydF4y2Ba)。此外,在pigf - 1r高表达患者中,与pigf - 1r低表达患者相比,奥西替尼诱导的肿瘤缩小更为显著(gydF4y2BapgydF4y2Ba= 0.011)(补充图gydF4y2Ba4摄氏度gydF4y2Ba),与实验结果一致gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系(图2)gydF4y2Ba1 a, bgydF4y2Ba)。这些结果表明,虽然磷酸化的IGF-1R水平与对奥西替尼的更好反应相关,但与奥西替尼介导的IGF-1R蛋白表达增加相关的IGF-1R磷酸化的进一步增加可能在axl低表达的耐受性中起关键作用gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌。gydF4y2Ba
IGF-1R支持AXL-low肿瘤细胞的存活gydF4y2Ba
为了评估IGF-1R在奥西替尼耐受中的作用,我们使用适当的sirna敲除IGF-1R。IGF-1R敲低不影响细胞的生存能力gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞在没有奥西替尼的情况下测试。在亚理想浓度(HCC4006和H3255细胞系为30 nmol/L,其他细胞系为300 nmol/L)的情况下,敲低IGF-1R可明显抑制axl低表达的HCC4006、HCC827和H3255细胞的活力(图2)。gydF4y2Ba2gydF4y2Ba和补充图。gydF4y2Ba5gydF4y2Ba),但axl高表达的PC-9或HCC4011细胞不存在(图2)。gydF4y2Ba2 bgydF4y2Ba)。Western blot结果显示,在axl低表达的细胞系中,奥西替尼暴露抑制EGFR、其衔接蛋白grb2相关结合蛋白1 (Gab1)、Src同源性和胶原同源性(Shc)以及下游信号分子AKT和ERK的磷酸化。gydF4y2Ba2摄氏度gydF4y2Ba和补充图。gydF4y2Ba5 bgydF4y2Ba)。IGF-1R敲低进一步抑制这些分子在奥西替尼暴露下的磷酸化,与细胞活力测定的结果一致。为了进一步证实IGF-1R的作用,我们通过CRISPR-CAS9靶向IGF-1R的两个不同位点(KO1和KO2)建立了IGF-1R敲除HCC827细胞(补充图2)。gydF4y2Ba6gydF4y2Ba,无花果。gydF4y2Ba二维gydF4y2Ba)。与亲代HCC827细胞相比,所有测试的IGF-1R KO克隆对奥希替尼明显更敏感。gydF4y2Ba2 egydF4y2Ba)。暴露于奥西替尼后,IGF-1R敲除进一步抑制了Gab1、Shc、AKT和ERK的磷酸化,这与使用IGF-1R siRNA敲除IGF-1R细胞观察到的结果一致。gydF4y2Ba2 fgydF4y2Ba)。gydF4y2Ba
低axl表达(gydF4y2Ba一个gydF4y2Ba)和axl高表达(gydF4y2BabgydF4y2Ba)gydF4y2Ba表皮生长因子受体gydF4y2Ba在存在或不存在奥西替尼(AXL-low of HCC4006和HCC827:30 nmol/L和300 nmol/L)的情况下,用非特异性对照(si-Scr)或IGF-1R特异性siRNA (si-IGF-1R)处理突变的NSCLC细胞系72小时;PC-9和HCC4011:1 μmol/L),测定细胞活力。与未经处理的对照相比,显示了生长的百分比。数据以均数±标准差表示。每个样品一式三次,每个实验至少独立重复三次。gydF4y2BapgydF4y2Ba值提供(单向方差分析)。附注:不显著。gydF4y2BacgydF4y2Ba将si-Scr或si-IGF-1R引入HCC4006和HCC827细胞。24 h后,分别用或不加奥西替尼(30 nmol/L和300 nmol/L)孵育72 h并裂解,western blotting检测指示蛋白。gydF4y2BadgydF4y2Ba利用CRISPR-CAS9对HCC827细胞IGF-1R敲低克隆(KO-1-6、KO1-21和KO2-14)进行裂解,western blotting检测蛋白表达。gydF4y2BaegydF4y2Ba将HCC827及其IGF-1R敲低克隆与不同浓度的奥西替尼孵育,用MTT法测定细胞活力。数据以均数±标准差表示。gydF4y2BafgydF4y2Ba将HCC827和KO1-6克隆与300 nmol/L的奥西替尼(osimertinib)孵育2 h后进行酶解,western blotting检测指定蛋白及其磷酸化水平。所示数据是三个独立实验的代表性数据。gydF4y2Ba
这些结果清楚地表明IGF-1R参与了axl低表达的耐受性并支持存活gydF4y2Ba表皮生长因子受体gydF4y2Ba暴露于奥西替尼后-突变的非小细胞肺癌细胞。gydF4y2Ba
奥西替尼通过FOXA1上调IGF-1R mRNA表达gydF4y2Ba
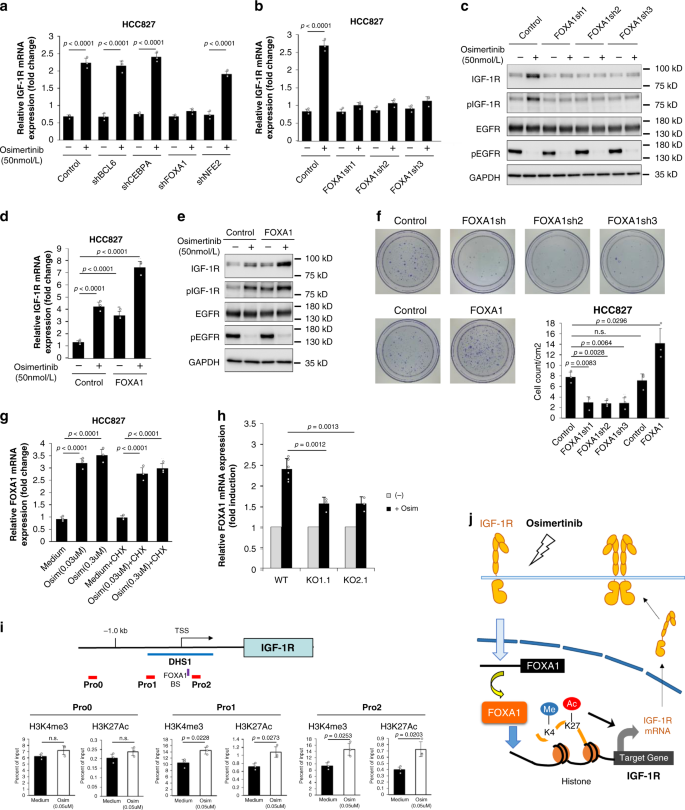
接下来,我们探索了暴露于奥西替尼后IGF-1R蛋白增加的机制。定量RT-PCR结果显示,暴露于奥西替尼可上调IGF-1R mRNA的表达。gydF4y2Ba7一个gydF4y2Ba)。暴露于奥希替尼后,环己亚胺在mRNA和蛋白质水平上都能阻止IGF-1R的诱导。gydF4y2Baa, b, cgydF4y2Ba)。因此,我们假设奥西替尼对IGF-1R的上调可能需要重新合成激活IGF-1R mRNA表达的转录因子。为了确定这些候选转录因子,我们试图发现可以结合IGF-1R启动子周围的调控区域的转录因子,并且在奥西替尼暴露后被上调。来自ChIP-Atlas整合的公开ChIP-seq数据gydF4y2Ba13gydF4y2Ba,我们选择了79个候选转录因子,这些转录因子可以结合IGF-1R转录起始位点(TSS)周围的DNase I超敏位点1 (DHS1)。gydF4y2Ba8gydF4y2Ba)。然后,我们进行了定量RT-PCR分析,以确定奥西替尼暴露后上调的候选转录因子。在HCC827细胞中,奥西替尼处理后,BCL6、CEBPA、FOXA1和NFE2等4个转录因子上调2倍以上(补充数据)gydF4y2Ba1gydF4y2Ba)。调查这四名候选人是否参与gydF4y2BaIGF-1RgydF4y2BamRNA上调后,我们检测了每种shRNA在奥西替尼处理的HCC827细胞中下调BCL6、CEBPA、FOXA1和NFE2的影响(图2)。gydF4y2Ba3gydF4y2Ba)。FOXA1的下调,而非NFE2、BCL6或CEBPA的下调,抑制了奥西替尼诱导的IGF-1R mRNA上调(图2)。gydF4y2Ba3gydF4y2Ba)。我们使用三种不同的shrna证实了FOXA1敲低对抑制IGF-1R mRNA诱导的影响(图2)。gydF4y2Ba3 bgydF4y2Ba)。此外,FOXA1敲低抑制了奥西替尼诱导的总IGF-1R和磷酸化IGF-1R蛋白的上调,但不能影响总EGFR和磷酸化EGFR蛋白的状态(图2)。gydF4y2Ba3 cgydF4y2Ba)。这些结果表明FOXA1在osimertinib暴露诱导的HCC827细胞IGF-1R上调中是不可或缺的。接下来,我们检查了FOXA1过表达在奥希替尼处理的细胞中的影响。在HCC827细胞中,无论是否存在奥西替尼,FOXA1的过表达都会增加IGF-1R mRNA、总IGF-1R和磷酸化IGF-1R蛋白的水平,但对总EGFR和磷酸化EGFR蛋白没有影响(图2)。gydF4y2Ba3 d, egydF4y2Ba)。这些结果表明FOXA1作为IGF-1R转录激活因子的特殊作用。接下来,我们检测了FOXA1敲低或过表达对HCC827细胞中奥希替尼耐受性的影响。使用三种不同的shrna敲除FOXA1可减少耐奥西替尼菌落的数量,并通过FOXA1过表达而增加(图2)。gydF4y2Ba3 fgydF4y2Ba)。这些结果表明FOXA1有助于增强HCC827细胞对奥西替尼的耐受性。与补充图中显示的IGF-1R表达结果相反。gydF4y2Ba4gydF4y2Ba,暴露于奥希替尼后FOXA1的诱导不受环己亚胺处理的影响,这表明奥希替尼对FOXA1的上调不需要从头合成蛋白质(图2)。gydF4y2Ba3 ggydF4y2Ba)。我们假设预先存在的信号蛋白或途径可能是奥西替尼诱导FOXA1 mRNA的原因。因此,我们观察到,在IGF-1R敲除的HCC827细胞克隆中,依赖奥西替尼的FOXA1诱导被显著抑制。gydF4y2Ba3 hgydF4y2Ba)。这些结果表明,IGF-1R蛋白参与了奥西替尼暴露后激活FOXA1 mRNA表达的信号转导。由于在DHS1中,在IGF-1R基因的TSS附近存在FOXA1的一致结合位点(图2)。gydF4y2Ba3我gydF4y2Ba和补充图。gydF4y2Ba8 bgydF4y2Ba),我们进行了ChIP检测,以检查奥西替尼治疗是否会诱导IGF-1R基因表观遗传状态的变化。奥西替尼治疗在DHS1区域(Pro1和Pro2)内诱导转录活性组蛋白修饰,如H3K4me3和H3K27Ac,而不在DHS1区域(Pro0)外。gydF4y2Ba3我gydF4y2Ba)。总的来说,这些数据表明,奥西替尼暴露通过包含内源性IGF-1R蛋白的信号通路激活FOXA1表达。然后,FOXA1诱导IGF-1R基因转录更活跃的表观遗传状态,导致IGF-1R在HCC827细胞中正反馈激活(图2)。gydF4y2Ba3 jgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba采用实时定量聚合酶链反应(qRT-PCR)检测表达对照shRNA (sh)或指定分子shRNA的慢病毒感染HCC827细胞24小时后IGF-1R mRNA的表达。gydF4y2BabgydF4y2Ba在HCC827细胞中进行IGF-1R转录本的qRT-PCR,与osimertinib处理相似(gydF4y2Ba一个gydF4y2Ba),引入了三种不同的FOXA1 shrna。gydF4y2BacgydF4y2Ba同样用奥西替尼处理对照或FOXA1 shrna的HCC827细胞,用western blotting检测指示蛋白。gydF4y2BadgydF4y2Ba采用qRT-PCR方法检测IGF-1R在感染对照或表达FOXA1逆转录病毒的HCC827细胞中表达,并进行类似的奥西替尼治疗。gydF4y2BaegydF4y2Ba用western blotting在指示细胞中检测指示蛋白,如(gydF4y2BadgydF4y2Ba)。gydF4y2BafgydF4y2BaFOXA1敲低或过表达的HCC827细胞在奥西替尼存在下于60mm培养皿中培养18天。用结晶紫染色,然后成像。耐药菌落的平均数量显示在右图中。gydF4y2BaggydF4y2Ba用奥西替尼(Osim)和/或环己亚胺(CHX) (50 μg/mL)处理HCC827细胞24 h。收集mRNA,采用qRT-PCR检测FOXA1 mRNA表达情况。gydF4y2BahgydF4y2Ba采用qRT-PCR检测HCC827细胞中FOXA1 mRNA的表达,以及IGF-1R的敲低。gydF4y2Ba我gydF4y2Ba图示IGF-1R基因的启动子区域。蓝色和紫色条分别代表DNase I超敏位点1 (DHS1)和FOXA1一致结合位点(BS)。用于ChIP测定的引物所覆盖的区域用红色条表示,命名为Pro0至Pro2。TSS:转录起始位点。经或不经奥西替尼(Osim)处理24h的HCC827细胞交联,制备细胞裂解液。H3K4me3和H3K27Ac在IGF-1R基因指定区域的ChIP分析如下图所示。gydF4y2BajgydF4y2Ba奥西替尼诱导FOXA1和IGF-1R表达的可能机制示意图。我:甲基化。Ac乙酰化作用。所示数据是三个独立实验的代表性数据。数据以均数±标准差表示。注:不重要。gydF4y2BapgydF4y2Ba值提供(双面学生的)gydF4y2BatgydF4y2Ba以及)。gydF4y2Ba
IGF-1R与EGFR和衔接蛋白相关gydF4y2Ba
接下来,我们试图阐明奥西替尼增强IGF-1R磷酸化的机制。据报道,IGF-1R主要通过其配体结合和与其他受体(包括EGFR)的相互作用而激活gydF4y2Ba14gydF4y2Ba。我们观察到gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系在培养上清中产生非常低水平的IGF-1和IGF-2蛋白,这是IGF-1R的主要配体。gydF4y2Ba9gydF4y2Ba)。此外,外源添加高浓度(50 ng/ml)的重组IGF-1可以增加IGF-1R的磷酸化,但对体外培养的HCC4006、HCC827和H3255细胞中奥西替尼的敏感性没有显著影响(补充图2)。gydF4y2Ba9 b, cgydF4y2Ba)。这些结果表明,在这些细胞系中,IGF-1R配体不太可能参与奥西替尼暴露诱导的IGF-1R磷酸化。gydF4y2Ba
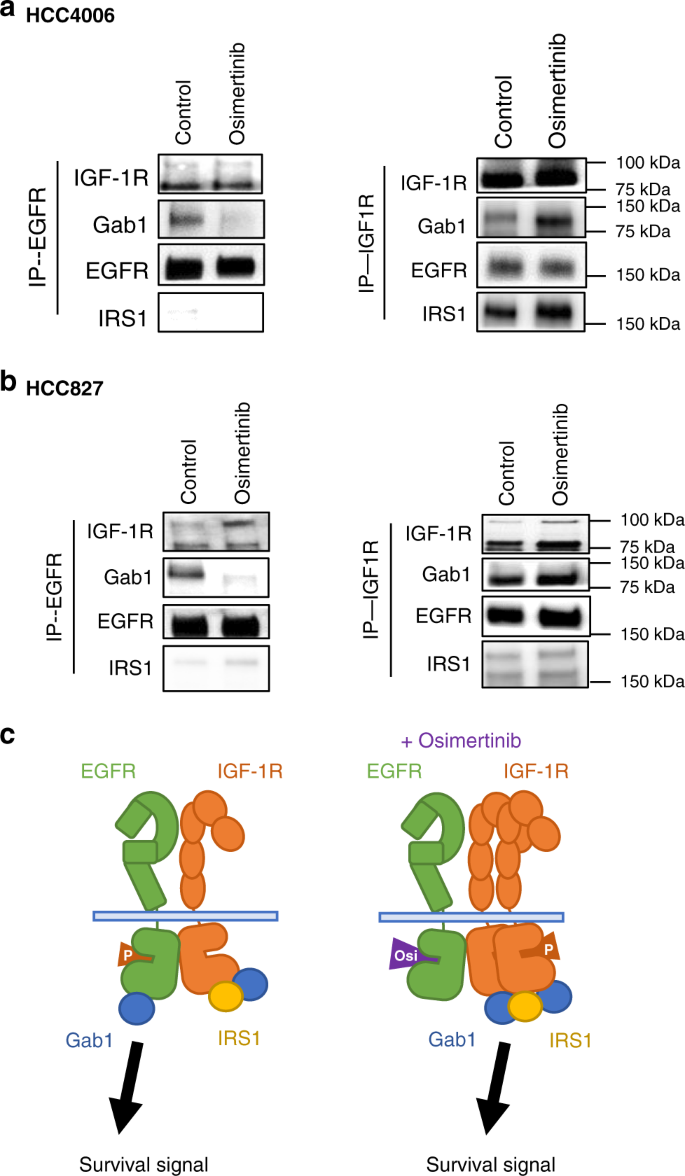
因此,我们接下来研究了IGF-1R与EGFR及其接头蛋白(如Gab1、Shc和胰岛素受体底物1 (IRS1))的关系。免疫沉淀和western blotting表明,在HCC4006和HCC827细胞中,EGFR与IGF-1R和Gab1组成性相关,而与IRS1无关(图2)。gydF4y2Ba4 a、bgydF4y2Ba)。奥西替尼治疗不影响EGFR与IGF-1R的关联;然而,EGFR与Gab1的相关性减弱。有趣的是,IGF-1R也与其接头蛋白IRS1组成相关,使用奥西替尼治疗倾向于增加IGF-1R与IRS1和Gab1的关联,但不增加EGFR。gydF4y2Ba
总的来说,这些发现表明,EGFR和IGF-1R组成性地与包括Gab1在内的接头蛋白相关的每种蛋白结合,并可能主要通过EGFR转导axl低表达的存活信号gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞。在奥西替尼暴露下,失活的EGFR仍然与IGF-1R相关,但不再与Gab1相关。然而,与EGFR结合的IGF-1R蛋白的数量增加,与包括IRS1和Gab1在内的衔接蛋白相关,并可以在这些细胞中转导生存信号(图2)。gydF4y2Ba4摄氏度gydF4y2Ba)。gydF4y2Ba
IGF-1R抑制剂抑制axl -低肿瘤细胞活力gydF4y2Ba
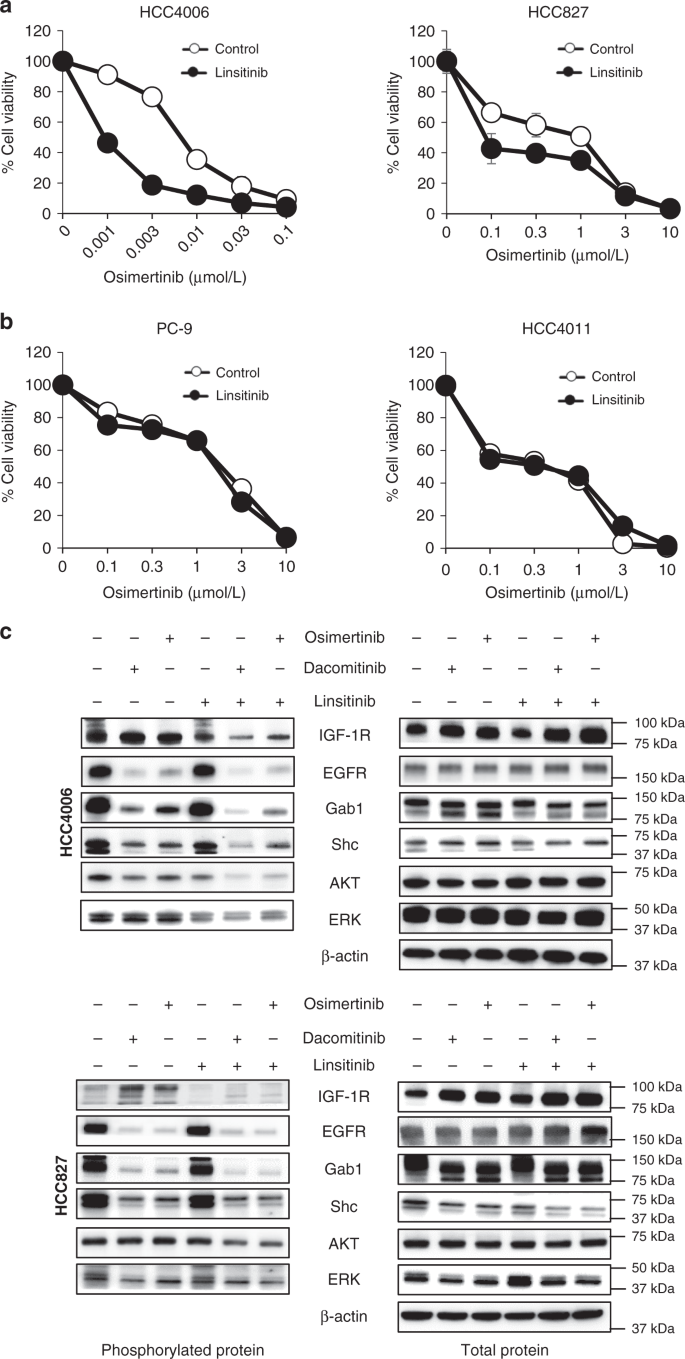
接下来,我们评估了抑制IGF-1R磷酸化的小化合物利西替尼的作用gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba。结果表明,单独使用3 μmol/L或更低浓度的利西替尼对细菌的生存能力没有影响gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系,与AXL表达无关(补充图2)。gydF4y2Ba10gydF4y2Ba)。联合使用1 μmol/L的利西替尼增强了奥西替尼对axl低表达的作用gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞(图2)gydF4y2Ba5gydF4y2Ba和补充图。gydF4y2Ba11个gydF4y2Ba),但axl高表达者不存在gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的PC-9或HCC4011细胞(图2)gydF4y2Ba5 bgydF4y2Ba)。在低表达axl的患者中,利西替尼与FDA批准的第一代和第二代EGFR-TKIs吉非替尼或dacomitinib联合使用时观察到类似的效果gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的非小细胞肺癌细胞系(补充图)gydF4y2Ba12gydF4y2Ba)。Western blotting研究细胞内信号传导表明,奥西替尼或dacomitinib单独抑制EGFR、Gab1和AKT的磷酸化,但增加了HCC4006、HCC827和H3255细胞中IGF-1R蛋白的表达和IGF-1R磷酸化(图2)。gydF4y2Ba5度gydF4y2Ba和补充图。gydF4y2Ba11 bgydF4y2Ba)。奥西替尼和利西替尼治疗时间较长(7天),可根除HCC4006、HCC827和H3255细胞(补充图)。gydF4y2Ba13gydF4y2Ba)。这些结果表明,IGF-1R抑制剂利西替尼可以阻止axl低表达的奥西替尼耐受gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的NSCLC细胞。gydF4y2Ba
低axl表达(gydF4y2Ba一个gydF4y2Ba)和axl高表达(gydF4y2BabgydF4y2Ba)gydF4y2Ba表皮生长因子受体gydF4y2Ba用不同浓度的奥西替尼(1 μmol/L)处理-突变的非小细胞肺癌细胞株72 h,检测细胞活力。与未经处理的对照相比,显示了生长的百分比。数据以均数±标准差表示。每个样品一式三次,每个实验至少独立重复三次。gydF4y2BacgydF4y2BaHCC4006和HCC827细胞分别用奥西替尼(分别为30和300 nmol/L)、达克替尼(分别为30和300 nmol/L)和/或利西替尼(1 μmol/L)处理。72h后,细胞裂解,western blotting检测指定蛋白。所示数据是三个独立实验的代表性数据。条形图表示s.d。gydF4y2Ba
短暂性联合利西替尼治疗体内低axl肿瘤gydF4y2Ba
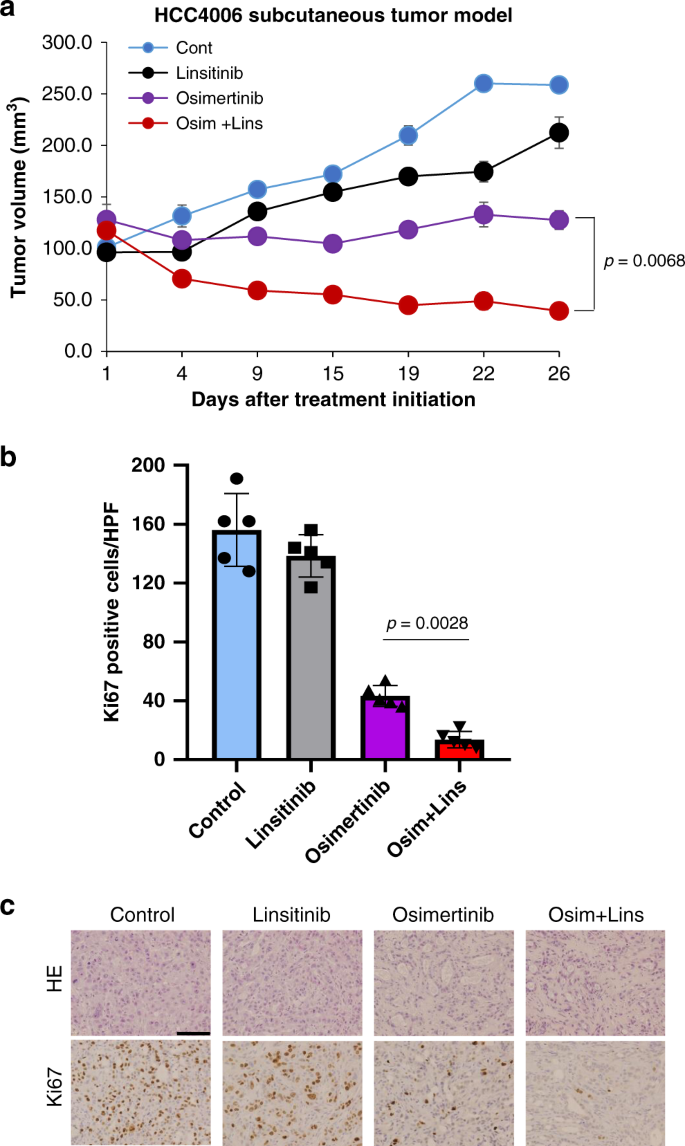
我们在体内评估了利西替尼联合奥希替尼的效果。皮下肿瘤HCC4006细胞生长迅速,利西替尼单药治疗不抑制生长。奥西替尼治疗的次优剂量(5mg /kg)gydF4y2Ba17gydF4y2Ba防止肿瘤扩大。奥希替尼和利西替尼联合治疗可诱导肿瘤缩小(图2)。gydF4y2Ba6gydF4y2Ba)。这些处理不影响小鼠的体重(补充图2)。gydF4y2Ba14个gydF4y2Ba),表明处理的可行性。免疫组化分析显示,奥西替尼治疗降低了肿瘤增殖细胞的数量,利西替尼与奥西替尼联合使用进一步抑制了肿瘤增殖细胞的数量(图2)。gydF4y2Ba6 bgydF4y2Bac)。gydF4y2Ba
一个gydF4y2BaHCC4006细胞系来源的异种移植物(CDX)肿瘤用载体(对照:gydF4y2BangydF4y2Ba= 4只小鼠),利西替尼50mg /kg (gydF4y2BangydF4y2Ba= 4只小鼠),奥希替尼5mg /kg (gydF4y2BangydF4y2Ba= 5只小鼠),或利西替尼50mg /kg加奥希替尼5mg /kg (gydF4y2BangydF4y2Ba= 5只小鼠),每日灌胃。从治疗开始测量肿瘤体积随时间的变化(平均值±s.e.m)。gydF4y2BapgydF4y2Ba值提供(双面学生的)gydF4y2BatgydF4y2Ba测试)。gydF4y2BabgydF4y2Ba增殖细胞的定量,通过ki -67阳性增殖指数(ki -67阳性细胞的百分比)测定,如“方法”所述。列,平均五个区域。数据以均数±标准差表示。gydF4y2BapgydF4y2Ba值提供(双面学生的)gydF4y2BatgydF4y2Ba测试)。高功率场。gydF4y2BacgydF4y2BaHCC4006异种移植物H&E染色和人Ki-67抗体免疫组化染色的代表性图像。Bar, 100 μm。gydF4y2Ba
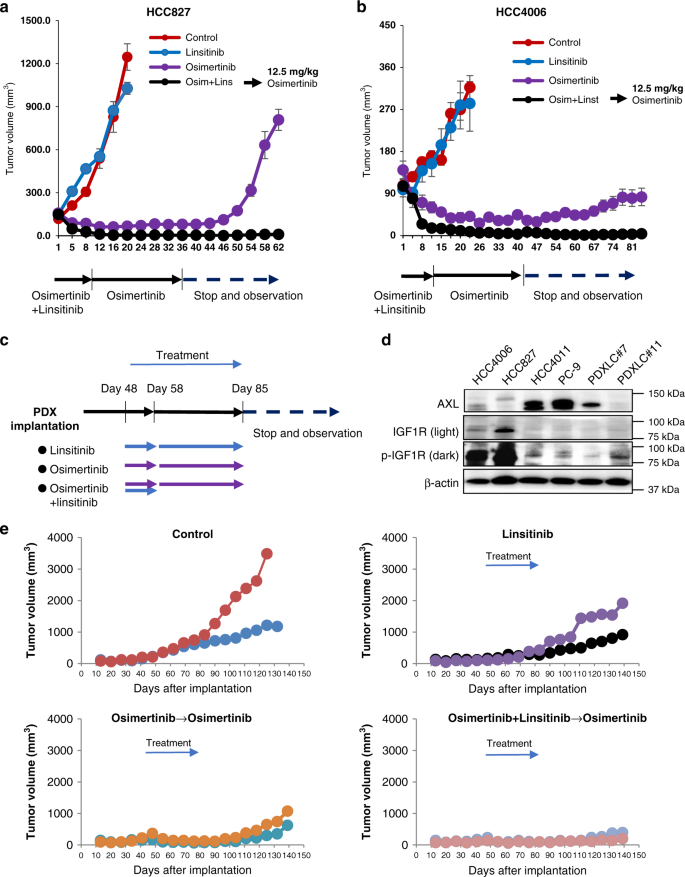
虽然最近的临床试验报告了利西替尼与EGFR-TKI厄洛替尼联合的可行性,但持续给药利西替尼导致厄洛替尼剂量中断、减少和停药的发生率更高gydF4y2Ba18gydF4y2Ba。因此,我们接下来评估了短暂联合利西替尼治疗HCC827或HCC4006细胞皮下肿瘤的效果。HCC827或HCC4006细胞的皮下肿瘤生长迅速,单药利西替尼不抑制其生长。较高剂量(12.5 mg/kg)的奥西替尼治疗可减小肿瘤大小,但在奥西替尼治疗期间仍存在小肿瘤。停止奥西替尼治疗后,这些肿瘤重新生长(图2)。gydF4y2Ba7 a、bgydF4y2Ba)。短暂联合使用利西替尼10天,连续使用奥西替尼治疗,肿瘤消失。令人惊讶的是,即使在停止奥西替尼治疗后,这些肿瘤也没有再生长。各组大鼠体重均未见明显下降(补充图2)。gydF4y2Ba14 bgydF4y2Ba)。gydF4y2Ba
HCC827 (gydF4y2Ba一个gydF4y2Ba)-或HCC4006 (gydF4y2BabgydF4y2Ba)细胞系来源的异种移植物(CDX)肿瘤用载体(对照:gydF4y2BangydF4y2Ba= 4只小鼠),利西替尼50mg /kg (gydF4y2BangydF4y2Ba奥希替尼12.5 mg/kg (gydF4y2BangydF4y2Ba= 5~6只小鼠),或利西替尼50mg /kg +奥希替尼12.5 mg/kg (gydF4y2BangydF4y2Ba= 5只小鼠),灌胃10 d。接下来,给予奥希替尼和利西替尼加奥希替尼的组每天给予12.5 mg/kg的奥希替尼治疗,持续25天。随后,终止治疗,第62天观察肿瘤再生情况。从治疗开始测量肿瘤体积随时间的变化(平均值±s.e.m)。gydF4y2BacgydF4y2BaPDX模型的治疗时间表。PDX肿瘤植入48 d后,分别给药(对照)、利西替尼50 mg/kg、奥西替尼12.5 mg/kg或利西替尼50 mg/kg +奥西替尼12.5 mg/kg,灌胃10 d。接下来,给予奥西替尼组和利西替尼加奥西替尼组每天12.5 mg/kg奥西替尼治疗27天。利西替尼组每日50mg /kg利西替尼治疗27天。此后,终止治疗,并在第140天评估肿瘤再生情况。gydF4y2BadgydF4y2Bawestern blotting分析细胞株和PDXs的裂解物。所示数据是两个独立实验的代表。gydF4y2BaegydF4y2BaPDX lc #11 (gydF4y2BangydF4y2Ba= 2只/组),处理方法见(gydF4y2BacgydF4y2Ba)。gydF4y2Ba
此外,我们在PDX模型中评估了与利西替尼的短暂联合(图2)。gydF4y2Ba7 cgydF4y2Ba)。我们从患者中建立了两个pdxgydF4y2Ba表皮生长因子受体gydF4y2Ba突变gydF4y2Ba19gydF4y2Ba。PDX LC#7有gydF4y2Ba表皮生长因子受体gydF4y2Ba-L858R和可识别水平的AXL,缺乏磷酸化的IGF-1R。另一方面,PDX LC#11有gydF4y2Ba表皮生长因子受体gydF4y2Ba-外显子19缺失和可识别水平的磷酸化IGF-1R,但没有AXL(图2)。gydF4y2Ba7 dgydF4y2Ba)。因此,我们选择PDX LC#11进行这组实验。PDX LC#11肿瘤逐渐生长,单药利西替尼没有抑制生长。较高剂量(12.5 mg/kg)的奥西替尼治疗可减小肿瘤大小,但小肿瘤在奥西替尼治疗后仍存在。停止奥西替尼治疗后,这些肿瘤迅速重新生长(图2)。gydF4y2Ba7 egydF4y2Ba)。短暂联合利西替尼与连续奥西替尼治疗10天,肿瘤消失。这些肿瘤即使在停止奥西替尼治疗后也很难再生长。这些结果表明,短暂联合使用利西替尼与持续奥西替尼治疗可以治愈或显著延缓axl低表达的肿瘤复发gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的非小细胞肺癌。gydF4y2Ba
讨论gydF4y2Ba
癌细胞的异质性限制了癌症治疗的效果gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。最近的研究发现,肺癌与经典的gydF4y2Ba表皮生长因子受体gydF4y2Ba突变,如外显子19和外显子21 L858R突变,在对EGFR-TKI治疗的反应方面是一种异质性疾病gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba。观察到的异质反应可能是由多种因素引起的,包括基因中复合突变的存在gydF4y2Ba表皮生长因子受体gydF4y2Ba24gydF4y2Ba肿瘤细胞中耐药蛋白如AXL和MET的表达gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba肝细胞生长因子(HGF)等多种基质源性耐药分子gydF4y2Ba27gydF4y2Ba。目前的研究表明,axl高表达与对第三代EGFR-TKI奥西替尼的不良初始反应有关。另一方面,虽然axl低表达的肿瘤细胞对奥西替尼高度敏感,但由于IGF-1R的表达和磷酸化增加,这些细胞中的一小部分表现出耐受性。此外,奥西替尼对IGF-1R的短暂抑制可能导致根除gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌细胞。gydF4y2Ba
我们之前报道过gydF4y2Ba表皮生长因子受体-gydF4y2Ba包括奥西替尼在内的EGFR-TKIs突变与肿瘤细胞中AXL的表达呈负相关gydF4y2Ba12gydF4y2Ba。在本研究中,我们证实了这一点,并进一步观察到,尽管一小部分高表达和低表达axl的肿瘤细胞对奥西替尼暴露产生耐受性,并成为获得性耐药的基础,但高表达和低表达axl的肿瘤细胞对奥西替尼的耐受性机制存在很大差异。在AXL-high-expressinggydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌细胞,奥西替尼暴露抑制ERK磷酸化,从而降低由ERK介导的MAPK信号维持的SPRY4的表达gydF4y2Ba12gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba。由于SPRY4抑制包括AXL在内的多种受体酪氨酸激酶的激活,因此暴露于奥西替尼后SPRY4的表达降低导致AXL蛋白的激活,而不影响AXL蛋白的表达水平,主要通过AKT恢复存活信号gydF4y2Ba12gydF4y2Ba。另一方面,我们证明了在axl低表达的情况下gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌细胞中,奥西替尼暴露增加了IGF-1R的蛋白表达和磷酸化,从而主要通过Gab1和IRS1恢复生存信号,产生耐受性。有趣的是,AXL低表达的肿瘤细胞对奥希替尼更敏感,其磷酸化的IGF-1R的基线水平高于AXL高表达的肿瘤细胞,这表明基线水平磷酸化的IGF-1R对奥希替尼敏感性的影响可能小于AXL表达。然而,在axl低表达的肿瘤细胞中,暴露于奥西替尼(例如,3天),通过增加蛋白表达和磷酸化IGF-1R,通过表观遗传修饰产生耐受性。这增加了转录因子FOXA1的表达,并通过与Gab1和IRS1相关的IGF-1R恢复了存活信号。Gab1/IRS1信号是由暴露于奥西替尼后通过FOXA1增加IGF-1R磷酸化而不是基线IGF-1R磷酸化引起的,其原因仍有待阐明。此外,磷酸化的IGF-1R在低表达axl的肿瘤细胞中的基线水平表达高于高表达axl的肿瘤细胞的原因目前也不清楚。今后有必要进一步检查以阐明这些机制。gydF4y2Ba
据报道,已经证明IGF-1R在EGFR-TKIs耐受细胞的出现中起着至关重要的作用。第一代EGFR-TKIs刺激组蛋白去甲基化酶KDM5A的表达,导致与IGF-BP3过表达相关的IGF-1R磷酸化增加,从而诱导耐药细胞gydF4y2Ba11gydF4y2Ba。第三代EGFR-TKIs PF299804和WZ4002激活IGF-1R,是由于IGFBP3的启动子病变甲基化导致其表达缺失gydF4y2Ba30.gydF4y2Ba。在本研究中,我们证明了对临床可用的第三代EGFR-TKI奥西替尼的耐受性是通过增加IGF-1R蛋白表达诱导的。奥西替尼暴露通过包含内源性IGF-1R蛋白的信号通路激活转录因子FOXA1的表达,FOXA1随后诱导IGF-1R基因转录更活跃的表观遗传状态,导致IGF-1R的正反馈激活(图2)。gydF4y2Ba3 jgydF4y2Ba)。FOXA1是一种开创性的转录因子,可以结合并打开“封闭染色质”并触发靶基因上的转录事件gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba。先前的一项研究报告称,FOXA1在各种类型的癌症中经常发生突变或扩增gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba。在某些肺癌病例中,FOXA1由于基因扩增而过度表达gydF4y2Ba37gydF4y2Ba。这些研究表明FOXA1参与了人类肺癌的癌变。然而,FOXA1是否参与肺癌的耐药尚不清楚。在这里,我们证明了FOXA1在奥西替尼耐受细胞的出现中不可或缺的作用,通过激活IGF-1R,与axl低表达的IGF-1R mRNA和蛋白表达增加相关gydF4y2Ba表皮生长因子受体gydF4y2Ba暴露于奥西替尼后-突变的非小细胞肺癌细胞。gydF4y2Ba
IGF-1R和其他rtk(包括EGFR、HER2、VEGFR2、PDGFR、MET和ALK)之间的串扰导致相互补偿机制,限制了针对单个途径的治疗的反应和/或介导获得性耐药gydF4y2Ba14gydF4y2Ba。最近有报道称,EGFR和IGF-1R可以在多个水平上相互作用,要么通过两个受体之间的直接关联,要么通过各自配体的可用性,要么间接通过共同的相互作用伙伴,如G蛋白偶联受体或下游信号分子,包括接头蛋白gydF4y2Ba14gydF4y2Ba。我们的数据表明,IGF-1R可能是通过与EGFR直接结合而不是其配体结合而被串扰激活的。gydF4y2Ba4gydF4y2Ba)。在axl低表达的肿瘤细胞中,EGFR和IGF-1R组成性地结合到与其适配蛋白相关的每种蛋白上,包括Gab1(图1)。gydF4y2Ba4gydF4y2Ba)。虽然奥西替尼降低了EGFR与Gab1的关联,但它没有抑制IGF-1R与EGFR或Gab1的关联。再加上奥西替尼增加IGF-1R蛋白水平的发现,这些结果强烈表明,IGF-1R的增加,维持了与EGFR和Gab1的关联,可能恢复axl低表达的生存信号gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌细胞暴露于奥西替尼。这种串扰及其对奥西替尼耐受的参与为EGFR和IGF-1R的双重靶向提供了明确的理论依据。gydF4y2Ba
另一方面,IGF-1R在体内平衡中起着不可缺少的作用,因此持续抑制IGF-1R可能导致血糖水平控制不佳等各种不良反应gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba。Rociletinib是第三代EGFR-TKI,已知具有抑制IGF-1R的代谢物活性gydF4y2Ba40gydF4y2Ba。虽然在t790m阳性患者中,罗西莱替尼与奥希替尼的抗肿瘤效果相似gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变肺癌,其安全性不如奥西替尼gydF4y2Ba41gydF4y2Ba。考虑到这些问题,我们选择IGF-1R抑制剂与奥西替尼的短暂联合,在axl低表达的CDXs和PDX模型中显示出良好的疗效和安全性gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变肺癌。这些新发现可能对考虑治疗策略或显著改善预后至关重要gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变肺癌。因为奥希替尼是一种选择性的突变gydF4y2Ba表皮生长因子受体gydF4y2Ba在肿瘤细胞和主要在宿主细胞中表达的野生型EGFR中,IGF-1R抑制剂与奥西替尼短暂联合的可行性可能比第一代或第二代EGFR- tkis更优越。gydF4y2Ba
总之,我们揭示了axl低表达的机制gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变的肺癌细胞表现出对奥西替尼的耐受性。我们的研究结果表明,通过IGF-1R联合奥西替尼对耐受信号进行最佳抑制可能会显著改善axl低表达的结果gydF4y2Ba表皮生长因子受体gydF4y2Ba-突变肺癌。此外,IGF-1R抑制剂与奥西替尼短暂联合应用的安全性和有效性还需在临床试验中进行评估。gydF4y2Ba
方法gydF4y2Ba
细胞培养和试剂gydF4y2Ba
六种人类非小细胞肺癌细胞系在gydF4y2Ba表皮生长因子受体gydF4y2Ba被利用。人类NSCLC细胞系HCC4011和H3255分别由Dr. David P. Carbone(俄亥俄州立大学综合癌症中心,Columbus, OH)和Dr. John D. Minna(德克萨斯大学西南医学中心,Dallas, TX)慷慨提供。人类细胞系HCC827和HCC4006购自美国类型培养收集(Manassas, VA), PC-9细胞系来自RIKEN cell Bank (Ibaraki, Japan)。PC-9GXR细胞中含有gydF4y2Ba表皮生长因子受体gydF4y2Ba-外显子19和T790M突变,是在金泽大学(Kanazawa, Japan)从获得吉非替尼抗性的裸鼠PC-9细胞异种移植肿瘤中建立的gydF4y2Ba12gydF4y2Ba。所有这些细胞系均保存在罗斯威尔公园纪念研究所(RPMI) 1640培养基(GIBCO, Carlsbad, CA)中,加10%胎牛血清(FBS),青霉素(100 U/mL)和链霉素(50 g/mL),加湿COgydF4y2Ba2gydF4y2Ba37℃培养箱。所有细胞传代时间均小于3个月,然后用冷冻的早期传代stock进行更新。使用MycoAlert支原体检测试剂盒(Lonza)定期对细胞进行支原体筛查。细胞系通过DNA指纹鉴定。奥西替尼、达克替尼、吉非替尼和利西替尼来自Selleckchem (Houston, TX)。gydF4y2Ba
细胞活力测定gydF4y2Ba
肿瘤细胞(2-3 × 10gydF4y2Ba3 gydF4y2Ba细胞/100 μL/孔)在添加10%胎牛血清的RPMI 1640培养基中接种于96孔板中,用指定的化合物培养72 h。培养后,使用CCK-8试剂盒(Dojindo Laboratories)测定细胞活力。相对于未经处理的对照组测定生长百分比。实验用三个重复的样品至少重复三次。gydF4y2Ba
人磷酸激酶抗体阵列gydF4y2Ba
49种激酶和两种相关总蛋白的相对磷酸化水平使用Human Phospho-Kinase Array Kit (R&D Systems)测量,使用对制造商说明书的修改。简而言之,细胞在含有10% FBS的rpm -1640中培养,并在到达汇合之前在阵列缓冲液中裂解。用阻断缓冲液阻断阵列,用450 μg细胞裂解液在4°C下孵育过夜。清洗后,用辣根过氧化物酶(HRP)偶联磷酸激酶抗体孵育,并用SuperSignal West Dura Extended Duration Substrate Enhanced chemluminescent Substrate (Pierce Biotechnology, Rockford, IL)处理。每个实验至少独立进行两次。gydF4y2Ba
抗体和免疫印迹gydF4y2Ba
用SDS聚丙烯酰胺凝胶电泳(Bio-Rad, Hercules, CA)分离25 μg的蛋白质等分,或用相应抗体免疫沉淀1000 μg的总蛋白质等分。免疫复合物用蛋白G-Sepharose或蛋白A-Sepharose珠(Zymed Laboratories, California)回收。电泳蛋白样品或免疫沉淀样品转移到聚偏二氟乙烯膜(Bio-Rad)上。清洗三次后,用印迹级阻断剂(Bio-Rad)室温孵育1小时,4℃孵育过夜,一抗为p-AXL (Tyr702)、t-AXL、p-EGFR、p-IGF-1R、t-IGF-1R、p-Akt (Ser473)、t-Akt、p-Gab1、t- gab1、p-Shc、t-Shc、ir -1、β-actin (13E5)(1:10 000稀释;Cell Signaling Technology, Danvers, MA, USA), p-Erk1/2 (Thr202/Tyr204), t-Erk1/2和t-EGFR(1:1000稀释,研发系统)。gydF4y2Ba
清洗三次后,用酶标的种特异性二抗在室温下孵育1小时。使用SuperSignal West Dura Extended Duration Substrate Enhanced Chemiluminescent Substrate (Pierce Biotechnology)对免疫反应条带进行可视化。每个实验至少独立进行三次。gydF4y2Ba
病人gydF4y2Ba
肿瘤标本含有gydF4y2Ba表皮生长因子受体gydF4y2Ba-激活突变,在以奥西替尼作为一线治疗的初始治疗之前,从29名非小细胞肺癌患者中获得,这些患者分别在大学医院、京都立医科大学(日本京都)、长崎大学医院(日本长崎)、国际医疗中心、埼玉医科大学(日本埼玉)或国立医院组织Kinki-chuo胸科医学中心(日本大阪)住院。研究方案由京都立医科大学、长崎大学、埼玉医科大学和国立医院组织Kinki-chuo胸科医学中心的机构审查委员会批准。所有患者均提供书面知情同意书。gydF4y2Ba
肿瘤的组织学分析gydF4y2Ba
简而言之,将福尔马林固定的、石蜡包埋的组织切片(4-μm厚)进行脱蜡处理。将组织切片用10 mM柠檬酸缓冲液(pH 6.0)微波提取抗原。用Ki-67抗体(克隆MIB-1;DAKO Corp, Glostrup, Denmark)。根据表达模式,分别用抗AXL抗体(1:20 00;山羊多克隆(R&D SYSTEMS)和pIGF-1R使用抗Phospho-IGF1- R抗体(1:80;细胞信号技术,丹佛斯,MA,美国)。由于免疫组织化学研究表明,AXL和pIGF-1R主要存在于细胞的细胞质中,并且其染色强度不同,因此我们将其表达量化为阴性(0),弱(1+),中等(2+)和强(3+),与血管内皮细胞相比作为内部对照gydF4y2Ba12gydF4y2Ba。用二抗孵育后,用Vectastain ABC Kit (Vector Laboratories, Burlingame, CA)处理,用3,3 ' -二氨基联苯胺(DAB)作为显色剂观察过氧化物酶活性。接下来,切片用苏木精反染。gydF4y2Ba
免疫组织化学结果的量化gydF4y2Ba
选择每个切片中含有阳性染色细胞数量最多的五个区域,使用光学或荧光显微镜在400倍放大下进行组织学定量。gydF4y2Ba
流式细胞术gydF4y2Ba
用于EGFR检测,肿瘤细胞单细胞悬液(5 × 10gydF4y2Ba5gydF4y2Ba冻存或不冻存Brilliant Violet 421TM抗人EGFR抗体(Biolegend Cat.No. 5)。352911, 2.5 μl/样品)静置30分钟。用于IGF-1R检测,肿瘤细胞单细胞悬液(5 × 10gydF4y2Ba5gydF4y2Ba)用PerFix-nc Kit (Beckman Coulter, Cat.No. 6)预处理。B31167, 50 μL 2% FBS, 5 μL Buffer 1(每个样品),室温作用15 min,用于膜渗透。洗涤后,每个样品加入300 μL Buffer 2和1 μL IGF-1受体B (D23H3)兔单克隆抗体,室温孵育30 min。然后清洗细胞,每个样品用300 μL Buffer 2和1 μL alexa -488偶联抗体处理,室温下处理30min。洗涤两次后,每个样品用500 μL的Final buffer重悬细胞,使用BD FACSCANTOII系统进行分析。gydF4y2Ba
sirna的转染gydF4y2Ba
双工消声器®选择siRNA用于gydF4y2BaIGF-1RgydF4y2Ba从Invitrogen (Carlsbad, CA)购买,并按照制造商的说明使用Lipofectamine RNAiMAX (Invitrogen)转染到细胞中。在所有实验中,Silencer®选择siRNA作为阴性对照1号(Invitrogen)作为混杂对照。用于pLKO的寡核苷酸的义链序列。1construct specific to BCL6, CEBPA, FOXA1, and NFE2 are listed in Supplementary Table1gydF4y2Ba。gydF4y2Ba
利用CRISPR/Cas9系统生成IGF-1R敲除HCC827细胞gydF4y2Ba
IGF-1RgydF4y2Ba-特异性单导rna (sgrna)使用CRISPRdirect (gydF4y2Bahttp://crispr.dbcls.jpgydF4y2Ba)。生成gydF4y2BaIGF-1RgydF4y2Ba敲除细胞时,我们使用了两对sgrna。部分缺失的sgRNA #1和#2序列gydF4y2BaIGF1RgydF4y2Ba外显子2 (KO1)分别为5′-GCGTTGCGGATGTCGATGCC-3′和5′-GCGGTAGCTGCGGTAGTCCT-3′。sgRNAs #3和#4用于部分删除gydF4y2BaIGF1RgydF4y2Ba外显子9 (KO2)为5 ' -GCTTCTCAGTTAATCGTGAAG-3 '和5 ' -GAGCAGTAATTGTGCCGGTAA-3 '。每个sgRNA被克隆到pX330-U6-Chimeric_BB-CBh-hSpCas9中,这是Feng Zhang博士的礼物(附加基因质粒#42230;gydF4y2Bahttp://n2t.net/addgene:42230gydF4y2Ba;RRID: Addgene_42230),然后是它们的通用克隆协议gydF4y2Ba42gydF4y2Ba。gydF4y2Ba
质粒使用1 mg/ml PEI MAX (Polysiences, Inc.)转染6孔板中的HCC827细胞。每孔使用150 ng两个CRISPR/Cas9质粒和50 ng编码嘌呤霉素耐药基因的pPurΔDTA质粒(由日本金泽大学Ryu Imamura博士赠送)。嘌呤霉素选择后,对耐药细胞进行稀释传代,取几个单菌落进行进一步实验。为检测细胞克隆的基因型,采用Tks Gflex DNA聚合酶(Takara Bio Inc.)进行PCR,引物如下:KO1细胞为5 ' -ATGGTCGGTTGGAGTGTGTTG-3 '和5 ' -CACTCGGAACAGCAGCAAGTAC-3 ', KO2细胞为5 ' -TGCCAGAGTATCTGATAGCCTGAC-3 '和5 ' -TAGGGCTCAGGCACATTACAAC-3 '。gydF4y2Ba
预测IGF-1R表达的转录因子gydF4y2Ba
为了获得调节IGF-1R表达的候选转录因子,我们首先利用ChIP-Atlas根据公开的dna序列峰预测,在IGF-1R转录起始位点(TSS)周围寻找DNase I超敏位点(DHS)区域gydF4y2Ba13gydF4y2Ba。总之,我们选择了智人(生物体)、dna序列(抗原类)、所有细胞类型(细胞类型类)和100(显著性阈值)。gydF4y2Bahttps://chip-atlas.org/peak_browsergydF4y2Ba)使用整合基因组学查看器(IGV)可视化dna -seq数据。我们在IGF-1R基因的TSS周围发现了两个潜在的DHS区域(DHS1: chr15:99191191-99192070和DHS2: chr15:99190087-99191190, hg19)。gydF4y2Ba8gydF4y2Ba)。接下来,我们使用CTCFBSDB 2.0 (gydF4y2Bahttp://insulatordb.uthsc.edu/gydF4y2Ba)gydF4y2Ba43gydF4y2Ba。由于DHS2区域包含几个潜在的CTCF结合位点,并可能作为绝缘子区域,我们将重点放在结合DHS1区域的候选转录因子上。如上所述,从ChIP-Atlas Peak Browser中获得的公共ChIP-seq峰中,除了“dna -seq”被“TFs和其他”取代外,我们观察到79个候选转录因子(见补充数据)gydF4y2Ba1gydF4y2Ba),在DHS1区有结合峰。gydF4y2Ba
定量rt - pcrgydF4y2Ba
对于RNA定量,使用SuperScript VILO cDNA合成试剂盒和Master Mix (Invitrogen)对收集的RNA进行逆转录。采用FastStart Universal SYBR Green Master (Roche)软件,ViiA7 Real-Time PCR系统(Applied Biosystems)进行定量PCR分析。gydF4y2Ba44gydF4y2Ba。将PCR数据与对照人GAPDH表达进行归一化处理。至少三个独立实验的平均值用标准差表示。gydF4y2BaPgydF4y2Ba-使用学生的值计算对照和样本之间的值gydF4y2BatgydF4y2Ba以及。用于定量PCR的引物列于补充表gydF4y2Ba1 bgydF4y2Ba。gydF4y2Ba
染色质免疫沉淀(ChIP)分析gydF4y2Ba
ChIP实验进行如下gydF4y2Ba44gydF4y2Ba。简而言之,将细胞与1%多聚甲醛交联10分钟,然后与200 mM甘氨酸孵育5分钟,以猝灭活性醛。交联染色质通过Bioruptor II型超声仪(日本BM Equipment Co.)破碎,并用兔抗体(anti-H3K4me3 (#07-473, Millipore)和anti-H3K27Ac (#39133, Active motif)结合Dynabeads Protein G (Invitrogen)进行免疫沉淀。免疫沉淀DNA依次用苯酚和氯仿提取,用乙醇沉淀回收。通过定量PCR分析特定扩增区域的富集情况,并显示每种修饰在输入染色质DNA上的富集百分比。用于定量PCR的引物列于补充表gydF4y2Ba1 cgydF4y2Ba。gydF4y2Ba
CDX模型gydF4y2Ba
悬液为5 × 10gydF4y2Ba6gydF4y2Ba将细胞皮下注射到6周龄SHO小鼠的侧翼(Crlj:SHO- prkdc)gydF4y2BascidgydF4y2Ba人力资源gydF4y2Ba人力资源gydF4y2Ba日本横滨查尔斯河)。一旦平均肿瘤体积达到~100 - 300mmgydF4y2Ba3 gydF4y2Ba小鼠口服靶向药物,每日监测体重和一般情况。肿瘤每周用卡尺测量两次,其体积以宽度计算gydF4y2Ba2gydF4y2Ba×长度/ 2。本研究方案经实验动物使用伦理委员会和日本金泽大学高级科学研究中心批准(批准号:美联社- 122505)。根据该机构的指导方针,在动物被戊巴比妥钠麻醉后进行手术,并尽一切努力减少动物的痛苦。gydF4y2Ba
PDX模型gydF4y2Ba
患者肿瘤样本是在知情同意的情况下获得的。将手术切除的肿瘤标本切成小块(3-5 mm),植入SHO小鼠腹部皮下组织gydF4y2Ba19gydF4y2Ba。PDX LC#7来自一名81岁的日本男性(pT2N2M0, IIIA期),伴有肺腺癌gydF4y2Ba表皮生长因子受体gydF4y2Ba-L858R。PDX LC#11来自一名69岁的日本男性(pT2aN1M1a, IV期),患有肺腺癌,含有EGFR外显子19缺失gydF4y2Ba19gydF4y2Ba。研究方案得到了实验动物使用伦理委员会和日本金泽大学高级科学研究中心的批准。gydF4y2Ba
统计分析gydF4y2Ba
MTT试验数据和异种移植物肿瘤进展分别以均数±标准差(SD)和均数±标准误差(SE)表示。采用单因素方差分析和Spearman秩相关分析差异的统计学意义。使用Kaplan-Meier法确定无进展生存期(PFS)和95%置信区间(CIs),并使用log-rank检验进行比较。采用单变量Cox比例风险模型确定PFS临床变量的风险比(hr)。所有统计分析使用GraphPad Prism Ver. 6.0 (GraphPad Software, Inc., San Diego, CA, USA)进行,采用双面gydF4y2BaPgydF4y2Ba-value < 0.05认为有统计学意义。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
所有相关数据均包含在论文及其补充信息文件中。图4的源数据。gydF4y2Ba3我gydF4y2Ba和补充图8a、b可在gydF4y2Bahttps://chip-atlas.org/peak_browsergydF4y2Ba。本文提供了源数据。gydF4y2Ba
参考文献gydF4y2Ba
布拉默,J.等。尼武单抗与多西他赛治疗晚期鳞状细胞非小细胞肺癌。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba373gydF4y2Ba, 123-135(2015)。gydF4y2Ba
索辛斯基,m.a.等。Atezolizumab用于转移性非鳞状NSCLC的一线治疗。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba378gydF4y2Ba中文信息学报,2288-2301(2018)。gydF4y2Ba
克罗斯,d.a.等。AZD9291是一种不可逆的EGFR TKI,克服了肺癌中t790m介导的对EGFR抑制剂的耐药性。gydF4y2Ba癌症。gydF4y2Ba4gydF4y2Ba, 1046-1061(2014)。gydF4y2Ba
莫克,t.s.等。奥西替尼或铂-培美曲塞治疗EGFR t790m阳性肺癌gydF4y2Ba心血管病。j .地中海。gydF4y2Ba376gydF4y2Ba, 629-640(2017)。gydF4y2Ba
索里亚时,J.-C。et al。奥西替尼治疗未经治疗的egfr突变晚期非小细胞肺癌。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba378gydF4y2Ba, 113-125(2018)。gydF4y2Ba
Ortiz-Cuaran, S.等。对第三代EGFR抑制剂的原发性和获得性耐药的异质性机制。gydF4y2Ba中国。癌症Res。gydF4y2Ba22gydF4y2Ba, 4837-4847(2016)。gydF4y2Ba
Thress, k.s.等人。获得性EGFR C797S突变介导含有EGFR T790M的非小细胞肺癌对AZD9291的耐药。gydF4y2BaNat,地中海。gydF4y2Ba21gydF4y2Ba, 560-562(2015)。gydF4y2Ba
Ho c c。et al。奥西替尼治疗后获得性BRAF V600E突变为耐药机制。gydF4y2Baj . Thorac。肿瘤防治杂志。gydF4y2Ba12gydF4y2Ba, 567-572(2017)。gydF4y2Ba
Piotrowska, Z.等。EGFR突变型NSCLC对奥西替尼获得性耐药的研究以及奥西替尼和BLU-667联合抑制EGFR和RET对获得性RET融合的临床验证。gydF4y2Ba癌症。gydF4y2Ba8gydF4y2Ba中文信息学报,1529-1539(2018)。gydF4y2Ba
小林,s等。EGFR突变与非小细胞肺癌对吉非替尼的耐药性。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba352gydF4y2Ba, 786-792(2005)。gydF4y2Ba
沙玛,S. V.等。癌细胞亚群中染色质介导的可逆耐药状态。gydF4y2Ba细胞gydF4y2Ba141gydF4y2Ba, 69-80(2010)。gydF4y2Ba
Taniguchi, H.等。AXL赋予对奥西替尼的内在抗性,并促进耐药细胞的出现。gydF4y2BaCommun Nat。gydF4y2Bahttps://doi.org/10.1038/s41467-018-08074-0gydF4y2Ba(2019)。gydF4y2Ba
Oki, S.等。Ch IP‐Atlas:一个数据挖掘套件,完全集成了公共Ch IP‐seq数据。gydF4y2BaEMBO代表。gydF4y2Bahttps://doi.org/10.15252/embr.201846255gydF4y2Ba(2018)。gydF4y2Ba
Simpson, A., Petnga, W., Macaulay, V. M., Weyer-Czernilofsky, U.和Bogenrieder, T. .胰岛素样生长因子(IGF)通路在癌症中的靶向作用:IGF轴的作用和未来联合研究的机会。gydF4y2Ba目标。肿瘤防治杂志。gydF4y2Ba12gydF4y2Ba, 571-597(2017)。gydF4y2Ba
Fassnacht, M.等。利西替尼(osii -906)与安慰剂对局部晚期或转移性肾上腺皮质癌患者的疗效:一项双盲、随机、3期研究gydF4y2Ba柳叶刀杂志。gydF4y2Ba16gydF4y2Ba, 426-435(2015)。gydF4y2Ba
M. J.等人。发现OSI-906:一种选择性和口服有效的IGF-1受体和胰岛素受体双重抑制剂。gydF4y2Ba未来医学。化学。gydF4y2Ba1gydF4y2Ba; 1153-1171(2009)。gydF4y2Ba
Finlay, m.r.v.等。发现了一种有效的、选择性的EGFR抑制剂(AZD9291),具有致敏性和T790M耐药突变,可以避免受体的野生型形式。gydF4y2Ba医学。化学。gydF4y2Ba57gydF4y2Ba中文信息学报,8249-8267(2014)。gydF4y2Ba
雷赖特,n.b.等。厄洛替尼联合利西替尼(OSI-906)或安慰剂治疗化疗初治非小细胞肺癌并激活表皮生长因子受体突变患者的2期研究gydF4y2Ba中国。肺癌gydF4y2Bahttps://doi.org/10.1016/j.cllc.2016.07.007gydF4y2Ba(2017)。gydF4y2Ba
基塔,K.等。非小细胞肺癌患者来源的异种移植模型用于评估靶向药物敏感性和耐药性。gydF4y2Ba癌症科学。gydF4y2Ba110gydF4y2Ba, 3215-3224(2019)。gydF4y2Ba
肿瘤异质性与肿瘤细胞可塑性。gydF4y2Ba自然gydF4y2Ba501gydF4y2Ba, 328-337(2013)。gydF4y2Ba
临床肿瘤异质性:这是一个真正的问题吗?gydF4y2Ba其他。医学博士。gydF4y2Ba6gydF4y2Ba, 43-51(2013)。gydF4y2Ba
李,c.k.等。特异性表皮生长因子受体(EGFR)突变和临床特征对EGFR酪氨酸激酶抑制剂治疗与化疗对EGFR突变肺癌患者预后的影响:一项荟萃分析gydF4y2Baj .中国。肿瘤防治杂志。gydF4y2Ba33gydF4y2Ba, 1958-1965(2015)。gydF4y2Ba
并非所有的肺癌表皮生长因子受体突变都是平等的:个体化治疗策略的观点。gydF4y2Ba癌症科学。gydF4y2Ba107gydF4y2Ba, 1179-1186(2016)。gydF4y2Ba
Kohsaka等人。一种高通量功能评价肿瘤中未知EGFR基因变异的方法。gydF4y2Ba科学。Transl。地中海。gydF4y2Bahttps://doi.org/10.1126/scitranslmed.aan6566gydF4y2Ba(2017)。gydF4y2Ba
张震等。激活AXL激酶导致肺癌对egfr靶向治疗产生耐药性。gydF4y2BaNat,麝猫。gydF4y2Ba44gydF4y2Ba, 852-860(2012)。gydF4y2Ba
恩格尔曼,j.a.等。MET扩增通过激活ERBB3信号导致肺癌患者对吉非替尼耐药。gydF4y2Ba科学gydF4y2Ba316gydF4y2Ba, 1039-1043(2007)。gydF4y2Ba
Yano, S.等。肝细胞生长因子诱导肺腺癌表皮生长因子受体激活突变的吉非替尼耐药。gydF4y2Ba癌症Res。gydF4y2Ba68gydF4y2Ba中文信息学报,947 - 947(2008)。gydF4y2Ba
Sasaki, A.等。哺乳动物sprouty4通过结合Raf1抑制ras非依赖性ERK激活。gydF4y2Ba奈特,细胞生物学。gydF4y2Ba5gydF4y2Ba[j], 2003。gydF4y2Ba
Kitai, H.等。kras突变肺癌中MEK抑制诱导的受体酪氨酸激酶信号反馈激活由上皮向间质转化。gydF4y2Ba癌症。gydF4y2Ba6gydF4y2Ba, 754-769(2016)。gydF4y2Ba
Cortot, a.b.等人。通过涉及IGF1R途径的多步骤机制对不可逆EGF受体酪氨酸激酶抑制剂的抗性。gydF4y2Ba癌症Res。gydF4y2Ba73gydF4y2Ba, 834-843(2013)。gydF4y2Ba
卡罗尔,j.s.等人。雌激素受体结合的全染色体图谱揭示了需要叉头蛋白FoxA1的远程调控。gydF4y2Ba细胞gydF4y2Ba122gydF4y2Ba, 33-43(2005)。gydF4y2Ba
先驱转录因子:建立基因表达能力。gydF4y2BaDev的基因。gydF4y2Ba25gydF4y2Ba, 2227-2241(2011)。gydF4y2Ba
张杨,等。DNA修复因子FOXA1的成核将DNA去甲基化与转录先驱联系起来。gydF4y2BaNat,麝猫。gydF4y2Ba48gydF4y2Ba, 1003-1013(2016)。gydF4y2Ba
Katoh, M, Igarashi, M, Fukuda, H, Nakagama, H. & Katoh, M.癌症遗传学和人类FOX家族基因的基因组学。gydF4y2Ba癌症。gydF4y2Ba328gydF4y2Ba, 1988 - 206(2013)。gydF4y2Ba
亚当斯等人。FOXA1突变改变先锋活动、分化和前列腺癌表型。gydF4y2Ba自然gydF4y2Ba571gydF4y2Ba中文信息学报,408-412(2019)。gydF4y2Ba
Parolia, A.等。在晚期前列腺癌中激活FOXA1改变的不同结构类别。gydF4y2Ba自然gydF4y2Ba571gydF4y2Ba, 413-418(2019)。gydF4y2Ba
林,L.等。染色体14q13带上的肝细胞核因子3α基因HNF3α (FOXA1)在食管癌和肺腺癌中扩增和过表达。gydF4y2Ba癌症Res。gydF4y2Ba62gydF4y2Ba, 573 - 5279(2002)。gydF4y2Ba
Viana-Huete, V.等。IGFIR在男性棕色脂肪产热功能中的重要作用:通过不同器官特异性胰岛素敏感性调节葡萄糖稳态。gydF4y2Ba内分泌学gydF4y2Ba157gydF4y2Ba, 1495-1511(2016)。gydF4y2Ba
鲍彻等人。胰岛素和IGF-1受体在脂肪组织发育和功能中的不同作用。gydF4y2Ba糖尿病gydF4y2Ba65gydF4y2Ba, 2201-2213(2016)。gydF4y2Ba
Sequist, L. V.等。罗西替尼在egfr突变的非小细胞肺癌中的作用。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba372gydF4y2Ba, 1700-1709(2015)。gydF4y2Ba
表皮生长因子受体(EGFR)酪氨酸激酶抑制剂在肿瘤治疗中的安全性和耐受性。gydF4y2BaSaf药物。gydF4y2Ba42gydF4y2Ba, 181-198(2019)。gydF4y2Ba
陈,L.等。利用CRISPR/Cas系统进行多重基因组工程。gydF4y2Ba科学gydF4y2Bahttps://doi.org/10.1126/science.1231143gydF4y2Ba(2013)。gydF4y2Ba
Ziebarth, J. D, Bhattacharya, a .和Cui, Y. CTCFBSDB 2.0: ctcf结合位点和基因组组织的数据库。gydF4y2Ba核酸测定。gydF4y2Bahttps://doi.org/10.1093/nar/gks1165gydF4y2Ba(2012).gydF4y2Ba
Terashima, M., Tange, S., Ishimura, A. & Suzuki, T.。MEG3长链非编码RNA参与肺癌细胞系上皮-间质转化的表观遗传调控。gydF4y2Ba生物。化学。gydF4y2Ba292gydF4y2Ba, 82-99(2016)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Ryu Imamura博士(日本金泽大学)提供的技术援助和CRISPR/Cas9质粒。这项工作得到了JSPS KAKENHI资助号JP16H05308 (to S.Y.),日本医学研究与开发机构的癌症研究和治疗进化项目(P-CREATE),资助号16cmo0106513h0001 (to S.Y.),勃林格殷格翰,卫钢和MSD的研究资助,以及金泽大学癌症研究所的外部合作研究资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念与设计:T. Yamada, S.Y.方法论的发展:m.t., t.s., T. Yamano。数据获取:r.w.、喜多光、s.a.、k.f.、m.t.、山野光、H.U、r.h.、t.s.、x.h.、K.M.数据分析与解释:w.r.、山田光、t.s.、S.Y.撰写稿件:w.r.、t.s.、S.Y.行政、技术或物质支持:山田光、h.t.、a.n.、a.t.、k.k.、山下光、a.y.、k.t.、Kaira、y.t.、s.a.、i.m.、a.i.、W.W.研究监督:S.Y.gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
Y.T.获得了Chugai Pharma、AstraZeneca和Boehringer-Ingelheim的酬金。T. Yamada获得了Ono Pharma, Chugai Pharma, Pfizer Co .和Takeda Pharma的研究资助。K. Kaira获得了阿斯利康的研究资助,以及小野制药、礼来、Chugai制药、阿斯利康和勃林格殷格翰的酬金。S.A.从Chugai获得赠款和个人费用,从F. Hoffmann-La Roche获得赠款和非财务支持,从Boehringer Ingelheim获得赠款和个人费用,从AstraZeneca获得赠款和个人费用。S.Y.获得了Chugai Pharma、AstraZeneca和Boehringer-Ingelheim的研究资助和奖金。其他作者没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然通讯gydF4y2Ba感谢David Barbie和其他匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王,R.,山田,T.,基塔,K.。gydF4y2Baet al。gydF4y2Ba短暂抑制IGF-1R联合奥西替尼可根除AXL-low表达gydF4y2Ba表皮生长因子受体gydF4y2Ba突变的肺癌。gydF4y2BaNat CommungydF4y2Ba11gydF4y2Ba, 4607(2020)。https://doi.org/10.1038/s41467-020-18442-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-020-18442-4gydF4y2Ba
这篇文章被引用gydF4y2Ba
负载贝伐单抗和吉非替尼的双反应纳米颗粒用于非小细胞肺癌的分子靶向治疗gydF4y2Ba
药理学报gydF4y2Ba(2023)gydF4y2Ba
结直肠癌患者IGF-1R和Livin表达的临床病理及预后意义gydF4y2Ba
BMC癌症gydF4y2Ba(2022)gydF4y2Ba
STAT3抑制通过转录调控凋亡抑制alk重排肺癌细胞的适应性存活gydF4y2Ba
npj精密肿瘤学gydF4y2Ba(2022)gydF4y2Ba
NT157通过靶向肺癌细胞中的JNK和AXL信号通路发挥抗肿瘤活性gydF4y2Ba
科学报告gydF4y2Ba(2022)gydF4y2Ba
GSK3抑制可规避并克服alk重排非小细胞肺癌获得性氯拉替尼耐药gydF4y2Ba
npj精密肿瘤学gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba