摘要
几种COVID-19疫苗已获得紧急批准。在这里,我们在一组卫生保健工作者(HCWs) (629 naïve和26名以前感染过)中评估了单剂量AZD1222疫苗的免疫原性,为期一个月。93.4%的naïve HCWs血清转换,不论年龄和性别。在一个亚队列中进行了受体结合域(RBD)抗体的血凝试验、替代中和试验(sVNT)和体外IFNγ ELISpot试验。在naïve hcw中,67/69(97.1%)检测到ACE2阻断抗体(sVNT测定)。对野生型病毒RBD的抗体水平高于B.1.1.7的RBD,对B.1.351的抗体滴度很低。在naïve HCWs中,30.8%至61.7%的人观察到体外T细胞反应。先前感染的HCWs出现显著较高(p < 0.0001)的ACE2阻断抗体和变异B.1.1.7和B.1.351的RBD抗体。这项研究表明,接种一剂疫苗后血清转化率高,但也表明,接种一剂疫苗可能不足以预防新出现的变异。
简介
2019年12月,中国湖北省武汉市报告了第一例因感染SARS-CoV-2而感染的COVID-19病例1.然而,在一年内,不仅开发出了几种COVID-19疫苗,而且在成功完成三期试验后,它们被用于世界许多地区的大规模免疫接种运动2,3.,4.mRNA COVID-19疫苗辉瑞BioNTech于2020年12月11日获得紧急使用授权,美国于12月18日获得Moderna疫苗,而英国MHRA于2020年12月30日批准阿斯利康疫苗(参考资料)。2,4).在2021年12月和1月初启动的大规模免疫接种运动已显示出有效性,在接种这些疫苗的人群中,大幅减少了死亡、严重疾病和住院人数5,6.
虽然大多数预防COVID-19的疫苗是两剂疫苗,但一些疫苗(如强生腺病毒载体疫苗)包括单剂疫苗,报告对症状感染的有效率为66%,对严重疾病的有效率为85%7.虽然尚未在大型临床试验中评估其他经世卫组织批准的疫苗单剂接种的有效性,但在一些国家,为了向更多人接种第一剂疫苗,第二剂疫苗最多推迟了12周8.研究发现,BNT162b2(辉瑞BioNTech)疫苗和AZD1222(阿斯利康)腺病毒载体疫苗的单次剂量在注射第一剂疫苗28-34天后,可显著减少因COVID-19而住院的人数9.最近有研究表明,在感染后几周或几个月,单剂量的BNT162b2(辉瑞BioNTech)疫苗诱导的T细胞和抗体反应与自然感染SARS-CoV-2的人相当10.虽然这些数据表明,在大多数国家缺乏疫苗的大流行情况下,接种单剂两剂疫苗确实能提供大量保护,但有人批评说,这种方法会导致变异的出现,因为只接种单剂疫苗的人的免疫反应不佳8,11.研究显示,那些特别是患有血液系统恶性肿瘤的患者对单剂量的BNT162b2(辉瑞BioNTech)的免疫反应不佳,这使他们容易感染SARS-CoV-2,并有可能出现新的变异12.然而,尽管存在这些担忧,加拿大等一些国家已决定将第二次注射推迟16周13.
由于病毒刺突蛋白的突变导致了许多令人担忧的变异,这些变异要么增加了疾病传播,逃避了目前可用的诊断方法的检测,要么突变发生在中和抗体结合的主要部位,因此它们有可能影响疫苗的效力14.最初在英国发现的B.1.1.7变异已表明与更高的传播率和更高的死亡率有关14,15.虽然AZD1222和BNT162b2 (Pfizer BioNTech)对B.1.1.7的中和活性略有降低,但对疫苗效力没有显著影响16,17.然而,在B.1.351变异和P.1变异中存在的E484K突变已显示显著影响大多数疫苗产生的抗体的中和能力16,17,18.由于大多数COVID-19疫苗都进行了临床试验,当这些特定变异不占主导地位时,确定这些疫苗产生的免疫反应在中和这些令人担忧的变异方面很重要。
尽管到2021年4月1日,英国、欧洲和美国等许多发达国家已为其15%以上的人口接种了一剂COVID-19疫苗,但许多南亚和东南亚国家的疫苗接种率低于5%,而一些非洲和亚洲国家的疫苗接种率低于1%19.因此,世界上许多国家都有部分免疫人口,只接种一剂疫苗。此外,由于最近对AZD1222疫苗可能产生的副作用(如脑静脉血栓形成和血小板减少)的担忧20.在美国,一些国家的许多人似乎对获得第二剂疫苗犹豫不决。为了在实时情况下确定单剂量AZD1222/Covishield疫苗的免疫原性,我们在斯里兰卡的一大队列卫生保健工作者(HCWs)中评估了免疫原性(抗体和T细胞反应),他们在1月底/ 2月初接种了AZD1222/Covishield疫苗,我们还评估了这些疫苗对关注的变体(B.1.1.7和B.1.351)产生的免疫反应。
结果
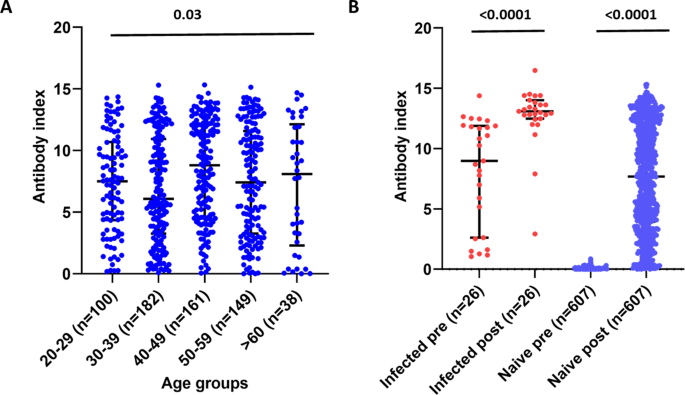
655名社工的人口特征及过去的感染情况见表1.总共有26/655人(3.9%)曾感染过SARS-CoV-2。hcw的中位年龄为41岁(范围21-81岁)。其中367例(57.9%)为女性,50例(7.9%)至少有一种共病(高血压、糖尿病或慢性肾病)。单次给药后的总血清转化率为588(93.4%)。这些人在接种第一剂疫苗后28至32天内的血清阳性情况见表1.40-49岁人群血清转换率最高,60岁人群血清转换率较低,为81.6%。血清转换率在男性(244,92.8%)和女性(343,93.4%)中相同。男性SARS-CoV-2总抗体水平(中位数7.1,IQR指数3.57-11.47)与女性(中位数7.7,IQR指数4.1-11.81)无差异。在50名有合并症(糖尿病、高血压或慢性肾病)的患者中,48人(96%)血清转化。
naïve个体和对SARS-CoV-2免疫的人的抗体滴度
抗体指数是该SARS-CoV-2总抗体测定方法中抗体水平的间接测量。30 ~ 39岁年龄组抗体滴度中位数最低(中位数6.1,IQR = 3.3 ~ 10.9),但> ~ 60岁年龄组抗体滴度中位数为8.1 (IQR = 2.3 ~ 12.13),与其他年龄组相当。不同年龄组的总抗体滴度有统计学意义(p= 0.03)。1).
2020年5月至12月期间,有26人(女性= 17人)过去感染过COVID-19,只有6/26人出现有症状的感染。其他20人过去的SARS-CoV-2感染是在使用Wantai总抗体测定法检测SARS-CoV-2特异性抗体后确定的,该测定法已显示在斯里兰卡人群中具有100%的特异性。因此,他们很可能是无症状感染。招募时既往COVID-19患者的抗体指数值中位数为8.9 (IQR 2.6-11.9),显著(p< 0.0001)在单剂疫苗接种后28 - 32天内上升到中位数13.1 (IQR12.5-14.0)(图。1 b).
刺突蛋白受体结合域的抗体,由血凝试验测定
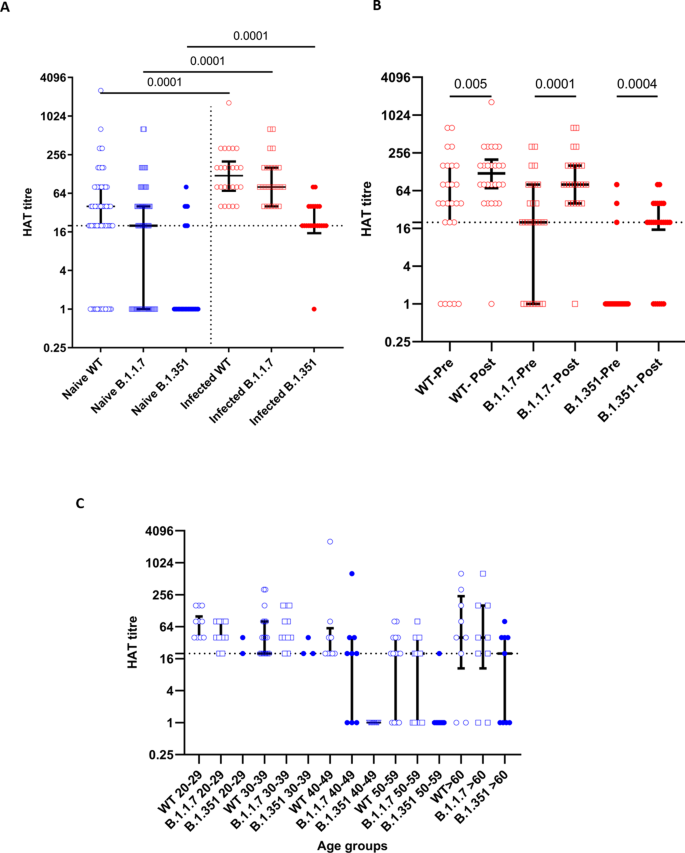
血凝试验(HAT)测量受体结合结构域(RBD)的抗体,其中病毒的RBD连接到一个纳米体IH4,专门针对红细胞(rbc)上糖蛋白a中的一个保守表位。21.我们已经证实,在感染SARS-CoV-2之前,99%的人的该检测结果为阴性。然后,我们使用该方法测量了68名SARS-CoV-2血清阴性个体和26名已感染该病毒的个体对SARS-CoV-2野生型(WT)病毒、B.1.1.7变体和B.1.351变体的RBD抗体滴度。接种单剂疫苗后28-32天,基线血清阴性的患者接种后HAT滴度的中位数为WT的1:40,B.1.1.7的1:20和B.1.351的0。2).在单剂量接种疫苗后,既往COVID-19患者的HAT滴度明显高于WT (p< 0.0001), b.1.1.7 (p< 0.0001)和B.1.351 (p< 0.0001)(图2).而SARS-CoV-2 naïve个体的(p< 0.0001)与WT相比,WT与B.1.1.7的HAT滴度无显著差异(p在SARS-CoV-2血清阳性的患者中,= 0.21)。2).基线时血清阴性或血清阳性的两组个体均显著降低(p与WT和B.1.1.7相比,HAT对B.1.351滴度< 0.0001。2).在接种单剂疫苗后,那些在基线时血清呈阳性的人,WT的HAT滴度显著增加(p= 0.005), b.1.1.7 (p< 0.0001)和B.1.351 (p= 0.0004)2 b).
在naïve个体中测量WT、B.1.1.7和B.1.351的HAT滴度(n= 68)(蓝色)和先前感染的人(n= 26)(红色)接种后28-32天(一个).在接种WT、B.1.1.7和B.1.351疫苗后,测量既往感染个体的HAT滴度(n= 26) (B).在以前naïve的不同年龄组(20-29岁= 13,30 - 39岁= 25,40 - 49岁= 8,50 - 59岁= 13,> 60岁= 9)的单次剂量后测量HAT滴度(C).黑色虚线表示HAT的正切。采用Wilcoxon配对符号秩检验比较疫苗接种前后HAT滴度的均值。所有测试都是双面的。的Mann-WhitneyU试验(双尾)用于计算感染和naïve个体的HAT滴度均值的差异。数据以中位数±四分位数范围表示。
HAT滴度为1:20被认为是存在rbd特异性抗体阳性。总之,54/68(78.2%)血清阴性的个体在单剂量疫苗接种后出现RBD抗体阳性。对B.1.1.7 RBD阳性反应45例(65.2%),对B.1.351 RBD阳性反应11例(15.9%)。在基线时,21/26(80.76%)之前已知感染过SARS-CoV-2的人具有WT病毒的RBD抗体。其中19/26(73%)的患者抗体为B.1.1.7,只有3/26(11.5%)的患者抗体为B.1.351。然而,接种一剂疫苗后,25/26(96.1%)人产生了对WT RBD的抗体,25/26(96.1%)人产生了对B.1.1.7 RBD的抗体,20/26(76.9%)人产生了对B.1.351 RBD的抗体。HAT滴度与WT的RBD之间无显著差异,B.1.1.7(图。2摄氏度).但B.1.351的滴度差异显著(p= 0.006), 60岁>人群的滴度高于部分年龄组(40-49岁年龄组)。这可能是由于某些年龄组的样本量较低。例如,在40-49岁年龄组中(n= 9),没有人对B.1.351的RBD有抗体,而在>60年龄组(n= 9), 5人有IgG抗体。
代理中和试验评估单剂量AZD1222后ace2阻断抗体
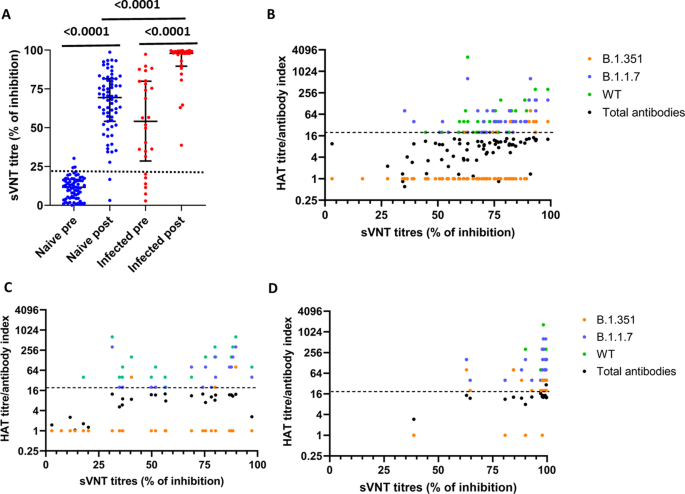
由于缺乏进行活病毒检测以检测中和抗体(NAbs)存在的设施,我们使用了替代检测方法,该方法测量了ace2阻断抗体,并已被证明与SARS-CoV-2特异性的NAbs相关(参考文献)。22).在先前naïve的个体中,接种疫苗后28-32天,sVNT滴度(ACE2结合抑制的百分比)显著增加(p< 0.0001)和先前感染的个体(p< 0.0001)(图3).然而,先前感染SARS-CoV-2的患者(中位数为97.99,IQR为89.65-99.27%)的抑制水平明显较高(p< 0.0001)比接种一剂疫苗后naïve(中位数69.42,IQR 54.09-81.54%的抑制)的人(图。3).只有2/68(2.9%)以前naïve的个体在单次接种疫苗后未能达到25%的抑制水平(被视为“阳性”)。在招募时血清呈阳性的患者中,6/26(23.1%)的人因sVNT存在ace2阻断抗体而呈阴性(抑制<25%)。所有这些人在免疫后都产生了高水平的ace2阻断抗体。
在naïve个体中测量sVNT滴度(抑制率%)(n= 68)(蓝色)和先前感染的人(n= 26)(红色)接种后28-32天(一个).sVNT滴度与WT病毒的HAT滴度相关(Spearman’s)R= 0.71,p< 0.0001), B.1.1.7 (Spearman’sR= 0.67,p< 0.0001), B.1.351 (Spearman’sR= 0.51,p< 0.0001)和sars - cov -2特异性总抗体(Spearman’sR= 0.54,p< 0.0001) (B).sVNT滴度与WT病毒的HAT滴度相关(Spearman’s)R= 0.64,p= 0.0005), B.1.1.7(斯皮尔曼的R= 0.73,p< 0.0001), B.1.351 (Spearman’sR= 0.25,p= 0.21)和sars - cov -2特异性总抗体(Spearman’sR= 0.56,p= 0.003)。C),以及接种单剂WT病毒疫苗(斯皮尔曼氏疫苗)后28-32天R= 0.47,p= 0.01), B.1.1.7 (Spearman’sR= 0.36,p= 0.06), B.1.351(斯皮尔曼的R= 0.13,p= 0.51)和sars - cov -2特异性总抗体(Spearman’sR= 0.25,p= 0.21) (D).黑色虚线表示ace2阻断抗体阳性临界值一个和帽子在B- - - - - -D.采用Wilcoxon配对符号秩检验(matching -pairs sign -rank test)比较接种前后ace阻断抗体的均数(抑制率%)。采用Spearman秩序相关系数评价HAT滴度与ace阻断抗体的相关性。所有测试都是双面的。数据以中位数±四分位数范围表示。
sVNT滴度(ace2阻断抗体)与WT病毒(Spearman’s)的HAT滴度显著相关R= 0.71,p< 0.0001), B.1.1.7 (Spearman’sR= 0.67,p< 0.0001)和B.1.351 (Spearman 'sR= 0.50,p< 0.0001)和sars - cov -2特异性总抗体(Spearman’sR= 0.53,p< 0.0001),这表明在这些个体中,接种疫苗后ace2阻断抗体和RBD抗体类似地增加(图。3 b).在招募之前感染过的患者时,sVNT滴度与WT病毒的HAT滴度显著相关(Spearman’sR= 0.63,p= 0.005),以及sars - cov -2特异性总抗体(Spearman’sR= 0.56,p= 0.003), B.1.1.7(斯皮尔曼的R= 0.73,p< 0.0001),但B.1.351 (Spearman’sR= 0.25,p= 20)(图3 c).在这些个体中,sVNT滴度与WT病毒的HAT滴度显著相关(Spearman’s)R= 0.47,p= 0.01),但接种B.1.1.7或B.1.351或接种后总抗体无效(图。3 d).
在68名naïve个体中,有2名个体在接种疫苗后没有产生ace2阻断抗体或RBD抗体,而在那些通过HAT似乎没有检测到RBD抗体的人中,有13人具有ace2阻断抗体。然而,ace阻断抗体滴度显著降低(pHAT抗体检测阴性(中位数45,IQR 34.3-56.8%的抑制),而HAT抗体检测阳性(中位数74.7,IQR 63.2-83.3%的抑制)。
在先前感染的个体中,单剂量疫苗接种后,中位HAT滴度从中位40 (IQR 20-160)增加到中位120 (IQR 70-200)。有趣的是,先前感染的个体中ace2阻断抗体的增加更多,从54.1%增加到97.9%,这表明RBD抗体的增加很可能转移到先前感染的ace2阻断抗体。
体外T细胞对穗蛋白重叠肽的反应
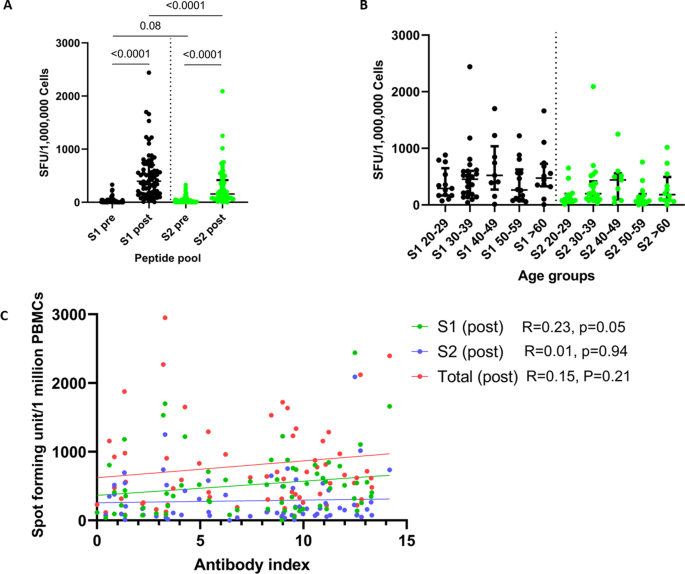
我们研究了76个个体的体外IFNγ ELISpot对代表刺突蛋白S1(肽1至130)和S2(肽131至253)的两个重叠池的反应。在这72人中,有4人之前感染过SARS-CoV-2。在SARS-CoV-2 naïve个体中,只有2/68对疫苗接种前S1肽库有体外T细胞反应,这可能是由于与其他季节性冠状病毒的交叉反应。naïve个体中没有人对接种前的S2肽池有任何反应。体外IFNγ ELISpot对S1和S2的反应显著增加(p< 0.0001)(图4).对代表刺突蛋白早期(肽1 - 130)区域的S1肽池的反应(中位数397.5,IQR 165.0-702.5点形成单位(SFU)/ 100万个外周血单个核细胞(pmcs))与重叠肽池的S2(肽131-256)(中位数155,IQR 75-417.5, SFU/ 100万个pmcs)相比。两者均无显著差异。p= 0.57)或S2 (p= 0.06)。4 b).体外elisa反应为背景反应的平均值±2 SD被认为是阳性反应。总的来说,42/68(61.7%)的个体对S1肽池有反应,21/68(30.8%)的个体对S2肽池有阳性反应。
在基线(接种疫苗前)和接种疫苗后28-32天,总共naïve个体(n= 72) (一个),以及在naïve个人的不同年龄分组中(n= 68) (B).体外IFNγ ELISpot对两个刺突蛋白库(S1和S2)的反应和对刺突蛋白重叠肽的总反应的关联与总抗体反应无关(n= 68) (C).采用Wilcoxon配对符号秩检验比较疫苗接种前后S1和S2肽库的体外ELISpot应答均值。采用Kruskal-Wallis检验比较不同年龄组的S1和S2 ELISpot反应。采用Spearman秩序相关系数评价离体elisa反应与sars - cov -2特异性抗体(抗体指数)的相关性。所有测试都是双面的。数据以中位数±四分位数范围表示。
体外IFNγ ELISpot对S1、S2或总S蛋白的反应与SARS-CoV-2特异性总抗体滴度无关(图2)。4摄氏度).体外ELISpot反应也与WT的HAT滴度(Spearman’s)无关R=−0.08,p= 0.48)或sVNT试验给出的抑制(ACE-Abs)百分比(Spearman’sR= 0.02,p= 0.86)。在对S1有反应的患者中,HAT滴度无显著差异(p= 0.34)和S2池(p= 0.86),与对这些肽无反应的患者相比。在对S1有反应的患者中,ace2阻断抗体(抑制率%)也没有显著差异(p= 0.66)和S2池(p= 0.42)的多肽,与无反应者相比。对疫苗没有抗体反应的两个人中的一人也没有产生任何T细胞反应,而另一人有可检测到的T细胞反应。
在之前感染过SARS-CoV-2的4名个体中,有3人在接种前对S1(中位数47.5,IQR 33.75-428.5 SFU/ 100万PBMCs)和S2(中位数152.5,IQR 108.8-192.5 SFU/ 100万PBMCs)的体外IFNγ ELISpot反应频率非常低。第四名患者后来被发现最近有感染(该患者在免疫接种前14天有一天出现轻度发烧)。免疫接种后,既往COVID-19患者的体外T细胞反应频率增加了几倍。
讨论
在本研究中,我们在先前naïve和感染的HCWs中研究了免疫后28-32天单剂量AZD1222疫苗的抗体和体外T细胞反应。我们的结果显示,93.4%以前naïve个人血清转化为单剂疫苗,无论年龄和性别。研究发现,在年龄<60岁和>年龄60岁的人群中,单剂量疫苗可诱导相似量级的抗体和T细胞反应,尽管>年龄60岁人群的血清转换率低于年轻人。在naïve个体中,单次剂量似乎比自然感染诱导更高比例的ace2阻断抗体。我们之前在斯里兰卡自然感染COVID-19患者中的数据显示,尽管所有中重度疾病患者都有ACE2-Abs,但通过sVNT检测评估,23/68(33.3%)轻度疾病患者的反应没有超过阳性临界值(>25%的抑制)。23.相比之下,只有2/68(2.9%)的先前naïve个体在接种单剂疫苗后未出现NAb阳性。在自然感染和免疫后,HAT试验也得到了类似的结果。例如,在无症状/轻度疾病患者中,只有33/66(50%)在4周结束时对WT病毒的HAT抗体反应呈阳性(正在审查中),而在单剂量疫苗接种后,78.2%的患者对RBD抗体的HAT抗体反应呈阳性。因此,单剂量的AZD1222疫苗似乎可以诱导针对病毒RBD的强大SARS-CoV-2抗体反应,这被认为与保护有关。
研究显示,最近从自然感染COVID-19中恢复的患者对许多病毒蛋白具有强大的CD4+和CD8+ T细胞反应,在经历过严重疾病的患者中,这种反应的幅度和广度更高24.研究发现,18%到32%的人能识别刺突蛋白的不同区域24.在恢复期轻度疾病患者或暴露家庭成员中,T细胞反应频率在67 - 87%之间25.我们发现,63.9%的个体在接种单剂量疫苗后,对S1重叠肽库显示出IFNγ体外T细胞反应,这与自然感染后所见的情况相当。与单剂量BNT162b2(辉瑞BioNTech)疫苗(中位数58,SFU/ 100万PBMCs)相比,在我们的队列中,单剂量AZD1222后观察到的离体ELISpot反应略高(S1组中位数397.5,S2组中位数155,SFU/ 100万PBMCs)。10.然而,这是两项不同的研究,因此,这些差异可能是由于实验室之间的化验差异,而不是两种疫苗诱导的T细胞反应的差异。
尽管世界卫生组织和许多其他政策制定者建议,以前感染过SARS-CoV-2的人应该接种疫苗26在美国,很多这样的人一直在犹豫。然而,在先前接触过AZD1222疫苗的个体中,单剂量的AZD1222疫苗不仅显著增加了他们的ace2阻断抗体,而且还显著增加了B.1.1.7和B.1.351等变体的RBD抗体。在这些个体中,sVNT测量的ace2阻断滴度从抑制的中位数54.1增加到97.9%。由于单次接种会导致ace2阻断滴度的大幅增加,而且先前感染的个体对变异的抗体反应也会增加,因此,重要的是要考虑单次接种疫苗是否能在此类个体中提供足够的免疫力。在P1或B.1.351变体导致严重疾病的环境中,甚至在先前感染了原始SARS-CoV-2的个体中,我们的结果表明,基于原始序列的单剂量疫苗仍可能诱导与变体交叉反应的抗体显著增加,这可能足以改善疾病。然而,在naïve个体中,B.1.1.7的HAT滴度显著降低,这可能是由于B.1.1.7中单个501Y突变导致的减少中和。与B.1.1.7变种相比,只有通过评估在拥有WT(武汉病毒株)的国家中减少无症状和有症状的疫苗效力,才能评估这在现实情况中的意义。然而,鉴于B.1.1.7似乎是大多数国家的主要变体,在目前的情况下很难评估这一点。
2个(2/68)naïve个体对疫苗没有任何反应(RBD抗体和ace2阻断抗体),而其中一个个体有T细胞反应。然而,在整个队列的个体中,7.1%(43/607)的人在Wantai总抗体ELISA中没有检测到抗体,而21.8%的人在HAT中是阴性的。除了>岁60岁人群血清转换率较低(7/43未血清转换率)外,共病不影响血清转换率。在未来的前瞻性研究中,发现这些对疫苗有不良血清学反应的人是否更容易感染将是很重要的。
总之,在以前naïve的个体中,单剂量的AZD1222疫苗诱导了高水平的RBD抗体和ace2阻断抗体,这大于那些经历轻度或无症状自然感染的人的免疫反应。T细胞的反应与自然感染后的反应相当。在先前感染过COVID-19的患者中,单次剂量诱导产生非常高水平的ace2阻断抗体和SARS-CoV-2变异rbd抗体。
方法
在知情书面同意后,655名HCWs被纳入研究,他们在2021年1月29日至2月5日期间接种了第一剂AZD1222/Covisheild疫苗。记录年龄、性别、共病等人口统计学细节。在招募时通过自我管理问卷确定糖尿病、高血压、心血管疾病和慢性肾脏疾病等共病的存在。从所有个体获取血液样本以确定基线时的SARS-CoV-2血清状态,而仅对随机选择的72人进行了T细胞研究。在第一次注射后的28至32天内获得了第二份血液样本,以评估sars - cov -2特异性抗体和T细胞反应。获得了Sri Jayewardenepura大学伦理审查委员会的伦理批准。这项研究中没有人报告在这一个月内感染了COVID-19。
SARS-CoV-2总抗体检测
采用万泰SARS-CoV-2抗体ELISA法(北京万泰生物制药有限公司)检测SARS-CoV-2特异性总抗体(IgM、IgG和IgA)反应。根据制造商的说明计算每种ELISA的临界值。在截止值的基础上,根据制造商的说明,用每个样品的吸光度除以截止值来计算抗体指数。该方法的灵敏度为98%27并且在2018年获得的斯里兰卡个体血清样本中发现100%的特异性。
HAT检测RBD抗体
HAT是按照前面描述的那样进行的21.IH4-RBD试剂的B.1.1.7 (N501Y)和B.1.351 (N501Y, E484K, K417N)版本如所述生产21,但包括位点定向突变引入的相关氨基酸变化。这些变体在对照HAT中用单克隆抗体EY-6A滴定(到保守的4类表位)21,28),且滴定量与原液相同,因此用100 ng (2 μg/ml原液中50 μl)制备HAT。简单地说,来自o -阴性供体的红细胞与IH4-RBD(一种针对红细胞上保守的糖蛋白a表位的纳米体,与SARS-CoV-2的RBD相关)混合,并与血清一起培养1小时。以磷酸盐缓冲盐水作为阴性对照。培养结束后,将培养皿倾斜20 s,然后拍照。两名独立的读者阅读了盘子的照片,以检查表明结果为阴性的“泪滴”结构。完全没有“泪滴”的阵型被认为是积极的,任何“泪滴”的流动都被认为是消极的。用11倍稀释的血清从1:20到1:20480进行HAT滴定,以确定rbd特异性抗体的存在。血清样本的rbd特异性抗体滴度由观察到完全没有“泪滴”形成的最后一个孔来定义。在69名基线时血清呈阴性的个体(69/72名T细胞检测为血清阴性的个体)和26名之前感染过SARS-CoV-2的个体中,还评估了B.1.1.7变体和B.1.351变体RBD的RBD特异性抗体滴度。
使用替代试验测量SARS-CoV-2中和抗体的存在
由于缺乏BSL-3设施来评估中和抗体的存在,我们采用了最近开发的替代病毒中和试验(sVNT)。22,该方法测量了S蛋白RBD结合重组ACE2的抑制百分比(Genscript Biotech, USA)。抑制率≥25%的样本被认为是ace2阻断抗体阳性。该方法被发现是100%特异性的,用于测量斯里兰卡人群中的ace2阻断抗体23.这些检测对69名血清阴性的个体(其中69/72名血清阴性的个体进行了T细胞检测)和26名被发现过去感染过SARS-CoV-2的个体进行了检测。
体外elisa法
体外IFNγ ELISpot检测使用72个个体在招募时和28-32天后新分离的PBMC进行29.我们从研究参与者中随机招募了T细胞检测的个体,除了抗体检测(5ml)外,我们还包括了那些同意提供额外T细胞检测血容量(7ml)的人。在最终浓度为10µM的情况下,将覆盖整个刺突蛋白(253个重叠肽)的重叠肽池分别命名为S1(肽1-130)和S2(肽131-253),并按照前面描述的那样孵育一夜24,30..所有肽序列均来自野生型共识,并进行了重复测试。细胞因子刺激的阳性对照是PHA,阴性对照是pbmc单独使用培养基。简单地说,ELISpot板(Millipore Corp., Bedford, USA)被抗人IFNγ抗体包裹过夜(Mabtech,瑞典)。在37°C和5% CO下孵育过夜2.这些细胞被移除,然后用第二个生物素化的人类IFNγ抗体培养板,并进一步洗涤6次。用链霉亲和素碱性磷酸酶(Mabtech AB)和比色底物显影,用自动ELISpot阅读器(AID Germany)枚举斑点。减去背景(单独的pbmc和介质),数据以每10个SFU的数量表示6PBMCs。阳性反应定义为背景反应的平均值±2SD。
统计分析
使用GraphPad Prism版本6进行统计分析。由于数据不是正态分布,因此使用Mann-Whitney比较平均值的差异U检验(双尾),配对数据比较时采用Wilcoxon配对符号秩检验。采用Kruskal-Wallis试验比较不同年龄组抗体水平和体外elisa反应的差异。采用Spearman秩序相关系数评价sars - cov -2特异性T细胞反应、年龄和抗体反应等变量之间的相关性。
统计和再现性
所有的体外elisa检测都是一式两份进行,相关的阳性和阴性对照以确保重复性。所有抗体测定(Wantai总抗体测定、ACE2抗体阻断测定/sVNT和HAT)均使用2017年和2018年收集的血液样本进行验证(n= 110),以确定特异性和敏感性,并在从急性COVID-19患者采集的系列血液样本中确定23.对于HAT,由两个独立的阅读器读取板的照片,以检查指示阴性结果的“泪滴”结构,以确保可重复性。在这项研究中,所有相关的阳性和阴性对照都包括在每个试验中。
研究批准
获得Sri Jayewardenepura大学伦理审查委员会的伦理批准(COVID 01/21)。这项研究还得到了斯里兰卡卫生部教育、培训和研究单位的批准。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
数据可用性
所有的数据都可以在手稿、图表和表格中找到。所有图中都显示了单个数据点。源数据提供了这篇论文。
参考文献
吴栋,吴涛,刘强,杨哲,我们所知道的SARS-CoV-2爆发。Int。j .感染。说。94, 44-48(2020)。
奥利弗,S. E.等。免疫实践咨询委员会关于使用辉瑞- biontech COVID-19疫苗的临时建议-美国,2020年12月。MMWR Morb。凡人。工作代表。69, 1922-1924(2020)。
新冠疫苗成为第二个获得美国批准的疫苗。自然https://doi.org/10.1038/d41586-020-03593-7(2020)。
药品和保健产品监管局疫苗和疫苗安全,2020年)。
Dagan, N.等人。BNT162b2 mRNA Covid-19疫苗在全国大规模疫苗接种环境中。心血管病。j .地中海。https://doi.org/10.1056/NEJMoa2101765(2021)。
2019冠状病毒病:苏格兰的第一批疫苗导致住院人数大幅下降。BMJ372,https://doi.org/10.1136/bmj.n523(2021)。
Ledford, H.强生的单剂COVID疫苗带来了更快推出的希望。自然https://doi.org/10.1038/d41586-021-00526-w(2021)。
Pimenta, D, Yates, C, Pagel, C. & Gurdasani, D.推迟第二剂Covid-19疫苗。BMJ372,https://doi.org/10.1136/bmj.n710(2021)。
瓦西里乌,E.等人。苏格兰首剂大规模COVID-19疫苗接种和COVID-19住院治疗的中期发现:一项全国性前瞻性队列研究《柳叶刀》397, 1646 - 1657,https://doi.org/10.1016/s0140 - 6736 (21) 00677 - 2(2021)。
安加尔,A.等人。既往sars - cov -2感染和未感染的英国医护人员对首剂BNT162b2疫苗的t细胞和抗体反应:一项多中心、前瞻性、观察性队列研究SSRNhttps://doi.org/10.2139/ssrn.3812375(2021)。
Kadire, S. R., Wachter, R. M.和Lurie, N.延迟第二次剂量与Covid-19疫苗接种标准方案相比。心血管病。j .地中海。384, e28(2021)。
莫宁,莱蒂西亚等人。一剂和两剂COVID-19疫苗BNT162b2对癌症患者的安全性和免疫原性:一项前瞻性观察性研究的中期分析柳叶刀肿瘤学22, 765 - 778,https://doi.org/10.1016/s1470 - 2045 (21) 00213 - 8.(2021)。
Tauh, T.等。BC省COVID-19疫苗剂量间隔16周的最新情况。BC医学J。63, 102-103(2021)。
美国疾病控制中心科学简报:新出现的SARS-CoV-2变种https://www.cdc.gov/coronavirus/2019-ncov/science/science-briefs/scientific-brief-emerging-variants.html(2021)。
Challen, R.等人。感染SARS-CoV-2关注变种患者的死亡风险202012/1:匹配队列研究BMJ372,https://doi.org/10.1136/bmj.n579(2021)。
沃西等人。针对SARS-CoV-2的ChAdOx1 nCoV-19疫苗(AZD1222)的安全性和有效性:对巴西、南非和英国四项随机对照试验的中期分析《柳叶刀》397, 99-111(2021)。
Planas, D.等人。传染性SARS-CoV-2 B.1.1.7和B.1.351变异对中和抗体的敏感性。Nat,地中海。https://doi.org/10.1038/s41591-021-01318-5(2021)。
Garcia-Beltran, W. F.等人。covid -19中和抗体可以预测疾病严重程度和生存期。细胞184, 476-488 e411(2021)。
汉娜·里奇,e.o.o。et al。COVID-19疫苗接种,https://ourworldindata.org/covid-vaccinations(2021)。
欧洲药品管理局发现,Covid-19:阿斯利康疫苗与血栓风险增加无关。BMJ372,https://doi.org/10.1136/bmj.n774(2021)。
Townsend, A.等人。快速检测SARS-CoV-2抗体的血凝试验。Commun Nat。https://doi.org/10.1101/2020.10.02.20205831(2020)。
谭,C. W.等。基于抗体介导的ACE2-spike蛋白-蛋白相互作用阻断的SARS-CoV-2代理病毒中和试验生物科技Nat。》。38, 1073-1078(2020)。
Jeewandara, C.等。不同严重程度急性COVID-19患者的SARS-CoV-2中和抗体。科学。代表。11, 2062(2021)。
彭,Y.等。COVID-19后英国恢复期SARS-CoV-2诱导的广泛和强记忆CD4(+)和CD8(+) T细胞Immunol Nat。21, 1336-1345(2020)。
Sekine, T.等。无症状或轻度COVID-19恢复期患者的强大T细胞免疫。细胞183, 158 - 168。e114(2020)。
组织,W. H。临时指导(世卫组织总部),2021年)。
Weidner, L.等人。用8种市售免疫测定法定量SARS-CoV-2抗体。j .中国。性研究。129, 104540(2020)。
Zhou, P.等。与一种可能来自蝙蝠的新型冠状病毒有关的肺炎爆发。自然579, 270-273(2020)。
Jeewandara, C.等。住院或轻度或亚临床登革热感染患者登革病毒特异性记忆T细胞反应的功能公共科学图书馆Negl。太。说。9, e0003673(2015)。
Malavige, G. N.等。斯里兰卡原发性水痘带状疱疹病毒感染的病毒载量、临床疾病严重程度和细胞免疫反应《公共科学图书馆•综合》3., e3789(2008)。
确认
我们感谢世界卫生组织、英国医学研究理事会和外交和联邦事务部的支持。T.K.T.由Townsend-Jeantet慈善信托基金(慈善编号1011770)和EPA头孢菌素早期职业研究基金资助。该项目由中国医学科学院(CAMS)医学科学创新基金(CIFMS)资助。2018 - i2m 2 - 002)。
作者信息
作者及隶属关系
贡献
c.j., A.T.和g.n.m.:概念化。c.j., a.k., p.d.p., D.J.和l.s.:方法论。a.k., p.d.p., D.J.和g.n.m.:形式分析。P.D.P. a.k.不论是,南达科他州I.S.A。d . Madushanka酸处理,T.T.J, A.W。纽约t和齿数:调查。南达科他州I.S.A,西奥多。罗斯福,地勤人员,香港,蒋振声,d . Milroy和n。:数据管理。c.j., d.g., r.w., S.S.和G.N.M:项目管理。G.S.O C.J G.N.M。,“,杰和T.K.T:融资收购。G.N.M.和G.S.O:写初稿。G.N.M, G.S.O, a.t., T.K.T.和t.d.:写作评论和编辑。L.S.和t.k.t.:验证。
相应的作者
道德声明
相互竞争的利益
G.N.M.是美国国家药物监管局COVID-19疫苗专家咨询小组的成员。在斯里兰卡担任首席流行病学家,并参与确定疫苗优先清单。
额外的信息
同行评审信息自然通讯感谢匿名审稿人对本工作的同行评议所作的贡献。同行评审报告是可用的。
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
源数据
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Jeewandara, C., Kamaladasa, A., Pushpakumara, P.D.et al。卫生保健工作者对单剂量AZD1222/Covishield疫苗的免疫反应。Nat Commun12, 4617(2021)。https://doi.org/10.1038/s41467-021-24579-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-021-24579-7
这篇文章被引用
AZD-1222、Sputnik V、国药集团、Covaxin疫苗抗rbd中和抗体的分析比较及其与医护人员性别的关系
免疫与衰老(2022)
接种前工作场所的RT-PCR阴性接触者显示高水平的SARS COV-2中和抗体
BMC公共卫生(2022)
包含omicron的SARS-CoV-2刺突蛋白表位突变诱导的变化和当前抗体的有效性评估
分子生物医学(2022)
第一剂Sputnik V (Gam-COVID-Vac)后的免疫反应
科学报告(2022)
一种用于预测SARS-CoV-2变异免疫的快速抗体筛查血凝试验
通信医学(2022)