摘要
CD11c+T-bet+B细胞被认为是体液免疫和自身免疫的重要组成部分。这些细胞可以与其他B细胞区分,因为它们的腺苷受体2a的表达更高。这里我们讨论A2受体激活可以影响CD11c+T-bet+B细胞。我们展示了A的管理2受体激动剂CGS-21680消耗已建立的CD11c+T-bet+卵泡病毒感染小鼠中的B细胞,以B细胞固有的方式。激动剂治疗同样会消耗CD11c+T-bet+B细胞和CD138+B细胞和减少狼疮易感小鼠的抗核抗体。激动剂治疗也与肾脏病理和淋巴结病变减少有关。此外,2受体刺激消耗致病淋巴细胞,甚至在疾病发作后改善疾病,突出了这种治疗的治疗潜力。本研究提示,靶向腺苷信号通路可能为治疗狼疮等由T-bet介导的自身免疫性疾病提供一种方法+B细胞。
介绍
CD11c+T-bet+B细胞,也被称为年龄相关B细胞(abc),是参与保护性和致病性免疫反应的B细胞的一个子集。CD11c+T-bet+B细胞在以I型免疫为特征的感染中发育,如疟疾、艾滋病毒、流感和丙型肝炎1,2,3.,4。CD11c+T-bet+在这些感染中产生的B细胞由toll样受体(TLR)信号和T-bet产生的CD40L、IFN-γ和IL-21驱动+CD4+T细胞3.,5,6,7,8。CD11c+T-bet+B细胞可以作为记忆细胞,具有自我更新的能力,并在继发性挑战后分化9。此外,CD11c的消除+B细胞埃立克体属缪里斯感染消除了转换抗体的召回反应10。CD11c+T-bet+B细胞参与了许多其他疾病的免疫反应。在疟疾感染期间,CD11c+T-bet+B细胞产生病原体特异性抗体,并与寄生虫密度降低有关11,12,13。CD11c+T-bet+在流感感染期间产生的B细胞占抗原特异性B细胞的20-30%3.。在HIV感染中,CD11c+T-bet+B细胞群比经典记忆B细胞含有更多的hiv特异性B细胞2。除了它们在感染过程中的功能外,CD11c+T-bet+B细胞还参与类风湿关节炎(RA)、干燥综合征和系统性红斑狼疮(SLE)等疾病的致病性免疫反应。14,15,16,17。
T-bet+B细胞是SLE疾病病因学的关键介质,SLE是一种复发性自身免疫性疾病,影响全球约500万人。SLE通常表现为面部皮疹、疲劳、关节疼痛和疾病发作,在某些情况下会出现终末期肾脏疾病和器官衰竭18。CD11c+T-bet+由于B细胞与自身抗体滴度和疾病严重程度相关,因此B细胞参与SLE的发病机制16,19,20.,21,22,23。CD11c+T-bet+B细胞对TLR7刺激有反应,并表现出负性促炎调节因子NFKBIA、TNFAIP3、TRAF5和TRAF4的表达减少,这可能有助于SLE期间它们的产生16。我们也知道CD11c+T-bet+人类和小鼠的B细胞可以产生抗体分泌细胞(ASCs),并且已经提出sle衍生的CD11c+T-bet+B细胞准备分化为浆母细胞(PBs)16。考虑到它们产生ASCs的倾向,CD11c+T-bet+B细胞可能通过分化为ASCs和产生自身反应性抗体而参与SLE疾病的发病机制24,25,26,27。CD11c+T-bet+B细胞也可能通过激活CD4参与SLE发病+T细胞,因为这些B细胞也可以作为有效的抗原呈递细胞28。CD4+T滤泡辅助细胞跳频反过来,可以驱动自身反应性生发中心(GC) B细胞和ASCs的形成,从而产生自身抗体和免疫复合物,最终导致全身炎症和肾小球肾炎29,30.,31。先前的工作已经明确地确定了T-bet+B细胞可以促进SLE的发病机制,因为消除B细胞中T-bet的表达可以大大减轻狼疮易感小鼠的疾病负担26。另一项研究同样证明了CD11c的消耗+B细胞降低了TLR7激动剂免疫小鼠的抗smith抗体25。这些研究强调了CD11c的重要性+T-bet+B细胞在SLE发病机制中的作用,并提示这些细胞的靶向消耗将降低自身免疫性疾病的疾病严重程度,其中这些细胞已被牵连;然而,目前还没有这样的药物治疗方法。
作为CD11c研究的一部分+T-bet+诱导的B细胞e·缪里斯Winslow等人发现了一些相对于cd11c阴性B细胞高表达的基因。其中包括编码g蛋白偶联受体A的基因2受体,图其CD11c水平高出10倍+T-bet+B细胞,与cd11c阴性B细胞相比32。的一个2受体是细胞外腺苷的几种受体之一,在大多数白细胞、神经元和内皮细胞上表达33,34,35。细胞外腺苷可以通过ATP和NAD的分解代谢产生+通过CD73、CD39和CD38等外切酶,它们都在CD11c上高表达+T-bet+B细胞10,36。腺苷信号通过A2受体可通过增加调节性T细胞(T注册)产生,抑制效应T细胞(Teff)及T跳频并阻断GC B细胞的形成37,38,39,40。鉴于其免疫调节能力,A2受体被广泛研究可能的抗肿瘤作用,因为已知一些肿瘤会产生大量的细胞外腺苷41,42,43。这些肿瘤产生的腺苷被认为通过诱导T细胞间的能量来损害抗肿瘤反应eff细胞,并通过增加T的产生注册免疫抑制因子TGFβ和IL-10的产生44。一致地,2受体缺陷小鼠与A2受体胜任对照,尽管这些小鼠容易产生自身免疫35。一个2受体缺乏还会加重小鼠重度实验性自身免疫性脑炎,这是巨噬细胞和淋巴细胞活化增加以及IFN-γ分泌增加的结果45。
的一个2受体与其他自身免疫性疾病如类风湿关节炎有关40,46,47,48。来自RA患者的淋巴细胞已被证明表达高水平的A2体外刺激该受体可抑制这些淋巴细胞产生TNF、IL-1β和IL-647,48。一个2受体激动作用已被证明损害自身抗体的产生并降低疾病的严重程度40。在易患狼疮的小鼠中,用A2受体激动剂CGS-21680可显著改善肾功能,但其机制尚不清楚49。其他研究表明,A2受体与SLE患者疾病严重程度相关,体外刺激该受体可减少淋巴细胞产生促炎细胞因子50。这些研究强调了A的重要性2自身免疫过程中的受体信号,并提示该受体的药物靶向可能有助于治疗多种疾病。
在本研究中,我们探讨了腺苷信号对T-bet的影响+B细胞。我们证明了A2受体激动剂CGS-21680,可消耗CD11c+T-bet+两者都有B细胞e·缪里斯-感染和狼疮易感小鼠此外,2受体激动剂治疗MRL/lpr小鼠显著降低疾病的严重程度,相比于载体治疗的对照组,无论是早给药还是晚给药。因此,我们的工作描述了一种消除致病性CD11c的靶向药理学方法+T-bet+B细胞,并强调A的治疗潜力2受体激动剂治疗SLE,也可能治疗其他自身免疫性疾病。
结果
一个2受体刺激减少了CD11c+T-bet+B细胞
先前已经证明编码A2受体的表达量至少高出10倍e·缪里斯-引起CD11c+T-bet嗨B细胞,相对于cd11c阴性B细胞32。而一个2受体信号被认为是免疫调节的,它对CD11c的维持有影响+T-bet嗨记忆B细胞没有被定位。因此,我们将e·缪里斯从感染后30-37天开始,每天1次用CGS-21680感染小鼠+T-bet嗨B细胞群发育完全10。CD11c+B细胞和t细胞嗨B细胞是可互换的,因为已经证明这些细胞在同一时间点代表相同的群体e·缪里斯感染5。CGS-21680治疗几乎消除了所有的CD11c+T-bet嗨B细胞e·缪里斯给药后7天内感染的小鼠(图2)。1及补充图1).在cgs -21680处理的小鼠中,细菌负荷没有变化,可能是因为感染小鼠的多种免疫机制(如IgM)具有保护作用。1 b).这种B细胞损耗早在24小时就发生了,单次给药CGS-21680足以消耗CD11c+T-bet嗨B细胞(图2)1 b).而一个2受体刺激减少了CD11c+T-bet嗨B细胞,cd11c阴性T-bet罗B细胞、ASCs和总B细胞在很大程度上不受影响,这表明这些细胞不表达或表达较少A2受体,可能表明a2受体表达和T-bet表达(补充图)1 c, D).来确认A2受体激动作用可消耗CD11c+T-bet嗨我们处理过B细胞e·缪里斯-感染了A的老鼠2受体激动剂,Regadenoson,感染后30-37天每隔一天服用一次。再腺苷子治疗导致CD11c降低+T-bet嗨B细胞e·缪里斯-这表明其他A2受体激动剂也能消耗CD11c+T-bet嗨B细胞,虽然可能小于CGS-21680(补充图)。1 e).接下来我们讨论了A的影响2CD11c受体拮抗剂+T-bet嗨B细胞e·缪里斯被A感染的老鼠2从感染后30-37天开始,每隔一天使用受体拮抗剂伊斯特defylline。与激动剂治疗相比,对CD11c的数量没有影响+T-bet嗨用依stradefylline处理后的B细胞(补充图)。1 f).这些数据表明A2受体激动剂可以有效地消耗CD11c+T-bet嗨B细胞。
一个e·缪里斯-感染的雌性C57BL6/J小鼠用DMSO(载药)处理;n= 7)或CGS-21680(激动剂;n= 6)感染后第30天开始,每天7天;感染后第37天用流式细胞术检测脾细胞。等高线图(左)和曲线图(右)显示了CD11c的百分比和数量+CD19+细胞(比例:p< 0.0012;数量:p< 0.0001)和T-bet嗨CD19+细胞(比例:p< 0.0001;数量:p= 0.0007)。图表表示两个实验的汇总数据。采用双尾法测定统计学显著性未配对t-检验,除了左上角使用双尾曼-惠特尼检验的图表。p值在图中表示。be·缪里斯-感染的雌性野生型小鼠用n感染后第30天(各5只),24 h后进行脾细胞分析。等高线图和图形显示了CD11c的百分比和数量+CD19+细胞。采用双尾法测定统计学显著性未配对t测试(比例:p= 0.0002;数量:p< 0.0001)。ce·缪里斯T-bet-cre来华的ERT2x Rosa26eYFP感染后第15-25天给小鼠喂食他莫昔芬,然后给药(n= 3,6)或激动剂(n= 4, 5)每隔一天,连续7天,从感染后第30天开始;感染后第37天对组织进行分析。等高线图和图形显示了eYFP的百分比和数量+B220+细胞。采用普通双因素方差分析和Sidak多重比较检验(df = 28)确定统计学显著性。de·缪里斯-受感染的图液氧/液氧小鼠和Mb1cre / +x图液氧/液氧小鼠分别用载虫剂(对照组:n= 7;Mb1cre / +x图液氧/液氧:n= 6)或激动剂(控制流量:n= 9;Mb1cre / +x图液氧/液氧:n= 7)感染后第30天开始,每隔一天进行一次,共7天;感染后第37天分析脾细胞。等高线图和图形显示了CD11c的百分比和数量+CD19+细胞。图表表示三个实验的汇总数据。采用普通双因素方差分析和Sidak多重比较检验(df = 25)确定统计学显著性(ns =不显著)。ee·缪里斯-受感染的图液氧/液氧小鼠和CD4cre / +x图液氧/液氧小鼠分别用载虫剂(对照组:n= 6;CD4cre / +x图液氧/液氧:n= 6)或激动剂(n= 7),如d。等高线图和图形显示了CD11c的百分比和数量+CD19+细胞。图表表示四个实验的汇总数据。采用普通双因素方差分析和Sidak多重比较检验(df = 21)确定统计学显著性。整个列和误差条表示算术平均值和标准差。
虽然我们的数据表明CGS-21680诱导CD11c细胞死亡+T-bet嗨B细胞,在CGS-21680给药后,细胞可能下调CD11c和T-bet的表达,或迁移到其他组织。因此,我们使用了T-bet-creERT2x Rosa26eYFP小鼠,其中表达t- bet的细胞在给予他莫昔芬后可以不可逆地通过eYFP表达进行标记。感染后15-25天给小鼠喂食含他莫昔芬的食物,感染后30-37天每隔一天给小鼠注射CGS-21680。使用aids -cre的类似标记技术ERT2x Rosa26eYFP他莫昔芬标记的eYFP+感染后第30天出现的细胞是典型的abc。同样,大部分的eYFP+t细胞的细胞ERT2x Rosa26eYFP小鼠cd138阴性,与T-bet相似嗨野生型的B细胞通常在这个时间点出现e·缪里斯-感染小鼠(补充图)2).我们观察到eYFP显著降低+T-bet-cre脾脏中的B细胞ERT2x Rosa26eYFP小鼠在CGS-21680给药后,eYFP的频率没有变化+淋巴结、肝脏和骨髓中的B细胞或骨髓中IgM ASCs的频率(图2)。1 c及补充图2 b).数据提示脾T-bet+经过CGS-21680处理后,B细胞没有迁移到其他组织或改变其表型。这些数据也表明脾CD11c+T-bet+B细胞是激动剂的主要靶点,可能是由于A2受体的表达+T-bet+位于不同解剖部位的B细胞,B细胞接收到的外部信号的差异,或CD11c能力的内在差异+T-bet+不同部位的B细胞对A2受体刺激。
而数据表明CD11c+T-bet嗨CGS-21680处理后,B细胞出现了凋亡,可能是间接介导的。例如,以前的研究已经证明A2受体刺激可通过消耗T细胞间接抑制GC B细胞的形成跳频细胞39。因此,我们接下来使用Mb1cre / +x图液氧/液氧老鼠,其中A2受体仅在B细胞中缺失。CD11c+T-bet嗨B细胞在Mb1中未受影响cre / +x图液氧/液氧小鼠经CGS-21680处理后,表明A2受体介导的CD11c耗竭+T-bet嗨B细胞需要激动剂与A直接相互作用2受体在B细胞上的作用(图。1 d及补充图3).相反,CD11c+T-bet嗨B细胞CD4减少cre / +x图液氧/液氧感染后30-37天用CGS-21680治疗的小鼠,表明CD11c的消耗+T-bet嗨B细胞不需要A2CD4上的受体信号+T细胞(图2)1 e及补充图3 b).与这些观察结果一致,1型滤泡辅助细胞(TFH1)感染后第30天出现,可能为记忆性TFH1细胞,在CGS-21680处理后未被耗尽(补充图。3 c这些数据表明A2受体激动剂直接靶向CD11c+T-bet+B细胞。
一个2受体激动作用减少CD11c+T-bet+红斑狼疮易感小鼠的B细胞
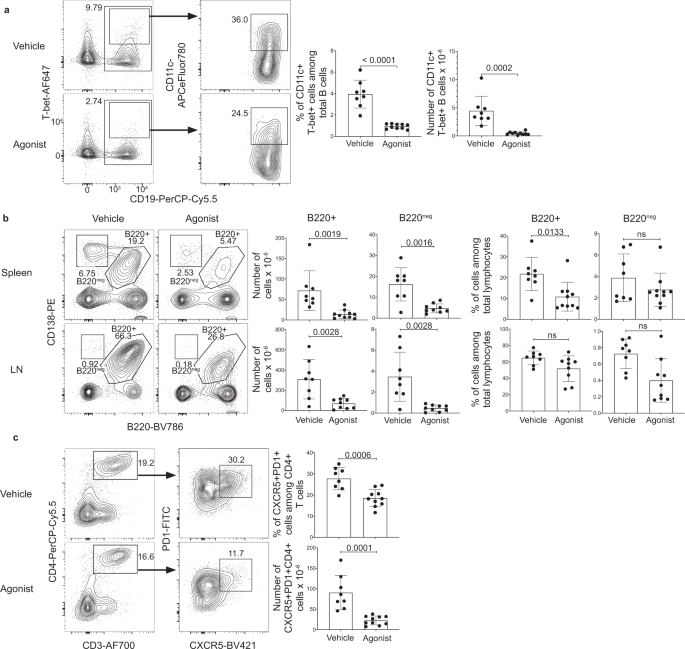
我们对e·缪里斯-这表明CGS-21680治疗可能对靶向CD11c有效+T-bet+B细胞在其他情况下这些细胞是致病的。先前对小鼠和人类的研究表明,CD11c+T-bet+B细胞在SLE期间产生,这些SLE衍生的CD11c+T-bet+B细胞看起来与CD11c相似,如果不是完全相同的话+T-bet+B细胞产生于e·缪里斯感染10,16,26。表达T-bet的B细胞被认为通过产生自身抗体和/或通过抗原呈递来促进疾病的发病,消除B细胞特异性T-bet表达可改善狼疮易感小鼠的疾病26,51。因此,我们接下来讨论了A的影响2CD11c受体激动作用+T-bet+利用MRL/lpr (MRL/MpJ-Fas)在自身免疫过程中生成的B细胞lpr/J)小鼠,为SLE提供了完善的多基因模型52。CD11c+T-bet+从8周龄开始,每周2次给予CGS-21680治疗的20周龄MRL/lpr小鼠脾脏B细胞显著减少(图2)。2).CGS-21680治疗也显著减少了CD138的数量+B220+和CD138+同一MRL/lpr小鼠脾脏和淋巴结中的b220阴性细胞(可能包括PBs, PCs,可能还有双阴性T细胞)(图2)。2 b).给定T跳频细胞可以促进SLE的发病机制,以及先前的研究表明自身免疫来源的T跳频细胞易受A2受体介导的耗竭,我们分析了MRL/lpr小鼠的脾脏中CXCR5的存在+PD1+CD4+T细胞。我们观察到CXCR5的减少+PD1+CD4+cgs -21680处理的MRL/lpr小鼠的T细胞(图2)。2摄氏度).我们没有观察到FoxP3的频率增加+T注册细胞;在cgs -21680处理的小鼠中,这些细胞的数量减少(补充图2)。4).虽然CGS-21680治疗没有改变B细胞和CD4的频率+在CGS-21680处理的小鼠中,T细胞、这些细胞的数量以及脾细胞的总数都减少了,这表明CGS-21680直接或间接地影响了MRL/lpr小鼠的一系列不同淋巴细胞(补充图2)。4 b).由于没有单一的实验模型完全概括人类SLE,我们使用SLE1.2.3进行了类似的研究。B6。NZMSle1 / Sle2 / Sle3小鼠携带三个SLE易感等位基因53。CGS-21680处理显著减少T-bet数量+9月龄SLE1.2.3小鼠脾脏B细胞每隔一天处理5天(补充图)。自己).正如长期治疗MRL/lpr小鼠所观察到的那样,这种短期治疗并没有导致ASCs的减少,尽管治疗方案的差异使进一步的比较复杂化(补充图2)。4 d).然而,这些数据表明A2受体激动剂可以消耗自身免疫来源的CD11c+T-bet+B细胞,尽管治疗也可能针对其他淋巴细胞。
一个雌性MRL/lpr小鼠用n= 8)或激动剂(n= 10)每周2次,从8周龄开始;在20周龄时分析脾细胞。斑马图和图表显示了T-bet的百分比和数量+CD11c+CD19+B细胞(%:p< 0.0001;#:p= 0.0002)。采用双尾检验确定统计学显著性未配对t-检验(左图)或曼-惠特尼检验(右图)。b小鼠脾细胞和LNs一个流式细胞术分析。等高线图和曲线图显示了CD138的百分比和数量+B220+细胞和CD138+分析小鼠脾脏和LNs中b220阴性细胞。采用双尾法测定统计学显著性未配对t-使用Benjamini, Kieger和Yekutieli两阶段递增错误发现率方法进行测试。q值如图所示。c小鼠的脾细胞一个流式细胞术分析。等高线图和曲线图显示PD-1的百分比和数量+CXCR5+CD4+CD3+细胞。采用双尾未配对法确定统计学显著性t测试。列和误差条表示算术平均值和标准差。
一个2受体刺激改善狼疮易感小鼠的疾病
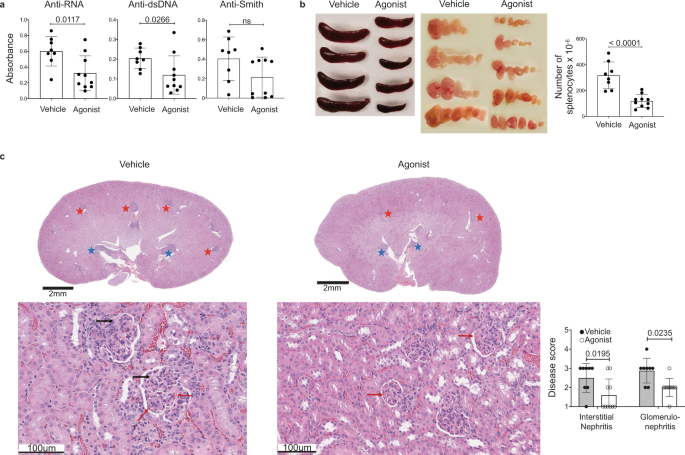
先前的研究已经证明CD11c+T-bet+B细胞参与SLE的发病机制26。因此,我们解决了A2受体介导的CD11c耗竭+T-bet+B细胞可以改善狼疮小鼠模型的疾病。我们通过分析从第8周开始每周两次接受CGS-21680治疗的20周龄MRL/lpr小鼠的血清来评估激动剂治疗后的疾病严重程度,以检测自身反应性抗体的存在。与对照小鼠相比,经CGS-21680处理的MRL/lpr小鼠的抗rna和抗dsdna抗体降低,而抗smith抗体无明显变化(图2)。3).IgG2a特异性抗dsdna抗体同样减少,尽管抗rna和抗smith IgG2a不变(补充图2)。5).抗dsdna IgG2a的降低与T-bet的降低一致+B细胞,其特征是经历IgG2a转换54。与CD138的减少一致+与对照组相比,cgs -21680处理的MRL/lpr小鼠的细胞和自身抗体、淋巴结病和脾肿大均减少(图2)。3 b).一个2受体激动剂治疗也减轻了MRL/lpr小鼠的肾脏病理;与对照组相比,cgs -21680治疗的MRL/lpr小鼠肾小球肾炎和间质性肾炎的严重程度较轻。3 c).cgs -21680处理的MRL/lpr小鼠肾脏中浸润淋巴细胞也较少。与之前的研究相反,我们没有观察到用CGS-21680治疗小鼠的蛋白尿与对照组相比有显著变化(p= 0.1694;采用混合效应模型和Sidak多重比较检验确定统计学显著性。5 b).未来的工作将有助于解决这一差距。CGS-21680治疗适度改善了MRL/lpr小鼠的生存时间,与激动剂治疗小鼠的中位生存时间32.1周相比,药物治疗小鼠的中位生存时间为21.8周,尽管这种差异无统计学意义(p= 0.535)。这种适度的影响可能是由于MRL/lpr小鼠之间的内在变异性,其他A2受体耐受疾病的细胞类型,或A2重复激动剂治疗后的受体脱敏(补充图。5度).体重没有被评估为疾病结果的衡量标准,因为已知CGS-21680通过一种不相关的机制影响小鼠的体重增加55。这些数据表明A2受体激动剂治疗显著改善狼疮小鼠模型的疾病结果,部分可能是由于CD11c的耗尽+T-bet+B细胞。
一个图中小鼠血清。220周龄时用ELISA检测抗rna、抗dsdna和抗smith抗体。图表显示了分析血清的相对吸光度值。采用双尾非配对t检验(左图)或Mann-Whitney检验(中图和右图)确定统计显著性。b图中小鼠的脾脏和脾脏。2在20周龄时进行分析。该图显示脾细胞数量。采用双尾未配对检验确定统计学显著性t以及(p< 0.0001)。c图中小鼠肾脏。2在20周龄时进行h&e染色,并对间质性肾炎和肾小球肾炎进行盲目评分。代表性的部分显示(上:1x,下:20x)。淋巴细胞和浆细胞聚集在皮质髓质交界处(红色星形)和肾盂(蓝色星形)。显示血管通畅(红色箭头)和毛细血管袢闭塞(黑色箭头)。图表显示病理评分。统计学显著性采用双因素方差分析和Sidak多重比较检验。列和误差条表示算术平均值和标准差。
一个2受体激动作用可减少发病后致病性淋巴细胞的数量
作为预防性的2受体刺激减少了致病性淋巴细胞的数量,改善了狼疮疾病的严重程度,我们接下来评估了A的治疗潜力2受体刺激对狼疮发病后,一个更相关的情景治疗SLE在人类。在这些研究中,MRL/lpr小鼠从发病后12周龄开始,每周用CGS-21680治疗两次,直到20周龄时小鼠被处死。一个2受体刺激显著降低CD11c的数量+T-bet+B细胞,尽管这些细胞的百分比没有明显变化(图2)。4).此外,脾CD138+b220阴性,CD138阴性+B220+CGS-21680给药后B细胞减少(图2)。4 b).与预防性的A2受体治疗,CXCR5+PD1+延迟CGS-21680治疗后,T细胞并未衰竭(图2)。4摄氏度).此外,淋巴细胞、B细胞和CD4细胞的总数+延迟CGS-21680处理对T细胞没有影响(补充图)。6).这些数据表明A2受体刺激可以减少某些致病淋巴细胞的数量,即使在发病后给予。
一个雌性MRL/lpr小鼠用n= 10)或激动剂(n= 10)每周两次,从12周龄开始;在20周龄时分析脾细胞。斑马图和图表显示了T-bet的百分比和数量+CD11c+CD19+B细胞。采用双尾检验确定统计学显著性未配对t-检验(左图)或曼-惠特尼检验(右图)。b小鼠脾细胞和LNs一个流式细胞术分析。等高线图和曲线图显示了CD138的百分比和数量+B220+细胞和CD138+分析小鼠脾脏和LNs中b220阴性细胞。采用双尾未配对法确定统计学显著性t-使用Benjamini, Kieger和Yekutieli两阶段递增错误发现率方法进行测试。问-值在图中显示。c小鼠的脾细胞一个流式细胞术分析。等高线图和曲线图显示PD-1的百分比和数量+CXCR5+CD4+CD3+细胞。采用双尾检验确定统计学显著性未配对t-检验(上图)或曼-惠特尼检验(下图)。列和误差条表示算术平均值和标准差。
一个2疾病发作后的受体刺激改善了狼疮易感小鼠的疾病
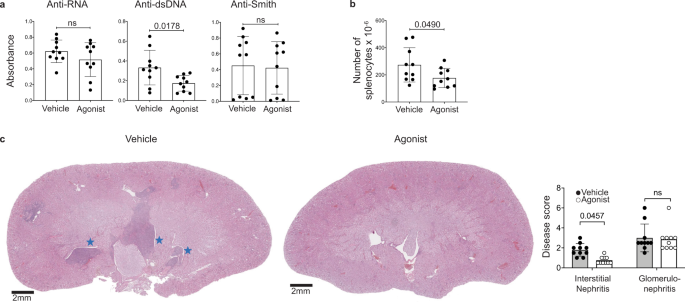
接下来我们评估了A的潜力2通过分析疾病发病后接受CGS-21680治疗的MRL/lpr小鼠的疾病严重程度,受体刺激作为SLE的治疗方法。MRL/lpr小鼠于12-20周龄用CGS-21680处理,第20周处死。这个时间点是根据之前发表的研究选择的56,57。与CD138的减少一致+在发病后用CGS-21680处理的小鼠脾细胞中,抗dsdna抗体显著降低,但抗rna和抗smith抗体未受影响(图2)。5).抗dsdna抗体的减少而非抗rna抗体的减少可能表明A2受体刺激优先针对浆母细胞而不是长寿命浆细胞,因为这些亚群被认为分别富含抗dsdna和抗rna反应性B细胞56,57。与从8周龄开始用CGS-21680治疗的小鼠类似,延迟治疗后脾脏肿大也减少了(图2)。5 b).推迟了2受体刺激也显著减少间质性肾炎,尽管肾小球肾炎保持不变(图2)。5度),可能是因为肾小球在治疗开始前已经受损。这些发现表明A2受体激动剂可以改善SLE疾病的严重程度,甚至在发病后。
讨论
尽管CD11c+T-bet+B细胞可以起到记忆细胞的作用,并有助于保护性体液免疫,同样的B细胞亚群也参与SLE和其他自身免疫性疾病14,15,16,17,26。狼疮小鼠模型研究表明,消除这些B细胞中的T-bet表达可显著降低疾病严重程度26。与这些发现一致,我们证明了A的管理2受体激动剂CGS-21680耗尽CD11c+T-bet+两者都产生了B细胞e·缪里斯-感染和狼疮易感小鼠,并减少自身免疫易感小鼠的疾病负担。我们的数据得到了先前一项研究的支持,该研究表明a2受体激动剂降低狼疮小鼠模型肾脏疾病的严重程度49。因此,CD11c的靶向消耗+T-bet+B细胞可能是a2受体刺激可改善疾病。我们也证明了A2受体刺激可以改善MRL/lpr小鼠发病后的疾病。虽然2发病后受体刺激对CD11c的影响不太明显+T-bet+B细胞,尽管如此,我们观察到这些细胞的总数减少,疾病病理减少。这些发现表明A2受体刺激可以改善SLE病理,甚至在疾病发作后,支持使用A2受体激动剂用于治疗人类已建立的SLE。我们的研究结果还表明,A2受体激动剂介导的CD11c耗竭+T-bet+B细胞将减轻其他疾病的疾病负担,其中CD11c+T-bet+B细胞参与疾病的发病机制,如类风湿关节炎、多发性硬化症和干燥综合征14,15,58,59,60,61。事实上,先前的研究已经证明CGS-21680治疗降低了RA小鼠模型中的自身抗体反应和疾病负担40。此外,A2CD11c中的受体信号+T-bet+B细胞可能对其他疾病也很重要,比如人类的慢性病毒和细菌感染。因此,A2受体在CD11c上+T-bet+B细胞可能为SLE和其他自身免疫性疾病的治疗提供一种治疗方法。
我们之所以选择CGS-21680作为我们的研究对象,是因为这种药物是一种有充分证据的a2受体,尽管有报道称它与A1受体和A3.低亲和力受体62。使用m1 -cre x Adora2a液氧/液氧我们发现CGS-21680对T-bet有作用+B细胞通过A2受体。在MRL/lpr小鼠模型中,需要进一步的研究来证实这些结果,尽管我们的数据强烈表明这些影响仅由A介导2受体也是如此。
我们的工作表明cgs -21680介导CD11c的耗竭+T-bet+B细胞需要表达A2在卵泡病毒感染过程中产生的B细胞受体。这一发现表明CGS-21680直接作用于CD11c+T-bet+B细胞。然而,从形式上讲,A2受体激动剂也通过靶向T跳频这些细胞已被证明对CD11c的产生至关重要+T-bet+B细胞5。CXCR5+PD1+CD4+在8 ~ 20周龄易患狼疮的MRL/lpr小鼠中检测到T细胞的频率要低得多,然而,在疾病发作后用CGS-21680治疗的MRL/lpr小鼠中,这些T细胞没有受到影响。这些数据表明A2受体激动作用损害T跳频细胞分化,但不消耗成熟T跳频细胞39,40。正在进行的研究将解决在狼疮易感小鼠中使用激动剂是否会影响完全成熟的T细胞功能跳频A2受体激动剂直接靶向sle衍生的CD11c+T-bet+B细胞。不管CD11c的机制如何+T-bet+B细胞在A后耗尽2受体激动剂的使用,我们的工作表明这些细胞在治疗后被消除,这伴随着疾病负担的减少。
除了T跳频细胞和CD11c+T-bet+B细胞,A2已知受体在其他白细胞群中广泛表达33,35。因此,CGS-21680治疗可能通过作用于CD11c以外的其他细胞类型来改善MRL/lpr小鼠的疾病+T-bet+B细胞。例如,A2受体刺激也可以通过抑制T细胞的分化来改善疾病eff通过消除NK细胞和T细胞分泌炎性细胞因子,或直接作用于ASCs49,63,64,65。与先前在RA小鼠模型中的研究类似,CGS-21680治疗似乎抑制了T的产生跳频MRL/lpr小鼠的细胞,这可能反过来损害自身反应性ASCs的产生40。在我们的研究中,CGS-21680治疗显著降低了脾B细胞总数和CD4+在MRL/lpr小鼠的T细胞中,表明A2受体激动作用影响广泛的细胞,或者CGS-21680治疗减轻了驱动淋巴细胞增殖的炎症环境。因此,需要进一步的研究来正式解决A2受体刺激改善狼疮易感小鼠的疾病结果。然而,考虑到它们参与SLE的发病机制,以及它们对A2受体介导的消除,我们提出CD11c的消耗+T-bet+B细胞是CGS-21680治疗减少MRL/lpr小鼠疾病的主要机制。
我们设想CD11c的消耗+T-bet+CGS-21680给药后的B细胞通过几种可能的机制改善MRL/lpr小鼠的疾病。首先,我们之前已经证明CD11c+T-bet+B细胞可以作为记忆细胞,并且可以分化为ASCs,其他实验室已经证明sle衍生的人CD11c+T-bet+B细胞具有前ascs的功能9,16,27。因此,CD11c的损失+T-bet+B细胞可间接减少自身反应性ASCs的数量,从而降低自身反应性抗体的产生。这种自身反应性抗体的减少反过来可以减少MRL/lpr小鼠肾脏中的免疫复合物沉积,并随后减少肾脏浸润的促炎T细胞的数量。第二,作为CD11c+T-bet+B细胞被认为是有效的apc,这些B细胞在A2受体激动剂治疗也可能抑制CD4的激活+T细胞,从而减少T细胞介导的发病机制28。事实上,虽然无法分泌抗体的MRL/lpr小鼠仍然会患上这种疾病,但B细胞中MHCII的缺失大大改善了MRL/lpr小鼠的疾病结局51。这表明抗原呈递,而不是抗体分泌,是B细胞参与SLE发病的机制。最后,CD11c的消耗+T-bet+B细胞可以直接减轻MRL/lpr小鼠的炎症,如slel衍生的T-bet+B细胞已被证明能分泌促炎细胞因子66。
而一个2受体信号在B细胞中尚未得到很好的研究,但在其他白细胞中,特别是在T细胞中已被表征。在Teff细胞,2受体刺激导致PKA活化,进而抑制ZAP70、各种MAP激酶、PKC以及Notch1信号,最终阻断T细胞活化以及IFN-γ和颗粒酶B的生成67。其他研究也发现pAKT和NFκB是A的重要组成部分2T细胞中的受体信号34,65,68。很可能A2B细胞中的受体信号通过类似的中间体,包括pAKT、PKA和NFκB,但这些信号成分诱导B细胞死亡的确切机制尚不清楚。一个2已知受体激动作用可下调MCL-1, MCL-1是维持活化的B细胞和pc所需的抗凋亡蛋白69,70,71,72。MCL-1结合BH3-only蛋白,阻止其激活Bax或Bad,诱导细胞凋亡73。有可能A2受体激动作用诱导CD11c细胞死亡+T-bet+B细胞通过抑制MCL-1,并允许BH3-only蛋白激活Bax和Bak,最终允许释放细胞色素c并诱导凋亡69,70,73。
在我们的初步研究中,我们没有观察到T-bet的表型或功能有任何变化+缺乏A表达的B细胞2受体。两届美国政府都没有2受体拮抗剂istafdefylline,而不是基因消除A2受体,影响CD11c的发育+T-bet+B细胞e·缪里斯-受感染的老鼠。尽管在其他细胞中得到了很好的研究,A2正常B细胞中的受体信号还不清楚。对cd73缺陷小鼠的研究表明,这种外酶的缺失并不抑制GC或记忆B细胞的形成,但确实阻碍了骨髓pc的维持74。鉴于A2受体信号在其他细胞类型,A2受体信号传导在B细胞中可能同样受到抑制。A的有限影响2在我们的研究中,受体耗竭表明可能存在最小的A2生理条件下的受体信号。因此,一个2受体信号可能只发生在细胞外腺苷水平高的特定情况下,如缺氧或炎症。也有可能A2T-bet中的受体信号+B细胞是一个冗余的调节机制,只有在没有其他调节信号的情况下才有必要。
靶向B细胞的策略在改善RA和MS的疾病方面是有效的,尽管这些方法在治疗SLE和其他自身免疫性疾病方面的疗效仍不确定75,76。两项临床试验未能显示使用B细胞消耗抗体利妥昔单抗(即抗cd20)治疗SLE患者的症状显著减轻。然而,这些发现可能被样本组内的异质性、B细胞不完全耗尽以及两组患者使用高水平的皮质类固醇所混淆77。目前的B细胞靶向治疗缺乏特异性,并且通过消除患者的大多数B细胞(即90-100%的外周B细胞)来起作用。78。B细胞的泛耗竭也消除了抑制性B细胞,并且已经提出,这些B细胞的损失有助于在一些接受抗B细胞治疗的MS患者中观察到的症状尖峰79。由于目前B细胞靶向治疗的副作用,需要开发副作用有限且可耐受的新型治疗方法。因此,针对腺苷信号通路的治疗可能为SLE和其他自身免疫性疾病的治疗提供了一条有希望的途径。的确,A2受体激动剂Regadenoson(也被称为Lexiscan)已经被用于无法进行运动应激测试的患者的心肌成像80。由于其广泛使用,Regadenoson治疗的副作用已被彻底记录,并且在人类中具有良好的耐受性,至少在目前的使用条件下是这样。副作用包括头痛、胸痛、头晕和血脑屏障破坏,尽管大多数这些症状在治疗后15分钟内消退81。对自身免疫的治疗可能需要反复施用激动剂,尽管限制人类疾病所需的剂量和施用频率尚不清楚,但在其他方面健康的患者中,适度的副作用可能耐受良好。需要进一步的研究来确定A的功效2受体激动剂,但我们的研究表明,这类药物代表了治疗部分由CD11c引起的自身免疫性疾病的有希望的方法+T-bet+B细胞。
方法
老鼠
CD4 C57BL / 6 jcre(B6.Cg-Tg (Cd4-cre) 1地板/ BfluJ), Mb1cre(B6.C -Cd79a (Cg)tm1 Reth (cre)/EhobJ), MRL/lpr (MRL/MpJ-Faslpr/ J),系统性红斑狼疮123(B6; NZM -Sle1NZM2410 / AegSle2NZM2410 / AegSle3NZM2410 / Aeg/LmoJ)和Rosa26eYFP(B6。Cg -Gt (ROSA) 26琼tm3 Hze (CAG-EYFP)/J)小鼠来自The Jackson Laboratory (Bar Harbor, ME)。T-bet-creERT2小鼠是由纽约州罗彻斯特市罗彻斯特大学的林甘博士制造的。图液氧(B6; 129 -图tm1Dyj/J)小鼠由La Jolla免疫学研究所Joel Linden博士提供。除MRL/MpJ-Faslpr/J,在C57BL/6J的背景上。根据动物福利机构的指导方针,所有小鼠都在纽约州立大学上州医科大学动物护理设施(Syracuse, NY)饲养和繁殖。所有用于实验的小鼠均为至少6周龄,除另有说明外,均使用雄性和雌性小鼠。所有涉及动物的研究都得到了纽约州立大学上州医科大学动物护理和使用机构委员会NYSDOH Unit A073 IACUC编号311的批准。
感染和药物管理
小鼠腹腔注射5-10 × 104e·缪里斯细菌拷贝数,通过qPCR测定,如前所述(探针序列:56-FAM/AGGGATTTC/ZEN/CCTATACTCGGT/3IABkFQ)82。CGS-21680盐酸和Istradefylline购自Cayman Chemical (Ann Arbor, MI)。Regadenoson (Lexiscan;安斯泰来制药公司(Astellas Pharma Inc.)是从纽约州立大学上州医科大学内部收购的。e·缪里斯小鼠腹腔注射CGS-21680 50 μg (C57BL6/J: 2.5 mg/kg;MRL/lpr: 1.43 mg/kg)、isstradefylline (6.6 mg/kg) 132 μg或Regadenoson (2.5 mg/kg) 50 μg,加入含有5% DMSO的200 μl PBS中,不麻醉。
流式细胞术和抗体
用70 μm细胞滤器(BD Falcon)对脾脏和淋巴结进行分解。用ACK裂解缓冲液(Quality Biological Inc .)孵育去除红细胞。细胞用抗cd16 /32 (2.4G2)处理,小鼠细胞用以下抗体孵育:percpcy5.5偶联抗cd19 (6D5, 1:200)、Alexa Fluor 700偶联抗cd19 (6D5, 1:200)、APC-eFluor 780偶联抗cd11c (N418, 1:200)、Brilliant Violet 785偶联抗b220 (RA3-6B2, 1:200)、v500偶联抗b220 (RA3-6B2, 1:100)、Alexa Fluor 647偶联抗t -bet (4B10, 1:200)、percpcy5.5偶联抗t -bet (4B10, 1:200)、fitc偶联抗pd -1 (29F)。1A12, 1:100), percpcy5.5偶联抗cd4 (rm4 - 4,1:20 0), Alexa Fluor 700偶联抗cd3 (17A2, 1:400), Brilliant Violet 421偶联抗cxcr5 (L138D7, 1:200), pe偶联抗cd138 (281-2, 1:200), Brilliant Violet 421偶联抗igm (rmm - 1,1:20 0), pe偶联抗foxp3 (150D, 1:200)。使用LIVE/DEAD固定Aqua死细胞染色(Thermo Fisher Scientific)或Ghost Dye Violet 510 (TONBO biosciences)染色以测定细胞活力。
细胞在4°C下染色30分钟,清洗,分析。对于细胞内染色,表面染色的细胞在4°C下固定/渗透40分钟,使用转录因子缓冲液固定/渗透缓冲液(BD Pharmingen),洗涤,在4°C下染色30分钟,洗涤并分析。未染色的细胞用于建立流式细胞仪电压设置,单色阳性对照用于调节补偿。使用Diva软件(BD Bioscience)在BD Fortessa流式细胞仪上获取数据,并使用FlowJo软件10.7版(BD Bioscience)进行分析。所有流式细胞术分析均在新鲜收获的细胞上进行。
用PBS灌注肝脏,并用70 μm细胞滤器(BD Falcon)进行分解。用40% Percoll (Sigma Aldrich)梯度分离细胞,用ACK裂解缓冲液(Quality Biological Inc)孵育去除红细胞。
蛋白尿
尿白蛋白浓度测定使用fishbrand 10-SG尿液试剂条,根据制造商的说明。
组织学
取小鼠肾脏,在室温下用4% PFA固定至少48小时。将固定肾脏石蜡包埋,切成5 μm的切片,用苏木精和伊红(H&E)染色,由Histowiz (Brooklyn, NY)的病理学家或匹兹堡大学医学中心的认证病理学家使用先前描述的指标进行盲目评分83。肾小球肾炎根据系膜细胞数量和扩张、毛细血管袢未闭、肾小球大小、核裂、月牙状形成和硬化症进行1 - 6级评估。根据淋巴细胞和浆细胞浸润在血管周围区域和/或间质间隙的患病率,间质性肾炎分为1 - 4级。
elisa
按照Blanco等人的描述进行抗rna elisa。84。平底免疫板(Thermo Scientific)涂覆100 μl聚l -赖氨酸(50 μg/ml) (Sigma Aldrich),然后涂覆100 μl酵母RNA (15 μl/ml) (Fisher Scientific)。用胎牛血清阻断,用血清(在洗涤缓冲液中稀释1:100)在4°C下孵育过夜。采用碱性磷酸酶偶联山羊抗小鼠抗体(1:1000)检测rna特异性抗体,无血清对照去除背景。(南方生物技术协会,伯明翰,AL)。
Anti-Smith和Anti-dsDNA elisa使用Bio-Rad Anti-Sm (cat # 96SM)和Anti-dsDNA (cat # 96DS) EIA试剂盒(Bio-Rad),按照制造商的说明进行检测,但Anti-Smith和Anti-dsDNA抗体使用碱性磷酸酶偶联山羊抗小鼠二抗(1:1000)进行检测(Southern Biotechnology Associates, Birmingham, AL)。
统计分析
使用Prism 9 (GraphPad)进行统计分析。所执行的统计测试显示在图例中。每个图中的列表示数据集的算术平均值,上界和下界表示数据集的标准差。使用Shapiro-Wilk检验分析数据的正态性,并根据数据的正态性选择统计检验。根据以往数据,假设幂为80%,显著性水平为0.05,估计效应量为2.02。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
参考文献
Chang L.-Y。,Li, Y. & Kaplan, D. E. Hepatitis C viraemia reversibly maintains subset of antigen-specific T-bet+ tissue-like memory B cells.J.病毒性肝炎;24, 389-396(2017)。
Moir, S.等。hiv感染病毒血症个体功能失调记忆B细胞区室中与hiv相关的B细胞衰竭的证据J.医学实验。205, 1797-1805(2008)。
纳拉迪基安,m.s.等。最新进展:IL-4、IL-21和IFN-γ相互作用,控制tlr活化的B细胞中T-bet和CD11c的表达。j . Immunol。197, 1023-1028(2016)。
Weiss, g.e.等人。非典型记忆B细胞在疟疾流行地区的个体中大量扩增。j . Immunol。183, 2176-2182(2009)。
Levack, R. C, Newell, K. L., Popescu, M., Cabrera-Martinez, B.和Winslow, G. M. CD11c+ T-bet+ B细胞需要来自1型T滤泡辅助细胞的IL-21和IFN-γ和内在的Bcl-6表达,但在没有T-bet的情况下正常发育。j . Immunol。205, 1050-1058(2020)。
Myles, A, Gearhart, P. J. & Cancro, M. P.驱动B细胞T-bet表达的信号。细胞。Immunol。321, 3-7(2017)。
Obeng-Adjei, N.等。疟疾诱导的干扰素- γ驱动Tbet的扩张嗨非典型记忆B细胞。公共科学图书馆Pathog。13, e1006576(2017)。
Wang, S.等。IL-21驱动SLE中自身反应性CD11c(hi)T-bet(+) B细胞的扩增和浆细胞分化。Nat Commun9, 1758(2018)。
Kenderes, K. J.等。T-bet + IgM记忆细胞产生多系效应B细胞。细胞的代表。24, 824-837 e3(2018)。
Yates, J. L., Racine, R., McBride, K. M.和Winslow, G. M.在细菌感染期间产生的T细胞依赖的IgM记忆B细胞是IgG应答抗原挑战所必需的。j . Immunol。191, 1240-1249(2013)。
Changrob, S.等。持久性长记忆B细胞特异性Duffy结合蛋白暴露于个体间日疟原虫。科学。代表。8, 8347(2018)。
Ly, A.和Hansen, D. S.疟疾中B细胞记忆的发展。前面。Immunol。10, 559(2019)。
Muellenbeck, m.f.等。非典型和经典记忆B细胞产生恶性疟原虫中和抗体。J.医学实验。210, 389-399(2013)。
Saadoun等人。自身反应性CD21-/低B细胞在Sjögren综合征相关淋巴细胞增殖中的扩增关节炎感冒。65, 1085-1096(2013)。
Wehr, C.等。一个新的CD21低SLE患者外周血中的B细胞群。中国。Immunol。113, 161-171(2004)。
詹克斯,s.a.等人。不受调节的toll样受体7诱导的不同效应B细胞参与系统性红斑狼疮的致病反应。免疫力49, 725-739 e6(2018)。
Rakhmanov, M.等。循环CD21低常见变异性免疫缺陷的B细胞类似于组织归巢,类似于先天B细胞。Proc。国家的。学会科学。美国106中文信息学报(英文版),2009)。
系统性红斑狼疮。心血管病。j .地中海。365, 2110-2121(2011)。
Anolik, J. H.等。利妥昔单抗改善人系统性红斑狼疮外周血B细胞异常。关节炎和风湿病。50, 3580-3590(2004)。
在炎症性关节炎小鼠模型中,利妥昔单抗特异性地消耗短命的自身反应性浆细胞。Proc。国家的。学会科学。美国107, 4658-4663(2010)。
魏,C.等。一种缺乏CD27表达的新细胞群代表了系统性红斑狼疮B细胞记忆区一个值得注意的组成部分。j . Immunol。178, 6624-6633(2007)。
Wu, O.等。中国人群新诊断、未经治疗的系统性红斑狼疮患者循环B细胞和T细胞中toll样受体9和T-bet的表达及其与疾病活动性和实验室数据的相关性免疫生物学214, 392-402(2009)。
你,x,等等。双阴性B细胞与系统性红斑狼疮的肾功能损害有关,并作为肾炎缓解的标志。前面。地中海(洛桑)。7, 85(2020)。
Liu, Y.等。T-bet(+)CD11c(+) B细胞在狼疮的发展过程中对抗染色质免疫球蛋白G的产生至关重要。关节炎。19, 225(2017)。
rutsov, a.v.等。toll样受体7 (TLR7)驱动的新型CD11c+ b细胞群的积累对自身免疫的发展很重要。血118, 1305-1315(2011)。
Rubtsova, K.等人。表达转录因子T-bet的B细胞驱动狼疮样自身免疫。j .中国。投资。127, 1392-1404(2017)。
斯通,S. L.等。T-bet转录因子通过限制ifn - γ对B细胞的炎症作用来促进抗体分泌细胞分化。免疫力50[j] .中文信息学报,2011(5):559 - 567。
rutsov, a.v.等。表达cd11c的B细胞位于脾脏的T细胞/B细胞边界,是有效的apc。j . Immunol195, 71-79(2015)。
Blanco, P., Ueno, H. & Schmitt, N.狼疮中的滤泡辅助(Tfh)细胞:激活和参与SLE发病机制。欧洲J.免疫;46科学通报,281-290(2016)。
Bocharnikov, a.v.等。PD-1嗨CXCR5- T外周辅助细胞通过MAF和IL-21促进狼疮B细胞应答。江森自控的洞察力4, 85(2019)。
辛普森等人。循环T细胞类似滤泡辅助性T细胞的扩增是一种固定表型,可识别严重系统性红斑狼疮的一个亚群。关节炎感冒。62, 234-244(2010)。
温思洛,G. M, Papillion, A. M, Kenderes, K. J.和Levack, R. C. CD11c+ T-bet+记忆B细胞:慢性感染和炎症的免疫维持?细胞。Immunol。321, 8-17(2017)。
免疫系统的嘌呤能调节。Nat, Rev. immuno1。16, 177(2016)。
Cronstein, b.n. & Sitkovsky, M.腺苷和腺苷受体在风湿病发病机制和治疗中的作用。Nat, Rev. Rheumatol。13, 41-51(2017)。
A2A腺苷受体保护肿瘤免受抗肿瘤T细胞的攻击。Proc。国家的。学会科学。美国103, 13132-13137(2006)。
核苷酸和核苷转换外切酶:嘌呤能信号级联的重要调节剂。Biochim。Biophys。学报。1783, 673-694(2008)。
莫兰迪,F.等。CD56明亮的CD16−NK细胞通过cd38介导的途径产生腺苷,并作为调节细胞抑制自身CD4+ T细胞增殖。j . Immunol。195, 965-972(2015)。
Ohta, A. CD4+CD25+FoxP3+调节性T细胞的发育和免疫抑制功能受腺苷- A2A腺苷受体途径的影响。前面。Immunol。3., 190(2012)。
杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军。j . Immunol。198, 623-628(2017)。
Schmiel, s.e.等。通过抑制致病性生发中心-滤泡辅助性T细胞,腺苷2a受体信号阻断小鼠自身免疫性关节炎。关节炎Rheumatol。71, 773-783(2019)。
Leone, R. D. & Emens, L. A.靶向腺苷用于癌症免疫治疗。j . Immunother。癌症6, 57(2018)。
leonet, R. D, Lo, Y. C.和Powell, J. D. A2aR拮抗剂:新一代检查点阻断肿瘤免疫治疗。第一版。结构体。Biotechnol。J。13, 265-272(2015)。
Wang, L.等。CD73在小鼠非造血细胞和造血细胞中具有促进肿瘤生长的不同作用。j .中国。投资。121科学通报,2371-2382(2011)。
查莱克,p.e.等。A2A受体信号通过诱导T细胞能量和适应性调节性T细胞的产生来促进外周耐受性。血111, 251-259(2008)。
CD73是实验性自身免疫性脑脊髓炎期间淋巴细胞有效进入中枢神经系统所必需的。Proc。国家的。学会科学。美国105, 9325-9330(2008)。
杜振辉等。腺苷A2A受体介导胶原诱导关节炎大鼠电针后滑膜炎和破骨细胞生成的抑制。Evid。的基础。补充选择来说。地中海。2019, 4617464(2019)。
Ravani, A.等。A2A和A(3)腺苷受体在强直性脊柱炎、银屑病关节炎和类风湿关节炎中的作用和功能Int。科学通报;18, 697(2017)。
Varani, K.等。类风湿关节炎A2A和A3腺苷受体表达上调,与疾病活动度评分呈负相关,抑制炎症细胞因子和金属蛋白酶释放。关节炎。13, r197(2011)。
腺苷2A受体对MRL/lpr小鼠肾损伤具有保护作用。红斑狼疮20., 667-677(2011)。
Bortoluzzi等人。A2A腺苷受体上调与系统性红斑狼疮患者的疾病活动性相关关节炎。18, 192(2016)。
Giles, J. R, Kashgarian, M., Koni, P. A.和Shlomchik, M. J. B细胞特异性MHC II类缺失揭示了狼疮小鼠B细胞抗原呈递的多重非冗余作用。j . Immunol。195科学通报,2571-2579(2015)。
Richard, M. L.和Gilkeson, G.小鼠狼疮模型:它们告诉我们的和没有告诉我们的。狼疮科学。地中海。5, e000199(2018)。
莫雷尔,L.等。多基因小鼠系统性红斑狼疮免疫病理基因重建。Proc。国家的。学会科学。美国97, 6670-6675(2000)。
彭淑丽,Szabo, S. J. & Glimcher, L. H. T-bet调节IgG类转换和致病性自身抗体的产生。Proc。国家的。学会科学。美国99, 5545-5550(2002)。
Geraghty, N. J, Adhikary, S. R., Watson, D. & Sluyter, R.。A2A受体激动剂CGS 21680在移植物抗宿主病人源化小鼠模型中对疾病发展的有利和不利影响。Int。Immunopharmacol。72, 479-486(2019)。
Grammer, a.c.和Lipsky, p.e.系统性红斑狼疮的B细胞异常。关节炎。5, s22(2003)。
McCune, W. J.等人。每月静脉注射环磷酰胺治疗严重系统性红斑狼疮的临床和免疫效果。心血管病。j .地中海。318, 1423-1431(1988)。
克拉斯等人。具有促炎特征的年龄相关B细胞在一定比例的多发性硬化症患者中扩增。j . Immunol。197, 4576-4583(2016)。
弗里苏洛,G.等。多发性硬化症和乳糜泻患者循环B细胞中T-bet表达增加嗡嗡声。Immunol。69; 837-839(2008)。
van Langelaar, J.等。多发性硬化症脑浸润表达t- bet的B细胞的诱导作用。安神经86中文信息学报,264-278(2019)。
van Langelaar, J., Rijvers, L., Smolders, J.和van Luijn, m.m.b和T细胞驱动多发性硬化症:身份,机制和潜在的触发因素。前面。Immunol。11, 760(2020)。
Alnouri, m.w.等。选择性是物种依赖的:在人、大鼠和小鼠腺苷受体上的标准激动剂和拮抗剂的表征。Purinergic信号。11中文信息学报,389-407(2015)。
阻断A2A受体可有效抑制CD73+肿瘤的转移。Proc。国家的。学会科学。美国110, 14711-14716(2013)。
细胞外腺苷介导的调节性T细胞的调节。前面。Immunol。5, 304(2014)。
小鼠Treg和Teff细胞中cd73来源的腺苷的胞外嘌呤代谢和信号传导。点。j .杂志。细胞杂志。301, c530-c539(2011)。
吴,C.等。狼疮相关的非典型记忆B细胞mtorc1过度激活和功能失调。安。感冒。说。78, 1090-1100(2019)。
索伦蒂诺,C.等。腺苷A2A受体刺激抑制tcr诱导的CD8+ t细胞Notch1激活。前面。Immunol。10, 162(2019)。
Cekic, C, Sag, D, Day, Y. J.和Linden, J.细胞外腺苷调节幼稚T细胞发育和外周维持。J.医学实验。210科学通报,2693-2706(2013)。
Minguet, S.等。腺苷和cAMP是免疫受体下游NF-κB通路的有效抑制剂。欧元。j . Immunol。35, 31-41(2005)。
J. H.等人。CAMP信号通路的激活增加了人b前体细胞的凋亡,并与Mcl-1表达的下调有关。J.细胞生理学。180, 71-80(1999)。
Vikstrom等人。Mcl-1对生发中心的形成和B细胞记忆至关重要。科学330, 1095-1099(2010)。
佩佩扎克,V.等。Mcl-1对浆细胞的存活至关重要。Immunol Nat。14, 290-297(2013)。
托马斯,L. W.,林,C.和爱德华兹,S. W. mcl;蛋白质功能的分子调控。2月。584, 2981-2989(2010)。
Conter, L. J, Song, E., Shlomchik, M. J. & Tomayko, M. M.,生发中心和骨髓浆细胞中CD73表达的动态调控。《公共科学图书馆•综合》9, 2009(2014)。
爱德华,j.c.w.等。利妥昔单抗b细胞靶向治疗类风湿性关节炎的疗效。新英格兰。j .地中海。350; 2572-2581(2004)。
豪瑟,S. L.等。利妥昔单抗治疗复发-缓解型多发性硬化症。心血管病。j .地中海。358, 676-688(2008)。
SLE中B细胞耗竭的难题。Nat, Rev. Rheumatol。5, 304-305(2009)。
霍夫曼,K,克劳德,a。自身免疫性疾病的B细胞和浆细胞靶向。前面。Immunol。9, 835(2018)。
Lehmann-Horn, K, Kronsbein, H. C. & Weber, M. S.靶向B细胞治疗多发性硬化症:最新进展和仍然存在的挑战。其他。放置神经。Disord。6, 161-173(2013)。
Iskandrian, A. E.等。心肌灌注成像中腺苷与腺苷的比较评价:ADVANCE 3期多中心国际试验的结果j .诊断。心功能杂志。14, 645-658(2007)。
卡曼,a.j.,米尔斯,j.h.,克伦茨,A.,金,d.g.。腺苷受体信号调节血脑屏障的通透性。j . >。31中文信息学报,13272-13280(2011)。
Bitsaktsis, C, Nandi, B., Racine, R., MacNamara, K. C.和Winslow, G. t细胞不依赖的体液免疫足以保护免受致命的细胞内埃利希体感染。感染。Immun。75中文信息学报,2007)。
蒂尔斯特拉,j.s.等人。B细胞内禀TLR9表达对狼疮有保护作用。j .中国。投资。130中文信息学报,372 - 387(2020)。
Blanco, F, Kalsi, J. & Isenberg, D. A.系统性红斑狼疮和其他自身免疫性风湿病患者RNA抗体的分析。中国。Exp Immunol。86, 66(1991)。
致谢
我们感谢北州医科大学流式细胞术中心提供的出色技术援助。我们感谢Lisa Phelps和Joanne Chilton的帮助,感谢王栋梁在统计分析方面的建议。我们也感谢博士。E. Leadbetter(德克萨斯大学健康科学中心)和J. Wilmore(纽约州立大学上州医科大学)感谢他们对手稿的有益审阅。这项工作得到了美国卫生与公众服务部拨款R01AI114545给G.M.W和AI072648给A.P.的支持
作者信息
作者及单位
贡献
概念化,R.C.L.和通用汽车;方法论,R.C.L.和通用汽车;形式分析;调查,R.C.L, K.L.N, b.c.m。、j.c.、a.p.、S.I.B和g.m.w;写作-原稿,R.C.L.和G.M.W.;r.c.l.、g.m.w.和K.L.N.的写作-评论和编辑;可视化,R.C.L.和通用汽车;监督G.M.W.;通用汽车公司项目管理;融资收购,通用汽车
相应的作者
道德声明
相互竞争的利益
两位作者声明了以下相互竞争的利益:通用汽车和R.C.L.是正在申请使用a的专利的发明者2受体激动剂在治疗性CD11c耗竭中的应用+T-bet+B细胞介导的疾病中的B细胞。申请人:纽约州立大学研究基金会,申请编号:PCT/US2019/045624。其余作者声明没有竞争利益。
同行评审
同行评议信息
自然通讯感谢Shaun Jackson和其他匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。
额外的信息
出版商的注意b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
源数据
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
莱瓦克,r.c.,纽维尔,k.l.,卡布雷拉-马丁内斯,B。et al。腺苷受体2a激动剂靶向小鼠CD11c+T-bet+感染和自身免疫中的B细胞。Nat Commun13, 452(2022)。https://doi.org/10.1038/s41467-022-28086-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-022-28086-1