摘要gydF4y2Ba
目前还没有治疗假体周围骨溶解的方法,这是关节置换术失败的最常见原因。在这里,我们研究了AnxA1在假体周围骨溶解中的作用和潜在的治疗方法。研究发现,颅骨组织中AnxA1表达的降低与骨溶解病变的增加有关,并且在缺乏AnxA1的小鼠中,碎片植入引起的骨溶解病变比野生型小鼠更严重。AnxA1通过抑制NFκB信号通路和促进PPAR-γ通路抑制破骨细胞分化。将N-terminal-AnxA1 (Ac2-26肽)应用于颅骨可显著减少磨损碎片引发的骨质溶解病变。这些治疗作用在接受PPAR-γ拮抗剂的小鼠中被取消,这表明AnxA1/PPAR-γ轴在骨溶解中具有抑制作用。Ac2-26抑制TNF-α和RANKL注射诱导的小鼠骨溶解。这些结果表明,AnxA1是一种潜在的治疗假体周围骨溶解的药物。gydF4y2Ba
简介gydF4y2Ba
全关节置换术(TJA)是矫形外科医生最合理的方法,因为它可以减少疼痛并恢复终末期关节炎关节的功能。发生在假体周围组织的炎性骨溶解引起的无菌性松动是假体失败和翻修手术的主要原因。在老年和年轻患者中,越来越多的翻修手术清楚地表明需要一种新的治疗干预来延长假体的寿命gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
由来自假体部件的材料释放的颗粒碎片所引发的局部炎症反应被认为是与假体周围骨溶解和无菌性松动相关的关键事件gydF4y2Ba2gydF4y2Ba.当假体的关节面在身体重量的载荷下相互移动时,就会产生磨损颗粒。它们启动以损伤相关分子模式激活、toll样受体信号转导、NALP3炎性小体和核因子κB (NFκB)为典型的生物反应,从而产生促炎细胞因子,包括白细胞介素1β (IL-1β)、IL-18、肿瘤坏死因子α (TNF-α)和C-C基序趋化因子配体20 (CCL20)。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.这促进了其他免疫细胞的招募,导致肉芽肿性慢性炎症的发展和假体周围滑膜样假膜的形成。巨噬细胞被认为在骨溶解的发病机制中起着至关重要的作用,因为它们是假体周围组织部位的主要细胞,是炎症细胞因子的主要来源,可以分化为骨吸收破骨细胞gydF4y2Ba2gydF4y2Ba.然而,不同类型的细胞,如成纤维细胞、树突状细胞和中性粒细胞也与骨溶解的发病机制有关gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.因此,种植体部位的慢性炎症环境对骨代谢产生负面影响,促进破骨细胞生成和骨吸收,导致种植体固定失效gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
减少破骨骨吸收活性或炎症发展的治疗靶点,包括双磷酸盐,NFκB配体受体激活物(RANKL)的单克隆抗体,以及促炎细胞因子(TNF-α和IL-1β)的抗体,均未能防止病理性骨丢失或延长植入物的寿命gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.这表明有必要为这一健康问题开发一种有效的治疗方法。尽管如此,越来越多的证据表明,控制植入物部位的慢性炎症将是一种有前途的治疗干预方法gydF4y2Ba7gydF4y2Ba.慢性炎症通常发生在最初的急性炎症由于免疫系统的促化解活性不足而不能有效化解时,这一过程被称为挫败化解。炎症的消退是一个活跃的过程,由内源性促消退介质严格协调,这些介质的作用不是免疫抑制剂,而是通过激活受影响组织中的稳态控制机制来促进炎症的消退gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.在这些分子中,膜联蛋白A1 (AnxA1)是膜联蛋白超家族的成员,主要由单核细胞和中性粒细胞释放,并与许多生物学过程有关,包括炎症、细胞内囊泡运输、白细胞迁移、组织生长和再生以及凋亡gydF4y2Ba11gydF4y2Ba.事实上,在广泛的实验模型中,包括心肌缺血损伤、中风、败血症、关节炎和多发性硬化症,都记录了AnxA1刺激内源性前化解途径导致组织修复和愈合的能力及其治疗效果gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
鉴于假体周围骨溶解是一种以持续性炎症为典型的慢性炎症性疾病,且促溶解介质可能恢复组织内稳态,我们探索了AnxA1在疾病病理生理学中的功能,并评估了其在实验性假体周围骨溶解模型中的治疗应用。我们的研究结果表明,AnxA1是一种潜在的治疗假体周围骨溶解和其他病理性骨吸收相关疾病的药物。gydF4y2Ba
结果gydF4y2Ba
溶骨性骨病变周围假体组织中AnxA1的检测gydF4y2Ba
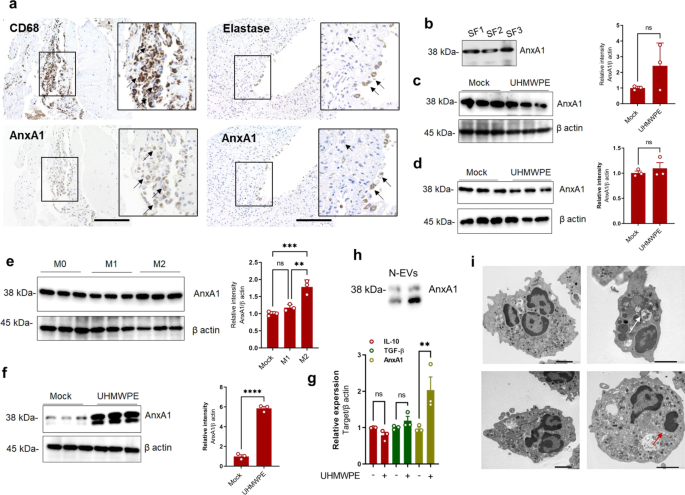
为了探索AnxA1在假体周围骨溶解中的作用,我们首先检查了AnxA1是否存在于三名接受全髋关节置换术翻修手术的患者的滑膜样组织(假囊)和滑膜液中。值得注意的是,在CD68和CD68中均检测到AnxA1gydF4y2Ba+gydF4y2Ba巨噬细胞和弹性蛋白酶gydF4y2Ba+gydF4y2Ba中性粒细胞来自假囊组织内的炎症区域,以及来自因无菌性松动而接受翻修手术的患者的滑液。gydF4y2Ba1gydF4y2Ba).CD68的gydF4y2Ba+gydF4y2Ba假体周围组织中巨噬细胞较多,弹性蛋白酶较少gydF4y2Ba+gydF4y2Ba在这些组织中检测到中性粒细胞(图;gydF4y2Ba1gydF4y2Ba).重要的是,大多数的AnxA1+细胞在假囊组织的衬里层被检测到(补充图。gydF4y2Ba1gydF4y2Ba).与这些观察结果一致,在CD68中检测到AnxA1gydF4y2Ba+gydF4y2Ba巨噬细胞和弹性蛋白酶gydF4y2Ba+gydF4y2Ba在碎片诱导的骨溶解小鼠模型中,中性粒细胞已浸润到颅骨组织(补充图。gydF4y2Ba1gydF4y2Ba).为了进一步评估植入磨损颗粒对细胞的激活与AnxA1产生的增加有关,超高分子量聚乙烯(UHMWPE)碎片处理刺激了人分化巨噬细胞、新分离的中性粒细胞和成纤维细胞样滑膜细胞(hFLS),然后进行Western blot分析。在UHMWPE碎片刺激的巨噬细胞或hFLS中,AnxA1的表达似乎没有显著增加(图2)。gydF4y2Ba1 c, dgydF4y2Ba).鉴于巨噬细胞是异质性的,假体周围组织中可能存在不同的表型,我们在分化的炎性和抗炎性巨噬细胞中检测了AnxA1的表达。在IL-4刺激的抗炎巨噬细胞(M2)中发现了AnxA1表达的增加(图4)。gydF4y2Ba1 egydF4y2Ba).与观察到的临床样本免疫组化染色一致,用UHMWPE碎片刺激的中性粒细胞表现出AnxA1的表达显著增加,但抗炎分子没有增加(图。gydF4y2Ba1 f, ggydF4y2Ba).在UHMWPE碎片刺激过的中性粒细胞(n - ev)细胞外载体中进一步检测到AnxA1(图)。gydF4y2Ba1 hgydF4y2Ba).为了证实中性粒细胞在植入物磨损碎片存在时是活跃的这一发现,新分离的人中性粒细胞被超高分子量聚乙烯(UHMWPE)碎片刺激2小时,然后通过透射电子显微镜(TEM)进行形态学检查。有趣的是,透射电镜检查显示,受刺激的中性粒细胞表现出典型的激活吞噬细胞的形态特征,如细胞延伸、细胞质嗜蓝颗粒和大吞噬溶酶体的存在(图2)。gydF4y2Ba1我gydF4y2Ba).凋亡中性粒细胞也存在,特征性染色质凝聚可见一斑。gydF4y2Ba1我gydF4y2Ba).这些结果表明,AnxA1存在于假体周围组织中,通过巨噬细胞和中性粒细胞表达,并可能在磨损碎片引起的炎症和病理性骨吸收中发挥作用。gydF4y2Ba
一个gydF4y2Ba通过免疫组化染色,特异性抗体靶向AnxA1、CD68巨噬细胞和中性粒细胞弹性蛋白酶检测翻修手术患者滑膜组织中的AnxA1。箭头表示CD68gydF4y2Ba+gydF4y2BaAnxA1gydF4y2Ba+gydF4y2Ba(左面板)或ElastasegydF4y2Ba+gydF4y2BaAnxA1gydF4y2Ba+gydF4y2Ba细胞。比例尺为100微米。gydF4y2BabgydF4y2BaWestern blot检测翻修手术患者滑液中AnxA1的表达。gydF4y2BacgydF4y2BaWestern blotting检测UHMWPE碎片刺激巨噬细胞中AnxA1的表达。右图显示频带密度的量化。gydF4y2BadgydF4y2BaUHMWPE碎片刺激hFLS中AnxA1的表达。右图显示频带强度的量化。gydF4y2BaegydF4y2BaAnxA1在不同巨噬细胞表型中的表达,包括体外产生的炎症M1 (LPS + IFN-γ)和抗炎M2 (IL-4)细胞。右图表示频带强度的量化。gydF4y2BafgydF4y2Ba超高分子量聚乙烯碎片刺激中性粒细胞中AnxA1的检测。右图表示频带强度的量化。结果表示三个重复的相对条带强度值±SEM的平均值。双尾学生法测定两组间有显著性差异gydF4y2BatgydF4y2Ba对多组进行单因素方差分析,然后采用Tukey的多重比较程序。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001和gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。gydF4y2BaggydF4y2Ba用qRT-PCR分析UHMWPE碎片刺激人中性粒细胞中AnxA1和抗炎细胞因子的基因表达。结果表示3只小鼠的相对表达值的平均值±SEM。两组之间的显著差异是由双尾学生确定的gydF4y2BatgydF4y2Ba测试。**gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BahgydF4y2Ba碎片刺激中性粒细胞(n - ev)胞外囊泡中AnxA1的检测gydF4y2Ba我gydF4y2Ba超高分子量聚乙烯碎片刺激中性粒细胞形态特征的透射电镜分析。白色箭头表示吞噬作用,红色箭头表示染色质凝聚。比例尺为2 μm。源数据作为源数据文件提供。gydF4y2Ba
AnxA1是一种潜在的磨损碎片引起的炎症和病理性骨吸收的抑制剂gydF4y2Ba
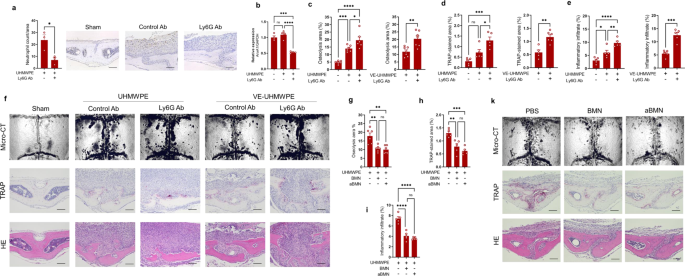
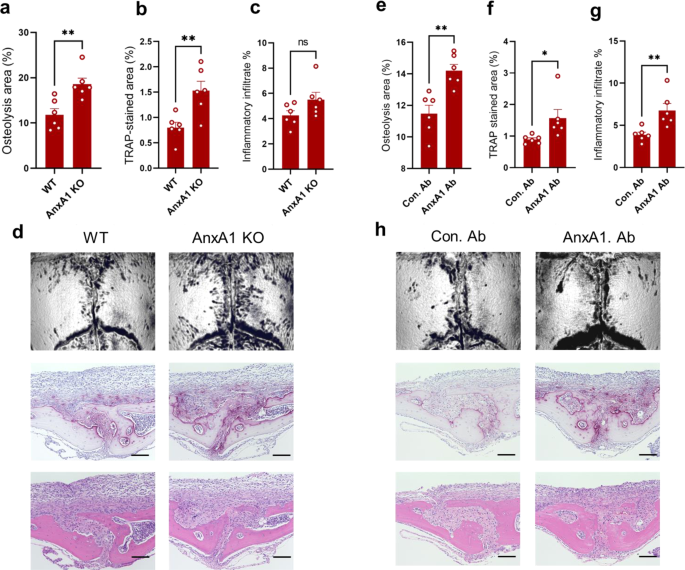
为了验证AnxA1可能在假体周围骨溶解的病理生理学中具有抑制作用的假设,我们试图通过在小鼠碎片诱导的骨溶解模型中使用中性粒细胞的消耗和过过性转移来操纵AnxA1的局部表达水平。采用Ly6G单克隆抗体在聚乙烯碎片诱导的骨溶解模型中消耗中性粒细胞。中性粒细胞减少小鼠颅骨骨组织中AnxA1的表达明显下降(图。gydF4y2Ba2 a, bgydF4y2Ba).还应该注意的是,显微ct显示,与假手术小鼠和对照组小鼠相比,中性粒细胞减少小鼠出现了明显更大的骨溶解病变(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).组织学上,这些小鼠在颅骨中trap阳性区域和炎症浸润显著增加(图2)。gydF4y2Ba2 d-fgydF4y2Ba).这些增加伴随着颅骨组织中破骨细胞分化因子表达的显著升高(补充图)。gydF4y2Ba2gydF4y2Ba).此外,骨髓来源的中性粒细胞在UHMWPE碎片植入后被过继转移到颅骨上。与接受PBS注射的对照组小鼠相比,这些小鼠的骨溶解病变和trap染色区域显著减少(图2)。gydF4y2Ba2 g-kgydF4y2Ba).与组织学观察一致,炎症因子的表达显著减少,包括gydF4y2Ba肿瘤坏死因子-αgydF4y2Ba,gydF4y2Bail - 1βgydF4y2Ba,gydF4y2Bail - 6gydF4y2Ba在中性粒细胞处理的小鼠中,UHMWPE颗粒周围形成的肉芽肿组织(补充图。gydF4y2Ba3.gydF4y2Ba).为了进一步证实这些发现,制造了anxa1缺失的小鼠,并在UHMWPE碎片植入后评估颅骨的骨溶解病变。值得注意的是,缺乏anxa1的小鼠(gydF4y2BaAnxA1gydF4y2BaKO)与野生型小鼠相比,在颅骨骨组织中表现出明显更大的骨溶解病变和更大的trap染色区域(图。gydF4y2Ba3模拟gydF4y2Ba).与这些结果一致,这些小鼠在炎性细胞因子的表达中表现出显著升高,包括gydF4y2Ba肿瘤坏死因子-αgydF4y2Ba,gydF4y2Bail - 1βgydF4y2Ba,gydF4y2Bail - 6gydF4y2Ba在UHMWPE碎片周围形成的肉芽肿组织中(补充图。gydF4y2Ba4 gydF4y2Ba).鉴于AnxA1以分泌蛋白的形式存在或存在于EVs中,我们接下来检测了一种特异性抗体对分泌的AnxA1进行功能阻断,对UHMWPE碎片诱导的骨溶解模型中骨溶解病变发展的影响。在UHMWPE碎片植入后,局部注射AnxA1中和抗体导致颅骨溶骨病变与对照组相比显著增加(图2)。gydF4y2Ba3情况gydF4y2Ba).这些结果表明,分泌的AnxA1是假体周围组织炎症和病理性骨吸收的潜在抑制剂。gydF4y2Ba
一个gydF4y2BaLy6G抗体处理小鼠和对照组小鼠的中性粒细胞计数。UHMWPE碎片植入抗体处理后颅骨肉芽肿组织中性粒细胞的免疫组化检测用Ly6G抗体处理减少了Elastase阳性细胞的数量。结果表示3只小鼠的相对表达值的平均值±SEM。用双尾学生量表测定两组间有显著性差异gydF4y2BatgydF4y2Ba测试。比例尺为100微米。gydF4y2BabgydF4y2BaqRT-PCR检测中性粒细胞缺失小鼠颅骨组织中AnxA1的表达。结果表示4只小鼠的相对表达值的平均值±SEM。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba中性粒细胞耗竭放大了UHMWPE和VE-UHMWPE聚乙烯碎片在小鼠模型中引发的骨溶解活性。gydF4y2BacgydF4y2Ba微ct定量分析颅骨骨组织溶解区。结果代表6只小鼠的平均值±SEM。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba颅骨切片中trap染色区和炎症浸润的定量研究。用双尾学生量表测定两组间有显著性差异gydF4y2BatgydF4y2Ba对多组进行单因素方差分析,然后采用Tukey的多重比较程序。gydF4y2BafgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。gydF4y2BaggydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba骨髓中性粒细胞过继转移(BMN)抑制UHMWPE碎片引发的骨溶解活性。从供体小鼠中分离BMN,然后在UHMWPE碎片植入后注入颅骨。转移细胞不受刺激(BMN)或受TNF-α刺激(aBMN)。gydF4y2BaggydF4y2Ba微ct定量分析颅骨骨组织溶解区。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba颅骨切片中trap染色区和炎症浸润的定量研究。结果表示6只小鼠的值±SEM的平均值。采用单因素方差分析(one-way ANOVA)分析各组间差异是否显著,然后采用Tukey多重比较法。gydF4y2BakgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001, ****gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。源数据作为源数据文件提供。gydF4y2Ba
一个gydF4y2Ba显微ct分析UHMWPE植入野生型WT和anxa1缺陷小鼠颅骨骨组织溶出区。结果代表6只小鼠的平均值±SEM。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba颅骨切片中trap染色区和炎症浸润的定量研究。结果代表6只小鼠的平均值±SEM。gydF4y2BadgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。gydF4y2BaegydF4y2Ba接受功能阻断抗体(AnxA1)的小鼠颅骨骨组织溶出区域的定量分析。Ab)或对照(Con. Ab)经显微ct分析。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Baab处理小鼠颅骨切片中trap染色区和炎症浸润的定量。结果代表6只小鼠的平均值±SEM。gydF4y2BahgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。用双尾学生量表(two-tailed Student’s)测定两组间有显著差异gydF4y2BatgydF4y2Ba测试。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001。Ns表示差异不显著。源数据作为源数据文件提供。gydF4y2Ba
AnxA1通过抑制NFκB通路激活和促进PPAR-γ信号通路调控炎症和骨吸收gydF4y2Ba
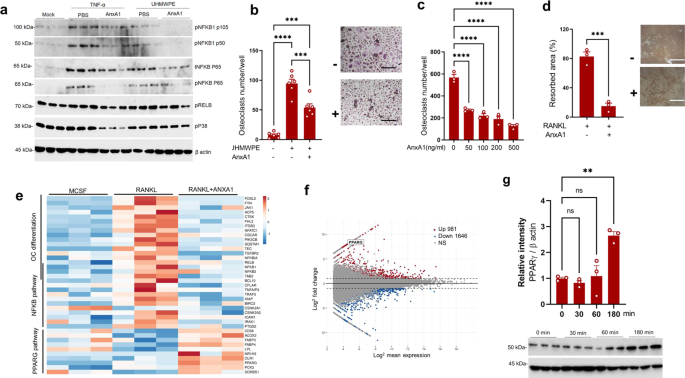
为了进一步了解AnxA1如何调节炎症和病理性骨吸收的机制,我们检测了AnxA1对转录因子的影响,这些转录因子参与了人类巨噬细胞培养中炎症反应的发展和破骨细胞的分化。重组人AnxA1在浓度为100 ng/mL时,可以抑制磷酸化的NFκB1 (p105/50)、NFκB (P65)、ERK1/2的表达,但在重组TNF-α和UHMWPE碎片刺激24小时后的巨噬细胞中,不抑制RelB和P38的表达。gydF4y2Ba4gydF4y2Ba和补充图。gydF4y2Ba5gydF4y2Ba).在UHMWPE碎片刺激培养6天的巨噬细胞中,AnxA1处理也显著减少了trap阳性细胞的数量(图2)。gydF4y2Ba4 bgydF4y2Ba).更有趣的是,将AnxA1添加到rankl刺激的人单核细胞中,会导致trap阳性细胞数量和牙本质切片上骨吸收面积的显著减少(图2)。gydF4y2Ba4 c, dgydF4y2Ba).这些综合结果表明,Anxa1作为一种有效的破骨细胞形成抑制剂,由骨科植入物中聚乙烯磨损碎片引发。为了进一步了解AnxA1抑制破骨细胞分化的机制,从三名健康供体中收集人类单核细胞,用RANKL刺激或不加AnxA1,然后进行RNA测序。生物信息学分析显示,AnxA1降低了破骨细胞分化和NFκB通路中聚集的基因的表达,并增强了PPAR-γ通路中聚集的基因的表达(图。gydF4y2Ba4 egydF4y2Ba).感兴趣的,gydF4y2BaPPAR -γgydF4y2Ba在最高调控基因列表中,其fold change为7.16(图;gydF4y2Ba4 fgydF4y2Ba).Western blot分析证实PPAR-γ表达增加,用AnxA1刺激巨噬细胞180 min后,PPAR-γ表达显著升高。gydF4y2Ba4 ggydF4y2Ba).考虑到甲酰基肽受体2 (FPR2)是AnxA1传递其生物学功能的主要受体,我们检测了在用FPR2选择性拮抗剂(WRW4)预处理的AnxA1刺激的巨噬细胞中PPAR-γ的表达增加。值得注意的是,在WRW4预处理过的巨噬细胞中,AnxA1促进PPAR-γ表达的能力略有降低。gydF4y2Ba6gydF4y2Ba).这些综合结果表明,AnxA1可能通过激活PPAR-γ通路作为炎症和病理性骨吸收的潜在抑制因子。gydF4y2Ba
一个gydF4y2BaAnxA1对参与炎症和破骨细胞分化的转录因子表达的影响。gydF4y2BabgydF4y2Ba在UHMWPE碎片刺激巨噬细胞中,AnxA1对破骨细胞形成的抑制作用。结果为6个样本的平均值±SEM。右图为TRAP染色破骨细胞代表性图像。比例尺为100微米。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaAnxA1对破骨细胞分化和骨吸收的抑制作用在不同浓度的AnxA1存在下,用RANKL刺激巨噬细胞。gydF4y2BadgydF4y2Ba骨吸收实验中rankl刺激巨噬细胞在100 ng/mL浓度的AnxA1中形成的骨吸收区域(点蚀)的定量。结果为3个样本的平均值±SEM。用双尾学生量表测定两组间有显著性差异gydF4y2BatgydF4y2Ba对多组进行单因素方差分析,然后采用Tukey的多重比较程序。比例尺为200微米。gydF4y2BaegydF4y2BaRANKL和AnxA1刺激巨噬细胞中上调基因KEGG途径富集分析的热图。gydF4y2BafgydF4y2BaRANKL和AnxA1刺激巨噬细胞中显著上调或下调基因转录表达水平的MA图分析(gydF4y2BapgydF4y2Ba< 0.05) (gydF4y2BangydF4y2Ba= 3)。gydF4y2BaggydF4y2BaWestern blot检测不同时间点AnxA1刺激巨噬细胞PPAR-γ的变化左图为检测条带相对强度的定量,结果为3个样品的均值±SEM。采用单因素方差分析(one-way ANOVA),然后采用Tukey多重比较(multiple-comparison procedure)。**gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001, ****gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。源数据作为源数据文件提供。gydF4y2Ba
鉴于成纤维细胞和成骨细胞在颗粒磨损碎片引发的假体周围骨溶解的发展过程中起着至关重要的作用,我们进一步在体外评估了AnxA1对这些细胞的影响。值得注意的是,TNF-α刺激的滑膜细胞中炎症介质的表达被AnxA1显著抑制(补充图。gydF4y2Ba7一个gydF4y2Ba).此外,Anxa1治疗显著增强了TNF-α刺激的成骨细胞中成骨合成代谢因子的表达(补充图。gydF4y2Ba7 bgydF4y2Ba).这些结果表明,AnxA1对炎症部位的多种细胞类型产生有益影响。gydF4y2Ba
AnxA1治疗假体周围骨溶解和病理性骨吸收的药理潜力gydF4y2Ba
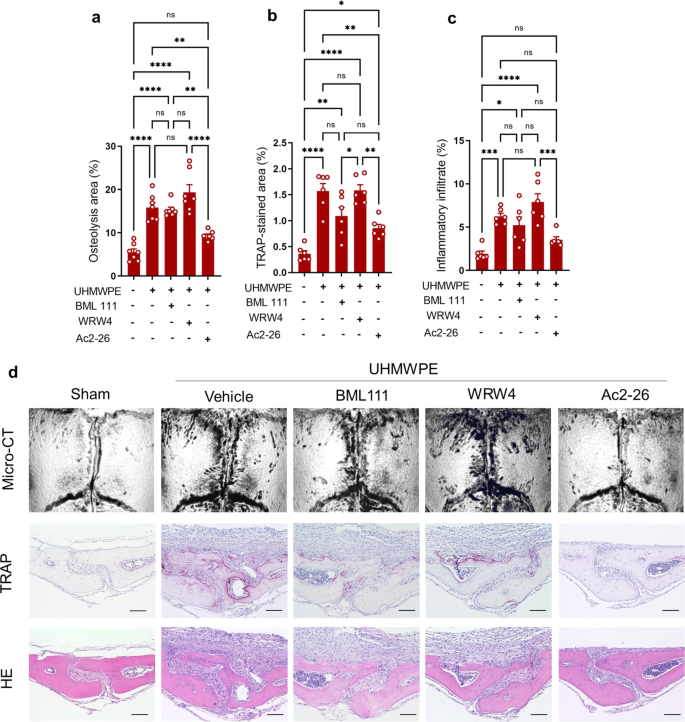
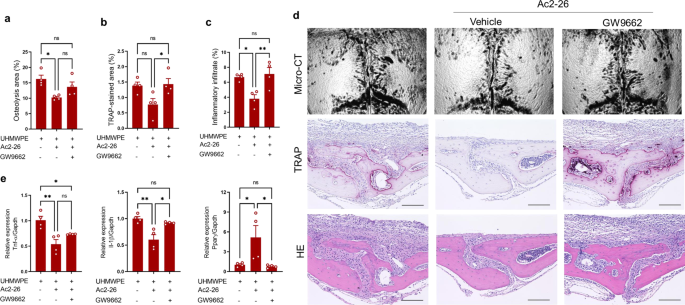
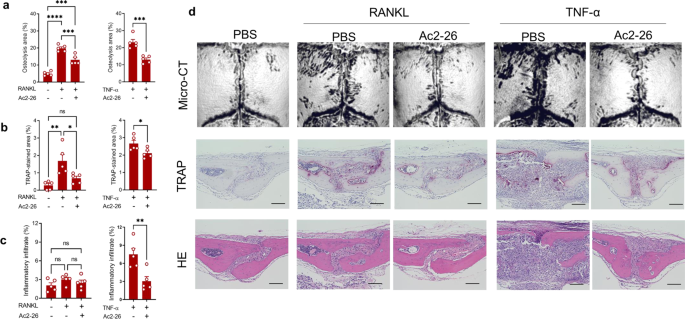
鉴于在许多炎症疾病模型中,AnxA1 n端衍生肽Ac2-26与全长的AnxA1具有相同的促溶解特性,我们使用小鼠实验模型评估了模拟肽Ac2-26治疗假体周围骨溶解的治疗效果。Ac2-26促进PPAR-γ表达的能力首次在THP1巨噬细胞中得到证实(补充图。gydF4y2Ba8gydF4y2Ba).此外,UHMWPE颗粒植入颅骨组织,局部注射Ac2-26,连续5天。另外两组小鼠连续5天使用甲酰基肽受体2 (FPR2)的选择性激动剂BML111,或在第1、3和5天使用FPR2的选择性拮抗剂WRW4。有趣的是,与注射载体的对照组相比,接受Ac2-26的小鼠表现出明显减少的骨溶解病变、TRAP染色和炎症(图2 - 26)。gydF4y2Ba5模拟gydF4y2Ba).在这些小鼠中,UHMWPE颗粒周围肉芽肿组织中炎症因子的基因表达显著降低(补充图。gydF4y2Ba9gydF4y2Ba).相比之下,BML111和WRW4治疗均未改变/加剧UHMWPE颗粒诱导的骨溶解病变(图2)。gydF4y2Ba5 a - cgydF4y2Ba).我们的研究结果表明,AnxA1 n端肽Ac2-26可能为聚乙烯颗粒引发的假体周围骨溶解提供一种新的治疗剂。为了进一步了解Anxa1的治疗机制,接受UHMWPE颗粒植入的小鼠用Ac2-26模拟肽和PPAR-γ拮抗剂(GW9662)治疗。值得注意的是,在接受GW9662的小鼠中,Ac2-26的治疗效果被取消了。gydF4y2Ba6模拟gydF4y2Ba),提示Anxa1的治疗机制与PPAR-γ通路的激活之间存在相关性。在gw9662处理的小鼠UHMWPE颗粒周围的肉芽肿组织中,炎症细胞因子的表达升高,同时PPAR-γ的表达降低(图9662处理小鼠UHMWPE颗粒周围肉芽肿组织中炎症细胞因子的表达升高。gydF4y2Ba6 egydF4y2Ba).为了进一步证明AnxA1在病理性骨吸收相关疾病中的潜在治疗应用,使用Ac2-26模拟肽治疗TNF-α-和rankl诱导的骨丢失模型。在两个模型中,Ac2-26肽治疗导致骨损失和trap染色区域显著减少(图2 - 26)。gydF4y2Ba7 a、bgydF4y2Ba).在TNF-α诱导的炎性骨溶解模型中,该治疗也能显著抑制炎性细胞的浸润(图。gydF4y2Ba7模拟gydF4y2Ba).从这些结果中,我们得出结论,AnxA1抑制TNF-α-和RANKL诱导的病理性骨吸收,被称为假体周围骨溶解的主要破骨因子。gydF4y2Ba
植入碎片后,用BML111 (1 mg/kg)、WRW4 (2.5 mg/kg)和Ac2-26 (1 mg/kg)处理小鼠颅骨。gydF4y2Ba一个gydF4y2Ba微ct定量分析颅骨骨组织溶解区。结果代表7只小鼠的平均值±SEM。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba颅骨组织中trap染色区和炎症浸润的定量研究。采用单因素方差分析(one-way ANOVA),然后采用Tukey多重比较(multiple-comparison procedure)。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001, ****gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。gydF4y2BadgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。源数据作为源数据文件提供。gydF4y2Ba
植入碎片后,小鼠每日局部注射AnxA1 (1 mg/kg),腹腔注射GW9662 (1 mg/kg)。gydF4y2Ba一个gydF4y2Ba微ct定量分析颅骨骨组织溶解区。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba颅骨组织中trap染色区和炎症浸润的定量研究。gydF4y2BadgydF4y2Ba显微ct代表性图像及TRAP、H&E染色骨组织组织学观察。比例尺为100微米。gydF4y2BaegydF4y2Ba用qRT-PCR分析UHMWPE碎片周围肉芽肿组织炎症分子的基因表达。结果代表4只小鼠的平均值±SEM。采用单因素方差分析(one-way ANOVA),然后采用Tukey多重比较(multiple-comparison procedure)。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001。Ns表示差异不显著。源数据作为源数据文件提供。gydF4y2Ba
颅骨局部注射细胞因子4天,第5天定量骨侵蚀。gydF4y2Ba一个gydF4y2Ba微ct定量分析颅骨骨组织溶解区。结果代表5只小鼠的平均值±SEM。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba颅骨切片中trap染色区和炎症浸润的定量研究。用双尾学生量表测定两组间有显著性差异gydF4y2BatgydF4y2Ba多组间采用单因素方差分析(one-way ANOVA),然后采用Tukey多重比较法(multiple-comparison procedure),表示为*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001, ****gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。gydF4y2BadgydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。源数据作为源数据文件提供。gydF4y2Ba
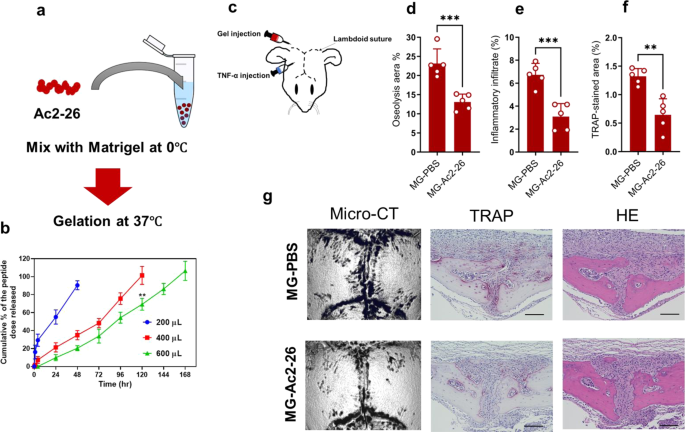
鉴于这些发现的临床相关性,我们开发了一种ac2 - 26混合基质,允许局部控制肽释放到颅骨上,并在tnf诱导的骨丢失模型中进行评估。Matrigel是一种天然水凝胶,已成功用于研究细胞迁移、血管生成和蛋白质/肽的传递。该肽被配制成一种热响应性材料,该材料在较低温度下可溶解,但在正常体温(37°C)下原位转变为半固态水凝胶(图2)。gydF4y2Ba8gydF4y2Ba).期望的配方将通过一周的时间跨度产生肽的控制释放模式,因此导致持续和延长的效果(图。gydF4y2Ba8 a、bgydF4y2Ba).值得注意的是,单次给药ac2 - 26混合Matrigel到颅骨(在lambdoid缝合之外)缓解了TNF-α给药引起的骨溶解病变和病理性骨吸收(图。gydF4y2Ba8 c ggydF4y2Ba).从Matrigel处理得到的结果与模拟肽Ac2-26连续4天的处理结果相当。这些集体数据证明了AnxA1在假体周围骨溶解和病理性骨吸收相关疾病中的潜在治疗和可转化应用。gydF4y2Ba
一个gydF4y2Ba示意图显示了制备封装Ac2-26肽的Matrigel的过程。gydF4y2BabgydF4y2Ba在37°C和pH 7.4条件下,从含有不同数量Matrigel的水凝胶中体外释放肽。结果代表独立实验的平均值±SEM。**gydF4y2BapgydF4y2Ba< 0.001显著性由双尾学生的显著性决定gydF4y2BatgydF4y2Ba测试。gydF4y2BacgydF4y2BaSchematigydF4y2BacgydF4y2Ba注射凝胶和细胞因子示意图。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaMatrigel包封Ac2-26对TNF-α诱导骨丢失模型的治疗作用。MG-PBS为对照凝胶,MG-Ac2-26为试验凝胶。gydF4y2BadgydF4y2Ba微ct分析颅骨骨组织溶解区定量。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba颅骨组织中trap染色区和炎症浸润的定量研究。两组之间的显著差异是由双尾学生确定的gydF4y2BatgydF4y2Ba测试。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001。结果代表5只小鼠的平均值±SEM。gydF4y2BaggydF4y2Ba显微ct代表性图像及TRAP和H&E染色骨切片组织学观察。比例尺100 μ m。源数据作为源数据文件提供。gydF4y2Ba
讨论gydF4y2Ba
促进与假体周围骨溶解相关的炎症的消退是一种有前途的治疗策略,因为这一过程是恢复组织稳态的基本机制gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.因此,我们探索了AnxA1在假体周围骨溶解中的前溶解功能,并评估了其在实验性假体周围骨溶解模型中的治疗潜力。gydF4y2Ba
在松动种植体周围组织的巨噬细胞和中性粒细胞中,AnxA1表达量较高。我们进一步的研究结果表明,在小鼠磨损碎片诱导的骨溶解模型中,AnxA1的缺失或阻断会导致严重的骨溶解病变的发展,这表明AnxA1在炎症性骨溶解中具有保护功能。体外实验结果表明,重组蛋白AnxA1通过降低NFκB转录因子的表达,对巨噬细胞的炎症反应和rankl诱导的破骨细胞分化具有抑制作用。这些发现似乎与早期研究报告的结果一致,该研究显示,在关节炎模型中,AnxA1对炎症和破骨细胞形成具有抑制活性gydF4y2Ba13gydF4y2Ba.值得注意的是,经AnxA1处理的巨噬细胞PPAR-γ表达升高,NFκB转录因子水平降低。与我们的研究结果一致,PPAR-γ的激活已被报道为通过降低NFκB p65的转录活性来治疗炎症性疾病和癌症的一种有前途的方法gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.此外,PPAR-γ的激活促使单核细胞极化为具有抗炎特性的M2巨噬细胞,并抑制RANKL-和TNF-α介导的破骨细胞分化gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.在一项相关研究中,有报道称IL-4通过激活PPAR-γ和抑制NFκB通路的激活来抑制rankl诱导的破骨细胞形成gydF4y2Ba18gydF4y2Ba.因此,AnxA1可能的抑制作用可能是由于其能够降低NFκB信号的激活,NFκB信号被认为是巨噬细胞促炎功能和破骨细胞骨吸收功能的正向调节因子。抑制和基因缺失实验表明,NFκB的激活是慢性炎症性疾病(包括炎症性肠病、类风湿性关节炎和哮喘)的中心介导因子。典型的NFκB通路包括IKKα和IKKβ两个催化亚基的激活,以及IKKγ的调节亚基(NEMO)。IKK磷酸化IκBα,导致IκBα在蛋白酶体中降解,导致NF-κB1 (p100/50)、NF-κB2 (p52)、RelA (p65)、RelB和c-Rel等可诱导转录因子快速核转位,这些转录因子与大量炎症基因的诱导有关。类似地,IKKβ活性参与破骨细胞前体中的RANKL信号传导,导致巨噬细胞分化为破骨细胞gydF4y2Ba19gydF4y2Ba.基因操纵实验强调了IKKβ在炎症和破骨细胞发生发展中的重要作用。因此,NF-κB抑制剂,即靶向IKK蛋白家族的抑制剂,在治疗与骨重塑受损过程相关的炎症性疾病和骨病(如类风湿关节炎和炎性骨溶解)方面显示出巨大潜力gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.gydF4y2Ba
在体外和体内模型中,AnxA1对炎症性骨溶解的治疗作用都很明显。我们的研究结果表明,在颅骨骨溶解模型中,AnxA1抑制局部炎症反应、免疫细胞浸润和骨吸收破骨细胞活性。AnxA1大量存在于炎性分泌物中,已知通过激活前分解相受体FPR2作为抗炎介质。AnxA1是钙依赖性磷脂结合蛋白膜联蛋白超家族的成员,在中性粒细胞和其他先天免疫细胞中大量表达,并通过指导白细胞吞噬、分化、迁移和凋亡作为炎症化解分子。AnxA1能够开启c-Jun N-terminal kinase (JNK)-信号通路,导致IL-10的产生,并通过促进Smad活性增强TGF-β信号通路gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.这些作用导致炎症细胞因子的产生减少,并将巨噬细胞的极化重定向到抗炎的M2表型,有利于组织中的化解/修复阶段gydF4y2Ba26gydF4y2Ba.在2020年的一项相关研究中,McArthur等人报道了AnxA1/AMPK轴是诱导产生骨骼肌损伤再生所需的促分解巨噬细胞表型的重要途径gydF4y2Ba26gydF4y2Ba.为了支持这一概念,AnxA1敲除小鼠在受影响的组织中显示出严重的病理损伤,这与炎症反应的增加和磷酸化的ERK-1/2和NF-κB p65的高水平有关gydF4y2Ba27gydF4y2Ba.同样值得注意的是,罗格列酮激活PPAR-γ可通过调节AMPK活性对小鼠酒精性脂肪肝产生药理作用,这表明PPAR-γ与AMPK信号通路存在相关性gydF4y2Ba28gydF4y2Ba.与这一观点一致,resolvin D1,相关前化解分子的激活,抑制炎症和NF-κB信号通路,其机制依赖于PPAR-γ激活gydF4y2Ba29gydF4y2Ba.这些发现解释了在磨损碎片诱导的骨溶解模型中注射PPAR-γ拮抗剂后,AnxA1治疗效果的丧失。我们收集的数据表明,AnxA1/PPAR-γ信号通路可能通过减轻种植体磨损碎片引起的炎症和病理性骨吸收,在假体周围骨溶解中发挥调节作用。gydF4y2Ba
AnxA1及其肽Ac2-26的治疗潜力也已在实验模型中得到广泛证明,如过敏性结膜炎和缺血性中风模型gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.已知AnxA1及其肽Ac2-26的药理特性依赖于它们激活FPR2信号的能力,这使其成为控制慢性炎症性疾病的有前途的抗炎和促化解治疗靶点。然而,有一系列证据表明Ac2-26通过下调α4β1整合素及其亲和力和价性抑制细胞粘附和迁移,而不改变其细胞表面表达gydF4y2Ba30.gydF4y2Ba.同样,AnxA1通过降低促炎细胞因子的水平和调节白细胞和血小板与大脑微血管内皮细胞的粘附/聚集来保护大脑免受血栓炎症的影响gydF4y2Ba31gydF4y2Ba因此,Ac2-26在炎症性骨溶解中的治疗作用可能是由于它能够减少整合素依赖的单核细胞粘附和炎症发展和破骨细胞形成所必需的迁移gydF4y2Ba33gydF4y2Ba.根据这一假设,无论是激动剂(BML111)激活FPR2,还是拮抗剂(WRW4)阻断FPR2,对碎片植入引起的病理性骨损伤均无显著影响,这表明Ac2-26的治疗潜力与FPR2信号通路无关。我们关于AnxA1潜在治疗用途的有希望的发现刺激了含有Ac2-26模拟肽的控释水凝胶的开发。纳米医学方法具有临床转译的潜力,因为它可以保护短肽在体内不被蛋白质水解,并且可以在不需要重复注射的情况下将货物运送到损伤部位。使用含有Ac2-26的Matrigel治疗可显著减少病理性骨吸收和炎症。所获得的结果与模拟肽治疗的结果相当,这证实了Ac2-26在治疗假体周围骨溶解和病理性骨吸收相关疾病中的应用。通过Ac2-26的最佳控释配方,成功开发了一种类似的方法用于真皮伤口修复应用gydF4y2Ba34gydF4y2Ba.此外,据报道,允许Ac2-26缓慢释放的纳米颗粒可以减少酶聚糖诱导的腹膜炎的组织损伤,并在高胆固醇血症小鼠中预防晚期动脉粥样硬化gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.进一步的研究,包括开发更安全的用于输送Ac2-26的纳米材料,有望在临床应用中具有巨大潜力。gydF4y2Ba
总之,本研究揭示了预防种植体失败的创新治疗方法的新策略。在假体周围骨溶解过程中,AnxA1/PPAR-γ轴似乎在减轻炎症和病理性骨吸收中发挥重要作用。我们的研究强调了AnxA1作为预防种植体松动的临床可转化治疗剂。gydF4y2Ba
方法gydF4y2Ba
研究批准gydF4y2Ba
人体样本的研究方案由北海道大学医院研究伦理审查委员会(批准号:016-0002)批准,并获得所有捐赠者的知情同意。动物实验的程序是根据北海道大学医学研究生院动物护理和使用委员会批准的协议(编号17-0085 & 18-0171)进行的。实验期间,将所有小鼠置于SPF级条件下,温度控制在21-22℃,湿度分别为40%和50%,并在恒定的12小时明暗室中进行。gydF4y2Ba
滑膜组织免疫染色gydF4y2Ba
3例全髋关节置换术患者(男1例60岁,女2例54岁和59岁)滑膜组织用石蜡包埋,3 μm切片进行免疫组化染色(IHC)。所有样本均未出现局部感染的临床征像,血清CRP低于0.07 mg/dl。对照组织取自行髋关节置换术的髋关节骨性关节炎患者(女性,64岁)。切片脱蜡,用蛋白酶K处理5分钟(Dako, CA, USA)进行抗原提取,然后用马血清阻断1小时。切片用髓过氧化物酶一抗(MPO: JM10-58, 1:200稀释,Novus Biologicals,美国)、中性粒细胞弹性酶(ab68672, 1:200稀释,Abcam,剑桥,英国)、CD68 (KP1,克隆PG-M1, M0876: 1:200稀释,Dako Agilent,美国)和AnxA1 (GTX113329;1:200稀释,GeneTex, CA, USA)过夜,然后用三-缓冲盐水缓冲液(TBS)清洗三次。用vecastain Elite ABC试剂盒扩增信号,检测辣根过氧化物酶(HRP) (Vector Laboratories, Burlingame, USA),然后用苏木精反染色检测细胞核。gydF4y2Ba
磨屑处理gydF4y2Ba
由原生超高分子量聚乙烯(UHMWPE)或其维生素e混合材料(ve -超高分子量聚乙烯)(Teijin Nakashima medical,冈山,日本)髋关节植入物的承载材料产生的预制磨损颗粒,制备的尺寸范围为0.1-100微米,如我们早期研究中所述gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.简单地说,GUR1020粉末(Celanese Japan, Tokyo, Japan)和与0.3 wt% dl-α-生育酚(Eisai, Tokyo, Japan)混合的GUR1050粉末分别采用直接压缩成型技术制备了原始UHMWPE和VE-UHMWPE的块状材料。之后,使用多珠冲击器(Yasui Kikai,大阪,日本)以3500转/分的速度粉碎制造的散装材料,然后使用环氧乙烷气体(EOG)灭菌器(Eogelk-SA-H160,大阪,日本)灭菌。颗粒尺寸的等效圆直径使用图像分析仪Morphologi G3 (Malvern Instruments,伍斯特,英国)确定。样品尺寸为0.1-100µm,使用tox sensor Single Test Kit (Genscript, Piscataway, NJ, USA)检测不含内毒素。gydF4y2Ba
中性粒细胞培养和刺激gydF4y2Ba
使用含有ACD的BD Vacutainer管(Becton, Dickinson and Company, NJ, USA)从三名没有炎症疾病、关节疾病和全关节置换术史的健康亚洲捐赠者中收集人类外周血。使用Ficoll-Paque™PLUS (GE Healthcare)分离人类中性粒细胞,然后将其放入MACSxpress中性粒细胞分离试剂盒(Miltenyi Biotec)。美国)。通过对吉姆萨染色涂片进行血细胞计数鉴别,确认分离细胞的纯度(>97%)。新鲜分离的中性粒细胞1 × 10gydF4y2Ba6gydF4y2Ba被播种到聚d-赖氨酸涂层的孔中,并以密度为0.1 mg/cm的超高分子量聚乙烯碎片刺激gydF4y2Ba3.gydF4y2Ba在最低必要培养基Eagle (MEM, Sigma)中加入10%热灭活胎牛血清(FBS, Nichirei Biosciences INC, Tokyo, Japan)和5% mg/L青霉素/链霉素溶液(Wako, Japan),在37°C含5% CO的潮湿气氛中孵育2小时gydF4y2Ba2gydF4y2Ba使用反向培养体系gydF4y2Ba3.gydF4y2Ba.为了分离受刺激中性粒细胞的细胞外囊泡(ev),新鲜分离的中性粒细胞4 × 10gydF4y2Ba6gydF4y2Ba用UHMWPE碎片刺激,PBS稀释细胞悬液(总样品量为10 mL), 400 g离心5 min。上清液以2000 g离心10分钟,然后通过0.45 μ m注射器过滤器(Advantec INC., CA, USA)。然后在10万下对上清液进行超离心分离evgydF4y2BaggydF4y2Ba1小时。用PBS清洗成球的ev,在100000 g下再次离心1小时。所有步骤都在4°C下进行。将颗粒悬浮在50µl PBS中,然后进行Western blot分析。用重组TNF-α刺激细胞(Biolegend, San Diego, USA)作为阳性对照。透射电镜检查时,用冷PBS清洗UHMWPE碎片培养的中性粒细胞,并固定在1.5%甲醛和1%戊二醛的碳酸钙缓冲液中(pH为7.4)。然后用卡妥酸缓冲液漂洗细胞,在1%四氧化锇中重悬2小时,然后用卡妥酸缓冲液漂洗。细胞在分级乙醇系列中干燥,然后包埋在环氧树脂中。切片在室温下用2%的乙酸铀酰孵育10分钟,然后用DW冲洗,用雷诺兹柠檬酸铅染色(Sigma)染色6分钟。中性粒细胞用日立H-7100透射电子显微镜在80 kV(杰姆-1400,Plus Nihon Denshi,东京,日本)下观察。gydF4y2Ba
巨噬细胞刺激和破骨细胞分化及其功能测定gydF4y2Ba
通过密度梯度离心(Ficoll-PaqueTM PLUS: GE Healthcare, Waukesha, WI, USA)从健康献血者的血液样本中分离出人原代单核细胞,然后使用MACS Pan单核细胞分离试剂盒(Miltenyi Biotec, Auburn, CA, USA)进行处理。巨噬细胞和破骨细胞的分化及相关功能测定基本与既往研究一致gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.将附着的细胞在添加10%热- fcs、5% mg/l青霉素/链霉素溶液和5% l -谷氨酰胺的MEM中培养,在37°c加5% CO2的潮湿气氛中培养3天,同时存在25 ng/mL的重组巨噬细胞集落刺激因子(MCSF, Peprotech, NJ,美国)。使用倒置培养系统,在存在或不存在100µg重组人AnxA1 (R&D Systems, MN, USA)的情况下,用UHMWPE碎片刺激分化的巨噬细胞gydF4y2Ba3.gydF4y2Ba.培养的巨噬细胞进行Western blot分析(刺激24 h)和TRAP染色(刺激6天)。用10µg/mL重组人TNF-α (Peprotech)刺激巨噬细胞作为阳性对照。在另一项实验中,用不同浓度的重组人AnxA1 (R&D Systems)刺激分化的巨噬细胞,并在不同时间点收获。此外,以1 × 10的密度播种人类单核细胞系THP1 (RIKEN, Saitama, Japan)的细胞gydF4y2Ba5gydF4y2Ba在5ng /mL的肉豆汤酸醋酸酯(PMA, Sigma)存在下,将细胞/孔移植到48孔板上,使其分化为巨噬细胞48小时。然后用重组AnxA1或合成肽Ac2-26 (KareBaygydF4y2BaTMgydF4y2BaBiochem, Inc.,新泽西州,美国)。为了制备巨噬细胞表型,用100 ng/mL的脂多糖(LPS;Sigma)加上100 ng/mL的重组人干扰素γ (IFN-γ)用于M1巨噬细胞,200 ng/mL IL-4 (Peprotech)用于M2巨噬细胞。对于破骨细胞分化,将单核细胞培养在含有25 ng/mL MCSF和50 ng/mL RANKL (Peprotech)以及不同浓度的重组人AnxA1(研发体系)的培养基中。第8天用TRAP试剂盒(Sigma)对细胞进行染色,TRAP染色阳性且细胞核≥3个的细胞视为破骨细胞。用20mg /mL过氧化物酶偶联小麦胚芽凝集素和3,3 ' -二氨基苯齐丁(0.52 mg/mL含0.1% H的PBS)溶液染色检测牙本质切片上的骨凹gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)第21天。切片用共聚焦显微镜检查,凹坑计算为骨吸收表面/总骨表面积的百分比(ImageJ,美国华盛顿国立卫生研究院,NIH, DC, USA)。gydF4y2Ba
FLS的刺激gydF4y2Ba
从Cell Applications (Cell Applications)购买的正常健康人体滑膜组织的hFLS根据供应商的建议进行培养。用密度为0.1 mg/cm的超高分子量聚乙烯碎片刺激培养细胞gydF4y2Ba3.gydF4y2Ba在37℃,含5% CO的潮湿空气中放置24小时gydF4y2Ba2gydF4y2Ba使用反向培养系统gydF4y2Ba3.gydF4y2Ba.在单独的实验中,在重组AnxA1存在或不存在的情况下,用重组人TNF-α (Peprotech)刺激培养的hFLS细胞。gydF4y2Ba
AnxA1缺陷小鼠的生成(AnxA1 KO)gydF4y2Ba
采用CRISPR/Cas9技术生成AnxA1 KO小鼠。简单地说,我们选择了分别位于Anxa1内含子3和5上的两个gRNA靶标(5 ' -GAA CAC CGG TGA TTA CGC TG-3 '和5 ' -CTG GCA CTC TTG GTC AGA AG-3 '),用于生产被切除了Anxa1外显子3到5的Anxa1 KO小鼠。这两种gRNA通过GeneArt精密gRNA合成试剂盒(赛默飞世尔科学,沃尔瑟姆,马萨诸塞州)合成和纯化,并溶解在Opti-MEM(赛默飞世尔科学,沃尔瑟姆,马萨诸塞州)中。然后,使用NEPA 21电穿孔仪(NEPA Gene Co. Ltd., Ichikawa, Japan)将两种gRNAs(每种25 ng/μL)和GeneArt Platinum Cas9 Nuclease (100 ng/μL)的混合物电镀到C57BL/6 J小鼠(Charles River Laboratories Japan, Yokohama, Japan)的受精卵上。电穿孔后,将双细胞胚胎移植到假孕女性输卵管中,获得新生儿。小鼠在SPF级条件下饲养。常规使用从3 - 4周龄小鼠<0.5 mm尾部提取的基因组DNA进行基因分型。PCR使用AmpliTaq Gold 360 Master Mix (Thermo Fisher Scientific, Waltham, Massachusetts)和适当的引物(补充表)进行gydF4y2Ba1gydF4y2Ba).PCR产物使用FastGene凝胶/PCR提取试剂盒(日本遗传,东京,日本)纯化,DNA序列使用BigDye Terminator v3.1循环测序试剂盒(赛默飞世尔科学,沃尔瑟姆,马萨诸塞州)、FastGene Dye Terminator去除试剂盒(日本遗传,东京,日本)和3500xL遗传分析仪(赛默飞世尔科学,沃尔瑟姆,马萨诸塞州)获得。gydF4y2Ba
颅骨骨溶解模型gydF4y2Ba
在小鼠颅骨表面植入6mg的UHMWPE或VE-UHMWPE,持续7天,诱导碎片性骨溶解gydF4y2Ba37gydF4y2Ba.野生型小鼠和anxa -1缺陷型小鼠腹腔注射氯胺酮100 mg/kg和xylazine 10 mg/kg麻醉。随后,在颅骨前部做矢状切口(~ 1cm),植入耐磨合成UHMWPE或VE-UHMWPE颗粒。在8周龄雄性BALB/c小鼠中,在碎片植入后的第1、2和5天,使用150µg抗小鼠Ly6G (Bio-X-Cell, NH, USA)腹腔注射3次,对中性粒细胞进行消耗gydF4y2Ba39gydF4y2Ba.对照组小鼠腹腔注射3次150µg IgG2a同型(Bio-X-Cell, NH, USA)。该方案进行了优化,以获得脾脏Ly6G的显著降低gydF4y2Ba+gydF4y2Ba和CD11bgydF4y2Ba+gydF4y2Ba流式细胞术分析的(生物传说)细胞gydF4y2Ba39gydF4y2Ba.使用弹性蛋白酶抗体(Abcam)的免疫组织化学染色也被用于确认植入碎片后形成的肉芽肿组织中中性粒细胞的消耗。对于过继转移实验,根据制造商的说明(Miltenyi Biotec, Auburn, CA, USA),使用小鼠中性粒细胞分离试剂盒从8周龄雄性C57/BL6小鼠中获得骨髓来源的中性粒细胞(BMN)。吉氏染色分析细胞纯度为>97%中性粒细胞。细胞在30ng /mL小鼠TNF-α (Biolegend)存在或不存在的情况下培养30 min,用冰冷的PBS冲洗,然后按1 × 10给药gydF4y2Ba6gydF4y2Ba在植入UHMWPE碎片后,在颅骨上。未受刺激的细胞被认为是模拟BMN, TNF-α刺激的细胞被认为是aBMN。在8周龄雄性C57BL/6小鼠体内阻断AnxA1,使用5µg抗AnxA1的中和小鼠单克隆抗体(R&D System),在碎片植入时和植入后第2天和第4天皮下注射到颅骨。按照相同的方法,对照组小鼠接受5µg同型对照抗体(R&D系统)。为了检验AnxA1的治疗效果,8周龄雄性C57/BL6小鼠注射n端AnxA1 (Ac2-26)或BML111 (R&D Systems),浓度为1mg /kg,注射5次。一组小鼠在碎片植入后第1、3、5天分别注射2.5 mg/kg WRW4 (R&D Systems)。将试剂溶于水中,在PBS中调整体积和浓度至100µl。在颅骨植入碎片后进行皮下注射。假小鼠和注射PBS的小鼠作为对照。在另一个实验中,8周龄雄性C57/BL6小鼠皮下注射5次Ac2-26(合成见补充图)。gydF4y2Ba10gydF4y2Ba)和平行5次腹腔注射GW9662 (Cayman Chemical, Michigan, USA)。将GW9662溶于二甲基亚砜(DMSO)中,用PBS稀释至终浓度10%。GW9662或其溶剂(载体)每天腹腔注射1 mg/kg,连续注射5天。对于细胞因子诱导的骨溶解模型,小鼠重组RANKL或TNF-α (Biolegend, San Diego, USA)以100 μg/kg浓度连续4天注射于颅骨表面。在第7天对碎片诱导的骨溶解进行病理性骨侵蚀评估,在第5天对细胞因子诱导的模型进行高分辨率微型计算机断层扫描评估(micro-CT)、组织病理学和基因表达评估。gydF4y2Ba
显微ct分析与骨组织形态测量gydF4y2Ba
使用R-mCT2扫描分析(Rigaku, Tokyo, Japan)对Calvariae进行微计算机断层扫描评估(micro-CT)。使用ImageJ (NIH, USA)对图像进行分析,以量化颅骨表面的骨质流失gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.为了进行组织形态测定,颅骨在10%的福尔马林中固定48小时,在脱钙液B (FUJIFILM Wako Pure Chemical Corporation, Osaka, Japan)中4℃脱钙3天,然后用石蜡包埋进行组织学检查。5 μm切片分别用白细胞酸性磷酸酶、抗酒石酸酸性磷酸酶(TRAP, Sigma, Tokyo, Japan)和苏木精伊红(HE, Wako)染色。镜检炎症细胞病变及浸润情况,图像分析采用Image J (NIH)进行定量评价gydF4y2Ba38gydF4y2Ba.gydF4y2Ba
西方墨点法gydF4y2Ba
裂解细胞蛋白经SDS-PAGE凝胶电泳分离,转移至聚偏氟乙烯膜(Immobilon-P膜;默克,达姆施塔特,德国)。β-肌动蛋白一级抗体(SP124, 1:2000稀释,Abcam,英国),AnxA-1 (BL28553, 1:1000稀释,Biolegend,圣地亚哥,美国),总NFκB P65 (14G10A21, 1:100稀释,Biolegend,圣地亚哥,美国),磷酸化NFκB P65 (GTX133899, 1:100稀释,genoletex, CA,美国),磷酸化NFκB P105 (18E6, #4806, 1:100稀释,细胞信号技术,CST, MA,美国),磷酸化P38 (D3F9, #4511, 1:100稀释,CST, MA,美国),磷酸化RelB (D41B9, #5025, 1:100稀释,CST, MA,美国)和PPAR-γ (D8I3Y, #95128,美国),1:10 000稀释,CST, MA,美国)。各自的二抗,包括抗小鼠HRP偶联抗体(1:2000稀释;CST, MA, USA)和抗兔HRP偶联抗体(1:2000稀释;CST, MA, USA)用于检测结合抗体。通过Ez WestLumi Plus (ATTO, Tokyo, Japan)检测信号,并使用Quantity One v. 4.6.9 (Bio-Rad)软件对波段进行可视化。使用ImageJ软件(NIH,美国)定量条带的相对强度。gydF4y2Ba
成骨细胞培养和刺激gydF4y2Ba
从Cell Applications (San Diego, CA, USA)购买的人胎儿成骨细胞在成骨细胞生长培养基(Cell Applications)中培养。细胞在成骨细胞分化培养基(细胞应用)中分化14天,每3天定期补充新鲜培养基gydF4y2Ba40gydF4y2Ba.用重组人TNF-α (Peprotech)刺激细胞48小时,同时存在或不存在重组AnxA1 (R&D Systems)。gydF4y2Ba
实时定量聚合酶链反应(qRT-PCR)gydF4y2Ba
使用TRIzol试剂(Invitrogen)裂解细胞和组织,分别使用RNeasy Plus Mini试剂盒柱(Qiagen, Hilden,德国)和GoScriptTM逆转录酶试剂盒(Promega, Madison,美国)进行RNA提取和cdna合成。SYBR®Premix Ex Taq™II (Takara,志贺,日本)使用补充表中描述的基因特异性引物进行qRT-PCRgydF4y2Ba2gydF4y2Ba.基因表达量由2gydF4y2Ba−ΔΔCtgydF4y2BaGAPDH和β-肌动蛋白归一化后gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
RNA测序和生物信息学gydF4y2Ba
人单核细胞在含有重组巨噬细胞集落刺激因子RANKL和100 ng/mL重组AnxA1(研发系统)的培养基中培养。接下来,我们通过RNA测序分析了受刺激细胞8天的转录谱。STAR软件绘制了每个样本平均6900万个reads(配对末端reads为101 bp),并使用RSEM软件确定了reads计数。使用DESeq2 R包计算显著差异(gydF4y2Bahttps://www.r-project.org/gydF4y2Ba).分析使用了标注可视化数据库和集成发现在线工具(DAVID: DAVID .abcc.ncifcrf.gov)。热图用于可视化每个富集GO项的折叠变化差异(gydF4y2Bahttp://biit.cs.ut.ee/clustvis/gydF4y2Ba).RNA-seq数据在基因表达综合(GEO)数据库(http:gydF4y2Bawww.ncbi.nlm.nih.gov /地理/gydF4y2Ba)的登记编号(GSE183145)及(GSE171542)gydF4y2Ba38gydF4y2Ba.gydF4y2Ba
多肽热响应平台的制备gydF4y2Ba
基底膜基质gydF4y2Ba®gydF4y2Ba(康宁公司,美国)根据制造商的指导方针解冻,并在实验期间保持在冰上。750 μg冻干肽样品溶解在50 μ L超纯蒸馏水中,滴入Matrigel中gydF4y2Ba®gydF4y2Ba涡流下的溶液。得到的水凝胶立即被放置在冰上或储存在4°C,直到用于进一步的实验。用PBS (Wako, Japan)稀释所制备的水凝胶的等分,并使用标准BCA测定方法(Thermo Fisher scientific, USA)测定肽含量。肽包封效率计算公式为:包封效率(%)=(预估肽含量/理论肽含量)× 100。为了进一步评估包裹Ac2-26肽的水凝胶的体外释放,将含有肽的水凝胶在37°C下孵育几分钟直到凝固,然后在热控制搅拌器(37°C, 300 rpm)中在PBS (pH 7.4)中孵育。在样品(25µL)中定量肽释放,频繁地在特定的时间间隔内。为了进一步了解所制备的热响应水凝胶的行为,应用了从水凝胶中释放肽的动力学分析。利用线性回归分析将肽释放数据拟合到与控释剂型相关的最常见模型中,包括零级(方程:gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba=gydF4y2BaKgydF4y2Ba0gydF4y2BatgydF4y2Ba.),一阶(方程:gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba= egydF4y2Ba−gydF4y2BaKgydF4y2Ba1gydF4y2BatgydF4y2Ba)和higuchi扩散(方程:gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba=gydF4y2BakgydF4y2BaHgydF4y2BatgydF4y2Ba½gydF4y2Ba).的gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba药物是否在当时被分次释放gydF4y2BatgydF4y2Ba,gydF4y2BakgydF4y2Ba0gydF4y2Ba是零阶速率常数,gydF4y2BakgydF4y2Ba1gydF4y2Ba是一阶速率常数,gydF4y2BakgydF4y2BaHgydF4y2Ba是Higuchi速率常数和gydF4y2BatgydF4y2Ba是估计发布的时间点。此外,Ritger和Peppas开发的方程gydF4y2Ba41gydF4y2Ba用于阐明肽从水凝胶中释放的机理,如式:gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba=gydF4y2BaKtgydF4y2BangydF4y2Ba.的gydF4y2Ba米gydF4y2BatgydF4y2Ba/gydF4y2Ba米gydF4y2Ba∞gydF4y2Ba比率是每次药物释放的分数gydF4y2BatgydF4y2Ba,gydF4y2BaKgydF4y2Ba为释放速率常数,n为扩散指数。对于形成薄膜样品的水凝胶,gydF4y2BangydF4y2Ba= 0.5为菲克扩散;0.5
统计和再现性gydF4y2Ba
采用单向方差分析(one-way ANOVA)进行统计分析,随后采用Tukey的多重比较程序(多组)和未配对的Student 'sgydF4y2BatgydF4y2Ba-test(两组)来比较各组之间的差异。图图例中提到了每个面板中使用的统计测试。当*时,结果被认为有统计学意义gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.001, ***gydF4y2BapgydF4y2Ba< 0.0001, ****gydF4y2BapgydF4y2Ba< 0.00001。Ns表示差异不显著。误差条表示SEM。使用GraphPad Software Prism 9 (CA, USA)分析数据。实验至少重复三次,以保证数据的可重复性。所有定量实验均由两名研究人员独立评估(实验组不可见)。以透射电镜、显微ct和组织学图像为代表。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本文的大量RNA-seq数据存储在NCBI Gene Expression Omnibus (GEO)上,可通过GEO系列登录号访问;GSE183145和GSE171542。其余数据在本文中提供gydF4y2Ba补充信息gydF4y2Ba或随本文件提供的源数据文件。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Kandahari, a.m.等人。超高分子量聚乙烯磨损引起的骨溶解:早期检测免疫反应的作用gydF4y2Ba骨Res。gydF4y2Ba4 gydF4y2Ba, 16014(2016)。gydF4y2Ba
Cobelli, N., Scharf, B., Crisi, g.m., Hardin, J. & Santambrogio, L.关节置换装置炎症反应的介质。gydF4y2Ba风湿醇。gydF4y2Ba10gydF4y2Ba, 600-608(2011)。gydF4y2Ba
Terkawi, m.a.等人。骨科植入物超高分子量聚乙烯颗粒碎片刺激人类巨噬细胞的转录谱揭示了类风湿关节炎的常见基因表达特征。gydF4y2BaActa Biomater。gydF4y2Ba65gydF4y2Ba, 417 - 25所示。(2018)。gydF4y2Ba
Ito, S., Matsumoto, T., Enomoto, H. & Shindo, H.松动髋关节假体周围肉芽组织在骨溶解发展中的组织学分析和生物学效应。gydF4y2Baj . .。科学。gydF4y2Ba9gydF4y2Ba, 478-487(2009)。gydF4y2Ba
Wozniak, W., Markuszewski, J., Wierusz-Kozlowska, M. & Wysocki, H.中性粒细胞在关节植入物完全松动中是活跃的。gydF4y2BaActa .。Scand。gydF4y2Ba75gydF4y2Ba, 549-553(2004)。gydF4y2Ba
Papatheofanis, F. J. & Barmada, R.暴露于聚甲基丙烯酸甲酯纳米颗粒的多形核白细胞脱粒。gydF4y2Baj .生物医学。板牙。ResgydF4y2Ba25gydF4y2Ba, 761 - 71。(1991)。gydF4y2Ba
Terkawi, m.a.等人。炎症和病理性骨吸收之间的相互作用:对相关疾病的近期机制和途径的洞察,为未来的展望。gydF4y2BaInt J. Mol. sciencegydF4y2Ba23gydF4y2Ba, 1786(2022)。gydF4y2Ba
富勒顿,J. &吉尔罗伊,D.炎症的解决:一个新的治疗前沿。gydF4y2BaNat. Rev.药物发现gydF4y2Ba15gydF4y2Ba, 551-567(2016)。gydF4y2Ba
巴克利,C. D.,吉尔罗伊,D. W.和Serhan, C. N.促进脂质介质和机制在解决急性炎症。gydF4y2Ba免疫力gydF4y2Ba40gydF4y2Ba, 315-327(2014)。gydF4y2Ba
佩鲁奇,L. O.等。膜联蛋白A1和专门的推进脂质介质:促进解决作为人类炎症性疾病的治疗策略。gydF4y2Ba当今专家。其他。目标gydF4y2Ba21gydF4y2Ba, 879-896(2017)。gydF4y2Ba
加文斯,F. N. & Hickey, M. J.膜联蛋白A1和先天和适应性免疫的调节。gydF4y2BaImmunol前面。gydF4y2Ba3.gydF4y2Ba, 354(2012)。gydF4y2Ba
Perretti, M. & Dalli, J.利用膜联蛋白A1通路开发新型抗炎疗法。gydF4y2BaBr。j .制药。gydF4y2Ba158gydF4y2Ba, 936-946(2009)。gydF4y2Ba
高,W.等。甲酰基肽受体激动剂抑制关节炎炎症和骨损伤。gydF4y2BaBr。j .制药。gydF4y2Ba171gydF4y2Ba, 4087-4096(2014)。gydF4y2Ba
Hou, Y., Moreau, F. & Chadee, K. PPARγ是一种E3连接酶,诱导NFκB/p65的降解。gydF4y2BaCommun Nat。gydF4y2Ba3.gydF4y2Ba, 1300(2012)。gydF4y2Ba
Bouhlel, m.a.等人。PPARγ激活使人单核细胞转变为具有抗炎特性的M2巨噬细胞。gydF4y2Ba细胞金属底座。gydF4y2Ba6gydF4y2Ba, 137-143(2007)。gydF4y2Ba
陈,B. Y.等。PPAR激动剂调节体外破骨细胞的形成和活性。gydF4y2Ba骨gydF4y2Ba40gydF4y2Ba, 149-159(2007)。gydF4y2Ba
Hounoki, H.等。过氧化物酶体增殖物激活受体γ的激活部分通过抑制单核细胞趋化蛋白-1的表达来抑制tnf - α介导的人外周单核细胞破骨细胞分化。gydF4y2Ba骨gydF4y2Ba42gydF4y2Ba, 765-774(2008)。gydF4y2Ba
Bendixen, a.c.等人。IL-4通过过氧化物酶体增殖物激活受体γ 1直接作用于破骨细胞前体,从而抑制破骨细胞的形成。gydF4y2Ba国家科学院学报美国gydF4y2Ba98gydF4y2Ba, 2443-2448(2001)。gydF4y2Ba
Ruocco, M. G.等。I{kappa}B激酶(IKK){beta},而不是IKK{alpha},是破骨细胞存活的关键介质,是炎症诱导的骨丢失所必需的。gydF4y2Ba实验,医学。gydF4y2Ba201gydF4y2Ba, 1677-1687(2005)。gydF4y2Ba
孙淑春,张建华,金建华。核因子kappab在自身免疫中的调控。gydF4y2BaImmunol趋势。gydF4y2Ba34gydF4y2Ba, 282-289(2013)。gydF4y2Ba
林,t.h.等。生物材料诱导的假体周围骨溶解的慢性炎症:NF-kappaB作为治疗靶点。gydF4y2BaActa Biomater。gydF4y2Ba10gydF4y2Ba, 1-10(2014)。gydF4y2Ba
吉尔摩,T. D. & Garbati, m.r.抑制NF-kappaB信号作为疾病治疗的一种策略。gydF4y2Ba咕咕叫。上面。Microbiol Immunol。gydF4y2Ba349gydF4y2Ba, 245-263(2011)。gydF4y2Ba
库雷,s.n.等人。g蛋白偶联受体ALX/FPR2的配体特异性构象变化决定了功能反应的提前。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 18232-18237(2013)。gydF4y2Ba
de Graauw, M.等。膜联蛋白A1调节tgf - β信号通路,促进基底样乳腺癌细胞转移形成。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 6340-6345(2010)。gydF4y2Ba
Mirsaeidi, M., Gidfar, S., Vu, A. & Schraufnagel, D. Annexins家族:对其在结节病发病机制中的功能和潜在作用的洞察。gydF4y2Baj . Transl。地中海。gydF4y2Ba14gydF4y2Ba, 89(2016)。gydF4y2Ba
麦克阿瑟等人。膜联蛋白A1通过AMPK激活,驱动巨噬细胞歪斜,加速肌肉再生。gydF4y2Baj .中国。投资。gydF4y2Ba130gydF4y2Ba, 1156-1167(2020)。gydF4y2Ba
Yang Y. H., Aeberli, D., Dacumos, A., Xue, J. R. & Morand, E. F. Annexin-1通过糖皮质激素诱导的亮氨酸拉链调节巨噬细胞IL-6和TNF。gydF4y2Baj . Immunol。gydF4y2Ba183gydF4y2Ba, 1435-1445(2009)。gydF4y2Ba
沈,Z.等。脂联素- sirt1 - ampk信号通路参与罗格列酮对小鼠酒精性脂肪肝的保护作用gydF4y2Ba点。j .杂志。Gastrointest。肝脏杂志。gydF4y2Ba298gydF4y2Ba, 364-374(2010)。gydF4y2Ba
夏,H.等。Resolvin D1通过激活PPAR缓解呼吸机所致小鼠肺损伤gydF4y2BaγgydF4y2Ba/ NF -gydF4y2BaκgydF4y2BaB信号通路。gydF4y2Ba生物医学。Int >,gydF4y2Ba4 gydF4y2Ba, 6254587(2019)。gydF4y2Ba
Solito, E., Romero, I. A., Marullo, S., Russo-Marie, F. & Weksler, B. B. Annexin 1与U937单核细胞结合并抑制其与微血管内皮的粘附:α 4 β 1整合素的参与。gydF4y2Baj . Immunol。gydF4y2Ba165gydF4y2Ba, 1573-1581(2000)。gydF4y2Ba
Senchenkova, E. Y.等。AnxA1-Fpr2/ALX信号轴作为血小板功能的关键调节因子,促进炎症的解决。gydF4y2Ba循环gydF4y2Ba140gydF4y2Ba, 319-335(2019)。gydF4y2Ba
Dufton, N.等人。小鼠甲酰基肽受体2的抗炎作用:配体特异性对白细胞反应和实验炎症的影响。gydF4y2Baj . Immunol。gydF4y2Ba184gydF4y2Ba(3), 2611-2619(2010)。gydF4y2Ba
施耐德,J. G.,修正,S. R. & Weilbaecher, K. N.整合素与骨转移:整合肿瘤细胞和基质细胞的相互作用。gydF4y2Ba骨gydF4y2Ba48gydF4y2Ba, 54-65(2011)。gydF4y2Ba
高迪奥,P. D.等。原位注射水凝胶作为伤口愈合中ANXA1衍生肽控释装置的评价。gydF4y2BaCarbohydr。变异较大。gydF4y2Ba115gydF4y2Ba, 629-633(2015)。gydF4y2Ba
Kamaly, N.等。靶向聚合物消炎纳米颗粒的研制及其体内疗效。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 6506-6511(2013)。gydF4y2Ba
弗雷德曼,G.等人。含有促溶解肽Ac2-26的靶向纳米颗粒可以预防高胆固醇血症小鼠的晚期动脉粥样硬化。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba275gydF4y2Ba, 277er2(2015)。gydF4y2Ba
Terkawi, m.a.等人。鉴定IL-27作为与维生素e混合超高分子量聚乙烯骨科植入物碎片相关的炎性骨溶解的有效调节因子。gydF4y2BaActa Biomater。gydF4y2Ba89gydF4y2Ba, 242-251(2019)。gydF4y2Ba
Matsumae, G.等。胸苷磷酸化酶作为一种潜在的治疗骨质丢失相关的假体周围骨溶解。gydF4y2BaBioeng。Transl。地中海gydF4y2Ba6gydF4y2Ba, e10232(2021)。gydF4y2Ba
莫伊尼汉等人。通过参与先天和适应性免疫反应的联合免疫疗法根除小鼠体内已建立的大肿瘤。gydF4y2Ba地中海Nat。gydF4y2Ba22gydF4y2Ba, 1402-1410(2016)。gydF4y2Ba
田,杨,等。阻断XCL1/淋巴素可改善聚乙烯颗粒引发的假体周围骨溶解的严重程度。gydF4y2BaImmunol前面。gydF4y2Ba11gydF4y2Ba, 1720(2020)。gydF4y2Ba
李志刚,李志刚。描述溶质释放的一个简单方程。膨胀器件的菲克键和异常释放。gydF4y2BaJ.控制释放gydF4y2Ba5gydF4y2Ba, 37-42(1987)。gydF4y2Ba
确认gydF4y2Ba
这项工作得到了日本科学促进协会的研究资助(科学研究资助C;17K10993),秋山生命科学基金会,小林基金会,上原纪念基金会,日本医学研究开发机构(JP20gm6210004)。我们感谢Teijin Nakashima医疗株式会社(日本)的Keita Uetsuki博士和Tomoyo Yutani夫人提供髋关节植入物材料中的UHMWPE颗粒碎片。我们也感谢Chowdhury Arpan在合成和表征肽Ac2-26方面的技术支持。敲除小鼠(AnxA1 KO小鼠)在筑波大学实验动物资源中心生成。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化:M.T。会面,方法:H.A。硕士,t,通用,Y.T, T.E, S.Y, Y.N, F.M,当,M.Y, H.H。验证:M.T。H.A。K.K, D.T,正式的分析:H.A。硕士,通用,T.E, Y.N, S.Y,资源:M.T。t。D.T,数据管理:M.T。H.A。t .,原创作品:草案H.A。Writing-Review &编辑:硕士K.K,会面,可视化:M.T。H.A。通用,监督:M.T。会面,项目管理:M.T。t。资金收购:M.T。t。K.K D.T.gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Rajeev Aurora、Mauro Perretti和匿名审稿人对本工作的同行评审所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Alhasan, H., Terkawi, M.A, Matsumae, G.。gydF4y2Baet al。gydF4y2Ba膜联蛋白A1在病理性骨吸收中的抑制作用及假体周围骨溶解的治疗意义。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 3919(2022)。https://doi.org/10.1038/s41467-022-31646-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-31646-0gydF4y2Ba
这篇文章被引用gydF4y2Ba
膜联蛋白A1有助于预防假体周围骨质流失gydF4y2Ba
自然评论风湿病gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba