摘要gydF4y2Ba
肝脏规格和功能成熟在整个发育过程中受到严格控制。N6-methyladenosine (mgydF4y2Ba6克ydF4y2BaA)是真核mrna中最丰富的RNA修饰,参与各种生理和病理过程。然而,m的函数gydF4y2Ba6克ydF4y2Ba肝脏发育的A仍是未知的。在这里,我们剖析了mettl3介导的m的作用gydF4y2Ba6克ydF4y2Ba出生后肝脏发育和稳态的改变。在围产期用gydF4y2BaAlb-CregydF4y2Ba(gydF4y2BaMettl3gydF4y2BacKO)诱导肝细胞凋亡和脂肪变性,导致严重肝损伤,最终导致出生后7周内死亡。米gydF4y2Ba6克ydF4y2Baa - rip测序和rna测序显示一系列重要的肝脏富集转录因子的mrna被mgydF4y2Ba6克ydF4y2Ba一个,包括gydF4y2BaHnf4agydF4y2Ba它是肝实质形成的主要调节因子。删除Mettl3会减少mgydF4y2Ba6克ydF4y2Ba对gydF4y2BaHnf4agydF4y2Ba,以igf2bp1依赖的方式降低其转录稳定性,并下调gydF4y2BaHnf4agydF4y2Ba而过表达AAV8的Hnf4a可减轻肝损伤,延长肝细胞寿命gydF4y2BaMettl3gydF4y2BacKO老鼠。然而,在成人使用中敲除Mettl3gydF4y2BaAlb-CregydF4y2BaERT2gydF4y2Ba不影响肝脏内稳态。我们的研究确定了mettl3介导的RNA m的动态作用gydF4y2Ba6克ydF4y2Ba肝脏发育的改变gydF4y2Ba
简介gydF4y2Ba
肝脏是负责新陈代谢、脂质运输、药物解毒和激素分泌的主要器官gydF4y2Ba1克ydF4y2Ba.肝脏的规格和从造血到代谢的巨大功能转变是由细胞外信号、转录因子和表观遗传调控因子之间复杂的相互作用密切控制的。先前的报道表明,肝脏富集转录因子、组蛋白修饰和DNA甲基化的协调在成人发育过程中协调肝脏分化程序,并维持肝脏稳态gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
N6-methyladenosine (mgydF4y2Ba6克ydF4y2BaA)修饰自20世纪70年代发现以来,已被确定为真核mrna中最丰富的修饰gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba.m的动态沉积和去除gydF4y2Ba6克ydF4y2BaA由包含类甲基转移酶3 (METTL3)和类甲基转移酶14 (METTL14)的甲基转移酶复合物催化。gydF4y2Ba7 gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,和Wilms肿瘤1相关蛋白(WTAP)gydF4y2Ba9gydF4y2Ba,以及其他辅助因子和去甲基酶,包括ALKB同源物5 (ALKBH5)gydF4y2Ba10gydF4y2Ba脂肪量和肥胖相关蛋白(FTO)gydF4y2Ba11gydF4y2Ba,分别。米gydF4y2Ba6克ydF4y2BaYTH家族成员在YT521-B同源结构域(YTHDF1-3, YTHDC1-2)中识别一个修饰。gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba胰岛素样生长因子-2 mrna结合蛋白(IGF2BP1/2/3)gydF4y2Ba17gydF4y2Ba,因此参与RNA代谢的各个步骤,如稳定性、翻译、核输出、mrna剪接以及miRNAs的生物发生和成熟gydF4y2Ba18gydF4y2Ba.gydF4y2Ba
在这项工作中,我们产生了肝特异性gydF4y2BaMettl3gydF4y2Ba击倒(gydF4y2BaMettl3gydF4y2BacKO)小鼠杂交gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba老鼠gydF4y2Ba白蛋白gydF4y2Ba(gydF4y2Ba铝青铜gydF4y2Ba)增强器/启动子驱动-gydF4y2BaCregydF4y2Ba在转基因小鼠中研究mgydF4y2Ba6克ydF4y2Ba肝脏发育的改变围产期Mettl3肝脏缺失可引起严重的肝损伤,包括脂肪变性、细胞凋亡和纤维化,最终在7周内致死。使用米gydF4y2Ba6克ydF4y2BaA-RNA免疫沉淀(mgydF4y2Ba6克ydF4y2BaA-RIP)测序和rna测序,我们确定了关键的肝脏富集转录因子,包括gydF4y2BaHnf4agydF4y2Ba,均被m修正gydF4y2Ba6克ydF4y2BaA在肝脏发育中的作用。Mettl3的丢失导致m的耗尽gydF4y2Ba6克ydF4y2Ba一个在gydF4y2BaHnf4agydF4y2Ba转录,以依赖igf2bp1的方式降低其转录稳定性,并下调gydF4y2BaHnf4agydF4y2Ba而过表达AAV8的Hnf4a可减轻肝损伤,延长肝细胞寿命gydF4y2BaMettl3gydF4y2BacKO老鼠。然而,在成年小鼠肝脏中删除Mettl3gydF4y2Ba白蛋白gydF4y2Ba增强器/ promoter-drivengydF4y2BaCregydF4y2BaERT2gydF4y2Ba对肝脏内稳态的影响很小。总之,我们阐明了mettl3介导的RNA m的动态作用gydF4y2Ba6克ydF4y2Ba小鼠出生后肝脏发育过程中的一种修饰,并破译了外延转录组控制肝脏器官发生的新功能。gydF4y2Ba
结果gydF4y2Ba
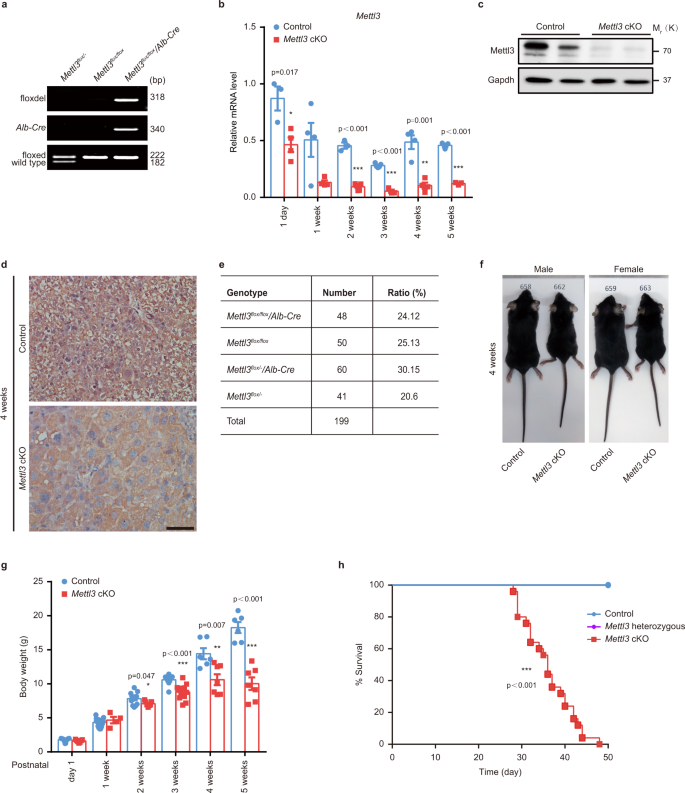
肝脏特异性Mettl3基因敲除小鼠的产生gydF4y2Ba
研究m的作用gydF4y2Ba6克ydF4y2Ba在肝脏发育中的修饰,我们首先测试了m的关键亚基的表达水平gydF4y2Ba6克ydF4y2Ba甲基转移酶复合体,Mettl3和Mettl14gydF4y2Ba7 gydF4y2Ba.这两种成分在小鼠新生儿(出生后一天内)中都表现出较浅的蛋白质水平,并逐渐增加,在2-3周达到峰值,然后从4周开始下降(补充图。gydF4y2Ba1gydF4y2Ba).在人类肝脏中也观察到类似的趋势,儿童肝脏高表达,随后随着年龄的增长而下降(补充图。gydF4y2Ba1 bgydF4y2Ba).这些结果表明mgydF4y2Ba6克ydF4y2BaA在出生后肝脏发育中受到动态调控。全球淘汰任一种gydF4y2BaMettl3gydF4y2Ba或gydF4y2BaMettl14gydF4y2Ba结果原肠形成缺陷引起胚胎死亡gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.因此,研究mgydF4y2Ba6克ydF4y2Ba一种修饰,我们生成小鼠肝脏特异性敲除m的催化亚基gydF4y2Ba6克ydF4y2Ba甲基转移酶通过交叉形成的甲基转移酶复合物,Mettl3gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba小鼠(loxP位点位于外显子2和4两侧)gydF4y2Ba铝青铜gydF4y2Ba增强器/ promoter-drivengydF4y2BaCregydF4y2Ba转基因小鼠(补充图。gydF4y2Ba1 c, dgydF4y2Ba).通过基因组PCR、实时定量PCR (RT-qPCR)、western blot和免疫化学等方法证实了Mettl3在肝脏中的特异性敲除(图。gydF4y2Ba1模拟gydF4y2Ba和补充图。gydF4y2Ba1 e-jgydF4y2Ba).基因组PCR和RT-qPCR显示,metttl3基因的高效敲除始于出生后第1天(图2)。gydF4y2Ba1 bgydF4y2Ba和补充图。gydF4y2Ba1 kgydF4y2Ba),以及gydF4y2BaCregydF4y2Ba表达式(补充图gydF4y2Ba1我gydF4y2Ba).果然,肝从gydF4y2BaMettl3gydF4y2BacKO小鼠mRNA m明显下降gydF4y2Ba6克ydF4y2BaA水平与对照组相比(补充图。gydF4y2Ba1 lgydF4y2Ba).此外,我们还观察到敲除mettl13会导致Mettl14的破坏(补充图。gydF4y2Ba1米gydF4y2Ba),与以往的报告一致gydF4y2Ba19gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba对所示基因型2周龄小鼠的尾部和肝脏组织(顶部为肝组织,其余为尾部)进行基因组PCR鉴定。顶部通道(floxdel)显示外显子2-4被删除的等位基因(使用F1和R2引物扩增,见补充图。gydF4y2Ba1 cgydF4y2Ba)),只有在gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2Ba(gydF4y2BaMettl3gydF4y2BacKO)老鼠肝脏。中间车道(gydF4y2BaAlb-CregydF4y2Ba)显示有效的插入gydF4y2Ba白蛋白gydF4y2Ba增强器/ promoter-drivengydF4y2BaCregydF4y2Ba进入“基因组安全港”hip11 (H11)位点。底巷为杂合型(gydF4y2BaMettl3gydF4y2Ba液氧/ -gydF4y2Ba)或纯合子(gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba) flox侧翼等位基因(由F1和R1引物扩增,如图(补充图)所示。gydF4y2Ba1 cgydF4y2Ba(3次实验独立重复,结果相似)。gydF4y2BabgydF4y2Ba定量的gydF4y2BaMettl3gydF4y2Ba野生型(WT)对照组(对照,以后也在类似实验中)和肝脏中mRNA的表达gydF4y2BaMettl3gydF4y2Ba通过RT-qPCR检测出生后不同时间点的cKO小鼠(gydF4y2BangydF4y2Ba对照组和3周cKO组= 3个;n = 5, 3周对照组;gydF4y2BangydF4y2Ba其他组= 4)。gydF4y2BacgydF4y2BaWestern blot检测Mettl3在对照和gydF4y2BaMettl3gydF4y2Ba出生后两周的cKO小鼠肝组织(独立重复6次实验,结果相似)。用Gapdh作为加载对照(以后也用在类似实验中)。gydF4y2BadgydF4y2Ba4周龄对照组和对照组Mettl3免疫组化染色gydF4y2BaMettl3gydF4y2BacKO小鼠肝脏(独立重复6次实验,结果相似)。比例尺= 50 μm。gydF4y2BaegydF4y2Ba杂交产生的具有不同基因型的后代数量gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba而且gydF4y2BaMettl3gydF4y2Ba液氧/ -gydF4y2Ba/gydF4y2BaAlb-CregydF4y2Ba老鼠。gydF4y2BafgydF4y2Ba性别匹配对照小鼠的代表性外观gydF4y2BaMettl3gydF4y2BacKO在出生后4周与窝仔交配。gydF4y2BaggydF4y2Ba男性控制体重和gydF4y2BaMettl3gydF4y2Ba出生后不同时间点的窝仔(gydF4y2BangydF4y2Ba1周cKO组= 4例;gydF4y2BangydF4y2Ba4周、5周对照组= 6;gydF4y2BangydF4y2Ba= 9例3周对照组;gydF4y2BangydF4y2Ba3周cKO组= 12例;n = 13例,2周对照组;gydF4y2BangydF4y2Ba第1天、第1周= 15例对照组;gydF4y2BangydF4y2Ba其他组= 7)。gydF4y2BahgydF4y2Ba对照组生存曲线,gydF4y2BaMettl3gydF4y2BacKO,gydF4y2BaMettl3gydF4y2Ba杂合的(gydF4y2BaMettl3gydF4y2Ba液氧/ -gydF4y2Ba/gydF4y2BaAlb-CregydF4y2Ba)窝友(每组n = 25)。数据gydF4y2BabgydF4y2Ba而且gydF4y2BaggydF4y2Ba以均数±SEM表示,有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;双尾学生的gydF4y2BatgydF4y2Ba以及)。(h)数据采用Log-rank (mantle - cox)检验进行分析,显著性(*** .gydF4y2BaPgydF4y2Ba< 0.001)。源数据作为源数据文件提供。gydF4y2Ba
肝脏Mettl3基因敲除可导致产后死亡gydF4y2Ba
肝gydF4y2BaMettl3gydF4y2Ba敲除小鼠几乎以预期的孟德尔频率出生。gydF4y2Ba1 egydF4y2Ba),排除产前致死率的可能性。然而,雄性和雌性敲除小鼠的体型都小于它们的年龄和性别匹配的野生型(WT)对照(对照,以后也在类似的实验中)的窝伴(图。gydF4y2Ba1 fgydF4y2Ba).这种差异出现在出生后2周,并在出生后4周和5周逐渐变得更加明显。gydF4y2Ba1克gydF4y2Ba和补充图。gydF4y2Ba1 n, ogydF4y2Ba).此外,所有的gydF4y2BaMettl3gydF4y2BacKO小鼠在出生后7周内死亡,而杂合子敲除个体可育并存活超过12个月,没有明显的发育缺陷(图。gydF4y2Ba1 hgydF4y2Ba的一个等位基因gydF4y2BaMettl3gydF4y2Ba足以维持小鼠肝脏的正常发育和功能。这些结果表明,Mettl3对出生后肝脏发育至关重要,特别是在出生后0 - 4周的高增殖阶段。gydF4y2Ba
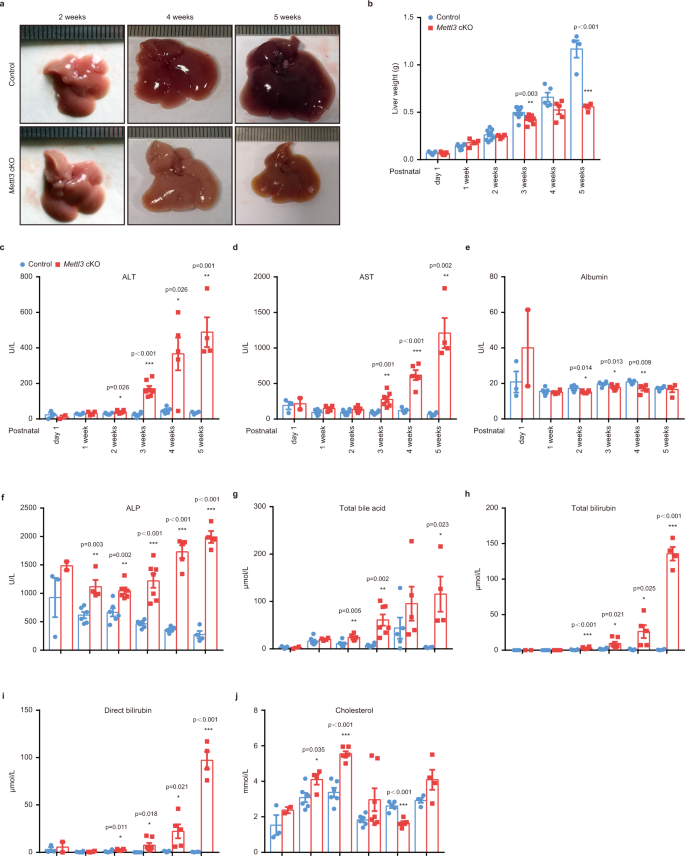
肝Mettl3缺失导致肝损伤gydF4y2Ba
为了阐明Mettl3在肝脏器官发生中的确切作用,我们解剖了对照组和对照组的肝脏gydF4y2BaMettl3gydF4y2Ba出生后不同时间点的cKO小鼠。大体上,在肝脏中观察到明显的斑驳外观,这是脂质沉积的指示gydF4y2BaMettl3gydF4y2BacKO小鼠出生后2周(图;gydF4y2Ba2gydF4y2Ba).4周婴儿的肝脏gydF4y2BaMettl3gydF4y2Ba与WT对照组相比,cKO小鼠呈黄色,体型更小,身体更僵硬。这些差异在第5周时变得更加显著。gydF4y2Ba2gydF4y2Ba).肝脏重量gydF4y2BaMettl3gydF4y2Ba小鼠出生3周后cKO下降(图;gydF4y2Ba2 bgydF4y2Ba),而肝脏重量与体重比略有增加(补充图。gydF4y2Ba2gydF4y2Ba).肝功能血清指标显示,出生后1-2周,Mettl3缺乏导致肝脏代谢、解毒、蛋白质合成和分泌功能缺陷,提示进行性肝损害(图)。gydF4y2Ba2 c-jgydF4y2Ba和补充图。gydF4y2Ba2 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba有代表性的肝脏大体外观gydF4y2BaMettl3gydF4y2Ba在出生后2周,4周和5周的cKO小鼠。gydF4y2BabgydF4y2Ba出生后不同时间点的肝脏重量(gydF4y2BangydF4y2Ba1周cKO组和5周cKO组= 4;gydF4y2BangydF4y2Ba= 5组4周;gydF4y2BangydF4y2Ba2周cKO组= 6例;gydF4y2BangydF4y2Ba第1天cKO组= 7;gydF4y2BangydF4y2Ba= 8例1周对照组;gydF4y2BangydF4y2Ba= 9例3周对照组;gydF4y2BangydF4y2Ba= 10例2周对照组;gydF4y2BangydF4y2Ba3周cKO组= 12例;gydF4y2BangydF4y2Ba第1天对照组= 15)。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba血清ALT水平gydF4y2BacgydF4y2Ba, ASTgydF4y2BadgydF4y2Ba、白蛋白gydF4y2BaegydF4y2Ba,高山gydF4y2BafgydF4y2Ba,总胆汁酸gydF4y2BaggydF4y2Ba,总胆红素gydF4y2BahgydF4y2Ba,直接胆红素gydF4y2Ba我gydF4y2Ba,以及胆固醇gydF4y2BajgydF4y2Ba管制及gydF4y2BaMettl3gydF4y2Ba出生后不同时间点的cKO小鼠(gydF4y2BangydF4y2Ba第1天cKO组= 2;gydF4y2BangydF4y2Ba第1天= 3个对照组;gydF4y2BangydF4y2Ba1周cKO组和5周组= 4;gydF4y2BangydF4y2Ba= 5组4周;gydF4y2BangydF4y2Ba1周对照组、2周组、3周对照组= 6例;gydF4y2BangydF4y2Ba3周cKO组= 7例)。数据gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba以均数±SEM表示,有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,双尾学生gydF4y2BatgydF4y2Ba以及)。源数据作为源数据文件提供。gydF4y2Ba
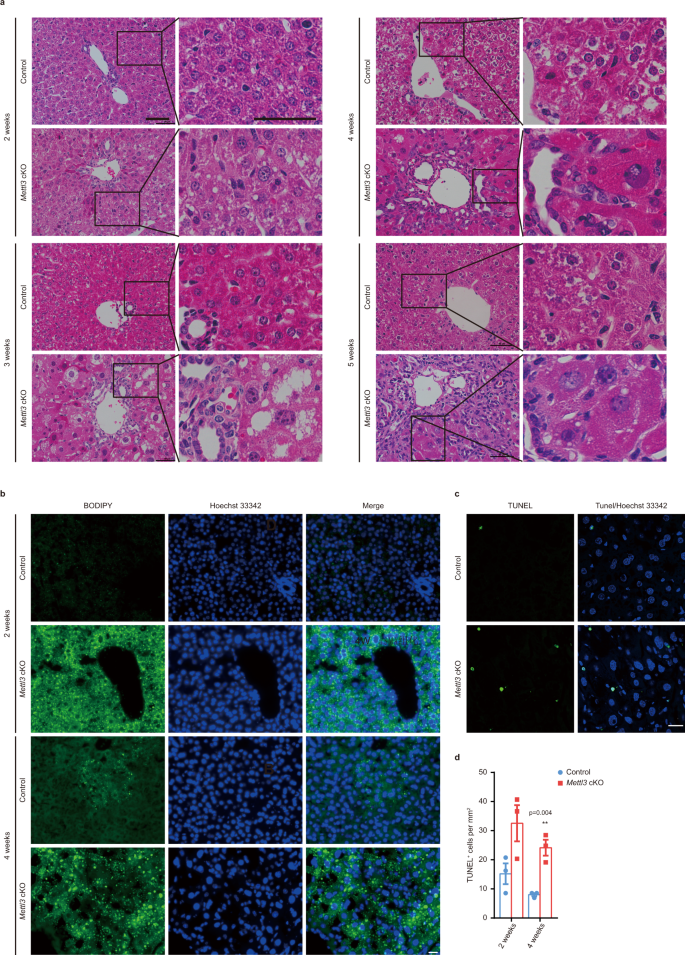
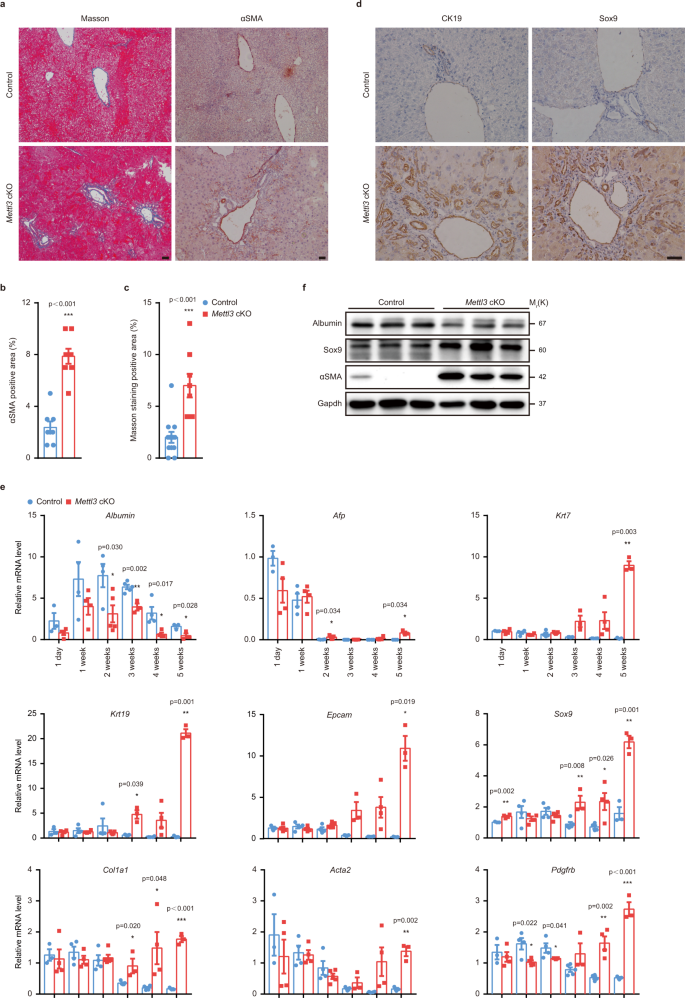
Mettl3缺失导致细胞凋亡、脂肪变性、纤维化和肝祖细胞激活gydF4y2Ba
虽然组织学分析显示对照组和对照组之间无明显差异gydF4y2BaMettl3gydF4y2Ba出生后1天和1周的cKO小鼠(补充图。gydF4y2Ba3 a, bgydF4y2Ba),可见明显的病理病变gydF4y2BaMettl3gydF4y2BacKO小鼠2周龄开始(图;gydF4y2Ba3gydF4y2Ba).脂滴沉积增加gydF4y2BaMettl3gydF4y2Ba出生后2周观察cKO肝脏,冷冻肝组织BODIPY染色和Oil Red O染色证实(图2)。gydF4y2Ba3 bgydF4y2Ba和补充图。gydF4y2Ba3 c, dgydF4y2Ba)和原代肝细胞(补充图。gydF4y2Ba3 egydF4y2Ba).我们还观察到细胞体积变大,细胞核变大,肝细胞凋亡增加gydF4y2BaMettl3gydF4y2BacKO小鼠出生后2周开始,出生后3周导管细胞扩张(图。gydF4y2Ba3模拟gydF4y2Ba和补充图。gydF4y2Ba3 f, ggydF4y2Ba).此外,纤维化突出gydF4y2BaMettl3gydF4y2BacKO肝脏在第4周出现,在第5周变得更加明显。gydF4y2Ba4得了gydF4y2Ba和补充图。gydF4y2Ba4 a、bgydF4y2Ba).通过组织学分析,我们没有观察到杂合子cKO肝脏的任何异常(补充图。gydF4y2Ba4摄氏度gydF4y2Ba).与导管细胞扩增一致,我们检测到Sox9, CK19, Ki67阳性细胞明显增加gydF4y2BaMettl3gydF4y2BacKO肝(图;gydF4y2Ba4 dgydF4y2Ba和补充图。gydF4y2Ba4 dgydF4y2Ba).同时,对不同时间点采集的肝组织进行RT-qPCR检测,肝细胞标记物(gydF4y2Ba白蛋白gydF4y2Ba(gydF4y2Ba铝青铜gydF4y2Ba)减少,而肝祖标记物(gydF4y2Ba法新社gydF4y2Ba,gydF4y2BaKrt7gydF4y2Ba,gydF4y2BaKrt19gydF4y2Ba,gydF4y2BaEpcamgydF4y2Ba,gydF4y2BaSox9gydF4y2Ba)和纤维化标志物(gydF4y2BaCol1a1gydF4y2Ba,gydF4y2BaActa2gydF4y2Ba,gydF4y2BaPdgfrbgydF4y2Ba)在gydF4y2BaMettl3gydF4y2BacKO个体(图;gydF4y2Ba4 egydF4y2Ba).western blot证实了这些变化。gydF4y2Ba4 fgydF4y2Ba).上述结果表明,围生期肝细胞Mettl3缺失导致肝细胞损伤、祖细胞激活和纤维化。gydF4y2Ba
一个gydF4y2Ba对照和肝切片的代表性H&E染色照片gydF4y2BaMettl3gydF4y2Ba在出生后指定时间点的cKO小鼠(10个实验独立重复,结果相似)。比例尺= 50 μm。gydF4y2BabgydF4y2Ba对照和冷冻肝脏切片的代表性BODIPY染色荧光照片gydF4y2BaMettl3gydF4y2Ba出生后2周和4周的cKO小鼠(独立重复6次实验,结果相似)。细胞核用Hoechst 33342反染色(以后也有类似实验)。比例尺= 20 μm。gydF4y2BacgydF4y2Ba冷冻肝脏切片的代表性TUNEL染色荧光照片gydF4y2BaMettl3gydF4y2Ba出生后4周cKO小鼠(独立重复6次实验,结果相似)。比例尺= 20 μm。gydF4y2BadgydF4y2BaTUNEL的量化gydF4y2Ba+gydF4y2Ba细胞/赫斯特33342gydF4y2Ba+gydF4y2Ba对照组和对照组肝脏切片的细胞比例gydF4y2BaMettl3gydF4y2Ba出生后2周及4周的cKO小鼠(gydF4y2BangydF4y2Ba每组= 3)。数据gydF4y2BadgydF4y2Ba均以均数±SEM表示,有显著性(**gydF4y2BaPgydF4y2Ba< 0.01;双尾学生的gydF4y2BatgydF4y2Ba以及)。源数据作为源数据文件提供。gydF4y2Ba
一个gydF4y2Ba对照组和对照组肝切片的代表性Masson三色染色和αSMA免疫组化染色照片gydF4y2BaMettl3gydF4y2BacKO小鼠出生后4周(独立重复10次实验,结果相似)。比例尺= 50 μm。gydF4y2BabgydF4y2BaαSMA阳性区域的定量(gydF4y2BangydF4y2Ba每组= 8)。gydF4y2BacgydF4y2Ba马森三色染色阳性区域的定量(gydF4y2BangydF4y2BacKO组= 8;gydF4y2BangydF4y2Ba对照组= 12)。gydF4y2BadgydF4y2Ba对照组和对照组肝脏切片CK19和Sox9免疫组化染色gydF4y2BaMettl3gydF4y2Ba出生后4周cKO小鼠(独立重复6次实验,结果相似)。比例尺= 50 μm。gydF4y2BaegydF4y2BaRT-qPCR分析对照组和对照组肝组织的肝细胞标记物、肝祖标记物和纤维化标记物gydF4y2BaMettl3gydF4y2Ba出生后不同时间点的cKO小鼠(gydF4y2BangydF4y2Ba对照组、cKO 3周组、5周组= 3个;gydF4y2BangydF4y2Ba= 5例3周对照组;gydF4y2BangydF4y2Ba其他组= 4)。gydF4y2BafgydF4y2BaWestern blot检测对照组和对照组的白蛋白、Sox9和αSMAgydF4y2BaMettl3gydF4y2Ba出生后4周cKO小鼠肝组织(3个实验独立重复,结果相似)。数据gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba以均数±SEM表示,有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;双尾学生的gydF4y2BatgydF4y2Ba以及)。源数据作为源数据文件提供。gydF4y2Ba
Transcriptome-wide米gydF4y2Ba6克ydF4y2BaA-RIP测序鉴定Mettl3的潜在靶点gydF4y2Ba
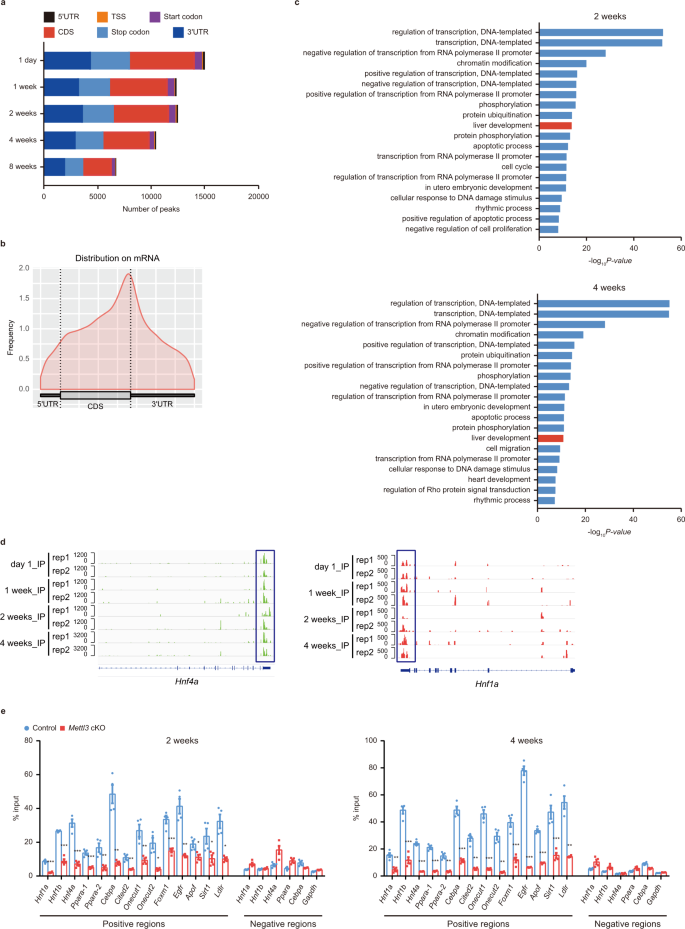
由于Mettl3是m的关键催化亚基gydF4y2Ba6克ydF4y2Ba甲基转移酶机制,为了全面了解metttl3调控出生后肝脏发育的分子机制,我们首先量化了mgydF4y2Ba6克ydF4y2BaLC-MS/MS检测不同发育阶段肝组织mrna的A水平。全局mRNA mgydF4y2Ba6克ydF4y2Ba出生后肝脏的A水平在出生后升高,在2周达到峰值,随后下降(补充图。gydF4y2Ba5gydF4y2Ba).接下来,我们分析了全基因组的mgydF4y2Ba6克ydF4y2Ba甲基化分布使用mgydF4y2Ba6克ydF4y2Ba小鼠肝组织5个发育时间点(出生后1天和1、2、4、8周)的rna A-RIP测序。m的分布gydF4y2Ba6克ydF4y2BaA修饰在出生后肝脏发育的不同阶段受到动态调节(图2)。gydF4y2Ba5gydF4y2Ba和补充图。gydF4y2Ba5模拟gydF4y2Ba).我们确定了15139,12483,12615,10561和6806米gydF4y2Ba6克ydF4y2BaA峰值,分别对应上述五组中的6330、5522、5515、4856、3445个基因。gydF4y2Ba5 bgydF4y2Ba及补充数据集gydF4y2Ba1克ydF4y2Ba).全球人口gydF4y2Ba6克ydF4y2Ba出生后2周达到富集高峰,同时出现大量mgydF4y2Ba6克ydF4y2Ba小鼠肝脏发育过程中A的水平(补充图。gydF4y2Ba5 a, dgydF4y2Ba).与之前的报告一致,mgydF4y2Ba6克ydF4y2BaA峰在终止密码子附近显著富集(图。gydF4y2Ba5 a、bgydF4y2Ba),共识基序“GGAC”在所有样本的峰中最常见地富集(补充图。gydF4y2Ba5 egydF4y2Ba).有趣的是,“肝脏发育”是m最显著丰富的术语之一gydF4y2Ba6克ydF4y2Ba通过基因本体(GO)分析在所有时间点的修改基因(图。gydF4y2Ba5度gydF4y2Ba及补充数据集gydF4y2Ba2gydF4y2Ba).几种关键的肝脏富集转录因子的mrna被mgydF4y2Ba6克ydF4y2Ba肝组织中的A,包括gydF4y2BaHnf4agydF4y2Ba,gydF4y2BaHnf1agydF4y2Ba,gydF4y2BaPparagydF4y2Ba,gydF4y2BaCebpagydF4y2Ba(无花果。gydF4y2Ba5 dgydF4y2Ba和补充图。gydF4y2Ba5 fgydF4y2Ba).这些因子在肝脏体内发育和肝细胞体外分化中都起着重要作用gydF4y2Ba2gydF4y2Ba.接下来,我们使用基因特异性mgydF4y2Ba6克ydF4y2BaA-RIP-qPCR检测证实了RNA m的真实沉积gydF4y2Ba6克ydF4y2BaMettl3对富肝因子的修饰,使用对照和gydF4y2BaMettl3gydF4y2BacKO老鼠。我们观察到m的显著下降gydF4y2Ba6克ydF4y2Ba关于gydF4y2BaHnf1agydF4y2Ba,gydF4y2BaHnf4agydF4y2Ba,gydF4y2BaPparagydF4y2Ba,gydF4y2BaCebpagydF4y2Ba等gydF4y2Ba.在gydF4y2BaMettl3gydF4y2Ba2周和4周的cKO小鼠(图;gydF4y2Ba5 egydF4y2Ba).这些结果表明,mettl3介导的mgydF4y2Ba6克ydF4y2Ba一种修饰在肝脏发育过程中被动态调节,并修饰控制肝脏规格和功能的关键转录因子。gydF4y2Ba
一个gydF4y2Ba峰数和m分布的总结gydF4y2Ba6克ydF4y2BaA在整个mRNA转录本中的5'UTR, TSS,开始密码子,CDS,停止密码子和3'UTR区域达到峰值。gydF4y2BabgydF4y2Bam .的元基因分布gydF4y2Ba6克ydF4y2Ba出生后2周小鼠肝脏mRNA转录本的a免疫沉淀reads。gydF4y2BacgydF4y2Ba基因本体(GO)分析mgydF4y2Ba6克ydF4y2Ba小鼠出生后2周和4周肝脏组织中的修饰基因经mgydF4y2Ba6克ydF4y2Ba一个破坏性的测序。gydF4y2BadgydF4y2Ba基因组浏览器截图mgydF4y2Ba6克ydF4y2BaA-RIP测序读取出生后4个不同时间点的密度信号gydF4y2BaHnf4agydF4y2Ba而且gydF4y2BaHnf1agydF4y2Ba位点。每个时间点包含两个重复。gydF4y2BaegydF4y2BaGene-specific米gydF4y2Ba6克ydF4y2Ba对照和A-RIP-qPCRgydF4y2BaMettl3gydF4y2Ba出生后2周及4周cKO小鼠肝组织(gydF4y2BangydF4y2Ba3个独立实验,每组= 4个)。米gydF4y2Ba6克ydF4y2Ba根据m选择一个正区域和一个负区域gydF4y2Ba6克ydF4y2Ba一个破坏性的测序。如果两个或两个以上m,则用序号标记基因gydF4y2Ba6克ydF4y2Ba在单个基因(如:gydF4y2BaPparagydF4y2Ba−1和gydF4y2BaPparagydF4y2Ba−2表示两个独立的mgydF4y2Ba6克ydF4y2Ba一个积极的区域gydF4y2BaPparagydF4y2Ba信使rna)。2周阳性区域对照与cKO各基因的确切p值列于此:gydF4y2BaHnf1agydF4y2Ba(< 0.001),gydF4y2BaHnf1bgydF4y2Ba(< 0.001),gydF4y2BaHnf4agydF4y2Ba(< 0.001),gydF4y2BaPpara-1gydF4y2Ba(< 0.001),gydF4y2BaPpara-2gydF4y2Ba(0.005),gydF4y2BaCebpagydF4y2Ba(0.004),gydF4y2BaCited2gydF4y2Ba(0.009),gydF4y2BaOnecut1gydF4y2Ba(0.004),gydF4y2BaOnecut2gydF4y2Ba(0.016),gydF4y2BaFoxm1gydF4y2Ba(< 0.001),gydF4y2Ba表皮生长因子受体gydF4y2Ba(0.007),gydF4y2BaApofgydF4y2Ba(0.018),gydF4y2BaSirt1gydF4y2Ba(0.040),gydF4y2BaLdlrgydF4y2Ba(0.011)。4周阳性区域对照与cKO各基因的确切p值列于此:gydF4y2BaHnf1agydF4y2Ba(0.001),gydF4y2BaHnf1bgydF4y2Ba(< 0.001),gydF4y2BaHnf4agydF4y2Ba(< 0.001),gydF4y2BaPpara-1gydF4y2Ba(< 0.001),gydF4y2BaPpara-2gydF4y2Ba(0.003),gydF4y2BaCebpagydF4y2Ba(< 0.001),gydF4y2BaCited2gydF4y2Ba(0.001),gydF4y2BaOnecut1gydF4y2Ba(< 0.001),gydF4y2BaOnecut2gydF4y2Ba(0.002),gydF4y2BaFoxm1gydF4y2Ba(< 0.001),gydF4y2Ba表皮生长因子受体gydF4y2Ba(< 0.001),gydF4y2BaApofgydF4y2Ba(< 0.001),gydF4y2BaSirt1gydF4y2Ba(< 0.001),gydF4y2BaLdlrgydF4y2Ba(0.003)。(e)中的数据以均数±SEM表示,具有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;双尾学生的gydF4y2BatgydF4y2Ba以及)。源数据作为源数据文件提供。gydF4y2Ba
米gydF4y2Ba6克ydF4y2BaA通过控制核心转录因子mRNA的稳定性来调控肝脏发育和代谢通路gydF4y2BaHnf4agydF4y2Ba
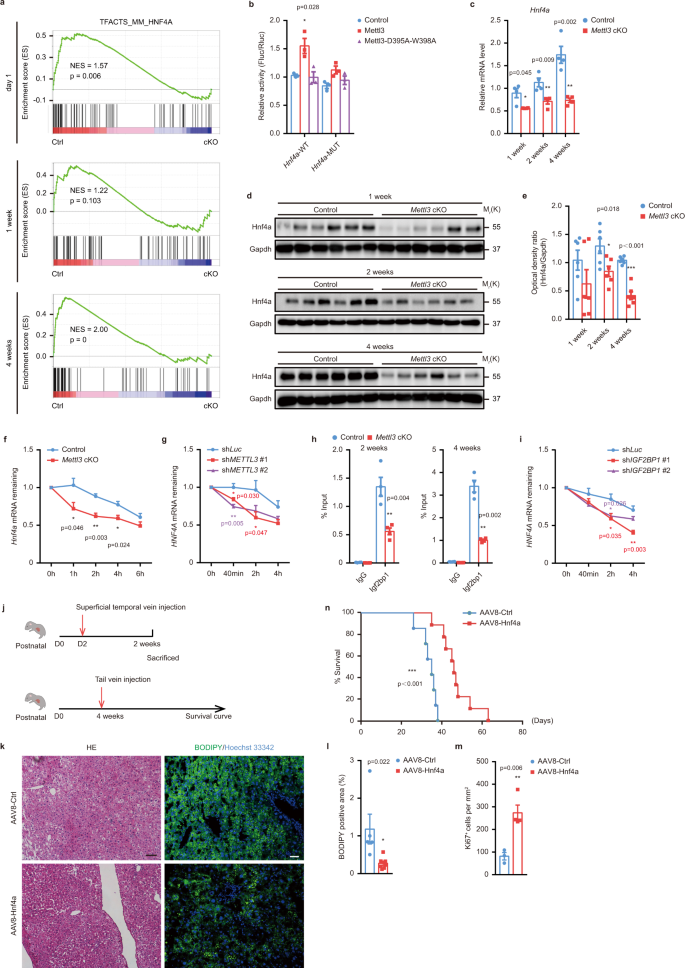
为了进一步了解Mettl3调节肝脏发育的机制,我们对Control和c组的肝组织进行了rna测序gydF4y2BaMettl3gydF4y2BacKO小鼠出生后1天,1周,2周,4周。对照组和对照组差异调控基因(DEGs)明显增多gydF4y2BaMettl3gydF4y2Ba稍后时间点的cKO小鼠(补充图。gydF4y2Ba6gydF4y2Ba,补充数据集gydF4y2Ba3.gydF4y2Ba),这与我们的观察相一致gydF4y2BaMettl3gydF4y2BacKO小鼠在出生后2周出现进行性严重肝损伤(图2)。gydF4y2Ba3gydF4y2Ba).基因集富集分析(GSEA)显示,该基因的靶点为gydF4y2BaHnf4agydF4y2Ba而且gydF4y2BaHnf1agydF4y2Ba在gydF4y2BaMettl3gydF4y2BacKO肝甚至在出生后1天(图;gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba6 bgydF4y2Ba).双荧光素酶报告试验和诱变试验(图。gydF4y2Ba6 bgydF4y2Ba和补充图。gydF4y2Ba6 c, dgydF4y2Ba)显示与WT共转染,但未与催化突变体Mettl3共转染gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,显著促进携带WT的报告细胞荧光素酶活性gydF4y2BaHnf4agydF4y2Ba而且gydF4y2BaHnf1agydF4y2Ba片段,而这样的增加被废除时,mgydF4y2Ba6克ydF4y2Ba一个共识基序发生突变,证实Mettl3对Hnf4a和Hnf1a的调控确实依赖于mgydF4y2Ba6克ydF4y2Ba转录本的甲基化。RT-qPCR和western blot均证实Hnf4a在小鼠中表达下调gydF4y2BaMettl3gydF4y2Ba出生后不同时间点的cKO肝脏(图;gydF4y2Ba6汉英gydF4y2Ba).尽管RNA水平gydF4y2BaHnf1agydF4y2Ba在所有时间点均下调(补充图;gydF4y2Ba6 egydF4y2Ba),我们观察到Hnf1a蛋白随着年龄的增长而急剧下降,仅在对照组和对照组之间观察到差异gydF4y2BaMettl3gydF4y2Ba出生后1周cKO小鼠肝脏(补充图。gydF4y2Ba6 fgydF4y2Ba),表明Hnf1a在肝细胞成熟过程中的作用不那么重要,这与以往的研究一致gydF4y2Ba25gydF4y2Ba.Hnf4a是胎儿和成人肝脏发育所需的主转录因子,并控制成熟肝细胞功能的大部分方面gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,我们主要针对Hnf4a进行进一步研究。rna -测序数据显示,随着Hnf4a的下调,大多数Hnf4a靶基因,如gydF4y2BaApoa2gydF4y2Ba,gydF4y2BaApoc3gydF4y2Ba,gydF4y2BaCyp8b1gydF4y2Ba,gydF4y2BaMttpgydF4y2Ba,被压抑在gydF4y2BaMettl3gydF4y2BacKO个体(补充图)gydF4y2Ba6克gydF4y2Ba,补充数据集gydF4y2Ba3.gydF4y2Ba),经RT-qPCR验证(补充图;gydF4y2Ba6小时gydF4y2Ba).我们还注意到gydF4y2BaSmadgydF4y2Ba信号,纤维化的中心介质gydF4y2Ba28gydF4y2Ba中显著富集gydF4y2BaMettl3gydF4y2Ba4周时cKO小鼠肝组织(补充图。gydF4y2Ba7一个gydF4y2Ba),支持了大范围肝纤维化的现象gydF4y2BaMettl3gydF4y2BacKO动物(图;gydF4y2Ba4gydF4y2Ba).这些结果表明,mettl3介导的mgydF4y2Ba6克ydF4y2BaA在肝脏发育过程中控制关键肝脏发育基因的表达。gydF4y2Ba
一个gydF4y2Ba基因集富集分析(GSEA)的Hnf4a通路的rna测序数据Control (Ctrl)和gydF4y2BaMettl3gydF4y2BacKO (cKO)小鼠肝组织在出生后1天,1周,4周。gydF4y2BabgydF4y2Ba双荧光素酶报告分析显示Mettl3对gydF4y2BaHnf4agydF4y2BaWT或m突变的记者gydF4y2Ba6克ydF4y2Ba经改良的地点(gydF4y2BangydF4y2Ba3个独立实验,每组3个)。gydF4y2BacgydF4y2BaRT-qPCR检测mRNA水平gydF4y2BaHnf4agydF4y2Ba在不同的时间点控制和gydF4y2BaMettl3gydF4y2Ba小鼠肝组织(gydF4y2BangydF4y2Ba3个独立实验,每组= 4个)。gydF4y2BadgydF4y2BaWestern blot检测Hnf4αgydF4y2BaMettl3gydF4y2BacKO小鼠肝组织在出生后1周,2周,4周。gydF4y2BaegydF4y2Ba对照和对照Hnf4a的western blot密度测定分析gydF4y2BaMettl3gydF4y2Ba在指定时间点的cKO小鼠肝脏组织(gydF4y2BangydF4y2Ba每组= 6)。gydF4y2BafgydF4y2BaRT-qPCR分析gydF4y2BaHnf4agydF4y2Ba分离自对照组和对照组的原代肝细胞mRNA水平gydF4y2BaMettl3gydF4y2Ba5 μM放线菌素D处理后不同时间点小鼠肝脏cKO (gydF4y2BangydF4y2Ba3个独立实验,每组= 4个)。gydF4y2BaggydF4y2BaRT-qPCR分析gydF4y2BaHNF4AgydF4y2Ba5 μM放线菌素D处理METTL3敲除HepG2细胞后不同时间点mRNA水平(gydF4y2BangydF4y2Ba3个独立实验,每组= 4个)。gydF4y2BahgydF4y2BaRIP-qPCR检测Igf2bp1与gydF4y2BaHnf4agydF4y2Ba在控制中gydF4y2BaMettl3gydF4y2Ba出生后2周及4周cKO小鼠肝组织(gydF4y2BangydF4y2Ba每组= 4)。gydF4y2Ba我gydF4y2BaRT-qPCR分析gydF4y2BaHNF4AgydF4y2Ba5 μM放线菌素D处理后不同时间点IGF2BP1敲除HepG2细胞的mRNA水平(gydF4y2BangydF4y2Ba每组= 4)。gydF4y2BajgydF4y2BaAAV8-Hnf4a的两种救援策略示意图。gydF4y2BakgydF4y2Ba2周肝切片代表性H&E染色和BODIPY染色照片gydF4y2BaMettl3gydF4y2BacKO小鼠出生后第2天静脉注射AAV8-Ctrl和AAV8-Hnf4a(独立重复6次实验,结果相似)。比例尺= 20 μm。gydF4y2BalgydF4y2BaBODIPY染色统计直方图(gydF4y2BangydF4y2BaAAV8-Ctrl组= 5;gydF4y2BangydF4y2BaAAV8-Hnf4a组= 7)。gydF4y2Ba米gydF4y2BaKi67免疫组化染色统计直方图(AAV8-Ctrl组n = 3;gydF4y2BangydF4y2BaAAV8-Hnf4a组= 4)。gydF4y2BangydF4y2Ba生存曲线gydF4y2BaMettl3gydF4y2BacKO小鼠静脉注射AAV8-Ctrl和AAV8-Hnf4a (gydF4y2BangydF4y2BaAAV8-Ctrl组= 8;gydF4y2BangydF4y2BaAAV8-Hnf4a组= 9)。数据gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba,gydF4y2BalgydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba以均数±SEM表示,有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;双尾学生的gydF4y2BatgydF4y2Ba以及)。数据gydF4y2BangydF4y2Ba采用Log-rank (mantle - cox)检验分析,差异有显着性(***gydF4y2BaPgydF4y2Ba< 0.001)。源数据作为源数据文件提供。gydF4y2Ba
米gydF4y2Ba6克ydF4y2Ba修饰涉及RNA代谢的各个方面,包括转录、剪接、核运输、稳定性和翻译。由于我们观察到Hnf4a在mRNA和蛋白水平上表达下降,我们确定了Hnf4a的替代剪接、核-细胞质转运和mRNA稳定性gydF4y2BaHnf4agydF4y2Ba信使rna。选择性剪接分析显示,两组间无差异gydF4y2BaHnf4agydF4y2Barna测序数据中的转录本gydF4y2BaMettl3gydF4y2BacKO肝脏(补充数据集gydF4y2Ba4gydF4y2Ba).的分布gydF4y2BaHnf4agydF4y2Ba细胞核和细胞质中的mRNA也不受影响gydF4y2BaMettl3gydF4y2Ba(补充图。gydF4y2Ba7罪犯gydF4y2Ba).只有mRNA稳定性在原代肝细胞和Mettl3抑制的HepG2细胞中显示出显著变化(图。gydF4y2Ba6 f, ggydF4y2Ba、补充图。gydF4y2Ba7 e, fgydF4y2Ba).Mettl3缺失的细胞半衰期较短gydF4y2BaHnf4agydF4y2Ba转录,表明mettl3介导的mgydF4y2Ba6克ydF4y2BaA通过调控其mRNA的稳定性来控制Hnf4a的表达。为了比较Mettl3基因敲除后mRNA稳定性的整体变化,我们对对照组和对照组的放线菌素d处理过的肝细胞进行了实验gydF4y2BaMettl3gydF4y2BacKO小鼠rna测序(补充数据集gydF4y2Ba5gydF4y2Ba).与以前的报告一致gydF4y2Ba15gydF4y2Ba,gydF4y2Ba19gydF4y2Ba敲除Mettl3基因可提高mRNA的整体稳定性,特别是mgydF4y2Ba6克ydF4y2Baa修饰基因(补充图。gydF4y2Ba7 g hgydF4y2Ba).在涉及肝脏发育的基因中(由基因本体资源定义,GO:0001889),只有gydF4y2BaHnf4agydF4y2Ba和另外10个基因在敲除Mettl3时显示mRNA半衰期缩短,而大多数基因(包括gydF4y2BaCited2gydF4y2Ba,gydF4y2BaCebpagydF4y2Ba,gydF4y2BaNotch2gydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba,等)较为稳定或不变(补充图;gydF4y2Ba7我gydF4y2Ba及补充数据集gydF4y2Ba5gydF4y2Ba).这些结果表明,Mettl3缺失通过缩短Hnf4a的半衰期来下调Hnf4a的表达gydF4y2BaHnf4agydF4y2Ba信使rna。gydF4y2Ba
米gydF4y2Ba6克ydF4y2Ba修饰主要通过“读取器”蛋白质识别并与m结合来控制RNA的命运gydF4y2Ba6克ydF4y2Ba包含记录。在已识别的m中gydF4y2Ba6克ydF4y2Ba众所周知,胰岛素样生长因子2 mrna结合蛋白(IGF2BPs,包括IGF2BP1/2/3)是一种“读者”,可促进其靶mrna的稳定性gydF4y2Ba17gydF4y2Ba.为了进一步描述m的作用机理gydF4y2Ba6克ydF4y2Ba作为Hnf4a的控制性表达,我们检查了以前的出版物,发现IGF2BP1的缺失会导致其不稳定gydF4y2BaHNF4AgydF4y2BamRNA在HepG2细胞中,而干扰其他两个成员没有影响gydF4y2BaHNF4AgydF4y2BamRNA降解(补充图。gydF4y2Ba7 jgydF4y2Ba)gydF4y2Ba17gydF4y2Ba,说明IGF2BP1可能直接识别mgydF4y2Ba6克ydF4y2Ba一个在gydF4y2BaHNF4AgydF4y2Ba并维持其在肝脏中的水平。因此,我们测试了Igf2bp1与gydF4y2BaHnf4agydF4y2Ba信使rna与RIP实验。结果表明,Igf2bp1能有效地与gydF4y2BaHnf4agydF4y2Ba2周和4周小鼠肝脏的转录本,富集后显著降低gydF4y2BaMettl3gydF4y2Ba击倒(无花果。gydF4y2Ba6小时gydF4y2Ba).因此,在HepG2细胞中,用小发夹RNA (small Hairpin RNA, shRNA)敲除IGF2BP1也减少了gydF4y2BaHNF4AgydF4y2BamRNA半衰期,类似于Mettl3中断(图。gydF4y2Ba6我gydF4y2Ba和补充图。gydF4y2Ba7 k, lgydF4y2Ba).这些数据证明了mettl3介导的mgydF4y2Ba6克ydF4y2BaA通过igf2bp1依赖的方式调节Hnf4a的mRNA稳定性来控制Hnf4a的表达。gydF4y2Ba
肝脏Hnf4a过表达减轻Mettl3基因敲除引起的肝损伤gydF4y2Ba
为了进一步强化我们的结论,即Hnf4a是肝脏发育中Mettl3功能的主要中介,我们使用AAV血清型8 (AAV8)进行抢救实验,在肝脏特异性启动子(甲状腺结合球蛋白,TBG) (AAV8-TBG-Hnf4a)的控制下表达Hnf4agydF4y2BaMettl3gydF4y2BacKO小鼠(图;gydF4y2Ba6 jgydF4y2Ba).出生后第2天经颞浅静脉注射AAV8-TBG-Hnf4a成功在肝脏中过表达(补充图。gydF4y2Ba7米gydF4y2Ba),减轻肝损伤gydF4y2BaMettl3gydF4y2Ba与AAV8-Ctrl相比,两周的基因敲除,Ki67的数量增加就是明证gydF4y2Ba+gydF4y2Ba肝细胞增殖和肝脏脂肪变性减少(图;gydF4y2Ba6为gydF4y2Ba).然而,我们没有看到在死亡率方面的长期益处。这可能与出生后4周内肝细胞剧烈分裂导致AAV迅速稀释有关gydF4y2Ba29gydF4y2Ba.在大鼠4周龄尾静脉注射AAV-TBG-Hnf4a过表达Hnf4agydF4y2BaMettl3gydF4y2Ba并发现Hnf4a过表达显著延长了cKO小鼠的寿命gydF4y2BaMettl3gydF4y2BacKO小鼠(图;gydF4y2Ba6 ngydF4y2Ba).这些结果进一步证明Hnf4a是介导Mettl3在肝脏发育中的作用的主要因素。gydF4y2Ba
metttl3对于成人肝脏的稳态是不可缺少的gydF4y2Ba
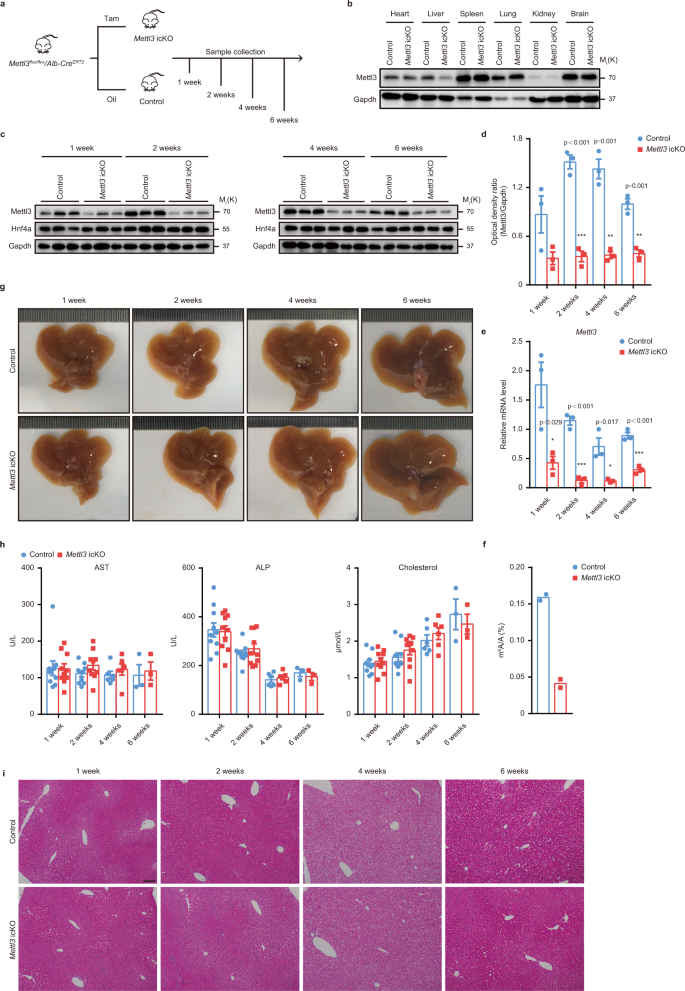
考虑到致命的gydF4y2BaMettl3gydF4y2BacKO小鼠在7周内产生条件诱导物gydF4y2BaMettl3gydF4y2Ba基因敲除小鼠(gydF4y2BaMettl3gydF4y2Ba通过交叉gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba老鼠gydF4y2BaAlb-CregydF4y2BaERT2gydF4y2Ba老鼠。经腹腔注射他莫昔芬后,成年小鼠Mettl3基因可被清除gydF4y2Ba30.gydF4y2Ba.基因组PCR, RT-qPCR和western blot证实了有效和特异性的消耗gydF4y2BaMettl3gydF4y2Ba他莫昔芬给药后1周(图;gydF4y2Ba7 a egydF4y2Ba和补充图。gydF4y2Ba8gydF4y2Ba).LC-MS/MS结果也显示了体积m的显著下降gydF4y2Ba6克ydF4y2Ba的修改gydF4y2BaMettl3gydF4y2BaicKO小鼠肝脏mrna(图;gydF4y2Ba7 fgydF4y2Ba).然而,我们没有观察到任何明显的异常gydF4y2BaMettl3gydF4y2BaicKO小鼠(图;gydF4y2Ba7 ggydF4y2Ba和补充图。gydF4y2Ba8 b, cgydF4y2Ba).血清学和组织学检查显示肝脏损伤很小。gydF4y2Ba7小时,我gydF4y2Ba、补充图。gydF4y2Ba8 dgydF4y2Ba).两种mrnagydF4y2BaHnf4agydF4y2BaHnf4a下游靶点在对照组和对照组之间无差异gydF4y2BaMettl3gydF4y2BaicKO肝脏(补充图。gydF4y2Ba8 e-kgydF4y2Ba).这些结果表明,尽管Mettl3对出生后肝脏的早期发育至关重要,但它对成人肝脏的稳态并不是至关重要的。gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba他莫昔芬诱导的肝脏特异性示意图gydF4y2BaMettl3gydF4y2Ba击倒(gydF4y2BaMettl3gydF4y2BaicKO)鼠标生成。4周大gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2BaERT2gydF4y2Ba用他莫西芬(Tam)或橄榄油(oil)治疗小鼠,连续5天,然后用0周标记。gydF4y2BabgydF4y2BaWestern blot检测对照组和对照组的指示组织中Mettl3gydF4y2BaMettl3gydF4y2Ba他莫西芬治疗后1周的icKO小鼠(3个实验独立重复,结果相似)。gydF4y2BacgydF4y2BaWestern blot检测对照组Mettl3和Hnf4agydF4y2BaMettl3gydF4y2Ba他莫西芬治疗后不同时间点的icKO小鼠肝组织(3个实验独立重复,结果相似)。gydF4y2BadgydF4y2Ba对照组和对照组Mettl3蛋白western blot的密度分析gydF4y2BaMettl3gydF4y2Ba他莫昔芬治疗后不同时间点的icKO小鼠肝组织(gydF4y2BangydF4y2Ba每组= 3)。gydF4y2BaegydF4y2BaRT-qPCR为gydF4y2BaMettl3gydF4y2Ba他莫昔芬治疗后不同时间点肝组织的表达(gydF4y2BangydF4y2Ba3个独立实验,每组3个)。gydF4y2BafgydF4y2BaLC-MS /MS分析mgydF4y2Ba6克ydF4y2BaA/A定量控制和gydF4y2BaMettl3gydF4y2Ba他莫昔芬治疗后2周的icKO小鼠肝脏(gydF4y2BangydF4y2Ba每组= 2)。gydF4y2BaggydF4y2Ba有代表性的肝脏大体外观gydF4y2BaMettl3gydF4y2Ba他莫西芬治疗后1周、2周、4周和6周的icKO小鼠(3个实验独立重复,结果相似)。gydF4y2BahgydF4y2Ba对照组血清AST、ALP和胆固醇水平gydF4y2BaMettl3gydF4y2Ba他莫昔芬治疗后不同时间点的icKO小鼠(gydF4y2BangydF4y2Ba= 3, 6周组;gydF4y2BangydF4y2Ba4周组= 6例;gydF4y2BangydF4y2Ba其他组= 10)。gydF4y2Ba我gydF4y2Ba对照部代表H&E染色照片gydF4y2BaMettl3gydF4y2Ba在指定时间点的icKO小鼠肝脏切片(3次实验独立重复,结果相似)。疤痕条= 100 μm。数据gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba而且gydF4y2BahgydF4y2Ba以均数±SEM表示,有显著性(*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;双尾学生的gydF4y2BatgydF4y2Ba以及)。源数据作为源数据文件提供。gydF4y2Ba
讨论gydF4y2Ba
先前的报道已经描述了转录组范围内的mgydF4y2Ba6克ydF4y2BaA在出生后三个阶段的猪肝中gydF4y2Ba31gydF4y2Ba并提供了m的路线图gydF4y2Ba6克ydF4y2Ba人类和老鼠肝脏的改造gydF4y2Ba32gydF4y2Ba,表示m的动态变化gydF4y2Ba6克ydF4y2Ba肝脏发育过程中的变化本研究证实了mettl3介导的m的重要作用gydF4y2Ba6克ydF4y2Ba小鼠出生后肝脏发育的改变。使用gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2Ba老鼠,我们发现gydF4y2BaMettl3gydF4y2BacKO小鼠出生后2周左右脂肪变性,4-5周肝纤维化,7周前因严重肝损伤死亡。gydF4y2Ba
肝脏经历了从子宫内到子宫外环境的功能突变,对应于从造血到代谢和免疫的功能转移gydF4y2Ba33gydF4y2Ba.一般来说,胎儿肝脏造血具有起始(E11.5)、高峰(E14.5)、衰退(E15.5)、消失(出生后3天)的特征,而新生儿肝脏则迅速演变为免疫监测和代谢的重要器官。组织学分析显示,出生后第一周,造血细胞迅速消失,实质细胞占据肝组织,与既往报道一致gydF4y2Ba34gydF4y2Ba.mett13在新生小鼠肝脏中表达量不高,而在两个胎儿肝脏中表达量较高gydF4y2Ba35gydF4y2Ba出生后1周蛋白质水平(尽管在这个过程中mRNA水平只有轻微变化)。Mettl3在围产期如何受到严格调控的机制仍然难以捉摸,值得研究。考虑到肝脏在围产期的功能转变,Mettl3在这一时期的动态调节和功能可能涉及造血和肝脏两个方面。一系列研究探讨了mettl3介导的m的作用gydF4y2Ba6克ydF4y2BaA在造血系统gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,包括胚胎肝脏的早期造血干细胞(HSC)发育gydF4y2Ba35gydF4y2Ba,揭示了m的重要作用gydF4y2Ba6克ydF4y2BaA在造血系统的规范和稳态方面。但是,Mettl3和m的函数gydF4y2Ba6克ydF4y2BaA在产前发育中的肝谱系规范目前尚不清楚,值得进一步研究。gydF4y2Ba
有趣的是,4周后肝脏中mettl13和Mettl14的表达同步下降,提高了m不那么关键的作用的可能性gydF4y2Ba6克ydF4y2Ba成年期和老年期的变化事实上,我们发现Mettl3对成人肝脏内稳态并不是必需的。先前的研究也表明,在分化或祖细胞的早期阶段,如神经发生,甲基转移酶复合物的表达水平较高gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba和造血作用gydF4y2Ba40gydF4y2Ba.全局m的水平gydF4y2Ba6克ydF4y2Ba一种修饰和甲基转移酶的表达在过早间充质干细胞中减少gydF4y2Ba41gydF4y2Ba,复制性衰老细胞gydF4y2Ba42gydF4y2Ba以及来自老年人群的外周血单个核细胞gydF4y2Ba43gydF4y2Ba.衰老总是伴随着再生能力的逐渐下降,尤其是在肝脏中gydF4y2Ba44gydF4y2Ba,因此,描述与年龄相关的再生能力下降是否由m的降低引起将是有趣的gydF4y2Ba6克ydF4y2Ba老年人的动力。虽然过表达RNA甲基转移酶减弱衰老表型gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba甲基转移酶表达升高与肝脏代谢紊乱加重有关gydF4y2Ba45gydF4y2Ba以及癌变过程gydF4y2Ba46gydF4y2Ba包括肝细胞癌gydF4y2Ba47gydF4y2Ba,表示m的微调调节gydF4y2Ba6克ydF4y2Ba机械是生理内稳态所必需的。gydF4y2Ba
肝脏是成人最大的消化和代谢器官,负责将蛋白质、糖原、胆固醇、脂肪酸等多种复杂分子转化为基本分子。肝脏的正常发育和功能是由一系列丰富的肝脏转录因子及其之间的综合调控网络来维持的gydF4y2Ba2gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.在这里,我们发现大量肝脏富集的转录因子转录本被mettl3介导的m修饰gydF4y2Ba6克ydF4y2Ba修改,包括gydF4y2BaHnf1agydF4y2Ba,gydF4y2BaHnf1βgydF4y2Ba,gydF4y2BaHnf4agydF4y2Ba,gydF4y2BaPparagydF4y2Ba,gydF4y2BaCebpagydF4y2Ba,gydF4y2BaOnecut1gydF4y2Ba,gydF4y2BaOnecut2gydF4y2Ba,gydF4y2BaCited2gydF4y2Ba,gydF4y2Ba等gydF4y2Ba.gydF4y2BaHnf4agydF4y2Ba似乎是metttl3在出生后肝脏发育中最关键的下游中介。此外,我们观察到Hnf4a在不同时间点的mRNA和蛋白水平均有所下降gydF4y2BaMettl3gydF4y2BacKO小鼠肝脏与对照组肝脏相比,其下游靶标明显失调。gydF4y2Ba
Hnf4a是胚胎和成人小鼠肝脏所需的主转录因子gydF4y2Ba26gydF4y2Ba.它直接与成人肝脏中几乎一半的活性转录基因结合,并作为肝脏转录层次中的高级转录因子gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.我们发现的大部分异常gydF4y2BaMettl3gydF4y2BacKO小鼠(包括肝脏中脂质沉积、血清中胆汁酸增加、肝损伤和青壮年的致死率)出现了肝脏的表型gydF4y2BaHnf4agydF4y2Ba基因敲除小鼠gydF4y2Ba26gydF4y2Ba.然而,gydF4y2BaMettl3gydF4y2BacKO小鼠肝脏损伤较肝损伤严重gydF4y2BaHnf4agydF4y2Ba基因敲除小鼠。这可能是由于mettl3介导的m调控了多个靶点gydF4y2Ba6克ydF4y2Ba其中的修饰、自动调节和交叉调节回路可能会进一步加速肝脏发育和功能的崩溃gydF4y2Ba49gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba.其中,越来越多的证据表明,mgydF4y2Ba6克ydF4y2BaA和组蛋白/DNA表观遗传修饰gydF4y2Ba53gydF4y2Ba这为解释Mettl3在肝脏发育和功能中的作用增加了另一层复杂性。最近的研究表明mgydF4y2Ba6克ydF4y2BaA直接调节异染色质组织gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba.异染色质的协调重塑对肝脏发育至关重要gydF4y2Ba56gydF4y2Ba异染色质景观的干扰有助于肝功能受损和肿瘤的发生gydF4y2Ba57gydF4y2Ba.因此,观察异常的染色质状态是否能解释这一问题将是很有趣的gydF4y2BaMettl3gydF4y2Backo致肝损伤。此外,Mettl3敲除还可能通过控制RNA代谢的其他方面,如mRNA的转运、翻译和其他调控因子的剪接,从而导致肝脏发育缺陷,这些调控因子涉及肝脏发育和对肝脏发生至关重要的miRNAs的生物发生。gydF4y2Ba
综上所述,我们的研究证明了mettl3介导的m在外延转录组学中具有新的调节功能gydF4y2Ba6克ydF4y2Ba对肝脏出生后发育和稳态的修正,扩展了我们对哺乳动物肝脏发育和功能调节网络的理解。gydF4y2Ba
方法gydF4y2Ba
道德声明gydF4y2Ba
本研究动物的使用依据国立卫生研究院《实验动物护理使用指南》,并经中山大学附属第三医院机构动物护理使用委员会批准。对于本研究中使用的人体标本,获得了所有个体的知情同意,并记录在电子数据库中。研究委员会的规程是根据中山大学附属第三医院医学伦理委员会制定的准则进行的。gydF4y2Ba
动物实验gydF4y2Ba
Mettl3gydF4y2Ba液氧/液氧gydF4y2Ba老鼠是周琦教授好心送的gydF4y2Ba58gydF4y2Ba.gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCregydF4y2Ba小鼠购自GemPharmatech有限公司(南京,中国)。gydF4y2BaAlb-CregydF4y2BaERT2gydF4y2Ba小鼠购自北京生物增素有限公司(北京,中国)。所有小鼠均为C57BL/ 6j背景,置于特定的无病原体环境中,光照/黑暗周期为12 h,温度为24±2°C,湿度为30 - 70%,可自由获取食物和水。gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2Ba老鼠(gydF4y2BaMettl3gydF4y2BacKO小鼠)通过杂交生成gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba小鼠杂合子gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCregydF4y2Ba老鼠。gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2BaERT2gydF4y2Ba小鼠是通过杂交产生的gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba老鼠gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCregydF4y2BaERT2gydF4y2Ba老鼠。用于肝脏特异性诱导敲除gydF4y2BaMettl3gydF4y2Ba(gydF4y2BaMettl3gydF4y2BaicKO)在成人,4-5周gydF4y2BaMettl3gydF4y2Ba液氧/液氧gydF4y2Ba/ Alb-CregydF4y2BaERT2gydF4y2Ba小鼠腹腔注射1 mg/只的他莫西芬(Sigma-Aldrich, T5648),连续5天,对照组小鼠腹腔注射相同体积的橄榄油(MACKLIN, O815211)。将他莫昔芬溶解在浓度为10 mg/mL的橄榄油中,在37°C摇动过夜。控制和gydF4y2BaMettl3gydF4y2BacKO或gydF4y2BaMettl3gydF4y2BaicKO小鼠是窝友和笼友。所有的gydF4y2BaAlb-CregydF4y2Ba或gydF4y2BaAlb-CregydF4y2BaERT2gydF4y2Ba本实验小鼠为Cre杂合子。gydF4y2Ba
用于小鼠基因分型的基因组PCRgydF4y2Ba
小鼠用尾巴和组织DNA进行基因分型。使用小鼠直接PCR试剂盒(ApexBio Technology, k1025)制备尾部和组织裂解物。使用两对引物来鉴定floxed等位基因:gydF4y2BaMettl3gydF4y2Baf1和gydF4y2BaMettl3gydF4y2Bar1,或gydF4y2BaMettl3gydF4y2Ba- f2和gydF4y2BaMettl3gydF4y2Ba-R2(见补充图。gydF4y2Ba1 cgydF4y2Ba).gydF4y2BaMettl3gydF4y2Baf1和gydF4y2BaMettl3gydF4y2Ba-R1引物(见补充图。gydF4y2Ba1 cgydF4y2Ba)用小鼠尾巴区分WT (182 bp)和floxed等位基因(222 bp)。gydF4y2BaMettl3gydF4y2Ba- f2和gydF4y2BaMettl3gydF4y2Ba-R2引物(见补充图。gydF4y2Ba1 cgydF4y2Ba),用小鼠尾巴区分WT (295 bp)和floxed等位基因(335 bp)。gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCregydF4y2Ba- f和gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCregydF4y2Ba-R引物用于检测gydF4y2BaAlb-CregydF4y2Ba等位基因与小鼠尾巴(340 bp为gydF4y2BaAlb-CregydF4y2Ba+ /−gydF4y2Ba也没有gydF4y2BaAlb-CregydF4y2Ba−−/gydF4y2Ba).gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCreERTgydF4y2Ba- f和gydF4y2Ba铝青铜gydF4y2Ba-gydF4y2BaCreERTgydF4y2Ba-R引物用于检测gydF4y2BaAlb-CregydF4y2Ba导gydF4y2Ba小鼠尾巴等位基因(788 bp forgydF4y2BaAlb-CregydF4y2BaERT2 + /−gydF4y2Ba也没有gydF4y2BaAlb-CregydF4y2Ba/ ERT2−−gydF4y2Ba).对于floxdel在不同组织中的检测,gydF4y2BaMettl3gydF4y2Baf1和gydF4y2BaMettl3gydF4y2Ba-R2引物。floxdel只有在成功缺失的组织中才能观察到318 bp的条带gydF4y2BaMettl3gydF4y2Ba,在约2500bp处伴随较薄的WT带。源数据文件中提供了未裁剪的凝胶。引物序列详见补充表gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
AAV病毒的制备和体内转导gydF4y2Ba
本研究采用血清型8 AAV (AAV8)。在TBG启动子的控制下,将Hnf4a编码测序克隆到AAV8载体上,实现Hnf4a蛋白的肝脏特异性过表达。病毒由Packgene生物技术有限公司(中国广州)包装,最终滴度大于2.0 × 10gydF4y2Ba13gydF4y2Ba病毒基因组/毫升。对于AAV在体内的转导,我们采用了两种策略进行抢救实验。在第一种策略中,每个gydF4y2BaMettl3gydF4y2BacKO小鼠接收1.0 × 10gydF4y2Ba11gydF4y2BaAAV8-Ctrl或AAV8-Hnf4a的病毒基因组在出生后第2天通过颞浅静脉传播。2周龄时处死小鼠作进一步分析。另一种策略是1.0 × 10gydF4y2Ba11gydF4y2Ba注射AAV8-Ctrl或AAV8-Hnf4a病毒基因组/小鼠gydF4y2BaMettl3gydF4y2BacKO小鼠在4周龄时通过尾静脉进行进一步的存活率分析。gydF4y2Ba
血清分析gydF4y2Ba
使用日立7020全自动生化分析仪(日立,东京,日本)检测血清肝功能指标(碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、天门冬氨酸转氨酶(AST)、白蛋白、胆固醇、甘油三酯、总胆汁酸、总胆红素和直接胆红素)水平。gydF4y2Ba
人体标本gydF4y2Ba
人肝组织取自中山大学第三附属医院肝移植手术中心脏死亡(DCD)后的捐赠。该研究已获得中山大学附属第三医院医学伦理委员会的批准。该研究的设计和实施遵守了所有关于使用人体研究参与者的相关规定,并遵循赫尔辛基宣言制定的标准进行。gydF4y2Ba
细胞培养gydF4y2Ba
HEK293T和HepG2细胞来自American Type Culture Collection (ATCC),培养于dmem -高糖培养基(Thermo Scientific, C11995500BT)中,添加10%胎牛血清(FBS) (PAN, P30-3302)。细胞在37°C的5% CO的潮湿气氛中孵育gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
原发性肝细胞分离gydF4y2Ba
原代肝细胞采用传统的两步胶原酶灌注法分离gydF4y2Ba59gydF4y2Ba.简言之,EGTA缓冲液(8000 mg/L NaCl, 400 mg/L KCl, 76.67 mg/L NaH)经门静脉插管灌注小鼠gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 120.45 mg/L NagydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4gydF4y2BaHEPES 2380 mg/L, NaHCO 350 mg/LgydF4y2Ba3.gydF4y2Ba, EGTA 190 mg/L,葡萄糖900 mg/L, PH = 7.35-7.4),以8 mL/min浸泡2 min,然后加入酶缓冲液(8000 mg/L NaCl, 400 mg/L KCl, 76.67 mg/L NaH)gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 120.45 mg/L NagydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4gydF4y2BaHEPES 2380 mg/L, NaHCO 350 mg/LgydF4y2Ba3.gydF4y2Ba, 481.8 mg/L氯化钙gydF4y2Ba2gydF4y2Ba, PH = 7.35-7.4)含有100 U/mL的胶原酶IV (Sigma-Aldrich, C5138),以8 mL/min的速度浸泡8分钟。细胞悬液通过70 μm细胞过滤器(Sorfa, 251200)过滤。清洗三次后,在4°C下以50 g离心1分钟收集细胞颗粒。然后将细胞重悬于添加10%胎牛血清和1%青霉素/链霉素(KeyGEN Biotech, KGY0023)的Williams’Medium E (GIBCO, 12551032)中,并在I型胶原蛋白(Invitrogen, A048301)预包被培养板中,在37℃、5% CO中培养gydF4y2Ba2gydF4y2Ba孵化器。培养2小时后更换培养基。6小时后将细胞换为无血清培养基,培养过夜后使用。gydF4y2Ba
质粒构建与病毒转导gydF4y2Ba
靶向人shRNAgydF4y2BaMETTL3gydF4y2Ba(上海gydF4y2BaMETTL3gydF4y2Ba),人类gydF4y2BaIGF2BP1gydF4y2Ba(上海gydF4y2BaIGF2BP1gydF4y2Ba)和荧光素酶(shgydF4y2Ba卢克gydF4y2Ba)克隆到pLKO中。1lent我viral vector (Addgene, 10878). All constructs were confirmed by Sanger sequencing. Lentivirus transfections were conducted using polyethylenimine (PEI, Polysciences, 23966) according to the manufacturer’s protocol. Briefly, HEK293T cell was seeded into 6 cm dish, and transfection experiments were performed at 80% confluence. For each well, 335 μl of pre-warmed Opti-MEM (Invitrogen) was mixed with 8 μg of plasmids (target plasmid: psPAX2: pMD2.G = 4:2:1), 36 μl of PEI (1 μg/ml), then incubated for 14 min at room temperature and added to the dish. The culture medium was changed 10 hours later. 48 h after transfection, the supernatants were collected and filtered through a 0.45 μm filter. HepG2 cells were infected with lentivirus-containing supernatants generated in HEK293T supplemented with 1 μg/ml polybrene (Sigma, H9268) for 8 h. Cells were then selected with 1.5 μg/ml puromycin (Thermo Scientific, A1113803) for two consecutive days. TRC lentiviral vectors encoding shRNAs against humanMETTL3gydF4y2Ba和人类gydF4y2BaIGF2BP1gydF4y2Ba在补充表中gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
免疫印迹gydF4y2Ba
组织样品用含有蛋白酶抑制剂(Roche, 04693132001)和磷酸酶抑制剂(Roche, 04906837001)的RIPA缓冲液(50 mM Tris-HCl (PH 7.4), 150 mM NaCl, 0.1% SDS, 1% Triton X-100, 1%脱氧胆酸钠,2 mM EDTA (PH 8.0))裂解。对于细胞,样本被计数,用冰冷的PBS冲洗两次,并与组织一样裂解。然后用SDS-PAGE凝胶分离裂解物并转移到硝化纤维膜上。用含5% (v/w)脱脂牛奶和0.1% Tween-20 (Sigma-Aldrich, P1379)的TBS阻断细胞膜,并依次与一抗和二抗孵育。根据制造商的说明,使用Immobilon ECL Ultra Western HRP底物(Millipore, WBULS500)检测蛋白带。以Gapdh或β-actin作为加载对照。源数据文件中提供了未裁剪的污点。用于western blot的抗体见补充表gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
RNA提取和RT-qPCRgydF4y2Ba
根据制造商的说明,使用TRIzol (Ambion)从组织或细胞中提取总rna,并用紫外分光光度法定量。使用PrimeScript™RT Reagent Kit和gDNA Eraser (Perfect Real Time) (Takara, RR047B)进行反转录。然后使用ChamQ Universal SYBR qPCR Master Mix (Vazyme, Q711-03)在Light Cycler 480 II (Roche)上进行RT-qPCR,重复三次。gydF4y2BaGapdhgydF4y2Ba作为内部控制。RT-qPCR所用引物见补充表gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
H&E,马松三色,免疫组化染色gydF4y2Ba
肝脏标本用4%多聚甲醛固定,石蜡包埋。样品切片成8 μm厚,进行苏木精-伊红(H&E)染色或马松三色染色。免疫组化切片脱蜡,再水化,然后在EDTA抗原回收缓冲液(ZSGB-BIO, ZLI-9072)中在100℃下孵育5分钟。切片用3% H孵育gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba用含0.02% Triton的PBS冲洗三次gydF4y2BaTMgydF4y2BaX-100 (Sigma-Aldrich, T8787),然后与一抗在4°C孵育过夜。以辣根过氧化物酶偶联抗体为二抗,37℃孵育1 h。这种颜色是由Dako Real孵育而成的gydF4y2BaTMgydF4y2Ba工具包(Dako, K5007)。切片用苏木精(Baso, BA4041)反染色,在尼康显微镜下检查。免疫组化染色所用的一抗见补充表gydF4y2Ba2gydF4y2Ba.采用ImageJ软件(1.8.0版)对Masson’s三色染色阳性区和αSMA免疫组化染色阳性区进行定量,每只小鼠5-8个随机野(10*)。gydF4y2Ba
TUNEL分析gydF4y2Ba
将肝组织固定,用OCT复合物(Servicebio, G6059)包埋,切片成8 μm厚,用含0.25% Triton的PBS渗透gydF4y2BaTMgydF4y2BaX-100 (Sigma-Aldrich, T8787),并按照制造商的说明使用原位细胞死亡检测试剂盒(Roche, 11684795910)进行染色。Hoechst 33342 (Beyotime, C1022)用于核反染色。切片在共聚焦显微镜(ZEISS, LSM 880)下观察,图像用ZEN 2012软件分析。TUNEL的量化gydF4y2Ba+gydF4y2Ba细胞/赫斯特33342gydF4y2Ba+gydF4y2Ba用ImageJ软件(version 1.8.0)进行细胞比和平均核直径检测。gydF4y2Ba
PI染色gydF4y2Ba
原代肝细胞进行PI染色。除去培养基,用预热的PBS洗涤细胞两次。然后用碘化丙啶溶液(BD, 556547)在37℃下染色15分钟。Hoechst 33342 (Beyotime, C1022)用于核反染色。在显微镜(Zeiss, Axio Observer Z1)下检测细胞,图像用ZEN 2012软件分析。gydF4y2Ba
油红O染色gydF4y2Ba
将肝组织固定,OCT复合物包埋,切片成8 μm厚。油红O (Sigma-Aldrich, O0625)粉末溶于0.7 g/100 mL浓度的异丙醇中,按3:2的体积比加水稀释,得到油红O溶液。预温组织切片用PBS洗涤2次,油红O溶液染色20 min,再用60%异丙醇洗涤10 s 3次,然后用苏木精(Baso, BA4041)反染,显微镜下观察(尼康)。采用ImageJ软件(1.8.0版),每只小鼠5-8个随机场(10*)定量油红O染色阳性区域。gydF4y2Ba
BODIPY染色gydF4y2Ba
对冷冻肝切片和原代肝细胞进行BODIPY染色。冷冻肝组织切片固定,OCT化合物包埋,切片厚度为8 μm, 7.6 μm BODIPY (Invitrogen, D3922)染色30 min。Hoechst 33342 (Beyotime, C1022)用于核反染色。切片在共聚焦显微镜(ZEISS, LSM 880)下安装和扫描,图像用ZEN 2012软件分析。对于原代肝细胞,除去培养基,用预热的PBS洗涤细胞两次。然后将细胞与肝组织一样染色,并在显微镜下检查(Zeiss, Axio Observer Z1)。gydF4y2Ba
mRNA稳定性测定gydF4y2Ba
对原代肝细胞和HepG2细胞系进行mRNA稳定性检测。原代肝细胞分别从对照组和肝细胞中分离gydF4y2BaMettl3gydF4y2BacKO老鼠。细胞培养过夜后用5 μM放线菌素D (Sigma-Aldrich, A1410)处理0 h、1 h、2 h、4 h和6 h。HepG2细胞培养后,用5 μM放线菌素D处理0 h、40 min、2 h、4 h。RT-qPCR分析中,分离总rna进行逆转录,通过RT-qPCR检测目标基因的mRNA水平。对于RNA稳定性RNA测序,发送总RNA进行RNA测序。gydF4y2Ba
rna测序和mgydF4y2Ba6克ydF4y2Ba一个破坏性的测序gydF4y2Ba
rna测序和mgydF4y2Ba6克ydF4y2Ba肝组织A-RIP测序由广州依必达生物科技有限公司进行。简而言之,对于肝组织RNA测序,总RNA从对照组和对照组中分离gydF4y2BaMettl3gydF4y2BacKO小鼠肝脏在出生后第1天、第1周、第2周、第4周和第8周(每个时间点2只)。序列reads与HISAT2.1.0小鼠基因组版本mm10进行比对gydF4y2Ba60gydF4y2Ba,用DESeq2计算差异表达基因(DEGs)gydF4y2Ba61gydF4y2Ba符合以下标准:|log2FC | > 1且P值< 0.05。基因集富集分析(GSEA)采用GSEA软件(gydF4y2Bahttps://www.broadinstitute.org/gsea/gydF4y2Ba)gydF4y2Ba62gydF4y2Ba.小鼠原代肝细胞RNA稳定性RNA测序,总RNA从对照组和对照组中分离gydF4y2BaMettl3gydF4y2Ba5 μM放线菌素D处理cKO原代肝细胞0 h、2 h、6 h, BerryGenomics Company (gydF4y2Bahttp://www.berrygenomics.com/gydF4y2Ba中国北京)。利用STAR v2.5.3a将Reads定位到小鼠mm10基因组gydF4y2Ba63gydF4y2Ba,保留q评分不小于250的唯一映射reads。基因计数由featurests v2.0.1执行,外显子特征记录在Gencode鼠标注释gtf文件中gydF4y2Ba64gydF4y2Ba.利用edgeR包检测WT与KO在不同时间点的差异表达基因gydF4y2Ba65gydF4y2Ba.为米gydF4y2Ba6克ydF4y2BaA-RIP测序,在WT小鼠出生后第1天、第1周、第2周、第4周和第8周(每个时间点2只)使用TRIZOL试剂从肝脏中分离总RNA,并进行碎片化。米gydF4y2Ba6克ydF4y2Baa修饰的RNA经mgydF4y2Ba6克ydF4y2Ba去除抗体和rRNA。用smart-seq方法制备文库并进行测序。序列reads与HISAT2.1.0小鼠基因组版本mm10进行比对。微分米gydF4y2Ba6克ydF4y2Ba使用exomePeak识别RIP和输入样本之间的a修正峰gydF4y2Ba66gydF4y2Ba.如果一个基因有一个以上的亚型,则最长的亚型被保留。Motif搜索采用HOMER进行gydF4y2Ba67gydF4y2Ba.gydF4y2Ba
LC-MS/MS为mgydF4y2Ba6克ydF4y2Ba检测和量化gydF4y2Ba
体mRNA mgydF4y2Ba6克ydF4y2Ba采用LC-MS/MS法进行改性定量。简单地说,将1 μg纯化后的mRNA在37℃下用S1核酸酶、磷酸二酯酶和碱性磷酸酶充分消化成核苷,然后用氯仿提取得到制备好的溶液样品。样品采用UPLC- esi -MS/MS系统(UPLC, ExionLCgydF4y2BaTMgydF4y2Ba广告,gydF4y2Bahttps://sciex.com.cn/gydF4y2Ba;MS,应用生物系统6500三重四极杆,gydF4y2Bahttps://sciex.com.cn/gydF4y2Ba).流出液交替连接到esi -三重四极线性离子阱(QTRAP)-MS。线性离子阱(LIT)和三重四极子(QQQ)扫描是在配有ESI Turbo离子喷雾接口的三重四极子线性离子阱质谱仪(QTRAP)上进行的,然后在正离子模式下操作,由analysis1.6.3软件(Sciex)控制。利用计划多反应监测(MRM)分析RNA修饰。数据采集使用analysis1.6.3软件(Sciex)。RNA修饰含量用MetWare (gydF4y2Bahttp://www.metware.cn/gydF4y2Ba)基于AB Sciex QTRAP 6500 LC-MS/MS平台。gydF4y2Ba
米gydF4y2Ba6克ydF4y2BaA-RIP-qPCRgydF4y2Ba
米gydF4y2Ba6克ydF4y2BaA-RIP-qRCR根据以前的报告进行gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba.简单地说,从2周或4周大的对照组和对照组中提取总rnagydF4y2BaMettl3gydF4y2BacKO老鼠。使用mRNA纯化试剂盒(Sigma-Aldrich, GenElute)分离Poly(A) mRNAgydF4y2BaTMgydF4y2BamRNA Miniprep Kit MRN10)。在每个实验中进行两轮纯化过程,根据制造商的说明充分去除rRNA污染。5 μg mrna在破碎缓冲液(10mm ZnCl)中94°C孵育30 s,破碎成200-300 nt片段gydF4y2Ba2gydF4y2Ba, 10 mM Tris-HCl (PH 7.0)),然后用50 mM EDTA停止,并用乙醇沉淀纯化。mrna片段和2 μg anti-mgydF4y2Ba6克ydF4y2Ba在600 μL RIP缓冲液(150 mM NaCl, 0.1% Igepal CA-630, 10 mM Tris-HCl (PH 7.4))中加入抗体(Synaptic Systems, 202003)或小鼠IgG (Beyotime, A7028),在4℃下孵育2 h。然后加入15 μL Dynabeads®Protein A珠(Thermo, 100-02D)和15 μL Dynabeads®Protein G珠(Thermo, 100-04D),在4℃下再孵育2 h。用RIP缓冲液清洗珠子5次。RNase抑制剂(Promega, N2611)全程添加。碎片化mrna用100 μL 0.3 μg/μL蛋白酶K (Thermo Scientific, AM2546)在55℃下洗脱1 h,苯酚-氯仿萃取乙醇沉淀纯化。将析出的mrna逆转录,采用RT-qPCR方法进行富集。RT-qPCR引物gydF4y2Ba6克ydF4y2Ba一个阳性区域被标记为“阳性-m”gydF4y2Ba6克ydF4y2BaA-RT”(例如,两个单独m的引物gydF4y2Ba6克ydF4y2Ba一个积极的区域gydF4y2BaPparagydF4y2Ba被列为gydF4y2BaPparagydF4y2BamgydF4y2Ba6克ydF4y2BaA-1-RT和gydF4y2BaPparagydF4y2BamgydF4y2Ba6克ydF4y2BaA-2-RT), m引物gydF4y2Ba6克ydF4y2Ba一个负区域被标记为“负m”gydF4y2Ba6克ydF4y2BaA-RT”(例如,m的引物gydF4y2Ba6克ydF4y2Ba一个负区域gydF4y2BaPparagydF4y2Ba被列为gydF4y2BaPparagydF4y2Ba- mgydF4y2Ba6克ydF4y2Ba在rt)。底漆用于mgydF4y2Ba6克ydF4y2BaA-RIP-qPCR列于补充表gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
RNA免疫沉淀(RIP)-qPCRgydF4y2Ba
RIP是根据之前发布的协议进行修改的gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba.简单地说,用600 μL匀浆缓冲液(100 mM KCl, 5 mM MgCl)匀浆200 mg肝组织gydF4y2Ba2gydF4y2Ba, 10 mM HEPES, pH 7.0, 0.5% Nonidet P-40, 1 mM DTT, 100 U/mL RNase抑制剂(Promega, N2611),然后在冰上孵育5分钟,然后离心得到上清。将2 μg Igf2bp1抗体加入15 μL Dynabeads®Protein A珠(Thermo, 100-02D)和15 μL Dynabeads®Protein G珠(Thermo, 100-04D)中,然后在4℃旋转2 h。抗体珠浆与均质上清液孵育,4°C旋转2 h。用洗涤缓冲液(50 mM Tris-HCl (pH 7.4), 150 mM NaCl, 1 mM MgCl洗涤5次gydF4y2Ba2gydF4y2Ba, 0.05% NP40),用Trizol提取RNA,进行进一步RT-qPCR分析。gydF4y2Ba
双荧光素酶报告分析gydF4y2Ba
利用Phanta Max DNA聚合酶(Vazyme, P505) PCR扩增小鼠Mettl3基因全长编码序列,构建Mettl3过表达载体gydF4y2BaMettl3gydF4y2Ba-PKD-F和gydF4y2BaMettl3gydF4y2Ba-PKD-R引物,然后使用clone express II One Step Cloning kit (Vazyme, C112)克隆到慢病毒载体PKD-EF1中。Mettl3- d395a - w398a催化突变体(DPPW/APPA)载体以Mettl3过表达载体为模板,采用pcr法构建gydF4y2BaMettl3gydF4y2Ba-AWWA-F和gydF4y2BaMettl3gydF4y2Ba- awa - r作为引物)。表达EGFP的PKD-EF1载体作为转染对照。DNA片段gydF4y2BaHnf1agydF4y2Ba而且gydF4y2BaHnf4agydF4y2Ba包含WT mgydF4y2Ba6克ydF4y2Ba一个基序和突变基序(补充图。gydF4y2Ba6摄氏度gydF4y2Ba)由上海杰日生物科技有限公司合成,并在Mlu I和Sac I位点之间亚克隆到pmmir - report萤火虫荧光素酶报告载体(Ambion, AM5795)。所有序列均经Sanger测序证实。将50 ng Mettl3载体(Mettl3过表达载体或对照)、40 ng含有WT或突变片段的萤火虫荧光素酶报告载体和10 ng pRL Renilla荧光素酶对照报告载体(Promega, E2231)在96孔板中共转染HEK293T细胞,共转染三次。24小时后,根据制造商的说明,使用双荧光素酶报告测定系统(Promega, E1910)测定Fluc和Rluc活性。相对荧光素酶活性通过将Fluc活性除以单个Rluc活性来计算,然后归一化为每个试验的对照。PCR引物序列见补充表gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本文提供了原始数据。rna测序和mgydF4y2Ba6克ydF4y2BaA-RIP测序原始数据和处理后的表达矩阵在接入代码下上传到GEO数据集gydF4y2BaGSE197564gydF4y2Ba.测序读数被映射到小鼠mm10基因组。本研究中分析或生成的所有其他数据随文章一起提供。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Ober, E. A. & Lemaigre, F. P.肝脏的发育:对器官和组织形态发生的洞察。gydF4y2Baj .乙醇。gydF4y2Ba68gydF4y2Ba中国农业科学,1049-1062(2018)。gydF4y2Ba
刘,H. H.等。肝细胞核因子的分子功能-在肝内和肝外。gydF4y2Baj .乙醇。gydF4y2Ba68gydF4y2Ba, 1033-1048(2018)。gydF4y2Ba
马基,F. &萨德勒,K. C.揭示肝脏发育、再生和疾病的表观遗传基础。gydF4y2Ba趋势麝猫。gydF4y2Ba36gydF4y2Ba, 587-597(2020)。gydF4y2Ba
Adams, J. M. & Cory, S.小鼠骨髓瘤mRNA中修饰的核苷和奇异的5 ' -末端。gydF4y2Ba自然gydF4y2Ba255gydF4y2Ba, 28-33(1975)。gydF4y2Ba
Desrosiers, R.等人。诺维科夫肝癌细胞信使RNA中甲基化核苷的鉴定。gydF4y2Ba国家科学院学报美国gydF4y2Ba71gydF4y2Ba, 3971-3975(1974)。gydF4y2Ba
佩里,R. P.等。L细胞信使RNA的甲基化成分:5 '端不寻常簇的证据。gydF4y2Ba细胞gydF4y2Ba4gydF4y2Ba, 387-394(1975)。gydF4y2Ba
刘,J.等。METTL3-METTL14复合物介导哺乳动物核RNA n6 -腺苷甲基化。gydF4y2BaNat,化学。医学杂志。gydF4y2Ba10gydF4y2Ba, 93-95(2014)。gydF4y2Ba
王毅,等。n6 -甲基腺苷修饰破坏胚胎干细胞发育调节因子的稳定。gydF4y2Ba细胞生物学。gydF4y2Ba16gydF4y2Ba, 191-198(2014)。gydF4y2Ba
平,X. L.等。哺乳动物WTAP是RNA n6 -甲基腺苷甲基转移酶的调节亚基。gydF4y2Ba细胞Res。gydF4y2Ba24gydF4y2Ba, 177-189(2014)。gydF4y2Ba
郑,G.等。ALKBH5是一种哺乳动物RNA去甲基酶,影响RNA代谢和小鼠生育能力。gydF4y2Ba摩尔。细胞gydF4y2Ba49gydF4y2Ba, 18-29(2013)。gydF4y2Ba
贾,G.等。核RNA中的n6 -甲基腺苷是肥胖相关FTO的主要底物。gydF4y2BaNat,化学。医学杂志。gydF4y2Ba7 gydF4y2Ba, 885-887(2011)。gydF4y2Ba
李,A.等。细胞质(6)读本YTHDF3促进mRNA翻译。gydF4y2Ba细胞Res。gydF4y2Ba27gydF4y2Ba, 444-447(2017)。gydF4y2Ba
Shi, H.等。YTHDF3促进N(6)-甲基腺苷修饰RNA的翻译和降解。gydF4y2Ba细胞Res。gydF4y2Ba27gydF4y2Ba, 315-328(2017)。gydF4y2Ba
肖,W.等。核(6)读本YTHDC1调控mRNA剪接。gydF4y2Ba摩尔。细胞gydF4y2Ba61gydF4y2Ba, 507-519(2016)。gydF4y2Ba
王,等。n6 -甲基腺苷依赖对信使RNA稳定性的调控。gydF4y2Ba自然gydF4y2Ba505gydF4y2Ba, 117-120(2014)。gydF4y2Ba
王,等。N(6)-甲基腺苷调节信使RNA翻译效率。gydF4y2Ba细胞gydF4y2Ba161gydF4y2Ba, 1388-1399(2015)。gydF4y2Ba
黄,H.等。IGF2BP蛋白对RNA N(6)-甲基腺苷的识别增强了mRNA的稳定性和翻译。gydF4y2Ba细胞生物学。gydF4y2Ba20.gydF4y2Ba, 285-295(2018)。gydF4y2Ba
赵,b.s.等。mRNA修饰的转录后基因调控。gydF4y2Ba细胞生物学。gydF4y2Ba18gydF4y2Ba, 31-42(2017)。gydF4y2Ba
Geula, S.等。干细胞。m6A mRNA甲基化促进了幼稚多能分化的解决。gydF4y2Ba科学gydF4y2Ba347gydF4y2Ba, 1002-1006(2015)。gydF4y2Ba
孟,t.g.等。Mettl14通过促进外胚层成熟来促进小鼠植后发育。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba33gydF4y2Ba, 1179-1187(2019)。gydF4y2Ba
王毅,等。N(6)-甲基腺苷RNA修饰通过组蛋白修饰调节胚胎神经干细胞的自我更新。gydF4y2BaNat。>。gydF4y2Ba21gydF4y2Ba, 195-206(2018)。gydF4y2Ba
Li, H. B. et al. m(6)A mRNA甲基化通过靶向IL-7/STAT5/SOCS通路控制T细胞稳态。gydF4y2Ba自然gydF4y2Ba548gydF4y2Ba, 338-342(2017)。gydF4y2Ba
王,P.等。甲基转移酶Mettl3和Mettl14协同功能的结构基础。gydF4y2Ba摩尔。细胞gydF4y2Ba63gydF4y2Ba, 306-317(2016)。gydF4y2Ba
王,等。METTL3-METTL14配合物甲基化N(6)-腺苷的结构基础。gydF4y2Ba自然gydF4y2Ba534gydF4y2Ba, 575-578(2016)。gydF4y2Ba
瓦特,a.j.等人。HNF4:肝细胞分化和功能的中心调节因子。gydF4y2Ba肝脏病学gydF4y2Ba37gydF4y2Ba, 1249-1253(2003)。gydF4y2Ba
海赫斯特,g.p.等。肝细胞核因子4alpha(核受体2A1)对维持肝脏基因表达和脂质稳态至关重要。gydF4y2Ba细胞生物学。gydF4y2Ba21gydF4y2Ba, 1393-1403(2001)。gydF4y2Ba
Parviz, F. et al。肝细胞核因子4控制肝上皮细胞的发育和肝形态发生。gydF4y2BaNat,麝猫。gydF4y2Ba34gydF4y2Ba, 292-296(2003)。gydF4y2Ba
孟,x.m.等。tgf - β:纤维化的主要调节因子。gydF4y2BaNat. Rev. Nephrol。gydF4y2Ba12gydF4y2Ba, 325-338(2016)。gydF4y2Ba
哈伯,B.等。围产期和再生肝脏中肝脏特异性和生长诱导基因的共表达:快速增殖期间分化状态的获得和维持。gydF4y2Ba肝脏病学gydF4y2Ba22gydF4y2Ba, 906-914(1995)。gydF4y2Ba
Metzger, D. & Chambon, P.小鼠的位点和时间特异性基因靶向。gydF4y2Ba方法gydF4y2Ba24gydF4y2Ba, 71-80(2001)。gydF4y2Ba
猪出生后肝脏发育的mRNA n6 -甲基腺苷甲基化。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba12gydF4y2Ba, e0173421(2017)。gydF4y2Ba
刘,J.等。m(6)A和m(6)Am甲基化组在人类和小鼠组织中的分布和调控。gydF4y2Ba摩尔。细胞gydF4y2Ba77gydF4y2Ba, 426 - 440。e426(2020).
中垣,B. N.等。新生儿发育期间的免疫和代谢变化会重新编程肝脏的特性和功能。gydF4y2Baj .乙醇。gydF4y2Ba69gydF4y2Ba, 1294-1307(2018)。gydF4y2Ba
Si-Tayeb, K.等。肝脏的器官发生和发育。gydF4y2BaDev细胞。gydF4y2Ba18gydF4y2Ba, 175-189(2010)。gydF4y2Ba
Gao, Y. et al. m(6)在造血发育过程中,一种修饰可以阻止内源性双链rna的形成和有害的先天免疫反应。gydF4y2Ba免疫力gydF4y2Ba52gydF4y2Ba, 1007 - 1021。e1008 (2020).
李,H.等。在造血干细胞分化过程中,mettl3依赖的m(6)A mRNA甲基化的阶段特异性需求。gydF4y2Ba细胞生物学。gydF4y2Ba21gydF4y2Ba, 700-709(2019)。gydF4y2Ba
Zhang, C. et al. m6A调节造血干细胞和祖细胞规格。gydF4y2Ba自然gydF4y2Ba549gydF4y2Ba, 273-276(2017)。gydF4y2Ba
Ma, C.等。RNA(6)甲基化参与小鼠小脑出生后发育的调节。gydF4y2Ba基因组医学杂志。gydF4y2Ba19gydF4y2Ba, 68(2018)。gydF4y2Ba
尹,K. J.等。m(6)A甲基化对哺乳动物皮质神经发生的时间控制。gydF4y2Ba细胞gydF4y2Ba171gydF4y2Ba, 877 - 889。e817(2017).
翁,H.等。METTL14抑制造血干/祖细胞分化,并通过mRNA m6A修饰促进白血病发生。gydF4y2Ba细胞干细胞gydF4y2Ba22gydF4y2Ba, 191 - 205。e199(2018).
吴,Z.等。METTL3通过m6a依赖的MIS12 mRNA稳定来抵消过早衰老。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, 11083-11096(2020)。gydF4y2Ba
张,J.等。Lamin A保护m(6) A甲基化酶METTL14核散斑库防止细胞衰老。gydF4y2Ba衰老细胞gydF4y2Ba19gydF4y2Ba, e13215(2020)。gydF4y2Ba
Min, K. W.等。m6A RNA修饰鉴定出AGO2 mRNA稳定性的年龄相关调控。gydF4y2Ba衰老细胞gydF4y2Ba17gydF4y2Ba, e12753(2018)。gydF4y2Ba
老化和肝脏再生。gydF4y2Ba性趋势。金属底座。gydF4y2Ba20.gydF4y2Ba, 171-176(2009)。gydF4y2Ba
谢伟,等。METTL3通过n6 -甲基腺苷修饰Fasn mRNA和促进脂肪酸代谢抑制肝脏胰岛素敏感性。gydF4y2Ba物化学。Biophys。Commun >,gydF4y2Ba518gydF4y2Ba, 120-126(2019)。gydF4y2Ba
Huang, H. et al. m(6)编码和非编码rna的修饰:在癌症中的作用和治疗意义。gydF4y2Ba癌症细胞gydF4y2Ba37gydF4y2Ba, 270-288(2020)。gydF4y2Ba
赵,Z.等。肝脏疾病的外延转录组学:基本概念和治疗潜力。gydF4y2Baj .乙醇。gydF4y2Ba73gydF4y2Ba, 664-679(2020)。gydF4y2Ba
Schrem, H.等人。肝脏富集转录因子在肝功能和发育中的作用。第一部分:肝细胞核因子网络与肝脏特异性基因表达。gydF4y2Ba杂志。牧师。gydF4y2Ba54gydF4y2Ba, 129-158(2002)。gydF4y2Ba
郭,C. J.等。涉及哺乳动物细胞类型规范的转录层次。gydF4y2Ba自然gydF4y2Ba355gydF4y2Ba, 457-461(1992)。gydF4y2Ba
奥多姆,d.t.等。HNF转录因子对胰腺和肝脏基因表达的控制。gydF4y2Ba科学gydF4y2Ba303gydF4y2Ba, 1378-1381(2004)。gydF4y2Ba
Miura, N. & Tanaka, K.大鼠肝细胞核因子(HNF) 1基因启动子的分析:HNF4和HNF1蛋白的协同激活。gydF4y2Ba核酸测定。gydF4y2Ba21gydF4y2Ba, 3731-3736(1993)。gydF4y2Ba
田建明,田建明,田建明。肝细胞核因子1编码基因的组织特异性表达可能涉及肝细胞核因子4。gydF4y2BaDev的基因。gydF4y2Ba5gydF4y2Ba, 2225-2234(1991)。gydF4y2Ba
Kan, R. L.等。基因调控中外转录组和外遗传机制之间的串扰。gydF4y2Ba趋势麝猫。gydF4y2Ba38gydF4y2Ba, 182-193(2022)。gydF4y2Ba
刘,J.等。RNA m(6)读本YTHDC1抑制逆转录转座子并保护ES细胞的身份。gydF4y2Ba自然gydF4y2Ba591gydF4y2Ba, 322-326(2021)。gydF4y2Ba
徐伟等。METTL3调节小鼠胚胎干细胞异染色质。gydF4y2Ba自然gydF4y2Ba591gydF4y2Ba, 317-321(2021)。gydF4y2Ba
冯塞卡,t.l.等。新生儿甲状腺素激活改变肝脏的表观遗传编程。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 4446(2021)。gydF4y2Ba
范,D. N.等。组蛋白赖氨酸甲基转移酶是变异3-9同源物1的抑制因子,可促进肝细胞癌的进展,并受microRNA-125b负调控。gydF4y2Ba肝脏病学gydF4y2Ba57gydF4y2Ba, 637-647(2013)。gydF4y2Ba
徐,K.等。mettl3介导的m(6)A调控精原细胞分化和减数分裂启动。gydF4y2Ba细胞Res。gydF4y2Ba27gydF4y2Ba, 1100-1114(2017)。gydF4y2Ba
克拉尼格,J. E.等。小鼠肝细胞培养。一、肝细胞分离。gydF4y2Ba体外gydF4y2Ba17gydF4y2Ba, 913-925(1981)。gydF4y2Ba
金,D.等人。HISAT:具有低内存需求的快速拼接对齐器。gydF4y2BaNat方法。gydF4y2Ba12gydF4y2Ba, 357-360(2015)。gydF4y2Ba
爱,m.i.等人。使用DESeq2调节RNA-seq数据的折叠变化和色散估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
萨勃拉曼尼亚,A.等。基因集富集分析:解释全基因组表达谱的一种基于知识的方法。gydF4y2Ba国家科学院学报美国gydF4y2Ba102gydF4y2Ba, 15545-15550(2005)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Liao, Y. et al. featu复述:一种高效的通用程序,用于分配序列读取基因组特征。gydF4y2Ba生物信息学gydF4y2Ba30.gydF4y2Ba, 923-930(2014)。gydF4y2Ba
Robinson, m.d.等人edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 139-140(2010)。gydF4y2Ba
孟,J.等。利用MeRIP-Seq数据和exomePeak R/Bioconductor包进行RNA甲基化差异分析的方案。gydF4y2Ba方法gydF4y2Ba69gydF4y2Ba, 274-281(2014)。gydF4y2Ba
金,T.等人。Octopus-toolkit:自动挖掘公共表观基因组和转录组下一代测序数据的工作流程。gydF4y2Ba核酸测定。gydF4y2Ba46gydF4y2Ba, e53(2018)。gydF4y2Ba
Dominissini, D.等人。基于免疫捕获和大规模并行测序的m(6)A-seq对N(6)-甲基腺苷的转录组范围映射。gydF4y2BaProtoc Nat。gydF4y2Ba8gydF4y2Ba, 176-189(2013)。gydF4y2Ba
Peritz, T.等人。mrna -蛋白复合物的免疫沉淀。gydF4y2BaProtoc Nat。gydF4y2Ba1克ydF4y2Ba, 577-580(2006)。gydF4y2Ba
基恩,J. D.等。RIP-Chip:从细胞提取物中分离和鉴定核糖核蛋白复合物的mrna、microRNAs和蛋白质成分。gydF4y2BaProtoc Nat。gydF4y2Ba1克ydF4y2Ba, 302-307(2006)。gydF4y2Ba
确认gydF4y2Ba
我们对张琪和徐燕实验室所有成员的讨论和技术援助表示充分的敬意和感谢。国家重点研究发展计划项目(No. 2017YFA0106100, x.y)、国家自然科学基金项目(No. 81970537, x.y;31601184号,X.Y.;编号81870449,Z.Q.;广东省基础与应用基础研究基金项目(No. 2020A1515011385, X.Y.),广州市科技计划项目(No. 202206010072, X.Y.),中山大学中央高校基本科研业务费专项(No. 22ykqb02, X.Y.),广东省科技计划项目(2020B1212060019)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Q.Z.和Y.X.构想了这个想法,监督了这项研究,分析了数据,并获得了资金。Y.X.在z.z的帮助下起草了手稿,x.k.q.z对手稿进行了批判性的修改。Z.Z.和X.K.对实验设计做出了贡献,并在l.p.、c.l.、x.l.、j.c.、s.d.、y.l.、q.l.、y.s.和S.Y.的帮助下进行了大部分实验。手稿经所有作者阅读并批准。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢李华兵和其他匿名审稿人对本工作的同行评议所作的贡献。可以获得同行评审报告。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
徐勇,周哲,康,X。gydF4y2Baet al。gydF4y2Bamettl3介导的mRNA mgydF4y2Ba6克ydF4y2Ba一种修饰通过调节转录因子Hnf4a控制出生后肝脏发育。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 4555(2022)。https://doi.org/10.1038/s41467-022-32169-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-32169-4gydF4y2Ba
这篇文章被引用gydF4y2Ba
n6 -甲基腺苷修饰通过稳定糖原合成酶2mrna调控肝糖发生gydF4y2Ba
自然通讯gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba