摘要gydF4y2Ba
慢性胰腺炎(CP)以慢性炎症和外分泌和内分泌胰腺组织的渐进性纤维化替代为特征。在实验CP的转基因小鼠模型(脱氮小鼠)中,我们通过选择性耗竭foxp3阳性细胞,确定Treg细胞为纤维炎症反应的中枢调节因子。在Treg耗竭的脱氮小鼠中,CP的诱导导致间质沉积显著增加,外分泌不足的发展和疾病发病后第14天开始的显著体重减轻。在CP中,FOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞通过抑制GATA3来抑制2型免疫反应gydF4y2Ba+gydF4y2BaT辅助细胞(Th2), GATA3gydF4y2Ba+gydF4y2Ba先天淋巴样细胞2型(ILC2)和CD206gydF4y2Ba+gydF4y2BaM2-macrophages。纤维化组织替代背后的可疑病理机制可能涉及巨噬细胞中激活素A表达及其反调节因子卵泡抑素的异常平衡。我们的研究发现Treg细胞是CP期间2型免疫反应和器官重塑的关键调节因子,Treg/Th2轴可能是预防纤维化和保存功能胰腺组织的治疗靶点。gydF4y2Ba
简介gydF4y2Ba
慢性胰腺炎(CP)是一种常见的胃肠道疾病,其特征是胰腺的进行性炎症过程,导致外分泌和内分泌组织的不可逆纤维化替代。这些形态改变,最终导致胰腺功能不全gydF4y2Ba1克ydF4y2Ba而糖尿病常伴有慢性疼痛gydF4y2Ba2 gydF4y2Ba并显著影响患者的生活质量gydF4y2Ba3 gydF4y2Ba.由于慢性胰腺炎无法治愈,对症治疗主要是缓解疼痛,改善吸收不良,治疗糖尿病gydF4y2Ba4gydF4y2Ba.gydF4y2Ba
胰脏内消化酶激活与腺泡细胞死亡相关,是CP发病和进展的初始触发事件gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba.促炎免疫反应的激活有助于胰腺损伤gydF4y2Ba8 gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba先天免疫系统的细胞,如单核/巨噬细胞和中性粒细胞,会浸润受损的胰腺gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba.特别是巨噬细胞作为先天免疫系统中具有巨大可塑性的细胞群,执行不同的任务,因此参与了急性的表现gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba以及慢性形式gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba胰腺炎。最近的数据说明了疾病如何从急性期的促炎症发展到组织修复和纤维化gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba在再生阶段。另外,活化的巨噬细胞被认为是纤维发生和组织再生的关键介质gydF4y2Ba13gydF4y2Ba.它们的特征是释放转化生长因子TGF-β, TGF-α,血小板衍生生长因子PDGFgydF4y2Ba16gydF4y2Ba或抗炎细胞因子IL-10gydF4y2Ba17gydF4y2Ba促进伤口愈合和纤维生成gydF4y2Ba18gydF4y2Ba.静止胰腺星状细胞(PSC)被TGF-β激活gydF4y2Ba19gydF4y2Ba并产生细胞外基质蛋白,如I型和III型胶原蛋白gydF4y2Ba20.gydF4y2Ba.PSC的过度激活可能有利于组织纤维化而不是组织修复,并可能导致外分泌和内分泌组织的损失。在胰腺炎中,纤维化组织替换与2型免疫反应相关gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.与受损胰腺内的局部促炎反应同时,一种防止过度炎症的全身对抗调节被激活gydF4y2Ba22gydF4y2Ba.gydF4y2Ba
FOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2Ba调节性T细胞(Treg细胞)是已知的平衡免疫反应和防止过度炎症反应的细胞玩家gydF4y2Ba23gydF4y2Ba它们作用于先天免疫系统和适应性免疫系统的细胞gydF4y2Ba24gydF4y2Ba并代表组织修复过程的调节器gydF4y2Ba25gydF4y2Ba.CP的特点是突出的2型免疫反应gydF4y2Ba26gydF4y2Ba涉及Th2细胞和通过IL-4/IL-13轴交替激活的巨噬细胞gydF4y2Ba22gydF4y2Ba.在这里,我们研究了FOXP3的影响gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞在慢性胰腺炎小鼠模型中使用的DEREG小鼠调节性T细胞被耗尽gydF4y2Ba27gydF4y2Ba.gydF4y2Ba
在这里,我们表明抑制由Treg细胞作用的2型免疫反应对于防止组织破坏和胰腺纤维化是必不可少的。gydF4y2Ba
结果gydF4y2Ba
CP与Treg细胞的活化和2型免疫反应有关gydF4y2Ba
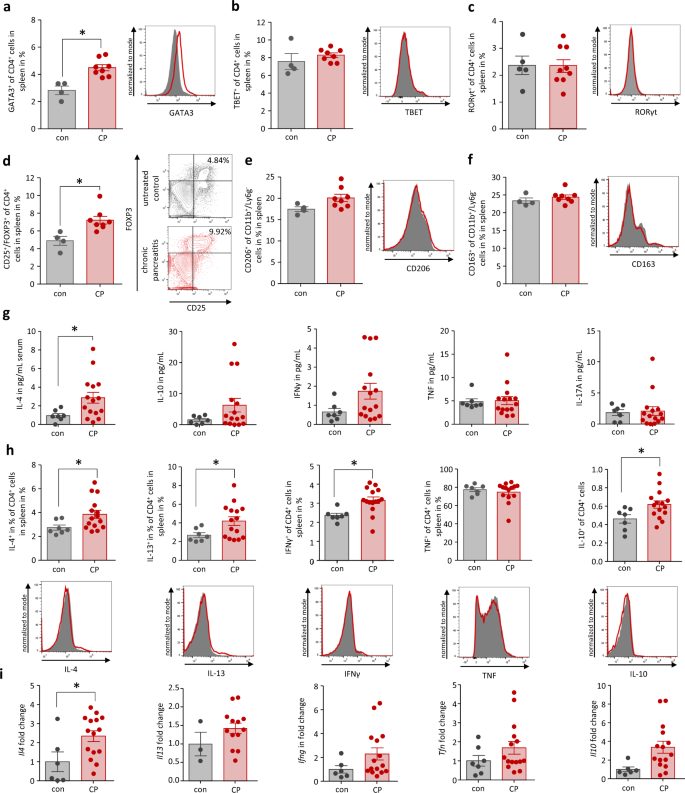
如治疗方案所示,C57Bl/6小鼠在4周内通过反复注射蓝青素诱导CP(补充图)。gydF4y2Ba1gydF4y2Ba).动物在最后一次蓝靛素治疗3d后被处死。脾细胞流式细胞术检测系统免疫反应显示GATA3升高gydF4y2Ba+gydF4y2BaTh2细胞(图;gydF4y2Ba1gydF4y2Ba),与未处理的对照组相比(con),而TBETgydF4y2Ba+gydF4y2BaTh1细胞和RORγtgydF4y2Ba+gydF4y2BaTh-17细胞未受影响(图。gydF4y2Ba1克ydF4y2Bab,gydF4y2BacgydF4y2Ba).有趣的是,我们还观察到FOXP3的显著增加gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2Ba调节性T细胞(图;gydF4y2Ba1 dgydF4y2Ba).与这些适应性免疫反应的变化相反,我们只观察到CD206的轻微而不显著的增加gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaLy6GgydF4y2Ba-gydF4y2Ba巨噬细胞(图gydF4y2Ba1 egydF4y2Ba).CD163gydF4y2Ba+gydF4y2Ba,脾脏中交替激活的巨噬细胞的第二个标记,也保持稳定(图。gydF4y2Ba1 fgydF4y2Ba).CP小鼠血清细胞因子IL-4水平明显升高,而血清IL-10和IFNγ水平升高不显著,TNF和IL-17A没有改变(图。gydF4y2Ba1克gydF4y2Ba).来测试CD4gydF4y2Ba+gydF4y2Bat辅助细胞是这些细胞因子的来源,我们分离脾细胞,用流式细胞术分析它们的细胞因子产生情况(图。gydF4y2Ba1 hgydF4y2Ba).我们观察到产生CD4的IL-4、IL-13显著增加gydF4y2Ba+gydF4y2Ba有趣的是,还有IFNγ产生CD4gydF4y2Ba+gydF4y2Ba与TNF相比,CP小鼠的细胞显著升高gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba细胞。除了这些产生Th2和Th1细胞因子的细胞外,我们还观察到IL-10略有增加gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba细胞。RT-qPCR对脾细胞的分析证实了Th2细胞因子的增加(图。gydF4y2Ba1我gydF4y2Ba).gydF4y2Ba
分析对照(con)和慢性胰腺炎(CP)小鼠的脾细胞。gydF4y2Ba一个gydF4y2BaT细胞(CD4gydF4y2Ba+gydF4y2Ba)通过细胞内转录因子GATA3染色显示Th2细胞的分化(gydF4y2BapgydF4y2Ba= 0.0016, congydF4y2BangydF4y2Ba= 4 / CPgydF4y2BangydF4y2Ba= 8),gydF4y2BabgydF4y2BaTh1细胞的TBET,gydF4y2BacgydF4y2Bar γt对Th17细胞和gydF4y2BadgydF4y2BaFOXP3与CD25结合以区分Treg细胞(gydF4y2BapgydF4y2Ba= 0.0085,反gydF4y2BangydF4y2Ba= 4 / CPgydF4y2BangydF4y2Ba= 8)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba与GATA3相反gydF4y2Ba+gydF4y2BaTh2细胞CD206增加gydF4y2Ba+gydF4y2Ba或CD163gydF4y2Ba+gydF4y2Ba另外,未观察到激活的巨噬细胞。gydF4y2BaggydF4y2Ba血清IL-4浓度明显升高(gydF4y2BapgydF4y2Ba= 0.0422, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15),而IL-10、IFNγ、TNF和IL-17A浓度的升高不显著(congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BahgydF4y2BaCD4细胞内细胞因子的产生gydF4y2Ba+gydF4y2Ba在布莱非汀a/莫能菌素处理后,通过标记IL-4、IL-13、IFNγ、TNF和IL-10分析T细胞。Th2细胞因子IL-4gydF4y2BapgydF4y2Ba= 0.0443, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15), il-13 (gydF4y2BapgydF4y2Ba= 0.0455, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)和IL-10 (gydF4y2BapgydF4y2Ba= 0.0294, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15), CD4升高gydF4y2Ba+gydF4y2Ba而Th1细胞因子中只有IFNγ (gydF4y2BapgydF4y2Ba= 0.0072,反gydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)升高,但TNF (congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 14)。gydF4y2Ba我gydF4y2BaRT-qPCR法检测脾细胞基因表达gydF4y2BaIl4gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0250, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)gydF4y2Ba使用Il13gydF4y2Ba(反对gydF4y2BangydF4y2Ba= 3 / CPgydF4y2BangydF4y2Ba= 13),gydF4y2BaIl10gydF4y2Ba(反对gydF4y2BangydF4y2Ba= 6 / CPgydF4y2BangydF4y2Ba= 15)gydF4y2Ba肿瘤坏死因子gydF4y2Ba(反对gydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)和gydF4y2BaIfnggydF4y2Ba(反对gydF4y2BangydF4y2Ba= 6 / CPgydF4y2BangydF4y2Ba= 15),证实Th2分化。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。所有数据均以均数±SEM表示,采用独立样本和显著性水平的非配对双尾学生t检验检验差异有统计学意义gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
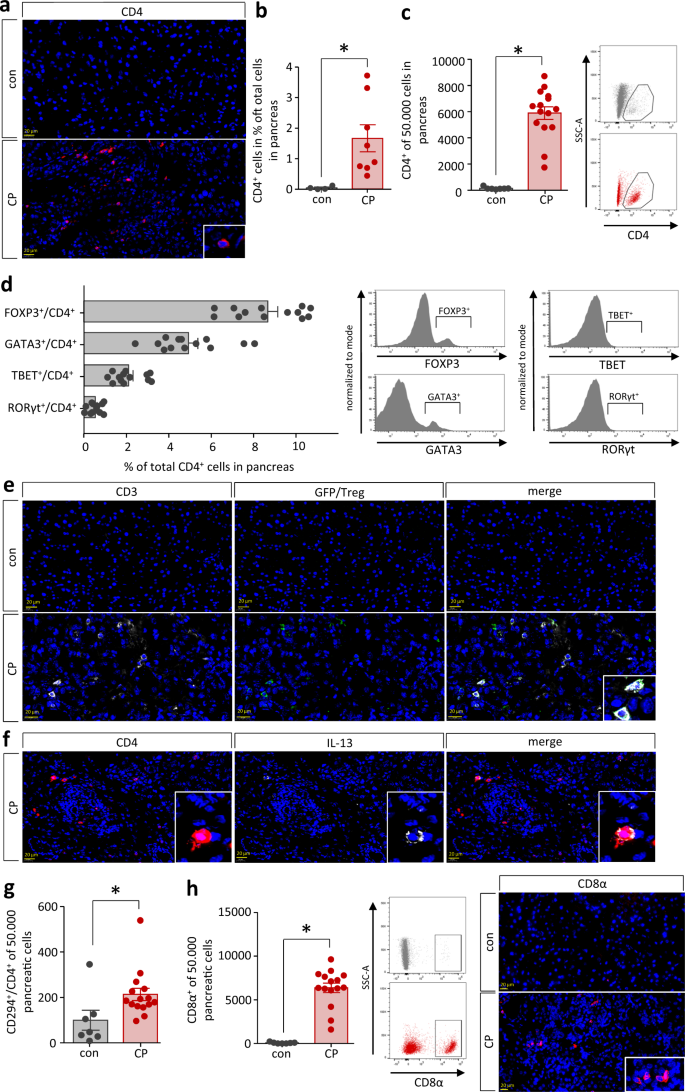
接下来,我们感兴趣的是,类似于在脾脏中观察到的th2反应,是否也能在慢性胰腺炎组织中观察到。小鼠胰腺CD4细胞的免疫荧光标记显示CP过程中T细胞浸润(图。gydF4y2Ba2 gydF4y2Ba一个,gydF4y2BabgydF4y2Ba).为了研究这些CD4细胞gydF4y2Ba+gydF4y2Ba我们利用组织分离试剂盒对T细胞进行了更详细的研究,并通过流式细胞术分析了分离的单个胰腺细胞。我们再次观察到CD4细胞显著增加gydF4y2Ba+gydF4y2BaCP小鼠胰腺中的T细胞(图;gydF4y2Ba2摄氏度gydF4y2Ba).我们使用转录因子染色更具体地确定Th1, Th2, Th17和Treg细胞(图。gydF4y2Ba二维gydF4y2Ba).而我们观察到FOXP3的比例很高gydF4y2Ba+gydF4y2BaTreg细胞和GATA3gydF4y2Ba+gydF4y2BaTh2细胞,TBETgydF4y2Ba+gydF4y2BaTh1细胞和RORγtgydF4y2Ba+gydF4y2BaTh17细胞的数量要少得多。令人惊讶的是CD4最突出的人群gydF4y2Ba+gydF4y2BaT细胞是FOXP3gydF4y2Ba+gydF4y2BaTreg细胞。为了证实这些结果,我们对Treg细胞进行了染色。在FOXP3启动子的控制下,表达白喉毒素受体(DTR)-eGFP融合转基因的调节性T细胞(DEREG)小鼠也诱导了CPgydF4y2Ba27gydF4y2Ba.这使我们能够通过抗gfp免疫荧光标记检测Treg细胞。值得注意的是,我们能够检测到CD3gydF4y2Ba+gydF4y2Ba慢性胰腺炎诱导后,DEREG小鼠胰腺中的Treg细胞/GFP阳性。gydF4y2Ba2 egydF4y2Ba).除Treg细胞外,我们还检测到GATA3gydF4y2Ba+gydF4y2Ba胰腺内的Th2细胞,其特征是释放Th2细胞因子IL-4和IL-13。CD4和IL-13共标记显示器官内零星双阳性细胞(图。gydF4y2Ba2 fgydF4y2Ba).Th2细胞的第二个标志是前列腺素D的表达gydF4y2Ba2 gydF4y2Ba受体2 (CRTH2或CD294)gydF4y2Ba28gydF4y2Ba我们还发现,在CP小鼠的胰腺组织中,其含量增加(图2)。gydF4y2Ba2 ggydF4y2Ba).除了CD4gydF4y2Ba+gydF4y2BaT细胞,大量CD8αgydF4y2Ba+gydF4y2Ba细胞也迁移到慢性炎症的胰腺(图。gydF4y2Ba2 hgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2BaCP小鼠胰腺CD4细胞免疫荧光标记显示CD4细胞明显浸润gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BapgydF4y2Ba= 0.0308, congydF4y2BangydF4y2Ba= 4 / CPgydF4y2BangydF4y2Ba= 8),比例尺为20µm。gydF4y2BacgydF4y2Ba流式细胞术检测分离的胰腺白细胞,CD4明显升高gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BadgydF4y2BaT细胞中FOXP3所占比例最大gydF4y2Ba+gydF4y2BaTreg细胞和GATA3细胞gydF4y2Ba+gydF4y2BaTh2细胞gydF4y2Ba,gydF4y2Ba而TBETgydF4y2Ba+gydF4y2BaTh1和RORγtgydF4y2Ba+gydF4y2BaTh17细胞只能检测到少量(gydF4y2BangydF4y2Ba= 13)。gydF4y2BaegydF4y2Ba在dt处理的DEREG小鼠和未处理的对照动物(con)中,对DTR-eGFP转基因表达的分析表明CD3的存在gydF4y2Ba+gydF4y2Ba/ GFPgydF4y2Ba+gydF4y2Ba细胞仅存在于CP动物胰腺部分,比例尺为20µm。gydF4y2BafgydF4y2Ba标签啊gydF4y2BafgydF4y2BaCD4与Th2细胞因子IL-13结合,在CP小鼠胰腺中发现双阳性Th2细胞,标尺为20µm。gydF4y2BaggydF4y2Ba通过流式细胞术分析胰腺白细胞,测量了Th2细胞的第三个标志物CRTH2 (CD294)的升高,并强调了胰腺内Th2细胞的增加(gydF4y2BapgydF4y2Ba= 0.0326, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BahgydF4y2Ba流式细胞术也可观察到CD8α细胞浸润胰腺(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)和免疫荧光标记,比例尺为20µm。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba的独立样本和显著性水平检验gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
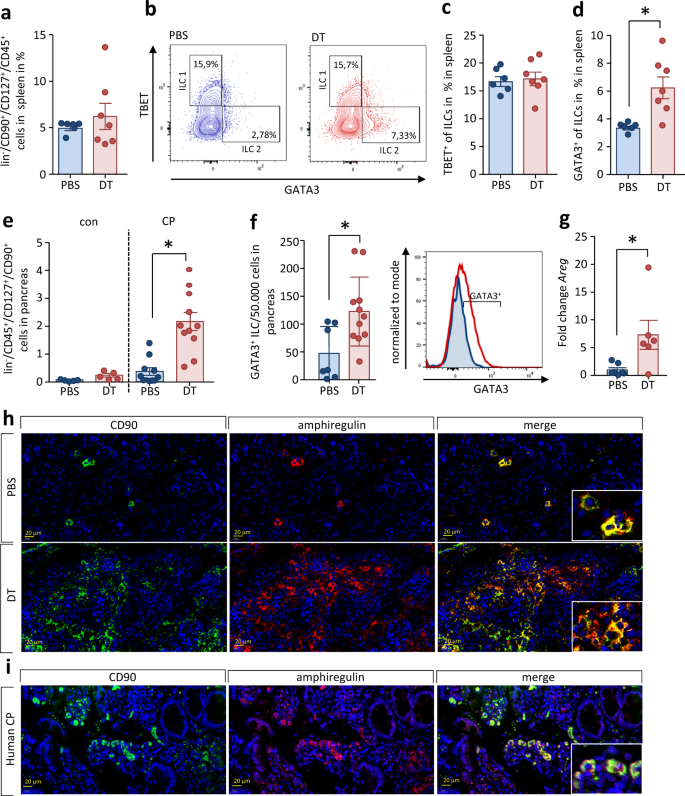
慢性炎症胰腺中的大多数白细胞趋化因子受体CCR2呈阳性(图。gydF4y2Ba3gydF4y2Ba),表明它们在CP过程中的迁移是由趋化因子触发的。CP的另一个特征是交替激活CD206的显著增加gydF4y2Ba+gydF4y2Ba控制组织纤维化的巨噬细胞gydF4y2Ba13gydF4y2Ba.我们观察到大量的CD11bgydF4y2Ba+gydF4y2Ba交替激活的巨噬细胞(图;gydF4y2Ba3 bgydF4y2Ba).CD206或CD163阳性(图;gydF4y2Ba3 cgydF4y2Ba).Ly6ggydF4y2Ba+gydF4y2Ba中性粒细胞的数量可以忽略不计(补充图。gydF4y2Ba2 gydF4y2Ba).小鼠CP组织的组织学标记和细胞定量也显示交替激活CD206的数量增加gydF4y2Ba+gydF4y2Ba巨噬细胞伴有明显的胶原1染色,这表明纤维化瘢痕(图。gydF4y2Ba3 dgydF4y2Ba).这些CD206gydF4y2Ba+gydF4y2Ba巨噬细胞表达细胞因子IL-33,如荧光标记所示(图2)。gydF4y2Ba3 egydF4y2Ba).IL-33通过st2受体参与Th2细胞和先天淋巴样细胞2型(ILC2)的分化。ILC2是2型免疫反应的主要组成部分。先天淋巴样细胞的特点是缺乏特定的谱系标记(lingydF4y2Ba-gydF4y2Ba),但表达CD45、CD127和CD90(补充图;gydF4y2Ba3 gydF4y2Ba).ILC2s还表达转录因子GATA3。我们可以发现ilc2 (lingydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2BaGATA3gydF4y2Ba+gydF4y2Ba)在CP小鼠的胰腺(图;gydF4y2Ba3 fgydF4y2Ba).与Th2细胞一样,ilc2也能表达细胞因子IL-4gydF4y2Ba29gydF4y2Ba和IL-13gydF4y2Ba30.gydF4y2Ba.流式细胞术分析脾GATA3中IL-4和IL-13染色的平均荧光强度升高gydF4y2Ba+gydF4y2BaILCs (ilc2)与GATA3相比gydF4y2Ba-gydF4y2Bailc或同型对照(补充图。gydF4y2Ba4gydF4y2Ba).此外,GATA3gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba-gydF4y2Ba通过免疫荧光标记检测CP组织中细胞因子IL-4和IL-13阳性(补充图。gydF4y2Ba4 bgydF4y2Ba),这表明ILC2s参与了胰腺纤维的形成。gydF4y2Ba
一个gydF4y2Ba流式细胞术分析胰腺组织分离的白细胞,发现CCR2明显升高gydF4y2Ba+gydF4y2Ba细胞(gydF4y2BapgydF4y2Ba= 0.0032, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BabgydF4y2BaCD11bgydF4y2Ba+gydF4y2Ba标记表明,先天免疫系统的细胞也渗入受损的胰腺(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BacgydF4y2Ba这些细胞大多呈CD206阳性(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)或CD163 (gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15),其特征为交替激活的巨噬细胞。gydF4y2BadgydF4y2BaCP组织中CD206的标记说明CD206在小鼠胰腺组织中的增加。定量分析显示,CP组织中约9%的细胞表达CD206阳性(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 5 / CPgydF4y2BangydF4y2Ba= 9),比例尺为20µm。gydF4y2BaegydF4y2BaCD206的IL-33表达gydF4y2Ba+gydF4y2Ba免疫荧光标记显示巨噬细胞,比例尺为20µm。gydF4y2BafgydF4y2Ba这种细胞因子是ILC2s (lingydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2BaGATA3gydF4y2Ba+gydF4y2Ba)在CP小鼠的胰腺中也显著升高(gydF4y2BapgydF4y2Ba= 0.0002, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)。gydF4y2BaggydF4y2Ba胰脏azan蓝染色显示胰脏纤维化组织替代胰脏外分泌,标尺为50µm。gydF4y2BahgydF4y2Ba流式细胞术检测离体胰腺细胞PSC标记蛋白CD271 (gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 15)和GFAP (gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba发现了显著的增长。gydF4y2Ba我gydF4y2Ba血清胶原蛋白水平显著升高(gydF4y2BapgydF4y2Ba= 0.0433, congydF4y2BangydF4y2Ba= 7 / CPgydF4y2BangydF4y2Ba= 13),组织学上可见胶原沉积和组织纤维化。gydF4y2BajgydF4y2Ba采用Masson Goldner三色染色评价CP过程中的组织重塑,比例尺为50µm。gydF4y2BakgydF4y2Ba模式定量软件的面积量化(%)显示外分泌和内分泌组织的损失(红色)和纤维化面积(绿色)和自由空间的增加,反映脂肪组织和水肿(黄色)。gydF4y2BalgydF4y2Ba外分泌及内分泌活动组织的面积量化(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 6 / CPgydF4y2BangydF4y2Ba= 10)与纤维化(gydF4y2BapgydF4y2Ba< 0.0001, congydF4y2BangydF4y2Ba= 6 / CPgydF4y2BangydF4y2Ba= 10)表明器官结构发生了显著变化。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba的独立样本和显著性水平检验gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BalgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
已知2型免疫反应可调节组织修复和纤维化。Azan蓝染色显示CP小鼠胰腺组织纤维化增加(图。gydF4y2Ba3 ggydF4y2Ba).胰腺纤维化主要是由胰腺星状细胞(PSCs)数量的增加介导的,可以通过CD271或GFAP的表达在CP组织中检测到。gydF4y2Ba3 hgydF4y2Ba).我们还观察到CP小鼠血清中可溶性胶原蛋白水平的增加(图。gydF4y2Ba3我gydF4y2Ba),并通过Masson Goldner三色染色显示胰腺组织组成的cp依赖性变化(图。gydF4y2Ba3 gydF4y2Baj,gydF4y2BakgydF4y2Ba).在CP中,外分泌组织(红色)被纤维化组织(绿色)所取代。黄色标记的游离间隙表示CP期间脂肪组织水肿。我们的组织形态学分析显示腺泡细胞明显减少,纤维化组织增加(图2)。gydF4y2Ba3 lgydF4y2Ba).gydF4y2Ba
Th2细胞反应的阻断可减轻组织纤维化gydF4y2Ba
已知2型免疫应答受IL-4/IL-13 - STAT6信号通路控制。Th2分化和M2极化受IL-4/IL-13调控,因此有助于纤维化。为了研究IL-4在慢性胰腺炎中的作用,我们用IL-4中和抗体治疗C57Bl/6小鼠,而对照动物在相同的治疗方案中接受同型抗体(补充图。gydF4y2Ba1 bgydF4y2Ba).如前所述诱发慢性胰腺炎。抗il -4治疗在CP期间没有导致体重变化(补充图。gydF4y2Ba5gydF4y2Ba).流式细胞术分析抗il -4处理小鼠的脾细胞显示GATA3显著降低gydF4y2Ba+gydF4y2BaTh2细胞和GATA3细胞gydF4y2Ba+gydF4y2BaILC2s(林gydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2Ba),而TBETgydF4y2Ba+gydF4y2BaTh1细胞,FOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞以及TBETgydF4y2Ba+gydF4y2Bailc1不受抗il -4治疗的影响(补充图。gydF4y2Ba5 bgydF4y2Ba,gydF4y2BacgydF4y2Ba).CD4细胞数量gydF4y2Ba+gydF4y2BaT细胞,尤其是CD4细胞gydF4y2Ba+gydF4y2Ba/ STAT6gydF4y2Ba+gydF4y2Ba这些CP小鼠胰腺中的细胞明显减少(补充图。gydF4y2Ba5 dgydF4y2Ba,gydF4y2BaegydF4y2Ba).胰腺组织学显示抗il -4和同型治疗小鼠之间的差异,包括抗il -4治疗CP小鼠的纤维化显著减少,如Masson Goldner三色和azan蓝染色所示。α- sma(活化星状细胞的标记物)的免疫荧光标记在这些动物中也减少了,而α-淀粉酶阳性腺泡细胞的数量增加了(补充图)。gydF4y2Ba5 fgydF4y2Ba).纤维化和αSMA的定量gydF4y2Ba+gydF4y2Ba在抗il -4处理的动物组,细胞明显减少(补充图。gydF4y2Ba5克gydF4y2Ba).胶原蛋白1和CD206的免疫荧光标记证实,抗il -4治疗小鼠胰腺中的胶原蛋白生成减少,而CD206的数量减少gydF4y2Ba+gydF4y2Ba细胞未受影响(补充图。gydF4y2Ba5克gydF4y2Ba).gydF4y2Ba
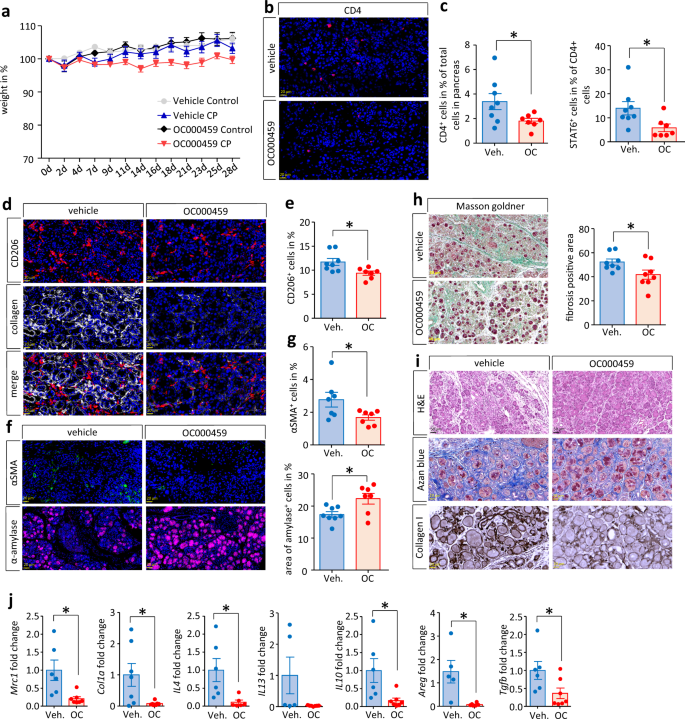
已知IL-4/IL-13在CP过程中负责纤维化的形成gydF4y2Ba13gydF4y2Ba.Th2细胞旁(图;gydF4y2Ba1克ydF4y2Bah和gydF4y2Ba2 fgydF4y2Ba)和ilc2(补充图。gydF4y2Ba4gydF4y2Ba)gydF4y2Ba胰腺星状细胞是IL-4的另一个来源gydF4y2Ba13gydF4y2Ba.为了更详细地考虑Th2/ ilc2对纤维发生的影响,我们使用其拮抗剂OC000459对CRTH2进行了阻断。通过每天应用30µg CRTH2拮抗剂OC000459来阻塞Th2/ ilc2反应gydF4y2Ba31gydF4y2Ba,而对照动物只接受载液(0.625% DMSO),如先前Wojno等人所述。gydF4y2Ba32gydF4y2Ba(补充图。gydF4y2Ba1 cgydF4y2Ba).OC000459是一种高效的选择性CRTH2拮抗剂,可抑制pgd2介导的嗜酸性粒细胞、Th2细胞和ilc2的激活。不同的处理条件在CP发展期间没有引起显著的体重减轻(图2)。gydF4y2Ba4gydF4y2Ba).CD4的定量gydF4y2Ba+gydF4y2BaCD4细胞明显降低gydF4y2Ba+gydF4y2Ba胰腺中的T细胞数量,还有CD4gydF4y2Ba+gydF4y2BaSTAT6gydF4y2Ba+gydF4y2BaOC000459处理组Th2细胞明显减少(图;gydF4y2Ba4gydF4y2Bab,gydF4y2BacgydF4y2Ba).免疫荧光标记也显示CD206明显减少gydF4y2Ba+gydF4y2BaOC000459处理小鼠胰腺中的巨噬细胞(图5)。gydF4y2Ba4gydF4y2Bad,gydF4y2BaegydF4y2Ba).OC000459处理后,胰腺淀粉酶表达增加,PSC标记物αSMA显示胰腺中PSCs数量减少。gydF4y2Ba4gydF4y2Baf,gydF4y2BaggydF4y2Ba).Masson Goldner三色染色的组织形态学分析证实,OC000459治疗组的组织纤维化显著减少(图5)。gydF4y2Ba4 hgydF4y2Ba).胶原蛋白1的H&E染色、azan蓝染色以及免疫组化标记支持了这一观察结果(图。gydF4y2Ba4我gydF4y2Ba).此外,基因表达分析显示,胰腺组织的表达明显降低gydF4y2BaMrc1gydF4y2Ba编码CD206的基因gydF4y2BaCol1a1gydF4y2Ba基因和gydF4y2BaIl4gydF4y2Ba编码细胞因子IL-4(图;gydF4y2Ba4 jgydF4y2Ba).细胞因子IL-13的表达下降未达到显著性,但其他基因的2型相关细胞因子和生长因子如gydF4y2BaIl10gydF4y2Ba,gydF4y2Ba沙土荒漠gydF4y2Ba或gydF4y2BaTgfbgydF4y2Ba在OC000459处理组中显著降低。gydF4y2Ba4 jgydF4y2Ba).gydF4y2Ba
C57Bl/6小鼠通过4周内重复注射蓝青素诱导CP。此外,动物每天接受30µg OC000459或对照品(0.625% DMSO)。gydF4y2Ba一个gydF4y2Ba体重随时间的变化在所有组(车辆控制组)之间不显著gydF4y2BangydF4y2Ba= 3/车辆CPgydF4y2BangydF4y2Ba= 8/OC000459控制gydF4y2BangydF4y2Ba= 4/ oc000459 cpgydF4y2BangydF4y2Ba= 8)。gydF4y2BabgydF4y2BaOC000459显著降低CD4gydF4y2Ba+gydF4y2BaCP小鼠胰腺T细胞浸润情况(gydF4y2BapgydF4y2Ba= 0.0469,嗯。gydF4y2BangydF4y2Ba= 8 / OCgydF4y2BangydF4y2Ba= 7),比例尺为20µm。gydF4y2BacgydF4y2BaCD4的比例gydF4y2Ba+gydF4y2BaSTAT6gydF4y2Ba+gydF4y2BaOC000459处理小鼠的CP组织中的细胞也变小了(gydF4y2BapgydF4y2Ba= 0.0285, VehgydF4y2BangydF4y2Ba= 8 / OCgydF4y2BangydF4y2Ba= 7)。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2BaCD206的标记gydF4y2Ba+gydF4y2Ba显示胰腺中交替激活的巨噬细胞显著减少(gydF4y2BapgydF4y2Ba= 0.0174,嗯。gydF4y2BangydF4y2Ba= 8日/ OCgydF4y2BangydF4y2Ba= 7),比例尺为20µm。gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba免疫荧光图像显示,OC000459处理小鼠胰腺中α-淀粉酶含量增加(标尺约50 μ m),而1型胶原蛋白和αSMA的标记减少。gydF4y2BaggydF4y2BaαSMA免疫荧光信号的定量研究gydF4y2Ba+gydF4y2Ba细胞明显减少(gydF4y2BapgydF4y2Ba= 0.0414, VehgydF4y2BangydF4y2Ba= 7 / OCgydF4y2BangydF4y2Ba= 7),而淀粉酶的面积gydF4y2Ba+gydF4y2BaOC000459处理小鼠胰腺细胞显著增加(gydF4y2BapgydF4y2Ba= 0.0174,嗯。gydF4y2BangydF4y2Ba= 8 / OCgydF4y2BangydF4y2Ba= 7)。gydF4y2BahgydF4y2Ba模式定量软件定量显示OC000459处理小鼠的纤维化组织显著减少(gydF4y2BapgydF4y2Ba= 0.0397, VehgydF4y2BangydF4y2Ba= 8 / OCgydF4y2BangydF4y2Ba= 8)。gydF4y2Ba我gydF4y2BaH&E染色、azan蓝染色和1号胶原免疫标记显示OC000459处理组纤维化减少,标尺为50µm。gydF4y2BajgydF4y2Ba通过RT-qPCR对胰腺组织进行基因表达分析,发现其转录水平显著降低gydF4y2BaMrc1gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0130, Veh。gydF4y2BangydF4y2Ba= 6 / OCgydF4y2BangydF4y2Ba= 7),gydF4y2BaCol1agydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0273,嗯。gydF4y2BangydF4y2Ba= 7 / OCgydF4y2BangydF4y2Ba= 7),gydF4y2BaIl4gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0212,嗯。gydF4y2BangydF4y2Ba= 6 / OCgydF4y2BangydF4y2Ba= 6),gydF4y2BaIl10gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0226, Veh。gydF4y2BangydF4y2Ba= 6 / OCgydF4y2BangydF4y2Ba= 7),gydF4y2Ba沙土荒漠gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0104, Veh。gydF4y2BangydF4y2Ba= 5 / OCgydF4y2BangydF4y2Ba= 6)和gydF4y2BaTgfbgydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0433,嗯。gydF4y2BangydF4y2Ba= 6 / OCgydF4y2BangydF4y2Ba= 7),表明2型免疫反应降低。转录水平gydF4y2Ba使用Il13gydF4y2Ba(阿明费。gydF4y2BangydF4y2Ba= 5 / OCgydF4y2BangydF4y2Ba= 7)降低,但降低未达到显著性。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。所有数据均以均数±SEM表示,采用独立样本和显著性水平的非配对双尾学生t检验检验差异有统计学意义gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BajgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
Treg细胞在CP期间抑制脾2型免疫反应gydF4y2Ba
除了Th2细胞外,Treg细胞是最突出的T细胞群,我们在CP小鼠的脾脏和胰腺中发现了Treg细胞,因此我们接下来研究了调节性T细胞在CP期间的影响。在DEREG小鼠中,Treg细胞被白喉毒素(DT)选择性地消耗,因为这些小鼠在白喉毒素(DT)下表达编码白喉毒素受体DTR-eGFP的基因gydF4y2BaFoxp3gydF4y2Ba启动子gydF4y2Ba27gydF4y2Ba.DEREG对照组接受磷酸盐缓冲盐水(PBS)而不是DT(补充图)。gydF4y2Ba1 dgydF4y2Ba).通过标记GFP在淋巴结切片上分析Treg耗竭的成功gydF4y2Ba+gydF4y2Ba通过流式细胞术分析脾脏细胞悬液中抗GFP抗体的Treg细胞gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba细胞(无花果。gydF4y2Ba5克ydF4y2Ba一个,gydF4y2BabgydF4y2Ba).在两个器官中,注射DT后Treg细胞均明显减少。增加CD69水平,CD4的一般激活标志gydF4y2Ba+gydF4y2BaT细胞,显示显着的T效应细胞激活在dt处理小鼠(图。gydF4y2Ba5度gydF4y2Ba).通过流式细胞术分析转录因子GATA3、TBET和RORγt的表达,研究t效应细胞反应的极性(Th1/Th2/Th17平衡)。CP诱导过程中Treg耗竭导致GATA3的比例几乎增加了三倍gydF4y2Ba+gydF4y2Ba脾脏中的Th2细胞(图;gydF4y2Ba5 dgydF4y2Ba),但没有改变Th1-或th17反应(图。gydF4y2Ba5克ydF4y2Bae,gydF4y2BafgydF4y2Ba).为了证实这一发现,在dt处理的小鼠血清中,伴随Th2/ 2型免疫应答的细胞因子IL-4和IL-10显著升高。另一方面,IL-6等促炎细胞因子没有受到FOXP3缺失的显著影响gydF4y2Ba+gydF4y2BaTreg细胞(图;gydF4y2Ba5克gydF4y2Ba).与Th2反应的升高一致,我们观察到CD11b数量的增加gydF4y2Ba+gydF4y2BaCD206gydF4y2Ba+gydF4y2Badt处理的DEREG小鼠脾脏中的巨噬细胞(图;gydF4y2Ba5 hgydF4y2Ba).有趣的是观察到CD8αgydF4y2Ba+gydF4y2Ba在CP期间,dt处理的DEREG小鼠的T细胞显著增加(图。gydF4y2Ba5我gydF4y2Ba).gydF4y2Ba
在treg耗尽的动物中,DEREG小鼠通过反复注射青绿素i.p.诱导CP超过4周。对照组小鼠接受PBS代替DT。gydF4y2Ba一个gydF4y2Ba采用抗GFP抗体对GFP进行免疫荧光染色gydF4y2Ba+gydF4y2Ba淋巴结Treg细胞,比例尺为10µm。gydF4y2BabgydF4y2Ba绿色荧光蛋白的测定gydF4y2Ba+gydF4y2Ba和CD25gydF4y2Ba+gydF4y2Ba脾细胞流式细胞术(gydF4y2BapgydF4y2Ba< 0.0001, PBSgydF4y2BangydF4y2Ba= 13 / DTgydF4y2BangydF4y2Ba= 13)。gydF4y2BacgydF4y2Bat效应细胞活化通过CD4上CD69的检测来检测gydF4y2Ba+gydF4y2BaT细胞gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0008, PBSgydF4y2BangydF4y2Ba= 13 / DTgydF4y2BangydF4y2Ba= 13)。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba此外,T效应子分化CD4gydF4y2Ba+gydF4y2Ba采用流式细胞术定量脾细胞数量。通过GATA3细胞内染色检测T效应免疫反应(gydF4y2BapgydF4y2Ba= 0.0002, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7), tbet (pbsgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)和RORγt (PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 6) CD4gydF4y2Ba+gydF4y2Ba细胞。两组间转录因子TBET和RORγt检测水平差异无统计学意义。与Th1和Th17免疫反应相反,Th2免疫反应,以GATA3的存在为标志,在CP期间通过耗损调节性T细胞而增加。gydF4y2BaggydF4y2Ba用细胞珠阵列测量血清细胞因子显示2型细胞因子如IL-10增加(gydF4y2BapgydF4y2Ba= 0.0271, PBSgydF4y2BangydF4y2Ba= 12 / DTgydF4y2BangydF4y2Ba= 11)和IL-4 (gydF4y2BapgydF4y2Ba= 0.0127, PBSgydF4y2BangydF4y2Ba= 12 / DTgydF4y2BangydF4y2Ba= 12),而典型的1型细胞因子如IL-6 (PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 6)不受影响。gydF4y2BahgydF4y2BaCD11b表面标记CD206的分析gydF4y2Ba+gydF4y2Ba流式细胞术显示,不仅Th2反应增加,而且交替激活的抗炎巨噬细胞数量也增加(gydF4y2BapgydF4y2Ba= 0.0186, PBSgydF4y2BangydF4y2Ba= 13 / DTgydF4y2BangydF4y2Ba= 13)。gydF4y2Ba我gydF4y2BaCD8α的数量gydF4y2Ba+gydF4y2Ba在CP期间,Treg细胞缺失时,T细胞也显著升高(gydF4y2BapgydF4y2Ba= 0.0206, PBSgydF4y2BangydF4y2Ba= 13 / DTgydF4y2BangydF4y2Ba= 12)。所有数据均以均数±SEM表示,采用独立样本和显著性水平的非配对双尾学生t检验检验差异有统计学意义gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
Treg细胞抑制CP中促纤维化胰腺2型免疫反应gydF4y2Ba
FOXP3抑制全身2型免疫反应gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞,因此显著增加。标签CD4gydF4y2Ba+gydF4y2Ba胰腺组织切片中的T细胞显示Treg的缺失加剧了胰腺T细胞的浸润(图2)。gydF4y2Ba6 a、bgydF4y2Ba).同样,CD8αgydF4y2Ba+gydF4y2Ba在dt处理的CP小鼠中,细胞数量显著增加(图;gydF4y2Ba6摄氏度gydF4y2Ba).与这些观察结果相吻合的,还有CD206的数目gydF4y2Ba+gydF4y2Ba在dt处理的CP动物切片中,巨噬细胞显著增加(图。gydF4y2Ba6 dgydF4y2Ba).分离胰腺白细胞的流式细胞术(图;gydF4y2Ba6 egydF4y2Ba)和胰腺组织中替代激活的巨噬细胞标记MRC-1和YM1的基因表达分析(图。gydF4y2Ba6 fgydF4y2Ba),并证实CD206升高gydF4y2Ba+gydF4y2Ba巨噬细胞在dt处理小鼠。的表达gydF4y2BaIl10gydF4y2Ba编码细胞因子IL-10,主要由CD206释放gydF4y2Ba+gydF4y2Ba与此相反,M1巨噬细胞相关的细胞因子IL-1β的基因表达不受细胞凋亡的影响(图2)。gydF4y2Ba6 fgydF4y2Ba).巨噬细胞向交替激活的抗炎m2样表型分化与胰腺星状细胞数量的增加和激活相关。α平滑肌肌动蛋白(α sma)的标记表明,在treg缺乏的动物胰腺中,活化的星状细胞数量增加gydF4y2BaCol1a1gydF4y2Ba编码细胞外基质蛋白胶原蛋白1(图;gydF4y2Ba6克gydF4y2Ba).从DEREG小鼠CP组织中分离的细胞的流式细胞术分析表明,CP期间Treg细胞的全体性耗竭导致星状细胞标记CD271和GFAP阳性细胞的显著增加(图2)。gydF4y2Ba6克ydF4y2Bah,gydF4y2Ba我gydF4y2Ba).αSMA的额外基因表达分析证实了这一发现(图2)。gydF4y2Ba6 jgydF4y2Ba).Treg耗竭增强胰腺纤维化,组织学染色可见Masson Goldner或Azan蓝(图2)。gydF4y2Ba6 kgydF4y2Ba).在treg缺乏的小鼠中,与总组织面积相关的纤维细胞面积显著增大。gydF4y2Ba6克ydF4y2Ba我,gydF4y2Ba米gydF4y2Ba).在dt处理动物的胰腺切片中检测到外分泌组织面积(红色包围)的显著减少(补充图。gydF4y2Ba6gydF4y2Ba).抗细胞角蛋白19抗体的免疫荧光标记显示导管结构数量增加,提示在dt处理小鼠中腺泡到导管化生增加(补充图)。gydF4y2Ba6 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba用免疫荧光标记评价浸润免疫细胞CD4 (gydF4y2BapgydF4y2Ba= 0.0172, PBSgydF4y2BangydF4y2Ba= 5 / DTgydF4y2BangydF4y2Ba= 5), cd8α (gydF4y2BapgydF4y2Ba= 0.0035, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 4)和CD206 (gydF4y2BapgydF4y2Ba= 0.0451, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 8)表明,在dt处理的动物中,其数量显著升高,比例尺为20µm。gydF4y2BaegydF4y2Ba流式细胞术分析从胰腺组织分离的白细胞提供了CD206交替激活增加的证据gydF4y2Ba+gydF4y2Badt处理小鼠的M2巨噬细胞(gydF4y2BapgydF4y2Ba= 0.0003, PBSgydF4y2BangydF4y2Ba= 8 / DTgydF4y2BangydF4y2Ba= 11)。gydF4y2BafgydF4y2Ba通过RT-qPCR基因表达分析证实gydF4y2BaMrc1gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0064, PBSgydF4y2BangydF4y2Ba= 9 / DTgydF4y2BangydF4y2Ba7)和gydF4y2BaYm1gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0003, PBSgydF4y2BangydF4y2Ba= 11 / DTgydF4y2BangydF4y2Ba= 6)编码抗炎巨噬细胞标记,抗炎细胞因子IL-10转录水平升高(gydF4y2BapgydF4y2Ba= 0.0020, PBSgydF4y2BangydF4y2Ba= 8 / DTgydF4y2BangydF4y2Ba= 6),而促炎IL-1β细胞因子(PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 5强调了这一观察结果。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。gydF4y2BaggydF4y2Ba经dt处理的小鼠中m2样巨噬细胞触发胰腺星状细胞(PSC), αSMA和胶原蛋白1染色显示,标尺为20µm。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba分离胰腺组织的流式细胞仪分析显示,GFAP数量显著增加gydF4y2Ba+gydF4y2Ba(gydF4y2BapgydF4y2Ba= 0.0059, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 11)和CD271gydF4y2Ba+gydF4y2Ba细胞(gydF4y2BapgydF4y2Ba= 0.0140, PBSgydF4y2BangydF4y2Ba= 8 / DTgydF4y2BangydF4y2Ba= 11),gydF4y2BajgydF4y2BaαSMA基因表达分析证实CP过程中Treg细胞耗竭后PSC激活(gydF4y2BapgydF4y2Ba= 0.0373, PBSgydF4y2BangydF4y2Ba= 12 / DTgydF4y2BangydF4y2Ba= 8)。gydF4y2BakgydF4y2Ba最后,较高的PSC数导致纤维化增加和腺泡细胞的明显损失,比例尺为100µm。gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2BaMasson Goldner进行的定量分析显示纤维化显著增加(gydF4y2BapgydF4y2Ba= 0.0042, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)并伴有腺泡细胞数量减少(gydF4y2BapgydF4y2Ba= 0.0008, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)在没有Treg细胞的情况下。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba-独立样本检验,p < 0.05显著性水平用星号(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba,gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
为了分析Treg细胞的永久耗尽是否对动物有直接影响,DEREG小鼠在相同的时间内用DT或PBS处理,但没有诱导CP, 6天后我们几乎没有检测到GFPgydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2Ba经dt处理的动物脾脏中有Treg细胞,但28d后可以观察到少量抗dt的Treg细胞(补充图。gydF4y2Ba7一个gydF4y2Ba而且gydF4y2Ba7 bgydF4y2Ba),如文献所述。基因缺陷gydF4y2BaFoxp3gydF4y2Ba或gydF4y2BaCTLA4gydF4y2Ba基因导致严重的自身免疫性疾病gydF4y2Ba33gydF4y2Ba,但在成年动物的耗竭不会引起类似的疾病表型gydF4y2Ba34gydF4y2Ba.Treg细胞的长期消耗不影响这些动物的效应T细胞反应(补充图。gydF4y2Ba7 cgydF4y2Ba)肾、肺、肝、小肠H&E染色分析未见慢性炎症或器官损伤;所有器官都不受Treg耗竭的影响(补充图。gydF4y2Ba7 dgydF4y2Ba).据报道,Treg细胞的基因缺失或新生儿缺失会通过浸润T细胞导致胰腺组织的完全破坏gydF4y2Ba27gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.我们在五分之二的动物中观察到CD3浸润的小而孤立的病灶gydF4y2Ba+gydF4y2Ba或CD8gydF4y2Ba+gydF4y2BaT细胞在T- T处理的动物胰腺,但没有一般组织破坏或CD206gydF4y2Ba+gydF4y2Ba激活和纤维化增加(补充图。gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba8 bgydF4y2Ba).胰腺的主要部分未受影响,且经dt处理的动物血清脂肪酶水平不变,排除了浸润的T细胞可能引发急性胰腺炎的发展(补充图)。gydF4y2Ba8 cgydF4y2Ba).gydF4y2Ba
Treg细胞在CP期间调节器官重塑gydF4y2Ba
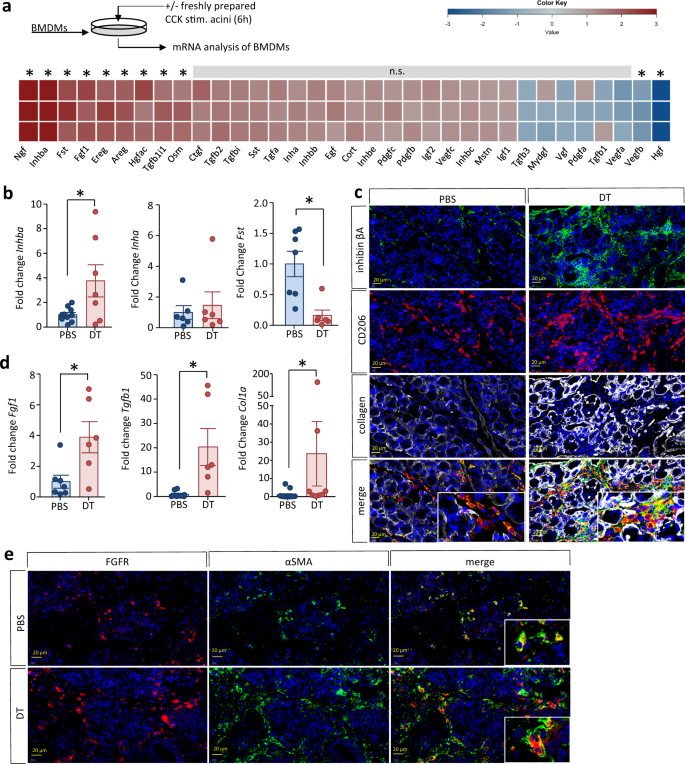
在CP过程中,除了纤维化组织置换外,腺泡细胞再生也参与了器官重塑过程。众所周知,巨噬细胞会影响器官再生gydF4y2Ba15gydF4y2Ba,如前所述,我们在骨髓来源的巨噬细胞(BMDM)和CCK刺激的腺泡体外共培养模型中研究了生长因子和生长因子相关蛋白的释放gydF4y2Ba10gydF4y2Ba.共培养6小时后,仔细清洗BMDMs,制备总RNA,随后使用Affymetrix阵列进行转录组分析。我们观察到编码各种生长因子的基因,如神经生长因子(NGF)、抑制素βa (INHBA)、成纤维细胞生长因子1 (FGF1)、双调节蛋白(AREG)的mRNA水平升高,但也有反调节因子如卵泡抑素(FST)的mRNA水平升高(图)。gydF4y2Ba7一个gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba从C57Bl/6小鼠中分离骨髓来源的巨噬细胞,与cck刺激的腺泡共孵育6小时。从BMDMs中分离总RNA,使用Affymetrix GeneChip Mouse Gene 2.0 ST阵列进行转录组分析。编码生长因子的基因表达变化通过热图可见。的基因特异性转录水平gydF4y2Ba神经生长因子gydF4y2Ba,gydF4y2BaInhbagydF4y2Ba,gydF4y2Ba置gydF4y2Ba,gydF4y2BaFgf1gydF4y2Ba,gydF4y2BaEreggydF4y2Ba,gydF4y2Ba沙土荒漠gydF4y2Ba编码神经生长因子、抑制素A亚单位β、卵泡抑素、成纤维细胞生长因子1、表调节素和双调节素在与腺泡共孵育后分别显著增加。gydF4y2BabgydF4y2Ba通过RT-qPCR检测DEREG小鼠+/−DT胰腺组织中生长因子基因的表达。的表达gydF4y2BaInhbagydF4y2Ba编码抑制素βA在dt处理小鼠中显著增加(gydF4y2BapgydF4y2Ba= 0.0242, PBSgydF4y2BangydF4y2Ba= 10 / DTgydF4y2BangydF4y2Ba= 7),而转录水平gydF4y2Ba韩国仁荷gydF4y2Ba编码抑制素α不受影响(PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 6)。的表达gydF4y2Ba置gydF4y2Ba编码卵泡抑素在dt处理小鼠中显著降低(gydF4y2BapgydF4y2Ba= 0.0049, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 6)。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。gydF4y2BacgydF4y2Ba抑制素βA和CD206的免疫荧光标记显示共定位。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba生长因子FGF1的基因表达(gydF4y2BapgydF4y2Ba= 0.0173, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 6)和TGFB (gydF4y2BapgydF4y2Ba= 0.0113, PBSgydF4y2BangydF4y2Ba= 8 / DTgydF4y2BangydF4y2Ba= 6)也在dt处理小鼠的胰腺中上调,并且通过免疫荧光标记和RT-qPCR(双尾Mann-Whitney试验)显示胶原蛋白1的更高表达gydF4y2BapgydF4y2Ba= 0.0053, PBSgydF4y2BangydF4y2Ba= 13 / DTgydF4y2BangydF4y2Ba= 8)。gydF4y2BaegydF4y2Baα-SMA上fgf受体的附加标记gydF4y2Ba+gydF4y2Ba在dt处理的小鼠中,PSCs显示纤维生成增加,比例尺为20µm。使用以下标准定义了基于微阵列的转录组分析检测到的显著差异mRNA水平:Benjamini和Hochberg错误发现率(gydF4y2BapgydF4y2Ba≤.05),信号校正统计(Ratio Builder软件;gydF4y2BapgydF4y2Ba≤.05),不同条件间的表达值之比≥1.5倍(gydF4y2BangydF4y2Ba= 3)。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba除非参数样本的胶原蛋白1基因表达采用双尾Mann-Whitney检验外,其他样本的显著性水平均为gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
接下来,我们通过RT-qPCR分析这些生长因子及其抑制剂的基因表达,研究了器官再生,使用的RNA来自患有CP的DEREG小鼠胰腺。gydF4y2Ba
在dt处理的Treg缺失小鼠的胰腺中,编码抑制素编码亚单位β的INHBA表达升高gydF4y2Ba一个gydF4y2Ba生长因子激活素的亚单位。编码抑制素α亚基的INHA的转录不受影响(图。gydF4y2Ba7 bgydF4y2Ba).激活素是抑制素β的同二聚体gydF4y2Ba一个gydF4y2Ba亚基,而其抑制性对应物抑制素代表抑制素α和抑制素β的异二聚体gydF4y2Ba一个gydF4y2Ba.我们的结果表明,以异二聚抑制素为代价,增加了同二聚激活素的形成。与此同时,激活素对抗调节因子卵泡抑素在dt处理的小鼠胰腺中下调(图。gydF4y2Ba7一个gydF4y2Ba).这些结果与我们体外共培养实验的结果一致(图。gydF4y2Ba7 bgydF4y2Ba).CD206免疫荧光标记gydF4y2Ba+gydF4y2Ba巨噬细胞和抑制素βA亚基的研究表明,这两种标志物在胰腺纤维化区域的共同定位,在Treg细胞缺失时荧光信号增加(图2)。gydF4y2Ba7 cgydF4y2Ba).在这些小鼠的胰腺中,FGF1和TGF-β的表达也升高了(图。gydF4y2Ba7 dgydF4y2Ba).已知这两种物质都能激活胰腺星状细胞gydF4y2Ba19gydF4y2Ba,并刺激细胞外基质蛋白如胶原蛋白的产生。胶原蛋白1在mRNA上也显著升高(图2)。gydF4y2Ba7 dgydF4y2Ba)和蛋白质水平(图;gydF4y2Ba7 cgydF4y2Ba).成纤维细胞生长因子受体的免疫标记分析显示与表达αSMA的PSCs共定位(图2)。gydF4y2Ba7 egydF4y2Ba).我们的研究结果表明,在CP中,调节性T细胞抑制胰腺巨噬细胞过度释放生长因子,从而限制外分泌胰腺组织的纤维化替代。gydF4y2Ba
Treg细胞抑制先天淋巴样细胞2型gydF4y2Ba
除了Th2细胞和交替激活的巨噬细胞外,ILC2还参与2型免疫反应。我们首先研究了患CP的DEREG小鼠脾脏中的ilc2,发现Treg细胞的缺失并不会导致脾脏中ILCs总数的增加(图2)。gydF4y2Ba8gydF4y2Ba).当我们通过转录因子TBET和GATA3的表达将ILC区分为1型和2型ILC亚群(图2)。gydF4y2Ba8 bgydF4y2Ba),与T细胞的分化相当,我们观察到ILC2分化的转变,类似于Th2分化的增加。而TBET的数量gydF4y2Ba+gydF4y2BaDT处理后ILC1s无变化,GATA3无变化gydF4y2Ba+gydF4y2Bailc2明显升高(图;gydF4y2Ba8 gydF4y2Bac,gydF4y2BadgydF4y2Ba).已知ilc2可促进组织纤维化gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.因此,我们接下来的问题是,在CP过程中,ILCs是否局部存在于胰腺组织中,是否也受到Treg细胞的调控。我们发现了林gydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2Ba流式细胞术分析分离的胰腺白细胞(图;gydF4y2Ba8 egydF4y2Ba).患有CP的动物表现出胰腺中ILCs的增加,在dt治疗的小鼠中显著增强。在缺乏Treg细胞时显著增加的ilc强烈表达GATA3,这将其识别为ilc2(图2)。gydF4y2Ba8 fgydF4y2Ba).ILC2的特征是双调节蛋白(AREG)的表达,这是一种属于表皮生长因子家族的跨膜糖蛋白。通过定量RT-qPCR对胰腺组织中编码AREG基因的表达进行分析,发现dt处理小鼠胰腺组织中编码AREG基因的表达显著增加。ILCs参与的第三条证据来自免疫荧光分析实验,检测CD90和AREG,发现它们由ilc2共表达。胰腺组织切片显示,在dt治疗的DEREG小鼠慢性炎症的胰腺中,大量ilc2的定位。gydF4y2Ba8 ggydF4y2Ba).我们还通过研究胰腺组织的组织学切片来评估CD90和双调节蛋白在人类慢性胰腺炎中的存在。双阳性细胞的显示强调了流式细胞术数据,并提示ILC2参与人类胰腺重塑(图2)。gydF4y2Ba8 hgydF4y2Ba).gydF4y2Ba
分离经DT或PBS处理的CP动物脾细胞,流式细胞术分析。gydF4y2Ba一个gydF4y2BaILCs的分数为lingydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2Ba细胞(PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)。gydF4y2BabgydF4y2Ba转录因子GATA3和TBET的存在被用来区分ILC1和ILC2。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaTreg耗竭增加了GATA3的数量gydF4y2Ba+gydF4y2BaILC2 (gydF4y2BapgydF4y2Ba= 0.0064, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)而不是TBETgydF4y2Ba+gydF4y2BaILC1 (PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba7)脾。gydF4y2BaegydF4y2Ba从小鼠CP组织中分离的白细胞进行了胰腺ILCs的研究。林的总数gydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2Ba细胞在Treg细胞缺失时显著增加(gydF4y2BapgydF4y2Ba< 0.0001, con PBS/DTgydF4y2BangydF4y2Ba= 5/ cp pbs / dtgydF4y2BangydF4y2Ba= 11),gydF4y2BafgydF4y2Ba以及GATA3的编号gydF4y2Ba+gydF4y2BaILC2显著升高(gydF4y2BapgydF4y2Ba= 0.0155, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 11)。gydF4y2BaggydF4y2Ba表达分析gydF4y2Ba沙土荒漠gydF4y2Ba通过RT-qPCR编码胰腺组织中的双调节蛋白,证实在CP期间treg缺失的动物数量增加(gydF4y2BapgydF4y2Ba= 0.0253, PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 6)。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2BaCD90的代表性免疫荧光标记gydF4y2Ba+gydF4y2Ba沙土荒漠gydF4y2Ba+gydF4y2Ba在CP动物的胰腺ILC2以及人体组织切片中检测到AREG,比例尺为20µm。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba的独立样本和显著性水平检验gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
Treg细胞促进腺泡细胞再生,并有助于防止外分泌功能的丧失gydF4y2Ba
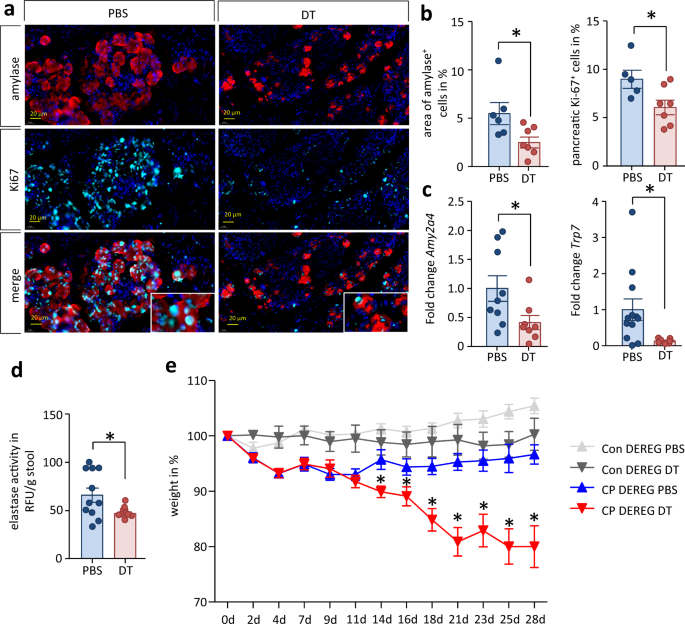
接下来,我们分析了treg依赖的生长因子表达是否也影响CP中腺泡细胞再生和胰腺外分泌功能。与pbs处理的对照组相比,dt处理小鼠胰腺切片中Ki67和α-淀粉酶的标记显示,增殖的腺泡细胞数量显著减少。这导致外分泌组织的损失(图。gydF4y2Ba9gydF4y2Ba一个,gydF4y2BabgydF4y2Ba).RT-qPCR检测到胰腺组织中编码分泌蛋白如α-淀粉酶和t7 -胰蛋白酶原(Mus musus RIKEN cDNA 2210010C04基因)的基因mRNA水平显著降低(图2)。gydF4y2Ba9 cgydF4y2Ba).最后,我们观察到,与PBS对照组相比,dt处理小鼠的粪便弹性蛋白酶活性降低(图2)。gydF4y2Ba9 dgydF4y2Ba).在临床实践中,粪便弹性蛋白酶的数量被用作胰腺功能不全的诊断标志gydF4y2Ba36gydF4y2Ba.青色蓝素治疗两周后,体重曲线显示dt治疗小鼠的体重稳步下降,而pbs治疗对照组小鼠则没有。这意味着Treg细胞对于胰腺外分泌组织的保存和/或再生是必需的,并且在我们的CP模型中,Treg介导的2型炎症抑制阻止了显著的体重减轻(图。gydF4y2Ba9 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Baα-淀粉酶和Ki-67的免疫荧光标记表明Treg缺失组腺泡细胞增殖减少。比例尺代表20µm。gydF4y2BabgydF4y2Ba定量免疫荧光标记证实腺泡细胞数量显著减少(gydF4y2BapgydF4y2Ba= 0.0314, PBSgydF4y2BangydF4y2Ba= 6 / DTgydF4y2BangydF4y2Ba= 7)和增殖较少的Ki67gydF4y2Ba+gydF4y2Ba腺泡细胞(gydF4y2BapgydF4y2Ba= 0.0342, PBSgydF4y2BangydF4y2Ba= 5 / DTgydF4y2BangydF4y2Ba= 7)在接受dt治疗的小鼠的胰腺中。gydF4y2BacgydF4y2Ba胰消化酶淀粉酶(gydF4y2BapgydF4y2Ba=gydF4y2Ba0.0391, PBSgydF4y2Ba=gydF4y2Ba9 / DT ngydF4y2Ba=gydF4y2Ba8)和胰蛋白酶原(pgydF4y2Ba=gydF4y2Ba0.0425, PBSgydF4y2Ba=gydF4y2Ba12个/ DTgydF4y2BaRT-qPCR测定的n = 7)在CP和Treg细胞耗竭过程中显著降低。RT-qPCR测定的转录水平归一化gydF4y2BaRn5sgydF4y2Ba作为内部校准基因,并与对照小鼠相应的mRNA数量相关。gydF4y2BadgydF4y2Ba粪便弹性蛋白酶的活性,外分泌功能的临床标志,也显著降低在dt处理小鼠(gydF4y2BapgydF4y2Ba= 0.0280, PBSgydF4y2BangydF4y2Ba= 11 / DTgydF4y2BangydF4y2Ba= 10)。gydF4y2BaegydF4y2Ba外分泌胰腺功能的下降进一步反映在体重减轻上。CP动物的Treg耗竭显著增加了随时间的体重减轻(单向方差分析gydF4y2BapgydF4y2Ba< 0.0001, Bonferroni后测,con PBSgydF4y2BangydF4y2Ba= 5 / DTgydF4y2BangydF4y2Ba= 5, cp PBSgydF4y2BangydF4y2Ba= 7 / DTgydF4y2BangydF4y2Ba= 6)。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba-检验独立样本和单因素方差分析,Bonferroni后验,显著性水平gydF4y2BapgydF4y2Ba< 0.05用星号标记。源数据作为源数据文件提供。gydF4y2Ba
CP患者血液和组织样本中Treg细胞和Th2细胞升高gydF4y2Ba
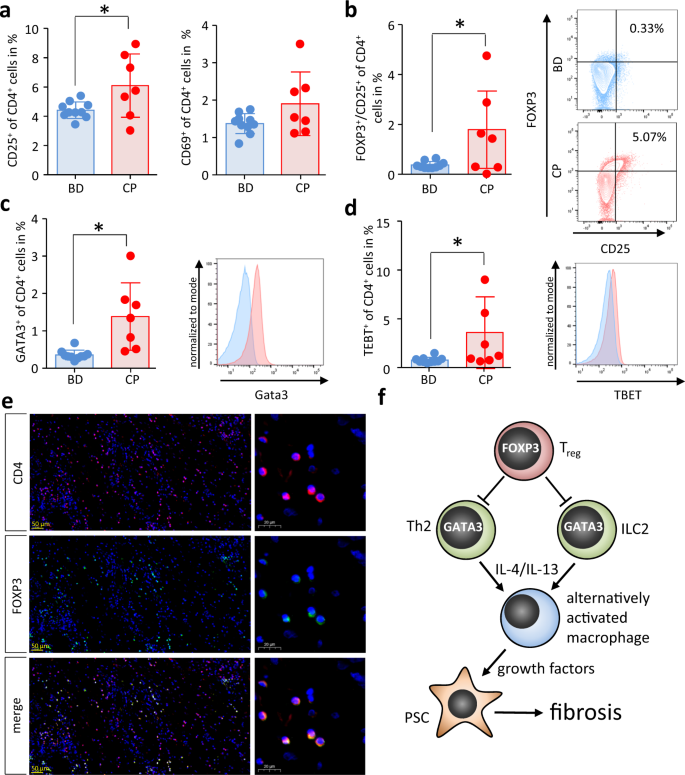
最后,我们研究了CP患者血液样本中Treg细胞和Th2细胞的数量,发现循环激活CD4细胞数量增加gydF4y2Ba+gydF4y2Ba在这些患者中,T细胞CD25或CD69阳性。gydF4y2Ba10gydF4y2Ba).此外,我们检测到FOXP3的数量显著增加gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞以及GATA3gydF4y2Ba+gydF4y2Ba与健康献血者相比,CP患者血液中的Th2细胞(图。gydF4y2Ba10 b, cgydF4y2Ba).有趣的是,我们还发现TBET数量增加gydF4y2Ba+gydF4y2BaTh1细胞(图;gydF4y2Ba10 dgydF4y2Ba).切除的CP患者胰腺组织切片显示大量FOXP3gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba侵袭器官的Treg细胞(图;gydF4y2Ba10 egydF4y2Ba).这些观察结果与在动物实验中得到的结果一致,并表明FOXP3gydF4y2Ba+gydF4y2BaTreg细胞也参与CP患者胰腺的重塑。gydF4y2Ba
从患者(CP)和献血者(BD)的EDTA血样中分离T细胞,用流式细胞术进行分析。gydF4y2Ba一个gydF4y2BaT细胞活化标记CD25 (gydF4y2BapgydF4y2Ba= 0.0317, bdgydF4y2BangydF4y2Ba= 10 / CPgydF4y2BangydF4y2Ba= 7)在CP患者中明显高于BD患者,而CD69 (BDgydF4y2BangydF4y2Ba= 10 / CPgydF4y2BangydF4y2Ba= 7)未达到显著性。细胞内转录因子FOXP3、GATA3和TBET染色分析T细胞分化。gydF4y2BabgydF4y2BaFOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaCP患者血液中的Treg细胞明显升高(gydF4y2BapgydF4y2Ba= 0.0345, bdgydF4y2BangydF4y2Ba= 10 / CPgydF4y2BangydF4y2Ba= 7),gydF4y2BacgydF4y2Ba与gatta3相同的方式gydF4y2Ba+gydF4y2BaTh2细胞(gydF4y2BapgydF4y2Ba= 0.0026, bdgydF4y2BangydF4y2Ba= 10 / CPgydF4y2BangydF4y2Ba= 7)。gydF4y2BadgydF4y2Ba有趣的是TBETgydF4y2Ba+gydF4y2BaTh1细胞显著增加(gydF4y2BapgydF4y2Ba= 0.0478, bdgydF4y2BangydF4y2Ba= 10 / CPgydF4y2BangydF4y2Ba= 7)。gydF4y2BaegydF4y2BaCD4和FOXP3具有代表性的免疫荧光标记图像显示CD4数量较高gydF4y2Ba+gydF4y2BaFOXP3gydF4y2Ba+gydF4y2Ba人CP组织中的Treg细胞。gydF4y2BafgydF4y2Ba摘要插图显示调节性T细胞如何通过抑制Th2/ ilc2介导的IL-4/IL-13对巨噬细胞的选择性激活来控制慢性胰腺炎期间的器官纤维化。另一方面,激活的巨噬细胞反过来诱导胰腺星状细胞(PSC)的激活,这有助于细胞外基质的产生和纤维化。所有数据以均数±SEM表示,未配对的双尾学生检验差异有统计学意义gydF4y2BatgydF4y2Ba的独立样本和显著性水平检验gydF4y2BapgydF4y2Ba< 0.05者以星号(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba).源数据作为源数据文件提供。gydF4y2Ba
讨论gydF4y2Ba
在CP中,炎症引发的过程导致功能性胰腺组织的进行性和不可逆破坏,并被纤维化瘢痕组织取代gydF4y2Ba37gydF4y2Ba.直到今天,还没有一种因果疗法或限制疾病进展的策略。胰腺巨噬细胞与星状细胞的相互作用对纤维化的进展至关重要gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.细胞因子IL-4和IL-13,主要由Th2细胞释放gydF4y2Ba39gydF4y2Ba和ILC2sgydF4y2Ba40gydF4y2Ba,使巨噬细胞极化为交替激活的巨噬细胞gydF4y2Ba13gydF4y2Ba,并将适应性与先天免疫反应联系起来。在本研究中,我们证明了诱导CP后小鼠胰腺组织组成的显著变化,其特征是CCR2的浸润gydF4y2Ba+gydF4y2Ba免疫细胞,包括CD4gydF4y2Ba+gydF4y2Ba和CD8αgydF4y2Ba+gydF4y2BaT细胞,巨噬细胞和ilc2。由于这种免疫反应,我们观察到外分泌和内分泌组织的损失被纤维化取代。此外,我们可以证明Treg细胞是平衡免疫反应和限制纤维化发展所必需的,通过抑制替代激活的巨噬细胞、Th2细胞和ilc2驱动的2型免疫反应。另一方面,激活的巨噬细胞极化似乎发生在胰腺组织中,这是慢性炎症器官中Treg细胞和Th2细胞迁移的结果。除了这些细胞在胰腺中的局部增加外,我们还能够在小鼠和人类样本中观察到Treg细胞和Th2细胞及其释放的细胞因子的全身增加。gydF4y2Ba
Th2细胞通过释放细胞因子IL-4和IL-13控制巨噬细胞向M2表型的极化gydF4y2Ba41gydF4y2Ba.既往研究表明,IL-4Rα信号通路和IL-4/IL-13的存在对CD206的M2极化至关重要gydF4y2Ba+gydF4y2Ba慢性胰腺炎期间巨噬细胞和决定纤维生成gydF4y2Ba13gydF4y2Ba.作为IL-4的来源,它们识别激活的PSCsgydF4y2Ba13gydF4y2Ba,这形成了一个自我延续的循环,其中PSCs驱动M2极化而CD206极化gydF4y2Ba+gydF4y2BaM2巨噬细胞通过TGF-β驱动PSC激活。除了PSCs外,我们还可以发现胰腺Th2细胞和ilc2是M2驱动细胞因子的来源。通过中和抗IL-4抗体治疗,IL-4在体内减少,导致Th2细胞分化显著减少,胰腺纤维化减轻。Th2和ilc2表面受体CRTH2的拮抗剂OC000459的阻塞gydF4y2Ba31gydF4y2Ba也会导致CD4细胞浸润减少gydF4y2Ba+gydF4y2Ba在我们的CP小鼠模型中,胰腺中的T细胞。IL-4转录的降低导致CD206数量的减少gydF4y2Ba+gydF4y2Ba或激活的巨噬细胞和有限的纤维化和外分泌组织的损失。这表明Th2/ILC2s是胰腺器官纤维化的驱动力。gydF4y2Ba
除了Th2细胞,还有FOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞是适应性免疫系统中最突出的细胞,在胰腺中被局部激活,在脾脏中被全身性激活。Treg细胞对组织修复、再生和纤维化的直接或间接影响已被报道用于皮肤等各种器官gydF4y2Ba42gydF4y2Ba、肌肉gydF4y2Ba43gydF4y2Ba,和肺gydF4y2Ba44gydF4y2Ba.Treg细胞影响单核细胞和中性粒细胞招募、巨噬细胞极化和t效应细胞分化gydF4y2Ba45gydF4y2Ba调节伤口愈合和组织重塑。在纤维化肺和肝脏疾病中,FOXP3gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTreg细胞限制纤维形成gydF4y2Ba44gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.在我们的CP小鼠模型中,以及在人类CP患者样本中,我们观察到FOXP3的显著增加gydF4y2Ba+gydF4y2BaTreg细胞和GATA3gydF4y2Ba+gydF4y2Ba慢性炎症胰腺中的Th2细胞。我们的观察结果与Habtezion等人的研究结果一致,他们观察到CP患者胰腺组织中有明显的Treg细胞浸润gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.CD4旁边gydF4y2Ba+gydF4y2BaT细胞,还有CD8αgydF4y2Ba+gydF4y2BaCP组织中可见T细胞gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.还CD8αgydF4y2Ba+gydF4y2BaT细胞受Treg细胞调控gydF4y2Ba49gydF4y2Ba.我们可以证明CD8αgydF4y2Ba+gydF4y2Ba细胞分布在慢性胰腺炎小鼠的组织中,Treg缺失小鼠的细胞数量增加。CD8αgydF4y2Ba+gydF4y2Ba细胞对纤维形成的影响尚不明确,一方面已知CD8αgydF4y2Ba+gydF4y2Ba细胞会导致组织纤维化,就像系统性硬化症一样gydF4y2Ba50gydF4y2Ba另一方面,它们可以通过诱导星状细胞凋亡来抗纤维化,就像在纤维化肝病中所描述的那样gydF4y2Ba51gydF4y2Ba.gydF4y2Ba
我们的实验证明,在胰腺炎期间,Treg细胞抑制涉及先天免疫系统和适应性免疫系统细胞的全身和局部2型免疫反应。Treg细胞的耗竭导致全身和胰腺Th2/ ilc2反应显著增加,伴随着细胞因子IL-4和IL-10水平的升高。在脾脏中,ILCs分化为ilc2,我们发现ilc2在胰腺中积累。已知Th2细胞和ilc2可以释放IL-4/IL-13并促进巨噬细胞的选择性极化gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.在受损的胰腺中,我们观察到巨噬细胞极化向交替激活的CD206方向的显著转变gydF4y2Ba+gydF4y2Ba可能引发过度纤维化和限制腺泡细胞再生的巨噬细胞。交替激活的巨噬细胞,主要描述为m2样巨噬细胞,已知调节星状细胞的活化和纤维化gydF4y2Ba13gydF4y2Ba以及器官再生和腺泡细胞分化gydF4y2Ba15gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.各种生长因子的释放决定了组织的再生/纤维化gydF4y2Ba55gydF4y2Ba.这两个过程都由生长因子及其反调控因子控制gydF4y2Ba18gydF4y2Ba,gydF4y2Ba55gydF4y2Ba.体外分析表明,巨噬细胞对受损腺泡细胞的反应与各种生长因子转录的增加反应。耗竭调节性T细胞允许胰腺CD206gydF4y2Ba+gydF4y2Ba巨噬细胞释放过量的各种生长因子,如已知的激活PSCs和促进纤维化的TGF-β和FGFgydF4y2Ba19gydF4y2Ba.类似地,激活素,另一个生长因子的tgf超家族,驱动组织纤维化在慢性肝脏gydF4y2Ba56gydF4y2Ba、肾gydF4y2Ba57gydF4y2Ba和肺gydF4y2Ba58gydF4y2Ba疾病,并已报道激活胰腺星状细胞和成纤维细胞gydF4y2Ba59gydF4y2Ba.抑制素与激活素密切相关,但具有相反的生物学作用。激活素是抑制素βA亚基的同型二聚体,而抑制素是抑制素βA的异型二聚体,具有较远的α亚基。巨噬细胞响应受损腺泡细胞的损伤相关分子模式(DAMP)信号,上调抑制素βA转录水平,而抑制素α转录水平不变,促进激活素同二聚体的形成。激活素可诱导多聚多糖分泌细胞外基质蛋白,协同TGF-ß的作用gydF4y2Ba59gydF4y2Ba.也有研究表明TGF-ß刺激后PSCs释放激活素,这可能启动自分泌激活循环。激活素的另一种对抗调节剂是卵泡抑素,它可以阻断激活素与其受体的相互作用gydF4y2Ba60gydF4y2Ba.Follistatin在Treg细胞缺失时被抑制,已知它可以抑制PSCs中胶原蛋白和TGF-ß的合成,从而终止激活素自分泌环gydF4y2Ba59gydF4y2Ba.不仅是PSCs,腺泡细胞也对激活素刺激敏感。腺泡细胞分化过程中激活素的存在抑制分泌蛋白的合成并阻止细胞增殖gydF4y2Ba61gydF4y2Ba.我们假设在dt处理的动物中观察到的激活素和卵泡抑素的表达变化影响了腺泡细胞的再生,这可能解释了我们在缺乏Treg细胞的小鼠中看到的腺泡到导管化生的增强。激活素与抑制素、卵泡抑素之间的不平衡可能导致组织纤维化,并可能限制腺泡细胞的再生和分化。DT处理对Treg细胞的消耗导致Th2/ILC2反应不受约束,导致巨噬细胞的替代激活,同时伴随着生长因子及其对抗调节因子(激活素/抑制素和卵泡抑素)的失衡。gydF4y2Ba
如我们所示,Treg细胞能够抑制巨噬细胞反应和生长因子释放,并防止CP中不受控制的组织纤维化。Treg细胞通过抑制Th2细胞分化来控制胰腺巨噬细胞。然而,先天免疫系统的另一种细胞群,即ilc,可能参与其中。在我们的模型中,Treg细胞的耗竭导致lin的显著积累gydF4y2Ba-gydF4y2BaCD45gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba+gydF4y2BaCD90gydF4y2Ba+gydF4y2Ba胰腺中的细胞,我们只能在野生型小鼠的CP中检测到非常有限的数量。转录因子GATA3的表达将这些细胞描述为ilc2gydF4y2Ba62gydF4y2Ba.Treg细胞能够通过诱导T细胞共刺激因子(ICOS)-ICOS配体细胞接触抑制组织驻留ILCs的增殖gydF4y2Ba63gydF4y2Ba并以il -2依赖的方式gydF4y2Ba64gydF4y2Ba.ilc2反过来可以通过释放IL-4/IL-13刺激m2样巨噬细胞反应gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba.ILC2s也表达生长因子双调节蛋白gydF4y2Ba67gydF4y2Ba研究表明,其参与TGF-β介导的肺纤维化激活和再生过程。双调节蛋白可激活表皮生长因子受体(EGFR)家族信号通路gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba.许多研究已经确定egfr途径是控制伤口愈合反应的关键途径gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba.有趣的是,在冠状病毒(SARS-CoV)感染期间,也发现了双调节蛋白水平的增加,许多幸存者会发展成肺纤维化。与我们的CP小鼠模型类似,也有报道称,调控异常的EGFR通路与SARS-CoV感染后肺纤维化样疾病的发展有关gydF4y2Ba74gydF4y2Ba.gydF4y2Ba
总之,我们的数据表明,Treg细胞通过抑制Th2细胞和IL-4/IL-13释放的ilc2依赖的m2样巨噬细胞极化,对防止不受控制的纤维形成至关重要。Treg细胞的耗竭引发2型免疫反应,伴有明显的星状细胞活化和细胞外基质蛋白的产生(图。gydF4y2Ba10 fgydF4y2Ba).胰腺巨噬细胞不规则释放各种生长因子可能是过度成纤维的原因。有趣的是,尽管生长因子的释放增加,受损的腺泡细胞不会再生。显然,强烈的纤维性刺激抑制了胰腺外分泌组织的再生。CP患者的数据支持我们对动物模型的观察,而且在CP患者中,我们可以检测到全身和局部Treg细胞数量的显著增加。对于患有CP的患者,为了防止外分泌和内分泌功能不全,保存组织的治疗将是根本的。我们的结果表明,Treg细胞可以限制胰腺纤维化,同时刺激腺泡细胞再生。基于我们的研究结果,Treg/Th2平衡可能代表了CP治疗概念发展的一个有前途的目标。gydF4y2Ba
方法gydF4y2Ba
道德声明gydF4y2Ba
所有动物实验均经当地动物保护委员会(LALLF - Landesamt für Landwirtschaft, Lebensmittelsicherheit und Fischerei Mecklenburg-Vorpommern)批准,并按照reach准则进行。人体样本的研究得到了Greifswald大学医学伦理委员会的批准。所有参与者均给予书面知情同意。参与者没有因为参与这项研究而得到补偿。gydF4y2Ba
动物模型gydF4y2Ba
所有小鼠在无病原体条件下饲养在通风的动物箱中。所有小鼠被置于动物室,在温度为21-24°C(湿度为50-70%),光照-黑暗周期为12小时,并可自由获得食物和水。实验选用8-12周大的雄性或雌性小鼠。gydF4y2Ba
DEREG小鼠(C57Bl/6背景,细菌人工染色体转基因小鼠表达白喉毒素(DT)受体增强的绿色荧光蛋白融合蛋白控制下gydF4y2BaFoxp3gydF4y2Ba基因座,允许选择性和有效的消耗FOXP3gydF4y2Ba+gydF4y2BaTreg细胞通过DT注射)是由Jochen Huehn提供的,之前已经详细描述过gydF4y2Ba27gydF4y2Ba.野生型C57Bl/6小鼠购自Charles River Laboratories (Sulzfeld, Germany)。CP由每小时重复紫蓝素i.p.注射(50µg/kg/体重)(4030451,Bachem)诱导,持续6小时,每周3次,持续4周(补充图)。gydF4y2Ba1gydF4y2Ba).在第一次给药前一小时,通过1µg白喉毒素(DT) (D0564, Sigma Aldrich) i.p.注射,Treg细胞每周消耗3次(补充图)。gydF4y2Ba1 dgydF4y2Ba).对照组动物接受磷酸盐缓冲盐水(PBS)代替DT。该小鼠模型建立良好,并导致Treg细胞的成功耗竭gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
为了在小鼠CP期间中和IL-4,我们将Ultra-LEAF纯化的抗小鼠IL-4抗体(504138,BioLegend)每周注射三次i.p.0.75 mg抗体。对照组小鼠用Ultra-LEAF纯化的大鼠IgG1同型抗体以相同浓度处理(补充图。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
crth2特异性抑制剂OC000459 (12027, Cayman Chemical)以30µg浓度1:160二甲亚砜(A994.2, Roth)每日一次i.p.注射。对照组小鼠用PBS稀释1:160的二甲基亚砜(补充图)溶液进行i.p.处理。gydF4y2Ba1 cgydF4y2Ba).gydF4y2Ba
这些老鼠的体重是在四周内确定的。从那以后,所有的动物都被处死。血清和器官立即取出,在不同条件下保存,以备进一步实验。gydF4y2Ba
抗体gydF4y2Ba
采用以下抗体进行免疫荧光标记和流式细胞术分析:抗gfp(稀释1:200,ab6673, abcam),抗cd3(稀释1:200,100202,BioLegend),抗cd4(稀释1:200,UM800010, origene),抗mrc1 /CD206(稀释1:200,OASA05048, aviva-sysbio),抗-αSMA(稀释1:200,M0851, Dako),抗cd90(稀释1:200,14-0900-85,Invitrogen),抗amphiregulin(稀释1:200,sc-5796, SanatCruz),抗amphiregulin(稀释1:200,PA5-27298, Invitrogen),抗I型胶原蛋白(稀释1:200,ab34710, abcam),抗淀粉酶(稀释1:200,sc-46657,Santa Cruz),抗ki -67(稀释1:200,IHC-00375, Bethyl),抗fgf受体(稀释1:200,9740S,细胞信号),抗抑制素β a(稀释1:200,C9B1223, BioGenesis),抗il -13(稀释1:200,bs-0560R, Bioss抗体),抗il -33(稀释1:200,AF3626, R&D系统),抗stat6(稀释1:200,ab32520, abcam),抗gata3(稀释1:200,14-9966-80,eBioscience),抗cd25 - pe /Cy7(稀释1:50,102016,BioLegend),抗cd25 - pe /Cy7(稀释1:50,302612,BioLegend),抗cd4 - percp /Cy5.5(稀释1:50,100433,BioLegend),抗细胞角蛋白19(稀释1:200,ab15463, abcam),抗cd4 - pe(稀释1:50,100408,BioLegend),抗cd4 - percp /Cy5.5(稀释1:50,100434,BioLegend),抗cd4 - brilliant - violet510(稀释1:50,116026,BioLegend),抗cd4 - alexafluor488(稀释1:50,317420,BioLegend),抗cd8 α- pe /Cy5(稀释1:50,100710,BioLegend),抗cd8 α- pe(稀释1:50,100708,BioLegend),抗tbet - brilliant Violet 421(稀释1:10,644815,、抗tbet - percp /Cy5.5(稀释1:10,644806,BioLegend)、抗tbet - brilliant Violet605(稀释1:10,644817,BioLegend)、抗gata3 - pe(稀释1:10,653803,BioLegend;稀释1:10,130-100-652,MiltenyiBiotec),抗gata3 - brilliant Violet421(稀释1:10,653814,BioLegend),抗or γt- apc(稀释1:10,130-123-840,MiltenyiBiotec),抗foxp1 - alexafluor488(稀释1:10,53-4774-42,Invitrogen),抗foxp1 - alexafluor647(稀释1:10,320114,BioLegend),抗ptgdr2 /CD294-AlexaFlour594(稀释1:50,C47774-af594, SAB Signalway Antibody),抗CD69-Brilliant Violet510(稀释1:50,104532,BioLegend),抗CD69-Brilliant Violet510(稀释1:50,BioLegend),抗CD69-Brilliant Violet510(稀释1:50,104532,BioLegend),310936,生物基因),抗cd11b - percp /Cy5.5(稀释1:50,101228,生物基因),抗cd206 - apc(稀释1:50,141708,生物基因),抗cd206 - pe /Cy7(稀释1:50,141719,生物基因),抗cd163 - pe /Dazzle(稀释1:50,155315,生物基因),抗ly6g - bv421(稀释1:50,127628,生物基因),抗lin- alexaflour700(稀释1:20,77923,生物基因),抗cd45 - percp(稀释1:20,生物基因),抗cd45 - pe(103106,生物基因),CD45-PE/Cy5(稀释1:50,103109,生物传奇),抗cd90 - brilliant Violet605(稀释1:50,105343,生物传奇),抗cd126 - brilliant Violet650(稀释1:50,135043,生物传奇),抗gfap - alexa Fluor647(稀释1:50,51-9792-82,Invitrogen),抗cd271 - pe(稀释1:50,12-9400-42,Invitrogen),抗ccr2 - fitc(稀释1:50,150608,生物传奇),抗il -4- alexafluor488(稀释1:50,504109,生物传奇),抗il -13- pe(稀释1:50,159403,生物传奇),抗ifn γ-Brilliant Violet650(稀释1:50,505831,BioLegend),抗tnf -PE/Cy7(稀释1:50,506324,BioLegend),抗il -10- apc(稀释1:50,505010,BioLegend) PE/Cyanine7大鼠IgG2b,同型Ctrl抗体(稀释1:50,400617,BioLegend), Brilliant Violet 510美国仓鼠IgG同型Ctrl抗体(稀释1:50,400941,BioLegend), Brilliant Violet 421小鼠IgG2b,同型Ctrl抗体(稀释1:50,400341,BioLegend), Brilliant Violet 421小鼠IgG1,同型Ctrl抗体(稀释1:50,400157,BioLegend), Brilliant Violet 650大鼠IgG1,同型Ctrl抗体(稀释1:50,400437,BioLegend), PerCP/Cy5.5小鼠IgG1,同型Ctrl抗体(稀释1:50,400150,BioLegend), IgG1抗体,抗小鼠APC(稀释1:50,130-117-099,MiltenyiBiotec), AlexaFluor488大鼠IgG1,同型Ctrl(稀释1:50,400417,BioLegend), PE小鼠IgG2b,同型Ctrl(稀释1:50,400313,BioLegend), PE小鼠IgG1,同型Ctrl(稀释1:50,400313,BioLegend), APC Rat IgG2b, Isotype Ctrl (dilution 1:50, 400612, BioLegend), anti-goat-Cy3 (dilution 1:200, 705-165-147, Jackson ImmunoResearch), anti-mouse-FITC (dilution 1:200,115-095-146, Jackson ImmunoResearch), anti-mouse-Cy3 (dilution 1:200, 115-165-166, Jackson ImmunoResearch), anti-mouse-Cy5 (dilution 1:200, 115-175-146, Jackson ImmunoResearch), anti-rabbit-FITC (dilution 1:200, 711-095-152, Jackson ImmunoResearch), anti-rabbit-Cy3 (dilution 1:200, 111-165-144, Jackson ImmunoResearch), anti-rat-Cy3 (dilution 1:200, 112-165-062, Jackson ImmunoResearch), AlexaFluor647 donkey anti-rabbit (dilution 1:200, A31573, Invitrogen).
流式细胞术分析gydF4y2Ba
脾脏用70µm细胞滤器均质。PBS清洗脾细胞,300倍离心gydF4y2BaggydF4y2Ba6分钟。细胞颗粒重悬于1 mL 1×裂解液(10×缓冲液:1.5 M NH)中gydF4y2Ba4gydF4y2BaCl, 0.1 M KHCOgydF4y2Ba3 gydF4y2Ba, 10mm EDTA∙2Na),室温孵育5min。用PBS终止反应。gydF4y2Ba
研究脾细胞细胞因子的产生,2 × 10gydF4y2Ba6克ydF4y2Ba用细胞活化鸡尾酒(423302,BioLegend)、Brefeldin a (420601, BioLegend)和莫能菌素(420701,BioLegend)在增殖培养基(TexMACS medium, 130-097-196, MiltenyiBiotec;+10% FCS, +25 mM β-巯基乙醇),在CO中37°C浸泡4小时gydF4y2Ba2 gydF4y2Ba孵化器。gydF4y2Ba
用Multi tissue Dissociation Kit 1 (130-110-201, MiltenyiBiotec)分离胰腺组织。首先,胰腺被转移到无血清DMEM和酶的混合物中。组织用gentleMACS Dissociator (130-093-235, MiltenyiBiotec)均质,120次,37秒。在37°C下连续旋转孵育20分钟后,样品再次分离168次,持续37秒。通过70µm细胞过滤器过滤去除腺泡细胞和细胞外残留物。随后将悬浮液以300 ×离心gydF4y2BaggydF4y2Ba6分钟。gydF4y2Ba
新鲜外周血采集自7名慢性胰腺炎患者和10名健康志愿者,采用BD Vacutainer K2E EDTA管(367864,BD)。获得所有人的知情同意。用1 mL外周血分离CD3gydF4y2Ba+gydF4y2Ba细胞(CD3 MicroBeads, 130-050-101, MiltenyiBiotec)。gydF4y2Ba
用FACS缓冲液清洗后,1 × 10gydF4y2Ba6克ydF4y2Ba每管细胞用1µL FcR阻断试剂(130-092-575,MiltenyiBiotec)预孵育以阻断非特异性fc介导的相互作用。使用Zombie NIR Fixable viable Kit (423106, BioLegend)来排除死亡细胞。接下来,细胞外标记(1:50 CD4, CD69和CD25;1:20 lin-, 1:50 CD90, CD127和CD45;1:50 CD11b, Ly6g, CD163, CD206, GFAP, CD271)加入抗体鸡尾酒,4°C孵卵30 min。固定和渗透后(转录因子染色缓冲组,130-122-981,Miltenyi Biotec;固定缓冲液,420801,BioLegend)再次用FcR阻断试剂处理细胞悬液,并用细胞内抗体鸡尾酒(1:10 FOXP3, GATA-3和TBET;1:50 IL-4, IL-13, IFNγ, TNF和IL-10)。最后用流式细胞仪(BD,gydF4y2BaLSRIIgydF4y2Ba),并按gydF4y2BaFlowJogydF4y2Ba(补充图。gydF4y2Ba3 gydF4y2Ba).gydF4y2Ba
人体样本采集gydF4y2Ba
慢性胰腺炎EDTA血液样本经Greifswald大学医学伦理委员会(III UV 91/03)批准后在Greifswald大学医学收集。所有患者均给予书面知情同意。在EDTA中,从提供书面和知情同意的健康献血者中抽取对照血液。该程序已获得Greifswald大学医学伦理委员会(BB 014/14)的批准。在ChroPac试验(ISRCTN38973832)的背景下收集了人类慢性胰腺炎组织样本。gydF4y2Ba
组织学、免疫组化和免疫荧光gydF4y2Ba
立即从牺牲的小鼠中取出胰腺和淋巴结,并在4.5%甲醛中固定,进行石蜡包埋和TissueTec冷冻包埋。gydF4y2Ba
石蜡包埋组织样本切成2µm载玻片,然后用于Masson Goldner (100485, Merck Millipore)和Azan染色(12079,Morphisto)。gydF4y2Ba
免疫荧光标记从2µm冷冻载玻片进行。抗体以1:200稀释,在4℃下孵育过夜。适当的二抗也用1:200稀释,室温下1小时。gydF4y2Ba
在ChroPac试验的背景下收集了人类慢性胰腺炎组织样本(ISRCTN38973832)。gydF4y2Ba75gydF4y2Ba, Areg和CD90染色,如前所述对小鼠组织样本进行。gydF4y2Ba
血清细胞因子测定gydF4y2Ba
采用流式细胞仪珠阵列(CBA)小鼠Th1/Th2/Th17 CBA试剂盒(小鼠炎症试剂盒)(BD 560485 (552364), BD Bioscience, San Jose, CA, USA)检测IL-6、IL-4、IFNγ、TNF、IL-17A和IL-10的血清细胞因子浓度。gydF4y2Ba
血清胶原蛋白测定gydF4y2Ba
采用可溶性胶原蛋白测定试剂盒(ab241015, abcam)测定血清胶原蛋白浓度。用荧光计(FluorStar Optima, BMG Labtech)在端点模式下测量荧光(Ex/Em = 340/460 nm)。gydF4y2Ba
血清脂肪酶测定gydF4y2Ba
使用罗氏/日立公司的比色试剂盒Lip (Ref. 11821792216)测定血清中脂肪酶的酶活性。gydF4y2Ba
粪便弹性蛋白酶活性分析gydF4y2Ba
称量粪便,在500 mmol/L NaCl、100 mmol/L CaCl中重悬gydF4y2Ba2 gydF4y2Ba含有0.1% Triton X-100和两次超声波。使用0.12 mM弹性蛋白酶底物Suc-AAA-AMC (4006305.0050, Bachem),在37°C下,通过荧光酶动力学测定粪便弹性蛋白酶活性超过1小时。gydF4y2Ba12gydF4y2Ba.在含5 mmol/l氯化钙的100 mmol/l Tris缓冲液中测定动力学gydF4y2Ba2 gydF4y2BapH值8.0。gydF4y2Ba
BMDMs和腺泡原代细胞的分离gydF4y2Ba
通过胶原酶消化(collagenase of。6)从小鼠(C57Bl/6)胰腺中分离出腺泡gydF4y2Bahistolyticum梭状芽胞杆菌gydF4y2Ba(EC.3.4.24.3)来自Serva,批号:14007,海德堡,德国)在无菌条件下。胰腺在含1mg胶原酶的培养基中消化2 × 15分钟,腺泡细胞通过多次重悬从组织中仔细分离gydF4y2Ba6克ydF4y2Ba.细胞在含有10 mM 4-(2-羟乙基)−1-哌嗪乙磺酸(HEPES)、2%牛血清白蛋白(BSA)和1% Penstrep的Dulbecco改良Eagle培养基中维持和刺激。用1µM CCK(胆囊收缩素(CCK) Fragment 26-33 Amide, non-sulphated, Sigma-Aldrich CAS No: 25679-24-7)刺激腺泡细胞30分钟,然后以70 g离心30秒,并重新悬浮在新鲜介质中以洗去残留的CCK。如前所述,在无菌条件下从C57Bl/6小鼠的股骨和胫骨中分离出BMDMsgydF4y2Ba10gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.用无菌PBS将骨髓从骨骼中冲洗出来,并通过细胞过滤器(70µm)。细胞用无菌PBS清洗,计数,并以浓度为250万个细胞/孔的RPMI培养基(1% Penstrep和10% FCS)保存在6孔板中。从骨髓培养基中分离6小时后,去除未附着的细胞,将细胞重悬于含有20µg/ml M-CSF的新鲜培养基中。5-7天后,将细胞用于实验。BMDMs与腺泡共孵育6 h后,仔细清洗BMDMs去除残留腺泡,用TRIzol试剂提取细胞总RNA,进行柱状纯化和质量控制。gydF4y2Ba
RNA分离及RT-qPCR分析gydF4y2Ba
胰腺被取出,直接冷冻在液氮中。使用TRIzol试剂(15596026,life technologies)从胰腺组织中提取总RNA。样品用500 μ L TRIzol处理,用TissueLyser均质。加入100µL氯仿后,在22000 × g下涡旋离心,4℃下离心15 min。随后,三个相的上部被转移到一个新的管中。RNA通过加入250 μ L异丙醇进行沉淀。样品RT孵育10 min, 22000 × g离心10 min, 4℃。用500µL 75%乙醇清洗球团,在4℃下,6500 × g离心10 min。风干后用100 μ L A溶液溶解。服务台。gydF4y2Ba
RNA样本(2µg)转录为互补DNA (cDNA)。cDNA的合成采用标准程序:2µg RNA;5µM OligodT引物;75 ng随机引物;0,5 μ M dNTP Mix;1× First Strand Buffer (18080044, Invitrogen);10µm dtt;40单位RNasin核糖核酸酶抑制剂(N251B, Promega)和200单位M-MLV RT (28025013, invitrogen)。每次反应的总体积为20µL。gydF4y2Ba
利用SYBR-green法进行反向转录-定量PCR (RT-qPCR)分析目标基因的表达。qPCR扩增在含有1× SYBR Green PCR Master Mix(4309155,应用生物系统)、300 ng基因特异性寡核苷酸引物(反向和正向)的5µL体积中进行,cDNA片段以1:10稀释,分两次技术重复。检测正常转录水平gydF4y2BaRn5sgydF4y2Ba并与对照小鼠的相对表达量相比较。定量mRNA改变使用2gydF4y2Ba−∆∆CtgydF4y2Ba方法。gydF4y2Ba
使用以下引物:gydF4y2BaRn5sgydF4y2Ba正向5 ' -GCCCGATCTCGTCTGATCTC-3 '逆向5 ' -GCCTACAGCACCCGGTATTC-3 ',gydF4y2BaAmy2a4gydF4y2Ba反向5 ' - acatcttctcgccattccac -3 ',gydF4y2Ba沙土荒漠gydF4y2Ba反向5 ' - agcctccttcttcttctgtt -3 ',gydF4y2BaCol1agydF4y2Ba反向5 ' -CAAGGGTGCTGTAGGTGAAG-3 ',gydF4y2BaFgf1gydF4y2Ba'反向5 ' -AAGCCCTTCGGTGTCCATGG-3 ',gydF4y2Ba置gydF4y2Baforward 5 ' -AAAACCTACCGCAACGAATG-3 ' reverse 5 ' -TTCAGAAGAGGAGGGCTCTG-3 ',gydF4y2BaIfnggydF4y2Ba正向5 ' -GGATGCATTCATGAGTATTGC-3 '反向5 ' - ccttttccgctttcctgagg -3 ',gydF4y2BaIl4gydF4y2Ba前5 ' -AGATCATCGGCATTTTGAACG-3 '逆5 ' -TTTGGCACATCCATCTCCG-3 ',gydF4y2BaIl10gydF4y2Ba'反向5 ' - tccactgccttgctctatttt -3 ',gydF4y2Ba使用Il13gydF4y2Ba反向5 ' -ATGTTGGTCAGGGAATCCAG-3 ',gydF4y2BaIl1bgydF4y2Ba反向5 ' -GCCTGTAGTGCAGTTGTCTAA-3 ',gydF4y2Ba韩国仁荷gydF4y2Ba'反向5 ' -GGATGGCCGGAATACATAAG-3 ',gydF4y2BaInhbagydF4y2Ba正向5 ' -GATCATCACCTTTGCCGAGT-3 '逆向5 ' - tgggtcctggttctgttagcc -3 ',gydF4y2BaMrc1gydF4y2Ba反向5 ' -CATAGGTCAGTCCCAACCAAA-3 ',gydF4y2BaTgfb1gydF4y2Ba正向5 ' -CGAAGCGGACTACTATGCTAAA-3 '逆向5 ' -TCCCGAATGTCTGACGTATTG-3 ',gydF4y2Ba肿瘤坏死因子gydF4y2Ba反向5 ' -CACTTGGTGGTTTGCTACGA-3 ',gydF4y2BaTrp7gydF4y2Ba反向5 ' -TGCCTGGGTAAGAACTTGTG-3 ',gydF4y2BaChil3gydF4y2Ba反向5 ' -GTCCTTAGCCCAACTGGTATAG-3 ',gydF4y2BaActa2gydF4y2Baforward 5 ' -GCCAGTCGCTGTCAGGAACCC-3 ' reverse 5 ' -CCAGCGAAGCCGGCCTTACA-3 '。gydF4y2Ba
BMDMs的转录组分析gydF4y2Ba
根据制造商的说明,使用Affymetrix GeneChip小鼠基因2.0 ST阵列(Cat. 902118,赛默飞世尔科学公司,沃尔瑟姆,马萨诸塞州)和GeneChip WT PLUS试剂试剂盒(Cat. 902280,赛默飞世尔科学公司,沃尔瑟姆,马萨诸塞州)分析单个RNA样本。使用Rosetta Resolver软件系统(Rosetta Bio software, Seattle, WA)进行微阵列数据分析。使用以下标准定义显著不同的mRNA水平:Benjamini和Hochberg FDR (gydF4y2BapgydF4y2Ba≤0.05),信号校正统计(Ratio Builder软件,Rosetta Resolver) (gydF4y2BapgydF4y2Ba≤0.05),不同条件间的表达值比为1.5倍gydF4y2Ba10gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.gydF4y2Ba
软件gydF4y2Ba
采用BD FACS Diva和FlowJo对流式细胞数据进行分析。采用GraphPad Prism和SigmaPlot进行数据呈现和统计分析。可视化转录组阵列数据的热图是用RStudio创建的。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
微阵列数据已存入国家生物技术信息中心(NCBI)基因表达综合(GEO)数据库,并可通过以下GEO登录号访问:gydF4y2BaGSE192517gydF4y2Ba.支持本研究结果的所有数据均可在论文及其补充信息文件中获得。本文提供了原始数据。gydF4y2Ba
参考文献gydF4y2Ba
Ammann, R. W., Akovbiantz, A., Largiader, F. & Schueler, G.慢性胰腺炎的病程和结局。245例患者的内科-外科混合系列纵向研究。gydF4y2Ba胃肠病学gydF4y2Ba86gydF4y2Ba, 820-828(1984)。gydF4y2Ba
杰伊汉,g.o.等人。胰腺神经病变与神经痛——546例综合病理形态学研究。gydF4y2Ba胃肠病学gydF4y2Ba136gydF4y2Ba, 177 - 186。e1(2009)。gydF4y2Ba
亚达夫,D. & Lowenfels, A. B.胰腺炎和胰腺癌的流行病学。gydF4y2Ba胃肠病学gydF4y2Ba144gydF4y2Ba, 1252-1261(2013)。gydF4y2Ba
辛格,V. K.,亚达夫,D. & Garg, P. K.慢性胰腺炎的诊断和治疗:综述。gydF4y2Ba《美国医学会杂志》gydF4y2Ba322gydF4y2Ba, 2422-2434(2019)。gydF4y2Ba
梅耶勒,J.等。胰腺炎的遗传学、细胞生物学和病理生理学。gydF4y2Ba胃肠病学gydF4y2Ba156gydF4y2Ba, 1951 - 1968。e1(2019)。gydF4y2Ba
Sendler, M.等人。组织蛋白酶B活性通过消化蛋白酶激活胰腺腺泡细胞和实验性胰腺炎引发细胞凋亡。gydF4y2Ba生物。化学。gydF4y2Ba291gydF4y2Ba, 14717-14731(2016)。gydF4y2Ba
Halangk, W.等人。组织蛋白酶B在细胞内胰蛋白酶原激活和急性胰腺炎发病中的作用。gydF4y2Baj .中国。投资。gydF4y2Ba106gydF4y2Ba, 773-781(2000)。gydF4y2Ba
Gukovsky, I., Gukovskaya, A. S., Blinman, T. A., Zaninovic, V. & Pandol, S. J.早期NF-kappaB激活与激素性胰腺炎相关。gydF4y2Ba点。j .杂志。gydF4y2Ba275gydF4y2Ba, g1402-g1414(1998)。gydF4y2Ba
Sendler, M.等人。肿瘤坏死因子α分泌诱导小鼠急性实验性胰腺炎的蛋白酶激活和腺泡细胞坏死。gydF4y2Ba肠道gydF4y2Ba62gydF4y2Ba, 430-439(2013)。gydF4y2Ba
Sendler, M.等人。组织蛋白酶b介导的内吞巨噬细胞胰蛋白酶原激活增加小鼠胰腺炎的严重程度。gydF4y2Ba胃肠病学gydF4y2Ba154gydF4y2Ba, 704 - 718。e10(2018).
古科夫斯卡娅,A. S.等。中性粒细胞和NADPH氧化酶介导小鼠实验性急性胰腺炎胰蛋白酶激活。gydF4y2Ba胃肠病学gydF4y2Ba122gydF4y2Ba, 974-984(2002)。gydF4y2Ba
Sendler, M.等人。补体成分5通过激活星状细胞在2个慢性胰腺炎小鼠模型中介导纤维化的发展。gydF4y2Ba胃肠病学gydF4y2Ba149gydF4y2Ba, 765 - 776。e10(2015).
薛,J.等。激活的巨噬细胞促进慢性胰腺炎胰腺纤维化。gydF4y2BaCommun Nat。gydF4y2Ba6克ydF4y2Ba, 7158(2015)。gydF4y2Ba
吴,J.等。巨噬细胞表型开关调节急性胰腺炎损伤后的炎症和修复/再生。gydF4y2BaEBioMedicinegydF4y2Ba58gydF4y2Ba, 102920(2020)。gydF4y2Ba
Criscimanna, A., Coudriet, G. M., Gittes, G. K., Piganelli, J. D. & Esni, F.激活的巨噬细胞为小鼠胰腺腺泡细胞和β细胞再生创造谱系特异性微环境。gydF4y2Ba胃肠病学gydF4y2Ba147gydF4y2Ba, 1106 - 1118。e11(2014)。gydF4y2Ba
Rappolee, D. A., Mark, D., Banda, M. J. & Werb, Z.伤口巨噬细胞在体内表达TGF-alpha和其他生长因子:通过mRNA表型分析gydF4y2Ba科学gydF4y2Ba241gydF4y2Ba, 708-712(1988)。gydF4y2Ba
Nascimento, d.c.等。IL-33通过扩大调节性T细胞群,参与脓毒症诱导的长期免疫抑制。gydF4y2BaCommun Nat。gydF4y2Ba8 gydF4y2Ba, 14919(2017)。gydF4y2Ba
Wynn, T. A. & Vannella, K. M.巨噬细胞在组织修复,再生和纤维化。gydF4y2Ba免疫力gydF4y2Ba44gydF4y2Ba, 450-462(2016)。gydF4y2Ba
Apte, M. V.等。胰腺星状细胞被促炎细胞因子激活:胰腺纤维形成的意义。gydF4y2Ba肠道gydF4y2Ba44gydF4y2Ba, 534-541(1999)。gydF4y2Ba
Bachem, m.g.等。大鼠和人胰腺星状细胞的鉴定、培养和特征。gydF4y2Ba胃肠病学gydF4y2Ba115gydF4y2Ba, 421-432(1998)。gydF4y2Ba
Gieseck, R. L., Wilson, M. S. & Wynn, T. A. 2型免疫在组织修复和纤维化。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba18gydF4y2Ba, 62-76(2018)。gydF4y2Ba
Sendler, M.等人。NLRP3炎性小体调节急性胰腺炎小鼠全身炎症反应和代偿性抗炎反应综合征的发展。gydF4y2Ba胃肠病学gydF4y2Ba158gydF4y2Ba, 253 - 269。e14(2020).
Sakaguchi, S., Sakaguchi, N., Asano, M., Itoh, M. & Toda, M.通过活化表达IL-2受体α -链(CD25)的T细胞维持免疫自我耐受性。单一的自我耐受机制的破坏会导致各种自身免疫性疾病。gydF4y2Baj . Immunol。gydF4y2Ba155gydF4y2Ba, 1151-1164(1995)。gydF4y2Ba
Sakaguchi, S., Wing, K., Onishi, Y., Prieto-Martin, P. & Yamaguchi, T.调节性T细胞:它们如何抑制免疫反应?gydF4y2BaInt。Immunol。gydF4y2Ba21gydF4y2Ba, 1105-1111(2009)。gydF4y2Ba
Tiemessen, m.m.等人。CD4+CD25+Foxp3+调节性T细胞诱导人单核/巨噬细胞的选择性激活。gydF4y2Ba国家科学院学报美国gydF4y2Ba104gydF4y2Ba, 1946 - 19451(2007)。gydF4y2Ba
渡边,T.,工藤,M. & Strober, W.胰腺炎的免疫发病机制。gydF4y2Ba粘膜Immunol。gydF4y2Ba10gydF4y2Ba, 283-298(2017)。gydF4y2Ba
拉尔,K.等。Foxp3+调节性T细胞选择性耗竭可诱发坏血病样疾病。gydF4y2Ba实验,医学。gydF4y2Ba204gydF4y2Ba, 57-63(2007)。gydF4y2Ba
科斯米,L.等。CRTH2是检测健康和疾病中循环的人类2th型和2t型细胞毒性细胞最可靠的标志物。gydF4y2Ba欧元。j . Immunol。gydF4y2Ba30.gydF4y2Ba, 2972-2979(2000)。gydF4y2Ba
佩利,V. S.等。产生il -4的ilc2是Heligmosomoides polygyrus感染后TH2细胞分化所必需的。gydF4y2Ba粘膜Immunol。gydF4y2Ba9gydF4y2Ba, 1407-1417(2016)。gydF4y2Ba
火腿,E.等。IL-25和2型先天淋巴样细胞诱导肺纤维化。gydF4y2Ba国家科学院学报美国gydF4y2Ba111gydF4y2Ba, 367-372(2014)。gydF4y2Ba
佩蒂弗,R.等人。OC000459的药理学资料,一种有效的,选择性的,口服活性D前列腺素受体2拮抗剂,抑制肥大细胞依赖性的T辅助性淋巴细胞和嗜酸性粒细胞的激活。gydF4y2Baj .制药。其他实验。gydF4y2Ba340gydF4y2Ba, 473-482(2012)。gydF4y2Ba
Wojno, e.d.t.等人。前列腺素DgydF4y2Ba2 gydF4y2Ba受体CRTH2调节炎症肺中2组先天淋巴样细胞的积累。gydF4y2Ba粘膜Immunol。gydF4y2Ba8 gydF4y2Ba, 1313-1323(2015)。gydF4y2Ba
夏尔马,R.等。皮屑小鼠调节性T细胞抑制自身免疫T细胞的大量功能库gydF4y2Baj . Autoimmun。gydF4y2Ba29gydF4y2Ba, 10-19(2007)。gydF4y2Ba
Klocke, K., Sakaguchi, S., Holmdahl, R. & Wing, K.成年小鼠CTLA-4缺失诱导自身免疫性疾病。gydF4y2Ba国家科学院学报美国gydF4y2Ba113gydF4y2Ba, e2383-e2392(2016)。gydF4y2Ba
Mchedlidze, T.等。白细胞介素33依赖性先天淋巴细胞介导肝纤维化。gydF4y2Ba免疫力gydF4y2Ba39gydF4y2Ba, 357-371(2013)。gydF4y2Ba
弗罗斯特,F.等。外分泌胰腺功能受损与肠道菌群组成和多样性的变化有关。gydF4y2Ba胃肠病学gydF4y2Ba156gydF4y2Ba, 1010-1015(2019)。gydF4y2Ba
Beyer, G., Habtezion, A., Werner, J., Lerch, m.m. & Mayerle, J.慢性胰腺炎。gydF4y2Ba《柳叶刀》gydF4y2Ba396gydF4y2Ba, 499-512(2020)。gydF4y2Ba
哈伯,P. S.等。人类和实验性胰腺纤维化中胰腺星状细胞的活化。gydF4y2Ba点。j .分册。gydF4y2Ba155gydF4y2Ba, 1087-1095(1999)。gydF4y2Ba
Ansel, K. M., Djuretic, I., Tanasa, B. & Rao, A. Th2分化和Il4位点可达性的调控。gydF4y2Ba免疫。gydF4y2Ba24gydF4y2Ba, 607-656(2006)。gydF4y2Ba
Noval Rivas, M, Burton, o.t., Oettgen, H. C. & Chatila, T. 2组先天淋巴样细胞产生IL-4通过阻断调节性T细胞功能促进食物过敏。gydF4y2BaJ.过敏临床。Immunol。gydF4y2Ba138gydF4y2Ba, 801 - 811。e9(2016)。gydF4y2Ba
戈登,S.和马丁内斯,F. O.巨噬细胞的替代激活:机制和功能。gydF4y2Ba免疫力gydF4y2Ba32gydF4y2Ba, 593-604(2010)。gydF4y2Ba
Kalekar, l.a.等。皮肤中的调节性T细胞具有独特的抑制纤维化前免疫反应的能力。gydF4y2BaSci ImmunolgydF4y2Ba4gydF4y2Ba, eaaw2910(2019)。gydF4y2Ba
Burzyn, D.等。一种特殊的调节性T细胞群增强了肌肉修复。gydF4y2Ba细胞gydF4y2Ba155gydF4y2Ba, 1282-1295(2013)。gydF4y2Ba
Kotsianidis, I.等。CD4整体损伤gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2BaFOXP3gydF4y2Ba+gydF4y2Ba特发性肺纤维化中的调节性T细胞。gydF4y2Ba点。j .和。暴击。保健医疗。gydF4y2Ba179gydF4y2Ba, 1121-1130(2009)。gydF4y2Ba
李俊,谭俊,马蒂诺,马明明,吕国强。调节性t细胞:组织修复和再生的潜在调节因子。gydF4y2Ba前面。Immunol。gydF4y2Ba9gydF4y2Ba, 585(2018)。gydF4y2Ba
Claassen, M. A. A., de knet, R. J., Tilanus, H. W., Janssen, H. L. A. & Boonstra, A.大量调节性T细胞定位于慢性丙型肝炎感染患者的肝脏并限制纤维化程度。gydF4y2Baj .乙醇。gydF4y2Ba52gydF4y2Ba, 315-321(2010)。gydF4y2Ba
李,B.等。不同的免疫特征区分遗传性和特发性慢性胰腺炎。gydF4y2Baj .中国。投资。gydF4y2Ba130gydF4y2Ba, 2705-2711(2020)。gydF4y2Ba
李,B.等。单细胞测序揭示了人类慢性胰腺炎中CCR6-CCL20串扰的独特免疫微环境gydF4y2Ba肠道gydF4y2Bagutjnl - 2021 - 324546,gydF4y2Bahttps://doi.org/10.1136/gutjnl-2021-324546gydF4y2Ba(2021)。gydF4y2Ba
McNally, A., Hill, G. R., Sparwasser, T., Thomas, R. & Steptoe, R. J. CD4+CD25+调节性T细胞通过调节IL-2稳态来控制CD8+ T细胞效应分化。gydF4y2Ba国家科学院学报美国gydF4y2Ba108gydF4y2Ba, 7529-7534(2011)。gydF4y2Ba
Fuschiotti, P., Larregina, a.t., Ho, J., Feghali-Bostwick, C. & Medsger, t.a.白细胞介素13产生CD8+ T细胞介导系统性硬化症患者皮肤纤维化。gydF4y2Ba关节炎感冒。gydF4y2Ba65gydF4y2Ba, 236-246(2013)。gydF4y2Ba
Koda, Y.等。CD8+组织驻留记忆T细胞通过诱导肝星状细胞凋亡促进肝纤维化的解决。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 4474(2021)。gydF4y2Ba
哈姆斯,E., Bermingham, R. & Fallon, P. G.巨噬细胞和先天淋巴样细胞在纤维化发生中的相互作用。gydF4y2Ba前面。ImmunolgydF4y2Ba.gydF4y2Ba6克ydF4y2Ba, 597(2015)。gydF4y2Ba
Sica, A. & Mantovani, A.巨噬细胞的可塑性和极化:体内真实性。gydF4y2Baj .中国。投资。gydF4y2Ba122gydF4y2Ba, 787-795(2012)。gydF4y2Ba
Criscimanna, A.等。成年小鼠胰腺损伤后导管细胞促进内分泌细胞和腺泡细胞的再生。gydF4y2Ba胃肠病学gydF4y2Ba141gydF4y2Ba, 1451-1462(2011)。gydF4y2Ba
Barrientos, S., Stojadinovic, O., Golinko, m.s., Brem, H. & Tomic-Canic, M.伤口愈合中的生长因子和细胞因子:伤口愈合中的生长因子和细胞因子。gydF4y2Ba伤口修复再生gydF4y2Ba16gydF4y2Ba, 585-601(2008)。gydF4y2Ba
Patella, S., Phillips, D. J., Tchongue, J., de Kretser, D. M. & Sievert, W. Follistatin减弱早期肝纤维化:对肝星状细胞活化和肝细胞凋亡的影响。gydF4y2Ba点。j .杂志。Gastrointest。肝脏杂志。gydF4y2Ba290gydF4y2Ba, g137-g144(2006)。gydF4y2Ba
Yamashita, S, Maeshima, A, Kojima, I. & Nojima, Y.激活素A是肾间质成纤维细胞的有效激活剂。gydF4y2Baj。Soc。Nephrol。gydF4y2Ba15gydF4y2Ba, 91-101(2004)。gydF4y2Ba
哈迪,C. L.等。激活素A拮抗剂卵泡抑素抑制囊性纤维化样肺炎症和病理。gydF4y2BaImmunol。细胞生物。gydF4y2Ba93gydF4y2Ba, 567-574(2015)。gydF4y2Ba
Ohnishi, N.等。激活素A是大鼠胰腺星状细胞的自分泌激活剂:卵泡抑素对胰腺纤维化的潜在治疗作用。gydF4y2Ba肠道gydF4y2Ba52gydF4y2Ba, 1487-1493(2003)。gydF4y2Ba
Walton, K. L. Johnson, K. E. & Harrison, C. A.靶向TGF-β介导的SMAD信号用于预防纤维化。gydF4y2Ba前面。制药。gydF4y2Ba8 gydF4y2Ba, 461(2017)。gydF4y2Ba
安田,H.等。激活素A:大鼠胰腺腺泡AR42J细胞淀粉酶分泌和细胞增殖的负调节因子。gydF4y2Ba点。j .杂志。gydF4y2Ba267gydF4y2Ba, g220-g226(1994)。gydF4y2Ba
霍勒等人。转录因子GATA-3控制细胞命运和2型先天淋巴样细胞的维持。gydF4y2Ba免疫力gydF4y2Ba37gydF4y2Ba, 634-648(2012)。gydF4y2Ba
Rigas, D.等。调节性T细胞抑制2型先天淋巴样细胞可减弱气道高反应性,需要诱导型T细胞共刺激剂-诱导型T细胞共刺激剂配体相互作用。gydF4y2BaJ.过敏临床。Immunol。gydF4y2Ba139gydF4y2Ba, 1468 - 1477。e2(2017)。gydF4y2Ba
Gasteiger, G., Fan, X., Dikiy, S., Lee, S. Y. & Rudensky, A. Y.先天淋巴细胞在淋巴和非淋巴器官中的组织驻留。gydF4y2Ba科学gydF4y2Ba350gydF4y2Ba, 981-985(2015)。gydF4y2Ba
莱希纳,A. J.等人。招募的单核细胞和2型免疫促进肺切除术后的肺再生。gydF4y2Ba细胞干细胞gydF4y2Ba21gydF4y2Ba, 120 - 134。e7(2017)。gydF4y2Ba
Bouchery, T.等。ilc2和T细胞合作,确保M2巨噬细胞对钩虫的肺免疫维持。gydF4y2BaCommun Nat。gydF4y2Ba6克ydF4y2Ba, 6970(2015)。gydF4y2Ba
Krishnamoorthy, N.等。前沿:maresin-1参与调节性T细胞,限制2型先天淋巴样细胞激活,促进肺部炎症的解决。gydF4y2Baj . Immunol。gydF4y2Ba194gydF4y2Ba, 863-867(2015)。gydF4y2Ba
Berasain, C.等。双调节蛋白:小鼠肝脏再生的早期触发因子。gydF4y2Ba胃肠病学gydF4y2Ba128gydF4y2Ba, 424-432(2005)。gydF4y2Ba
周,Y.等。双调节蛋白是一种表皮生长因子受体配体,在转化生长因子-β诱导肺纤维化的发病机制中起着重要作用。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 41991-42000(2012)。gydF4y2Ba
德丸,S.等。表皮生长因子受体配体的外膜脱落是皮肤伤口愈合中角质形成细胞迁移所必需的。gydF4y2BaJ.细胞生物学。gydF4y2Ba151gydF4y2Ba, 209-220(2000)。gydF4y2Ba
华生杰,S. K.等。表皮生长因子受体促进皮肤切口损伤后早期愈合。gydF4y2BaJ.调查性皮肤病。gydF4y2Ba123gydF4y2Ba, 982-989(2004)。gydF4y2Ba
陈,J.等。EGFR信号通路促进TGFgydF4y2BaβgydF4y2Ba依赖性肾纤维化。gydF4y2BaJASNgydF4y2Ba23gydF4y2Ba, 215-224(2012)。gydF4y2Ba
Fuchs, b.c.等人。表皮生长因子受体抑制减弱肝纤维化和肝细胞癌的发展:Fuchs等。gydF4y2Ba肝脏病学gydF4y2Ba59gydF4y2Ba, 1577-1590(2014)。gydF4y2Ba
Venkataraman, T, Coleman, C. M. & friedman, M. B.过度活跃的表皮生长因子受体信号导致严重急性呼吸综合征冠状病毒感染后纤维化增加。gydF4y2Baj .性研究。gydF4y2Ba91gydF4y2Ba, e00182-17(2017)。gydF4y2Ba
迪纳,m.k.等。慢性胰腺炎的部分胰十二指肠切除术与保留十二指肠胰头切除术:多中心、随机、对照、双盲ChroPac试验gydF4y2Ba《柳叶刀》gydF4y2Ba390gydF4y2Ba, 1027-1037(2017)。gydF4y2Ba
确认gydF4y2Ba
作者要感谢Jochen Huehn提供的DEREG小鼠。我们也感谢Kathrin Gladrow, Diana Krüger, Susanne Wiche和Jenny Radel的技术支持。本工作得到了:Deutsche Forschungsgemeinschaft DFG SE 2702/2-1 - ms的支持。德国Forschungsgemeinschaft DFG SE 2702/2-3 - ms。,Deutsche Forschungsgemeinschaft DFG AG 203/4-1—A.A.A., Deutsche Forschungsgemeinschaft DFG GRK 1947—M.S., Deutsche Forschungsgemeinschaft DFG GRK 2719—M.S., A.A.A., B.M.B., and U.V. Deutsche Forschungsgemeinschaft DFG MA 4115/1-2/3—J.M., Deutsche Forschungsgemeinschaft DFG SFB1321: Project-ID 329628492— J.M., the PePPP center of excellence MV (ESF/14-BM-A55-0045/16)— F.U.W., M.M.L., and the EnErGie/P2 Project (ESF/14-BM-A55-0008/18)—A.A.A. and M.M.L.
资金gydF4y2Ba
由Projekt DEAL启动和组织的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
研究概念m.s., F.U.W, Juliane Glaubitz。数据采集和解读:Juliane Glaubitz, a.w., a.a.a., m.s., Janine Golchert, g.h., u.v., b.m.b., T.T.写作委员会m.s., f.u.w., Juliane Glaubitz, j.m., M.M.L.手稿的修正和最终版本的批准:全部。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Mark Kaplan和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
格劳比茨,J.,威尔登,A.,高尔赫特,J.。gydF4y2Baet al。gydF4y2Ba小鼠慢性胰腺炎CD25gydF4y2Ba+gydF4y2BaFOXP3gydF4y2Ba+gydF4y2Ba调节性T细胞通过抑制2型免疫反应来控制胰腺纤维化。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 4502(2022)。https://doi.org/10.1038/s41467-022-32195-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-32195-2gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba