摘要
虽然目前含有小hbs抗原(Ag)的乙型肝炎(HB)疫苗是有效和安全的,但有报道称,具有疫苗逃逸突变(VEMs)的乙型肝炎病毒(HBV)减毒预防。我们研究了一种由大剂量hbsag组成的HB疫苗,它克服了目前HB疫苗的缺点。将酵母源性大剂量hbsag免疫恒河猴,并将诱导抗体的中和活性与现有HB疫苗进行比较。虽然目前HB疫苗诱导的抗体不能预防VEMs的HBV感染,但大hbsag疫苗诱导的抗体可以中和这些感染。通过这些疫苗表现出减毒中和作用的HBV基因型不同。在这里,我们表明由大hbsag组成的HB疫苗有助于弥补目前HB疫苗的缺点。联合使用这些乙肝疫苗可能会诱导抗体,可以中和具有VEMs或多种HBV基因型的HBV株。
介绍
乙型肝炎病毒(HBV)感染可导致慢性肝脏疾病,如慢性肝炎、肝硬化和肝细胞癌1,2.2015年,世界卫生组织估计,全球约有2.57亿人感染乙肝病毒,并有肝硬化和肝细胞癌的风险3..母婴传播是一种重要的传播途径,但成人中的其他传播途径,如通过性接触或静脉注射毒品,也有助于乙型肝炎病毒的全球传播,因为血液或体液中的乙型肝炎病毒具有高度传染性4,5.目前基于核苷类似物和干扰素的慢性乙型肝炎(HB)治疗策略旨在抑制病毒繁殖和疾病进展,但它们不能根除患者体内的病毒2,6.虽然已经进行了几项试验,以确定一种有效的治疗方法,以消除感染患者的HBV,但这一目标尚未实现。因此,乙肝疫苗被认为是控制HBV传播和降低HBV相关发病率和死亡率的最有效方法。
HBV有部分双链3.2 kb DNA基因组,在其基因组中有四个开放阅读框编码乙型肝炎表面抗原(Ag)、乙型肝炎e (HBe) Ag/乙型肝炎核心(HBc) Ag、乙型肝炎聚合酶和乙型肝炎X蛋白7.HBsAg有三种形式:小(S-)、中(M-)和大(L-) HBsAg。S-HBsAg有226个氨基酸(aa),而M-和L-HBsAg分别有额外的preS2 (55 aa)和preS1+preS2 (174 aa)区域附着在S-HBsAg上。已知这些hbsag既可形成传染性HBV颗粒,也可形成非传染性亚病毒颗粒;HBV颗粒由所有HBsAg种类组成,亚病毒颗粒由S-HBsAg单独或与M-HBsAg联合组成。L-HBsAg在感染性病毒颗粒的形成中是必不可少的,因为它在preS1区域包含受体结合域(RBD)。酵母衍生的S-HBsAg已在世界范围内用作HB疫苗。目前日本正在使用两种采用不同HBV基因型的酵母源S-HBsAg的乙肝疫苗。两者都被认为具有同样强大的诱导中和抗体的能力,具有可容忍的安全性。但是,人们注意到一些不能忽视的问题。 Approximately 10% of vaccinated adults are known to have a low or no humoral response to these vaccines8.此外,抗原区氨基酸多态性的HBV变异(一个S-HBs的决定因素)甚至可以感染接种疫苗的个体9,10,11,12,13,14,15.这些变体中的氨基酸多态性被认为是导致病毒不被HB疫苗诱导的抗体中和的原因,被称为疫苗逃避突变(VEMs),尽管这些多态性对HB疫苗诱导抗体中和能力的影响的精确和定量评估尚未实现。
在这项工作中,为了解决目前HB疫苗的问题,我们的目标是建立一种包含酵母来源的L-HBsAg的HB疫苗。该L-HBsAg是通过将整个HBs区域的蛋白质包埋在单层脂质体中产生的,该脂质体通过形成模拟HBV颗粒的三维结构,在空心纳米颗粒表面显示从preS1到S-HBs的区域16,17,18.该抗原中包含的preS1区域含有RBD,有望成为HB疫苗的一个有前途的候选者19,20..为了评估L-HBsAg疫苗的有效性和安全性,我们将其与两种有效佐剂联合用于恒河猴免疫,并评估其对不同区域HBsAg的抗体诱导。为了研究诱导抗体的中和能力,我们利用细胞培养产生的HBV (HBVcc)和HBV报告病毒的感染系统21,22,23.HBV报告病毒感染系统可用于评估疫苗诱导抗体对VEM或细胞培养中各种基因型HBV克隆的HBV变异的中和作用。
结果
恒河猴抗hbs抗体的诱导
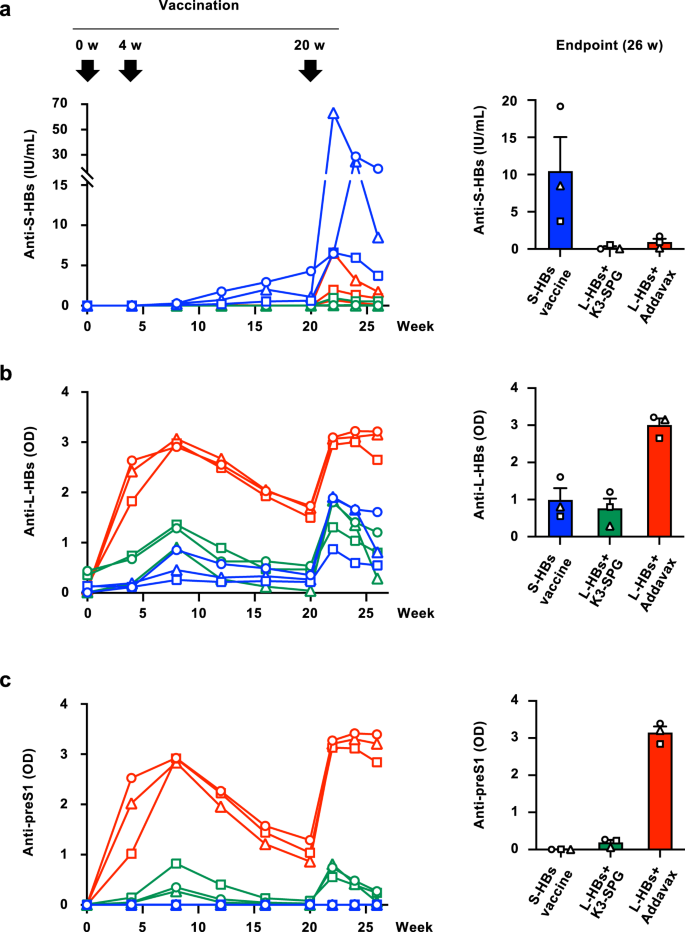
为了评估由酵母来源的L- hbsag组成的HB疫苗的免疫原性,HBV基因型(GT) C的L- hbsag(3.0µg)与K3-SPG(100µg, L- hbs +K3-SPG)或Addavax(500µL, L- hbs +Addavax)混合,并用于免疫恒河猴(n每组= 3)。作为对照,由GTC的酵母衍生的S-HBsAg组成的市售HB疫苗(S-HBs疫苗)也被用于免疫恒河猴(n= 3)。这些疫苗在首次接种后4周和20周按照三剂HB系列疫苗的方案进行三次皮下注射,观察持续到首次接种后26周(图2)。1).在接种疫苗期间,未观察到与疫苗相关的临床异常或肝酶水平的严重升高,包括丙氨酸转氨酶、天门冬氨酸转氨酶和γ -谷氨酰转肽酶的水平。1).
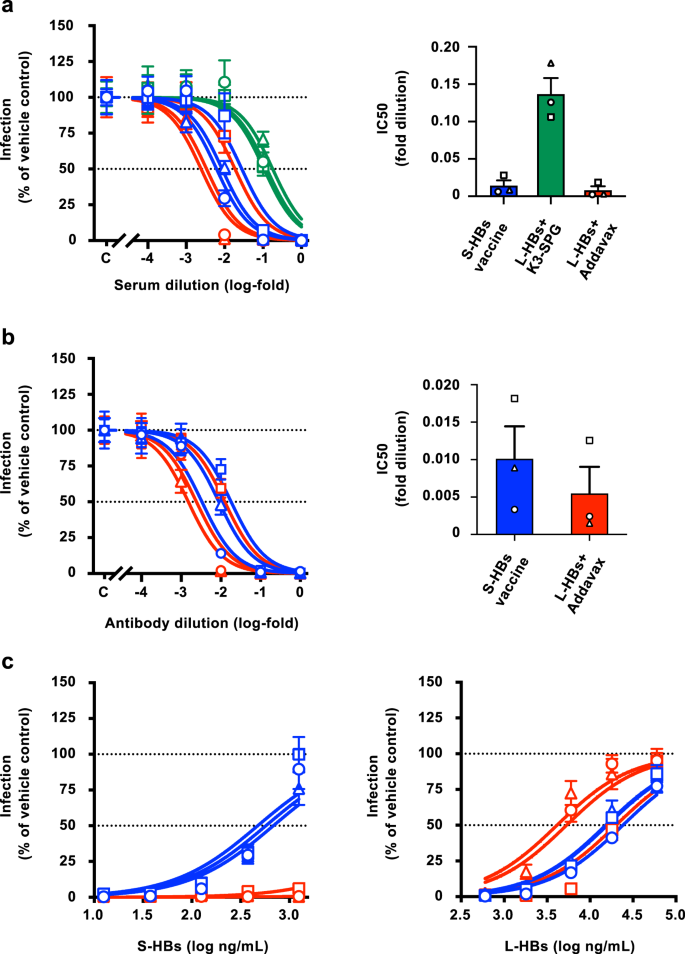
诱导S-HBs抗体(一个)、L-HBs (b),及preS1 (c)在恒河猴免疫S-HBs疫苗(蓝色)、L-HBs+K3-SPG(绿色)或L-HBs+Addavax(红色)后进行测量。这些疫苗分别在0、4和20周皮下注射三次,观察持续到首次接种疫苗后26周。疫苗接种期间每4周采集一次血液样本,最后一次疫苗接种后每2周采集一次血液样本。一个抗s - hbs抗体滴度用酶知抗- hbs II测定。b采用酶联免疫吸附法测定抗l - hbs抗体效价。的y-轴表示450nm处的吸光度。c采用酶联免疫吸附法测定抗pres1抗体效价。的y-轴表示450nm处的吸光度。右图显示了3只动物在观察期结束时滴度的平均值±SE。源数据作为源数据文件。
对于S-HBs疫苗免疫,在给猕猴注射第三次疫苗后,检测到抗- hbs抗体的强烈诱导(本研究称其为抗-S-HBs抗体,以区别于对其他hbsag的抗体),而L-HBs+K3-SPG和L-HBs+Addavax免疫的抗-S-HBs抗体的诱导有限(图。1).在观察期结束时,L-HBs+K3-SPG和L-HBs+Addavax免疫后的抗S-HBs滴度分别比S-HBs疫苗低53倍和11倍(图2)。1,右侧面板)。然而,L-HBs+Addavax免疫检测到抗L-HBs抗体的强烈诱导,高于S-HBs疫苗和L-HBs+K3-SPG(图2)。1 b).在终点,L-HBs+Addavax免疫诱导的抗L-HBs滴度分别比S-HBs疫苗和L-HBs+K3-SPG诱导的抗L-HBs滴度高约3倍和4倍(图2)。1 b,右侧面板)。L-HBs+Addavax免疫的抗pres1抗体诱导比L-HBs+K3-SPG高约17倍,而S-HBs疫苗免疫未检测到抗pres1抗体的诱导(图2)。1 c).
诱导抗体中和HBV感染
为了评估诱导抗体的中和活性,使用了HBVcc感染系统(补充图。2).在观察期结束时获得的10倍或100倍稀释的免疫猕猴血清样本与HBVcc (GTC)以1000个基因组当量(GEq)/细胞混合,接种到HepG2-NTCPsec+细胞中24.当用稀释了100倍的S-HBs疫苗免疫的猕猴血清样本处理的HBVcc进行感染时,检测到的hbc阳性细胞水平明显低于用载体处理的HBVcc感染时。用10倍稀释处理后,几乎检测不到hbc阳性细胞,这表明S-HBs疫苗免疫的猕猴血清样本中和了hbc阳性细胞(图2)。2).与S-HBs疫苗免疫的猕猴相比,L-HBs+ k3 - spg免疫的猕猴血清样本经病毒感染后,hbc阳性细胞数量增加,而L-HBs+ addavax免疫的猕猴血清样本经病毒感染后,hbc阳性细胞数量减少(图2)。2 b).
一个HBVcc (GTC, 1000 GEq/cell)用10倍或100倍稀释的恒河猴血清样本接种乙肝疫苗并感染HepG2-NTCPsec+细胞。PBS处理HBVcc作为对照。感染后12天用抗hbc抗体染色检测感染细胞,用DAPI观察细胞核。给出了每组3只动物的数据。b用恒河猴血浆样本处理HBVcc后,评价其感染效率。测量每张图像中hbc阳性细胞的相对荧光强度,并表示为载体处理的百分比。表示各组3只动物的均值±SE。源数据作为源数据文件。
诱导抗体中和活性的定量
为了精确量化中和效果,使用了HBV报告病毒(HBV/NL)感染系统(补充图)。2 b).本实验中使用的HBV/NL是由HBV GTC菌株和指定的HBV/NL野生型(WT)生成的。HB疫苗免疫的猕猴血清样本以10倍的增量连续稀释,并与HBV/NL-WT混合孵育。随后,用猕猴血清处理过的病毒感染G2/NT18-C细胞25.通过检测感染细胞中的NanoLuc荧光素酶(NL)活性来量化HBV感染效率(图2)。3,左面板)。HBV/NL- wt感染后NL活性随血清样品稀释系数的增加而增加。50%抑制浓度(IC50L-HBs+ addavax免疫的猕猴血清样品的免疫活性最低(8.15 × 10−3±5.25 × 10−3其次是S-HBs疫苗免疫的猕猴(1.43 × 10−2±6.93 × 10−3倍)。的集成电路50L-HBs+ k3 - spg免疫的猕猴血清样品的值最高,为1.37 × 10−1±2.15 × 10−2倍(无花果。3,右侧面板)。这些动物的免疫前血清样本显示对HBV/NL-WT感染没有抑制作用(补充图。3.).接下来,我们重点比较了S-HBs疫苗和L-HBs+Addavax的免疫效果。
一个在HBV/NL-WT感染系统中评估血清样本的中和活性。细胞培养生成的HBV/NL-WT (GTC, 20 GEq/cell)与连续稀释的S-HBs疫苗(蓝色)、L-HBs+K3-SPG(绿色)或L-HBs+Addavax(红色)免疫的恒河猴血清样本在37℃混合1 h后感染G2/NT18-C细胞。在感染后7天,通过测量5孔中感染细胞的NL活性来评估在相应稀释度下的感染效率,并在每种稀释度下指示平均值±SD。绘制了log(抑制剂)与归一化反应模型的剂量-反应曲线50计算数值。IC的平均值±SE50三种动物的数值显示在右侧面板中。b在HBV/NL-WT感染系统中评估纯化抗体的中和活性。HBV/NL-WT (GTC, 20 GEq/cell)与S-HBs疫苗-(蓝色)或L-HBs+Addavax-(红色)免疫猕猴诱导的连续稀释抗体在37℃下混合1 h,用于感染G2/NT18-C细胞。通过在感染后7天在5孔中测量感染细胞的NL活性来评估相应稀释度下的感染效率,并表示每种稀释度下的平均值±SD。绘制了log(抑制剂)与归一化反应模型的剂量-反应曲线50计算数值。IC的平均值±SE50三种动物的数值显示在右侧面板中。c使用S-HBs或L-HBs抗原的抗体吸附试验来评估诱导抗体对中和作用的特异性。以10倍浓度的IC制备S-HBs疫苗-(蓝色)和L-HBs+Addavax-(红色)免疫猕猴诱导的纯化抗体50并以指定浓度与S-HBs或L-HBs抗原混合。HBV/NL-WT与抗原吸附抗体孵卵,用于感染G2/NT18-C细胞。在感染后7天的5孔内,通过检测感染细胞的NL活性来评估在S-HBS或L-HBs抗原指定浓度下的感染效率,并表示每种浓度下的平均值±SD。绘制了log(抑制剂)与标准化反应模型的剂量-反应曲线。源数据作为源数据文件。
为了确认所观察到的中和作用是否依赖于血清中的抗体,我们对血清样本中的抗体进行了纯化,并对其中和作用进行了研究。从S-HBs疫苗和L-HBVs+ addavax免疫的猕猴中纯化的抗体蛋白浓度具有可比性,而从L-HBVs+ k3 - spg免疫的猕猴中纯化的抗体蛋白浓度略低于前者(补充图)。4).与血清样本实验相似,HBV/NL-WT与纯化的抗体以10倍的增量稀释后孵育并感染。正如预期的那样,用纯化抗体治疗产生了与用血清治疗观察到的相似的剂量-反应曲线(图。3 b,左面板)。的集成电路50S-HBs疫苗-和L-HBs+ addavax免疫的猕猴纯化抗体值为1.01 × 10−2±4.32 × 10−3-fold和5.45 × 10−3±3.54 × 10−3-fold(图;3 b,右侧面板)。当比较血清样品和纯化抗体的检测结果时,IC的比例50S-HBs疫苗免疫与L-HBs+ addavax免疫的价值基本相同。
对诱导抗体进行了抗体吸附实验。纯化的抗体在10倍浓度的IC下制备50并与连续稀释的S-HBs或L-HBs抗原混合。HBV/NL-WT与抗原吸附抗体孵卵后感染G2/NT18-C细胞。S-HBs疫苗免疫的猕猴的抗体中和能力在与S-HBs抗原孵育后减弱(图。3 c,左面板)。相比之下,L-HBs+ addavax免疫的猕猴抗体的中和作用很少受到S-HBs蛋白孵育的影响。然而,与L-HBs抗原孵卵后,S-HBs疫苗和L-HBs+ addavax免疫的猕猴抗体的中和作用均有效降低(图2)。3 c,右侧面板)。
HB疫苗诱导的VEMs抗体的中和活性
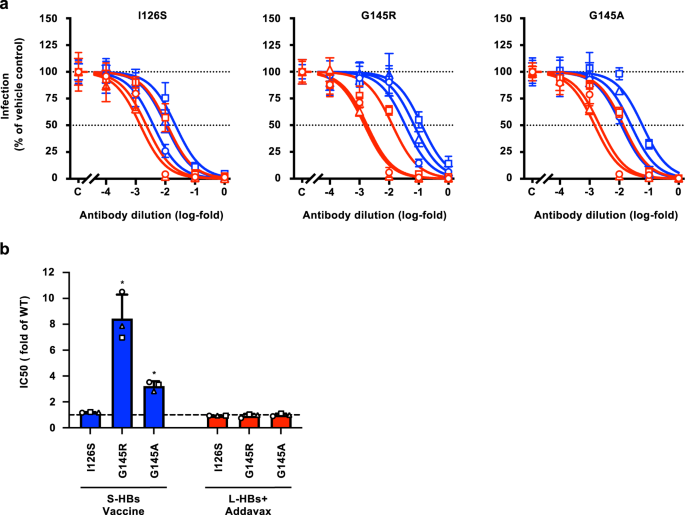
然后,我们评估了VEMs对HBV/NL乙肝疫苗诱导的抗体中和活性的影响。将具有代表性的VEMs,包括126氨基酸上的异亮氨酸到丝氨酸(I126S)、145氨基酸上的甘氨酸到精氨酸(G145R)、145氨基酸上的甘氨酸到丙氨酸(G145A)引入HBV/NL-WT,生成HBV/NL-I126S、HBV/NL-G145R和HBV/NL-G145A(补充图)。2 b和5).这些HBV/NL变体与连续稀释的抗体孵卵,并用于感染G2/NT18-C细胞。S-HBs疫苗诱导的HBV/NL-I126S感染抗体的中和活性略低于HBV/NL-WT感染的中和活性(剂量-反应曲线向右迁移)。4,左面板;参见图。3 b,左面板)。的集成电路50HBV/NL-I126S是HBV/NL-WT的1.19±0.0240倍。4 b及补充表1).在使用HBV/NL-G145R和-G145A的实验中,IC增加50值的检测(图;4,中间和右边的面板)。的集成电路50HBV/NL-G145R和- g145a分别是HBV/NL-WT的8.45±1.84倍和3.23±0.363倍。4 b及补充表1).相反,这些vem不影响L-HBs+ addavax诱导的抗体的中和活性。的集成电路50HBV/NL-I126S、-G145R和-G145A的值与HBV/NL-WT相似(图2)。4 b及补充表1).
一个通过HBV/NL感染系统评估VEMs诱导的HBV抗体的中和活性。将VEMs、HBV/NL- i126s、-G145R和-G145A (20 GEq/cell)的HBV/NL菌株与S-HBs疫苗(蓝色)和L-HBs+Addavax(红色)免疫的恒河猴连续稀释抗体在37℃混合1 h,用于感染G2/NT18-C细胞。在感染后7天,通过检测感染细胞中的NL活性来评估感染效率。b的集成电路50通过对数(抑制剂)与标准化反应模型绘制剂量-反应曲线,并与HBV/NL-WT的百分比进行比较,计算值。表示3只动物的平均值±SD。*P双尾配对= 0.0033t以及。源数据作为源数据文件。
为了证实该系统是否可用于检测VEMs对乙肝疫苗诱导的HBV感染抗体中和作用的影响,我们评估了人体内S-HBs疫苗诱导抗体的中和活性。从S-HBs疫苗免疫个体血清样品中纯化抗体,比较其对HBV/NL-WT和-G145R的中和活性。与在恒河猴中诱导的抗体相似,引入G145R后,S-HBs疫苗诱导的抗体在人体内的中和活性也减弱了。HBV/NL-G145R的剂量反应曲线与HBV/NL-WT的呈右迁移,计算出的IC50HBV/NL-G145R抗体是HBV/NL-WT抗体的3.89±0.622倍(补充图)。6).
不同基因型HBV株的中和活性
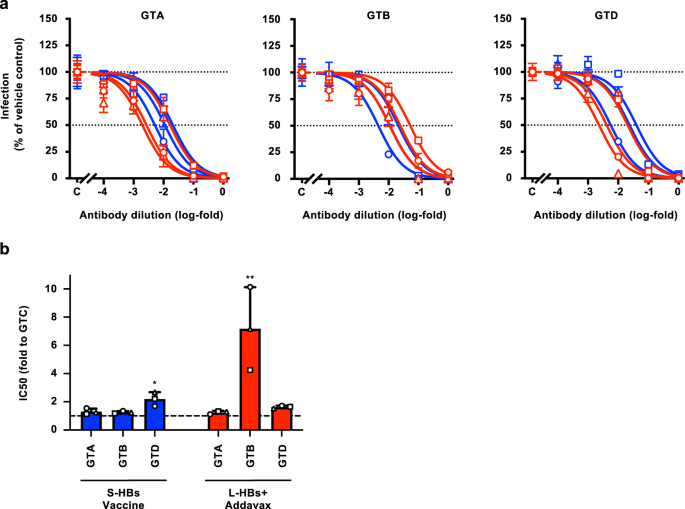
为了研究HB疫苗诱导抗体中和活性的基因型依赖性,生成并使用了GTA的L-HBs区HBV/NLs (HBV/NL-GTA)、GTB (HBV/NL-GTB)和GTD (HBV/NL-GTD)(补充图)。2 b和5).这些HBV/NL菌株用连续稀释的抗体孵育,并用于感染G2/NT18-C细胞。S-HBs疫苗诱导的HBV/NL-GTA和-GTB抗体的中和活性与HBV/NL-WT (GTC)相当(图2)。5、左、中面板;参见图。3 b,左面板)。的集成电路50这些基因型的抗体值分别是HBV/NL-WT (GTC)的1.31±0.208-和1.26±0.0876倍(图2)。5 b及补充表2).对于HBV/NL-GTD, S-HBs疫苗诱导抗体的中和活性低于HBV/NL-GTA和-GTB(图)。5(右侧面板)和集成电路50为HBV/NL-WT (GTC)的2.19±0.489倍。5 b及补充表2).在使用L-HBs+ addavax诱导的抗体的实验中,对HBV/NL-GTA和-GTD的中和活性与对HBV/NL-WT的中和活性相当(图2)。5).对HBV/NL-GTB的中和活性较低50抗体值为HBV/NL-WT (GTC)的7.18±2.94倍(图2)。5 b及补充表2).这些数据表明,S-HBs疫苗和L-HBs+Addavax诱导的抗体的中和作用取决于HBV基因型;在GTD和GTB菌株中分别观察到S-HBs疫苗诱导抗体和L-HBs+ addavax诱导抗体的中和活性减弱。
一个通过HBV/NL感染系统评价诱导抗体对不同基因型HBV毒株的中和活性。将含有GTA、GTB和GTD的L-HBs区域的HBV/NLs与S-HBs疫苗(蓝色)或L-HBs+Addavax(红色)免疫的恒河猴的连续稀释抗体在37℃混合1小时,感染到G2/NT18-C细胞中。感染后7天,通过检测感染细胞的NL活性来评估感染效率。b的集成电路50通过对数(抑制剂)与归一化反应模型绘制剂量-反应曲线计算值,并指示与HBV/NL-WT (GTC)的折叠程度。表示3只动物的平均值±SD。*P双尾配对= 0.0139t以及。**P双尾配对= 0.0171t以及。源数据作为源数据文件。
负责对GTB中和作用减弱的区域
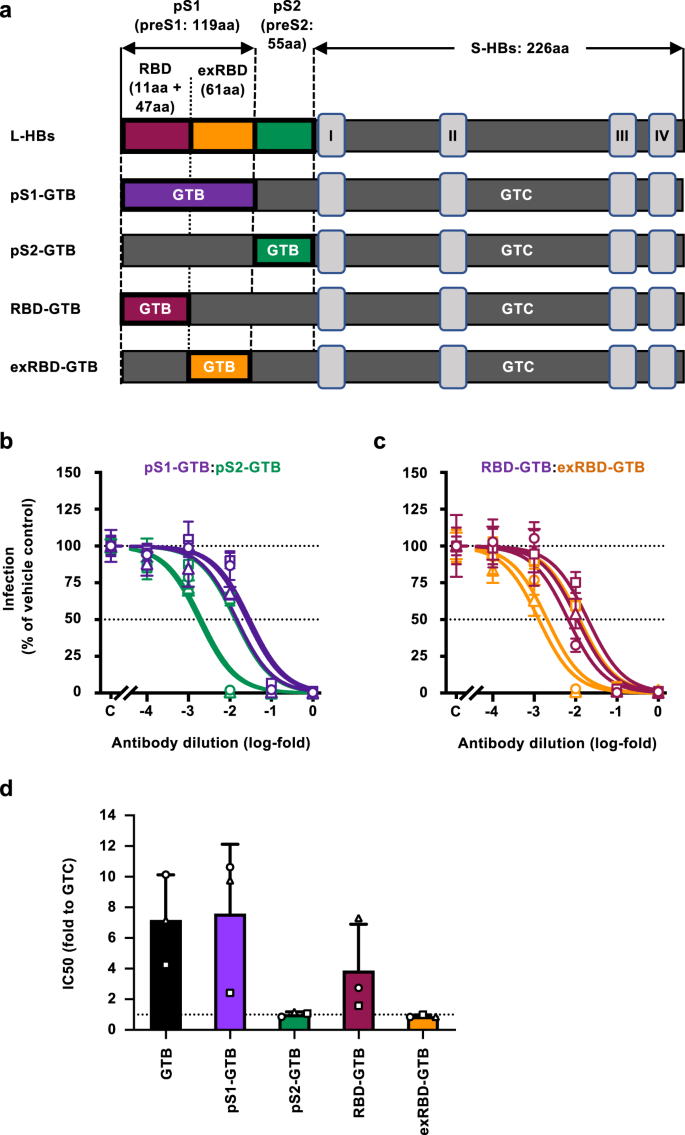
为了确定L-HBs+ addavax诱导的抗体对GTB菌株的中和作用减弱的区域,生成并使用与GTB菌株不同区域的嵌合HBV/NL。将HBV/NL (GTC)的preS1和preS2区替换为GTB的preS1和preS2区,生成的嵌合菌株分别命名为HBV/NL- ps1 -GTB和-pS2-GTB(图2)。6).将这些HBV/NL菌株与L-HBs+ addavax诱导的抗体孵育,并评估感染效率。对HBV/NL-pS1-GTB的中和活性减弱与对HBV/NL-GTB相似,而对HBV/NL-pS2-GTB的中和活性几乎与对HBV/NL-WT (GTC)相同,这表明preS1区域是导致L-HBs+ addavax诱导的抗体对GTB株中和作用减弱的原因(图)。6 b, d).接下来,我们将preS1分为两个区域;包括RBD和不包括受体结合域(exRBD),分别生成包含这些区域的HBV/NL菌株:HBV/NL-RBD- gtb和HBV/NL-exRBD- gtb(图2)。6).对HBV/NL-RBD-GTB (GTC)的中和活性与HBV/NL-GTB或HBV/NL-pS1-GTB的中和活性相似,而对HBV/NL-exRBD-GTB的中和活性与HBV/NL-WT (GTC)的中和活性相似。(无花果。6 c, d).这些数据表明,GTB菌株特异性RBD中的5个氨基酸多态性是导致L-HBs+ addavax诱导抗体中和作用减弱的原因(补充图)。5).这些数据也表明,L-HBs+ addavax诱导抗体的主要抗原区在preS1区的RBD。为了确定负责的氨基酸,我们用GTC型替换其中一个氨基酸,并评估L-HBs+ addavax诱导的抗体对这些菌株的中和活性。5株含有gtc型氨基酸(-K35G、-E39N、-L45F、-H48N和-N51H)的HBV/NL-RBD-GTB的中和作用减弱,与HBV/NL-RBD-GTB的中和作用水平相似(补充图)。7),并没有指明负责的氨基酸。
一个L-HBsAg和HBV/NL嵌合结构的架构。标记L-HBsAg区域中包含的氨基酸数量,S-HBsAg的跨膜片段用罗马数字标记。b评价L-HBs+ addavax诱导的HBV/NL抗体与GTB的preS1和preS2的中和活性。将含有GTB preS1(紫色)或preS2(绿色)区域的HBV/NLs与连续稀释的恒河猴抗体混合,在37℃下接种L-HBs+Addavax 1小时,用于感染G2/NT18-C细胞。感染后7天,在5孔中检测感染细胞的NL活性,以评估感染效率。c评价含GTB受体结合域(RBD)和不含GTB受体结合域(exRBD)的区域对HBV/NL的中和活性。携带GTB RBD(栗色)或exRBD(橙色)的HBV/NLs与连续稀释的抗体在37℃混合1小时,用于感染G2/NT18-C细胞。感染后7天,通过检测感染细胞的NL活性来评估感染效率。d的集成电路50通过对数(抑制剂)与归一化反应模型绘制剂量-反应曲线计算值,并指示与HBV/NL-WT (GTC)的折叠程度。表示3只动物的平均值±SD。源数据作为源数据文件。
讨论
在这项研究中,我们建立了一种HB疫苗,克服了目前HB疫苗的缺点。该疫苗在非人灵长类动物模型中诱导了主要针对preS1区域的抗体,这不是S-HBs疫苗所针对的。利用HBVcc和HBV报告病毒的感染系统,我们证明了含有VEMs的HBV可以逃脱S-HBs疫苗诱导的抗体的中和,并证明含有L-HBsAg的HB疫苗可以中和含有VEMs的HBV感染,其效果与野生型HBV相似。此外,每种疫苗都可以弥补其他疫苗在特定HBV基因型的弱毒中和方面的弱点。据我们所知,这是第一份用定量数据表明vem疫苗逃逸能力的报告。
用L-HBsAg+Addavax组成的HB疫苗免疫恒河猴,能诱导出抗hbs抗体,且无肝毒性,且诱导抗体的抗原区与S-HBs疫苗不同。L-HBsAg+Addavax免疫主要诱导preS1区抗体,而S-HBs疫苗免疫主要诱导S-HBs抗体。这些数据表明,当L-HBsAg被用作疫苗时,preS1区域比S-HBs表现出更强的抗原性。L-HBsAg+K3-SPG免疫也能诱导preS1区抗体,但该疫苗未达到L-HBsAg+Addavax免疫的诱导水平。L-HBsAg+Addavax-和L-HBsAg+ k3 - spg -免疫的猕猴血清样品对HBVcc的中和作用分别高于S-HBs疫苗免疫的猕猴血清样品,反映了抗体诱导水平。K3-SPG是一种包被裂叶菌素的k型CpG寡脱氧核苷酸佐剂。已知它是诱导体液和细胞免疫反应的有效佐剂,特别是诱导细胞毒性T淋巴细胞26,27.Addavax,类似于MF59的配方,是一种水包油乳液佐剂28.它被用于季节性流感疫苗,据报道,即使在对疫苗反应较低的人群中,如老年人,它也能增强免疫反应29.这些佐剂的特性可能与抗体诱导效率的差异有关。
为了定量评估中和活性,我们使用HBV报告病毒感染系统。感染效率数据生成的剂量-反应曲线表明,L-HBsAg+ addavax免疫的猕猴血清样本具有强大的中和活性。计算IC50L-HBs+Addavax免疫组价值最低,其次为S-HBs疫苗免疫组。相似的剂量-反应曲线和IC50用从L-HBs+Addavax-和S-HBs疫苗免疫的猕猴血清样本中纯化的抗体处理也得到了这些值,这表明由这些HB疫苗诱导的抗体是观察到的中和作用的原因。抗体吸附实验证实了纯化抗体的中和作用的特异性。S-HBs疫苗诱导抗体对HBV感染的中和作用被S-HBsAg吸附而失效,而L-HBs+ addavax诱导抗体的中和作用不受影响。相反,S-HBs疫苗和L-HBs+ addavax诱导抗体的中和作用被L-HBsAg吸附而失效,因为该抗原包括从preS1到S-HBs区域。综上所述,这些数据表明,L-HBs+ addavax诱导的抗体可以识别除S-HBsAg以外的区域,并且与S-HBs疫苗诱导的抗体类似,对HBV感染具有强大的中和活性。
氨基酸在特定位置上的多态性一个已知S-HBs区域的-决定因子可以改变识别该区域并中和HBV感染的抗体的结合亲和力。这些多态性被称为vem,与免疫逃逸相关的最常见的多态性是G145R,在注射HB疫苗和免疫球蛋白后的急性HB患者中检测到9.从那时起,有许多其他的vem候选人被报道出来13,14,15.为了评估VEMs对中和活性的影响,我们使用了含有VEMs的HBV/NL系统。在HBV/NL系统中,可以在不改变HB聚合酶蛋白氨基酸的情况下引入HBsAg中的氨基酸替换,因为这些蛋白是由不同的质粒独立提供的。我们评估了具有代表性的VEMs I126S、G145R和G145A对HB疫苗诱导抗体中和的影响。将G145R引入HBV后,S-HBs疫苗诱导抗体的中和活性显著降低;的集成电路50值增加到HBV/NL-WT的约8.5倍。同样,G145A也增加了IC50值,尽管在本试验中I126S对HBV中和活性的衰减是最小的。这些数据表明,S-HBs疫苗诱导抗体在抗体滴度足够高时可以用G145R或G145A中和HBV,而在抗体滴度较低时则不能中和HBV。相反,在L-HBs+ addavax诱导抗体的情况下,IC50这些vem的HBV/NL值不受影响。这些数据表明,L-HBs+Addavax诱导的中和抗体可以预防VEMs的HBV感染,这些VEMs不能被目前可用的S-HBs疫苗诱导的抗体充分中和。S-HBs疫苗诱导的抗HBV G145R抗体的中和活性在接种S-HBs疫苗的人类个体中也得到证实。因此,由L-HBsAg+Addavax组成的HB疫苗被证明可以弥补目前可用的HB疫苗的缺点。
根据其遗传多样性,HBV被分为至少8种基因型,GTA到GTH,这些基因型之间的临床特征和结局存在差异30.,31.其中以GTA、GTB、GTC、GTD等HBV株为主。关于S-HBs疫苗诱导的抗体,已经报道了依赖基因型的中和活性衰减32.中和不同基因型乙肝病毒的乙肝疫苗诱导抗体所需效价高于中和相同基因型乙肝病毒的乙肝疫苗诱导抗体所需效价。在本研究中,为了量化中和活性的基因型依赖性,我们使用了一种嵌合报告病毒,其包膜蛋白被GTA、GTB或GTD毒株的包膜蛋白取代。关于S-HBs疫苗诱导抗体的中和作用,IC50GTA和GTB的值与GTC(疫苗中使用的基因型)的值相当。的集成电路50GTD的价值是GTC的2倍多。在L-HBs+ addavax诱导的抗体的情况下,观察到GTB和IC的弱毒中和50价值增加到GTC的大约7倍。这些数据表明,单一乙肝疫苗诱导的抗体并不能在同一水平上中和所有基因型的HBV感染,中和活性弱的基因型之间存在差异。如果抗体诱导水平不高,或者诱导抗体的效价随着时间的推移而降低,那么除疫苗接种中使用的基因型外,中和HBV基因型可能是不可行的。GTB和GTC之间的各种嵌合HBV报告病毒显示,preS1区域RBD的氨基酸多态性是导致L-HBs+ addavax诱导抗体中和活性减弱的原因,尽管我们不能确定该区域的负责氨基酸。这些数据还表明,该区域包含由L-HBs+Addavax诱导的抗体的主要抗原区,并且与S-HBs疫苗的抗原区不同一个-行列式在S-HBs区域。因此,同时或顺序免疫这些乙肝疫苗可能有助于诱导抗体,可以中和HBV的多种基因型。
总之,使用L-HBsAg,我们建立了一种HB疫苗,该疫苗诱导能够用VEMs中和HBV的抗体,而VEMs不能预防目前可用的S-HBs疫苗诱导的抗体感染。此外,HBV基因型表现出减弱的中和诱导抗体在这些疫苗之间有所不同。因此,联合使用这些乙肝疫苗可能能够诱导抗体来中和HBV变异,包括具有VEMs的菌株或多种HBV基因型的菌株。其他基因型或未来出现VEMs的HBV毒株将被这两种疫苗诱导的抗体中和。包括不同佐剂的这些疫苗组合,即使在对S-HBs疫苗有低或无体液反应的人群中,也可能有效诱导抗体的产生,在大约10%的接种疫苗的成年人中观察到。需要进一步的研究来建立这些疫苗联合使用的方案,以诱导有效产生中和抗体。此外,本研究中使用的HBV报告病毒感染系统有助于准确定量地评估HB疫苗诱导抗体的中和活性,这一评估将需要讨论HB疫苗的效力和特征以及诱导抗体的中和活性的VEM或基因型依赖的衰减。
方法
乙肝疫苗和佐剂
市售S-HBs疫苗Bimmugen购自KM生物制剂公司(日本熊本)。该疫苗使用HBV GTC菌株的酵母衍生的S-HBsAg,并含有氢氧化铝作为佐剂。酵母来源的L-HBsAg (BCL-AG-001)来自Beacle, Inc.(京都,日本)16,18.k型CpG寡脱氧核苷酸佐剂由裂褶菌兰包裹(K3-SPG)制备如前所述26,27.一种角鲨烯基水包油纳米乳佐剂(Addavax)购自Invivogen公司(San Diego, CA)。已知这种佐剂的配方与MF59类似。
猴子实验
在这项研究中,9只恒河猴(3-5岁,雌雄,体重约5公斤)被用作非人灵长类动物模型,用于HB疫苗免疫。所有的猴子都来自京都大学人类行为进化起源中心。这些猴子被养在户外的群体笼子里,并提供木制玩具作为环境丰富。它们被喂食苹果、土豆和商业猴子饲料。他们可以随意取水。他们从出生起就有健康记录,每年进行一次健康检查。我们证实它们不含B病毒、猴免疫缺陷病毒、猴t细胞白血病病毒和猴逆转录病毒。动物实验采用京都大学动物福利和动物保护委员会(批准号:2017-158、2018-122、2019-144、2020-105、2021-159)批准的方案和实验程序进行,并按照京都大学动物福利和动物保护委员会的《非人类灵长类动物护理和使用指南(第三版)》进行。本指南是根据2006年6月1日颁布的《动物实验规范》的规定制定的;根据Weatherall报告的建议:在研究中使用非人类灵长类动物(2006年6月1日,日本文部科学省第71号通知)以及学术研究机构中正确进行动物实验和相关活动的基本准则(http://www.acmedsci.ac.uk/more/news/the-use-of-nonhuman-primates-in-research/).
在氯胺酮麻醉下,用美托咪定皮下注射HB疫苗免疫恒河猴,然后在手术结束时给予其拮抗剂阿替帕唑。在麻醉下采集血液样本,如上所述。为了评估疫苗引起的潜在即时副作用,仔细进行了兽医观察,包括任何临床和血液学异常以及皮肤异常(如耀斑、皮疹或水肿)的存在。
细胞培养
HepG2细胞来自欧洲认证细胞培养收藏(目录号;EC85011430, ECACC,索尔兹伯里,英国),并在添加10%胎牛血清的MEM中培养22.牛磺胆酸钠共转运多肽(NTCP)转导HepG2细胞;如前所述,使用G2/NT18-C和HepG2-NTCPsec+24,25.
酶联免疫吸附试验
使用enzymatic gnost Anti-HBs II (Siemens Healthcare Diagnostics, Tokyo, Japan)测量抗s - hbs抗体滴度。为了测定抗pres1和抗l - hbsag的滴度,使用了实验室自制的酶联免疫吸附测定法33.简单地说,1 μg/mL的preS1-peptide (n - end 12-119 aa of preS1 region, BCL-AGS1-02, Beacle)或1 μg/mL的L-HBsAg (Beacle)在含0.02% NaN的磷酸盐缓冲盐水(PBS)中3.(PBSN)被吸附到MaxiSorp 96孔板(Nunc Immunoplate F96 Cert MaxiSorp, Thermo Fisher Scientific, Nunc A/S, Roskilde, Denmark)上,在4°C孵育过夜。用洗涤缓冲液(含0.05% Tween 20的PBS)冲洗孔三次,用0.2% bsa补充的PBSN堵塞,并孵育24小时以上。盘子在使用前洗了三次。血清用含0.02% NaN的0.2% bsa - PBST稀释3.(PBSTN)加入每孔,4℃孵育过夜。然后丢弃上清液,每孔清洗三次。加入酶标的抗人IgG (P0214, Dako Cytomation, Glostrup, Denmark),浓度为0.2µg/mL,在37°C下孵育2 h,然后加入底物(TMB substrate Kit, Thermo Scientific, IL)。30分钟后,加入2n H后,显色停止2所以4100 μ L/孔,然后在微孔板阅读器(SUNRISE, Tecan, Grödig, Austria)中测量450 nm的光密度。
细胞培养产生的HBV的产生和感染
HBVcc质粒由HBV GTC株(登录号:AB246345)生成22.该质粒编码具有1.38倍基因组长度的复制能力的HBV分子克隆(补充图)。2).使用Lipofectamine 3000试剂(Thermo Fisher Scientific, Waltham, MA)将HBV克隆转染到HepG2细胞中,转染1周后收获培养基。收集的培养基通过0.45 μm过滤器去除细胞碎片,用碘伏醇密度梯度净化。用梯度中传染性的峰值分数作为接种物。用DNase (RQ1 RNase-Free DNase, Promega, Madison, WI)处理后,通过实时PCR检测接种物的HBs区域的HBV DNA滴度。
将制备好的病毒与恒河猴血清混合,37℃孵育1 h,在4% PEG8000和2%二甲基亚砜存在下接种hepg2 - ntp -sec+细胞16 h。感染后12天,用兔多克隆抗hbc IgG片段(目录号;HBP-023-9, Austral Biologicals, San Ramon, CA),浓度为1.0µg/mL,然后用Alexa Fluor 555共轭抗兔IgG(目录号;A32732,赛默飞世尔科学公司)的浓度为1.0µg/mL后固定和渗透。核也用4 ',6-二氨基-2-苯基吲哚染色。用BZ-X710荧光显微镜(Keyence,大阪,日本)观察和捕获感染细胞。为了估计感染效率,用内置软件BZ-3HA ver定量染色面积大小。1.3.0.3(日本基恩士)。
重组HBV报告病毒系统
在重组HBV报告病毒(HBV/NL)感染系统中,制备了编码1.2倍HBV基因组的HBV-NL质粒替换HBe/HBc区,制备了编码1.2倍HBV基因组的HBV- dedels质粒,并制备了所有HBsAg种的无包封信号和ORF的起始密码子。2 b)22,34.我们使用了GTC克隆(登录号:AB246345)来产生这些质粒。将这些质粒转染HepG2细胞一周后,收集培养液中的HBV/NL。收集的培养基通过0.45 μm过滤器去除细胞碎片,用碘伏醇密度梯度净化。用梯度中传染性的峰值分数作为接种量,并使用相同的接种量来评估所有疫苗诱导的血清或纯化抗体的中和作用。用DNase (RQ1 RNase-Free DNase)处理NL区后,采用实时荧光定量PCR检测病毒滴度。HBV/NL感染G2/NT18-C细胞一周后,在用被动裂解缓冲液(Promega)裂解细胞后,使用Nano-Glo荧光素酶测定系统(Promega)测定感染细胞中的荧光素酶活性,以估计感染效率。
HBV/NL菌株也产生VEMs。在该系统中,所有HBsAg物种都来自HBV-NL质粒。因此,通过位点定向PCR将氨基酸突变I126S、G145R和G145A引入HBV-NL质粒,用限制性内切酶BstEII和BstBI消化交换片段(补充图)。2 b).通过将GTA的L-HBs区域替换为GTA的L-HBs区域,生成编码GTA、GTB和GTD的L-HBs区域的嵌合HBV-NL质粒(登录号:LC488828)、GTB(登入编号:AB246341)和GTD菌株经限制性内切酶BstEII和BstBI酶切(补充图;2 b).GTD株的L-HBs区序列与来源于HepG2.2.15细胞的HBV序列一致35.通过位点定向PCR和片段交换获得HBV- nl嵌合质粒HBV/NL-pS1-GTB、-pS2-GTB、-RBD-GTB和-exRBD-GTB。采用位点定向PCR法获得HBV/NL-RBD-GTB含gtc型氨基酸的质粒。补充图中提供了L-HBs区域氨基酸序列的排列。5.
抗体纯化及抗体吸附试验
恒河猴血清样本中的诱导抗体由Protein G HP SpinTrap (Cytiva, Tokyo, Japan)按照制造商的说明进行纯化。为了估计纯化抗体的数量,纯化抗体的蛋白质浓度由Pierce BCA蛋白测定试剂盒(赛默飞世尔科学公司)定量。抗体吸附试验使用S-HBsAg(在CHO细胞中产生的重组HBsAg adr, ProSpec, Rehovot, Israel)和L-HBsAg (Beacle)。
人血清样本
血清样本来自3名在日本Bimmugen市接种了市售S-HBs疫苗的人(37-42岁,1男2女),经书面知情同意无补偿获得。从血清样本中纯化疫苗诱导的抗体,并评估其对HBV报告病毒的中和作用。该实验得到了研究所伦理委员会的批准(国家传染病研究所批准号为780)。
统计分析
采用比例配对进行统计分析t-使用GraphPad PRISM 8软件(GraphPad software, La Jolla, CA)进行测试。的集成电路50通过使用log(抑制剂)和标准化反应模型生成剂量-反应曲线来计算值。结果与P<0.05为有统计学意义。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
数据可用性
源数据提供了这篇论文。
参考文献
慢性乙型肝炎病毒感染的自然史。肝脏病学49, s45-s55(2009)。
梁,t.j.等。乙型肝炎的目前和未来疗法:从发现到治愈。肝脏病学62, 1893-1908(2015)。
世界卫生组织。全球肝炎报告, 2017 (who, 2017)。
Indolfi, G.等人。儿童和青少年乙型肝炎病毒感染。柳叶刀杂志。乙醇。4, 466-476(2019)。
刘建峰,陈天勇,赵永荣。乙型肝炎病毒垂直传播的研究现状及未来发展方向。下巴。医学博士(英国)134, 2825-2831(2021)。
Nassal, M. HBV cccDNA:病毒持久性库和治愈慢性乙型肝炎的关键障碍。肠道64, 1972-1984(2015)。
西格尔,C.和梅森,W. S.乙型肝炎病毒生物学。微生物摩尔。牧师。64, 51-68(2000)。
Averhoff, F.等人。乙型肝炎疫苗的免疫原性。对有乙型肝炎病毒感染职业风险的人的影响。点。j .上一页。地中海。15, 1-8(1998)。
卡门,W. F.等。疫苗诱导的乙型肝炎病毒逃逸突变体。《柳叶刀》336, 325-329(1990)。
哈里森,T. J.,霍普,E. A.,欧恩,C. J.,萨内蒂,A. R. &朱克曼,A. J.疫苗诱导的乙型肝炎病毒逃逸突变体的独立出现。j .乙醇。13, s105-s107(1991)。
沃特斯,J. A.等。由疫苗诱导的逃逸突变体导致常见的乙型肝炎表面抗原决定因素“A”的丢失。j .中国。投资。90, 2543-2547(1992)。
Lai, M. W.等。在完全接种疫苗后,大于18岁的个体中,带有s基因突变的HBV DNA血清流行率增加。胃肠病学143, 400-407(2012)。
卞,T.等。中国实施全民疫苗接种计划13年后乙肝病毒大表面抗原变异流行率的变化j .性研究。87, 12196-12206(2013)。
Tosti, m.e.等。意大利实施普遍疫苗接种后的急性乙型肝炎:来自22年监测(1993-2014)的结果中国。感染。说。62, 1412-1418(2016)。
Inoue, T. & Tanaka, Y.不同基因型乙型肝炎疫苗接种的交叉保护。疫苗(巴塞尔)8, 456年。https://doi.org/10.3390/vaccines8030456(2020)。
Kuroda, S., Otaka, S., Miyazaki, T., Nakao, M. & Fujisawa, Y.乙型肝炎病毒包膜L蛋白颗粒。合成和组装酿酒酵母纯化和表征。生物。化学。267, 1953-1961(1992)。
山田,T.等。用于向人类肝细胞输送基因和药物的纳米颗粒。生物科技Nat。》。21, 885-890(2003)。
荣格等人。高效和快速纯化药物和基因携带生物纳米胶囊,乙型肝炎病毒表面抗原L颗粒,从酿酒酵母.蛋白质Expr。Purif。78, 149-155(2011)。
纽瑞特,a . R.,肯特,S. B.,斯特里克,N. &帕克,K.乙型肝炎病毒宿主细胞受体结合位点的鉴定和化学合成。细胞46, 429-436(1986)。
Blanchet, M. & Sureau, C.乙型肝炎病毒前s结构域的感染性决定因素局限于n端75个氨基酸残基。j .性研究。81, 5841-5849(2007)。
Nishitsuji, H.等人。新型报告系统监测乙型肝炎病毒生命周期的早期阶段。癌症科学。106, 1616-1624(2015)。
村山,A.等。n端PreS1序列调控细胞培养产生的乙型肝炎病毒的高效感染肝脏病学73, 520-532(2021)。
本田,T.等。乙型肝炎病毒氨基酸多态性与功能性治愈相关。细胞Mol,肠胃醇。乙醇。12, 1583-1598(2021)。
科尼格,A.等人。缓慢增殖的HepG2-NTCP细胞感染后乙肝病毒分离株的有效长期扩增j .乙醇。71, 289-300(2019)。
Otoguro, T.等。建立可感染乙型和丙型肝炎病毒的细胞培养模型。乙醇。Commun。5, 634-649(2021)。
Kobiyama, K.等。非激动性Dectin-1配体将CpG转化为多任务纳米TLR9激动剂。国家科学院学报美国111, 3086-3091(2014)。
Yokokawa, H.等。丙型肝炎颗粒疫苗免疫在非人灵长类动物模型中诱导体液和细胞免疫肠道67, 372-379(2018)。
Podda, A. & Del Giudice, G. mf59佐剂疫苗:免疫原性增加,安全性最佳。专家版本疫苗2, 197-203(2003)。
Gasparini, R.等人。与传统亚单位疫苗相比,mf59佐剂流感疫苗在老年受试者中的免疫原性增强。欧元。j .论文。17, 135-140(2001)。
乙型肝炎病毒的基因型和遗传变异。Intervirology57, 141-150(2014)。
Araujo, N. M., Teles, S. A. & Spitz, N.与基因型、亚基因型和地理区域相关的临床显著乙型肝炎病毒突变的综合分析。前面Microbiol11, 616023(2020)。
加藤,等人。疫苗获得性多克隆抗- hbs抗体在预防非疫苗基因型HBV感染中的作用j .杂志。52, 1051-1063(2017)。
Yato, K.等。乙型肝炎病毒preS1受体结合域两个关键中和表位的鉴定。j .性研究。95, e01680-01620(2020)。
Nishitsuji, H.等人。利用工程报告型乙型肝炎病毒研究乙型肝炎病毒生命周期。癌症科学。109, 241-249(2018)。
李志刚,李志刚,李志刚,李志刚。乙型肝炎病毒在HepG2细胞中的增殖中间体的研究。j .性研究。62, 2836-2844(1988)。
确认
这项工作得到了肝炎研究计划(JP19fk0310120 [T。加藤浩,李志强,李志强,李志强],JP21fk0310103 [j]。加藤],JP22fk0310503 [T。加藤,HA],和JP22fk0310517 [T。),由日本医学研究开发机构(AMED)和泰居生命社会福利基金会[T。加藤]。资助者在研究设计、数据收集或解释,或提交论文发表的决定中没有任何作用。作者要感谢Marc Peter Windisch博士(韩国巴斯德研究所,首尔,韩国)提供的HepG2-NTCPsec+细胞株,以及Hitomi Igarashi和Kaoru Tsuji女士的技术援助。
作者信息
作者及隶属关系
贡献
H.A.和T. Kato构想了这项研究。a.w., a.m., m.m., T.清原,k.y., n.y., h.h.a., r.s., h.a.和T. Kato进行了实验。a.w., a.m., h.a.和T. Kato讨论并解释了结果。a.w., a.m., h.a.和T. Kato撰写了手稿。t.t.、k.m.、h.n.、k.s.、y.g.和K.J.I.提供了关键材料和使用说明。h.y.、m.m.、k.i.和Y.T.监督实验和项目。
相应的作者
道德声明
相互竞争的利益
Y.G.是比克尔公司的员工。其他作者宣称没有利益竞争。
同行评审
同行评审信息
自然通讯感谢其他匿名审稿人对本工作的同行评审所作的贡献。可以获得同行评审报告。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
源数据
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Washizaki, A, Murayama, A, Murata, M。et al。大hbs抗原乙型肝炎疫苗免疫逃逸突变中和乙型肝炎病毒Nat Commun13, 5207(2022)。https://doi.org/10.1038/s41467-022-32910-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467-022-32910-z