摘要gydF4y2Ba
大肠杆菌gydF4y2Ba噬菌体SU10属于噬菌体属gydF4y2BaKuravirusgydF4y2Ba从课堂上gydF4y2BaCaudoviricetesgydF4y2Ba具有短而不收缩的尾巴的噬菌体。与其他短尾噬菌体不同,库拉病毒的尾巴在细胞附着时拉长。在这里,我们发现SU10病毒粒子有一个长形头部,包含基因组蛋白和喷射蛋白;尾巴,由门蛋白、接头蛋白、喷嘴蛋白和尾针蛋白组成,并装饰有长短纤维。长尾纤维与细菌外膜受体的结合诱导了喷嘴蛋白的拉直和短尾纤维的旋转。重新排列后,喷嘴蛋白质和短尾纤维交替形成一个喷嘴,将尾部延长28纳米。随后,尾针与喷嘴蛋白分离,并从SU10头部释放出五种喷射蛋白。该喷嘴具有由喷射蛋白形成的假定延伸,能够将SU10基因组递送到细菌细胞质中。很可能所有库拉病毒都采用这种涉及尾部喷嘴形成的基因组传递机制。gydF4y2Ba
介绍gydF4y2Ba
噬菌体属gydF4y2BaKuravirusgydF4y2Ba属于这个阶层gydF4y2BaCaudoviricetesgydF4y2Ba具有短而不收缩的尾巴的噬菌体gydF4y2Ba1gydF4y2Ba.库拉病毒,包括gydF4y2Ba大肠杆菌gydF4y2BaSU10噬菌体是短尾噬菌体中的一种,具有75-80,000个碱基对,编码50多种蛋白质gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.库拉病毒具有溶解性,其中一些具有较短的复制周期并产生大量的后代,这使它们成为噬菌体治疗中针对致病性菌株的候选gydF4y2Ba大肠杆菌gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.含有噬菌体ES17的鸡尾酒噬菌体,来自噬菌体属gydF4y2BaKuravirusgydF4y2Ba,在一个案例研究中用于治疗gydF4y2Ba大肠杆菌gydF4y2Ba前列腺和泌尿道的感染gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
库拉病毒的基因组被安置在长头中,其特征是五倍对称和尾轴方向的延伸gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.尾状噬菌体的基因组被分子马达包装成预先形成的前头,通过一个由门蛋白十二聚体形成的通道,取代衣壳蛋白的五聚体在衣壳的五倍顶点之一。噬菌体尾部附着在入口复合物上gydF4y2Ba9gydF4y2Ba.感染革兰氏阴性菌的短尾噬菌体的常见尾部成分有适配蛋白、主要尾部蛋白、尾针蛋白和尾部纤维gydF4y2Ba10gydF4y2Ba.尾部的纤维使噬菌体能够与细菌初始结合gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba而尾针则负责穿透宿主细胞的外膜gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.大多数短尾噬菌体的头部含有喷射蛋白,可以将噬菌体基因组传递到宿主细胞中。喷射蛋白形成一个易位复合体,将尾部拉长以跨越细菌细胞壁gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.噬菌体头部内部的压力使30-50%的基因组能够喷射到细菌细胞中gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.然而,在噬菌体头和细菌细胞质内的压力平衡后,剩余的DNA必须通过另一种机制被输送到细菌中gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.使用负染色电子显微镜显示,噬菌体SU10比以前属于该家族的大多数噬菌体具有更长的尾巴gydF4y2BaPodoviridaegydF4y2Ba尾巴在与细菌结合时发生了构象变化gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
在这里,我们展示了病毒粒子和噬菌体SU10基因组释放中间体的冷冻电子显微镜(cryo-EM)结构,以及其附着的冷冻电子断层扫描(cryo-ET)表征gydF4y2Ba大肠杆菌gydF4y2Ba细胞。与宿主结合后,SU10尾部、喷嘴蛋白和短纤维重新排列,形成延伸尾部的喷嘴。库拉病毒的尾部蛋白序列相似性超过70%。因此,这种涉及尾部喷嘴形成的基因组传递机制很可能被大多数(如果不是全部)库拉病毒所采用。gydF4y2Ba
结果与讨论gydF4y2Ba
SU10病毒粒子的结构gydF4y2Ba
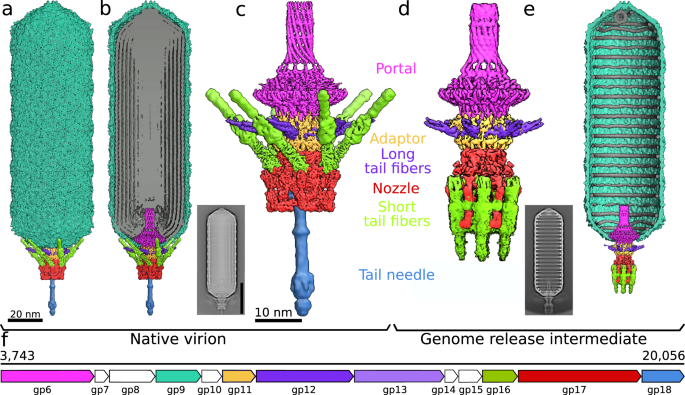
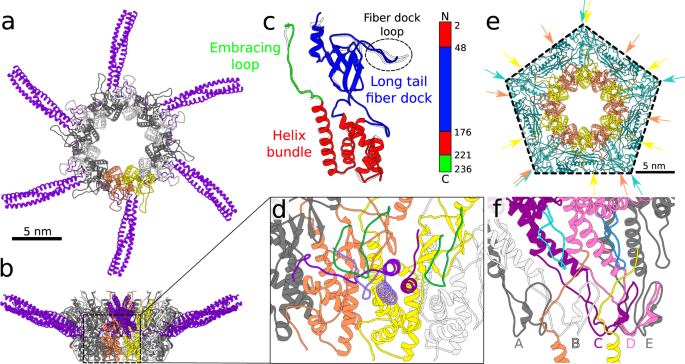
噬菌体SU10的病毒粒子头部呈长条状,长度为1430 Å,直径为460 Å,由主要衣壳蛋白(gp9)形成(图9)。gydF4y2Ba1gydF4y2Ba、补充表gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba)gydF4y2Ba2gydF4y2Ba.尾巴长220 Å,由6根长尾纤维和6根短尾纤维装饰(图2)。gydF4y2Ba1gydF4y2Ba得了,gydF4y2Ba2, cgydF4y2Ba、补充表gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba).尾巴附着在长链衣壳的一个顶点上,在那里门脉蛋白的十二聚体(gp6)取代了衣壳蛋白的五聚体(图2)。gydF4y2Ba1得了gydF4y2Ba).从衣壳突出的门脉复合体的一部分使接合蛋白十二聚体(gp11)的结合成为可能。接头复合体为长尾纤维提供了6个附着位点,每个附着位点都是由长尾纤维近端蛋白(gp12)和长尾纤维远端蛋白(gp13)三聚体组成的。gydF4y2Ba1gydF4y2Bac,gydF4y2Ba2, cgydF4y2Ba).喷嘴蛋白的六聚体(gp17)附着在接头复合体上,并使六个短尾纤维结合,短尾纤维蛋白的三聚体(gp16)(图16)。gydF4y2Ba2, cgydF4y2Ba).尾针由三条多肽链(gp18)组成,从喷嘴蛋白形成的中央通道中突出(图2)。gydF4y2Ba1gydF4y2Ba得了,gydF4y2Ba2, cgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba噬菌体SU10病毒粒子复合低温电镜图的表面表示(按蛋白类型着色)。主要衣壳蛋白(gp9)为蓝绿色,门脉蛋白(gp6)为洋红色,接头蛋白(gp11)为黄色,长尾纤维(gp12)为紫色,喷嘴蛋白(gp17)为红色,短尾纤维(gp16)为绿色,尾针(gp18)为浅蓝色。病毒粒子的长度是1590 Å。有关合成地图构建的详细信息,请参阅材料和方法部分。gydF4y2BabgydF4y2Ba与A相同,但SU10头部合成图的前半部分被删除,以显示灰色的基因组结构。插图显示了SU10病毒粒子的2D类平均值。刻度条表示45nm。gydF4y2BacgydF4y2BaSU10病毒粒子门尾复合体的低温电镜合成图。复合体的长度是540 Å。gydF4y2BaDgydF4y2BaSU10基因组释放中间体门脉和尾复合体的低温电镜重建。gydF4y2BaegydF4y2BaSU10基因组释放中间体的低温电镜合成图谱。头部的前半部分被移除,以显示留在衣壳中的基因组结构。插图显示了SU10基因组释放中间体的2D类平均值。gydF4y2BafgydF4y2BaSU10基因组编码结构蛋白片段的示意图,颜色编码与面板中的蛋白质相同gydF4y2Ba一个gydF4y2Ba来gydF4y2BaegydF4y2Ba.白色显示的蛋白质要么是非结构性的,要么在重建中没有被识别出来。gydF4y2Ba
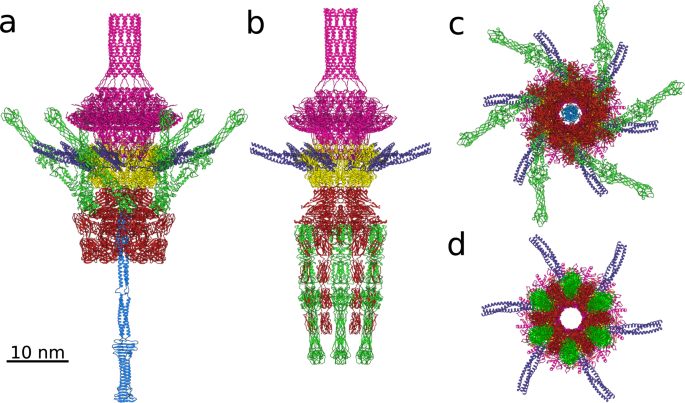
形成SU10病毒粒子尾部的蛋白质的卡通表示gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba基因组释放中间体gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba.门脉蛋白(gp6)为洋红色,接头蛋白(gp11)为黄色,长尾纤维蛋白(gp12)为紫色,喷嘴蛋白(gp17)为红色,短尾纤维蛋白(gp16)为绿色,尾针蛋白(gp18)为浅蓝色。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba视图垂直于尾轴和gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba沿尾轴朝向噬菌体头的视图。在SU10病毒粒子中,短尾纤维向衣壳倾斜,尾针从尾复合体中突出。SU10的基因组释放中间体gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba没有尾针,含有由短尾纤维和喷嘴蛋白质组成的277 Å-long喷嘴。利用AlphaFold2 multitimer对短尾纤维的尾针和中央及受体结合域进行建模,并拟合到低温电镜图谱中。其余结构进行低温电镜重建。有关结构预测和建造的详细信息,请参阅材料和方法部分。gydF4y2Ba
SU10衣壳及其主要衣壳蛋白的结构gydF4y2Ba
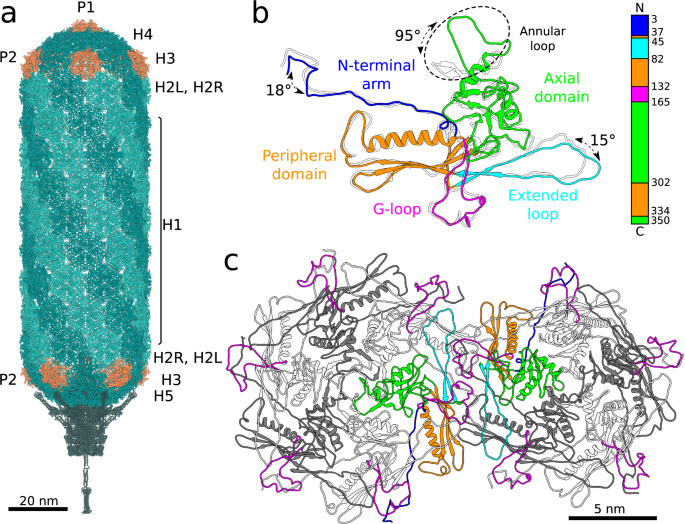
SU10的长链衣壳具有五重对称结构,由715个主要衣壳蛋白拷贝组成,其结构参数为三角形参数TgydF4y2Ba结束gydF4y2Ba= 4, tgydF4y2Ba中期gydF4y2Ba= 20(图。gydF4y2Ba3gydF4y2Ba,补充图gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba).主要的衣壳蛋白形成两种类型的衣壳体:五聚体和六聚体。衣壳的中心管状部分由90个六聚体组成,它们排列在10个入口的螺旋结构的9层中。gydF4y2Ba3gydF4y2Ba).衣壳两端封闭,主要衣壳蛋白以局部T = 4准二十面体对称组织形成帽状结构。瓶盖的闭合是由五聚体实现的,与平坦的六聚体相比,五聚体是弯曲的(图1)。gydF4y2Ba3gydF4y2Ba,补充图gydF4y2Ba1gydF4y2Ba).然而,长SU10头的形成也需要六聚体的形状和它们相互作用的角度的变化。帽状六聚体弯曲度更高(H4, H5;149-150°),而形成衣壳管状部分的那些相对平坦(H1, H2L, H2R, H3;154-164°)。gydF4y2Ba2gydF4y2Ba).帽体中所有六聚体-六聚体和六聚体-五聚体界面呈145°拱形。gydF4y2Ba2gydF4y2Ba),然而,形成衣壳管状部分的六聚体由两种类型的界面连接,拱形(145°)和更平面(160°)(补充图2)。gydF4y2Ba2gydF4y2Ba).拱形界面能够形成六聚体环,而更平面的界面则介导环之间的相互作用(补充图1)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba形成噬菌体SU10病毒粒子的蛋白质的卡通表示。长链衣壳具有五重对称性,衣壳蛋白以T形参数组织gydF4y2Ba结束gydF4y2Ba= 4, tgydF4y2Ba中期gydF4y2Ba= 20。衣壳蛋白的五聚体显示为橙色,六聚体显示为深蓝或浅海绿色。根据它们在衣壳中的位置,五聚体有两种类型。P1五聚体位于颗粒的五重轴上,而剩余的P2五聚体位于衣壳管状部分和帽状部分之间的边界上的准五重轴上。六聚体有六种变体:H1构成长头的中心部分;H2L和H2R位于衣壳中部,但与端帽相互作用;H3在P2五聚体之间;H4位于P1和P2五聚体之间;和H5位于P2五聚体和门脉复合体之间。gydF4y2BabgydF4y2Ba形成H1六聚体(根据结构域的颜色)和P1五聚体(白色)的主要衣壳蛋白的结构比较。SU10的主要衣壳蛋白为HK97倍gydF4y2Ba25gydF4y2Ba,gydF4y2Ba66gydF4y2Ba.P1和H1亚基结构的主要区别在于n端臂、延伸环和环状环。主要衣壳蛋白的结构域组织如图1D图所示。gydF4y2BacgydF4y2Ba形成P2五聚体和H2R六聚体的主要衣壳蛋白的卡通表示。两种主要的衣壳蛋白介导了五聚体和六聚体之间的大部分接触,其结构域以颜色突出显示。其余的亚单位以白色和深灰色交替显示。所有亚基的g环都用洋红色突出显示。gydF4y2Ba
SU10的主要衣壳蛋白具有HK97折叠,这在尾状噬菌体和疱疹病毒中很常见(图2)。gydF4y2Ba3 bgydF4y2Ba)gydF4y2Ba25gydF4y2Ba.按照惯例,衣壳蛋白可分为n端臂、外周结构域、延伸环、轴向结构域和富含甘氨酸的环(图2)。gydF4y2Ba3 bgydF4y2Ba).形成六聚体和五聚体的衣壳蛋白之间的主要区别在于位于轴向结构域尖端的环状环的结构(图2)。gydF4y2Ba3 bgydF4y2Ba).在六聚体中,环形环路突出远离轴向域(图1)。gydF4y2Ba3 b, cgydF4y2Ba).形成一个六聚体的亚基的六个环形环围绕其准六重轴形成一个环(图1)。gydF4y2Ba3 cgydF4y2Ba).相反,在形成五聚体的亚基中,环形环向衣壳中心弯曲90°。gydF4y2Ba3 cgydF4y2Ba).来自五聚体的主要衣壳蛋白环的β链形成一个β桶,其中心孔直径为8 Å,穿透衣壳。(无花果。gydF4y2Ba3 cgydF4y2Ba,补充图gydF4y2Ba3 ggydF4y2Ba).在基因组包装和喷射过程中,孔可用于离子和水分子进出衣壳。gydF4y2Ba
SU10的基因组编码一种蛋白(gp10),其预测的免疫球蛋白样折叠与噬菌体Epsilon15的小衣壳蛋白和噬菌体φ29的头纤维蛋白的n端结构域相似gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.然而,SU10头部的冷冻电镜重建不包含与次要衣壳蛋白相对应的密度。SU10的gp10可能具有不同的功能或以低亲和力与衣壳结合,并在噬菌体纯化过程中丢失(补充图2)。gydF4y2Ba4摄氏度gydF4y2Ba).gydF4y2Ba
SU10病毒粒子包装的基因组结构gydF4y2Ba
SU10病毒粒子基因组的低温电镜(cryo-EM)密度在其头部的五倍对称和不对称重建中得到解决(图2)。gydF4y2Ba1 bgydF4y2Ba,补充图gydF4y2Ba3.gydF4y2Ba).尽管在重建过程中施加的对称性有所不同,但基因组密度的排列是相似的(补充图2)。gydF4y2Ba3模拟gydF4y2Ba).在封头的管状部分内可以区分出9个密度壳,而在衣壳帽下只有4个密度壳(补充图1)。gydF4y2Ba3.gydF4y2Ba).在最外层的三个壳层中,密度分成股,可以解释为双链DNA片段(补充图2)。gydF4y2Ba3模拟,FgydF4y2Ba).在冷冻电镜重建中,基因组的解析结构表明,基因组包装导致大多数SU10病毒粒子的DNA排序相似。然而,SU10头部中心部分的DNA片段之间必须存在连接,因为基因组是由单个77,325 bp长的双链DNA组成的gydF4y2Ba2gydF4y2Ba的问题没有得到解决。在SU10头部的五重对称和非对称重建中,最外层的DNA链都被组织为10个入口的螺旋。gydF4y2Ba3 b、DgydF4y2Ba).来自基因组最外层的DNA链曲线,以避免从衣壳蛋白的五聚体中突出-桶(补充图)。gydF4y2Ba3 ggydF4y2Ba).这一有趣的DNA结构可以作为未来通过计算机模拟研究噬菌体基因组包装过程的附加限制。gydF4y2Ba
蛋白gp20-24存在于SU10病毒粒子中,但不存在于基因组释放中间体中,表明它们是喷射蛋白(补充图2)。gydF4y2Ba4摄氏度gydF4y2Ba、补充表gydF4y2Ba1gydF4y2Ba).然而,SU10病毒粒子的重建不包含可归因于假定的喷射蛋白的分解密度(图2)。gydF4y2Ba1 bgydF4y2Ba),尾巴噬菌体T7、Epsilon15和N4也是如此gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.SU10基因组包装在衣壳中,密度为0.48 Da/ÅgydF4y2Ba3.gydF4y2Ba,与0.49-0.52 Da/Å相当gydF4y2Ba3.gydF4y2Ba先前测定的噬菌体P22, λ, T4, ϕ29和T7gydF4y2Ba29gydF4y2Ba.因此,SU10的衣壳可能同时含有基因组DNA和喷射蛋白。gydF4y2Ba
门户复杂gydF4y2Ba
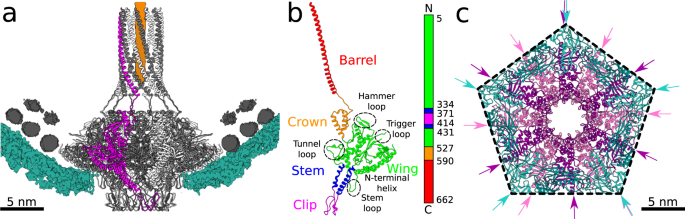
SU10的门脉复合体嵌入衣壳的五重顶点之一,在那里它取代了衣壳蛋白的五聚体(图2)。gydF4y2Ba1gydF4y2Baa、bgydF4y2Ba4gydF4y2Ba).SU10的门脉蛋白可分为翼域、茎域、夹域、冠域和桶域(图2)。gydF4y2Ba4 bgydF4y2Ba)gydF4y2Ba29gydF4y2Ba.机翼结构域是最大的,由8个螺旋和一个含有5个反平行β链和3个反平行β链的两个β片的β-三明治组成。gydF4y2Ba4 bgydF4y2Ba).Lys带正电的侧链gydF4y2Ba3.gydF4y2Ba和赖氨酸gydF4y2Ba5gydF4y2Ba翼结构域与包裹门脉复合体的DNA相互作用(图2)。gydF4y2Ba4gydF4y2Ba).这两种赖氨酸在门脉复合体中重复12次,从而形成一个高亲和力的界面,可能在基因组包装启动后不久就与DNA结合。将DNA末端锚定到入口将影响基因组包装到头部及其最终结构。此外,翼结构域介导门脉复合物与衣壳的相互作用(图2)。gydF4y2Ba4 a, cgydF4y2Ba).由于衣壳的五倍对称性和入口的十二倍对称性不匹配,我们使用SU10病毒粒子颈部区域的不对称重建来表征它们的相互作用,其分辨率达到4.6 Å(补充表)gydF4y2Ba2gydF4y2Ba).机翼结构域的残基8-44形成一个弯曲的α-螺旋,排列在衣壳的内表面(图2)。gydF4y2Ba4 a、bgydF4y2Ba).入口和衣壳之间的其他相互作用是由翼结构域的茎环介导的(图2)。gydF4y2Ba4 a、bgydF4y2Ba).来自翼域的隧道环使SU10的门洞通道变窄至33 Å(图2)。gydF4y2Ba4gydF4y2Ba,补充图gydF4y2Ba5gydF4y2Ba).在噬菌体T7和P23-45中,研究表明隧道环打开门脉通道,从而调节基因组释放gydF4y2Ba15gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.然而,SU10病毒粒子中的隧道环和基因组释放中间体具有相同的结构,因此可能有不同的机制确保SU10的基因组保留(补充图2)。gydF4y2Ba5gydF4y2Ba).茎结构域连接翼和夹结构域,横跨衣壳(图2)。gydF4y2Ba4 bgydF4y2Ba).门脉复合体的剪切结构域从衣壳伸出,使接头蛋白能够附着(图2)。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba传送门复合体嵌入衣壳的卡通表示。其中一个门脉蛋白呈洋红色,其余亚基呈白色和灰色相间。衣壳的低温电镜密度显示为绿松石色,DNA的低温电镜密度显示为灰色。在门脉复合体的桶状结构中,一个假定的dsDNA基因组末端或喷射蛋白的密度用橙色表示。衣壳和DNA的图分别以2σ和4σ表示。gydF4y2BabgydF4y2Ba根据结构域组成,门脉蛋白亚基的卡通表示。门脉蛋白的结构域组织如图所示。gydF4y2BacgydF4y2Ba从粒子外沿尾轴观察门脉复合体与衣壳的相互作用。门脉蛋白呈粉红色和紫色相间,衣壳蛋白呈深绿色和浅绿色。主要衣壳蛋白外周结构域的脊柱螺旋方向和门脉蛋白翅膀结构域的n端螺旋方向用箭头突出,以强调衣壳的五重对称和门脉的十二重对称之间的不匹配。gydF4y2Ba
适配器复杂gydF4y2Ba
SU10接头蛋白的十二聚体在门静脉蛋白的十二聚体和喷嘴蛋白的六聚体之间形成了界面。gydF4y2Ba1gydF4y2Bac,gydF4y2Ba2gydF4y2Ba一个,gydF4y2Ba5gydF4y2Ba).SU10的接头蛋白具有与噬菌体T7和KP32相同的结构域组织:螺旋束结构域、长尾纤维码头结构域和拥抱环(图2)。gydF4y2Ba5度gydF4y2Ba)gydF4y2Ba15gydF4y2Ba.从衣壳外观察门脉复合体时,接合蛋白的拥抱环夹在一对相邻门脉蛋白的剪切结构域之间,并与另外两个顺时针定位的门脉蛋白的茎环结合(图2)。gydF4y2Ba5 fgydF4y2Ba).由于长尾纤维与一根长尾纤维的不同部分相互作用,两个相邻的接头蛋白的停靠域在结构上有所不同。gydF4y2Baa, b, dgydF4y2Ba).SU10长尾纤维码头结构域与噬菌体T7和KP32相似(补充图)。gydF4y2Ba6gydF4y2Ba)gydF4y2Ba15gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,它们有长长的尾纤维gydF4y2Ba13gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.相比之下,没有长尾纤维的噬菌体P22和Sf6的接头蛋白缺乏长尾纤维停靠域(补充图2)。gydF4y2Ba6gydF4y2Ba)gydF4y2Ba12gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba由六条长尾纤维装饰的接头复合体的卡通表示,沿尾轴和垂直于尾轴观察。从十二聚体中选择的两个接头蛋白以橙色和黄色突出显示。其余的亚单位以白色和灰色交替显示。六个长尾纤维中的每一个都是由gp12蛋白的三聚体(紫色)形成的。gydF4y2BacgydF4y2Ba两个相邻接头蛋白结构的叠加,它们的长尾纤维码头环的构象不同。其中一个接头蛋白根据结构域组成被着色。重叠的亚基显示为白色。接头蛋白的结构域组织如图1D图所示。gydF4y2BadgydF4y2Ba接头蛋白与长尾纤维的相互作用。两个相邻的接头蛋白的纤维码头环(绿色)与一个长尾纤维相互作用。形成长尾纤维的三个亚基以紫色的深浅来区分。来自一根长尾纤维的每根长尾纤维蛋白的n端与接头复合体形成独特的相互作用。gydF4y2BaegydF4y2Ba从粒子外沿尾轴观察接头复合物与衣壳的相互作用。接头蛋白以黄色和橙色交替显示,衣壳蛋白以绿松石色表示。主要衣壳蛋白的外周结构域和接头蛋白的纤维码头环的棘螺旋方向用箭头表示,以强调衣壳和接头复合物之间的对称性不匹配。gydF4y2BafgydF4y2Ba门静脉蛋白与衔接蛋白的c端拥抱环之间的界面。拥抱环(橙色)进入门脉亚基A(灰色)和B(白色)的门脉夹域之间,然后穿过门脉亚基C的茎(深品红),到达亚基C的翼环(青色)和亚基D的茎(粉红色)之间。相邻的接头蛋白在其拥抱环的结构上是不同的。具有其他构象的接头蛋白的拥抱环(黄色)在门脉亚基B(白色)和C(深品红)的门脉夹结构域之间通过,然后穿过门脉亚基D(粉红色)的茎,到达亚基D(灰色)的翼环(浅蓝色)和亚基E(粉红色)的茎之间。gydF4y2Ba
长尾纤维gydF4y2Ba
六根长尾纤维连接到适配器复合体的两侧(图2)。gydF4y2Ba1gydF4y2Ba得了,gydF4y2Ba2gydF4y2Ba一个和gydF4y2Ba5 a、bgydF4y2Ba).SU10的长尾纤维是由长尾纤维近端(gp12)和远端(gp13)蛋白的三聚体形成的。长尾纤维从接头复合体的每一个亚基的螺旋束结构域分支出来(图2)。gydF4y2Ba2gydF4y2BaA, c和gydF4y2Ba5 a、bgydF4y2Ba).当从衣壳外观察接头复合体时,来自一根纤维的两个长尾纤维近端蛋白的n端延伸覆盖逆时针位置的相邻接头蛋白的螺旋束结构域的表面(图2)。gydF4y2Ba5 b, dgydF4y2Ba).第三个长尾纤维近端蛋白的n端与纤维分支的接头蛋白的长尾纤维码头结构域结合(图2)。gydF4y2Ba5 dgydF4y2Ba).长尾纤维与从接头蛋白的纤维码头结构域径向突出的纤维码头环形成额外的接触(图2)。gydF4y2Ba5a, c, dgydF4y2Ba).每根长尾纤维的盘绕部分由来自两个相邻接头蛋白的纤维码头环保持(图2)。gydF4y2Ba5 a, dgydF4y2Ba).通过低温电镜(cryo-EM)重建尾巴,从786个残基的长尾纤维近端蛋白的n端构建了90个残基(图2)。gydF4y2Ba2gydF4y2BaA, c和gydF4y2Ba5 a、bgydF4y2Ba).长尾纤维的剩余部分没有解决,可能是因为它的柔韧性。纯化噬菌体的电子显微照片显示,长尾纤维长700 Å,包含一个肘关节,将纤维分为300和400-Å-long段(补充图1)。gydF4y2Ba4 a、bgydF4y2Ba).gydF4y2Ba
SU10喷嘴蛋白的结构gydF4y2Ba
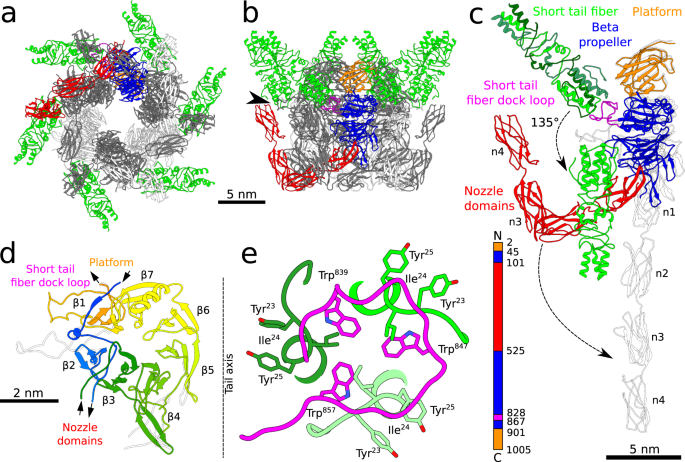
喷嘴蛋白的六聚体连接在接头上,由6根短尾纤维装饰,其中心通道用尾针堵塞(图2)。gydF4y2Ba1得了gydF4y2Ba,gydF4y2Ba2gydF4y2BaA, c和gydF4y2Ba6gydF4y2Ba).根据为T7噬菌体建立的惯例gydF4y2Ba15gydF4y2Ba, SU10的喷嘴蛋白可分为平台结构域、β -螺旋桨结构域和喷嘴结构域(图2)。gydF4y2Ba6 a - cgydF4y2Ba).然而,SU10和T7的喷嘴蛋白没有可检测到的序列相似性。gydF4y2Ba
带短尾纤维的喷嘴蛋白的六聚体从SU10病毒粒子外沿(gydF4y2Ba一个gydF4y2Ba)和垂直(gydF4y2BabgydF4y2Ba)到尾轴。喷嘴蛋白以白色和灰色交替显示,短尾纤维以绿色显示。其中一个喷嘴蛋白以颜色突出显示,平台结构域为橙色,β -螺旋桨结构域为蓝色,短尾纤维码头为洋红色,四个喷嘴结构域为红色。面板上的黑色箭头(gydF4y2BabgydF4y2Ba)显示了喷嘴域4与短尾光纤的相互作用。gydF4y2BacgydF4y2BaSU10病毒粒子喷嘴蛋白和短尾纤维结构与基因组释放中间体的比较。来自病毒粒子的喷嘴蛋白呈彩色,如图所示gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba形成短尾纤维的三个gp16亚基以深浅不一的绿色来区分。来自基因组释放中间体的喷嘴蛋白和短尾纤维的叠加结构分别显示为白色和浅绿色。喷嘴蛋白的结构域组织如图所示。gydF4y2BadgydF4y2BaSU10病毒粒子喷嘴蛋白和基因组释放中间体β -螺旋桨结构域的结构比较,分别用彩虹色和白色表示。七叶β -螺旋桨结构域是彩虹色的,从蓝色的n端到红色的c端。短尾光纤码头环是叶片1 (β1)的延伸,而喷嘴区域插入叶片2 (β2)和叶片3 (β3)之间。gydF4y2BaegydF4y2Ba短纤维码头环(洋红色)与三个短尾纤维蛋白(绿色阴影)的相互作用。色氨酸的侧链gydF4y2Ba839gydF4y2Ba, TrpgydF4y2Ba847gydF4y2Ba和TrpgydF4y2Ba857gydF4y2Ba从短光纤码头环形成一个星形具有准三重对称,这使得连接短尾光纤,这是一个三聚体。残留酪氨酸gydF4y2Ba23gydF4y2Ba,微笑gydF4y2Ba24gydF4y2Ba和提尔gydF4y2Ba25gydF4y2Ba从每个短尾纤维蛋白中,在每个色氨酸之前夹住一段纤维码头环。gydF4y2Ba
平台结构域具有β -三明治折叠,分别由5条和3条β -链形成两个β -片(图2)。gydF4y2Ba6摄氏度gydF4y2Ba).每个喷嘴蛋白的平台结构域与两个相邻接头蛋白的螺旋束结构域相互作用。喷嘴蛋白之间独特的相互作用只会引起邻近接头蛋白结构上的微小差异。gydF4y2Ba
七叶β -螺旋桨结构域直径为50 Å,形成喷嘴蛋白的核心(图2)。gydF4y2Ba6 dgydF4y2Ba).β -螺旋桨区域的叶片4,5和6排列在尾通道上,而叶片1,2和3则远离尾轴。β -螺旋桨结构域被多肽主链的两个入口点和出口点所中断,即所谓的开口。叶片1的第一个开口包括主链从平台域的n端部分进入和平台域的c端部分出出口(图2)。gydF4y2Ba6 dgydF4y2Ba).β -螺旋桨叶片1的结构是由结构域c端残基与结构域n端残基形成的最外层β -链的反平行相互作用稳定的,即所谓的魔术贴封闭(图2)。gydF4y2Ba6 dgydF4y2Ba)gydF4y2Ba33gydF4y2Ba.第二个开口是由于在β -螺旋桨叶片2和3之间插入喷嘴区域造成的(图2)。gydF4y2Ba6 dgydF4y2Ba).从叶片4和叶片5的边缘突出的环,使尾针的绑定。这些环在基因组释放中间体中具有不同的构象,导致尾通道直径从25扩大到31 Å(补充图1)。gydF4y2Ba5gydF4y2Ba).短尾光纤停靠环位于β -螺旋桨区域叶片1的边缘,可实现短尾光纤的附着(图2)。gydF4y2Ba6汉英gydF4y2Ba).gydF4y2Ba
在SU10病毒粒子中,ig状喷嘴结构域被组织成l形排列(图2)。gydF4y2Ba2gydF4y2Ba一个,gydF4y2Ba6 a - cgydF4y2Ba).前两个喷嘴区域形成尾部的钝尖,然后有一个82°的转弯,其余两个区域指向衣壳(图2)。gydF4y2Ba6摄氏度gydF4y2Ba).喷嘴蛋白之间的接触由平台结构域和β -螺旋桨结构域介导。此外,喷嘴结构域环绕在尾部周围,喷嘴结构域1与喷嘴蛋白的喷嘴结构域2和3相互作用,当沿其轴向衣壳方向观察尾部时,喷嘴蛋白的喷嘴结构域2和3位于顺时针方向。gydF4y2Ba6 a、bgydF4y2Ba).喷嘴结构域4与喷嘴蛋白的短尾纤维码头环逆时针方向相互作用(图2)。gydF4y2Ba6 a、bgydF4y2Ba).喷嘴区域的多重相互作用稳定了SU10尾部的固有结构。gydF4y2Ba
短尾纤维gydF4y2Ba
SU10的短尾纤维长度为210 Å,呈直状,可分为近端结构域、中央结构域和受体结合结构域(图2)。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba6 a - cgydF4y2Ba,补充图gydF4y2Ba7gydF4y2Ba).重建近端结构域的分辨率为3.8 Å,从而可以构建gp16的前98个残基(图2)。gydF4y2Ba6 a - cgydF4y2Ba,补充图gydF4y2Ba7gydF4y2Ba).形成近端结构域的α螺旋被短环打断,短环介导结构域内单个亚基螺旋位置的交换(补充图2)。gydF4y2Ba7gydF4y2Ba).使用AlphaFold2 multitimer程序建模的中心结构域和受体结合结构域可以分别拟合到7和15 Å分辨率的冷冻电镜重建中,实空间相关系数为0.81(补充图2)。gydF4y2Ba7一个gydF4y2Ba)gydF4y2Ba34gydF4y2Ba.中心结构域与噬菌体T4 (PDB)短尾纤维尖端相似:gydF4y2Ba1 pdigydF4y2Ba)(补充图:gydF4y2Ba7gydF4y2Ba)gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba而受体结合域类似于噬菌体T4 (PDB)的长尾纤维的尖端;gydF4y2Ba2 xgfgydF4y2Ba),它识别脂多糖或外膜孔蛋白C(补充图2)。gydF4y2Ba7gydF4y2Ba)gydF4y2Ba36gydF4y2Ba.此外,中心结构域和受体结合结构域都与温带噬菌体JUB59 (PDB)受体结合蛋白的相应部分相似:gydF4y2Ba6 ov6gydF4y2Ba)(补充图:gydF4y2Ba7gydF4y2Ba)gydF4y2Ba37gydF4y2Ba.SU10短尾纤维蛋白含有两对组氨酸(His)gydF4y2Ba194gydF4y2Ba和他的gydF4y2Ba196gydF4y2Ba,他的gydF4y2Ba230gydF4y2Ba和他的gydF4y2Ba232gydF4y2Ba),可以结合铁gydF4y2Ba2 +gydF4y2Ba离子,从而稳定纤维,就像T4和JUB59中发生的那样gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.gydF4y2Ba
短尾纤维从喷嘴蛋白连接到纤维码头环(图1)。gydF4y2Ba6 c, egydF4y2Ba).纤维码头环包含色氨酸839、847和857,其侧链以伪三重对称排列(图2)。gydF4y2Ba6 egydF4y2Ba).每个色氨酸侧链与来自三种短尾纤维蛋白之一的Ile24形成疏水相互作用(图2)。gydF4y2Ba6 egydF4y2Ba).此外,Tyr的侧链gydF4y2Ba23gydF4y2Ba,微笑gydF4y2Ba24gydF4y2Ba和提尔gydF4y2Ba25gydF4y2Ba每条短尾纤维在纤维码头环色氨酸之前夹住一段多肽(图2)。gydF4y2Ba6 egydF4y2Ba).短尾纤维的残基3-6与喷嘴蛋白的喷嘴结构域4的残基303-308相互作用,沿尾轴向衣壳方向顺时针定位。gydF4y2Ba6 bgydF4y2Ba).短尾光纤的中心区域与长尾光纤的残基71-78的相互作用使短尾光纤的位置更加稳定(图2)。gydF4y2Ba1gydF4y2Bac,gydF4y2Ba2, cgydF4y2Ba).很可能这些相互作用的破坏使得SU10与宿主细胞结合时,长尾和短尾纤维以及喷嘴蛋白的构象变化得以协调。gydF4y2Ba
尾针gydF4y2Ba
对SU10尾针的三重对称结构进行重构,分辨率为15 Å(图2)。gydF4y2Ba1gydF4y2Ba得了,gydF4y2Ba2, cgydF4y2Ba,补充图gydF4y2Ba8gydF4y2Ba).由Alphafold2 multitimer预测的尾针结构可分为coil -coil和C-terminal结构域,可拟合到cro - em密度中,实空间相关系数为0.80。gydF4y2Ba8 a、BgydF4y2Ba).SU10尾针的盘绕结构域与噬菌体P22尾针同源gydF4y2Ba14gydF4y2Ba,其弯曲度可达18°gydF4y2Ba40gydF4y2Ba.因此,我们期望SU10的尾针也具有类似的柔性,这可能是我们无法将其解析到高分辨率的原因。c端结构域具有β -棱镜结构,类似于gydF4y2BaMyoviridaegydF4y2Ba噬菌体(无花果。gydF4y2Ba2, cgydF4y2Ba,补充图gydF4y2Ba8 a、BgydF4y2Ba)gydF4y2Ba38gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.SU10尾针与尾部通道的结合是通过喷嘴蛋白β -螺旋桨结构域叶片4上的两个环和叶片5上的一个环来实现的。gydF4y2Ba8 c, DgydF4y2Ba).260-Å-long尾针从喷嘴复合体突出200 Å(图2)。gydF4y2Ba1gydF4y2Bac,gydF4y2Ba2, cgydF4y2Ba).gydF4y2Ba
SU10基因组释放中间体头部gydF4y2Ba
SU10基因组释放中间体的衣壳与病毒粒子的衣壳相同(图2)。gydF4y2Ba1gydF4y2Ba、补充表gydF4y2Ba3.gydF4y2Ba).在体外通过渗透休克诱导SU10基因组释放导致噬菌体DNA的不完全喷射(补充图2)。gydF4y2Ba4gydF4y2Ba).SU10基因组释放中间体头部的重建包含附着在衣壳内表面的推定DNA密度环(图2)。gydF4y2Ba1 egydF4y2Ba,补充图gydF4y2Ba9gydF4y2Ba).尽管基因组释放中间体重建中的DNA密度呈环状组织,但留在头部内的DNA很可能是一条连续的单链。这些环是由单个颗粒中DNA片段的结构变异性和它们在重建过程中的错位共同引起的人工产物。正如在基因组释放中间体中观察到的那样,SU10衣壳组织DNA链的倾向可能会影响包装过程中的基因组结构。gydF4y2Ba
无尾衣壳帽的非对称重构包含一个密度为球状壳,外径为80 Å,壁厚为15 Å(补充图)。gydF4y2Ba9 c、EgydF4y2Ba).这个密度球在基因组释放中间体的二维类平均中也可见(补充图2)。gydF4y2Ba9 fgydF4y2Ba).球体不是以衣壳的五重对称轴为中心,而是通过密度连接到由五聚体中主要衣壳蛋白的环状环形成的β -桶(补充图1)。gydF4y2Ba9 egydF4y2Ba).密度球壳的位置使得五聚体的一个边缘可以与DNA结合。gydF4y2Ba9 cgydF4y2Ba).SU10病毒粒子的不对称重建不包含这种密度的球形壳,然而,可能是基因组的强信号阻止了解析球形结构所需的不对称排列。目前尚不清楚是什么形成了观测到的密度球壳。球体的半径太小,不可能由弯曲的dsDNA形成gydF4y2Ba43gydF4y2Ba.因此,球形外壳很可能是由蛋白质形成的。gydF4y2Ba
基因组释放的SU10尾部结构重排gydF4y2Ba
SU10基因组释放中间体的尾部被重组成由喷嘴蛋白和短尾纤维组成的喷嘴(图2)。gydF4y2Ba2gydF4y2Bac, d,gydF4y2Ba6摄氏度gydF4y2Ba,补充图gydF4y2Ba5gydF4y2Ba、辅助电影gydF4y2Ba1gydF4y2Ba).为了形成喷嘴,四个喷嘴结构域经历了广泛的结构变化,从SU10病毒粒子中的L形到基因组释放中间体中的直线排列(图2)。gydF4y2Ba6摄氏度gydF4y2Ba).在新的构象中,这四个结构域形成一条线,指向远离门户复合体的方向。虽然短尾纤维码头环与短尾纤维的相互作用保持不变,但短尾纤维环与β -螺旋桨结构域的连接相互旋转并弯曲135°以指向远离噬菌体头(图2)。gydF4y2Ba6 c, dgydF4y2Ba).短尾光纤也进行同样的旋转。在新的排列中,喷嘴蛋白质和短尾纤维交替形成一个喷嘴,将尾部延长277 Å(图2)。gydF4y2Ba1gydF4y2Bad,gydF4y2Ba2 b, dgydF4y2Ba).此外,喷嘴蛋白β -螺旋桨结构域的远端部分偏离尾轴3 Å,导致尾通道变宽(图1)。gydF4y2Ba6摄氏度gydF4y2Ba,补充图gydF4y2Ba8 c, DgydF4y2Ba).喷嘴的形成需要将短尾纤维的受体结合域带到可以与纤维外膜相互作用的位置gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Ba
su10感染细胞的冷冻电镜和荧光显微镜gydF4y2Ba
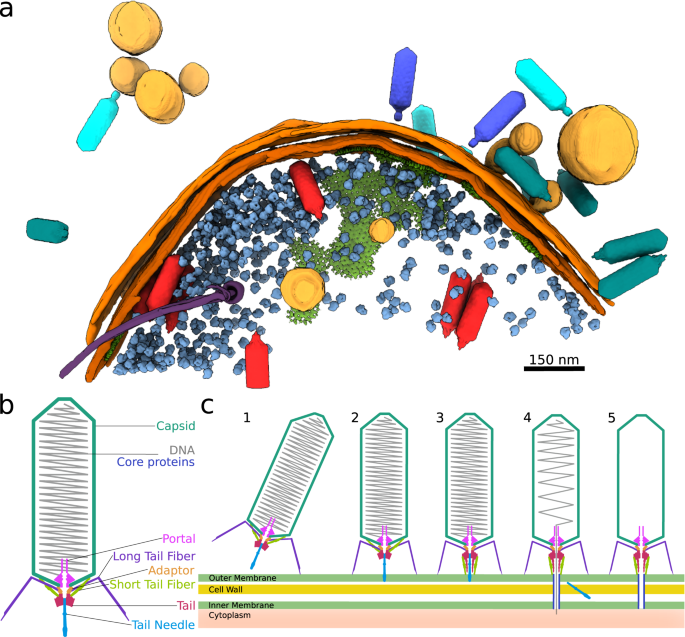
su10感染的断层摄影gydF4y2Ba大肠杆菌gydF4y2Ba证明了多个噬菌体可以结合并将它们的基因组传递到一个细胞中(图2)。gydF4y2Ba7一个gydF4y2Ba,补充图gydF4y2Ba10gydF4y2Ba、辅助电影gydF4y2Ba2gydF4y2Ba).一些噬菌体仅通过长尾纤维附着,而其余噬菌体的尾部形成喷嘴(图2)。gydF4y2Ba7一个gydF4y2Ba,补充图gydF4y2Ba10gydF4y2Ba).此外,带有喷嘴的噬菌体处于基因组释放的不同阶段,从满头部到空头部。空颗粒仍然附着在细胞表面(图2)。gydF4y2Ba7一个gydF4y2Ba,补充图gydF4y2Ba10 d-fgydF4y2Ba).在SU10感染的后期,样品中含有结合噬菌体颗粒的外膜囊泡(图2)。gydF4y2Ba7一个gydF4y2Ba,补充图gydF4y2Ba10 j-lgydF4y2Ba).在浮游培养基中生长的细菌可使膜囊脱落gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.在的条件下gydF4y2Ba大肠杆菌gydF4y2Ba在我们的实验中,许多子代病毒粒子在感染后45至65分钟在感染细胞中组装(补充图2)。gydF4y2Ba10 j-lgydF4y2Ba).最初形成的少数颗粒是随机分布的,然而,随着感染后的一段时间,子代病毒粒子组装成规则的阵列,如前所述gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba感染段gydF4y2Ba大肠杆菌gydF4y2Ba感染后45分钟的细胞在感染周期的各个阶段含有SU10噬菌体。细胞外的病毒粒子用绿松石表示,基因组释放的中间产物用深蓝色表示,空粒子用青色表示,细胞内的子代病毒粒子用红色表示。内层和外层细胞膜分别为深橙色和橙色,小泡为浅橙色,核糖体为浅蓝色,化学受体阵列为绿色,鞭毛为紫色。噬菌体颗粒、核糖体(gydF4y2Baemd - 13270gydF4y2Ba),以及化学感受器阵列(gydF4y2Baemd - 10160gydF4y2Ba)使用EMclarity中实现的模板匹配来识别gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,并将相应的高分辨率结构定位到断层图中。gydF4y2BabgydF4y2BaSU10病毒粒子方案。gydF4y2BacgydF4y2BaSU10的附着和基因组传递机制。(1) SU10病毒粒子通过长尾纤维附着在细胞表面。(2)所有6根长尾纤维的结合使噬菌体的长轴垂直于细菌膜。尾针可以与外膜相互作用。(3)短尾纤维向细胞膜方向旋转,喷嘴蛋白伸直形成喷嘴。(4)尾针与尾部分离。喷射蛋白从噬菌体头部释放出来,降解细胞壁肽聚糖,并延伸噬菌体喷嘴,形成穿过外周质的通道。开始将SU10 DNA喷射到细菌细胞质中。(5)空粒子与细胞保持联系。gydF4y2Ba
的共聚焦图像gydF4y2Ba大肠杆菌gydF4y2Ba用带有标记DNA的SU10感染具有标记膜和基因组的细胞,证实了许多噬菌体颗粒结合并将其基因组传递到一个细胞中(补充图2)。gydF4y2Ba10氟gydF4y2Ba).标记的噬菌体DNA的荧光信号在细胞质中可检测到,直到细胞裂解,甚至被纳入子代病毒粒子(补充图2)。gydF4y2Ba我,我gydF4y2Ba).感染后45分钟,受感染的细胞仍保持其原有的形状单位,但在65分钟时,它们失去了肿胀(补充图)。gydF4y2Ba10 j-lgydF4y2Ba).gydF4y2Ba
SU10基因组传递机制gydF4y2Ba
SU10病毒粒子与外膜受体的初始结合gydF4y2Ba大肠杆菌gydF4y2Ba是由长尾纤维介导的,其远端具有受体结合域(图2)。gydF4y2Ba7 b, cgydF4y2Ba).SU10病毒粒子和基因组释放中间体的结构在长尾纤维指向远离接头复合物的方向上有所不同(图2)。gydF4y2Ba2 c, dgydF4y2Ba).基因组释放中间体中的长尾纤维相对于它们在病毒粒子中的方向旋转6.6°。我们推测,在天然条件下,这种构象变化是由噬菌体与细菌膜结合引起的。此外,长尾纤维的运动可能会破坏它们与短尾纤维的相互作用,从而使它们为尾部喷嘴的形成做好准备。所有六个SU10长尾纤维与受体的结合使噬菌体的长轴垂直于细菌膜(图2)。gydF4y2Ba7 a、cgydF4y2Ba).假定的尾针与细菌膜的相互作用触发了喷嘴蛋白的构象变化,从而导致喷嘴结构域4与短尾纤维的相互作用中断。通过排列成与尾轴平行的直线,喷嘴区域为短尾纤维的135°旋转腾出空间,使其指向远离噬菌体头部。短尾纤维和喷嘴蛋白交替形成277-Å-long喷嘴(图2)。gydF4y2Ba7 cgydF4y2Ba).喷嘴的形成使短尾纤维的预期受体结合域能够与细胞表面的受体相互作用。短尾纤维与感受器的结合可以迫使从喷嘴伸出的尾针穿过外部gydF4y2Ba大肠杆菌gydF4y2Ba膜。随后,尾针与尾部分离,使尾部通道打开(图2)。gydF4y2Ba7 cgydF4y2Ba).抛射蛋白可能在基因组开始之前或与基因组开始一起从SU10头部抛射出来。抛射蛋白在质周间隙形成易位通道,抛射蛋白gp20具有转糖基化酶活性,可降解细胞壁肽聚糖。噬菌体基因组被送到gydF4y2Ba大肠杆菌gydF4y2Ba细胞质通过由喷嘴和移位通道形成的通道(图1)。gydF4y2Ba7 cgydF4y2Ba).gydF4y2Ba
方法gydF4y2Ba
SU10的繁殖和纯化gydF4y2Ba
在噬菌体SU10上进行繁殖gydF4y2Ba大肠杆菌gydF4y2Ba菌株ECOR10,在37°C的营养肉汤(Oxoid)中培养。取细菌培养物300 ml噬菌体裂解液,用涡轮核酸酶(Abnova)(终浓度5单位/ml)处理,6000倍离心gydF4y2BaggydF4y2Ba在4℃下放置20 min,通过0.45 μm聚醚砜注射器过滤器过滤。滤液中噬菌体在54,000倍离心下成球gydF4y2BaggydF4y2Ba在50.2 Ti转子(Beckman Coulter)中,在4°C下工作2.5小时。噬菌体微球在6 ml噬菌体缓冲液(50 mM Tris-Cl, 10 mM NaCl, 10 mM CaCl)中孵育过夜gydF4y2Ba2gydF4y2Ba(pH 8.0),温度为4℃。将溶解的微球覆盖在CsCl阶梯密度梯度上(每种CsCl溶液在噬菌体缓冲液中各取3ml,密度分别为1.45 g/ml、1.50 g/ml和1.70 g/ml),并在210,000 x下离心gydF4y2BaggydF4y2Ba使用SW40Ti转子(Beckman Coulter)在12°C下工作4小时。使用0.8 mm规格的针头和注射器收集含有噬菌体颗粒的条带。使用Visking透析管8/32型″,0.05 mm厚(部件号:0.05 mm),在4°C下对噬菌体缓冲液进行过夜透析去除氯化铯。1780.1,卡尔·罗斯,德国)。gydF4y2Ba
诱导噬菌体基因组释放gydF4y2Ba
纯化后的噬菌体样品(10gydF4y2Ba12gydF4y2BaPFU/ml)在噬菌体缓冲液中用3 M尿素溶液稀释10倍,在42°下孵育30分钟。孵育后,将样品在噬菌体缓冲液中稀释3倍,在室温下以终浓度为3.5 Units/ml的turbonucase (Abnova)处理15min。在75000倍离心下将噬菌体颗粒成球gydF4y2BaggydF4y2Ba在50.2 Ti的转子(Beckman Coulter)中4°加热1小时,并在噬菌体缓冲液中重悬。采用SDS凝胶电泳和质谱分析比较了SU10病毒粒子和基因组释放中间体的蛋白质组成。gydF4y2Ba
噬菌体SU10结构蛋白的鉴定gydF4y2Ba
将纯化的SU10噬菌体重悬于Laemmli缓冲液中,煮沸3min,然后用终浓度为2 Units/ml (Abnova)的turbonucase在室温下处理15min。用三辛梯度凝胶电泳分离蛋白质。所有主要的蛋白质带都从凝胶中剪下,并用于质谱分析。质谱数据处理和分析使用FlexAnalysis 3.4软件和MS BioTools (Bruker Daltonics)进行。使用Mascot软件(Matrix Science, London, UK)对输出的MS/MS谱与国家生物技术信息中心数据库和提供预期蛋白质序列的本地数据库进行序列搜索。肽段和MS/MS片段在MS/MS离子搜索中的质量耐受性分别为百万分之50和0.5 Da。所有的搜索都设置了甲硫氨酸氧化和半胱氨酸丙酰酰胺化作为可选修饰和一种酶错切。多肽评分具有统计学意义(gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
低温电镜样品制备,数据收集,运动校正,CTF估计gydF4y2Ba
纯化噬菌体溶液(4 μl),浓度为10gydF4y2Ba12gydF4y2Ba将PFU/ml移液到多孔碳涂层铜网格(R2/1,目数200;使用FEI Vitrobot Mark IV浸入液体乙烷中进行染色和玻璃化。玻璃化后的样品被转移到Thermo Fisher Scientific Titan Krios电子显微镜中,在低温条件下和300 kV加速电压下操作。在NanoProbe模式下对光束进行平行照射,并进行无昏迷对准以消除残余光束倾斜。SU10病毒粒子的显微照片在猎鹰III型直接电子探测器上以59000倍的放大倍数在线性模式下收集,校准后的像素尺寸为1.38 Å/pix。在低剂量条件下(总剂量49 e)成像gydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba),离焦范围为−1.2 ~−2.7 μm。一秒钟的曝光被分割成40帧并保存为电影。基因组释放中间体数据集在K2 Summit直接电子探测器上以105,000倍的放大倍率在计数模式下收集,校准后的像素大小为1.34 Å/pix。在低剂量条件下(总剂量52 e)成像gydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba),离焦范围为−1.2 ~−2.7 μm。8秒的曝光被分割成40帧并保存为电影。使用软件EPU (Falcon III探测器)或Serial EM (K2 Summit探测器)进行自动数据采集。使用MotionCor2软件对电影进行全局和局部(5 × 5个补丁)的运动校正gydF4y2Ba47gydF4y2Ba并保存为剂量加权显微照片。使用Gctf程序从排列的非剂量加权显微照片估计离焦值gydF4y2Ba48gydF4y2Ba.gydF4y2Ba
SU10病毒粒子的Cryo-ETgydF4y2Ba
制备用于单粒子采集的SU10病毒粒子网格,使用SerialEM在低剂量条件下使用双向倾斜方案,记录角度范围为- 60°至+60°,增量为2°的断层扫描倾斜系列。每个倾斜序列的标称离焦值为- 6µm。每张图像作为7帧的电影在Falcon II探测器上以1 e的剂量在计数模式下操作gydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba/倾斜。每次倾斜系列的总累积剂量为57 egydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba.校正后的像素大小为1.8 Å。利用包IMOD中的eTomo重建层析图gydF4y2Ba49gydF4y2Ba.使用PEET程序对SU10病毒粒子头部的亚断层图进行平均gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba从包IMOD应用D5对称。gydF4y2Ba
SU10病毒粒子头部的重建gydF4y2Ba
利用SPHIRE软件包中的CrYOLO神经网络对人工选取的SU10病毒粒子头部图像子集进行训练gydF4y2Ba52gydF4y2Ba.使用crYOLO对4倍分箱显微照片进行最终自动拾取。将得到的粒子坐标校正为分箱因子,并使用Relion从9,000张原始未分箱的显微照片中提取粒子图像(盒大小为1296 × 1296像素)gydF4y2Ba53gydF4y2Ba.使用Xmipp软件包中实现的互反空间分块,将粒子分块到256 px (6.99 Å/pixel)gydF4y2Ba54gydF4y2Ba.在Relion中进行了几轮二维分类,以从自动挑选的粒子集中选择完整的病毒粒子。从亚层析图平均得到的SU10头部的初始模型经过低通滤波,分辨率为30 Å。使用relion3.1进行了几轮3D分类和细化,并施加了C5对称性。软件包SpidergydF4y2Ba55gydF4y2Ba用于制备不含噬菌体基因组的圆柱形掩膜,以防止基因组信号干扰衣壳重构。在施加C5对称的初始自动细化后,无需对齐步骤即可进行3D分类。选择属于最佳类别的粒子进行进一步的自动细化,施加C5对称,最大允许偏离先前的方向10°。随着重建分辨率的提高,颗粒逐渐解盒到512 px (3.49 Å/pixel)和1296 px (1.38 Å/pixel)。最后的C5对称重构经过阈值掩码,除以调制传递函数,并在Relion 3.1的后处理过程中进行b因子锐化。为了进一步提高衣壳的分辨率,我们将衣壳分为C5对称无尾帽、D10对称中心部分和C5对称带尾帽。所有这些部分都被重新提取到更小的盒子中,并使用局部角搜索对它们的重建进行改进。为了获得噬菌体尾部和周围衣壳的不对称重构,使用程序relion_relax_symm从C5到C1进行对称弛缓(Supplementary Fig. 1)。gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
重组SU10病毒粒子的门脉和尾脉gydF4y2Ba
利用噬菌体头部C5重构的颗粒方向提取以SU10病毒粒子入口和尾部为中心的亚粒子图像。对亚粒子的图像进行几轮二维分类,使其能够选择均匀的数据集。在门静脉的C12对称和尾部的C6和C3对称初始自动细化后,无需对齐步骤即可进行3D分类。选择属于最佳类别的粒子进行进一步的Relion自动细化,施加对称性和最大允许偏差从先前的方向10°。得到的图像经过阈值屏蔽,用调制传递函数进行分割,并在后期处理过程中对图像中的b因子进行锐化。gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
尾针重建gydF4y2Ba
利用噬菌体尾部C6重构的粒子方向,提取以SU10病毒粒子尾针为中心的亚粒子图像。对亚粒子的图像进行了几轮二维分类,从而选择了一个均匀的数据集。在初始自动细化后,松弛对称性设置为C3,无需对齐步骤即可进行3D分类。选择最佳类别的粒子进行进一步的自动细化,施加C3对称,最大允许偏差为10°(补充图)。gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
SU10病毒粒子的不对称重构gydF4y2Ba
为了获得整个SU10病毒粒子的不对称重建,使用relion_relax_symm对C5对称头部重建的方向进行松弛。软件包SpidergydF4y2Ba55gydF4y2Ba制备覆盖噬菌体尾部和40 nm衣壳的球形掩膜。gydF4y2Ba
初始重建是在颗粒图像上进行的,分类到256像素(6.99 Å/像素),使用高正则化因子,只允许旋转搜索。通过在属于噬菌体头部和尾部的部分重建中存在生物学相关特征,验证了对称性的成功松弛。随后,继续重建,将数据分仓到512 px (3.49 Å/pixel)和1296 px (1.38 Å/pixel)(补充图1)。gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
SU10基因组释放中间衣壳的重建gydF4y2Ba
使用软件包EMAN2中的e2boxer手动包装SU10基因组释放中间体gydF4y2Ba56gydF4y2Ba.得到的粒子坐标用于使用Relion从5688显微照片中提取粒子gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.使用Xmipp软件包中实现的互反空间分块,将粒子分块到256 px (6.99 Å/pixel)gydF4y2Ba54gydF4y2Ba.在Relion中进行了几轮二维分类,以从一组颗粒中选择完整的基因组释放中间体。SU10病毒粒子的衣壳重建,低通滤波至30 Å分辨率,作为在Relion中进行3D重建的初始模型。使用relion3.1进行了几轮3D分类和细化,并施加了C5对称性。得到的图像被阈值屏蔽,被调制传递函数分割,并在后期处理过程中对b因子进行锐化(补充图)。gydF4y2Ba12gydF4y2Ba).gydF4y2Ba
SU10基因组释放中间体尾部的重建gydF4y2Ba
利用SU10基因组释放中间体衣壳C5重构的粒子取向提取以尾部为中心的亚粒子图像。对亚粒子的图像进行了几轮二维分类,从而选择了一个均匀的数据集。在初始的C6对称自细化后,无需对齐步骤即可进行3D分类。选择属于最佳类别的粒子进行进一步的Relion自细化,施加C6对称,最大允许偏离先前的方向10°。得到的图像被阈值屏蔽,被调制传递函数分割,并在后期处理过程中对b因子进行锐化(补充图)。gydF4y2Ba12gydF4y2Ba).gydF4y2Ba
SU10基因组释放中间体衣壳顶部的不对称重构gydF4y2Ba
利用SU10基因组释放中间体衣壳C5重构的粒子取向提取以衣壳顶部为中心的亚粒子图像。对亚粒子的图像进行了几轮二维分类,从而选择了一个均匀的数据集。粒子进行C5对称扩展,无需对齐步骤即可进行10类三维分类。选取最优类的粒子,去除对称展开中的重复粒子。得到的粒子被用于进一步的自细化,没有对称,最大允许偏差为10°(补充图2)。gydF4y2Ba12gydF4y2Ba).gydF4y2Ba
低温电镜结构测定和细化gydF4y2Ba
使用COOT程序构建PDB结构gydF4y2Ba47gydF4y2Ba(门脉蛋白,接头蛋白,长尾纤维残基1-90和短尾纤维近端结构域),使用Deep Tracer自动构建gydF4y2Ba57gydF4y2Ba(喷嘴蛋白)或使用Alphafold2建模gydF4y2Ba34gydF4y2Ba(短尾纤维和尾针的中央和受体结合区域)。利用程序PHENIX real_space_refine.py在实际空间中对结构进行迭代细化gydF4y2Ba58gydF4y2Ba并在COOT中手动修正gydF4y2Ba47gydF4y2Ba和伊索尔德gydF4y2Ba59gydF4y2Ba.在PHENIX程序中使用综合验证来评估结构的质量及其与低温电镜密度图的契合度。低温电镜重建的FSC曲线见附图。gydF4y2Ba13gydF4y2Ba.模型映射单个结构的FSC曲线,以及PDB模型与低温电镜密度的拟合示例见补充图。gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
AlphaFold2结构预测gydF4y2Ba
使用局部安装的AlphaFold multitimer 2.1.2,预测了在冷冻电镜重建中未分解到足够分辨率以进行结构测定的SU10蛋白的结构。该软件是从gydF4y2Bahttps://github.com/deepmind/alphafoldgydF4y2Ba,使用Dockerised环境。为了进行预测,使用了AlphaFold作者在安装时(2021年冬季)推荐的数据库(BFD, MGnify, PDB70, PDB, PDB序列,Uniclust30, UniProt, UniRef90)。gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
SU10病毒粒子与基因组释放中间体冷冻电镜合成图谱的制备gydF4y2Ba
将SU10病毒粒子区域亚粒子重构片段结合,合成SU10病毒粒子复合图谱。利用嵌合体将SU10病毒粒子区域的亚粒子重构与完整的SU10病毒粒子的不对称重构相匹配gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba(匹配地图命令)。合成图由以下重建得到:C5对称衣壳重建;C12对称颈重建门静脉;C6对称尾重建接头、长尾纤维、喷嘴和短尾纤维;C3对称尾针重建。亚粒子重建片段通过以下步骤组合成复合图:(1)使用pdb2mrc生成覆盖组分蛋白PDB结构的掩模。(2)蒙版扩展了6个体素,并增加了4个软边缘体素(Relion3 - relion_mask_create)。(3)子粒子重构与对应的掩码(Relion3 - relion_image_handler)相乘。(4)对于每一段阈值,选取分解细节最大的整个构件结构进行显示。对于沿光纤分辨率递减的短尾光纤图,选择了三个不同阈值的段。 (5) The maps of segments were normalized using CCP4 mapmask. (6) The normalized segments were combined into the final composite map using the Chimera command vop add onGrid. The composite map of the SU10 genome release intermediate was prepared using the same procedure from capsid reconstructed with C5 symmetry and tail reconstructed with C6 symmetry.
荧光显微镜样品制备,数据收集和处理gydF4y2Ba
呈指数增长的文化gydF4y2Ba大肠杆菌gydF4y2Ba用DmaO (BIOTIUM)预染色的噬菌体SU10 (MOI = 10)在0.002 M CaCl存在下感染ECOR10 (OD = 0.3)gydF4y2Ba2gydF4y2Ba.感染在带有玻璃底(Greiner bio-one)的PS 75/25 mm cellview细胞培养载玻片中进行,温度37°C,转速100 RPM,并允许进行5、25、45和65分钟。用synapated (BIOTIUM)(终浓度4 μM)和DAPI (Roche)(终浓度300 nM)对细菌膜和DNA进行染色。成像时,将样品用戊二醛和甲醛的混合物(分别为0.125%和4%)固定在50 mM磷酸盐缓冲液(pH=7.5)中。为了防止成像过程中的运动,在噬菌体缓冲液中覆盖1%低熔点琼脂糖。gydF4y2Ba
使用蔡司LSM 880共聚焦显微镜和airscan在R-S模式下对样品进行成像,荧光团激发波长为:DAPI在405 nm, DmaO在488 nm, synapiled在514 nm。使用ZEN Black处理数据,并使用Fiji进行可视化gydF4y2Ba63gydF4y2Ba.gydF4y2Ba
su10感染的冷冻etgydF4y2Ba大肠杆菌gydF4y2Ba细胞gydF4y2Ba
呈指数增长的文化gydF4y2Ba大肠杆菌gydF4y2Ba用噬菌体SU10 (MOI = 10)感染ECOR10 (OD = 0.3)。让感染进展5、25、45和65分钟。将1.5 ml感染细菌培养物在10000倍离心下成球gydF4y2BaggydF4y2Ba在4°下放置1分钟。将微球用15 μl噬菌体缓冲液重悬,冰冻保存。金基准标记(10 nm珠子)应用于多孔碳包覆铜网格(R3.5/1,目数200;用滤纸擦拭,立即用4 μl细胞悬液覆盖。随后,使用Vitrobot Mark IV浸入液体乙烷中对网格进行染色和玻璃化。在K2 Summit直接电子探测器上,在低剂量条件下,使用剂量对称倾斜方案自动记录角度范围从−60°到+60°,增量为3°的断层扫描倾斜系列,该探测器位于Titan Krios显微镜的能量过滤器后面。每个倾斜系列以标称离焦值- 6µm收集,并在检测器计数模式下以2 e的剂量获得包含5帧的电影gydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba/倾斜。每次倾斜系列的总累积剂量为57 egydF4y2Ba−gydF4y2Ba/一个gydF4y2Ba2gydF4y2Ba.校正后的像素大小为4.33 Å。利用eTomo软件包中的IMOD对层析图进行重建和可视化gydF4y2Ba58gydF4y2Ba.使用Amira程序对膜和鞭毛进行分割gydF4y2Ba64gydF4y2Ba.噬菌体颗粒、核糖体(gydF4y2Baemd - 13270gydF4y2Ba),以及化学感受器阵列(gydF4y2Baemd - 10160gydF4y2Ba)使用EMclarity中实现的模板匹配来识别gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,并使用内部脚本将相应的高分辨率结构定位到层析图中gydF4y2Bahttps://github.com/fuzikt/tomostarpygydF4y2Ba.gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
冷冻电镜重建和相应的PDB结构在以下EMDB和PDB代码下沉积:SU10病毒粒子结构:五重对称衣壳gydF4y2Baemd - 14488gydF4y2Ba和gydF4y2BaPDB-7Z49gydF4y2Ba,不对称衣壳重构gydF4y2Baemd - 14492gydF4y2Ba和gydF4y2BaPDB-7Z4BgydF4y2Ba、衣壳顶部gydF4y2Baemd - 14485gydF4y2Ba和gydF4y2BaPDB-7Z46gydF4y2Ba,衣壳中心gydF4y2Baemd - 14484gydF4y2Ba和gydF4y2BaPDB-7Z45gydF4y2Ba、衣壳底gydF4y2Baemd - 14487gydF4y2Ba和gydF4y2BaPDB-7Z48gydF4y2Ba,衣壳底部和尾部的非对称重构gydF4y2Baemd - 14489gydF4y2Ba和gydF4y2BaPDB-7Z4AgydF4y2Ba颈部有十二重对称gydF4y2Baemd - 14483gydF4y2Ba和gydF4y2BaPDB-7Z44gydF4y2Ba尾巴呈六重对称gydF4y2Baemd - 14486gydF4y2Ba和gydF4y2BaPDB-7Z47gydF4y2Ba尾针有三重对称gydF4y2Baemd - 14909gydF4y2Ba,以及整个病毒粒子的合成图gydF4y2Baemd - 14977gydF4y2Ba.基因组释放中间体的结构:五重对称衣壳gydF4y2Baemd - 14490gydF4y2Ba尾巴呈六重对称gydF4y2Baemd - 14495gydF4y2Ba和gydF4y2BaPDB-7Z4FgydF4y2Ba、衣壳顶部gydF4y2Baemd - 14491gydF4y2Ba,并合成全基因组释放中间体图谱gydF4y2Baemd - 14920gydF4y2Ba.gydF4y2Ba
代码的可用性gydF4y2Ba
将高分辨率结构定位到层析图中的脚本可从gydF4y2Bahttps://github.com/fuzikt/tomostarpygydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
阿克曼,H.-W。阮玉明(音译)[m] . [m] . unnouveau bactsamriophage d ' entsamrobactsamries tête allongsamet queue court .]gydF4y2Ba巴斯德研究所年鉴/病毒学gydF4y2Ba132gydF4y2Ba, 229-234(1981)。gydF4y2Ba
Mirzaei, M. K, Eriksson, H. Kasuga, K., haggatrad - ljungquist, E.和Nilsson, a . S.具有C3形态的足病毒科噬菌体vB_EcoP_SU10的基因组学、蛋白质组学、形态学和系统发育分析。gydF4y2BaPLoS ONE。gydF4y2Ba9gydF4y2Ba, e116294(2014)。gydF4y2Ba
Savalia, D.等人。新型大肠杆菌噬菌体phiEco32的基因组学和蛋白质组学分析gydF4y2BaJ.摩尔生物学。gydF4y2Ba377gydF4y2Ba, 774-789(2008)。gydF4y2Ba
Kropinski, a.m., Lingohr, e.j.和Ackermann, h.w.。肠杆菌噬菌体7-11的基因组序列,它具有一个异常长的头部。gydF4y2Ba拱门。性研究。gydF4y2Ba156gydF4y2Ba, 149-151(2011)。gydF4y2Ba
Kaper, j.b., Nataro, j.p.和Mobley, h.l.t.致病性大肠杆菌。gydF4y2BaNat Rev. Microbiol。gydF4y2Ba2gydF4y2Ba, 123-140(2004)。gydF4y2Ba
Górski, A.等。噬菌体疗法:我们学到了什么?gydF4y2Ba病毒gydF4y2Ba10gydF4y2Ba, 288(2018)。gydF4y2Ba
海恩斯,m.e.k.等。新型噬菌体治疗鸡尾酒抗临床耐药菌株的选择方法分析。gydF4y2Ba前面。Microbiol。gydF4y2Ba12gydF4y2Ba中文信息学报,613529(2021)。gydF4y2Ba
Terwilliger等人。与噬菌体治疗相关的微生物序列与复发性尿路感染的成功临床结果相关。gydF4y2Ba病毒gydF4y2Ba13gydF4y2Ba, 2049(2021)。gydF4y2Ba
Fokine, A. & Rossmann, M. G.尾巴双链DNA噬菌体的分子结构。gydF4y2Ba噬菌体gydF4y2Ba4gydF4y2Ba, e28281(2014)。gydF4y2Ba
李建军,李建军,李建军,等。短尾机器:足病毒对DNA的吸附和传递。在143 - 179年gydF4y2Bahttps://doi.org/10.1007/978-1-4614-0980-9_7gydF4y2Ba(2012)。gydF4y2Ba
莱曼,p.g.等人。噬菌体K1E和K1-5的结构解释了多糖胶囊的过程降解和新宿主特异性的进化。gydF4y2Ba分子生物学[J]。gydF4y2Ba371gydF4y2Ba; 836-849(2007)。gydF4y2Ba
Tang, L., Marion, W. R., Cingolani, G., Prevelige, P. E. & Johnson, J. E.噬菌体P22尾部机的三维结构。gydF4y2BaEMBO J。gydF4y2Ba24gydF4y2Ba, 2087-2095(2005)。gydF4y2Ba
Cuervo, A.等。T7噬菌体尾部机械的结构表征。gydF4y2Ba生物。化学。gydF4y2Ba288gydF4y2Ba科学通报,26290-26299(2013)。gydF4y2Ba
Olia, A. S., Casjens, S.和Cingolani, G.噬菌体P22细胞穿膜针的结构。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba14gydF4y2Ba, 1221-1226(2007)。gydF4y2Ba
Cuervo, A.等。T7噬菌体portal和tail的结构提示病毒DNA保留和喷射机制。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 3746(2019)。gydF4y2Ba
Hrebík, D.等。金黄色葡萄球菌噬菌体P68的结构及基因组抛射机制。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Ba, eaaw7414(2019)。gydF4y2Ba
崔,K.等。洞察双链DNA病毒中的DNA和蛋白质运输:噬菌体N4的结构。gydF4y2BaMicrosc。微量分析。gydF4y2Ba14gydF4y2Ba[j], 2008。gydF4y2Ba
Jiang, W.等。epsilon15噬菌体的结构揭示了基因组组织和DNA包装/注射装置。gydF4y2Ba自然gydF4y2Ba439gydF4y2Ba, 612-616(2006)。gydF4y2Ba
金,Y.等。噬菌体P22在其基因组之前喷射出其所有内部蛋白质。gydF4y2Ba病毒学gydF4y2Ba485gydF4y2Ba, 128-134(2015)。gydF4y2Ba
将噬菌体DNA“注射”到细胞中——生物学家和物理学家对此表示同意。gydF4y2Ba咕咕叫。当今。Microbiol。gydF4y2Ba10gydF4y2Ba中文信息学报,401-409(2007)。gydF4y2Ba
Van Valen等人。单分子赫尔希-蔡斯实验gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba22gydF4y2Ba, 1339-1343(2012)。gydF4y2Ba
Molineux, i.j. & Panja, D.弹出软木塞:噬菌体基因组喷射的机制。gydF4y2BaNat Rev. Microbiol。gydF4y2Ba11gydF4y2Ba, 194-204(2013)。gydF4y2Ba
包装噬菌体基因组的移动性控制喷射动力学。gydF4y2BaElifegydF4y2Ba7gydF4y2Ba, e37345(2018)。gydF4y2Ba
陈,Y.-J。et al。体内噬菌体基因组喷射的两阶段动力学。gydF4y2Ba理论物理。启XgydF4y2Ba8gydF4y2Ba, 021029(2018)。gydF4y2Ba
杜达,r.l.和特斯克,c.m.惊人的HK97折:适度差异的通用结果。gydF4y2Ba咕咕叫。当今。性研究。gydF4y2Ba36gydF4y2Ba, 9-16(2019)。gydF4y2Ba
Chang, j.t.等。噬菌体Epsilon15及其宿主沙门氏菌感染过程中结构变化的可视化研究gydF4y2BaJ.摩尔生物学。gydF4y2Ba402gydF4y2Ba, 731-740(2010)。gydF4y2Ba
Chang, J, Weigele, P., King, J, Chiu, W.和Jiang, W.噬菌体P22的低温电镜非对称重构揭示其DNA包装和感染机制的组织。gydF4y2Ba结构gydF4y2Ba14gydF4y2Ba, 1073-1082(2006)。gydF4y2Ba
Chen, W.等。噬菌体在DNA包装和成熟过程中的结构变化。gydF4y2Ba蛋白细胞gydF4y2Ba11gydF4y2Ba, 374-379(2020)。gydF4y2Ba
Lokareddy, r.k.等人。门脉蛋白的功能类似于dna传感器,将基因组包装偶联到二十面体衣壳成熟。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 14310(2017)。gydF4y2Ba
贝菲尔德,o.w.等。具有超大T=7衣壳的嗜热病毒的低温电镜结构和体外DNA包装。gydF4y2Ba自然科学进展。gydF4y2Ba116gydF4y2Ba中文信息学报,3556-3561(2019)。gydF4y2Ba
皮拉等人。尾管蛋白A:肺炎克雷伯菌噬菌体KP32的一种双功能尾蛋白。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 2223(2017)。gydF4y2Ba
Kęsik-Szeloch, A.等。表征感染多重耐药肺炎克雷伯菌的新型溶解噬菌体的生物学。gydF4y2Ba性研究。J。gydF4y2Ba10gydF4y2Ba, 100(2013)。gydF4y2Ba
Fülöp, V. & Jones, D. T. β螺旋桨:结构刚性和功能多样性。gydF4y2Ba咕咕叫。当今。结构体。医学杂志。gydF4y2Ba9gydF4y2Ba, 715-721 (1999)gydF4y2Ba
跳楼者,J.等。高度精确的蛋白质结构预测与AlphaFold。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 583-589(2021)。gydF4y2Ba
科斯尤琴科,V. A.等。噬菌体T4基板三维结构。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba10gydF4y2Ba, 688-693(2003)。gydF4y2Ba
Bartual, s.g.等。T4噬菌体长尾纤维受体结合尖端的结构。gydF4y2Ba自然科学进展。gydF4y2Ba107gydF4y2Ba科学通报,20287-20292(2010)。gydF4y2Ba
Pellizza, L.等。来自南极细菌阿根廷Bizionia argentinensis JUB59的一种新型温带噬菌体的假定长尾纤维受体结合尖端的结构。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba212gydF4y2Ba中文信息学报,107595(2020)。gydF4y2Ba
Harada, K.等。噬菌体中心突刺c端结构域的晶体结构及结合钙离子的功能。gydF4y2Ba生物化学与生物物理学报(BBA) -蛋白质与蛋白质组。gydF4y2Ba1834gydF4y2Ba, 284-291(2013)。gydF4y2Ba
Browning, C, schneider, M. M., Bowman, V. D., Schwarzer, D.和Leiman, P. G.,噬菌体用铁负载刺穿宿主细胞膜。gydF4y2Ba结构gydF4y2Ba20.gydF4y2Ba, 326-339(2012)。gydF4y2Ba
陈晓明,陈晓明,陈晓明,等。氙气探测噬菌体P22尾针gp26的结构可塑性。gydF4y2Ba蛋白质科学gydF4y2Ba18gydF4y2Ba, 537-548(2009)。gydF4y2Ba
泰勒,n.m.i.等。T4基板的结构及其触发鞘收缩的作用。gydF4y2Ba自然gydF4y2Ba533gydF4y2Ba, 346-352(2016)。gydF4y2Ba
Yamashita等人。P2噬菌体尾突的宿主结合域显示出三聚体铁结合结构。gydF4y2BaActa Crystallogr。第六节结构医学杂志。结晶Commun。gydF4y2Ba67gydF4y2Ba, 837-841(2011)。gydF4y2Ba
Brinkers, S., Dietrich, H. R. C., de Groote, F. H., Young, I. T. & Rieger, B.利用暗场束缚粒子运动测定双链DNA的持续长度。gydF4y2Baj .化学。理论物理。gydF4y2Ba130gydF4y2Ba中文信息学报,215105(2009)。gydF4y2Ba
Parent, k.n.等。OmpA和OmpC是噬菌体Sf6进入的关键宿主因子gydF4y2Ba年代higellagydF4y2Ba.gydF4y2Ba摩尔。Microbiol。gydF4y2Ba92gydF4y2Ba, 47-60(2014)。gydF4y2Ba
张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。gydF4y2Ba病毒学gydF4y2Ba427gydF4y2Ba, 177-188(2012)。gydF4y2Ba
Reyes-Robles等。霍乱弧菌外膜囊泡抑制噬菌体感染。gydF4y2Baj . Bacteriol。gydF4y2Ba200gydF4y2Ba, e00792-17(2018)。gydF4y2Ba
埃姆斯利,P. &考坦,K。gydF4y2Ba傻瓜gydF4y2Ba:分子图形的模型构建工具。gydF4y2BaActa Crystallogr。D部分生物学。Crystallogr。gydF4y2Ba60gydF4y2Ba, 2126-2132 (2004)gydF4y2Ba
张凯。Gctf:实时CTF测定与校正。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba193gydF4y2Ba, 1-12(2016)。gydF4y2Ba
Kremer, J. R, Mastronarde, D. N.和McIntosh, J. R.使用IMOD的三维图像数据的计算机可视化。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba116gydF4y2Ba, 71-76(1996)。gydF4y2Ba
Heumann, J. M, Hoenger, A.和Mastronarde, D. N.使用楔形掩膜差异的低温电子断层成像的聚类和方差图。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba175gydF4y2Ba, 288-299(2011)。gydF4y2Ba
Nicastro等人。低温电子断层扫描揭示轴突的分子结构。gydF4y2Ba科学(1979)gydF4y2Ba313gydF4y2Ba, 944-948(2006)。gydF4y2Ba
瓦格纳,T.等。SPHIRE-crYOLO是一款快速准确的全自动颗粒拾取器。gydF4y2BaCommun。医学杂志。gydF4y2Ba2gydF4y2Ba, 218(2019)。gydF4y2Ba
Zivanov等人。用于RELION-3高分辨率低温电镜结构自动测定的新工具。gydF4y2BaElifegydF4y2Ba7gydF4y2Ba, e42166(2018)。gydF4y2Ba
de la Rosa-Trevín, j.m.等。Xmipp 3.0:一个改进的电子显微镜图像处理软件套件。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba184gydF4y2Ba, 321-328(2013)。gydF4y2Ba
谢赫,t.r.等。基于电子显微图的生物大分子单粒子重建的SPIDER图像处理。gydF4y2BaProtoc Nat。gydF4y2Ba3.gydF4y2Ba, 1941-1974(2008)。gydF4y2Ba
Tang, G.等。一个可扩展的电子显微镜图像处理套件。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba157gydF4y2Ba, 38-46(2007)。gydF4y2Ba
Pfab, J., Phan, N. M. & Si, D. DeepTracer用于快速从头低温电镜蛋白结构建模和冠状病毒相关复合物的特殊研究。在gydF4y2Ba美国国家科学促进会。gydF4y2Ba118gydF4y2Ba, e2017525118(2021)。gydF4y2Ba
Afonine, P. V.等。中的实空间细化gydF4y2Ba凤凰gydF4y2Ba用于低温电镜和晶体学。gydF4y2BaActa Crystallogr。D节结构。医学杂志。gydF4y2Ba74gydF4y2Ba, 531-544(2018)。gydF4y2Ba
滚动,t。gydF4y2Ba伊索尔德gydF4y2Ba:为低分辨率电子密度图建立模型的物理逼真环境。gydF4y2BaActa Crystallogr。D节结构。医学杂志。gydF4y2Ba74gydF4y2Ba中文信息学报,519-530(2018)。gydF4y2Ba
戈达德,t.d.等人。UCSF ChimeraX:迎接可视化和分析的现代挑战。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba, 14-25(2018)。gydF4y2Ba
彼得森,e.f.等人。UCSF ChimeraX:研究人员、教育工作者和开发人员的结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70-82(2021)。gydF4y2Ba
彼得森,e.f.等人。UCSF chimera -用于探索性研究和分析的可视化系统。gydF4y2BaJ第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605-1612(2004)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat。方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
Himes, b.a.和Zhang, P. emClarity:高分辨率低温电子断层扫描和亚层析成像平均的软件。gydF4y2BaNat。方法。gydF4y2Ba15gydF4y2Ba, 955-961(2018)。gydF4y2Ba
伯特,A.等。大肠杆菌微型细胞株化学感觉阵列核心信号单元的完整结构。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 743(2020)。gydF4y2Ba
苏汉诺夫斯基,M. M. &特施克,C. M.大自然的最喜欢的构建模块:用hk97折叠解码蛋白质的折叠和衣壳组装。gydF4y2Ba病毒学gydF4y2Ba479 - 480gydF4y2Ba, 487-497(2015)。gydF4y2Ba
致谢gydF4y2Ba
感谢MEYS CR (LM2018127)支持的CEITEC MU冷冻电子显微镜和断层扫描核心设施和CIISB蛋白质组学核心设施,指导- cz中心为获得本文所提供的科学数据提供的帮助。我们感谢捷克生物成像大型RI项目(由MEYS CR资助的LM2018129)支持的核心设施CELLIM,感谢他们对本文中提供的科学数据的支持。我们非常感谢参与国家电网基础设施元中心的各方和项目拥有的计算和存储设施,这些设施是在大型研究、开发和创新基础设施项目(LM2010005)下提供的。本研究由it4创新卓越中心(项目CZ.1.05/1.1.00/02.0070)支持。这项工作,包括Pavel Plevka的努力,由捷克教育,青年和体育部ERC-CZ合并资助LL1906,捷克科学基金会资助GA18-17810S,以及国家病毒学和细菌学研究所项目(Program EXCELES, ID project No. 5)资助。LX22NPO5103) -由欧盟资助-下一代欧盟。资助者没有参与研究的设计、数据收集和解释,也没有参与是否提交论文发表的决定。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
概念化最大功率;方法m .Š。,T.F., M.P., J.N., and M.B.; validation M.Š. and T.F.; formal analysis M.Š., M.P., J.N, and M.B.; investigation M.Š., M.P., J.N., and M.B.; resources A.N.; data curation M.Š. and T.F.; writing—original draft preparation M.Š., T.F., and P.P.; writing—review and editing M.Š., T.F., and P.P.; visualization M.Š. and T.F.; supervision P.P.; funding acquisition P.P.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行评议信息gydF4y2Ba
自然通讯gydF4y2Ba感谢其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Šiborová, M., f
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33305-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba