摘要gydF4y2Ba
微孢子虫是一种与真菌相关的专性细胞内寄生虫,感染大多数动物门。尽管微孢子虫对人类和农业动物的威胁正在显现,但目前几乎没有可靠的治疗方案。在这里,我们开发了一种高通量筛选方法,用于鉴定微孢子虫感染的化学抑制剂,使用液体培养gydF4y2Ba秀丽隐杆线虫gydF4y2Ba感染了微孢子虫gydF4y2BaNematocida parisiigydF4y2Ba.我们筛选了2560种fda批准的化合物和天然产物,并确定了11种候选微孢子虫抑制剂。五种化合物通过抑制孢子发射来预防小孢子虫感染,而一种化合物,dexrazoxane,减缓感染进程。这些化合物在体外对其他几种微孢子虫有活性,包括那些已知会感染人类的微孢子虫。总之,我们的研究结果强调了gydF4y2Ba秀丽隐杆线虫gydF4y2Ba作为针对细胞内病原体的药物发现的模型宿主,并为微孢子虫抑制剂的鉴定和表征提供了可扩展的高通量系统。gydF4y2Ba
简介gydF4y2Ba
微孢子虫是一组多样化的寄生虫,包括1400多个种类,可以感染大多数主要的动物门gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.许多微孢子虫感染农业上重要的动物。这包括无脊椎感染物种,如gydF4y2Ba微孢子虫gydF4y2Ba和gydF4y2Ba疾病的apigydF4y2Ba感染蜜蜂,gydF4y2BaEnterocytozoon hepatopenaeigydF4y2Ba它会感染虾gydF4y2BaHepatospora eriocheirgydF4y2Ba什么会感染螃蟹gydF4y2Ba疾病bombycisgydF4y2Ba什么会感染蚕gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.此外,还有几个物种会感染养殖鱼类,包括gydF4y2BaLoma salmonaegydF4y2Ba也会感染鲑鱼和鳟鱼gydF4y2BaEnterospora nucleophilagydF4y2Ba是什么感染了吉尔头海鲷gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.这些动物感染微孢子虫会导致体型缩小,后代减少,死亡率增加gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.微孢子虫感染的经济影响很大。蚕蛹感染引发了蚕业的历史性崩溃,据估计,微孢子虫感染每年给泰国虾业造成超过2亿美元的损失gydF4y2Ba7gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.猪、牛、羊等家畜以及狗、猫、兔等宠物会感染gydF4y2BaEncephalitozoongydF4y2Ba物种和gydF4y2BaEnterocytozoon bieneusigydF4y2Ba.人类也会被这些物种感染,其中免疫功能低下的感染更为普遍gydF4y2Ba11gydF4y2Ba.微孢子虫通常感染动物,据报道,超过一半的蜂箱和大约40%的猪被感染gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.微孢子虫也是新兴病原体,其中许多物种构成的威胁在过去几十年才被认识到gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
尽管这些寄生虫对人类和动物健康构成威胁,但几乎没有治疗方案。烟熏青霉素是真菌中的一种化合物gydF4y2Ba来自烟曲霉属真菌gydF4y2Ba它抑制蛋氨酸氨基肽酶2型(MetAP2),自20世纪50年代以来一直被用于治疗蜜蜂的微孢子虫感染gydF4y2Ba14gydF4y2Ba.然而,最近的报告表明,烟熏青霉素可能对该病无效gydF4y2Ban ceranaegydF4y2Ba在蜜蜂和gydF4y2Ba大肠hepatopenaeigydF4y2Ba在虾gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.此外,烟熏青霉素对人体有毒性,一些国家禁止在养蜂中使用它gydF4y2Ba17gydF4y2Ba.另一种最常用的治疗微孢子虫的药物是阿苯达唑,它会破坏β-微管蛋白的功能。一些微孢子虫种类,包括gydF4y2Ba大肠bieneusigydF4y2Ba与阿苯达唑耐药相关的β-微管蛋白变异,因此,这些物种对药物不敏感gydF4y2Ba18gydF4y2Ba.已经描述了药物治疗小孢子虫感染的其他几种方法,包括抑制几丁质合成酶,以及通过阻断钙通道抑制孢子发射gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.微孢子虫只在宿主细胞内生长,这使得抑制剂的筛选具有挑战性。已经进行了几种鉴定微孢子虫抑制剂的筛选,但由于缺乏适用的高通量筛选试验,这些筛选每次仅限于不到100种化合物gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.gydF4y2Ba
模式生物gydF4y2Ba秀丽隐杆线虫gydF4y2Ba是一个研究传染病的强大系统,广泛适用于高通量药物筛选。gydF4y2Ba秀丽隐杆线虫gydF4y2Ba在自然界中通常被微孢子虫感染吗gydF4y2BaNematocida parisiigydF4y2Ba,并以此为模型研究了微孢子虫孢子出口、寄主免疫以及微孢子虫与寄主相互作用的蛋白gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.感染gydF4y2Ba秀丽隐杆线虫gydF4y2Ba开始的时候gydF4y2Ban parisiigydF4y2Ba孢子被摄入。然后孢子在肠腔中萌发,在那里它们独特的入侵装置被称为极性管,使孢子质沉积到肠上皮细胞中。在细胞内,孢子质通过二元或多重裂变启动增殖过程,称为merogony,产生与宿主细胞质直接接触的merontsgydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.繁殖后,梅龙进行孢子生殖,形成孢子,然后由蠕虫排出,每只受感染的动物产生超过10万个孢子gydF4y2Ba29gydF4y2Ba.感染gydF4y2Ba秀丽隐杆线虫gydF4y2Ba通过gydF4y2Ban parisiigydF4y2Ba导致生长受损,减少子代产量和致死率gydF4y2Ba23gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.易于培养和生长大量的动物,以及易于识别的表型,已经使gydF4y2Ba秀丽隐杆线虫gydF4y2Ba一个强大的平台,以确定新的驱虫,抗生素和抗真菌剂gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
为了发现更多的微孢子虫抑制剂,我们使用了gydF4y2Ba秀丽隐杆线虫/巴黎线虫gydF4y2Ba模型系统开发一个高通量,液体为基础的药物筛选试验,其中化合物评分的能力,以防止感染诱导的子代抑制。使用这种方法,我们筛选了2560种fda批准的化合物和天然产物的谱集,并确定了11种微孢子虫感染的化学抑制剂,我们使用半自动化方法进行量化确认gydF4y2Ba秀丽隐杆线虫gydF4y2Ba液体培养子代数。我们报道了其中五种化合物,包括已知的丝氨酸蛋白酶抑制剂ZPCK和四种共享醌结构的化合物,可防止微孢子虫入侵gydF4y2Ba秀丽隐杆线虫gydF4y2Ba通过抑制孢子燃烧。此外,铁螯合剂和拓扑异构酶II抑制剂dexrazoxane防止感染进展。总之,这项工作描述了筛选数千种假定的微孢子虫抑制剂的方法,并确定了新的微孢子虫抑制剂,它们可以阻止微孢子虫的入侵或增殖。gydF4y2Ba
结果gydF4y2Ba
高通量筛选2560个光谱收集化合物,发现11种微孢子虫抑制剂gydF4y2Ba
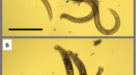
为了确定微孢子虫感染的抑制剂,我们开发了一种新的化学抑制剂筛选方法gydF4y2Ba秀丽隐杆线虫gydF4y2Ba感染后,子代的产生受到极大的抑制gydF4y2Ban parisiigydF4y2Ba23gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.在我们的筛选试验中,L1动物在96孔板中液体中生长并感染gydF4y2Ban parisiigydF4y2Ba孢子在21°C下培养6天(图;gydF4y2Ba1gydF4y2Ba,参见方法)。在没有gydF4y2Ban parisiigydF4y2Ba孢子,gydF4y2Ba秀丽隐杆线虫gydF4y2Ba幼虫发育成成虫并产生子代。在孢子存在的情况下,动物体积更小,产生的后代更少,这为感染提供了一个方便的视觉指示。已知的微孢子虫抑制剂烟马青霉素可阻止这种子代产生的抑制(图。gydF4y2Ba1 bgydF4y2Ba).使用该方法,我们测试了2560种fda批准的化合物和来自Spectrum Collection的天然产物防止感染诱导的子代抑制的能力。在与化合物孵育6天后,每个孔都进行了视觉评估gydF4y2Ba秀丽隐杆线虫gydF4y2Ba生产后代。我们确定了25种初始化合物,当它们被添加到井中时,会产生比对照DMSO更多的子代。经过重新测试,11种化合物被证实可重复恢复gydF4y2Ba秀丽隐杆线虫gydF4y2Ba孢子存在时子代的产生(表gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba小分子抑制剂筛选示意图(见方法)。漂白同步L1动物与光谱收集的每种化合物60 μM在21°C下孵育6天gydF4y2Ban parisiigydF4y2Ba孢子。总共2560个化合物被筛选一次,产生25个初始命中。最初的撞击被重新测试了一次,产生了11个确认的撞击。然后使用WorMachine在筛选试验的多个重复中量化这11种化合物的有效性。使用Biorender.com制作的图。gydF4y2BaBgydF4y2Ba含有蠕虫的井的代表性图像。(gydF4y2BaB极左gydF4y2Ba)没有孢子的正常蠕虫生长。(gydF4y2BaB左中gydF4y2Ba)微孢子虫感染可抑制子代的产生。(gydF4y2BaB中间和极右gydF4y2Ba)用抗微孢子化合物处理可以恢复子代的生产。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba化合物对子代产量的影响(gydF4y2BaCgydF4y2Ba)感染和(gydF4y2BaDgydF4y2Ba)未受感染的动物(gydF4y2BangydF4y2Ba= 6)。子代水平表示为DMSO未感染对照组的百分比。统计显著性评估与DMSO对照使用双面gydF4y2BatgydF4y2Ba测试:* * *gydF4y2BapgydF4y2Ba< 0.001, **gydF4y2BapgydF4y2Ba< 0.01, *gydF4y2BapgydF4y2Ba< 0.05, ns =不显著(gydF4y2BapgydF4y2Ba> 0.05)。柱状图表示样本均值,误差柱状图表示与均值之间的+ /−1标准误差。源数据作为源数据文件提供。gydF4y2Ba
为了量化每种化合物的抑制作用,我们开发了一种半自动方法来量化液体培养中的子代数量(图2)。gydF4y2Ba1gydF4y2Ba,参见方法)。动物在如上所述的井中生长,用染料玫瑰孟加拉染色,并使用平板扫描仪成像。采用一致的参数对图像进行处理,突出染色动物,并使用WorMachine进行分析,检测并统计每孔动物数量(图2)。gydF4y2BaS1A-CgydF4y2Ba)gydF4y2Ba39gydF4y2Ba.使用WorMachine检测到的动物数量与手动计数的动物数量相关性良好(图2)。gydF4y2BaS1DgydF4y2Ba).此外,相关性良好(平均RgydF4y2Ba2gydF4y2Ba为0.71)。gydF4y2BaS1EgydF4y2Ba).这种方法类似于最近发表的一种方法,但优点是使用相对便宜的平板扫描仪进行成像gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.我们观察到,在感染条件下,11种化合物中的每一种都能显著增加动物产生的子代数量(图2)。gydF4y2Ba1 cgydF4y2Ba).考虑到其中六种化合物在未受感染的动物体内的子代产量显著减少,表明中等的宿主毒性,这种影响甚至更加明显(图2)。gydF4y2Ba1 dgydF4y2Ba).gydF4y2Ba
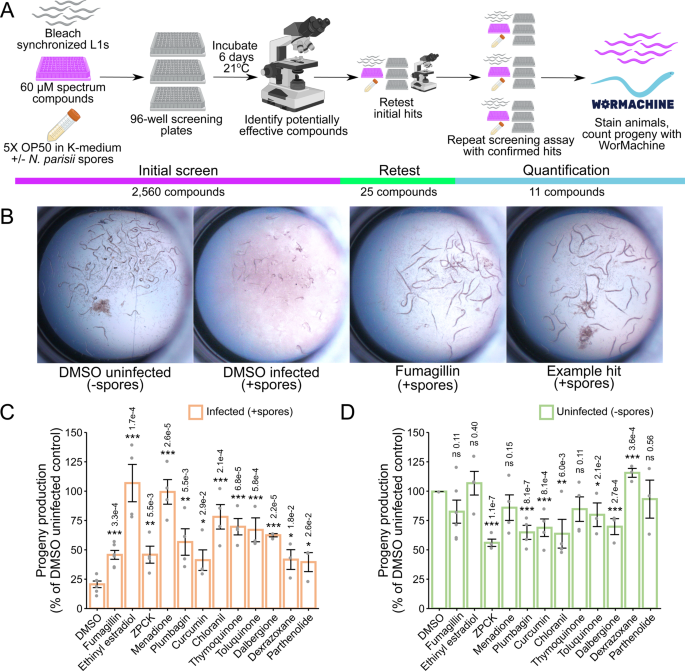
我们最初的筛选确定了可以挽救能力的化合物gydF4y2Ba秀丽隐杆线虫gydF4y2Ba在…的存在下产生后代gydF4y2Ban parisiigydF4y2Ba孢子。为了确定这些化合物是否对微孢子虫感染有直接影响,我们进行了连续感染试验。L1动物连续感染gydF4y2Ban parisiigydF4y2Ba孢子在化合物存在4天21gydF4y2BaogydF4y2BaC在24孔板液体中(图;gydF4y2Ba2gydF4y2Ba).孵育后,将动物固定,用直接黄96 (DY96)染色,这是一种荧光染料,可以结合几丁质,这是小孢子虫孢子壁和孢子壁的关键成分gydF4y2Ba秀丽隐杆线虫gydF4y2Ba胚胎(无花果。gydF4y2Ba2 bgydF4y2Ba)gydF4y2Ba22gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.首先,我们观察到每一种化合物都显著增加了含有胚胎的成年动物的比例gydF4y2Ban parisiigydF4y2Ba孢子(图。gydF4y2Ba2摄氏度gydF4y2Ba).这些结果与我们最初筛选的数据一致,表明在孢子存在的情况下,所有化合物都增加了子代产量(图2)。gydF4y2Ba1 cgydF4y2Ba).其次,我们确定对照抑制剂fumagillin和11种化合物中的9种抑制了微孢子虫感染,因为用这些化合物处理后,具有新形成孢子的动物比例显著降低(图2)。gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba连续感染试验示意图(见方法)。漂白同步L1动物与化合物在21°C下孵育4天gydF4y2Ban parisiigydF4y2Ba孢子在液体中。随后用丙酮固定动物,用DAPI(蓝色)和DY96(绿色)染色。使用Biorender.com制作的图。gydF4y2BaBgydF4y2Ba5倍放大的代表性图像;比例尺为500 μm。(gydF4y2BaB极左gydF4y2Ba)没有孢子的正常蠕虫生长。(gydF4y2BaB左中gydF4y2Ba)微孢子虫感染导致产生新的孢子,DY96以亮绿色显示,并减缓生长,从而阻止妊娠成虫的发育。(gydF4y2BaB中右和极右gydF4y2Ba)用抗微孢子化合物处理可减少新孢子的形成,并恢复妊娠成虫的发育。gydF4y2BaCgydF4y2Ba含有胚胎的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥200只动物)。gydF4y2BaDgydF4y2Ba含有新形成孢子的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥200只动物)。使用单向方差分析和Dunnett事后检验评估DMSO感染对照的显著性:gydF4y2Ba* * * pgydF4y2Ba< 0.001, **gydF4y2BapgydF4y2Ba< 0.01, *gydF4y2BapgydF4y2Ba< 0.05, ns =不显著(gydF4y2BapgydF4y2Ba> 0.05)。柱状图表示样本均值,误差柱状图表示与均值之间的+ /−1标准误差。源数据作为源数据文件提供。gydF4y2Ba
n parisiigydF4y2Ba增殖被右拉恶烷抑制gydF4y2Ba
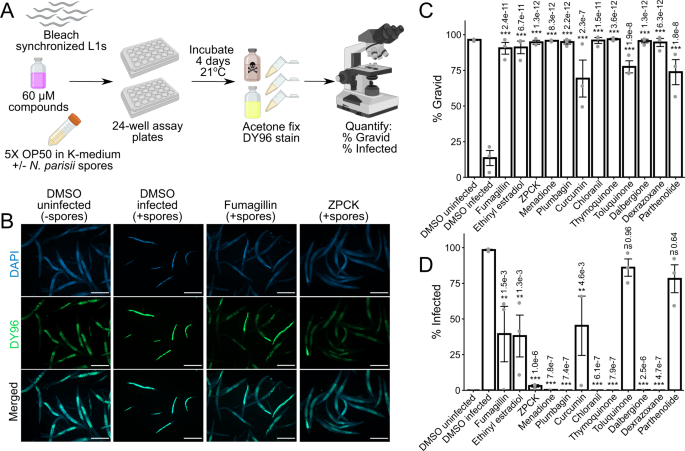
微孢子虫感染可以通过阻断入侵或在感染建立后防止增殖来抑制。为了区分这些可能性,我们在L1动物被感染的地方进行了脉冲追踪感染实验gydF4y2Ban parisiigydF4y2Ba孢子3小时,清洗以去除多余的孢子,并与化合物孵育4天(图。gydF4y2Ba3gydF4y2Ba).正如预期的那样,考虑到其作为MetAP2抑制剂的作用模式gydF4y2Ba17gydF4y2Ba,烟熏青霉素限用gydF4y2Ban parisiigydF4y2Ba扩散(无花果。gydF4y2Ba3 bgydF4y2Ba).令人惊讶的是,在我们的11种化合物中,只有一种,dexrazoxane,被抑制gydF4y2Ban parisiigydF4y2Ba扩散(无花果。gydF4y2Ba3 egydF4y2Ba).fumagillin和dexrazoxane都能在感染时恢复动物制造胚胎的能力,而其他化合物都不能这样做(图2)。gydF4y2Ba3 dgydF4y2Ba).浓度为60 μM时,dexrazoxane的效果尤其显著,其具有新形成孢子的动物比例减少了约1200倍,而在浓度为350 μM时,fumagillin仅减少了约2倍。gydF4y2Ba3 egydF4y2Ba).在此浓度下,我们观察到对未感染的动物没有负面影响(图。gydF4y2Ba1 dgydF4y2Ba).总之,这些结果表明,在我们筛选的化合物中,只有右拉恶烷具有抑制作用gydF4y2Ban parisiigydF4y2Ba入侵后gydF4y2Ba秀丽隐杆线虫gydF4y2Ba发生。gydF4y2Ba
一个gydF4y2Ba脉冲追踪感染试验示意图(见方法)。白化同步L1动物脉冲感染gydF4y2Ban parisiigydF4y2Ba孢子在21°C NGM板上培养3小时。将多余的孢子洗掉,感染的动物与化合物在21°C的液体中孵育2或4天。将动物固定在丙酮或PFA中,FISH染色,然后用DY96(绿色)和DAPI(蓝色)染色。使用Biorender.com制作的图。gydF4y2BaBgydF4y2Ba5倍放大下感染后4天丙酮固定动物的代表性图像;比例尺为500 μm。(gydF4y2BaB极左gydF4y2Ba)未受感染蠕虫的正常生长。(gydF4y2BaB左中gydF4y2Ba脉冲感染的结果是microB FISH探针用红色标出的孢子质和菱子体,DY96用亮绿色标出的新孢子。脉搏感染还会减缓生长,从而阻止妊娠成人的发育。(gydF4y2BaB中右和极右gydF4y2Ba)用烟马青霉素或dexrazoxane治疗脉冲感染的动物可减少孢子质和梅朗,减少新孢子,恢复妊娠成虫的发育。gydF4y2BaCgydF4y2Ba代表性图像(z-stack最大强度投影;7片,间隔0.25 μm) pfa固定动物感染后2天,63倍放大;比例尺为20 μm。(gydF4y2BaC左gydF4y2Ba)在没有药物治疗的情况下,受脉冲感染的动物会长出有许多核的大梅峰。(gydF4y2BaC中间gydF4y2Ba)烟马青霉素治疗抑制增殖;大的和小的都可以观察到。(gydF4y2BaC对吧gydF4y2Ba)右拉恶烷治疗抑制增殖;只有一个或两个核的小菱子被观察到。gydF4y2BaDgydF4y2Ba有胚胎的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥170只动物)。gydF4y2BaEgydF4y2Ba有新形成孢子的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥170只动物)。gydF4y2BaFgydF4y2Ba有FISH信号的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥170只动物)。方差分析不显著(gydF4y2BapgydF4y2Ba= 0.111)。gydF4y2BaGgydF4y2Ba每条蠕虫的FISH荧光定量(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复量化15只动物)。gydF4y2BaHgydF4y2Ba用BP螯合铁对感染的影响,以及用FAC补充铁对右拉恶烷活性的影响。有新形成孢子的动物百分比(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥120只动物)在连续感染4天后显示。使用单向方差分析和Dunnett事后检验评估DMSO感染对照的显著性:gydF4y2Ba* * * pgydF4y2Ba< 0.001, **gydF4y2BapgydF4y2Ba< 0.01, *gydF4y2BapgydF4y2Ba< 0.05, ns =不显著(gydF4y2BapgydF4y2Ba> 0.05)。柱状图表示样本均值,误差柱状图表示与均值之间的+ /−1标准误差。源数据作为源数据文件提供。gydF4y2Ba
为了确定dexrazoxane是否通过减缓增殖或增强寄生虫清除来抑制微孢子虫,我们使用特定的探针对脉冲追逐感染的动物进行FISH染色gydF4y2Ban parisiigydF4y2Ba18S RNA,在新孢子形成之前,观察感染早期阶段的孢浆和梅朗gydF4y2Ba27gydF4y2Ba.虽然烟熏青霉素和右拉恶烷都减少了新形成孢子的动物(图。gydF4y2Ba3 egydF4y2Ba),至少有一些FISH信号的动物比例没有显著差异(图。gydF4y2Ba3 fgydF4y2Ba).当gydF4y2Ba秀丽隐杆线虫gydF4y2Ba脉冲追踪感染了吗gydF4y2Ban parisiigydF4y2Ba48小时,观察到许多大的多核菱斑。用烟马青霉素治疗的蠕虫既含有许多核的大梅龙,也含有一些不能超过2个核的寄生细胞。相反,右拉恶烷处理导致几乎所有的寄生细胞含有1或2个核,许多寄生细胞显示不规则形态(图。gydF4y2Ba3 cgydF4y2Ba).使用fish染色的图像gydF4y2Ban parisiigydF4y2Ba,我们量化了被孢子体和梅朗覆盖的受感染动物的面积。我们观察到烟马西林和右拉恶烷治疗可显著降低病原体负荷,其中右拉恶烷效果最强(图。gydF4y2Ba3 ggydF4y2Ba).总之,这些结果表明,右拉恶烷可以极大地抑制gydF4y2Ban parisiigydF4y2Ba增殖,但不会导致感染被清除。gydF4y2Ba
右拉恶烷是一种铁螯合剂,铁水平已被证明会影响其他微孢子虫物种的生长gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba.来确定铁含量是否对gydF4y2Ban parisiigydF4y2Ba的增长gydF4y2Ba秀丽隐杆线虫gydF4y2Ba,我们补充我们的液体培养柠檬酸铁铵(FAC)作为水溶性铁源gydF4y2Ba46gydF4y2Ba,用低剂量孢子连续感染L1动物4天。虽然在补充条件下,具有新形成孢子的动物比例略高,但这种影响不具有统计学意义(图2)。gydF4y2BaS2AgydF4y2Ba).相比之下,添加FAC导致含有胚胎的动物比例小幅但显著增加(图2)。gydF4y2Ba开通gydF4y2Ba).为了确定右拉恶烷是否可能在我们的系统中充当铁螯合剂,我们测试了另一种铁螯合剂,2,2 ' -联吡啶(BP),在我们的连续感染试验中抗微孢子的活性,但没有观察到效果(图2)。gydF4y2Ba3 hgydF4y2Ba和gydF4y2BaS2CgydF4y2Ba).此外,补充FAC不能抵消右拉恶烷的抗微孢子作用(图。gydF4y2Ba3 hgydF4y2Ba和gydF4y2BaS2CgydF4y2Ba).我们还测试了gydF4y2Basmf-3 (ok1035)gydF4y2Ba突变株RB1074对右拉恶烷敏感。与野生型N2菌株相比,RB1074的铁含量减少了约50%,并且在用铁螯合剂BP处理后显示出显著的生长缺陷gydF4y2Ba46gydF4y2Ba.然而,用右拉恶烷治疗后,RB1074并没有表现出任何这样的生长障碍。gydF4y2BaS3gydF4y2Ba).综上所述,这些结果表明,右拉恶烷的抑制作用gydF4y2Ban parisiigydF4y2Ba感染可能独立于其作为铁螯合剂的既定功能。gydF4y2Ba
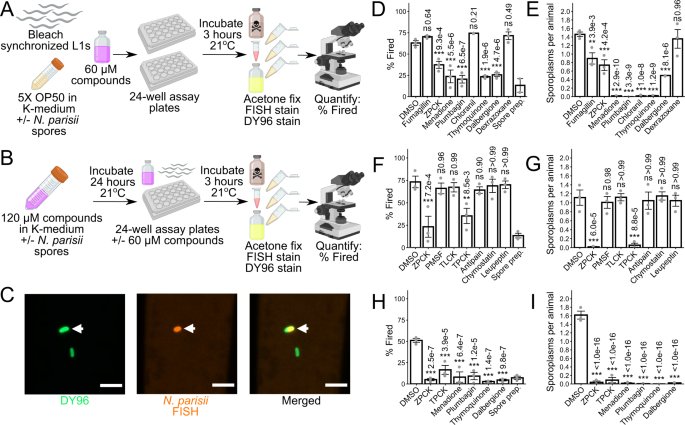
蛋白酶抑制剂和醌衍生物通过抑制孢子燃烧来防止入侵gydF4y2Ba
在连续感染实验中显示出较强抗小孢子虫感染活性的化合物,而在脉冲追赶感染中表现不明显的化合物,可能是通过抑制孢子发射来防止入侵的。在gydF4y2Ba秀丽隐杆线虫gydF4y2Ba,gydF4y2Ban parisiigydF4y2Ba孢子被摄入,并在肠道内触发孢子燃烧gydF4y2Ba27gydF4y2Ba,gydF4y2Ba47gydF4y2Ba.为了测试是否有任何化合物干扰这一过程,我们对连续感染试验中影响最强的7种化合物进行了孢子激发试验(图2)。gydF4y2Ba二维gydF4y2Ba).L1阶段gydF4y2Ba秀丽隐杆线虫gydF4y2Ba感染了gydF4y2Ban parisiigydF4y2Ba3 h后用FISH和DY96染色(图2)。gydF4y2Ba4gydF4y2Ba).这种双重染色使我们能够确定肠道中给定的孢子是否被点燃,基于它是否释放了它的孢子质(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).我们发现,用五种化合物(ZPCK, menadione, plumbagin,百里醌和dalbergione)处理导致肠道中燃烧孢子的比例显著降低(图。gydF4y2Ba4 dgydF4y2Ba).用这些化合物以及氯茴香处理,也会导致每只动物的孢质体数量显著减少(图2)。gydF4y2Ba4 egydF4y2Ba).抑制微孢子虫增殖的两种化合物,烟马青霉素和右拉唑烷,对孢子激发没有显著影响,尽管烟马青霉素处理确实导致孢子质数量显著减少(图2)。gydF4y2Ba4 d, EgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba孢子发射试验示意图(见方法)。漂白同步L1动物与化合物在21°C下孵育3小时gydF4y2Ban parisiigydF4y2Ba孢子在液体中。孢子准备控制是通过培养孢子在液体中,在没有gydF4y2Ba秀丽隐杆线虫gydF4y2Ba.动物和孢子固定在丙酮中,用microB FISH探针(红色)和DY96(绿色)染色。使用Biorender.com制作的图。gydF4y2BaBgydF4y2Ba改进的孢子发射试验原理图(见方法)。孢子与化合物在21°C下孵育24小时,然后用于感染海滩同步L1动物,无论是否事先清洗以去除多余的化合物。使用Biorender.com制作的图。gydF4y2BaCgydF4y2Ba63倍放大的未燃烧和燃烧孢子的代表图像;比例尺为5 μm。未燃烧的孢子用白色箭头表示。gydF4y2BaDgydF4y2Ba,gydF4y2BaEgydF4y2Ba微孢子虫抑制剂对(gydF4y2BaDgydF4y2Ba)中燃烧孢子的百分比gydF4y2Ba秀丽隐杆线虫gydF4y2Ba肠腔(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物复制计数≥60个孢子)和(gydF4y2BaEgydF4y2Ba)每只动物的平均孢质体数目(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba在孢子激发试验中,每个生物重复计数≥40只动物。gydF4y2BaFgydF4y2Ba,gydF4y2BaGgydF4y2Ba丝氨酸蛋白酶抑制剂对(gydF4y2BaFgydF4y2Ba)孢子发射和(gydF4y2BaGgydF4y2Ba)在感染前不洗去化合物的情况下,用改良的孢子激发试验检测孢子质入侵(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复计数≥39只动物和≥60个孢子,除了一个凝乳素重复,其中仅计数12只动物和19个孢子)。gydF4y2BaHgydF4y2Ba,gydF4y2Ba我gydF4y2Ba孢子激发抑制剂对(gydF4y2BaHgydF4y2Ba)孢子发射和(gydF4y2Ba我gydF4y2Ba)在改良的孢子激发试验中,感染前化合物被冲洗掉(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=≥40只动物,每个生物重复计数≥70个孢子)。使用单向方差分析和Dunnett事后检验评估与DMSO对照的显著性:***gydF4y2BapgydF4y2Ba< 0.001, **gydF4y2BapgydF4y2Ba< 0.01, *gydF4y2BapgydF4y2Ba< 0.05, ns =不显著(gydF4y2BapgydF4y2Ba> 0.05)。柱状图表示样本均值,误差柱状图表示与均值之间的+ /−1标准误差。源数据作为源数据文件提供。gydF4y2Ba
ZPCK是一种不可逆的丝氨酸蛋白酶抑制剂,而一种微孢子丝氨酸蛋白酶先前被认为参与了孢子的产生gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.以确定其他丝氨酸蛋白酶抑制剂是否可以预防gydF4y2Ban parisiigydF4y2Ba入侵时,我们测试了三种额外的小分子(TPCK, TLCK和PMSF)和三种肽(Antipain, Chymostatin和Leupeptin),在我们的孢子激发试验的修改版本中,已知抑制丝氨酸蛋白酶。在这些实验中,我们将孢子与丝氨酸蛋白酶抑制剂孵育24小时以增强其作用,然后用孢子感染L1期gydF4y2Ba秀丽隐杆线虫gydF4y2Ba在抑制剂存在的3小时(图;gydF4y2Ba4 bgydF4y2Ba).对每只动物的孢子燃烧比例和孢子质数量的分析表明,ZPCK和结构相关抑制剂TPCK都表现出强烈的抑制作用gydF4y2Ban parisiigydF4y2Ba孢子发射和侵入(图;gydF4y2Ba4 f, GgydF4y2Ba).gydF4y2Ba
抑制孢子发射可以通过抑制或抑制gydF4y2Ban parisiigydF4y2Ba孢子蛋白或gydF4y2Ba秀丽隐杆线虫gydF4y2Ba发射和入侵所必需的蛋白质。为了区分这些可能性,我们用每种抑制孢子激发的化合物孵育孢子24小时,洗掉多余的抑制剂,然后用处理过的孢子感染L1期gydF4y2Ba秀丽隐杆线虫gydF4y2Ba在没有抑制剂的情况下维持3小时(图;gydF4y2Ba4 bgydF4y2Ba).所有6种抑制剂(ZPCK, TPCK, menadione, plumbagin,百里醌和dalbergione)均显著抑制孢子发射和孢子质入侵(图2)。gydF4y2Ba4 h,我gydF4y2Ba).这些结果表明,所有这些抑制剂都直接作用于gydF4y2Ban parisiigydF4y2Ba在ZPCK和TPCK的情况下,这可能是通过抑制丝氨酸蛋白酶发生的。gydF4y2Ba
鉴定出的化合物抑制多种微孢子虫gydF4y2Ba
接下来,我们确定我们鉴定的化合物是否可以抑制其他微孢子虫的感染。除了被感染gydF4y2Ban parisiigydF4y2Ba,gydF4y2Ba秀丽隐杆线虫gydF4y2Ba也感染了gydF4y2BaPancytospora epiphagagydF4y2Ba.本种感染的表皮gydF4y2Ba秀丽隐杆线虫gydF4y2Ba属于肠细胞原虫分支,其中包括人类感染种gydF4y2BaVittaformae角膜gydF4y2Ba和gydF4y2BaEnterocytozoon bieneusigydF4y2Ba22gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.以确定右拉恶烷是否能抑制gydF4y2Bap . epiphagagydF4y2Ba增殖,我们感染了gydF4y2Ba秀丽隐杆线虫gydF4y2Ba使用FISH染色监测寄生虫的生长(图2)。gydF4y2Ba5gydF4y2Ba).当用350 μM烟马西林或60 μM右拉恶烷处理动物时,我们观察到的寄生虫明显少于未处理的对照动物,其中右拉恶烷处理动物的寄生虫生长最少(图2)。gydF4y2Ba5 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba白化同步L1动物脉冲感染gydF4y2Bap . epiphagagydF4y2Ba孢子在NGM板上培养3小时。洗去多余孢子,用350 μM烟马青霉素或60 μM右拉恶烷在21℃液体中孵育4 d。动物固定后用DAPI(蓝色)和FISH探针(红色)染色。gydF4y2Ba一个gydF4y2Ba感染后4天动物的代表性图像;比例尺为25 μm。gydF4y2BaBgydF4y2Ba每条蠕虫的FISH荧光定量(gydF4y2BangydF4y2Ba= 3,gydF4y2BaNgydF4y2Ba=每个生物重复在每种条件下量化15只动物)。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba细胞感染gydF4y2Ba答:algeraegydF4y2Ba孢子3小时与60德斯拉恶烷4天。gydF4y2BaCgydF4y2Ba被感染细胞用dapi(蓝色)、FISH(红色)和DY96(绿色)染色的代表图像;比例尺为5 μm。正在分裂的梅龙用箭头表示,目前没有分裂的梅龙用箭头表示。初次感染后孢子附着在细胞上,呈星形。gydF4y2BaDgydF4y2Ba平均数量gydF4y2Ba答:algeraegydF4y2Ba每细胞分裂数(gydF4y2BangydF4y2Ba= 2,gydF4y2BaNgydF4y2Ba=每个生物重复分析30-243个细胞)。gydF4y2BaEgydF4y2Ba宿主细胞活力(gydF4y2BangydF4y2Ba= 3)。对照和右拉恶烷处理条件的方差分析不显著(gydF4y2BapgydF4y2Ba= 0.325) (gydF4y2BaFgydF4y2Ba- - - - - -gydF4y2BaHgydF4y2Ba)用60 μM抑制剂处理大肠杆菌孢子24 h。孢子要么被诱导发射(gydF4y2BaFgydF4y2Ba)或用于感染细胞24小时,然后用FISH探针和DAPI染色(gydF4y2BaGgydF4y2Ba,gydF4y2BaHgydF4y2Ba).gydF4y2BaFgydF4y2Ba已完全萌发的孢子百分比(gydF4y2BangydF4y2Ba= 5,gydF4y2BaNgydF4y2Ba=每个生物复制计数≥100个孢子)。gydF4y2BaGgydF4y2Ba感染细胞的代表性图像gydF4y2Ba大肠intestinalisgydF4y2Ba未治疗或用ZPCK治疗的;比例尺为10 μm。微分干涉对比显微镜。gydF4y2BaHgydF4y2Ba受感染细胞百分比(gydF4y2BangydF4y2Ba= 4,gydF4y2BaNgydF4y2Ba=每个生物复制计数≥100个细胞)。使用单向方差分析和Dunnett事后检验评估与DMSO感染对照的显著性:***gydF4y2BapgydF4y2Ba< 0.001, **gydF4y2BapgydF4y2Ba< 0.01, *gydF4y2BapgydF4y2Ba< 0.05, ns =不显著(gydF4y2BapgydF4y2Ba> 0.05)。柱状图表示样本均值,误差柱状图表示与均值之间的+ /−1标准误差。源数据作为源数据文件提供。gydF4y2Ba
Anncaliia algeraegydF4y2Ba它可以感染蚊子和人类,属于微孢子虫的新孢子虫分支gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba.为了测试右拉恶烷是否也能阻止这种物种的抑制,我们感染了人成纤维细胞gydF4y2Ba答:algeraegydF4y2Ba并用FISH观察感染情况(图2)。gydF4y2Ba5度gydF4y2Ba).我们观察到寄生虫分裂抑制的显著剂量依赖反应(图2)。gydF4y2Ba5 dgydF4y2Ba).为了测试在阻止细胞生长的浓度下,右拉恶烷是否对细胞有毒性gydF4y2Ba答:algeraegydF4y2Ba增殖时,我们监测了细胞活力,并观察到在我们测试的浓度下没有明显的毒性(图。gydF4y2Ba5 egydF4y2Ba).gydF4y2Ba
Encephalitozoon intestinalisgydF4y2Ba感染人类和其他哺乳动物,属于微孢子虫的小孢子虫分支gydF4y2Ba50gydF4y2Ba,gydF4y2Ba52gydF4y2Ba.为了确定我们发现的化合物是否能阻止该物种的孢子燃烧,我们进行了预处理gydF4y2Ba大肠intestinalisgydF4y2Ba然后进行了体外孢子萌发试验,我们可以直接观察极性管发射。我们观察到,当用这些化合物预处理孢子时,萌发频率显著降低(图2)。gydF4y2Ba5 fgydF4y2Ba).为了测试这些化合物是否会影响宿主细胞感染,我们将Vero细胞与未处理或预先用每种化合物处理的孢子孵育,并监测FISH感染(图2)。gydF4y2Ba5克gydF4y2Ba).我们观察到,当细胞与经过化合物预处理的孢子孵育时,细胞基本上未受感染,这表明所有这些抑制剂也可以防止入侵(图2)。gydF4y2Ba5 hgydF4y2Ba).在ZPCK存在的情况下,我们发现了少量的单一入侵事件(图。gydF4y2Ba5克gydF4y2Ba),但不会复制寄生虫。我们的研究结果表明,我们发现的化合物可以抑制不同种类的微孢子虫。gydF4y2Ba
讨论gydF4y2Ba
为了确定微孢子虫的抑制剂,我们筛选了2560种化合物的能力,以抵消感染诱导gydF4y2Ba秀丽隐杆线虫gydF4y2Ba后代抑制。我们鉴定了11种具有可复制抑制活性的化合物(表gydF4y2BaS1gydF4y2Ba).我们发现右拉恶烷抑制gydF4y2Ban parisiigydF4y2Ba而蛋白酶抑制剂ZPCK和TLCK,以及4种醌衍生物,可以防止孢子燃烧和入侵(图2)。gydF4y2Ba6gydF4y2Ba).其中三种已确定的抑制剂,姜黄素、白花草素和百里醌,先前已被证明可以抑制微孢子虫感染,尽管在白花草素和百里醌的情况下,这些化合物在微孢子虫感染细胞后有效gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.这与我们的结果相反,这些化合物只能阻止微孢子虫的入侵。据我们所知,我们发现的其他化合物之前都没有被报道过可以预防微孢子虫感染,这证明了这种无偏倚方法识别新型微孢子虫抑制剂的价值。gydF4y2Ba
右拉恶烷是fda批准的用于预防癌症患者化疗药物引起的心肌病的药物gydF4y2Ba52gydF4y2Ba.右拉恶烷可以水解成一种类似于金属离子螯合剂乙二胺四乙酸的结构,被认为是通过减少铁与蒽环类化疗药物络合的量来起作用,从而减少由这种相互作用形成的超氧自由基的数量gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.铁是微孢子虫增殖的重要代谢产物。蜜蜂感染了gydF4y2Ban ceranaegydF4y2Ba是否铁含量降低而生长gydF4y2Ba大肠cuniculigydF4y2Ba在巨噬细胞中,随着铁的添加而促进,而在铁螯合剂的添加时被抑制gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba.鉴于dexrazoxane作为铁螯合剂的既定作用,它作为抗微孢子菌的机制似乎可能涉及将铁从孢质体和墨珠中隔离,从而剥夺了它们生长和感染进展所需的关键资源。然而,我们的研究结果并不支持这一点。无论是用铁螯合剂BP治疗,还是用FAC补充铁,都没有任何显著影响gydF4y2Ban parisiigydF4y2Ba感染。此外,右拉恶烷仍表现出强烈的抗微孢子作用gydF4y2Ba秀丽隐杆线虫gydF4y2Ba都暴露在gydF4y2Ban parisiigydF4y2Ba在高铁环境中。这些结果表明,右拉恶烷的抗微孢子特性不太可能是药物诱导改变铁稳态的结果。这与致死率形成对比gydF4y2Ba秀丽隐杆线虫gydF4y2Ba由致病菌引起gydF4y2Ba铜绿假单胞菌gydF4y2Ba我们的筛查中包括铁螯合剂环吡酮醇胺,但未观察到对其有影响gydF4y2Ban parisiigydF4y2Ba55gydF4y2Ba.铁螯合剂铁铁胺,它抑制gydF4y2Ba大肠cuniculigydF4y2Ba在巨噬细胞中,也被包括在我们的筛选中,但没有观察到对gydF4y2Ban parisiigydF4y2Ba45gydF4y2Ba.第二个提出的机制是对拓扑异构酶II的抑制gydF4y2Ba56gydF4y2Ba.然而,一些拓扑异构酶II抑制剂之前被用于gydF4y2Ba秀丽隐杆线虫gydF4y2Ba(依托泊苷、替尼泊苷、达替霉素和安司碱)被包括在我们最初的筛选中,但未观察到对其有活性gydF4y2Ban parisiigydF4y2Ba57gydF4y2Ba.右拉恶烷的阻滞作用机理gydF4y2Ban parisiigydF4y2Ba因此,扩散仍然难以捉摸。我们发现dexrazoxane可以阻止微孢子虫的增殖,其浓度对宿主的适应性没有显著影响。然而,我们确实观察到较高浓度对宿主毒性的趋势。已经产生了更多的dexrazoxane类似物,并且测试dexrazoxane类似物对宿主的毒性及其抑制微孢子虫的能力可以识别出更多的选择性化合物gydF4y2Ba58gydF4y2Ba.gydF4y2Ba
在微孢子虫中控制孢子燃烧的蛋白质是未知的gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba.虽然体内的点火信号是不确定的,但几种不同的pH值和盐条件可以在体外触发点火gydF4y2Ba59gydF4y2Ba.一旦微孢子孢子暴露在宿主信号下,孢子的渗透压就会增加,迫使极性管被挤压。一种假设的控制孢子激发的蛋白质是枯草菌素丝氨酸蛋白酶,它在整个微孢子中都是保守的gydF4y2Ba60gydF4y2Ba.这种蛋白质定位于的两极gydF4y2Ban bombycisgydF4y2Ba孢子和蛋白酶的激活版本定位到孢子的末端,极性管从那里发射gydF4y2Ba48gydF4y2Ba.在这里,我们发现两种不可逆的丝氨酸蛋白酶抑制剂(ZPCK和TPCK)可以阻止放电和防止入侵。此外,我们还发现了四种醌衍生物(麦地那酮、白花丹素、百里醌和达尔柏乔酮)也可以阻止发射和入侵。对于所有这六种孢子发射抑制剂,我们观察到,即使化合物在孢子预处理后被冲洗掉,发射仍然被阻止。这些结果表明,抑制剂可能直接作用于孢子以阻止发射,即使发射的触发器发生在宿主动物内部。由于孢子发射是入侵的第一步,阻断孢子发射是预防农业动物微孢子虫感染的一种有前途的潜在策略。gydF4y2Ba
的gydF4y2Ba秀丽隐杆线虫gydF4y2Ba/gydF4y2Ban parisiigydF4y2Ba该系统为揭示和鉴定新型微孢子虫抑制剂提供了强有力的工具。我们的方法是高通量,相对便宜,可扩展的,允许筛选更多样化的小分子文库gydF4y2Ba61gydF4y2Ba.我们的筛选是有利的,因为它是在野生型动物和病原体上进行的,并且通过基于宿主适应度的筛选,这种方法只识别具有最小宿主毒性的化合物gydF4y2Ba35gydF4y2Ba.gydF4y2Ba秀丽隐杆线虫gydF4y2Ba也感染了gydF4y2Bap . epiphagagydF4y2Ba,为在同一宿主中测试复合抑制对多种微孢子虫的特异性提供了机会gydF4y2Ba22gydF4y2Ba.我们发现的几种化合物也能抑制其他微孢子虫,证明了使用的力量gydF4y2Ban parisiigydF4y2Ba发现新型微孢子虫抑制剂。我们的研究结果证明,gydF4y2Ba秀丽隐杆线虫gydF4y2Ba这是一种非常有用的宿主,可用于确定在微孢子虫感染的哪个阶段识别的抑制剂起作用gydF4y2Ba23gydF4y2Ba.一些识别抑制剂靶点的策略已成功用于其他真核寄生虫,包括产生和测序耐抑制的寄生虫变体或通过热蛋白质组分析gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba.gydF4y2Ba秀丽隐杆线虫gydF4y2Ba也可能有助于未来的工作,以确定抑制靶点gydF4y2Ban parisiigydF4y2Ba使用这些方法。gydF4y2Ba
方法gydF4y2Ba
化学物质来源gydF4y2Ba
fda批准的化合物和天然产物的谱集来自MicroSource。为了重新测试和筛选后分析,从Sigma-Aldrich和MicroSource中获得单个化合物。gydF4y2Ba
秀丽隐杆线虫gydF4y2Ba菌株、维护和漂白同步gydF4y2Ba
动物按照前面描述的方式进行培养gydF4y2Ba65gydF4y2Ba.所有实验均采用野生型N2菌株进行gydF4y2Ba秀丽隐杆线虫gydF4y2Ba除非另有说明。的gydF4y2Basmf-3 (ok1035)gydF4y2Ba从CGC中获得突变株RB1074。为了生成与漂白同步的L1期动物,首先将L4期动物挑取到10 cm NGM板上,在21°C下生长~96 h。然后用M9将蠕虫从培养皿中洗去,用~4% NaClO / 1 M NaOH溶液处理1 - 3分钟以提取胚胎,然后用M9清洗。胚胎在M9中21°C孵育18-24 h,以便孵化。gydF4y2Ba
n parisiigydF4y2Ba菌株和孢子制备gydF4y2Ba
Nematocida parisiigydF4y2Ba孢子的制备如前所述gydF4y2Ba23gydF4y2Ba.简单地说,大量受感染的秀丽隐杆线虫被1毫米直径的氧化锆珠破坏(BioSpec Products Inc .)。然后将得到的裂解液通过5 μm过滤器(Millipore Sigma)。孢子制剂被证实不含任何污染细菌,并在−80°C保存。所有实验均用gydF4y2Ban parisiigydF4y2Ba应变ERTm1。gydF4y2Ba
96孔板筛选微孢子虫抑制剂gydF4y2Ba
秀丽隐杆线虫gydF4y2Ba液体培养方法和96孔平板筛选方法部分改编自已建立的协议gydF4y2Ba32gydF4y2Ba,gydF4y2Ba66gydF4y2Ba.gydF4y2Ban parisiigydF4y2Ba孢子按上述方法制备,混合于k介质(51 mM NaCl, 32 mM KCl, 3 mM CaCl2, 3 mM MgSO4, 3.25 μM胆固醇)和5倍饱和OP50-1中gydF4y2Ba大肠杆菌gydF4y2Ba,分别加入到96孔培养板中。96孔光谱收集板从-80°C解冻。使用V&P Scientific 96孔固定工具,将300 nL DMSO溶解化合物固定在筛选板柱2-11中,300 nL DMSO固定在筛选板柱1和12中,用于DMSO感染、DMSO未感染和烟抑菌素对照。如上所述制备漂白同步l1,在k介质中与5倍饱和OP50-1混合gydF4y2Ba大肠杆菌gydF4y2Ba,并添加到筛选板。每孔最终体积为50 μL,约100 l1,gydF4y2Ban parisiigydF4y2Ba最终浓度为6250孢子/μL, DMSO最终浓度< 1%,除烟熏青霉素(所有实验均以350 μM浓度使用)外,其他化合物的最终浓度为60 μM。将筛选板覆盖有黏性的多孔膜,置于包有伞膜的湿度箱中,在21℃下孵育,以180转/分钟的转速震动6天。孵育后,通过目测筛选板人工评分子代产量。在最终浓度为60 μM的DMSO中重悬单个化合物,以同样的方式重新筛选初始命中物的重现性。通过再筛选的化合物的抑制作用在单独的实验中量化,使用下面描述的半自动方法。gydF4y2Ba
子代生产的半自动量化gydF4y2Ba
用化合物+ /−处理与漂白同步的l1gydF4y2Ban parisiigydF4y2Ba孢子在96孔板制备和孵化如上所述。为每个生物重复的每种条件检测三个孔。孵育后,用Integra VIAFLO 96电子移液器向每孔中加入0.3125 mg/mL玫瑰孟加拉溶液10 μL,对动物进行染色。将培养皿包裹在伞状膜中,在37℃下孵育16-24小时。每孔添加240 μL M9 + 0.1% Tween-20。然后在2200 x g下离心1分钟。再取200 μL,每孔加入150 μL M9 + 0.1% Tween-20。每孔取25 μL转入96孔白色板,每孔含300 μL M9。使用Epson perfect V850 Pro平板扫描仪成像,参数如下(dpi = 4800,颜色= 24位,。jpg压缩= 1)。在GIMP版本2.10或更高版本中编辑图像,通过删除HTML颜色代码#000000和#FFC9AF来突出显示染色动物,使用以下参数(半径= 10,效果= 10,阈值= 10)应用非锐化掩蔽,使用以下参数编辑色调饱和度(对于黄色、绿色、蓝色和蓝绿色:明度= 100,饱和度=−100。 For red and magenta: lightness = −100, saturation = 100), and exporting each well as a single.tiff image with LZW compression67gydF4y2Ba.使用基于matlab的表型分析工具WorMachine计算每个孔中的动物数量,参数如下(像素邻域阈值= 1,像素二值化阈值= 30,最大要去除的对象面积= 0.003%)gydF4y2Ba39gydF4y2Ba.gydF4y2Ba
持续感染试验gydF4y2Ba
连续感染实验在24孔板中进行,每孔最终容积为400 μL, ~800 L1s, 5000gydF4y2Ban parisiigydF4y2Ba孢子/μL,除烟抑菌素(见上)外,各化合物均为60 μM, DMSO的终浓度为1%。对每种化合物进行3个生物重复的3个孔检测。检测板覆盖有粘接性多孔膜,放置在parfilm包裹的湿度箱中,在21°C, 180 rpm下孵育4天,并在4°C, 20 rpm下保存1-2天。孵育后,样品丙酮固定,dy96染色,并进行荧光显微镜观察,如下所述。gydF4y2Ba
脉搏感染测定gydF4y2Ba
~8000个漂白同步l1和1000万gydF4y2Ban parisiigydF4y2Ba孢子以10 μL 10x OP50-1加入6 cm NGM板中。板在干净的柜子中干燥,在室温下孵育3小时。脉冲感染后,用1 mL M9 + 0.1%吐温-20将动物清洗1 -2倍以去除多余的孢子,然后添加到上述制备的24孔透明检测板中进行连续感染试验,除非不添加任何孢子。对每种化合物进行3个生物重复的3个孔检测。除潜伏期为2天或4天外,检测板按连续感染试验所述处理。样品孵育4天,丙酮固定,fish染色,dy96染色;样品孵育2天,4% PFA固定,fish染色。荧光显微镜检查如下所示。gydF4y2Ba
孢子发射试验gydF4y2Ba
24孔实验板的制备与连续感染实验完全相同gydF4y2Ban parisiigydF4y2Ba最终浓度为5000孢子/μL,除烟熏青霉素(见上)外的化合物的最终浓度为60 μM, DMSO的最终浓度为1%。在所有含TPCK的孢子激发实验中,以10,000个孢子/μL的浓度,在含120 μM化合物和2% DMSO的k介质中,在21℃下孵育24 h。然后用这些孢子制备与连续感染试验完全相同的测定板,最终浓度如上所述。在感染前去除多余化合物的所有孢子激发实验中,孢子在用于检测板制备前用1ml K-medium洗涤3次。对每种化合物进行3个生物重复的3个孔检测。用多孔胶膜覆盖检测板,置于包有伞膜的湿度箱中,在21°C下孵育,以180转/分钟的速度振荡3小时。孵育后,样品丙酮固定,fish染色,dy96染色,荧光显微镜观察,如下所述。gydF4y2Ba
铁的螯合和补充gydF4y2Ba
24孔实验板的制备与连续感染实验完全相同gydF4y2Ban parisiigydF4y2Ba最终浓度为5000个孢子/μL(正常剂量)或78个孢子/μL(低剂量)、2,2 ' -联吡啶(BP)或右拉恶烷(60 μM)、水溶性柠檬酸铁铵(FAC) (6.6 mg/mL)、DMSO(1%)。分析板按所述处理进行连续感染分析。孵育后,样品丙酮固定,dy96染色,并进行荧光显微镜观察,如下所述。gydF4y2Ba
RB1074药敏试验gydF4y2Ba
用120 μL 10x op50 - 1,2,2′-联吡啶基(BP)或右拉恶烷(drazoxane),终浓度为60 μM, DMSO,终浓度为1%,将约1000个RB1074或N2同步漂白l1加入6 cm NGM板中。平板在干净的柜子中室温下干燥约1小时,然后在21℃下孵育3天。孵育后,活体动物使用徕卡微系统解剖镜成像。gydF4y2Ba
DY96染色,荧光原位杂交(FISH),镜检gydF4y2Ba
孵育后,样品用1 mL M9 + 0.1% Tween-20清洗1 -2倍除去多余的OP50,固定于700 μL丙酮中-20℃保存,或固定于500 μL PFA溶液(4% PFA, 1倍PBS, 0.1% Tween-20)中4℃保存,待后续步骤进行。然后用1ml 1xPBS + 0.1% Tween-20冲洗1 -2次,用1ml杂交缓冲液(900 mM NaCl, 20 mM Tris HCl, 0.01% SDS)冲洗1次。加入100 μL FISH染色液(杂交缓冲液中5 ng/μL FISH探针),46℃孵育18-24 h。的gydF4y2Ban parisiigydF4y2Ba使用与Cal Fluor Red 610 (LGC Biosearch Technologies)结合的18S rrna特异性microB FISH探针(ctctcggcactccttcctg)gydF4y2Ba27gydF4y2Ba.FISH孵育后,用1 mL洗涤缓冲液(50 mL杂交缓冲液+ 5 mM EDTA)清洗样品1次,去除多余的FISH探针。加入500 μL DY96染色液(20 μ g/µL DY96, 0.1% SDS in 1xPBS + 0.1% Tween-20), 21℃孵育1小时。DY96培养后,样品悬浮于EverBrite中gydF4y2BaTMgydF4y2Ba使用DAPI安装介质,并使用ZEISS Axio Imager 2在5x-63x放大倍率下使用ZEISS Zen 2.3进行荧光显微镜观察。连续感染试验省略FISH染色步骤,直接用DY96染色。gydF4y2Ba
FISH荧光定量gydF4y2Ba
FISH荧光定量采用FIJI version 2.1.0gydF4y2Ba68gydF4y2Ba.根据DAPI染色勾勒边界确定动物面积。FISH信号的最小荧光阈值设置为4000,以排除胚胎的自动荧光和背景染色,同时最大限度地包括FISH染色gydF4y2Ban parisiigydF4y2Ba孢子体和菱子体。计算FISH信号所覆盖的动物面积百分比。gydF4y2Ba
p . epiphagagydF4y2Ba感染分析gydF4y2Ba
孢子的gydF4y2Bap . epiphagagydF4y2Ba菌株JUm1396与gydF4y2Ban parisiigydF4y2Ba.对于感染,约8000个漂白同步l1和8000万个gydF4y2Bap . epiphagagydF4y2Ba孢子以4 μL 10X OP50-1加入6 cm NGM板中。在室温下将平板干燥并孵育3小时。脉冲感染后,用M9 + 0.1%吐温-20冲洗动物2倍以去除多余的孢子,然后加入透明的24孔检测板。井的总体积为400 μL K-medium + 5倍OP50-1,混合约800只蠕虫。在井中加入DMSO,最终浓度为1%,加入烟熏青霉素,最终浓度为350 μM,加入右拉恶烷,最终浓度为60 μM。用多孔胶膜覆盖检测板,放置在有伞膜包裹的湿度箱中,在21°C, 180 rpm下孵育4天。样品固定在4%的PFA中,用5 ng/μL的FISH探针对样品进行FISH染色gydF4y2Bap . epiphagagydF4y2Ba18S RNA (CAL Fluor Red 610- ctcttatactgtgcgcacgg)。荧光显微镜和定量的FISH荧光进行了所述gydF4y2Ban parisiigydF4y2Ba感染。gydF4y2Ba
测定右拉恶烷对gydF4y2Ba答:algeraegydF4y2Ba细胞分裂gydF4y2Ba
答:algeraegydF4y2Ba如前所述,从培养基中收集孢子,用无菌水清洗以去除宿主细胞gydF4y2Ba69gydF4y2Ba.人成纤维细胞(Human Fibroblasts, HFF) (ATCC SCRC-1041)以5 × 10的密度播种于覆盖物上gydF4y2Ba4gydF4y2BaMEM培养基中添加10%灭活胎牛血清,2 mM谷氨酰胺,2.5 μg.mLgydF4y2Ba−1gydF4y2Ba两性霉素B, 100 μg mLgydF4y2Ba−1gydF4y2Ba链霉素,100 U.mLgydF4y2Ba−1gydF4y2Ba青霉素25 μg.mLgydF4y2Ba−1gydF4y2Ba庆大霉素,37°C, 5% CO加湿gydF4y2Ba2gydF4y2Ba的气氛。一旦达到汇合点,用1 × 10感染细胞gydF4y2Ba6gydF4y2Ba孢子的gydF4y2Ba答:algeraegydF4y2Ba1小时。用培养基洗涤3次后,感染细胞在含0、15、30、60或120µM右拉恶烷的培养基中30°C孵育30-35 h。进行两个生物重复,每个重复检测2或3个覆盖层。在- 20°C甲醇固定过夜后,使用特异的cy3标记探针对寄生虫进行fish染色gydF4y2Ba答:algeraegydF4y2Ba,按照所描述的协议gydF4y2Ba69gydF4y2Ba.用DAPI和DY96染色。使用蔡司Axio Imager 2显微镜计算每个感染宿主细胞中的梅龙数量,以评估Dexrazoxane对寄生虫分裂的影响。每个感染细胞的分裂数由以下公式获得:(当前正在分裂的梅龙数× 2) +(当前未分裂的梅龙数−1)。gydF4y2Ba
测定右拉恶烷的细胞毒性gydF4y2Ba
HFF细胞在96孔微孔板中,密度为gydF4y2Ba10gydF4y2Ba4gydF4y2Ba细胞/孔置于上述培养基中,37℃,5% CO加湿gydF4y2Ba2gydF4y2Ba大气大约48小时达到合流。然后将培养基替换为含有不同浓度的右拉恶烷(15、30、60和120µM)的新鲜培养基。阴性对照(仅使用培养基的细胞)和阳性对照(在培养基中稀释20% DMSO的细胞)也包括在内。每种条件分别进行3个独立实验,每个实验6口井。如前所述,用四氮唑染料MTT评价了右拉恶烷的细胞毒性gydF4y2Ba69gydF4y2Ba.简单地说,细胞在37°C和5% CO下与或不与右拉恶烷孵育48小时gydF4y2Ba2gydF4y2Ba.每孔加入22 μL MTT标记试剂(终浓度0.5 mg/mL, Sigma-Aldrich),在湿润气氛(例如,37°C, 5% CO)中孵育2小时gydF4y2Ba2gydF4y2Ba).去除介质后,用100 μl的增溶液(DMSO:异丙醇(1:1))将紫色甲醛晶体增溶到每孔中。在550nm (Multiscan FC, ThermoScientific)测量了甲醛产品的吸光度。gydF4y2Ba
大肠intestinalisgydF4y2Ba孢子繁殖和准备gydF4y2Ba
EgydF4y2Ba.gydF4y2BaintestinalisgydF4y2Ba(ATCC 50506)在Vero细胞(ATCC CCL-81)中培养,使用Dulbecco 's Modified Eagle 's Medium,含有高葡萄糖(DMEM),补充非必需氨基酸(1X)和10%热灭活胎牛血清(FBS), 37°C和5% COgydF4y2Ba2gydF4y2Ba.在70%-80%合流时,将寄生虫加入75 cmgydF4y2Ba2gydF4y2Ba将组织培养瓶和培养基换成添加3%胎牛血清的DMEM。让细胞生长10天,每两天更换一次培养基。为纯化孢子,用细胞刮板将感染细胞从组织培养瓶中分离,放入15 ml锥形管中,1300 ×离心gydF4y2BaggydF4y2Ba在25°C下放置10分钟。细胞在无菌DPBS中重悬,用G-27针机械中断。使用Percoll梯度对释放的孢子进行纯化。等量(5ml)孢子悬浮液和100% Percoll加入15 mL锥形管中,涡旋,1800 ×离心gydF4y2BaggydF4y2Ba室温30分钟。纯化后的孢子球用无菌DPBS洗涤三次,并在不连续的Percoll梯度中进一步纯化。简单地说,孢子球在2 mls无菌DPBS中重悬,并分层到10 ml四层percoll梯度上(2.5 mls 100% percoll, 2.5 mls 75% percoll, 2.5 mls 50% percoll, 2.5 mls 25% percoll),以8600 ×离心gydF4y2BaggydF4y2Ba仔细收集分离到第四层(100% percoll)的孢子,在10 mls无菌DPBS中以3000 ×清洗两次gydF4y2BaggydF4y2Ba纯化的孢子球保存在无菌DPBS中,4°C,用于进一步分析。gydF4y2Ba
肠球菌萌发及感染试验gydF4y2Ba
纯化gydF4y2Ba大肠intestinalisgydF4y2Ba孢子(2.3 × 10gydF4y2Ba7gydF4y2Ba孢子)用终浓度为60µM的化合物或终浓度为0.6%的DMSO处理。对于孢子激发和感染性试验,孢子与化合物在室温下孵育24小时。gydF4y2Ba
极性管萌发测定用纯化的0.3µlgydF4y2Ba大肠intestinalisgydF4y2Ba孢子放置在聚l -赖氨酸处理载玻片上,并允许短暂风干。接下来,加入3 μ l预热的发芽缓冲液(140 mM NaCl, 5 mM KCl, 1 mM CaClgydF4y2Ba2gydF4y2Ba, 1mm MgClgydF4y2Ba2gydF4y2Ba, 5% (v/v) HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BapH值9.5)添加到载玻片中,并用#1.5 18 × 18 mm的盖片密封。在向孢子中添加萌发缓冲液后30秒至1分钟内发生PT放电。PT发射在蔡司Elyra 7显微镜上进行成像,使用蔡司C-Apochromat 40x/1.2水物镜和Dual PCO。Edge 4.2 sCMOS摄像头。所有成像均在37℃进行。以0.12 μ m间距收集Z层。萌发孢子被定义为极性管被释放的孢子。每种条件下至少计数100个孢子。gydF4y2Ba
为了测量传染性,Vero细胞生长在直径为12毫米、#1.5的覆盖物上,并用孢子感染24小时。细胞在4% PFA PBS-T (0.1% Tween 20)中室温固定45分钟,然后进行FISH处理。在安装之前,细胞用NucBlue染色以显示宿主和寄生虫DNA。盖片使用ThermoScientific公司的extend Diamond anti - fade技术安装在载玻片上,并密封。所有样本均在尼康W1旋转盘共聚焦显微镜上成像,配有尼康Apo 60×1.40油物镜和双Andor 888 Live EMCCD摄像机。以0.3 μ m间距收集Z层。每种条件下至少计数100个细胞。gydF4y2Ba
统计分析gydF4y2Ba
所有统计分析均使用Microsoft Excel 365和R 3.6.1或更高版本,通过RStudio 1.2.5019或更高版本访问gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba.gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
评估论文结论所需的所有数据均在论文、补充材料和源数据文件中。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
杨晓明,杨晓明,张晓明,张晓明,杨晓明。微孢子虫物种属性数据库的建立与微孢子虫广泛的生态和表型多样性分析。gydF4y2BamBiogydF4y2Ba12gydF4y2Ba, e0149021(2021)。gydF4y2Ba
Wadi, L. & Reinke, A. W.微孢子虫的进化:一个极其成功的真核细胞内寄生虫群。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba16gydF4y2Ba, e1008276(2020)。gydF4y2Ba
斯坦蒂福德,g.d.,费斯特,s.w.,斯通,d.m.,贝特曼,k.s.和邓恩,a.m.。微孢子虫:水生系统中多样的、动态的和突发的病原体。gydF4y2BaParasitol趋势。gydF4y2Ba29gydF4y2Ba, 567-578(2013)。gydF4y2Ba
控制的科学进展gydF4y2Ba微孢子虫gydF4y2Ba(gydF4y2Ba小孢子虫目gydF4y2Ba)蜜蜂的感染情况(gydF4y2Ba的蜜蜂gydF4y2Ba).gydF4y2Ba前面。兽医。科学。gydF4y2Ba6gydF4y2Ba, 79(2019)。gydF4y2Ba
Chaijarasphong, T.等人。虾微孢子虫肝对虾肠细胞虫(EHP):生物学、病理、诊断与防治。gydF4y2Baj . Invertebr。病理学研究。gydF4y2Ba186gydF4y2Ba, 107458(2020)。gydF4y2Ba
丁,Z.等。塘养中华绒螯蟹肝胰腺坏死病首例与微孢子虫相关。gydF4y2Baj .鱼。说。gydF4y2Ba39gydF4y2Ba, 1043-1051(2016)。gydF4y2Ba
巴特,i.a.,布赫罗,Z. &巴特,m.a.蚕微孢子病,特别是桑蚕(Bombyx Mori L.)。gydF4y2BaInt。j . Entomol。Res。gydF4y2Ba2gydF4y2Ba, 01-09(2017)。gydF4y2Ba
Picard-Sánchez, A.等。Gilthead Sea鲷(Sparus aurata)的嗜核肠孢子虫(微孢子虫):自然感染中的病理效应和细胞免疫反应。gydF4y2Ba兽医。病理学研究。gydF4y2Ba57gydF4y2Ba, 565-576(2020)。gydF4y2Ba
肯特,M. L.,艾略特,D. G.,格罗夫,J. M. & Hedrick, R. P.海水饲养的银鲑(原生动物:小孢子虫)感染。gydF4y2Ba水产养殖gydF4y2Ba80gydF4y2Ba, 211-222(1989)。gydF4y2Ba
希恩等人。亚洲虾的生产和疾病的经济成本。亚洲水产科学31S,(2018)。gydF4y2Ba
阮,Y.等。关于哺乳动物、鸟类和水中微孢子虫全球流行率的最大规模荟萃分析为了解这些无处不在的病原体的流行特征提供了见解。gydF4y2Ba寄生虫向量gydF4y2Ba14gydF4y2Ba, 186(2021)。gydF4y2Ba
Ostroverkhova N. V, Konusova, O. L., Kucher, A. N., Kireeva, T. N. & Rosseykina, S. A.微孢子虫在北亚一些生态区域蜜蜂种群(蜜蜂)中的流行。gydF4y2Ba兽医。科学。gydF4y2Ba7gydF4y2Ba, 111(2020)。3.gydF4y2Ba
Stentiford, g.d.等人。微孢子虫-全球食物链中的新兴病原体。gydF4y2BaParasitol趋势。gydF4y2Ba32gydF4y2Ba, 336-348(2016)。gydF4y2Ba
卡兹尼尔森,H.和贾米森,C. A.用烟熏青霉素控制蜜蜂小孢子虫病。gydF4y2Ba科学gydF4y2Ba115gydF4y2Ba, 70-71(1952)。gydF4y2Ba
黄,W.-F。,Solter, L. F., Yau, P. M. & Imai, B. S. Nosema ceranae Escapes Fumagillin Control in Honey Bees.公共科学图书馆Pathog。gydF4y2Ba9gydF4y2Ba, e1003185(2013)。gydF4y2Ba
唐,K. F. j。凡纳滨对虾粪便中表现出白色粪便综合征的小孢子虫肝对虾肠细胞虫(EHP)的密集种群及其传播途径gydF4y2Baj . Invertebr。病理学研究。gydF4y2Ba140gydF4y2Ba, 1-7(2016)。gydF4y2Ba
van den Heever, J. P., Thompson, t.s., Curtis, J. M., Ibrahim, A. & Pernal, S. F. Fumagillin:最近的科学进展及其对养蜂的意义的概述。gydF4y2Baj·阿格利司。食品化学。gydF4y2Ba62gydF4y2Ba, 2728-2737(2014)。gydF4y2Ba
韩,B. & Weiss, L. M.治疗人类微孢子虫病的治疗靶点。gydF4y2Ba专家。当今。其他。目标gydF4y2Ba22gydF4y2Ba, 903-915(2018)。gydF4y2Ba
何琪,李奇,李志强,李志强,李志强,李志强。硝苯地平、甲硝唑和一氧化氮供体对小肠和颅内微孢子虫孢子萌发和细胞培养感染的影响。gydF4y2BaAntimicrob。代理Chemother。gydF4y2Ba40gydF4y2Ba, 179-185(1996)。gydF4y2Ba
Didier, E. S.等。体外抗菌孢子活性化合物的筛选。gydF4y2Ba叶形线ParasitologicagydF4y2Ba45gydF4y2Ba, 129-139(1998)。gydF4y2Ba
Borges, D., Guzman-Novoa, E. & Goodwin, P. H.使用营养和免疫刺激化合物控制蜜蜂(Apis mellifera)中的微孢子寄生虫Nosema ceranae。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba15gydF4y2Ba, e0227484(2020)。gydF4y2Ba
张,G.等。一大批新型感染线虫的微孢子虫及其与秀丽隐杆线虫和其他相关线虫的不同相互作用。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba12gydF4y2Ba, e1006093(2016)。gydF4y2Ba
威利斯,a.r.等人。父母对微孢子虫感染的转录反应诱导后代的遗传免疫。gydF4y2Ba科学。睡觉。gydF4y2Ba7gydF4y2Ba, eabf3114。(2021)。gydF4y2Ba
Bakowski, m.a.等人。线虫对微孢子虫和病毒感染的泛素介导反应。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba10gydF4y2Ba, e1004200(2014)。gydF4y2Ba
Reinke, a.w., Balla, K. M. Bennett, E. J. & Troemel, E. R.微孢子虫宿主暴露蛋白的鉴定揭示了一个快速进化的蛋白库。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 14023(2017)。gydF4y2Ba
埃斯蒂斯,K. A., Szumowski, S. C. & Troemel, E. R.线虫肠细胞非溶性、肌动蛋白为基础的细胞内寄生虫出口。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba7gydF4y2Ba, e1002227(2011)。gydF4y2Ba
Troemel, e.r., Félix, m.a。,Whiteman, N. K., Barrière, A. & Ausubel, F. M. Microsporidia Are Natural Intracellular Parasites of the Nematode Caenorhabditis elegans.公共科学图书馆杂志。gydF4y2Ba6gydF4y2Ba, e309(2008)。gydF4y2Ba
bala, K. M., Luallen, R. J., Bakowski, M. A. & Troemel, E. R.微孢子虫的细胞间传播导致秀丽隐杆线虫器官形成合胞体。11.大自然。gydF4y2Ba微生物学gydF4y2Ba1gydF4y2Ba, 1-6(2016)。gydF4y2Ba
Luallen, R. J.等人。在秀丽隐杆线虫中发现一种具有广泛组织趋向性的天然微孢子病原体。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba12gydF4y2Ba, e1005724(2016)。gydF4y2Ba
Ewbank, J. J. & Zugasti, o.c.秀丽隐杆线虫:模型宿主和抗微生物药物发现的工具。gydF4y2Ba分离模型。机制gydF4y2Ba4gydF4y2Ba, 300-304(2011)。gydF4y2Ba
Peterson, N. D. & Pukkila-Worley, r.c elegans在抗感染化合物的高通量筛选中。gydF4y2Ba咕咕叫。当今。Immunol。gydF4y2Ba54gydF4y2Ba, 59-65(2018)。gydF4y2Ba
伯恩斯,a.r.等人。秀丽隐杆线虫是驱虫研究的有用模型。1.gydF4y2BaCommun Nat。gydF4y2Ba6gydF4y2Ba, 7485(2015)。gydF4y2Ba
Anastassopoulou, C. G. Fuchs, B. B. & Mylonakis, E.秀丽隐杆线虫抗真菌药物发现的模型系统。gydF4y2Ba咕咕叫。制药。Des。gydF4y2Ba17gydF4y2Ba, 1225-1233(2011)。gydF4y2Ba
Mylonakis, E., Ausubel, F. M., Perfect, J. R., Heitman, J. & Calderwood, S. B.用新型隐球菌杀灭秀丽隐杆线虫作为酵母发病机制的模型。gydF4y2Ba国家科学院学报美国gydF4y2Ba99gydF4y2Ba, 15675-15680(2002)。gydF4y2Ba
莫伊,t.i.等人。利用活体动物感染模型鉴定新型抗菌素。gydF4y2Ba国家科学院学报美国gydF4y2Ba103gydF4y2Ba, 10414-10419(2006)。gydF4y2Ba
莫伊,t.i.等人。利用全动物感染模型高通量筛选新型抗菌剂。gydF4y2BaACS化学。医学杂志。gydF4y2Ba4gydF4y2Ba, 527-533(2009)。gydF4y2Ba
O 'Reilly, L. P., Luke, C. J., Perlmutter, D. H., Silverman, G. A. & Pak, s.c.c elegans在高通量药物发现。gydF4y2Ba放置药物。Deliv。牧师。gydF4y2Ba0gydF4y2Ba, 247-253(2014)。gydF4y2Ba
卢艾伦,R. J., Bakowski, M. a . & Troemel, E. R.微孢子虫诱导发育停滞的特征和跨膜富亮氨酸重复蛋白在秀丽隐杆线虫。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba10gydF4y2Ba, e0124065(2015)。gydF4y2Ba
哈基姆等人。WorMachine:基于机器学习的蠕虫表型分析工具。gydF4y2BaBMC医学杂志。gydF4y2Ba16gydF4y2Ba, 8(2018)。gydF4y2Ba
Wittkowski, P., Violet, N., Oelgeschläger, M., Schönfelder, G. & Vogl, S.一种定量中通量测定秀丽隐杆线虫发育和繁殖的方法。gydF4y2Ba明星。Protoc。gydF4y2Ba1gydF4y2Ba, 100224(2020)。gydF4y2Ba
Wittkowski, P.等人。秀丽隐杆线虫作为一种有前途的环境化学混合物效应评价替代模型的比较研究。gydF4y2BaEnv。科学。抛光工艺。gydF4y2Ba53gydF4y2Ba, 12725-12733(2019)。gydF4y2Ba
Mathew, m.d., Mathew, N. D. & Ebert, P. R. WormScan:用于秀丽隐杆线虫高通量表型分析的技术。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Ba, e33483(2012)。gydF4y2Ba
Vávra J,拉尔森JIR。2014.微孢子虫的结构,p. 1-70。在小孢子虫目。约翰威利父子有限公司gydF4y2Ba
Rodríguez-García, C.等。转铁蛋白介导的铁隔离为控制蜜蜂小孢子虫病提供了一种新的治疗策略。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba17gydF4y2Ba, e1009270(2021)。gydF4y2Ba
Didier, E. S.等。在体外和体内,巨噬细胞介导的活性氮和活性氧以及铁的固存有助于控制小孢子虫(门)感染。gydF4y2Ba微生物感染。gydF4y2Ba12gydF4y2Ba, 1244-1251(2010)。gydF4y2Ba
拉詹,等人。在秀丽隐杆线虫中,NHR-14功能的丧失通过PQM-1信号传导将肠道铁摄取与先天免疫耦合。gydF4y2BaeLifegydF4y2Ba8gydF4y2Ba, e44674(2019)。gydF4y2Ba
Tamim El Jarkass, H.等人。肠道分泌的宿主因子限制细菌定植,但促进微孢子虫入侵秀丽隐杆线虫。gydF4y2BabioRxivgydF4y2Ba2021.07.12.452088。(2021)。gydF4y2Ba
Dang, x等。微孢子虫家蚕微孢子虫枯草菌素样蛋白酶顶端定位的鉴定。gydF4y2Baj . Invertebr。病理学研究。gydF4y2Ba112gydF4y2Ba, 166-174(2013)。gydF4y2Ba
Yavelow, J., Caggana, M. & Beck, K. a .发生在细胞膜上的蛋白酶:鲍曼-伯克型蛋白酶抑制剂的可能细胞受体。gydF4y2Ba癌症Res。gydF4y2Ba47gydF4y2Ba, 1598-1601(1987)。gydF4y2Ba
Bojko, J.等。微孢子虫:一种新的分类学、进化和生态学综合。gydF4y2BaParasitol趋势。gydF4y2Bas1471 - 4922gydF4y2Ba, 00110-6(2022)。gydF4y2Ba
魏斯,L. M. & Takvorian, P. M.阿尔及利亚anncalia。gydF4y2BaParasitol趋势。gydF4y2Ba37gydF4y2Ba, 762-763(2021)。gydF4y2Ba
赖克哈特,P.,塔朋,M.-D。,Mora, J., Morland, B. & Jones, R. L. Risk–benefit of dexrazoxane for preventing anthracycline-related cardiotoxicity: re-evaluating the European labeling.未来的杂志。gydF4y2Ba14gydF4y2Ba, 2663-2676(2018)。gydF4y2Ba
右拉恶烷用于降低蒽环类药物诱导的心脏毒性。gydF4y2Ba专家。Rev. Cardiovascular Ther。gydF4y2Ba6gydF4y2Ba, 1311-1317(2008)。gydF4y2Ba
哈西诺夫,B. B.右拉恶烷及其类似物的化学。gydF4y2BaSemin。肿瘤防治杂志。gydF4y2Ba25gydF4y2Ba, 3-9(1998)。gydF4y2Ba
Kirienko, n.v.等人。铜绿假单胞菌破坏秀丽隐杆线虫铁稳态,引起缺氧反应和死亡。gydF4y2Ba细胞宿主微生物gydF4y2Ba13gydF4y2Ba, 406-416(2013)。gydF4y2Ba
邓,等。催化拓扑异构酶II抑制剂dexrazoxane在癌细胞中诱导DNA断裂、ATF3和DNA损伤反应。gydF4y2BaBr。j .杂志。gydF4y2Ba172gydF4y2Ba, 2246-2257(2015)。gydF4y2Ba
兹德拉耶维奇,S.等人。单一氨基酸替代的自然变异是拓扑异构酶II中毒的生理反应的基础。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba13gydF4y2Ba, e1006891(2017)。gydF4y2Ba
Jirkovská, A.等。右拉恶烷类似物的构效关系研究表明,ICRF-193由于其强拓扑异构酶IIβ相互作用,是抗蒽环类药物对心肌细胞毒性最强的双二氧哌嗪类药物。gydF4y2Ba医学。化学。gydF4y2Ba64gydF4y2Ba, 3997-4019(2021)。gydF4y2Ba
韩,B. Takvorian, P. M. & Weiss, L. M.微孢子虫对宿主细胞的入侵。gydF4y2Ba前面。Microbiol。gydF4y2Ba11gydF4y2Ba, 172(2020)。gydF4y2Ba
Tamim El Jarkass, H. & Reinke, A. W.宿主-微孢子虫在入侵、增殖和退出过程中的相互作用。gydF4y2Ba细胞。Microbiol。gydF4y2Ba22gydF4y2Ba, e13247(2020)。gydF4y2Ba
威尔逊,B. A. P.,索恩伯格,C. C.,亨利克,C. J.,格尔科维奇,T. & O 'Keefe, B. R.创建和筛选天然产品库。gydF4y2BaNat。产品。代表。gydF4y2Ba37gydF4y2Ba, 893-918(2020)。gydF4y2Ba
Rosenberg, A., Luth, M. R., Winzeler, E. A., Behnke, M. & Sibley, L. D.体外耐药性的进化揭示了刚地弓形虫青蒿素活性的机制。gydF4y2BaPNASgydF4y2Ba116gydF4y2Ba, 26881-26891(2019)。gydF4y2Ba
考威尔,a.n.等人。利用体外进化和化学基因组学研究疟疾寄生虫的药物基因组。gydF4y2Ba科学gydF4y2Ba359gydF4y2Ba, 191-199(2018)。gydF4y2Ba
Herneisen, A. L.等。利用热蛋白质组分析鉴定弓形虫抗寄生化合物的靶点。gydF4y2BaACS化学。医学杂志。gydF4y2Ba15gydF4y2Ba1801-1807(2020)。gydF4y2Ba
路易斯,J. A.弗莱明,J. T.基本培养方法。gydF4y2Ba方法细胞生物学。gydF4y2Ba48gydF4y2Ba, 3-29(1995)。gydF4y2Ba
Lehner, B., Tischler, J. & Fraser, a . G. 96孔液体格式的秀丽隐杆线虫RNAi筛选及其在遗传相互作用系统识别中的应用。3.gydF4y2BaProtoc Nat。gydF4y2Ba1gydF4y2Ba, 1617-1620(2006)。gydF4y2Ba
GIMP开发团队,2018。GIMP。gydF4y2Bahttps://www.gimp.orggydF4y2Ba.gydF4y2Bahttps://www.gimp.org/gydF4y2Ba.2021年9月3日检索。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
Prybylski, N.等人。蓖麻毒素B凝集素样蛋白在微孢子虫脑原虫和阿尔及利亚Anncaliia阿尔及利亚参与宿主细胞入侵。gydF4y2BaParasitol。Int。gydF4y2Ba87gydF4y2Ba, 102518(2022)。gydF4y2Ba
微软公司,2021年。Microsoft Excel。gydF4y2Bahttps://office.microsoft.com/excelgydF4y2Ba.gydF4y2Bahttps://www.microsoft.com/en-ca/microsoft-365/excelgydF4y2Ba.2021年9月3日检索。gydF4y2Ba
R Core Tam, 2021年。R:用于统计计算的语言和环境。gydF4y2Bahttps://wwwR-project.orggydF4y2Ba.gydF4y2Bahttps://www.r-project.org/gydF4y2Ba.2021年9月3日检索。gydF4y2Ba
RStudio团队,2020年。RStudio: R的集成开发。gydF4y2Bahttps://rstudio.comgydF4y2Ba.gydF4y2Bahttps://rstudio.com/gydF4y2Ba.2021年9月3日检索。gydF4y2Ba
确认gydF4y2Ba
我们感谢Hala Tamim El Jarkass和Alexandra R. Willis对手稿提供了有益的评论,并感谢Hala Tamim El Jarkass为图中的插图。gydF4y2Ba6gydF4y2Ba.这项工作得到了加拿大自然科学和工程研究委员会本科生研究奖(B.M.)的支持,加拿大卫生研究所no. 1。400784(给A.R.), 173448(给P.R.)和313296(给P.R.),合作药物研究中心试点项目基金(给A.R.),康诺特新研究员奖(给A.R.),阿尔弗雷德·p·斯隆研究奖学金FG2019-12040(给A.R.),加拿大研究主席奖(给P.R.),皮尤生物医学学者,Pew -00033055(给G.B.), Searle学者计划,SSP-2018-2737(给G.B.), NIAID R01AI147131(给G.B.), NIGMS R35GM128777(给D.C.E.)。一些菌株是由美国国立卫生研究院研究基础设施项目办公室(P40 OD010440)资助的CGC提供的,我们感谢WormBase。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
b.m., j.k., a.r.和P.R.设计了抑制剂筛选。所有的实验都是用gydF4y2Ban parisiigydF4y2Ba.W.Z.和A.R.设计了gydF4y2Bap . epiphagagydF4y2Ba由W.Z.进行实验。A.D.和h.e.a设计并实施了gydF4y2Ba答:algeraegydF4y2Ba实验。na, d。e。和g。b。设计了gydF4y2Ba大肠intestinalisgydF4y2Ba由N.A.进行实验。B.M.和A.R.分析了数据,并与所有作者共同撰写了这篇论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Maria Anete Lallo和其他匿名评审员对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Murareanu, b.m.,安涛,n.v.,赵伟。gydF4y2Baet al。gydF4y2Ba高通量小分子筛选鉴定微孢子虫入侵和增殖抑制剂gydF4y2Ba秀丽隐杆线虫gydF4y2Ba.gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 5653(2022)。https://doi.org/10.1038/s41467-022-33400-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33400-ygydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba