文摘gydF4y2Ba
非酒精性脂肪肝炎),常见的临床疾病,正在成为肝细胞癌(HCC)的主要原因。双特异性磷酸酶22 (DUSP22,也称为JKAP或JSP-1)表示在许多组织在免疫反应中扮演重要的生物功能和肿瘤的生长。然而,DUSP22对纳什的影响仍然未知。在这里,我们发现明显降低DUSP22表达在人类和小鼠脂肪肝,是由活性氧(ROS)生成。Hepatic-specific DUSP22删除特别加重脂质沉积,炎症反应在肝纤维化,促进纳什和非酒精脂肪肝(NAFLD)相关肝癌进展。相比之下,转基因表达,慢病毒或腺相关病毒(AAV)介导DUSP22基因疗法显著抑制NASH-related表型和肝癌发展的老鼠。我们提供机械的证据表明DUSP22直接与粘着斑激酶(FAK)和抑制其磷酸化Tyr397 (Y397)和Y576 + Y577残留物,随后禁止下游激活细胞外signal-regulated激酶1/2 (ERK1/2)和核factor-κB (NF-κB)级联。绑定DUSP22 FAK和去磷酸化的FAK DUSP22-meliorated纳什发展是不可或缺的。总的来说,我们的研究结果确定DUSP22 NASH-HCC的主要抑制器,并强调DUSP22-FAK轴作为一个有前途的治疗目标疾病的治疗。gydF4y2Ba
介绍gydF4y2Ba
非酒精性脂肪肝炎通常遵循简单的肝脂肪变性在非酒精性脂肪肝病(NAFLD)影响~ 40%的成年人口,近几十年来,其患病率急剧上升gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba。纳什正在成为终末期肝脏疾病的主要致病启动子,如肝癌和肝衰竭gydF4y2Ba3gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。纳什的致病过程特点是肝脂肪变性,肝细胞膨胀,小叶炎症和纤维化gydF4y2Ba5克ydF4y2Ba。此外,纳什通常伴随着代谢异常,包括高血糖、肥胖和2型糖尿病(T2D)gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8 gydF4y2Ba。不过,没有通过有效的调药的治疗纳什治疗目前,这很大程度上归因于一个不完整的对其发病机制的理解gydF4y2Ba9gydF4y2Ba。目前,基因疗法如体内和体外基因治疗已成为关注的焦点在hepatosteatosis的规定。作为体内基因传递的一个向量,AAV-mediated基因置换、基因沉默、基因,基因编辑已经表现出极大的成功在临床前和临床情况下gydF4y2Ba10gydF4y2Ba,AAV-mediated基因超表达有望成为一种有效的治疗以减轻肝脂肪变性和炎症在纳什gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba。体外细胞的基因治疗涉及转基因以外的身体产生疗效的因素和其后续移植回患者或收件人的动物gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba。我们最近报道,体外基因therapy-mediated Trim31功能几乎缓解严重的恶化和进展性脂肪肝与非酒精性脂肪肝小鼠的表型gydF4y2Ba15gydF4y2Ba。因此,更好地了解纳什发病机理和确定治疗目标是迫切需要的关键。gydF4y2Ba
几个分子事件被激活代谢压力下导致肝脂肪变性,如核因子κB (NF-κB)和增殖蛋白激酶(MAPK)信号,它表现出多种功能在细胞生存和死亡,葡萄糖和脂类代谢,meta-inflammationgydF4y2Ba16克ydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。Dual-specificity磷酸酶(DUSPs),包括MAPK磷酸酶,调解各种下游激酶的活化通过丝氨酸、苏氨酸、酪氨酸去磷酸化gydF4y2Ba19gydF4y2Ba。DUSP22(也称为JKAP或JSP-1),作为一个非典型DUSP,有规范的酪氨酸蛋白磷酸酶(PTP)签名主题,gydF4y2BaHCXXGXXRgydF4y2Ba87 - 94,在残留。DUSP22可以调节MAPK信号转导和各种类型的组织和细胞中表达,证明DUSP22可能调节几个至关重要的生物事件,如炎症反应和肿瘤细胞增殖gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba。DUSP22已被证明特别和积极调节物激活在哺乳动物细胞。小鼠胚胎成纤维细胞与DUSP22不足无法调解物激活TNF-a或者TGF治疗gydF4y2Ba23gydF4y2Ba。然而,最近越来越多的研究也报道称,DUSP22调节许多其他信号级联的基质gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba。例如,DUSP22函数作为脱去磷酸酪氨酸磷酸酶和灭活粘着斑激酶(FAK),抑制细胞的能动性gydF4y2Ba21gydF4y2Ba。此外,DUSP22直接脱去磷酸在Y394 Lck残留物,使其失去活性,导致t细胞免疫应答的镇压,炎症和自身免疫性疾病gydF4y2Ba26gydF4y2Ba。由于广泛的影响DUSP22 MAPKs激活,炎症——和fibrosis-associated疾病或反应,我们推测,可能有一个潜在的功能性DUSP22参与NASH发病机理和相关肝细胞癌。然而,这个假设支持数据在很大程度上是未知的。gydF4y2Ba
在目前的研究中,我们表明,DUSP22显著减少脂肪肝的肿瘤组织中,纳什的个人和NAFLD-HCC患者与正常细胞相比。Hepatocyte-specific DUSP22淘汰赛明显加速了纳什和肝癌的发展多个鼠标模型通过促进肝脏脂肪变性、炎症和纤维化;然而,DUSP22超表达肝细胞显著缓解严重恶化纳什和相关肝细胞癌的老鼠。从力学上看,细胞内DUSP22证明直接与FAK和抑制其磷酸化酪氨酸残基Y397 Y576 + Y577,从而抑制hyperactivation ERK1/2和NF-κB信号通路在代谢的挑战。这些结果说明DUSP22纳什是一个有前途的抑制和肝癌,并维持肝DUSP22可能作为一种新的治疗策略治疗纳什和脂肪liver-associated hepatocarcinogenesis。gydF4y2Ba
结果gydF4y2Ba
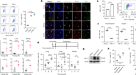
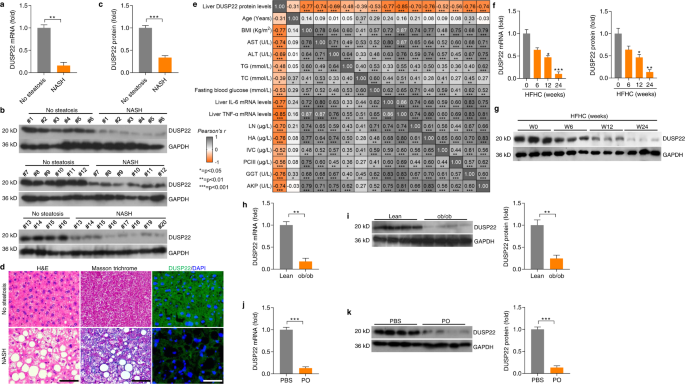
DUSP22是脂肪肝的表达下调gydF4y2Ba
几个DUSPs家庭成员报告了调解的发展高脂肪饮食引起的非酒精性脂肪肝(HFD)gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29日gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31日gydF4y2Ba。在我们目前的工作,高通量定量PCR (HTqPCR)分析首先执行检查的表达变化25 DUSPs家庭成员的开发过程中患者的肝脏病理纳什纳什和高脂引起的肝脂肪变性的小鼠模型+高胆固醇饮食(饲料)gydF4y2Ba32gydF4y2Ba。DUSP8,在所有这些分析DUSPs DUSP3 DUSP12, DUSP14, DUSP16, DUSP22,和DUSP26显著降低肝脏中纳什的患者明显的肝细胞膨胀,严重的炎性浸润,肝纤维化与正常个体的模式。类似的表达变化这些DUSPs家庭成员被发现在HFHC-fed小鼠的肝脏。更多的西方墨点法和RT-qPCR结果表明,在这些影响DUSPs, DUSP22 NASH患者是最严重的受感染小鼠模型,证明了其明显的蛋白和基因表达水平最低(补充图。gydF4y2Ba1模拟gydF4y2Ba和无花果。gydF4y2Ba1模拟gydF4y2Ba)。DUSP12,此外,与DUSP3相比,DUSP8 DUSP14, DUSP16, DUSP26,肝DUSP22显示密切负相关蛋白表达水平与体重指数(BMI)、血清总胆固醇(TC)、γ-glutamyl转肽酶(GGT)、空腹血糖、碱性磷酸酶(AKP)、胶原IV型(IVC)和层粘连蛋白(LN)的内容,和肝脏NASH患者il - 6基因表达(补充图。gydF4y2Ba2 fgydF4y2Ba和补充图。gydF4y2Ba3 a -gydF4y2Ba)。正如所料,多元线性回归和培生多个相关分析证实了负相关肝DUSP22蛋白表达与纳什严重性(无花果。gydF4y2Ba1 egydF4y2Ba)。一致,明显降低DUSP22 mRNA和蛋白表达水平观察老鼠的肝脏与饲料24周,和ob / ob小鼠比正常小鼠的食物饮食(非传染性疾病)和精益组织,分别(无花果。gydF4y2Ba外:我1gydF4y2Ba)。这些发现表明,在所有DUSPs家庭成员,DUSP22大幅减少是引起人类和小鼠纳什模型。gydF4y2Ba
一个gydF4y2Ba肝脏RT-qPCR分析DUSP22 mRNA水平的个体没有(没有脂肪变性;gydF4y2BangydF4y2Ba与纳什= 16)或(gydF4y2BangydF4y2Ba= 20)(* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba代表西方墨点法分析(gydF4y2BabgydF4y2Ba)和量化(gydF4y2BacgydF4y2Ba)DUSP22蛋白表达在肝脏的个体没有(没有脂肪变性;gydF4y2BangydF4y2Ba与纳什= 16)或(gydF4y2BangydF4y2Ba= 20)(* * *gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba。gydF4y2BadgydF4y2Ba肝脏部分从个人没有()或与纳什(下)沾)(左),马森三色的(中间)和免疫荧光(右)考试DUSP22表达式(绿色)(gydF4y2BangydF4y2Ba= 8每组10为每个样本图像;酒吧、规模50µm)。gydF4y2BaegydF4y2Ba皮尔森之间的多重相关所有参数索引收集从脂肪变性和纳什的个人(gydF4y2BangydF4y2Ba每个参数= 36)。橙色显示负相关,灰色显示积极的颜色相关性;强烈的颜色音调识别相关性最强。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba分析gydF4y2BafgydF4y2BaRT-qPCR和gydF4y2BaggydF4y2Ba西方墨点法DUSP22信使rna和蛋白质含量,分别在WT C57BL / 6 n小鼠的肝脏喂养饲料周(表示时间的gydF4y2BangydF4y2Ba每组)(* = 3gydF4y2BaPgydF4y2Ba< 0.05和* * *gydF4y2BaPgydF4y2Ba< 0.001和表达式HFHC-0周组)。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba分析gydF4y2BahgydF4y2BaRT-qPCR和gydF4y2Ba我gydF4y2Ba西方墨点法DUSP22信使rna和蛋白质含量,分别在精益或ob / ob小鼠的肝脏(gydF4y2BangydF4y2Ba每组)= 4 (* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba分析gydF4y2BajgydF4y2BaRT-qPCR和gydF4y2BakgydF4y2Ba西方墨点法DUSP22信使rna和蛋白质含量,分别在孤立的原发性肝细胞组织或阿宝治疗宾夕法尼亚州(0.4毫米和0.8毫米OA) 24小时(gydF4y2BangydF4y2Ba每组)= 4 (* * *gydF4y2BaPgydF4y2Ba< 0.001)。数据表示为均值±SEM从至少三个独立的实验。统计分析,gydF4y2Baa、c、hgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba是由双尾学生的gydF4y2BatgydF4y2Ba以及;gydF4y2BafgydF4y2Ba和gydF4y2BaggydF4y2Ba由单向方差分析。gydF4y2Ba
建立体外模型脂质积累,细胞受到订单,由棕榈酸(PA)、油酸(OA)gydF4y2Ba33gydF4y2Ba。我们证实小鼠原发性肝细胞表现出显著降低DUSP22表达式在阿宝治疗(图。gydF4y2Ba1 jgydF4y2Ba和k)。确认DUSP22表达变化与血脂异常和炎症代谢压力下,我们下建造了一个特殊的体外模型使用人类肝细胞co-treated L02细胞条件培养基(CM)含有血清从纳什收集受试者血清(纳什)或无脂肪变性科目(无脂肪变性血清)。正如预期的那样,从纳什CM-containing血清主题显著增加脂质沉积和细胞内甘油三酯(TG)含量L02细胞(补充图。gydF4y2Ba3 i (kgydF4y2Ba)。明显更高水平的促炎细胞因子和趋化因子,包括TNF-α,il - 6,地震,MCP-1纳什血清中发现的比无脂肪变性组。重要的是,我们发现各种pro-steatotic刺激(包括TNF-α、il - 6和有限合伙人)大幅抑制DUSP22表达式(补充图。gydF4y2Ba3 l和mgydF4y2Ba)。gydF4y2Ba
鉴于DUSP22表达显著变化在脂肪肝,那时一个体外模型建立使用adenovirus-mediated shDUSP22击倒(Ad-shDUSP22)和adenovirus-mediated DUSP22过度(Ad-DUSP22)向量最初调查监管DUSP22对肝脂肪变性的影响从纳什CM-containing血清L02细胞培养中或No-steatosis个体,首先DUSP22删除或超表达无显著影响的表达改变其他DUSPs(补充图。gydF4y2Ba4 ggydF4y2Ba)。然后我们发现从纳什主题导致血清脂质和细胞内TG L02细胞中积累,这是,然而,由Ad-shDUSP22明显加速,伴随着加重炎性分子的基因表达(补充图。gydF4y2Ba4 h-jgydF4y2Ba)。相反,DUSP22过度大大改善纳什serum-caused L02细胞脂质沉积,炎症反应(补充图。gydF4y2Ba4为gydF4y2Ba)。NASH患者血清中也表现出更高的TGF-β1浓度比无脂肪变性的(补充图。gydF4y2Ba4 ngydF4y2Ba)。肝脂肪变性刺激TGF-β1强烈表达下调DUSP22表达L02细胞(补充图。gydF4y2Ba4 ogydF4y2Ba期间),指示的潜在参与DUSP22纤维化。我们后来发现,在人类肝星状细胞(HSC)行LX2, CM来自纳什serum-treated L02细胞纤维化标志物的表达明显增加,包括α-SMA COL1A1, COL3A1, CTGF, Ad-shDUSP22这些影响明显加剧,而被Ad-DUSP22显著减轻(补充图。gydF4y2Ba4 p和qgydF4y2Ba)。此外,HTqPCR试验表明,纳什serum-caused共有128个基因表达变化介导炎症(87个基因)和脂质代谢基因(25)L02细胞和纤维化(16基因)由Ad-DUSP22 LX2细胞逆转(补充图。gydF4y2Ba4 rgydF4y2Ba)。这些体外发现最初展示的抑制性影响DUSP22脂质沉积,炎症和纤维化,从而揭示出DUSP22可能拥有纳什治疗潜力的治疗。gydF4y2Ba
DUSP22表达式是减少活性氧的生产gydF4y2Ba
因为ROS产生潜在pro-steatotic中介和肝脏中纳什的动物模型gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba因此,我们介绍了活性氧清除剂N-acetyl-cysteine (NAC) HFHC-induced纳什的小鼠模型。一致,24周饲料喂养导致肝ROS生产大幅增加,MDA, HgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba内容,这几乎是改善NAC合并施打,连同明显获救抗氧化酶SOD活动(补充图。gydF4y2Ba5 a egydF4y2Ba)。值得注意的是,HFHC-restrained DUSP22表达式大大恢复了NAC(补充图。gydF4y2Ba5 fgydF4y2Ba)。皮尔森相关分析进一步披露DUSP22表达式和H之间的负相关gydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba内容在HFHC-fed老鼠的肝脏(补充图。gydF4y2Ba5克gydF4y2Ba和h)。检查如果ROS生产导致几个关键NASH-associated DUSPs在肝脂肪变性,减少小鼠原发性肝细胞受到hgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba刺激。RT-qPCR结果表明H DUSP22更敏感gydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba刺激与其他DUSPs相比,施加一个明显时间依赖方式(补充图。gydF4y2Ba5我gydF4y2Ba)。然后我们发现DUSP22蛋白表达水平逐渐下降6 - 48 h, hgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2BaNAC暴露后治疗时明显恢复(补充图。gydF4y2Ba5 jgydF4y2Ba和k)。正如所料,NAC孵化显著恢复DUSP22表达PO-incubated主肝细胞(补充图。gydF4y2Ba5 lgydF4y2Ba)。在一起,上面的研究结果表明,活性氧产量在纳什病态的差别主要是负责对这些DUSP22。gydF4y2Ba
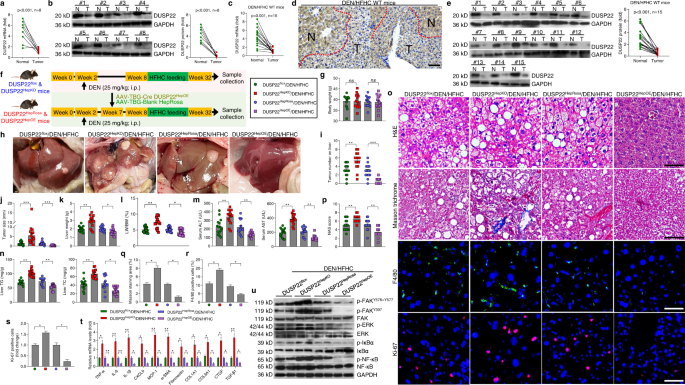
Hepatocyte-specific DUSP22淘汰赛加剧HFHC-induced纳什病态gydF4y2Ba
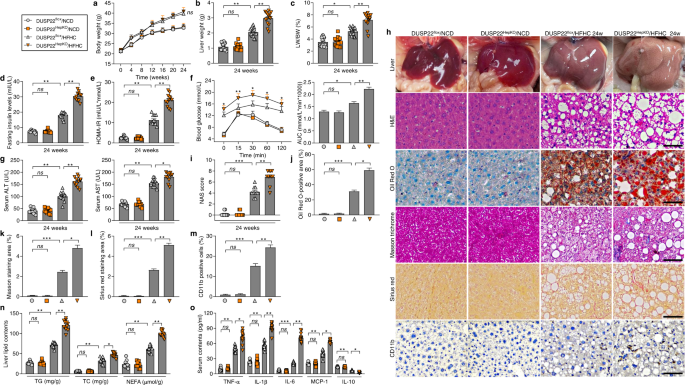
由于势函数DUSP22脂肪肝,hepatocyte-specific DUSP22-knockout (DUSP22gydF4y2BaHepKOgydF4y2Ba)老鼠然后生成。免疫印迹结果证实DUSP22淘汰赛并不影响其他DUSPs(补充图的表达变化。gydF4y2Ba6 fgydF4y2Ba)。在NCD-feeding状态从0至24周开始,DUSP22gydF4y2BaHepKOgydF4y2Ba没有出现任何NASH-related肝表型与DUSP22相比gydF4y2Ba液氧gydF4y2Ba老鼠,表示的肝组织学结构相似,血清ALT和AST浓度,TNF-α,IL-1β内容,肝脏TG, TC水平(补充图。gydF4y2Ba6 g-jgydF4y2Ba)。这里,没有自发的肝DUSP22表型gydF4y2BaHepKOgydF4y2Ba鼠标菌株。随后,DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠受到24周饲料喂养调查是否DUSP22消融导致肝脂肪变性过程。饲料的挑战后,DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠施加更高的肝脏重量和liver-to-body重量(LW / BW)比DUSP22比例gydF4y2Ba液氧gydF4y2Ba观察组和无显著差异在两组之间的体重变化(图gydF4y2Ba2 a - cgydF4y2Ba)。HFHC-fed DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠还显示更高的空腹血胰岛素水平和稳态模型评估胰岛素抵抗比DUSP22 (HOMA-IR)值gydF4y2Ba液氧gydF4y2Ba老鼠(图。gydF4y2Ba二维gydF4y2Bae),葡萄糖耐量试验(GTT)证实DUSP22葡萄糖耐量降低gydF4y2BaHepKOgydF4y2Ba老鼠与DUSP22相比gydF4y2Ba液氧gydF4y2Ba后的饲料喂养(无花果。gydF4y2Ba2 fgydF4y2Ba)。肝脏功能障碍引起的饲料是DUSP22明显加速gydF4y2BaHepKOgydF4y2Ba老鼠DUSP22相比gydF4y2Ba液氧gydF4y2Ba证明的集团,促进血清ALT和AST浓度(无花果。gydF4y2Ba2 ggydF4y2Ba)。此外,饲料喂养后,DUSP22gydF4y2BaHepKOgydF4y2Ba的老鼠表现出强烈的肝脂肪变性,强化肝脏外观变化,与膨胀和microvesicular脂肪变性肝细胞损伤,NAS分数)染色,油红O染色脂质沉积,典型的小叶和pericellular纤维化马森三色的和天狼星红染色(图。gydF4y2Ba2 h lgydF4y2Ba和补充图。gydF4y2Ba7一个gydF4y2Ba)。一致,DUSP22gydF4y2BaHepKOgydF4y2Ba小鼠呈现显著加速肝脏炎症,表示CD11b-positive明显浸润的炎症细胞与DUSP22相比gydF4y2Ba液氧gydF4y2Ba老鼠饲料喂养后(图。gydF4y2Ba2 hgydF4y2Ba和m)。此外,DUSP22gydF4y2BaHepKOgydF4y2Ba加重脂质积累和炎症HFHC-challenged老鼠验证了肝脏TG浓度越高,总胆固醇(TC)和nonesterified脂肪酸(NEFA),和更高的血清炎性因子的内容(TNF-αIL-1β,il - 6和MCP-1),伴随着低浓度的抗炎调节器il - 10(无花果。gydF4y2Ba2 ngydF4y2Ba和o)。RT-qPCR结果进一步表明,与炎症相关基因的异常表达,脂质代谢和肝纤维化是由饲料喂养诱导的DUSP22gydF4y2Ba液氧gydF4y2Ba老鼠和恶化的过程中检测出HFHC-fed DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠(补充图。gydF4y2Ba7中gydF4y2Ba)。内脏脂肪堆积通常是与代谢紊乱有关gydF4y2Ba36gydF4y2Ba。实际上,没有发现显著差异在食物摄入量的变化(补充图。gydF4y2Ba8gydF4y2Ba)。然而,DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠表现出显著的加速体内脂肪重量("),和"自行车造福世界"组织/ BW的比率比DUSP22饲料喂养gydF4y2Ba液氧gydF4y2Ba老鼠(补充图。gydF4y2Ba8 b和cgydF4y2Ba)。)染色显示,脂肪细胞的大小是由饲料挑战高度增大而非传染性疾病组;然而,肝细胞DUSP22表达变化不影响HFHC-fed老鼠的脂肪细胞大小(补充图。gydF4y2Ba8 dgydF4y2Ba和e)。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba的测量gydF4y2Ba一个gydF4y2Ba体重,gydF4y2BabgydF4y2Ba肝脏重量,gydF4y2BacgydF4y2Ba肝脏重量比体重(LW / BW) (gydF4y2BangydF4y2Ba= 15老鼠每组),gydF4y2BadgydF4y2Ba空腹血胰岛素水平,gydF4y2BaegydF4y2Ba在DUSP22 HOMA-IRgydF4y2Ba液氧gydF4y2Ba和hepatocyte-specific DUSP22淘汰赛(DUSP22gydF4y2BaHepKOgydF4y2Ba)与非传染性疾病或老鼠饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BafgydF4y2Ba在DUSP22葡萄糖耐量试验(GTT)gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠与非传染性疾病或饲料24周进行,和曲线下面积(AUC)值计算(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BaggydF4y2Ba在DUSP22血清ALT和AST水平gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BahgydF4y2Ba肝脏外观的形象代表,他走时染色,油红O染色,马森三色的染色,天狼星红染色和免疫组织化学检查CD11b DUSP22在肝脏的部分gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba= 6 10或11老鼠每组10为每个鼠标图片;酒吧、规模50µm)。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba结果gydF4y2Ba我gydF4y2BaNAS的分数,gydF4y2BajgydF4y2Ba油红o染色的好心人,gydF4y2BakgydF4y2Ba马森trichrome-positive染色,gydF4y2BalgydF4y2Ba小天狼星red-positive染色gydF4y2Ba米gydF4y2BaCD11b-positive细胞进行了分析和量化(gydF4y2BangydF4y2Ba= 6 10或11老鼠每组)(*gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2BangydF4y2Ba考试TG、TC和NEFA DUSP22肝脏的内容gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BaogydF4y2Ba测量血清浓度的炎症因子,包括TNF-αIL-1β,il - 6, MCP-1, DUSP22和il - 10gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba= 9到12老鼠每组)(*gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。数据表示为均值±SEM从至少三个印度gydF4y2BapgydF4y2Baendent实验gydF4y2Ba。gydF4y2Ba统计分析是由单向方差分析。gydF4y2Ba
我们还在分析主要从DUSP22小鼠肝细胞gydF4y2Ba液氧gydF4y2Ba或DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠(补充图。gydF4y2Ba9gydF4y2Ba)和人类肝细胞L02有或没有DUSP22击倒。一致,DUSP22淘汰赛显示无显著影响其他DUSPs(补充图的表达。gydF4y2Ba9 bgydF4y2Ba)。我们证实,在对阿宝的刺激做出反应,主要鼠肝细胞和缺乏DUSP22 L02细胞表现出更高版本的促炎细胞因子在细胞的收集上层清液比DUSP22表达式(补充图。gydF4y2Ba9 cgydF4y2Ba和d)。RT-qPCR结果验证的功能DUSP22消融加剧炎症反应在PO-incubated原发性肝细胞和L02细胞(补充图。gydF4y2Ba9 e和fgydF4y2Ba)。符合体内结果,DUSP22删除造成高在原发性肝细胞脂质沉积和TG积累和DUSP22 L02细胞比其他细胞表达在阿宝治疗(补充图。gydF4y2Ba9 g和hgydF4y2Ba),以及显著异常的脂质代谢相关基因的表达(补充图。gydF4y2Ba9 i和jgydF4y2Ba)。TGF-β1刺激,产生更高的表达人类肝星状细胞LX2 fibrosis-associated分子在CM中孵化后PO-treated DUSP22gydF4y2BaHepKOgydF4y2Ba肝细胞比从DUSP22-expressing肝细胞培养在CM(补充图。gydF4y2Ba9 kgydF4y2Ba)。综上所述,这些研究结果清楚地表明,DUSP22不足可能会加速纳什病态体内和体外。gydF4y2Ba
Hepatocyte-specific DUSP22超表达改善HFHC-caused纳什病态gydF4y2Ba
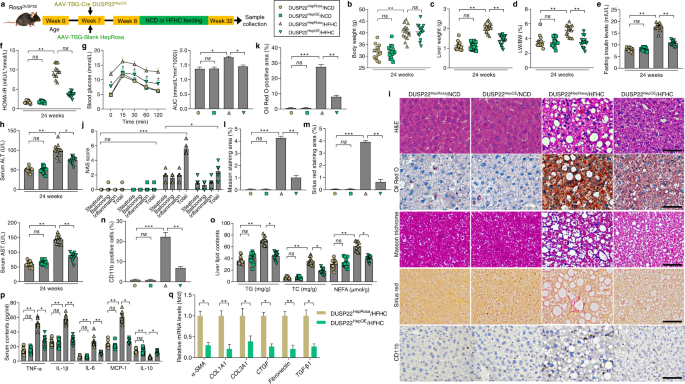
接下来,hepatocyte-specific DUSP22超表达小鼠(DUSP22gydF4y2BaHepOEgydF4y2Ba)使用DUSP22创建条件敲在老鼠(DUSP22 Rosa26的轨迹gydF4y2Ba罗莎gydF4y2Ba基于Rosa26条件和/或诱导转基因技术进一步证实DUSP22在纳什的监管功能。DUSP22gydF4y2Ba罗莎gydF4y2Ba小白鼠被注射入腺相关virus-serotype 8-thyroxine-binding球蛋白promoter-Cre重组酶向量(AAV8-TBG-Cre)诱导DUSP22仅在肝细胞过度表达,和DUSP22gydF4y2BaHepRosagydF4y2Ba小鼠AAV8-TBG空白向量注入被用作控制(补充图。gydF4y2Ba10模拟gydF4y2Ba)。此外,DUSP22gydF4y2BaHepOEgydF4y2Ba不影响任何其他的蛋白表达变化DUSPs(补充图。gydF4y2Ba10 egydF4y2Ba)。EGFP荧光染色,肝细胞白蛋白标记,HNF4a胆道上皮细胞标记CK19,内皮标记PECAM和平滑肌细胞标记α-SMA DUSP22构造gydF4y2BaHepOEgydF4y2Ba肝脏部分证实DUSP22有效vegf在肝细胞(补充图。gydF4y2Ba10 f和ggydF4y2Ba)。考试通过)染色证实DUSP22和生化分析gydF4y2BaHepOEgydF4y2Ba老鼠没有开发一个自发的肝与纳什与DUSP22表型相关gydF4y2BaHepRosagydF4y2Ba老鼠被喂食从0至24周开始非传染性疾病(补充图。gydF4y2Ba10 h-kgydF4y2Ba)。24周后饲料喂食,DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠显示显著降低肝重量和LW比DUSP22 / BW比率gydF4y2BaHepRosagydF4y2Ba老鼠;然而,没有观察到显著差异DUSP22之间的体重变化gydF4y2BaHepRosagydF4y2Ba/饲料和DUSP22gydF4y2BaHepOEgydF4y2Ba(图/饲料组的老鼠。gydF4y2Ba3模拟gydF4y2Ba)。此外,异常增强的空腹胰岛素水平,HOMA-IR值和葡萄糖耐量受损造成的饲料被大大减弱小鼠DUSP22过度(无花果。gydF4y2Ba3比gydF4y2Ba)。DUSP22gydF4y2BaHepOEgydF4y2Ba还得改善肝脏功能障碍HFHC-challenged老鼠,证明了降低血清ALT和AST的内容(图。gydF4y2Ba3 hgydF4y2Ba)。相比之下,DUSP22gydF4y2BaHepRosagydF4y2Ba老鼠,DUSP22gydF4y2BaHepOEgydF4y2Ba小鼠表现出明显降低肝细胞膨胀,NAS得分,脂质沉积、纤维化和CD11b-positive炎性细胞浸润在肝脏部分饲料喂养(无花果。gydF4y2Ba3 i ngydF4y2Ba)。DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠也呈现显著降低肝脂肪变性后饲料的挑战,正如通过减少肝脏TC, TG, NEFA内容,伴随着修正的脂类代谢相关基因的表达水平(无花果。gydF4y2Ba3 ogydF4y2Ba和补充图。gydF4y2Ba11个gydF4y2Ba)。血清和肝脏炎症标记物在DUSP22大幅逆转gydF4y2BaHepOEgydF4y2Ba相比DUSP22老鼠饲料后治疗gydF4y2BaHepRosagydF4y2Ba集团(无花果。gydF4y2Ba3 pgydF4y2Ba和补充图。gydF4y2Ba11 bgydF4y2Ba)。Hepatocyte-specific DUSP22超表达显著减少fibrosis-related基因的表达在肝脏HFHC-fed老鼠(图。gydF4y2Ba3问gydF4y2Ba)。证实DUSP22 HTqPCR结果gydF4y2BaHepOEgydF4y2Ba减轻肝脏炎症、血脂异常和纤维化饲料喂养(补充图。gydF4y2Ba11 cgydF4y2Ba)。更重要的是,身体脂肪体重,比"自行车造福世界"组织/ BW和HFHC-fed小鼠脂肪细胞大小明显扩张;DUSP22gydF4y2BaHepOEgydF4y2Ba显著减少体内脂肪重量和比"自行车造福世界"组织/ BW,但并未影响HFHC-challenged小鼠脂肪细胞大小的变化,以及食物的摄入量(补充图。gydF4y2Ba12 a egydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba腺相关病毒的原理图(8)血清型-TBG-Cre (AAV-TBG-Cre)介导DUSP22超表达的肝脏HFHC-fed DUSP22gydF4y2Ba罗莎gydF4y2Ba老鼠(DUSP22gydF4y2BaHepOEgydF4y2Ba/饲料)。作为控制(DUSP22 AAV-TBG-blankgydF4y2BaHepRosagydF4y2Ba/饲料)。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba的测量gydF4y2BabgydF4y2Ba体重,gydF4y2BacgydF4y2Ba肝脏重量,gydF4y2BadgydF4y2BaLW / BW(比gydF4y2BangydF4y2Ba= 15老鼠每组),gydF4y2BaegydF4y2Ba空腹血胰岛素水平,gydF4y2BafgydF4y2BaHOMA-IR,gydF4y2BaggydF4y2BaGTT和AUC值gydF4y2BahgydF4y2Ba在DUSP22血清ALT和AST浓度gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;gydF4y2BansgydF4y2Ba,gydF4y2Ba无显著差异)。gydF4y2Ba我gydF4y2Ba代表图像)染色,油红O染色,马森三色的染色,天狼星红染色和免疫组织化学检查CD11b DUSP22在肝脏的部分gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba= 10老鼠每组10为每个鼠标图片;酒吧、规模50µm)。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba结果gydF4y2BajgydF4y2BaNAS的分数,gydF4y2BakgydF4y2Ba油红o染色的好心人,gydF4y2BalgydF4y2Ba马森trichrome-positive染色,gydF4y2Ba米gydF4y2Ba小天狼星red-positive染色gydF4y2BangydF4y2BaCD11b-positive细胞进行了分析和量化(gydF4y2BangydF4y2Ba每组)(* = 10老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2BaogydF4y2Ba评估TG、TC和NEFA DUSP22肝脏的内容gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BapgydF4y2Ba炎症因子的计算包括TNF-αIL-1β,il - 6, DUSP22 MCP-1,血清中il - 10gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;gydF4y2BansgydF4y2Ba,无显著差异)。gydF4y2Ba问gydF4y2BaRT-qPCR结果fibrosis-related基因的mRNA水平包括α-SMA COL1A1, COL3A1, CTGF、纤连蛋白和TGF-β1 DUSP22的肝脏gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠饲料24周(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。数据表示为均值±SEM从至少三个独立的实验gydF4y2Ba。gydF4y2Ba统计分析,gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BapgydF4y2Ba是由单向方差分析;gydF4y2Ba问gydF4y2Ba是由双尾学生的gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
验证DUSP22的保护作用,主要从DUSP22分离的肝细胞gydF4y2BaHepRosagydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠和L02细胞转染Ad-DUSP22或Ad-GFP被使用,和DUSP22超表达并不影响其他DUSPs成员(补充图的表达变化。gydF4y2Ba13gydF4y2Ba和b)。与体内的结果一致,PO-triggered脂质沉积和TG积累在小鼠和人类肝细胞明显废除DUSP22过度,伴随着改良性的脂质metabolism-associated基因的表达水平(补充图。gydF4y2Ba十三氟gydF4y2Ba)。炎性因子释放PO-treated肝细胞被戏剧性地废除在DUSP22过度(补充图。gydF4y2Ba13 g和hgydF4y2Ba)。RT-qPCR DUSP22的结果验证了抗炎作用主要与阿宝刺激肝细胞和L02细胞(补充图。gydF4y2Ba13 i和jgydF4y2Ba)。LX2细胞显示fibrosis-related基因的低表达文化厘米后PO-incubated DUSP22gydF4y2BaHepOEgydF4y2Ba在CM中肝细胞比孵化来自DUSP22gydF4y2BaHepRosagydF4y2Ba肝细胞(补充图。gydF4y2Ba13 kgydF4y2Ba)。在一起,这些调查结果清楚地显示,DUSP22可以防止肝病。gydF4y2Ba
DUSP22对HFMCD-induced纳什表型产生保护作用gydF4y2Ba
由于不同的机制和发病机制的纳什发展引起的高脂肪饮食+蛋氨酸和choline-deficient饮食(HFMCD)和其他高能量饮食(即。饲料),我们随后调查如果DUSP22也发挥保护作用对一个8周HFMCD-triggered DUSP22纳什gydF4y2BaHepKOgydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠(补充图。gydF4y2Ba14 a和bgydF4y2Ba)。HFMCD挑战身体重量DUSP22显著减少造成的gydF4y2Ba液氧gydF4y2Ba老鼠和显著的肝脂肪变性,证明由肝细胞膨胀升高,NAS得分,脂质沉积,胶原蛋白的积累。值得注意的是,DUSP22gydF4y2BaHepKOgydF4y2Ba明显加速这些组织学改变HFMCD-fed老鼠但对身体没有影响权重(补充图。gydF4y2Ba14个碳氢键gydF4y2Ba)。相比之下,DUSP22gydF4y2BaHepOEgydF4y2Ba明显改善肝脂肪变性,降低细胞膨胀,证明了NAS得分,脂质积累,纤维化没有任何影响体重的变化(补充图。gydF4y2Ba14 i ngydF4y2Ba)。血清ALT和AST水平和肝脏TG, TC, NEFA内容在DUSP明显加速gydF4y2BaHepKOgydF4y2Ba与HFMCD老鼠,但在DUSP22减轻gydF4y2BaHepOEgydF4y2Ba老鼠(补充图。gydF4y2Ba14或者gydF4y2Ba)。此外,HFMCD-increased纤维化标志物的表达被DUSP22强烈加剧gydF4y2BaHepKOgydF4y2Ba,而DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠表现出改善表型的分子(补充图。gydF4y2Ba14 s vgydF4y2Ba)。此外,DUSP22gydF4y2BaHepKOgydF4y2Ba显著促进HFMCD-treated老鼠的肝脏炎症反应,而DUSP22gydF4y2BaHepOEgydF4y2Ba显著减轻肝脏炎症(补充图。gydF4y2Ba14 w xgydF4y2Ba)。这些发现进一步表明,DUSP22可以冲HFMCD-induced纳什的进展。gydF4y2Ba
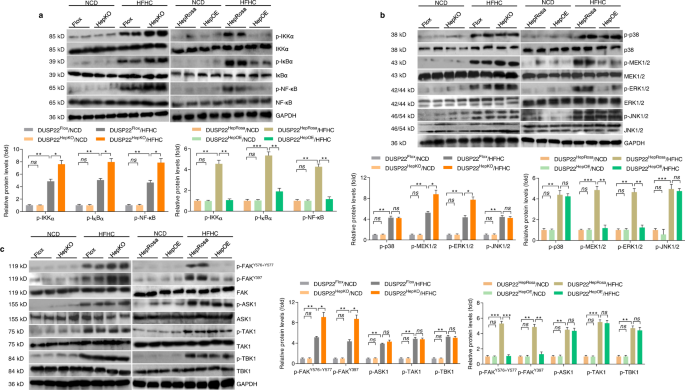
NF-κB DUSP22调节肝细胞激活和FAK信号HFHC-fed老鼠gydF4y2Ba
来洞察DUSP22背后的分子机制的影响,我们考察了DUSP22-mediated下游通路参与炎症反应。鉴于DUSP22调节的能力MAPKs激活和MAPKs信号参与病理纳什gydF4y2Ba14gydF4y2Ba,gydF4y2Ba16克ydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,我们首先评估的潜在参与炎性NF-κB信号级联以及MAPKs信号DUSP22脂肪肝gydF4y2BaHepKOgydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba后小鼠饲料喂食。符合上面的炎症反应的变化观察中,我们发现DUSP22gydF4y2BaHepKOgydF4y2Ba转录因子的显著升高的HFHC-induced over-activation NF-κB信号通路通过促进磷酸化IKKα的表达,和NF-κB / p65, DUSP22 IκBαgydF4y2BaHepOEgydF4y2Ba老鼠相当克制这些蛋白质(图的激活。gydF4y2Ba4gydF4y2Ba)。DUSP22负面调解的功能在PO-incubated NF-κB信号通路的激活验证主肝细胞(补充图。gydF4y2Ba15一个gydF4y2Ba)。然后我们检查的潜在参与MAPKs途径。如无花果所示。gydF4y2Ba4 bgydF4y2Ba和补充图。gydF4y2Ba15 bgydF4y2Ba、饲料喂养或阿宝暴露明显激活MAPKs信号所表示的调节p38的磷酸化,MEK1/2, ERK1/2, JNK1/2在肝组织中,主要的肝细胞。然而,DUSP22删除进一步加剧p-MEK1/2 p-ERK1/2,但不是p-p38 p-JNK1/2,与此同时,DUSP22超表达明显地废除了他们的激活。FAK的激活,ASK1、TAK1 TBK1中扮演着重要的角色在调解NF-κB和MAPKs信号通路在众多的生理活动gydF4y2Ba12gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba然后是调查揭示的可能的上游激酶DUSP22运行调节NF-κB ERK1/2信号通路。我们发现饲料喂养导致显著增加肝FAK磷酸化gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba、ASK1 TAK1, TBK1。值得注意的是,DUSP22gydF4y2BaHepKOgydF4y2Ba只有加剧了激活的FAK Y576 + Y577 Y397,但不影响ASK1 TAK1, TBK1活动。这些影响也证实PO-treated主要与DUSP22消融肝细胞。相反,从DUSP22肝组织和主要的肝细胞gydF4y2BaHepOEgydF4y2Ba代谢压力刺激后小鼠表现出相反的表现型(无花果。gydF4y2Ba4摄氏度gydF4y2Ba和补充图。gydF4y2Ba15摄氏度gydF4y2Ba)。总的来说,这些观察插图,通过调解NF-κB DUSP22防止肝脂肪变性,ERK1/2, FAK信号通路。gydF4y2Ba
一个gydF4y2Ba代表西方墨点法和量化的总蛋白表达和磷酸化IKKαIκBα,NF-κB DUSP22的肝脏gydF4y2Ba液氧gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba,DUSP22gydF4y2BaHepRosagydF4y2Ba,DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2BabgydF4y2Ba代表西方墨点法和量化的总蛋白表达和磷酸化p38 MEK1/2, ERK1/2, JNK1/2 DUSP22的肝脏gydF4y2Ba液氧gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba,DUSP22gydF4y2BaHepRosagydF4y2Ba,DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2BacgydF4y2Ba代表西方墨点法和量化的蛋白质总和磷酸化FAK的表达gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba、ASK1 TAK1, TBK1 DUSP22的肝脏gydF4y2Ba液氧gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba,DUSP22gydF4y2BaHepRosagydF4y2Ba,DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠与非传染性疾病或饲料24周(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。数据表示为均值±SEM从至少三个独立的实验。统计分析是由双尾学生的gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
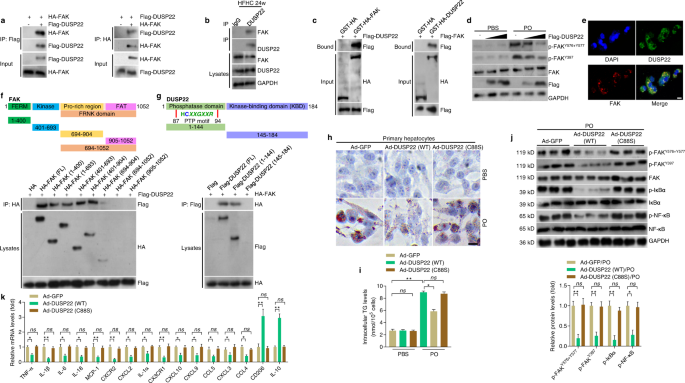
DUSP22直接与FAK调节纳什gydF4y2Ba
因此,分子DUSP22和FAK主要是探索之间的联系。Co-immunoprecipitation (co-IP)结果显示DUSP22之间的交互和FAK(无花果。gydF4y2Ba5gydF4y2Ba),它被证实在小鼠的肝脏组织24周饲料喂养(无花果。gydF4y2Ba5 bgydF4y2Ba)。谷胱甘肽S-transferase(销售税)降水分析证实了DUSP22之间的直接交互,FAK(无花果。gydF4y2Ba5度gydF4y2Ba),并在FAK DUSP22激活的抑制效应Y576 + Y577和Y397网站(图存在剂量依赖的相关性。gydF4y2Ba5 dgydF4y2Ba)。此外,双重免疫荧光染色法显示出相当程度的colocalization DUSP22和FAK L02细胞(图。gydF4y2Ba5 egydF4y2Ba)。分子映射和截断FAK DUSP22建议丰贸(带4.1、ezrin radixin, moesin同源性;残留1 - 400)和激酶(残留401 - 693)域的主要碎片FAK负责绑定DUSP22和DUSP22 FAK-binding碎片主要是位于磷酸酶域(残留1 - 144)(无花果。gydF4y2Ba5 fgydF4y2Ba和g)。gydF4y2Ba
一个gydF4y2BaCo-IP化验结果的L02细胞转染Flag-tagged DUSP22和HA-tagged FAK。Anti-Flag和anti-HA抗体被用作免疫印迹调查。gydF4y2BabgydF4y2Ba免疫沉淀反应和免疫印迹分析表明绑定DUSP22和FAK在24周后小鼠肝脏WT饲料,和免疫球蛋白作为控制。gydF4y2BacgydF4y2Ba销售税降水分析呈现直接DUSP22-FAK绑定。纯化销售税是用作控制。gydF4y2BadgydF4y2Ba代表总FAK蛋白免疫印迹,p-FAKgydF4y2BaY576 + 577gydF4y2Ba,p-FAKgydF4y2BaY397gydF4y2Ba与不同数量的L02细胞转染Flag-tagged DUSP22 PO或BSA治疗24小时。gydF4y2BaegydF4y2Ba代表immunofluorescent L02细胞的染色与Flag-tagged co-transfected DUSP22(绿色)和HA-tagged FAK(红色)转染24 h后(gydF4y2BangydF4y2Ba在总= 10图片;规模的酒吧,10µm)。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba示意图显示完整(FL)和截断gydF4y2BafgydF4y2BaFAK(上)gydF4y2BaggydF4y2BaDUSP22与代表Co-IP分析(上)(下)的映射分析域负责DUSP22-FAK交互L02细胞。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba代表油红O染色图像(gydF4y2BahgydF4y2Ba)和细胞内TG内容(gydF4y2Ba我gydF4y2Ba)表明脂质沉积PO-treated Ad-DUSP22 (WT)或Ad-DUSP22 (C88S)主肝细胞转染24 h。原发性肝细胞转染与Ad-GFP用作控制(gydF4y2BangydF4y2Ba= 5 /组,每组10图片;规模的酒吧,25µm) (*gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BajgydF4y2Ba代表总FAK磷酸化蛋白免疫印迹和总,IκBα,NF-κB在原发性肝细胞转染GFP, WT DUSP22或C88S DUSP22变体阿宝治疗后24小时(gydF4y2BangydF4y2Ba每组)(* = 3gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BakgydF4y2BaRT-qPCR分析显示炎症相关的关键基因表达的变化PO-treated Ad-DUSP22 (WT)或Ad-DUSP22 (C88S)转染主要肝细胞24小时(gydF4y2BangydF4y2Ba每组)(* = 6gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。数据表示为均值±SEM从至少三个独立的实验。统计分析,gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba是由双尾学生的gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
此外,我们发现NASH患者表现出显著激活FAK升高,表明p-FAK调节表达的gydF4y2BaY576 + Y577gydF4y2Ba和p-FAKgydF4y2BaY397gydF4y2Ba在肝脏标本与无脂肪变性参与者(补充图。gydF4y2Ba16一个gydF4y2Ba)。逐渐增加的FAK磷酸化gydF4y2BaY576 + Y577gydF4y2Ba和FAKgydF4y2BaY397gydF4y2Ba进一步发现HFHC-challenged小鼠的肝脏(补充图。gydF4y2Ba16 bgydF4y2Ba)。之间的负相关DUSP22 FAK的表达和激活在纳什科目(补充图确认。gydF4y2Ba16 c和dgydF4y2Ba)。双重免疫荧光验证DUSP22 colocalization和激活FAK在肝脏的部分的NASH患者(补充图。gydF4y2Ba16 e和fgydF4y2Ba)。可能DUSP22与FAK之间的相关性对人类和老鼠,理论上,被GeneMANIA预测和字符串(补充图。gydF4y2Ba16克gydF4y2Ba和补充图。gydF4y2Ba17一个gydF4y2Ba)。之间的交互DUSP22 FAK,及其在鼠标co-expression原发性肝细胞被Co-IP验证和免疫荧光染色法(补充图。gydF4y2Ba17 b和cgydF4y2Ba)。我们进一步发现,引入FAK-FERM和FAK-Kinase变异而不是FAK-related non-kinase (FRNK)变体在FAK未能恢复FAK的激活和开凿ERK1/2 NF-κB / p65信号,伴随着恢复促炎症反应、脂质沉积和细胞内TG积累与脂质代谢有关的特异表达基因表达在阿宝暴露在FAK-knockout L02细胞(补充图。gydF4y2Ba18 a egydF4y2Ba)。在一起,这些发现表明,DUSP22直接互动与FAK和抑制FAK激活主要Y576 + Y577 Y397,这是必不可少的anti-NASH DUSP22体内和体外的影响。gydF4y2Ba
众所周知,C88S突变(DUSP22-C88S)是一种显性负突变没有脱去磷酸基板的能力gydF4y2Ba22gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba41gydF4y2Ba。肝细胞被感染adenoviral向量表达一个完整的DUSP22,或与半胱氨酸突变DUSP22 88代替丝氨酸(C88S)进一步确定DUSP22之间的相互作用和FAK是不可或缺的PO-treated DUSP22来执行其生物功能的细胞。我们指出C88S变异显著废除DUSP22的保护作用抑制脂质沉积和TG积累在小鼠原发性肝细胞和L02细胞在阿宝刺激(无花果。gydF4y2Ba5 hgydF4y2Ba和我,和补充图。gydF4y2Ba19个得了gydF4y2Ba)。此外,阿宝孵化后,DUSP22在FAK磷酸化的抑制作用gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba、IκBαNF-κB / p65大大消除原发性肝细胞和C88S L02细胞突变,伴随着恢复促炎症反应(图。gydF4y2Ba5 jgydF4y2Ba和k,补充图。gydF4y2Ba19 d和egydF4y2Ba)。DUSP22的表达显著改善PO-stimulated血脂异常在肝细胞,但这种影响是完全废除DUSP22-C88S突变时(补充图。gydF4y2Ba19 f和ggydF4y2Ba)。正如所料,LX2细胞表现出明显恢复后fibrosis-associated基因的表达文化在CM与DUSP22-C88S PO-incubated小鼠肝细胞突变(补充图。gydF4y2Ba19gydF4y2Bah)。gydF4y2Ba
鉴于FAK阻塞之间的密切相关的活动PTP-motif域包含C88S DUSP22,一个AAV8-TBG-loaded WT长篇DUSP22序列向量(AAV-TBG-DUSP22)和AAV8-TBG-loaded DUSP22 PTP-motif域删除向量(AAV-TBG-DUSP22(ΔPTP主题))生产和介绍了进一步检查的影响DUSP22 PTP-motif突变体在HFHC-caused纳什病态体内(补充图。gydF4y2Ba20gydF4y2Ba)。的DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠注射AAV-TBG-DUSP22(消息灵通的gydF4y2BaDUSP22gydF4y2BaGOF)或AAV-TBG-DUSP22(ΔPTP主题)(消息灵通的gydF4y2BaDUSP22-ΔPTP主题gydF4y2BaGOF)诱导相应DUSP22功能(GOF)表达式,紧随其后的是饲料喂养24周。的DUSP22gydF4y2BaHepKOgydF4y2Ba小鼠注射AAV-TBG-Blank向量被用作控制(HepControl)。正如所料,老鼠注射AAV-TBG-DUSP22(ΔPTP主题)未能减少HFHC-increased肝脏重量,LW / BW的比率,空腹胰岛素水平,HOMA-IR值,血清ALT和AST浓度(补充图。gydF4y2Ba20 b-fgydF4y2Ba)。同时,ΔPTP-motif消融非常废除DUSP22纳什在小鼠的保护作用,restrengthened证实的肝细胞膨胀,NAS得分,脂质沉积,胶原蛋白的积累,CD11b-positive HFHC-fed老鼠的肝脏炎症细胞浸润(补充图。gydF4y2Ba20 g-lgydF4y2Ba)。一致,DUSP22-ΔPTP-motif突变不能降低肝脂质积累和血清炎性因子的浓度,以及集中通过加重FAK特异表达基因表达水平与炎症激活及其下游瀑布(p-ERK1/2、p-IκBαp-NF-κB),脂质代谢和肝纤维化(补充图。gydF4y2Ba20先生gydF4y2Ba)。这些结果表明DUSP22直接互动与FAK随后减轻纳什通过激活PTP病态的主题。gydF4y2Ba
FAK失活对DUSP22至关重要的功能gydF4y2Ba
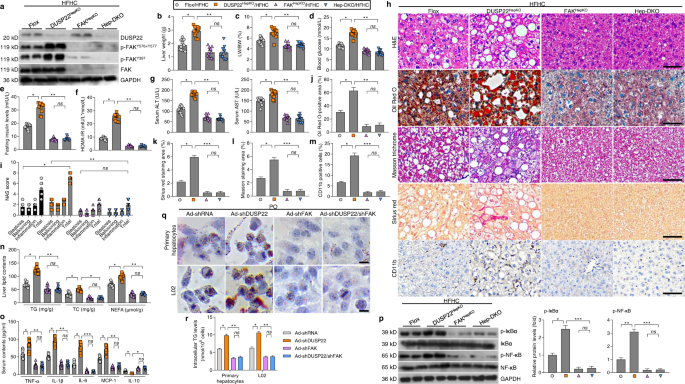
鉴于FAK激活在纳什的重要进展和进一步确认潜在的抑制效应DUSP22 FAK信号体内,hepatocyte-specific FAK淘汰赛(FAKgydF4y2BaHepKOgydF4y2Ba)(补充图。gydF4y2Ba21日得了gydF4y2Ba),hepatocyte-specific DUSP22和FAK双删除(Hep-DKO)老鼠之后生成的(补充图。gydF4y2Ba21 dgydF4y2Ba)。损耗DUSP22和肝脏中FAK在这些鼠标线确认通过免疫印迹分析(无花果。gydF4y2Ba6gydF4y2Ba),FAK缺乏废除DUSP22击倒的增效效果HFHC-induced FAK磷酸化gydF4y2BaY576 + Y577gydF4y2Ba和FAKgydF4y2BaY397gydF4y2Ba。有趣的是,DUSP22gydF4y2BaHepKOgydF4y2Ba加速肝脏重量,LW / BW比、血糖水平、空腹胰岛素含量,HOMA-IR值,血清ALT和AST浓度大大液在小鼠FAK饲料的挑战(图后删除。gydF4y2Ba6 b-ggydF4y2Ba)。FAK淘汰赛也减少DUSP22的增效作用gydF4y2BaHepKOgydF4y2BaHFHC-enhanced NAS分数、脂质沉积、纤维化形成,CD11b-positive炎性细胞浸润(无花果。gydF4y2Ba6氯gydF4y2Ba),伴随着极大地降低了肝脏TG, TC, NEFA水平和较低的血清炎性因子磷酸化IκBα和NF-κB / p65在肝脏(无花果。gydF4y2Ba6阻燃剂gydF4y2Ba)。一致,FAK击倒废除了Ad-shDUSP22加剧PO-stimulated激活FAK的函数gydF4y2BaY576 + Y577gydF4y2Ba和FAKgydF4y2BaY397gydF4y2Ba(补充图。gydF4y2Ba21日egydF4y2Ba)、脂质沉积、细胞内TG生成和p-IκBαp-NF-κB / p65在原发性肝细胞和L02细胞(图。gydF4y2Ba6问gydF4y2Ba和r,补充图。gydF4y2Ba21 fgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba代表西方墨点法DUSP22的表达,p-FAKgydF4y2BaY576 + Y577gydF4y2Ba,p-FAKgydF4y2BaY397gydF4y2Ba从DUSP22, FAK在肝脏gydF4y2BaHepKOgydF4y2Ba老鼠,hepatocyte-specific FAK-knockout (FAKgydF4y2BaHepKOgydF4y2Ba)小鼠,hepatocyte-specific DUSP22 FAK双敲除小鼠(Hep-DKO)和液氧24周后小鼠饲料喂养(gydF4y2BangydF4y2Ba每组)= 4老鼠。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba的测量gydF4y2BabgydF4y2Ba肝脏重量,gydF4y2BacgydF4y2BaLW / BW,比gydF4y2BadgydF4y2Ba血糖水平,gydF4y2BaegydF4y2Ba空腹胰岛素水平,gydF4y2BafgydF4y2BaHOMA-IR,gydF4y2BaggydF4y2Ba血清ALT和AST浓度表示与饲料组的白鼠的24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BahgydF4y2Ba代表图像)染色,油红O染色,马森三色的染色,天狼星红染色和免疫组织化学检查CD11b在肝脏的部分显示组的老鼠饲料24周(gydF4y2BangydF4y2Ba= 6或12老鼠每组10为每个鼠标图片;酒吧、规模50µm)。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba结果gydF4y2Ba我gydF4y2BaNAS的分数,gydF4y2BajgydF4y2Ba油红o染色的好心人,gydF4y2BakgydF4y2Ba小天狼星red-positive染色,gydF4y2BalgydF4y2Ba马森trichrome-positive染色gydF4y2Ba米gydF4y2BaCD11b-positive细胞进行了分析和量化(gydF4y2BangydF4y2Ba每组)= 6或12老鼠(*gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BansgydF4y2Ba,无显著差异)。gydF4y2BangydF4y2Ba评估TG、TC和NEFA内容显示组的白鼠的肝饲料24周(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。gydF4y2BaogydF4y2Ba血清炎症因子水平的计算,包括TNF-α,IL-1β,il - 6, MCP-1, il - 10,老鼠从24周后显示组饲料喂养(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2BapgydF4y2Ba代表西方墨点法和量化的总蛋白表达和磷酸化IκBαNF-κB肝脏显示组的白鼠在24周的饲料(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05,* *gydF4y2BaPgydF4y2Ba< 0.01,* * *gydF4y2BaPgydF4y2Ba< 0.001;ns无显著差异)。gydF4y2Ba问gydF4y2Ba,gydF4y2BargydF4y2Ba代表油红O染色图像(gydF4y2Ba问gydF4y2Ba)和细胞内TG内容(gydF4y2BargydF4y2Ba)24小时阿宝宾夕法尼亚州(0.4毫米和0.8毫米OA)治疗原发性肝细胞或L02细胞转染或co-transfected Ad-shDUSP22, Ad-shFAK, Ad-shDUSP22 / shFAK。细胞转染Ad-shRNA被用作控制(gydF4y2BangydF4y2Ba= 5 /组,每组10图片;规模的酒吧,25µm) (*gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01;ns无显著差异)。数据表示为均值±SEM从至少三个独立的实验。统计分析被双尾学生的表现gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
大幅度确认DUSP22 / FAK轴纳什病态的函数,我们进一步建立另一个特殊的纳什模型体内。FAKgydF4y2BaHepKOgydF4y2Ba老鼠和FAKgydF4y2Ba液氧gydF4y2Ba老鼠注射/不通过门静脉LV-shDUSP22向量构造hepatocyte-specific DUSP22-FAK丧失小鼠或hepatocyte-specific FAK丧失小鼠在24周的饮食喂养(FAK纳什gydF4y2BaHepKOgydF4y2Ba/饲料)或中途通过纳什饮食喂养(FAKgydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22 /饲料,FAKgydF4y2Ba液氧gydF4y2Ba/ LV-shDUSP22 /饲料)(补充图。gydF4y2Ba22gydF4y2Ba)。FAK磷酸化的gydF4y2BaY576 + Y577gydF4y2Ba和FAKgydF4y2BaY397gydF4y2Ba显然是在肝脏中发现的FAKgydF4y2Ba液氧gydF4y2Ba/ LV-shDUSP22 /饲料的老鼠,但不是在FAKgydF4y2BaHepKOgydF4y2Ba/饲料和FAKgydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22 /饲料小鼠(补充图。gydF4y2Ba22 bgydF4y2Ba)。我们发现,相比之下,HFHC-challenged FAKgydF4y2Ba液氧gydF4y2Ba/ LV-shDUSP22老鼠,表型表示纳什进展包括肝脏重量,LW / BW的比率,血糖、空腹胰岛素含量,HOMA-IR指数和血清ALT和AST浓度大大减轻与FAK LV-shDUSP22老鼠gydF4y2BaHepKOgydF4y2Ba尽管没有发现显著差异在体重变化(补充图。gydF4y2Ba22岁的我gydF4y2Ba)。正如所料,FAKgydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22小鼠表现出得改善肝细胞膨胀,NAS得分、脂质沉积、纤维化CD11b-positive比FAK在肝脏炎性细胞浸润gydF4y2Ba液氧gydF4y2Ba/ LV-shDUSP22小鼠饲料喂养后(补充图。gydF4y2Ba22 j-ogydF4y2Ba)。此外,HFHC-caused异常肝脏TG、TC和NEFA内容,以及与脂类代谢相关基因的信使rna表达水平和纤维化,在FAK有效禁止gydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22老鼠与FAK相比gydF4y2Ba液氧gydF4y2Ba(补充图/ LV-shDUSP22老鼠。gydF4y2Ba22页gydF4y2Ba和q)。此外,FAKgydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22老鼠还显示明显减少的表达p-IκBα和p-NF-κB /肝脏中p65,伴随着血清中炎性因子和/或改善肝脏后饲料挑战(补充图。gydF4y2Ba22 rtgydF4y2Ba)。这些结果表明,FAK失活是必不可少的DUSP22对纳什进程执行它的保护功能。gydF4y2Ba
DUSP22防止HFHC-induced纳什病态gydF4y2Ba
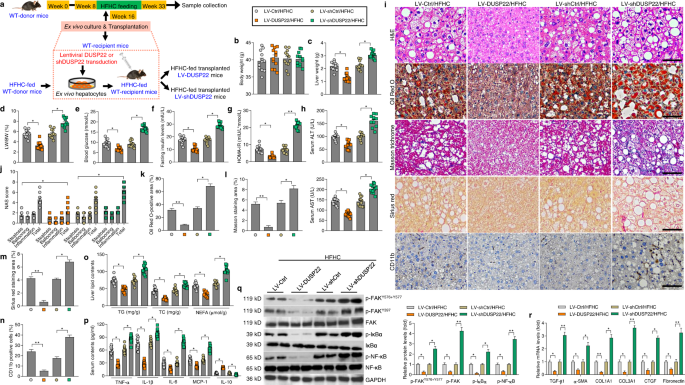
体外基因治疗方法使用lentivirus-loaded长篇DUSP22序列(LV-DUSP22)或成分针对DUSP22 (LV-shDUSP22)随后利用披露的治疗潜力DUSP22纳什管理(无花果。gydF4y2Ba7一个gydF4y2Ba)。DUSP22过度或击倒在肝组织中验证了免疫印迹(补充图。gydF4y2Ba23个gydF4y2Ba和b)。在体外移植小鼠模型,hepatocyte-specific DUSP22过度(LV-DUSP22)传导大大降低肝脏重量,LW / BW比率,血糖浓度,空腹胰岛素水平,HOMA-IR值,和小鼠血清ALT和AST浓度24周饲料挑战;然而,hepatocyte-specific DUSP22击倒(LV-shDUSP22)小鼠表现出明显加速纳什饲料引起的表型,而无显著差异在所有组小鼠的体重变化(图gydF4y2Ba7 b - hgydF4y2Ba)。LV-DUSP22 /饲料的老鼠也施加显著降低肝细胞膨胀,NAS得分、脂质沉积、纤维化和炎症细胞浸润在肝组织内,伴随着减少肝脏TG、TC和NEFA内容,血清促炎介质(无花果。gydF4y2Ba7投入gydF4y2Ba)。IκBα,此外,增强激活FAK和NF-κB / p65和异常表达的纤维化、炎症和脂质代谢相关的基因也大大减少LV-DUSP22 /饲料小鼠相比LV-Ctrl /饲料的老鼠。然而,LV-shDUSP22老鼠表现出更严重的肝脏脂肪变性比那些表型LV-shCtrl老鼠饲料喂养后(图。gydF4y2Ba7 p-rgydF4y2Ba和补充图。gydF4y2Ba23 c和dgydF4y2Ba)。这些结果说明HFHC-triggered纳什发展可以有效地缓解DUSP22-regulated体外基因疗法。gydF4y2Ba
一个gydF4y2Ba计划显示前vivo-regulated基因治疗。主要从预先处理这些WT白鼠肝细胞的分离和体外培养8周饲料作为供体。培养肝细胞被转导与lentivirus-loaded DUSP22或shDUSP22序列。相应的空白向量被用作控制。随后,额外的HFHC-fed同窝出生的老鼠在接受者通过门静脉注射了转导肝细胞。HFHC-fed移植小鼠(饲料LV-DUSP22或饲料LV-shDUSP22)此后饲料喂了一个额外的16周。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba的测量gydF4y2BabgydF4y2Ba体重,gydF4y2BacgydF4y2Ba肝脏重量,gydF4y2BadgydF4y2BaLW / BW,比gydF4y2BaegydF4y2Ba血糖水平,gydF4y2BafgydF4y2Ba空腹胰岛素水平,gydF4y2BaggydF4y2BaHOMA-IR指数,gydF4y2BahgydF4y2Ba血清ALT和AST (gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2Ba我gydF4y2Ba代表图像)染色,油红O染色,马森三色的染色,天狼星红染色和免疫组织化学检查CD11b从显示组老鼠在肝脏的部分(gydF4y2BangydF4y2Ba= 6或12老鼠每组10为每个鼠标图片;酒吧、规模50µm)。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba结果gydF4y2BajgydF4y2BaNAS的分数,gydF4y2BakgydF4y2Ba油红o染色的好心人,gydF4y2BalgydF4y2Ba马森trichrome-positive染色,gydF4y2Ba米gydF4y2Ba小天狼星red-positive染色gydF4y2BangydF4y2BaCD11b-positive细胞进行了分析和量化(gydF4y2BangydF4y2Ba每组)= 6或12老鼠(*gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BaogydF4y2Ba对TG、TC和NEFA从表示组小鼠肝组织中(gydF4y2BangydF4y2Ba每组)(* = 12老鼠gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2BapgydF4y2Ba评估血清TNF-αIL-1β,il - 6, MCP-1,从显示组小鼠il - 10的内容(gydF4y2BangydF4y2Ba每组)(* = 11老鼠gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba问gydF4y2Ba代表西方墨点法和量化的蛋白质总和磷酸化FAK的表达gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba、IκBαNF-κB显示组小鼠的肝脏(gydF4y2BangydF4y2Ba每组)(* = 4老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BargydF4y2BaRT-qPCR结果fibrosis-related基因的mRNA水平包括TGF-β1α-SMA, COL1A1, COL3A1, CTGF,纤连蛋白表示组小鼠的肝脏(gydF4y2BangydF4y2Ba每组)(* = 8老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。数据表示为均值±SEM从至少三个独立的前女友gydF4y2BapgydF4y2Ba结果。统计分析被双尾学生的表现gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
DUSP22改善NASH-associated肝癌gydF4y2Ba
DUSP22一直报道作为一个肿瘤抑制功能gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba。探针DUSP22是否参与NAFLD-HCC进展,DUSP22表达水平随后被检查在人类NAFLD-HCC 8-paired肿瘤样本和邻近的正常组织。DUSP22 mRNA和蛋白表达水平也显著下调到邻近的正常细胞相比,NAFLD-HCC标本(无花果。gydF4y2Ba8gydF4y2Ba和b)。然后,我们检查DUSP22在两个肥胖相关的表达NAFLD-HCC小鼠模型。同样,DUSP22在所有肝癌肿瘤明显减少gydF4y2BaN, NgydF4y2Ba-diethylnitrosamine(穴),和HFHC-treated老鼠(无花果。gydF4y2Ba8汉英gydF4y2Ba)。一致,明显减少DUSP22表达式在肝细胞癌肿瘤从DEN-treated ob / ob老鼠(补充图。gydF4y2Ba24gydF4y2Ba和b)。此外,肝癌细胞系(Hep3B HepG2, smmc - 7721)也产生显著降低DUSP22表达式比肿瘤细胞系(补充图。gydF4y2Ba24 cgydF4y2Ba和d)。这些研究结果阐明,可能导致差别DUSP22对这些NAFLD-associated肝癌发展。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba结果gydF4y2Ba一个gydF4y2BaRT-qPCR和gydF4y2BabgydF4y2Ba免疫印迹分析DUSP22 mRNA和蛋白表达水平,分别在8个人配对NAFLD-HCC (T)和相邻的正常样本(N)。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba结果gydF4y2BacgydF4y2BaRT-qPCR,gydF4y2BadgydF4y2Ba免疫组织化学检查,gydF4y2BaegydF4y2Ba免疫印迹分析DUSP22表达饮食NASH-HCC小鼠模型:DEN-injected和HFHC-treated WT老鼠(gydF4y2BangydF4y2Ba= 15老鼠每组)。gydF4y2BafgydF4y2Ba实验设计的方案DEN-injected和HFHC-induced NASH-HCC小鼠模型与hepatocyte-specific DUSP22淘汰赛(上)或hepatocyte-specific DUSP22 overexpressin(底部)。14岁的日子,DUSP22gydF4y2Ba液氧gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba,DUSP22gydF4y2BaHepRosagydF4y2Ba,DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠注射一剂窝。在8周的年龄开始,老鼠一个额外的24周的饲料。gydF4y2BaggydF4y2Ba记录显示的老鼠的体重组的老鼠(gydF4y2BangydF4y2Ba每组)小鼠= 15 (ns)无显著差异。gydF4y2BahgydF4y2Ba代表图像的肝脏出现(gydF4y2BangydF4y2Ba= 8老鼠每组)。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba表面肿瘤数量(gydF4y2Ba我gydF4y2Ba)和肿瘤大小(gydF4y2BajgydF4y2Ba)在每个显示组量化(gydF4y2BangydF4y2Ba每组)小鼠= 15 (* *gydF4y2BaPgydF4y2Ba< 0.01和* * *gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba。gydF4y2BakgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba的测量gydF4y2BakgydF4y2Ba肝脏重量,gydF4y2BalgydF4y2BaLW / BW,比gydF4y2Ba米gydF4y2Ba血清ALT和AST浓度gydF4y2BangydF4y2Ba肝脏TG, TC水平表示组老鼠(gydF4y2BangydF4y2Ba每组)(* = 15老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BaogydF4y2Ba代表图像)染色(酒吧、规模50µm),马森三色的染色(酒吧、规模50µm),免疫荧光检查F4/80(酒吧、规模20µm)和ki - 67(酒吧、规模20µm)在肝脏的部分显示组老鼠(gydF4y2BangydF4y2Ba= 6或每组15老鼠,10图片为每个鼠标)。gydF4y2BapgydF4y2Ba- - - - - -gydF4y2Ba年代gydF4y2Ba的测量gydF4y2BapgydF4y2BaNAS的分数,gydF4y2Ba问gydF4y2Ba马森trichrome-positive染色,gydF4y2BargydF4y2BaF4/80-positive细胞,gydF4y2Ba年代gydF4y2Baki - 67阳性细胞进行了分析和量化(gydF4y2BangydF4y2Ba= 6或每组)(* 15的老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BatgydF4y2BaRT-qPCR结果mRNA水平的炎症,fibrosis-related基因所示表示组小鼠的肝脏(gydF4y2BangydF4y2Ba每组)(* = 8老鼠gydF4y2BaPgydF4y2Ba< 0.05和* *gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BaugydF4y2Ba代表西方墨点法和量化的蛋白质总和磷酸化FAK的表达gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba、ERK1/2 IκBα,NF-κB表示组小鼠的肝脏(gydF4y2BangydF4y2Ba每组)= 4。数据表示为均值±SEM从至少三个独立的实验。统计分析被双尾学生的表现gydF4y2BatgydF4y2Ba以及。gydF4y2Ba
我们随后调查DUSP22的监管作用的病理进展纳什在DUSP22肝癌gydF4y2BaHepKOgydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠窝处理(25毫克/公斤;在24周2周大)和饲料,和DUSP22gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2BaHepRosagydF4y2Ba老鼠分别担任相应的控制,(无花果。gydF4y2Ba8 fgydF4y2Ba)。无显著差异检测小鼠的体重变化在所有组中(图gydF4y2Ba8 ggydF4y2Ba)。如无花果所示。gydF4y2Ba8 h-jgydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠开发更多和更大的规模的肿瘤在肝表面与DUSP22相比gydF4y2Ba液氧gydF4y2Ba老鼠窝/饲料治疗后。DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠也会产生更高的肝脏重量,LW / BW比率,血清ALT和AST浓度,肝脏TG, TC水平比DUSP22gydF4y2Ba液氧gydF4y2Ba老鼠在回应穴(图/饲料的挑战。gydF4y2Ba8 k - ngydF4y2Ba)。相反,hepatic-specific DUSP22超表达显著抑制NASH-associated肝癌肿瘤发生在窝/ HFHC-treated小鼠改善纳什表型(无花果。gydF4y2Ba8 h ngydF4y2Ba)。值得注意的是,除了监管肿瘤发生,DUSP22gydF4y2BaHepOEgydF4y2Ba极大地压抑纳什的病理特征,包括肝脂肪变性、纤维化F4/80-mediated炎性细胞浸润,减少和抑制肝癌细胞增殖的ki - 67阳性染色DUSP22相比gydF4y2BaHepRosagydF4y2Ba老鼠窝/饲料治疗,伴随着减少炎症和fibrosis-related基因的表达通过其下游FAK的堵塞,ERK1/2, NF-κB信号通路。然而,这些巢穴/ HFHC-induced组织学和机械的特点在DUSP22 NASH-related HCC明显加速gydF4y2BaHepKOgydF4y2Ba老鼠与DUSP22相比gydF4y2Ba液氧gydF4y2Ba(图/窝/饲料老鼠。gydF4y2Ba8输出gydF4y2Ba)。此外,体外结果使用HepG2和转染smmc - 7721细胞与Ad-shDUSP22或Ad-DUSP22表明DUSP22击倒显著促进细胞增殖,而其超表达明显抑制肝癌细胞生长与相应对照组相比CCK-8和EdU染色(补充图。gydF4y2Ba24练习gydF4y2Ba)。TUNEL染色证实,促进DUSP22导致肝癌细胞凋亡(补充图。gydF4y2Ba24 jgydF4y2Ba和k),一贯smmc - 7721细胞Ad-shDUSP22清楚表明FAK磷酸化的提升gydF4y2BaY576 + Y577gydF4y2Ba,FAKgydF4y2BaY397gydF4y2Ba,IκBαERK1/2 NF-κB,,然而,减少与Ad-DUSP22 HepG2细胞转染(补充图。gydF4y2Ba24 lgydF4y2Ba)。这些结果说明,DUSP22抑制NAFLD-associated肝癌体内和体外。gydF4y2Ba
FAK已经报告给函数作为癌基因,包括肝细胞癌gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba。进一步探讨FAK堵塞是否参与DUSP22-restrained NASH-HCC进展,其激活然后以NAFLD-HCC患者的肝脏。免疫印迹结果表明NAFLD-HCC病人表现出显著升高p-FAK的表情gydF4y2BaY576 + Y577gydF4y2Ba和p-FAKgydF4y2BaY397gydF4y2Ba与匹配相邻正常样本(补充图。gydF4y2Ba25一个gydF4y2Ba)。随后,使用DUSP22 NASH-HCC小鼠模型成立gydF4y2BaHepKOgydF4y2Ba,FAKgydF4y2BaHepKOgydF4y2Ba老鼠,Hep-DKO探讨FAK激活的影响在DUSP22-mediated NASH-HCC进展。补充图中显示。gydF4y2Ba25个罪犯gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba加速NASH-HCC大大减轻在窝/ HFHC-fed FAK的老鼠gydF4y2BaHepKOgydF4y2Ba和Hep-DKO组,证明减少肿瘤的大小和数量。细胞的数量与ki - 67阳性染色加重DUSP22gydF4y2BaHepKOgydF4y2Ba也显著废除在FAK淘汰赛(补充图。gydF4y2Ba25 egydF4y2Ba和f)。他走时染色表明,后穴/饲料挑战,DUSP22gydF4y2BaHepKOgydF4y2Ba小鼠癌细胞发展强烈的细胞学特征分布在薄壁组织显示异常肝的架构,而在FAK改善gydF4y2BaHepKOgydF4y2Ba老鼠或Hep-DKO老鼠,以及显著降低血清ALT和AST浓度(补充图。gydF4y2Ba25gydF4y2Bag和h),表明改进后的肝脏功能。发现在这方面说明DUSP22-inhibited恶化NASH-HCC部分归因于FAK信号的阻塞。gydF4y2Ba
讨论gydF4y2Ba
目前,还没有公认和批准药理治疗纳什治疗除了生活方式方法,和促进肝癌发展的机制,在纳什仍然不清楚。发展有效的策略纳什管理很大程度上依赖于目标的主要监管机构在其致病通路。最近的研究遗传和环境因素之间的交互作用对脂肪肝表明,代谢紊乱在纳什可以极大地放大了基因变异的影响,从脂肪变性到肝脏炎症和肝硬化gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba。初步临床试验表明,NASH患者特定的基因变异反应不同生活方式和药物干预gydF4y2Ba44gydF4y2Ba。纳什的治疗上,更多的研究迫切需要在特定的基因变异,这可能是有用的指导个性化治疗在不久的将来。新兴的研究报道,基因治疗方法的潜在的治疗肝脂肪变性及其相关肝细胞癌gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba。gydF4y2Ba
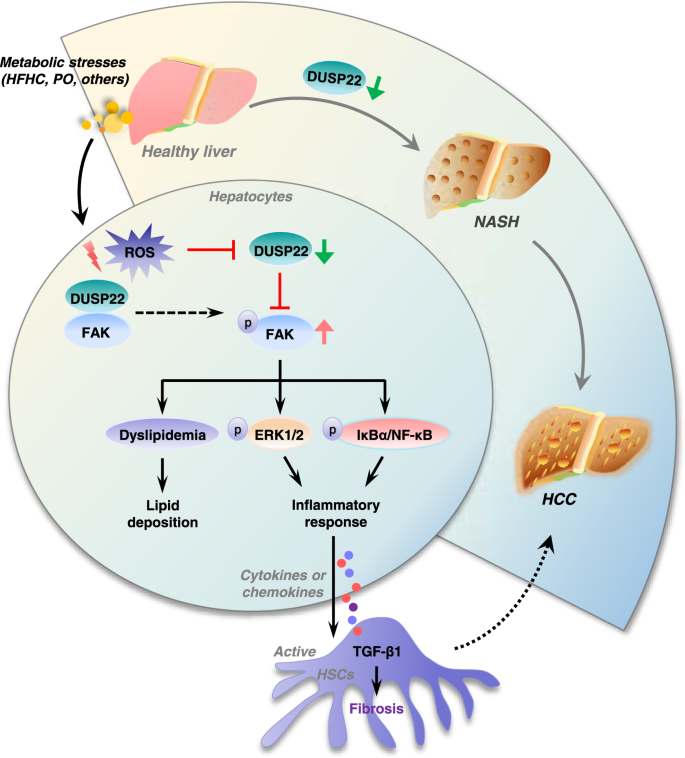
在目前的研究中,我们首次发现DUSP22肝病的一个关键的抑制和NAFLD-associated肝癌(无花果。gydF4y2Ba9gydF4y2Ba)。使用多个长期饲料或引起的小鼠模型和纳什HFMCD喂食,我们发现hepatocyte-specific DUSP22消融(DUSP22gydF4y2BaHepKOgydF4y2Ba)使用CRISPR / Cas9系统显著加剧肝脂肪变性、炎症和纤维化;然而,AAV8-mediated DUSP22过度(DUSP22gydF4y2BaHepOEgydF4y2Ba)大大授予保护纳什发展饲料或HFMCD挑战后,这证实了lentivirus-mediated DUSP22 (LV-DUSP22)体外基因治疗。同时,DUSP22删除或提升的并不影响其他DUSPs的表达式,并与DUSP22老鼠gydF4y2BaHepKOgydF4y2Ba或DUSP22gydF4y2BaHepOEgydF4y2Ba没有出现任何NASH-associated自发肝表型在正常情况下。深入的调查表明,DUSP22直接与FAK和抑制其活化脱去磷酸FAK在Y397 Y576 + Y577残留物,随后抑制其下游NF-κB和ERK1/2信号级联。我们进一步发现PTP主题包含的功能网站(C88S) DUSP22 FAK堵塞所需蛋白质。因此,DUSP22独立运作与其他DUSPs可能是一个有前途的治疗目标纳什及其相关肝细胞癌的治疗通过抑制FAK信号(图。gydF4y2Ba9gydF4y2Ba)。gydF4y2Ba
NASH的发病机制是复杂的,包括一个复杂的重组分子网络gydF4y2Ba3gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba。ROS是一个重要的纳什pro-steatotic刺激和一个潜在的治疗目标管理,和一些抗氧化剂已经被用于临床试验gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba。不幸的是,临床应用抗氧化剂的结果并不乐观的具有争议性的问题gydF4y2Ba49gydF4y2Ba。因此,目标更具体的监管机构对纳什对于有效治疗是必要的。在这项研究中,我们首次发现ROS调制DUSP22退化和发展大大促进了纳什,而NAC治疗调节DUSP22表达水平,保护肝细胞和肝组织的损伤在氧化或代谢压力。ROS的有力影响DUSP22透露的表达在我们目前的研究类似于先前的报道,氧化的催化活性部位内的半胱氨酸DUSPs抑制DUSP磷酸酶活动和触发他们的蛋白酶体降解gydF4y2Ba50gydF4y2Ba。gydF4y2Ba
DUSP22广泛表达于各种不同类型的组织和细胞,从而调节不同的病理生理过程,如细胞活性、肿瘤进展,和炎症gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba51gydF4y2Ba。DUSP22主要调节MAPKs信号通路,它尤其激活物但不兵或者p38 MAPK信号通路在哺乳动物细胞gydF4y2Ba23gydF4y2Ba。相反,DUSP22也报告给脱去磷酸和灭活物和p38,但不是兵,转染COS-1细胞gydF4y2Ba52gydF4y2Ba。此外,DUSP22表达抑制T细胞抗原被发现receptor-triggered ERK2 Jurkat T细胞的活化gydF4y2Ba53gydF4y2Ba。因此,MAPKs DUSP22的影响是有争议的,这可能与不同刺激下细胞或组织的类型。此外,DUSP22也可以抑制IL-6-provoked STAT3激活gydF4y2Ba24gydF4y2Ba。老年小鼠DUSP22缺乏自发表现出升高血清促炎细胞因子的内容(IFN-γ,il - 6, TNF-α和IL-17A)gydF4y2Ba26gydF4y2Ba,gydF4y2Ba54gydF4y2Ba。此外,DUSP22-absent老鼠对广式相比,加重炎症和自身免疫小鼠和实验性自身免疫性脑脊髓炎的人更有可能发展(运算单元)。从力学上看,DUSP22可以激活T细胞受体(TCR)信号通过脱去磷酸和灭活Lck Y397,和DUSP22-knockout T细胞呈现丰富的炎症细胞因子的表达gydF4y2Ba26gydF4y2Ba。炎症被认为是一个关键球员在代谢紊乱的发病机制。炎症信号,如ERK1/2、物和NF-κB途径,是至关重要的复杂的联系,连接炎症和代谢调节,肝损伤、功能障碍,导致纳什进展gydF4y2Ba55gydF4y2Ba。我们的研究结果表明,DUSP22体内和体外表达显著减少反应代谢刺激。一致,我们还显示,DUSP22施加抗炎功能饲料或者PO的挑战,这主要是通过灭活ERK1/2和NF-κB信号通路,但对物和p38 MAPK没有显著影响。因此,我们认为DUSP22功能细胞类型和/或刺激相关的。脂肪肝创建一个促炎症情况,进而导致肝星状细胞活化,导致过量的胶原蛋白积累在纳什或脂肪liver-related肝癌患者gydF4y2Ba56gydF4y2Ba。除了抗炎作用,DUSP22脂质代谢和纤维化的影响仍然是难以捉摸的。这里我们新验证的能力肝DUSP22改善葡萄糖耐量,脂质代谢,和胶原沉积,随后纳什发展不利影响最小化。此外,我们的研究结果的有利影响DUSP22超表达在纳什是体重增加,独立的强烈照明DUSP22可能直接影响肝细胞在不改变体重。gydF4y2Ba
DUSP22以前发现脱去磷酸FAK和抑制细胞的能动性gydF4y2Ba21gydF4y2Ba。FAK由氨基端丰贸,c端粘着斑激酶,而攻击(脂肪)域gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,调节各种细胞过程从代谢紊乱炎症反应和细胞生存,这取决于特定的刺激或上下文gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba。FAK激活进行第一次通过自身磷酸化Y397残渣,随后通过磷酸化Y576 + Y577gydF4y2Ba61年gydF4y2Ba。FAK激活已经涉及炎性刺激后基因表达gydF4y2Ba62年gydF4y2Ba。此外,FAK抑制剂显著废除了NF-κB转录活性和炎性细胞因子的基因表达gydF4y2Ba鲁兹锥体gydF4y2Ba(gydF4y2BaTcgydF4y2Ba)来华的巨噬细胞gydF4y2Ba63年gydF4y2Ba。MAPKs被称为加监管者FAK信号,和FAK-dependent MAPK激活参与不仅炎症还纤维化gydF4y2Ba38gydF4y2Ba,gydF4y2Ba57gydF4y2Ba。此外,FAK的作用在调节糖原合成HepG2细胞和体外肝脏胰岛素信号也被报道gydF4y2Ba64年gydF4y2Ba。此外,siRNA-mediated FAK击倒促进脂质氧化,而损伤骨骼肌糖原合成gydF4y2Ba59gydF4y2Ba,这表明FAK抑制可能提升新陈代谢的灵活性。FAK激活也涉及癌症发展通过提高细胞生存、增殖和迁移gydF4y2Ba65年gydF4y2Ba。最近,FAK磷酸化被发现调节在肝细胞癌组织与正常肝组织和参与NAFLD-related HCC进展部分通过促进肝癌细胞增殖gydF4y2Ba66年gydF4y2Ba。此后,FAK激活非常参与代谢疾病和肿瘤的生长。在我们的研究中,我们还显示,FAK是一个主要的下游目标调节DUSP22在纳什的功能。我们提供了一个更好的理解纳什FAK激活诱导代谢刺激。值得注意的是,DUSP22之间的负相关蛋白质表达和FAK激活NASH患者的肝脏中发现。更重要的是,我们发现的区域DUSP22蛋白质从1到144 aa域包含C88S可以绑定到FAK,并直接与FAK通过其丰贸和激酶域,之后删除它通过脱去磷酸活化FAK在Y397 Y576 + Y577残留。最后,我们惊讶地发现,DUSP22减少肿瘤大小和数量在窝/ HFHC-induced NASH-related肝癌小鼠模型,有效的降低肝癌细胞体外增殖,表明DUSP22可能作为肿瘤抑制,进一步抑制纳什发展成肝癌。与此同时,更高的FAK激活也是NASH-HCC患者的肝脏中发现。值得注意的是,DUSP22gydF4y2BaHepKOgydF4y2Ba大大加速NASH-HCC进展是废除与FAK窝/ HFHC-treated小鼠gydF4y2BaHepKOgydF4y2Ba,表明DUSP22抑制NASH-HCC的能力在很大程度上归因于其抑制作用FAK激活和其下游的信号。总的来说,这些发现表明DUSP22可以减轻脂质积累、炎症、肝纤维化和NASH-HCC进展,主要依靠FAK失活。gydF4y2Ba
DUSP家族可以脱去磷酸DUSPs丝氨酸/苏氨酸残基的基板和/或酪氨酸残基。DUSP家族的所有成员包含常见的磷酸酶域gydF4y2Ba50gydF4y2Ba,gydF4y2Ba54gydF4y2Ba。例如,DUSP3删除导致更高的ERK和p38磷酸化,从而促进肥胖和纳什在HFD-fed老鼠gydF4y2Ba27gydF4y2Ba。DUSP9和DUSP12阻碍ASK1磷酸化,从而抑制MAPKs磷酸化和随后的炎症抑制,因此改善肝脂肪变性过程gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29日gydF4y2Ba。同样,DUSP14和DUSP26目标和抑制TAK1的磷酸化,MAPKs信号的上游调节器,在肝细胞,导致MAPKs失活和抑制炎症,导致纳什治疗gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31日gydF4y2Ba。DUSP22规范PTP签名主题,gydF4y2BaHCXXGXXRgydF4y2Ba从87年到94年,在残留gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba。我们的体外研究进一步说明,阿宝刺激,DUSP22 phosphatase-dead突变(DUSP22-C88S)失去了脱去磷酸和灭活FAK的能力,和之后未能减少脂质沉积,炎症反应在肝细胞通过其下游ERK1/2和NF-κB瀑布,在人类肝星状细胞和纤维化。一致,维护整个主题包含突变C88S DUSP22残渣也禁用禁止FAK磷酸化Y397 Y576 + Y577,导致血脂异常、炎症反应和胶原蛋白的积累。这些结果进一步阐述了脱磷酸作用DUSP22由PTP的活动主题是不可或缺的DUSP22-regulated FAK信号的抑制,从而对肝病发挥保护作用。同样,催化域突变废除TAK1 DUSP14的脱去磷酸能力,加速肝脏损伤gydF4y2Ba31日gydF4y2Ba。根据我们目前的发现,先前的研究,DUSPs家庭的特点,我们证明了脱去磷酸DUSPs家庭成员的能力(DUSP22、DUSP3 DUSP9, DUSP12, DUSP14, DUSP26,等等)可能是必不可少的对肝脂肪变性的保护作用。除了这些已经报道DUSPs家庭成员,DUSP22是发展的一个新发现的和有价值的目标在NASH-HCC前景的治疗策略。然而,考虑到许多细胞活动参与肝细胞癌的发展gydF4y2Ba67年gydF4y2Ba在我们目前的工作,仍有局限性。首先,考虑到NASH的发病机制是一个复杂的过程,涉及代谢紊乱和不受控制的慢性炎症和纤维化,有趣的是,调查其他DUSPs道路是否会产生类似的保护作用在个人或小鼠模型的发展与简单的脂肪肝,严重的肝脂肪变性,甚至NASH-HCC。第二,下游FAK信号分子,如细胞周期和细胞凋亡可能参与DUSP22-suppressed NASH-HCC尚未完全了解。同时,除了FAK,其他目标是否参与DUSP22-regulated NASH-HCC,继续研究和发现项目迫切需要和热切期待。gydF4y2Ba
综上所述,我们的研究提供了进一步的证据,支持DUSPs家庭的保护作用对肝脂肪变性。简而言之,我们第一次发现ROS-mediated DUSP22退化参与脂肪肝的设置和发展,有助于通过促进NASH的发病机理和相关的肝细胞癌的FAK磷酸化Y397此后Y576 + Y577残留物和加重其下游ERK1/2和NF-κB信号级联。因此,针对DUSP22 upregulation和/或其与FAK可能是一个有用的NASH-HCC疗法治疗。gydF4y2Ba
方法gydF4y2Ba
抗体和试剂gydF4y2Ba
主要的抗体anti-GAPDH (# 2118), anti-p-JNK (# 4668), anti-JNK (# 9258), anti-p38 (# 8690), anti-p-p38 (# 4511), anti-p-IκBα(# 2859),anti-p-TBK1 (# 5483), anti-p-NF-κB(# 3033)和anti-IκBα(# 4814)从细胞信号技术公司(美国贝弗利CST)。抗体anti-IKKα(# ab32041), anti-MEK1/2 (# ab178876), anti-p-MEK1/2 (# ab278564), anti-ERK1/2 (# ab184699), anti-p-ERK1/2 (# ab201015), anti-NF-κB (# ab16502), anti-TGF-β1 (# ab179695), anti-TAK1 (# ab50431), anti-TBK1 (# ab40676), anti-HA (# ab18181), anti-Flag (# ab205606), anti-CD11b (# ab133357), anti-DUSP22 (# ab70124), anti-DUSP3 (# ab248113), anti-EGFP (# ab184601), anti-HNF4a (# ab201460), anti-CK19 (# ab52625)和anti-α-SMA (# ab124964)买来Abcam(美国Cambridge, MA)。抗体anti-p-IKKα(# pa5 - 36652), anti-p-FAKgydF4y2BaY397gydF4y2Ba(# 44 - 624 G), anti-p-FAKgydF4y2BaY576 + Y577gydF4y2Ba(# pa5 - 37706), anti-FAK (# pa5 - 88093), anti-p-TAK1 (# pa5 - 99340), anti-HA (# pa1 - 985), anti-Flag (# ma1 - 91878), anti-F4/80(# 41-4801-82),反- ki - 67 (# pa5 - 19462) anti-p-ASK1 (# pa5 - 105027), anti-ASK1 (# pa5 - 20200), anti-DUSP8 (# pa5 - 18007), anti-DUSP9 (# pa5 - 106527), anti-DUSP12 (# pa5 - 89113), anti-DUSP14 (# pa5 - 15565), anti-DUSP16 (# pa5 - 23140), anti-DUSP26 (# pa5 - 22013), anti-Albumin (# pa5 - 89332),和anti-PECAM (# pa5 - 32321)购买了从热费希尔科学,Inc .)、美国沃尔瑟姆)。抗体anti-DUSP22 (# H00056940-B01P和# nbp1 - 83078)获得罗福斯生物制剂(美国)。Diethylnitrosamine(窝;猫# 55-18-5),棕榈酸酯(PA;猫# P9767)、油酸(OA);猫# O1008),活性氧清除剂N-acetyl-cysteine(南京;猫# A7250)和脂多糖(LPS);来自gydF4y2Ba大肠杆菌gydF4y2Ba(055:B5);猫# L2880)从Sigma-Aldrich购买(圣路易斯,美国)。重组人il - 6(猫# 206 - il - 050 / CF), TNF-α(猫# 210 - ta - 020 / CF),和TGF-β1(猫# 240 - b - 002)蛋白质是购买从研发系统(明尼阿波利斯,美国)。gydF4y2Ba
人类的样本gydF4y2Ba
人类肝脏组织样本收集从成人非酒精性脂肪肝患者接受肝移植或肝脏活组织检查麻醉。相应的控制肝组织收获来自捐献者不能用于肝移植,因为non-hepatic原因。无脂肪变性(n = 16),纳什肝脏(gydF4y2BangydF4y2Ba= 20)样本收集和包括在这项研究中。短暂,标本与纳什活动分数分为non-steatotic (NAS)的0。样品与NAS≥5或3 - 4的NAS,但显示肝纤维化是包含在纳什群。肝脏脂肪变性患者样本满足下列标准被排除在研究:过量饮酒(> 140 g男性或> 70 g为女性,每周),药物滥用,或病毒感染(包括感染乙型肝炎病毒或丙肝病毒)。人类NAFLD-associated肝细胞癌肿瘤组织和邻近的正常组织从患者获得biopsy-proven NAFLD-HCC (gydF4y2BangydF4y2Ba= 8)。通知和书面同意之前获得所有受试者或其家庭成员参与这项研究。特点、肝脏injury-associated血清学和NAS NASH患者补充表中列出gydF4y2BaS1gydF4y2Ba和gydF4y2BaS2gydF4y2Ba,NAFLD-HCC受试者的临床信息显示在补充表gydF4y2BaS3gydF4y2Ba。本研究中使用的所有程序涉及人类受试者符合赫尔辛基宣言中概述的原则,完全由学术研究伦理委员会批准重庆市重点实验室在三峡水库地区的药用资源和其他参与单位。gydF4y2Ba
动物实验gydF4y2Ba
所有程序和协议为动物实验动物保健和使用委员会批准所有参与单位。对于这个调查,我们专注于雄性老鼠在人类基于事实,非酒精性脂肪肝/纳什在男性比女性更为普遍gydF4y2Ba68年gydF4y2Ba。老鼠可以适应生活环境的所有正常实验开始前一周。所有的动物都被安置在一个恒定的温度,湿度(由格力中央空调控制,# GMV-Pd250W / NaB-N1,中国),和pathogen-free-controlled环境(第23 - 25°C, 50 - 60%)笼标准12 h光/ 12 h黑暗周期,大量的水和食物(无菌)在笼子里。gydF4y2Ba
动物品种gydF4y2Ba
所有的男性,正常野生型(WT) C57BL / 6 N小鼠(6 - 8周大;22日至25日克体重)使用在当前的研究中从北京购买重要河流实验动物科技有限公司有限公司(中国,北京)。年龄(6 - 8周大)男性ob / ob小鼠(# N000103)是购自南京南京大学生物医学研究所)。gydF4y2Ba
生成条件敲除基因的老鼠DUSP22, DUSP22gydF4y2Ba液氧/液氧gydF4y2Ba建立了小鼠C57BL / 6 N背景使用CRISPR / Cas9-regulated基因组工程系统。DUSP22被选为条件敲除的第3外显子区域(cKO)。简单地说,选择的外显子DUSP22的两侧是两个loxP网站,因此两个单指导rna (gRNA1 #和gRNA2 #)针对DUSP22内含子的设计。针对向量包含DUSP22外显子3两侧是两个loxP网站和两个同源臂被用作模板。目标向量,gRNA1 #, gRNA2 #,连同Cas9 co-injected到受精卵cKO的鼠标生产。获得的小鼠,外显子3两侧是两个loxP网站一个等位基因,被用来建立DUSP22gydF4y2Ba液氧/液氧gydF4y2Ba老鼠。(DUSP22 Hepatocyte-specific DUSP22删除gydF4y2BaHepKOgydF4y2Ba)DUSP22交配产生的老鼠gydF4y2Ba液氧/液氧gydF4y2Ba老鼠老鼠albumin-Cre (Alb-Cre)(美国缅因州杰克逊实验室,巴尔港)。一个简单的示意图表示在补充图。gydF4y2BaS6AgydF4y2Ba。DUSP22gydF4y2Ba液氧/液氧gydF4y2Ba(液氧)同窝出生的小鼠被用于作为获得DUSP22控制工作gydF4y2BaHepKOgydF4y2Ba老鼠。gydF4y2Ba
获得小鼠DUSP22条件敲,RosaDUSP22小鼠C57BL / 6 N背景建立了使用DUSP22条件敲在Rosa26轨迹的老鼠CRISPR / Cas-regulated基因组工程系统。总之,Rosa26-pCAG-loxp-STOP-loxp-mDUSP22-pA磁带是克隆的基因内区1 Rosa26。工程师针对向量,同源性武器然后由PCR使用BAC克隆为模板。此后,针对矢量,gRNA, Cas9 co-injected RosaDUSP22鼠标生产成受精卵。在表明实验中,肝细胞(DUSP22 DUSP22条件超表达的gydF4y2BaHepOEgydF4y2Ba)是通过注射腺相关诱导virus-serotype 8 (AAV8) -thyroxine-binding球蛋白(油管)promoter-Cre重组酶向量(AAV8-TBG-Cre)通过静脉注射,然后利用免疫印迹分析决定。一个简单的示意图表示在补充图。gydF4y2BaS10AgydF4y2Ba。RosaDUSP22老鼠同窝出生没有AAV注入被用作DUSP22获得控制gydF4y2BaHepOEgydF4y2Ba老鼠。gydF4y2Ba
的hepatocyte-specific FAK-knockout (FAKgydF4y2BaHepKOgydF4y2Ba)小鼠的外显子4删除FAK生产使用协议类似于DUSP22成立的一个描述gydF4y2Ba液氧/液氧gydF4y2Ba老鼠和DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠。简单地说,FAKgydF4y2Ba液氧/液氧gydF4y2Ba老鼠被设计和建造CRISPR / Cas-mediated基因组工程系统。FAK基因的外显子4地区被选为一个条件敲除。工程师针对向量,同源性武器和cKO地区由PCR的BAC克隆C57BL / 6 N库作为模板。然后Cas9 gRNA co-injected到受精卵老鼠生产目标向量。然后,FAKgydF4y2Ba液氧/液氧gydF4y2Ba与Alb-Cre老鼠老鼠交叉生成hepatocyte-specific FAK缺乏小鼠(FAKgydF4y2BaHepKOgydF4y2Ba)。一个简单的示意图表示在补充图。gydF4y2BaS21AgydF4y2Ba。FAK-floxed老鼠的同胞被用作FAK获得控制gydF4y2BaHepKOgydF4y2Ba老鼠。gydF4y2Ba
的hepatocyte-specific DUSP22 (DUSP22gydF4y2BaHepKOgydF4y2Ba)和FAK (FAKgydF4y2BaHepKOgydF4y2Ba)双删除(Hep-DKO)老鼠跨越DUSP22生成gydF4y2Ba液氧/液氧gydF4y2Ba小鼠与FAKgydF4y2BaHepKOgydF4y2Ba老鼠。获得的后代没有DUSP22 FAK蛋白表达,证实,使用免疫印迹分析和选择,用于进一步的体内实验。一个简单的示意图表示在补充图。gydF4y2BaS21DgydF4y2Ba。gydF4y2Ba
纳什小鼠模型的建立gydF4y2Ba
两个不同的纳什在小鼠模型构建和相应的实验研究中使用。首先,全身的脂肪+高胆固醇的饮食(饲料)纳什小鼠模型建立了用饲料喂养雄性小鼠饲料(包含42%的饱和脂肪,14%的蛋白质,碳水化合物,44%和0.2%胆固醇w / w) 24周gydF4y2Ba69年gydF4y2Ba。与正常食物饮食的老鼠(20%的蛋白质,10%的脂肪和碳水化合物,70% # D12450H;研究饮食,美国新泽西州新不伦瑞克)24周被定义为控制(非传染性疾病)。第二个纳什模型使用高脂肪饮食+执行蛋氨酸和choline-deficient饮食(HFMCD)。短暂,雄性老鼠HFMCD饮食(HFMCD A06071301B,研究饮食)8周gydF4y2Ba17gydF4y2Ba,gydF4y2Ba70年gydF4y2Ba。控制老鼠收到相应的正常饮食(非传染性疾病、专业feed)。gydF4y2Ba
动物研究设计1 #gydF4y2Ba
的6-8-week-old WT雄性老鼠喂养的饲料24周诱导纳什表型和WT老鼠24周的标准非传染性疾病被定义为对照组(非传染性疾病)。年龄(6 - 8周大)ob / ob老鼠作为另一个脂肪肝模型和美联储非传染性疾病。最后的实验时间,从所有小鼠肝脏样本收集进行进一步分析。gydF4y2Ba
动物研究设计2 #gydF4y2Ba
检查ROS DUSP22表达式在纳什的作用进程,6-8-week-old WT雄性老鼠喂养的饲料24周。NAC(150毫克/公斤)受到老鼠通过腹腔内注射每周两次消除活性氧HFHC-challenged老鼠gydF4y2Ba17gydF4y2Ba。汽车组老鼠收到同样体积的生理盐水。gydF4y2Ba
动物研究设计3 #gydF4y2Ba
(DUSP22 Hepatocyte-specific DUSP22删除gydF4y2BaHepKOgydF4y2Ba)雄性老鼠喂养的饲料24周诱导纳什表型。获得条件DUSP22功能(GOF)小鼠饲料饮食RosaDUSP22老鼠注射1.5×10gydF4y2Ba12gydF4y2Ba基因组拷贝(gc)的剂量AAV8-TBG-Cre向量通过尾静脉诱导hepatocyte-specific DUSP22过度(DUSP22gydF4y2BaHepOEgydF4y2Ba/饲料)。RosaDUSP22小鼠给予同等剂量的AAV空向量(EV)作为控制(DUSP22gydF4y2BaHepRosagydF4y2Ba/饲料)。一个简单的原理图已经显示在无花果。gydF4y2Ba3gydF4y2Ba。gydF4y2Ba
动物研究设计4 #gydF4y2Ba
探索的功能DUSP22在饲料食源性纳什病态,ex vivo-mediated DUSP22基因疗法干预通过lentivirus-packaged长篇DUSP22序列(LV-DUSP22)或成分针对DUSP22 LV-shDUSP22转导和移植进行预先处理8周HFHC-fed WT雄性老鼠。的详细协议体外治疗性实验建立了根据我们以前的报告gydF4y2Ba71年gydF4y2Ba。给出了实验设计的简单图Fig。gydF4y2Ba7一个gydF4y2Ba。的体外治疗干预,小鼠禁食8 h,然后眼睛血液和肝脏样本收获,称重,并存储在−80°C进行进一步的动物实验。肝组织的其他部分进行组织学分析和生化分析。gydF4y2Ba
动物研究设计5 #gydF4y2Ba
获得另一个纳什食源性肝病,DUSP22gydF4y2BaHepKOgydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba雄性老鼠HFMCD饮食喂养8周创建纳什表型。DUSP22gydF4y2BaHepKOgydF4y2Ba和DUSP22gydF4y2BaHepOEgydF4y2Ba老鼠产生如上所述。DUSP22gydF4y2Ba液氧gydF4y2Ba和DUSP22gydF4y2Ba罗莎gydF4y2Ba老鼠被用作控制,分别。所有的老鼠受到8周HFMCD或非传染性疾病。一个简单的示意图表示在补充图。gydF4y2BaS14A和BgydF4y2Ba。gydF4y2Ba
动物研究设计6 #gydF4y2Ba
进一步探索在纳什DUSP22进展的影响,完整的鼠标DUSP22序列或鼠标DUSP22序列与PTP-motif域删除加载在创建AAV-TBG-DUSP22或AAV-TBG-DUSP22 AAV8向量(ΔPTP主题)向量。的DUSP22gydF4y2BaHepKOgydF4y2Ba随后老鼠注射1.5×10gydF4y2Ba12gydF4y2Ba基因组拷贝(gc)剂量的功能对应的向量产生DUSP22 (GOF)雄性老鼠。这些老鼠被喂食了24周饲料触发纳什表型(消息灵通的gydF4y2BaDUSP22gydF4y2BaGOF /饲料,消息灵通的gydF4y2BaDUSP22-ΔPTP主题gydF4y2BaGOF /饲料)。相应的小鼠注射空白向量作为控制。一个简单的示意图表示在补充图。gydF4y2BaS20AgydF4y2Ba。gydF4y2Ba
动物研究设计7 #gydF4y2Ba
男性DUSP22gydF4y2BaHepKOgydF4y2Ba老鼠,FAKgydF4y2BaHepKOgydF4y2Ba老鼠,老鼠Hep-DKO,液氧老鼠饲料的24周产生纳什表型和探索病理改变。gydF4y2Ba
动物研究设计8 #gydF4y2Ba
进一步探索对纳什DUSP22进展的保护作用。男性FAKgydF4y2BaHepKOgydF4y2Ba老鼠和FAKgydF4y2Ba液氧gydF4y2Ba老鼠注射/不通过门静脉LV-shDUSP22向量建立hepatocyte-specific DUSP22-FAK丧失小鼠或hepatocyte-specific DUSP22丧失饲料喂养的小鼠在24周(FAKgydF4y2BaHepKOgydF4y2Ba/饲料)或饲料喂养(FAK的一半gydF4y2BaHepKOgydF4y2Ba/ LV-shDUSP22 /饲料,FAKgydF4y2Ba液氧gydF4y2Ba/ LV-shDUSP22 /饲料)。一个简单的示意图表示在补充图。gydF4y2BaS22AgydF4y2Ba。gydF4y2Ba
动物研究设计9 #gydF4y2Ba
调查DUSP22表达式的函数和FAK激活NASH-associated肝癌,NASH-HCC动物模型被建立。男性WT C57BL / 6 N小鼠,DUSP22gydF4y2Ba液氧gydF4y2Ba,DUSP22gydF4y2BaHepKOgydF4y2Ba,DUSP22gydF4y2BaHepRosagydF4y2Ba,DUSP22gydF4y2BaHepOEgydF4y2Ba,FAKgydF4y2BaHepKOgydF4y2Ba,hepatocyte-specific DUSP22双基因敲除和FAK (Hep-DKO)老鼠被创建为上面提到的ip注射一剂窝(25毫克/公斤)2周时,美联储饲料8周时开始。NASH-HCC建立ob / ob老鼠是由ip注射单剂量的巢穴(25毫克/公斤)2周时,当时受到非传染性疾病的饮食。饲料喂养24周后,小鼠牺牲了,他们的血清和肝组织样本收集。肝表面的肿瘤和肿瘤大小测量和分析。gydF4y2Ba
实验期间,体重、空腹血糖、空腹血清胰岛素浓度,和食物摄入量在不同时间点记录和测量显示在每个图的传说。gydF4y2Ba
细胞培养gydF4y2Ba
复苏细胞株用于我们的实验室都是通过不超过30倍。细胞系参与实验需要检测支原体污染的PCR分析。人类正常的L02肝细胞细胞系从文化的集合类型购买中国科学院(中国上海),并培养在杜尔贝科修改鹰介质(DMEM) (# 22320030, Gibco®)补充10%胎牛血清(的边后卫;# 10100147,Gibco penicillin-streptomycin®)和1% (# SV30010;Hyclone)湿润孵化器(热费希尔科学)有限公司为5%gydF4y2Ba2 gydF4y2Ba在37°C。人类肝星状细胞(HSC)线LX2和人类肝癌细胞系(Hep3B和HepG2)是来自默克密理博(上海,中国)和美式文化收集(写明ATCC;美国弗吉尼亚州马纳萨斯),分别。人肝癌细胞株smmc - 7721是来自上海细胞库类型文化收藏委员会(CBTCCC、上海、中国)。所有细胞都保持在DMEM培养基中5%与10%的边后卫和1% penicillin-streptomycin有限公司gydF4y2Ba2 gydF4y2Ba孵化器在37°C。小鼠原发性肝细胞用于研究与相应的表示组小鼠肝脏灌注方法如前所述gydF4y2Ba69年gydF4y2Ba,gydF4y2Ba71年gydF4y2Ba。简而言之,小鼠的腹腔无痛麻醉条件下开放。此后,肝脏组织灌注仔细1×肝脏灌注介质(# 17701 - 038,Gibco™)和1×肝脏消化介质(# 17703 - 034,Gibco™)通过门静脉。随后,100µm钢网是用于研磨和筛选消化肝脏样本。老鼠的主要肝细胞然后通过离心法收集滤液在800 rpm, 5分钟4°C,进一步纯化使用50% percoll解决方案(# 17-0891-01,通用电气医疗集团生命科学)。获得的肝细胞保持在DMEM培养基含有10%的边后卫和1% penicillin-streptomycin和培养在37°C细胞孵化器有限公司为5%gydF4y2Ba2 gydF4y2Ba。模仿体内肝脏脂质沉积和脂肪变性,细胞被孵化的显示剂量阿宝宾夕法尼亚州(0.4毫米和0.8毫米OA), TNF-α,il - 6,有限合伙人,或者TGF-β1如图传说调查证明DUSP22体外实验的功能。gydF4y2Ba
淘汰赛细胞系的建设gydF4y2Ba
的一代和协议FAK-deficient L02细胞系进行如前所述gydF4y2Ba72年gydF4y2Ba。短暂,L02细胞与FAK消融线是由CRISPR / Cas9基因编辑系统。小指南RNA (sgRNA)针对产生的人类FAK基因和克隆到lentiCRISPRV2向量生成Cas9-sgRNA慢病毒。益生元序列用于生成sgRNA表达载体显示为:sgFAK-1 #: 5“-ACTGGTATGGAACGTTCTCC-3”;sgFAK-2 #: 5“-TGAGTCTTAGTACTCGAATT-3”。随后,pMD2包装向量。G和psPAX2,连同相应的sgRNA表达载体,然后分别转染成HEK293T细胞使用Lipofectamine™CRISPRMAX™Cas9或FuGENE®6转染试剂42 h。然后,获得的L02细胞转导上层清液含慢病毒构建目标基因缺陷细胞系。细胞克隆目标基因敲除选择使用免疫印迹分析。gydF4y2Ba
向量建立和转染gydF4y2Ba
过DUSP22,人类全身DUSP22表达向量生成的pcr扩增的cDNA,然后克隆到3×Flag-tagged pcDNA3.1向量或3×HA-tagged pcDNA3.1向量(表达载体),分别。截断人类DUSP22 FAK表达质粒片段包括FAK-HA DUSP22-Flag, DUSP22(1 - 144)旗,DUSP22(145 - 184)的旗帜,和FAK(1 - 400)哈哈,FAK(1 - 693)哈哈,FAK(401 - 693)哈哈,FAK(401 - 904)哈哈,FAK(694 - 904)哈哈,FAK公顷(694 - 1052),和FAK (905 - 1052) ha作为显示在无花果。gydF4y2Ba5 fgydF4y2Ba和无花果。gydF4y2Ba5克gydF4y2Ba和图传说,生产使用标准的PCR方法,然后被克隆到相应的向量。的Flag-FAK WT表达质粒构建基于pcDNA3.1向量。此外,FAK和相应的衍生品,包括FAK的唯一完整的氨基酸残基是FAK-FERM, FAK-Kinase, FAK-FRNK,然后装进Flag-tagged pcDNA3.1向量(热费希尔科学)。获得向量被小心翼翼地转染进L02或FAK-knockout L02细胞使用Lipofectamine™3000转染试剂(英杰公司™)根据制造商的协议。此外,探索影响DUSP22在体外实验中,我们构造了一个adenovirus-packaged目标基因表达载体。人类和老鼠全身DUSP22序列和具体的针对人类短发卡RNA寡核苷酸序列或鼠标DUSP22 (shDUSP22) (shRNA序列RNAi # 1: 5“-TACCTGTGCATCCCAGCAG-3”;# 2:5“-ACACTGGTGATCGCATACA-3”对人类;RNAi # 1: CAGGAGTTTGAGAAACATGAA;RNAi # 2: 5“-CCCATGTTGGAGGGAGTTAAA-3”鼠标),人类与C88S WT DUSP22序列突变(DUSP22 (C88S)的半胱氨酸→Ser替换)gydF4y2Ba21gydF4y2Ba,针对人类或鼠标使命®shRNA质粒DNA FAK (shFAK)获得Sigma-Aldrich (SHCLND-NM_153831 SHCLND-NM_007982)分别打包成腺病毒(Ad-DUSP22, Ad-DUSP22 (C88S) Ad-shDUSP22,和Ad-shFAK)容易Adenoviral向量系统工具包(# 240009,安捷伦科技)。Ad-GFP和Ad-shRNA(炒RNA)作为控制,分别。重组腺病毒的纯化和滴定5×10gydF4y2Ba10gydF4y2Ba点状单位(PFU)。病毒的验证是基于病毒的DNA分析,这是一个病毒空斑纯化限制性内切酶。生成LV-DUSP22或LV-shDUSP22向量,鼠标DUSP22 cDNA序列或成分针对鼠标DUSP22序列被包装成pLenti-RFP-Puro-CMV或pLenti-U6-EGFP抑制或调控DUSP22表达式体内实验。gydF4y2Ba
肝功能指标和脂质含量测定gydF4y2Ba
的浓度血清丙氨酸转氨酶(ALT) (# MAK052, Sigma-Aldrich)、天冬氨酸转氨酶(AST) (# MAK055, Sigma-Aldrich)、碱性磷酸酶(AKP) (# ab83369, Abcam)、血清胰岛素(# ab277390, Abcam)和肝甘油三酯(TG) (# MAK266, Sigma-Aldrich)、总胆固醇(TC) (# ab65359, Abcam)和nonesterified游离脂肪酸(NEFA) (# E-BC-K014 Elabscience, Inc .)、休斯顿、美国)使用商用检测试剂盒检测根据制造商年代的协议。gydF4y2Ba
Co-Immunoprecipitation (Co-IP)分析gydF4y2Ba
免疫沉淀反应检测进行了研究(如前所述)gydF4y2Ba69年gydF4y2Ba,gydF4y2Ba71年gydF4y2Ba。简单,细胞或肝组织均质成IP专用溶菌作用的解决方案(# 87787,皮尔斯™IP裂解缓冲,热科学皮尔斯)在4°C,在13000转离心20分钟紧随其后。细胞溶解产物被收集和孵化与蛋白质A / G磁琼脂糖珠(# 78609,热科学皮尔斯)在室温下搅拌1 - 2 h,并随后被co-incubated表示抗体在一夜之间在4°C。与装有冲洗后免疫沉淀反应洗缓冲区,免疫复合物被收集并进行免疫印迹分析显示主要抗体和相应的二次抗体。gydF4y2Ba
谷胱甘肽S-transferase(销售税)下拉试验gydF4y2Ba
直接DUSP22蛋白质相互作用和FAK利用消费税拉试验之前进行报道gydF4y2Ba14gydF4y2Ba。快速皮尔斯™销售税蛋白质相互作用下拉工具(# 21516,热费希尔科学)被用来研究蛋白质绑定。总之,罗塞塔(DE3)gydF4y2Ba大肠杆菌gydF4y2Ba(gydF4y2Ba大肠杆菌gydF4y2Ba)细胞转化质粒pGEX-4T-1-GST-DUSP22或pGEX-4T-1-GST-FAK然后诱导表达通过与0.5毫米孵化β-D-thiogalactopyranoside异丙酯(IPTG) (# I5502, Sigma-Aldrich)。拔牙的溶解性gydF4y2Ba大肠杆菌gydF4y2Ba与相应的销售税混合珠子在4°C 1 h。然后,消费税珠子与Flag-tagged co-incubated DUSP22或Flag-tagged FAK,由IP为另一个4 h。蛋白质的相互作用是在洗脱筛选了缓冲区,然后使用anti-Flag抗体进行免疫印迹。的gydF4y2Ba大肠杆菌gydF4y2Ba表达GST-tag作为消极的控制。gydF4y2Ba
RNA提取、质量控制和高通量定量PCR (HTqPCR)gydF4y2Ba
肝脏样本或细胞总RNA提取使用试剂盒™试剂(# 15596 - 018,热费希尔科学)根据制造商的指示。然后,1µg总RNA的提取是反向转录使用M-MLV-RT系统(英杰公司),这是在42°C 1 h和终止酶的失活10分钟的70°C。随后,进行了PCR SYBR绿色(Bio-Rad)在7900年ABI棱镜ht系统(美国应用生物系统公司)。特定的引物序列是由表达载体或Generay生物技术(上海,中国),和补充表中列出gydF4y2BaS4gydF4y2Ba。2折感应值计算gydF4y2Ba(−ΔΔCt)gydF4y2Ba表达式。ΔCt代表循环阈值的差异数量之间的目标基因和GAPDH和ΔΔCt代表的相对变化控制和治疗组之间的差异。gydF4y2Ba
高通量定量PCR (HTqPCR), TaqMan®低密度阵列(P / N 4342259, TLDA卡片、ABI、希尔登,德国)与384 -微流控牌是用于比较分析基因表达根据制造商的指示。TLDA卡用于本研究由ABI公司定制的需求后,我们目前的实验。获得的卡片是基于TaqMan化学基因表达的一个面板1运行的128个基因进行了分析。同时,TLDA卡片预装TaqMan目标基因表达分析的重要性为87炎症相关的基因,25脂质代谢相关的基因,和16个pro-fibrosis-related基因,和6为归一化控制设计。获得的基因表达改变被规范化的均值5 6控制(GAPDH、β-actinβ-tubulin, B2M, HPRT1)相同的样本(ΔCT),选择符合其稳定性。数据从任何一个随机选择的组被定义为一个标准量具(ΔΔCT)和数据从其他组都是标准化的。基因表达水平终于表示相对表达式(呈现褶皱变化(2gydF4y2Ba-ΔΔCTgydF4y2Ba)方法计算)。TaqMan基因表达主人混合(P / N 4369510,应用生物系统公司)是运行HTqPCR时使用。ABI棱镜SDS 2.1软件连接7900 ht ABI棱镜系统用于数据分析和量化。最终获得的数据和结果的热图的形象。gydF4y2Ba
西方墨点法gydF4y2Ba
细胞或肝脏样本均质成里帕裂解和提取缓冲(# 89900,热费希尔科学)匀浆。然后,最后的液体上层清液离心机在13500 rpm, 30分钟4°C。蛋白质浓度使用PierceTM快速检查黄金BCA分析工具与BSA作为标准后,供应商的协议。总蛋白提取样本进行免疫印迹分析。等量的获得的总蛋白(20 - 50μg)受到10 - 12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds - page)系统,然后转移到一个0.45µM PVDF膜(# 10600023,Amersham Hybond,通用电气医疗集团生命科学,德国)。随后,PVDF膜被封锁的5%脱脂牛奶(美国BD DifcoTM脱脂牛奶)1×TBS缓冲区(# T1080, Solarbio,北京)含0.1% Tween-20 (# abs9152 Absin,中国)(TBST)用1 h和混合的主要抗体(稀释1:1000或1:50 0)在一夜之间在4°C。此后,洗了PVDF膜1×TBST三次和随后co-treated辣根过氧化物酶(合)共轭anti-rabbit (# ab6721)或anti-mouse (# ab6789)二级抗体(Abcam稀释1:8000)在室温下为1.5 h。西方墨点法乐队是可视化使用PierceTM ECL +免疫印迹基质(# 32134,热费希尔科学)和暴露于柯达(美国伊士曼柯达公司)x光胶片。随后相应的蛋白表达水平确定为灰度值(版本1.52 v,形象J,国立卫生研究院、美国)和标准化的看家基因(GAPDH),表示为一个褶皱的控制。gydF4y2Ba
代谢指标和血清细胞因子参数评估gydF4y2Ba
GTT进行小鼠禁食了8 h。小鼠腹腔注射葡萄糖(2克/公斤体重)(# 158968,Sigma-Aldrich)。然后,尾静脉血液中血糖的浓度(0)15、30、60、120分钟后测定了葡萄糖注射液商业血糖测试条(ACCU-CHEK®,罗氏糖尿病护理GmbH是一家,上海,中国。最后,空腹胰岛素和空腹血糖水平被用来计算稳态模型评估胰岛素抵抗(HOMA-IR)。下面的方程被用来计算HOMA-IR价值观:血液(葡萄糖(mg / dL)×(血清胰岛素(μU /毫升)/ 405gydF4y2Ba73年gydF4y2Ba。小鼠的血清中细胞因子和趋化因子的内容检查使用相应的商业酶联免疫吸附剂测定(ELISA)试剂盒,包括鼠标TNF-α(# MTA00B), IL-1β(# MLB00C), il - 6 (# M6000B), il - 10 (# M1000B)和MCP-1 (# MJE00B) ELISA试剂盒购自研发系统根据制造商的协议。相应的血清小心地储存在−80°C冰箱之前使用。对于人类来说,血清TNF-α内容(# DTA00D)地震(# DY318-05), il - 6 (# D6050), MCP-1 (# DCP00)和TGF-β1 (# DY240)测量使用相应的人类ELISA试剂盒(研发系统)根据制造商的指示。gydF4y2Ba
细胞内TG和炎性细胞因子测定gydF4y2Ba
使用商业甘油三酯测定细胞内TG含量测量工具量化(# ab65336, Abcam)根据制造商的协议。对于小鼠原发性肝细胞,细胞因子在中计算使用相应的商业ELISA试剂盒,包括TNF-α(# MTA00B), IL-1β(# MLB00C)和il - 6 (# M6000B)都从研发系统遵循制造商的指示。L02细胞,TNF-α的内容(# DTA00D), IL-1β(# QLB00B)和il - 6 (# D6050)收集媒介评估使用相应的ELISA试剂盒(研发系统)按照制造商推荐的程序。gydF4y2Ba
组织病理和免疫组织化学染色gydF4y2Ba
探索组织病理和免疫组织化学的变化,肝脏组织因此固定与4% formaldehyde-histological组织固定剂(# R37814,照片™,英杰公司™),嵌入在石蜡(# YA0010, Solarbio生命科学,北京),然后分段横向(5µm厚)。薄被苏木精和伊红染色肝组织部分(圆))(# ab245880,苏木精和伊红染色设备,Abcam)可视化肝脏的脂质积累的模式和炎症。NAS分数分数之和)分析后三个组件,包括脂肪变性(0 - 3),小叶炎症(0 - 3)和肝细胞膨胀(0 - 2)。进一步表明在肝脏脂质积累,部分被冻结在Tissue-Tek最佳切削温度(O.C.T.) (# 4583, Tissue-Tek樱花Finetek,美国),然后沾油红O染色工具包(# ab150678, Abcam) 10分钟。60%异丙醇清洗后(# I9030, Sigma-Aldrich),肝脏部分与苏木精re-stained。此外,检查在肝组织中胶原蛋白积累,部分沾马森三色的染色(# G1346,马森的三色的染色设备,Solarbio生命科学)和天狼星红染色(# ab150681, Picro天狼星红染色装备,Abcam)。执行免疫组织化学分析,嵌入式部分脱蜡,通过柠檬酸钠加热抗原被检索。内源性过氧化物酶被通过添加30% HgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba和免疫组织化学的钢笔是用来组织周围画一个圆。然后,5%山羊血清(# C0265, Beyotime、上海、中国)添加阻止肝脏组织。部分被孵化的主要抗体anti-CD11b (# ab133357 Abcam,稀释1:200)和DUSP22(美国罗福斯生物制品# nbp1 - 83078;稀释1:200)在4°C在指定的组。部分被洗了三次与PBS 3分钟,其次是孵化anti-rabbit免疫球蛋白(合)二级抗体(# ab6721 Abcam,稀释1:200)在室温下1 h。免疫组织化学染色观察使用3,3 ' -diaminobenzidine (DAB)衬底工具包(# ab64238, Abcam)和与苏木精复染色。所有图片都被使用光学显微镜(日本奥林巴斯)组织观察。positive-staining区域进行了分析和量化Image-Pro +软件(版本6.0),结果被表示为一个百分比(%)提起的大功率的总面积(高通滤波器)。gydF4y2Ba
免疫荧光染色gydF4y2Ba
免疫荧光显微镜,冷冻肝脏部分(5µm厚)在室温下放置20分钟,然后用PBS洗了三遍。肝脏部分被封锁在10%山羊血清(# C0265, Beyotime)含0.3% Triton x - 100 (# ST797, Beyotime) 1 h与初级抗体在室温和孵化DUSP22 (# H00056940-B01P,稀释1:200)phospho-FAK (Tyr576 + 577) (# pa5 - 37706,稀释1:10 0),phospho-FAK (Tyr397) (# 44 - 624 G,稀释1:10 0),F4/80(# 41-4801-82,稀释1:200),ki - 67 (# pa5 - 19462,稀释1:200),EGFP (# ab184601,稀释1:50)、白蛋白(# pa5 - 89332,稀释1:10 0),HNF4a (# ab201460,稀释1:10 0)、CK19 (# ab52625,稀释1:50)PECAM (# pa5 - 32321,稀释1:10 0)和α-SMA (# ab124964,稀释1:50)一夜之间在4°C。部分与PBS然后洗了三次。Anti-rabbit免疫球蛋白g h和l (Alexa萤石®594)(# ab150080), anti-mouse免疫球蛋白g h和l (Alexa萤石®488)(# ab150113)或anti-rat免疫球蛋白g h和l (Alexa萤石®488)(# ab150165)二次荧光抗体(Abcam稀释施用)准备肝脏幻灯片在黑暗中在室温下孵化1 h。与PBS洗涤后,2 - (4-Amidinophenyl)−6-indolecarbamidine盐酸盐溶液(DAPI;# C1006 Beyotime)被添加到部分细胞核染色5分钟后跟PBS洗涤。图像可视化和捕获在荧光显微镜(日本奥林巴斯)。colocalization考试,L02细胞和小鼠肝细胞与质粒编码co-transfected Flag-tagged DUSP22(绿色)和HA-tagged FAK(红色)24 h。随后,这些细胞被double-stained anti-Flag和anti-HA抗体,紧随其后的是相应的fluorophore-conjugated二级抗体(Abcam)。图像被捕获在荧光显微镜(日本奥林巴斯)。gydF4y2Ba
氧化应激相关参数的测量gydF4y2Ba
肝组织与冷洗PBS溶液然后均质在冰上。离心后在4°C和1000×gydF4y2BaggydF4y2Ba15分钟,上层的收获。SOD活动评估评估antioxidases使用商业套装(# A001-3-2),结果给出了SOD的单位每毫克(mg)的蛋白质。肝脏的脂质过氧化状态是衡量测试(# A003-1-2) MDA水平,这是作为nmol /毫克的蛋白质。程序进行了根据设备制造商提供的说明(南京建成生物工程研究所、南京、中国)。肝组织细胞溶解使用裂解缓冲,然后在12000×离心机gydF4y2BaggydF4y2Ba5分钟在4°C。液体上层清液收集计算肝脏的HgydF4y2Ba2 gydF4y2BaOgydF4y2Ba2 gydF4y2Ba水平的商业工具(# S0038 Beyotime)推荐由制造商提供。gydF4y2Ba
活性氧(ROS)在肝脏gydF4y2Ba
ROS内容在肝脏测定使用dihydroethidium(她)染色(10μM;# S0063, Beyotime)新鲜冷冻肝脏部分(5μm厚)37°C 30分钟的湿润和暗室根据制造商的指示。使用荧光显微镜图像捕获(奥林巴斯、日本)和DHE-stained面积的百分比进行了分析和量化图像J软件(版本1.52 v,国立卫生研究院、美国)。gydF4y2Ba
细胞生存能力gydF4y2Ba
细胞生存能力测试使用细胞计数Kit-8化验设备根据制造商的指示。简单地说,稳定转染HepG2和smmc - 7721细胞被播种在96 -孔板(5000个细胞/)。孵化后表示,10μL细胞计数Kit-8试剂(# C0039, Beyotime)被添加到每个。孵化后4小时37°C。每个在450 nm的吸光度测量的标(SpectraMax iD3、分子器件、美国)检查可行的细胞的数量。gydF4y2Ba
尼罗红染色gydF4y2Ba
在24 h post-transfection,这些细胞被洗两次与PBS和固定4%多聚甲醛在室温下10分钟。另一个PBS冲洗后,细胞与尼罗红染色15分钟(# 7385-67-3,Solarbio)在室温下。执行与PBS洗涤后,核染色用DAPI (# C1006, Beyotime)额外的5分钟。荧光成像技术被使用荧光显微镜(日本奥林巴斯)。gydF4y2Ba
EdU染色试验gydF4y2Ba
稳定转染HepG2和smmc - 7721细胞(5×10gydF4y2Ba4gydF4y2Ba24-well板)被播种。执行试验使用BeyoClick™EdU细胞增殖工具包Alexa萤石594成像设备(# C0078S, Beyotime)。EdU染色后执行制造商的协议。然后,DAPI (# C1006 Beyotime)的解决方案是在室温下与细胞孵化5分钟。图像可视化和捕获在荧光显微镜(日本奥林巴斯)。EdU-positive细胞率是基于EdU-positive核的比率(红色)/荧光核(蓝色)。gydF4y2Ba
末端转移酶的dUTP缺口末端标记(TUNEL)染色体外gydF4y2Ba
一步TUNEL细胞凋亡测定工具包(# C1090 Beyotime)被用来研究细胞凋亡的稳定转染HepG2和smmc - 7721细胞根据制造商的协议。洗后两次与PBS和4%多聚甲醛固定30分钟,0.3%的细胞被permeabilized Triton x - 100 (# ST797, Beyotime)在室温下5分钟。然后,细胞被洗两次与PBS和孵化与TUNEL检测解决方案在37°C 1 h在黑暗中,紧随其后的是核与DAPI染色(# C1006, Beyotime)额外的5分钟。与PBS三次洗涤后,凋亡细胞的红色荧光被使用荧光显微镜(日本奥林巴斯)。细胞凋亡是计算TUNEL-positive细胞(红色)/ DAPI(蓝色)。gydF4y2Ba
统计分析gydF4y2Ba
定量数据的值表示为平均值±标准平均误差(SEM)。学生的双尾gydF4y2BatgydF4y2Ba以及进行比较的两群样本,和单向方差分析(方差分析)是用于比较多个组,其次是Bonferroni事后测试(用于数据显示方差齐性)或Tamhane T2 (M)事后测试(数据显示异方差性)。9.2.0 GraphPad棱镜软件(版本;图垫软件公司,圣地亚哥,CA)或SPSS统计软件(版本26.0.0.2;IBM公司,美国纽约)是用于最后的数据分析。gydF4y2BaPgydF4y2Ba值< 0.05被认为是重要的。随机化和炫目的方式是尽可能地使用。gydF4y2Ba
报告总结gydF4y2Ba
进一步研究信息设计是可用的gydF4y2Ba自然研究报告摘要gydF4y2Ba与这篇文章有关。gydF4y2Ba
数据可用性gydF4y2Ba
支持这项工作的结果的数据可从相应的作者的请求。没有数据可用性限制在当前的工作。gydF4y2Ba源数据gydF4y2Ba本文提供的。gydF4y2Ba
引用gydF4y2Ba
Younossi, z . m . et al。全球非酒精性脂肪肝的流行病学disease-meta分析评估等患病率,发病率和结果。gydF4y2Ba肝脏病学gydF4y2Ba64年gydF4y2Ba,73 - 84 (2016)。gydF4y2Ba
Younossi, z . m .非酒精脂肪肝疫情全球公共卫生的角度。gydF4y2Baj .乙醇。gydF4y2Ba70年gydF4y2Ba,531 - 544 (2019)。gydF4y2Ba
Grohmann, m . et al .肥胖驱动器STAT-1-dependent纳什和STAT-3-dependent肝癌。gydF4y2Ba细胞gydF4y2Ba175年gydF4y2Ba,1289 - 1306 (2018)。gydF4y2Ba
安思提,问:m . et al。从纳什到肝细胞癌:当前概念和未来的挑战。gydF4y2BaNat,启杂志。乙醇。gydF4y2Ba16克ydF4y2Ba,411 - 428 (2019)。gydF4y2Ba
Bedossa, p .病理学的非酒精性脂肪肝。gydF4y2Ba肝脏IntgydF4y2Ba。gydF4y2Ba37gydF4y2Ba,85 - 89 (2017)。gydF4y2Ba
Yki-Jarvinen, h .非酒精脂肪肝作为代谢综合征的原因和结果。gydF4y2Ba柳叶刀糖尿病性骨质。gydF4y2Ba2 gydF4y2Ba,901 - 910 (2014)。gydF4y2Ba
哈代,t . et al。非酒精性脂肪肝病:发病机制和疾病谱系。gydF4y2Ba为基础。启分册。gydF4y2Ba11gydF4y2Ba,451 - 496 (2016)。gydF4y2Ba
成Bril, f & Cusi k .管理非酒精性脂肪肝病的2型糖尿病患者:行动呼吁。gydF4y2Ba糖尿病护理gydF4y2Ba40gydF4y2Ba,419 - 430 (2017)。gydF4y2Ba
在纳什维兰纽瓦,m . t .有意识的解偶联。gydF4y2BaNat。启药物。gydF4y2Ba16克ydF4y2Ba,239 - 239 (2017)。gydF4y2Ba
王,D。,Tai, P. W. L. & Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery.Nat。启药物。gydF4y2Ba18gydF4y2Ba,358 - 378 (2019)。gydF4y2Ba
徐,y . et al .肝细胞的核因子4α阻止脂肪变性~纳什进展通过调节p53和胆汁酸信号(老鼠)。gydF4y2Ba肝脏病学gydF4y2Ba73年gydF4y2Ba,2251 - 2265 (2021)。gydF4y2Ba
张,p . et al . deubiquitinating酶TNFAIP3介导肝ASK1和改善非酒精性脂肪肝炎的失活。gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba,84 - 94 (2018)。gydF4y2Ba
Michailidis、大肠等。扩张,vivo-ex体内循环,基本人类肝细胞基因操作。gydF4y2BaProc。《科学。美国gydF4y2Ba117年gydF4y2Ba,1678 - 1688 (2020)。gydF4y2Ba
徐,m . x等人iRhom2促进肝脂肪变性,激活MAP3K7相关的通路。gydF4y2Ba肝脏病学gydF4y2Ba73年gydF4y2Ba,1346 - 1364 (2021)。gydF4y2Ba
徐,m . et al . E3 ubiquitin-protein连接酶针对Rhbdf2 Trim31减轻非酒精脂肪肝的鼠肝细胞。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba(2022),1 - 20。gydF4y2Ba
徐、最小值高宣等。三方主题量包含蛋白质31日授予保护非酒精性肝病的绝大促分裂原活化蛋白激酶激酶激酶7。gydF4y2Ba肝脏病学gydF4y2Bahttps://doi.org/10.1002/hep.32526gydF4y2Ba(2022)。gydF4y2Ba
咚,j . et al . Hepatocyte-specific IL11 cis-signaling驱动器lipotoxicity,构成从非酒精性脂肪肝过渡到纳什。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba1 - 15,。(2021)。gydF4y2Ba
王,j . et al .肝调节器的G蛋白信号5改善非酒精性脂肪肝病通过抑制转化生长因子beta-activated激酶1-c-Jun-N-terminal激酶/ p38信号。gydF4y2Ba肝脏病学gydF4y2Ba73年gydF4y2Ba,104 - 125 (2021)。gydF4y2Ba
黄,c . y &谭,t·h·DUSPs MAP激酶和超越。gydF4y2Ba细胞Biosci。gydF4y2Ba2 gydF4y2Ba,1 - 10 (2012)。gydF4y2Ba
m . b . et al . DUSP22和彼得TP63重组ALK-negative间变性大细胞淋巴瘤的预测结果:丹麦的队列研究。gydF4y2Ba血gydF4y2Ba130年gydF4y2Ba,554 - 557 (2017)。gydF4y2Ba
李,j . p . et al .物pathway-associated磷酸酶脱去磷酸粘着斑激酶和抑制细胞迁移。gydF4y2Ba生物。化学。gydF4y2Ba285年gydF4y2Ba,5472 - 5478 (2010)。gydF4y2Ba
林,惠普等。DUSP22抑制前列腺癌扩散,针对表皮生长因子受体的基于“增大化现实”技术的轴。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba33gydF4y2Ba,14653 - 14667 (2019)。gydF4y2Ba
陈,a . j . et al .双特异性JKAP专门激活c-Jun n端激酶途径。gydF4y2Ba生物。化学。gydF4y2Ba277年gydF4y2Ba,36592 - 36601 (2002)。gydF4y2Ba
y关根身上,et al . LMW-DSP2 STAT3-mediated调节信号。gydF4y2Ba致癌基因gydF4y2Ba25gydF4y2Ba,5801 - 5806 (2006)。gydF4y2Ba
关根身上,y . et al . DUSP22 / LMW-DSP2调节雌激素receptor-α-mediated信号通过脱磷酸作用ser - 118。gydF4y2Ba致癌基因gydF4y2Ba26gydF4y2Ba,6038 - 6049 (2007)。gydF4y2Ba
李,j . p . et al .磷酸酶JKAP / DUSP22抑制t细胞受体信号并通过灭活Lck自身免疫。gydF4y2BaCommun Nat。gydF4y2Ba5克ydF4y2Ba1-13 (2014)。gydF4y2Ba
雅克·s . et al . Dual-specificity磷酸酶3删除促进肥胖、非酒精性脂肪肝和肝细胞癌。gydF4y2Ba科学。代表。gydF4y2Ba11gydF4y2Ba1 - 15,(2021)。gydF4y2Ba
你们,p . et al .双特异性磷酸酶应承担9防止通过ASK1抑制小鼠的非酒精性脂肪肝病。gydF4y2Ba肝脏病学gydF4y2Ba69年gydF4y2Ba,76 - 93 (2019)。gydF4y2Ba
黄,z . et al .双特异性磷酸酶12调节肝脏脂质代谢通过抑制脂肪生成和细胞凋亡信号调节激酶1通路。gydF4y2Ba肝脏病学gydF4y2Ba70年gydF4y2Ba,1099 - 1118 (2019)。gydF4y2Ba
你们,p . et al .双特异性磷酸酶26应承担的保护对非酒精性脂肪肝小鼠通过转化生长因子beta-activated激酶1抑制。gydF4y2Ba肝脏病学gydF4y2Ba69年gydF4y2Ba,1946 - 1964 (2019)。gydF4y2Ba
王,s . et al。肝细胞DUSP14维护在肝脏代谢体内平衡和抑制炎症。gydF4y2Ba肝脏病学gydF4y2Ba67年gydF4y2Ba,1320 - 1338 (2018)。gydF4y2Ba
法雷尔,g . et al。非酒精性脂肪肝炎小鼠模型:对优化人类非酒精性肝病的相关性。gydF4y2Ba肝脏病学gydF4y2Ba69年gydF4y2Ba,2241 - 2257 (2019)。gydF4y2Ba
剑,c . et al。低剂量索拉非尼作为线粒体解偶联剂和改善非酒精性脂肪肝炎。gydF4y2Ba细胞金属底座。gydF4y2Ba31日gydF4y2Ba,892 - 908 (2020)。gydF4y2Ba
劳伦特,a . et al .关键作用的超氧化物阴离子和有益的抗氧化剂分子肝病小鼠的影响。gydF4y2Ba肝脏病学gydF4y2Ba39gydF4y2Ba,1277 - 1285 (2004)。gydF4y2Ba
获利,k . et al .肝AdipoR2信号具有保护作用对发展非酒精性肝病的老鼠。gydF4y2Ba肝脏病学gydF4y2Ba48gydF4y2Ba,458 - 473 (2008)。gydF4y2Ba
Hamdy, O。,Porr一个米一个t我kul,S. & Al-Ozairi, E. Metabolic obesity: the paradox between visceral and subcutaneous fat.咕咕叫。糖尿病牧师。gydF4y2Ba2 gydF4y2Ba,367 - 373 (2006)。gydF4y2Ba
Lawan, a &贝内特,a . m .增殖蛋白激酶调节肝脏代谢。gydF4y2BaEndocrin趋势。满足。gydF4y2Ba28gydF4y2Ba,868 - 878 (2017)。gydF4y2Ba
阿拉姆,s . et al .向上调节组织蛋白酶C诱导巨噬细胞M1极化通过FAK-triggered p38 MAPK / NF-κB通路。gydF4y2BaExp。细胞Res。gydF4y2Ba382年gydF4y2Ba111472 (2019)。gydF4y2Ba
卡瓦依,t &彰,s .信号NF-κB toll样受体。gydF4y2Ba趋势地中海摩尔。。gydF4y2Ba13gydF4y2Ba,460 - 469 (2007)。gydF4y2Ba
呗,l . et al . F检测盒/ WD重复量包含蛋白质5泛素化介导的细胞凋亡信号调节激酶1和加剧了非酒精性脂肪肝炎小鼠。gydF4y2Ba肝脏病学gydF4y2Ba70年gydF4y2Ba,1942 - 1957 (2019)。gydF4y2Ba
居,a . et al .脚手架DUSP22 ASK1-MKK7-JNK信号通路的作用。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba11gydF4y2Bae0164259 (2016)。gydF4y2Ba
张,j . & Hochwald s . n . FAK在肿瘤代谢和治疗的作用。gydF4y2Ba杂志。其他。gydF4y2Ba142年gydF4y2Ba,154 - 163 (2014)。gydF4y2Ba
陈,j . s . et al . FAK在肝细胞癌侵袭转移有关。gydF4y2Ba中国。Exp。转移gydF4y2Ba27gydF4y2Ba,71 - 82 (2010)。gydF4y2Ba
沈,j . et al . PNPLA3基因多态性和应对非酒精性脂肪肝患者生活方式修改。gydF4y2Baj . Gastroen。乙醇。gydF4y2Ba30.gydF4y2Ba,139 - 146 (2015)。gydF4y2Ba
夏,m F。,Bian, H. & Gao, X. NAFLD and diabetes: two sides of the same coin? Rationale for gene-based personalized NAFLD treatment.前面。杂志。gydF4y2Ba10gydF4y2Ba877 (2019)。gydF4y2Ba
李,f . et al . FBP1损失破坏肝脏代谢和促进肿瘤发生检查参与组成分泌腺肝星状细胞衰老。gydF4y2BaNat,细胞生物。gydF4y2Ba22gydF4y2Ba,728 - 739 (2020)。gydF4y2Ba
Sanyal, a . j . et al .吡格列酮,维生素E,对非酒精性脂肪肝炎或安慰剂。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba362年gydF4y2Ba,1675 - 1685 (2010)。gydF4y2Ba
Lavine, j·E。,Schwimmer, J. B. & Van, M. L. Natta, et al. Effect of vitamin E or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: the TONIC randomized controlled trial.《美国医学会杂志》gydF4y2Ba305年gydF4y2Ba,1659 - 1668 (2011)。gydF4y2Ba
马苏之后,G。,Cassader, M. & Gambino, R. Non-alcoholic steatohepatitis: emerging molecular targets and therapeutic strategies.Nat。启药物。gydF4y2Ba15gydF4y2Ba,249 - 274 (2016)。gydF4y2Ba
陈,h F。,Chuang, H. C. & Tan, T. H. Regulation of dual-specificity phosphatase (DUSP) ubiquitination and protein stability.Int。j .摩尔。科学。gydF4y2Ba20.gydF4y2Ba2668 (2019)。gydF4y2Ba
Arruga, f . et al .突变NOTCH1害虫域编排CCL19-driven归航的慢性淋巴细胞白血病细胞通过调节DUSP22肿瘤抑制基因。gydF4y2Ba白血病gydF4y2Ba31日gydF4y2Ba,1882 - 1893 (2017)。gydF4y2Ba
沈,y . et al .激活物dual-specificity磷酸酶信号通路,JSP-1。gydF4y2BaProc。《科学。美国gydF4y2Ba98年gydF4y2Ba,13613 - 13618 (2001)。gydF4y2Ba
阿隆索,a . et al .抑制T细胞抗原受体信号由VHR-related MKPX (VHX),一个新的双特异性磷酸酶与VH1相关(VHR)。gydF4y2Ba生物。化学。gydF4y2Ba277年gydF4y2Ba,5524 - 5528 (2002)。gydF4y2Ba
壮族,t·h·h·c & Tan MAP4K家族激酶和DUSP家庭磷酸酶在t细胞信号和系统性红斑狼疮。gydF4y2Ba细胞gydF4y2Ba8 gydF4y2Ba1433 (2019)。gydF4y2Ba
法雷尔,g . c . et al .纳什是一种炎症性疾病:致病性、预后和治疗的影响。gydF4y2Ba肠肝gydF4y2Ba6gydF4y2Ba149 (2012)。gydF4y2Ba
山东圣光,a . g . et al . PNPLA3在纤维化的影响肝细胞癌的进展与发展:一个荟萃分析。gydF4y2Ba点。j .杂志。gydF4y2Ba109年gydF4y2Ba,325 - 334 (2014)。gydF4y2Ba
叮,问:et al。粘着斑激酶(FAK) -相关non-kinase抑制myofibroblast分化通过微分MAPK激活FAK-dependent的方式。gydF4y2Ba生物。化学。gydF4y2Ba283年gydF4y2Ba,26839 - 26849 (2008)。gydF4y2Ba
切,d . f . j . et al .晶体结构的粘着斑激酶的丰贸领域。gydF4y2Ba生物。化学。gydF4y2Ba281年gydF4y2Ba,252 - 259 (2006)。gydF4y2Ba
Bisht B。,Srinivasan, K. & Dey, C. S. In vivo inhibition of focal adhesion kinase causes insulin resistance.j .杂志。gydF4y2Ba586年gydF4y2Ba,3825 - 3837 (2008)。gydF4y2Ba
Gabarra-Niecko, V。,Schaller, M. D. & Dunty, J. M. FAK regulates biological processes important for the pathogenesis of cancer.癌症Metast。牧师。gydF4y2Ba22gydF4y2Ba,359 - 374 (2003)。gydF4y2Ba
格雷厄姆,z。,Gallagher, P. M. & Cardozo, C. P. Focal adhesion kinase and its role in skeletal muscle.j .肌肉细胞Motil》。gydF4y2Ba36gydF4y2Ba,305 - 315 (2015)。gydF4y2Ba
墨菲,j . m . et al . FAK和Pyk2活动促进TNF-αIL-1β-mediated炎性基因表达和血管炎症。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba1 - 14 (2019)。gydF4y2Ba
广域网,x et al .来源的单核细胞/巨噬细胞在恰加斯病导致慢性炎症:SIRT1 FAK-NFκB-dependent抑制增殖和促炎激活的巨噬细胞。gydF4y2Ba细胞gydF4y2Ba9gydF4y2Ba80 (2020)。gydF4y2Ba
黄,d . et al .粘着斑激酶(FAK)调节刺激肝细胞内糖原的合成。gydF4y2Ba生物。化学。gydF4y2Ba277年gydF4y2Ba,18151 - 18160 (2002)。gydF4y2Ba
Sulzmaier f·J。,Jean, C. & Schlaepfer, D. D. FAK in cancer: mechanistic findings and clinical applications.Nat。启癌症gydF4y2Ba14gydF4y2Ba,598 - 610 (2014)。gydF4y2Ba
郑,x et al .胶原蛋白促进肝癌细胞增殖通过调节整合素β1 / FAK信号通路在非酒精性脂肪肝。gydF4y2BaOncotargetgydF4y2Ba8 gydF4y2Ba95586 (2017)。gydF4y2Ba
Margini, c &杜福尔j . f .在非酒精性脂肪肝肝细胞癌的故事:从流行病学、发病机制、预防和治疗。gydF4y2Ba肝脏Int。gydF4y2Ba36gydF4y2Ba,317 - 324 (2016)。gydF4y2Ba
Ballestri, s . et al。非酒精性脂肪肝性二态的疾病:角色的性别和生殖状况发展和非酒精性脂肪肝疾病的进展和固有的心血管风险。gydF4y2Ba放置其他。gydF4y2Ba34gydF4y2Ba,1291 - 1326 (2017)。gydF4y2Ba
刘,d . et al . TNFAIP3相互作用蛋白质3过度抑制非酒精性脂肪肝炎通过阻断TAK1激活。gydF4y2Ba细胞金属底座。gydF4y2Ba31日gydF4y2Ba,726 - 740 (2020)。gydF4y2Ba
无力偿付,a . a . et al .抑制白介素11信号降低肝细胞死亡和肝纤维化,炎症和脂肪变性在非酒精性脂肪肝炎小鼠模型。gydF4y2Ba胃肠病学gydF4y2Ba157年gydF4y2Ba,777 - 792 (2019)。gydF4y2Ba
Du, x等。增加Tim-3表达式减轻肝损伤通过调节巨噬细胞激活MCD-induced纳什老鼠。gydF4y2Ba细胞。摩尔。Immunol。gydF4y2Ba16克ydF4y2Ba,878 - 886 (2019)。gydF4y2Ba
奥斯特曼c . j . d . et al . FAK活动维持内在和获得性耐卵巢癌铂化疗。gydF4y2BaElifegydF4y2Ba8 gydF4y2Bae47327 (2019)。gydF4y2Ba
Nishimoto s . et al . Obesity-induced DNA释放脂肪细胞刺激脂肪组织慢性炎症和胰岛素抵抗。gydF4y2Ba科学。睡觉。gydF4y2Ba2 gydF4y2Bae1501332 (2016)。gydF4y2Ba
确认gydF4y2Ba
我们感谢陈文贤李教授实验室的成员对他们有用的讨论和见解的手稿。我们也感谢Y.T.秦博士的批判阅读手稿。同时,我们非常感激h . Chen先生太太y . f . Li及其工作团队寻求帮助在体外基因治疗实验准备和设备供应。这项工作是由(1)国家自然科学基金(国家自然科学基金委批准号:82200652);(2)重庆基础研究和前沿技术研究项目(批准号:c年代tc20.17jcyjAX0356, cstc2018jcyjA3686, cstc2018jcyjAX0784, cstc2018jcyjA1472, cstc2018jcyjAX0811, cstc2018jcyjA3533, and KJZD-M201801601); (3) School-level Research Program of Chongqing University of Education (Grant No.: KY201710B and 17GZKP01); (4) Advanced Programs of Post-doctor of Chongqing (Grant No.: 2017LY39); (5) Science and Technology Research Program of Chongqing Education Commission of China (Grant No.: KJQN201901608, KJQN201901615, and KJ1601402); (6) Children’s Research Institute of National Center for Schooling Development Programme and Chongqing University of Education (Grant No.: CSDP19FSO1108); (7) Chongqing Professional Talents Plan for Innovation and Entrepreneurship Demonstration Team (CQCY201903258).
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
概念化:C.G.,j.t,C.Z.,L.Z.,B.W.,和M.X.; Methodology: C.G., L.Z., and M.X.; Investigation: C.G., J.T., X.D., Q.K., S.Z., L.L., C.Y., Y.S., and J.L.; Data analysis: C.G., J.T., C.Z., L.Z., and M.X.; Funding acquisition: C.G., J.T., C.Z., L.Z., and M.X.; Project administration: M.X., C.Z., and J.T.; Supervision: C.G., J.T., C.Z., L.Z., B.W., and M.X.; Writing—original draft: C.G., J.T., C.Z., L.Z., B.W., and M.X.; Writing—review and editing: M.X. and J.T.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然通讯gydF4y2Ba谢谢尼古拉斯·韦伯家Schattenberg和其他,匿名的,评论家为他们贡献的同行评审工作。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
通用电气,C。,Tan, J., Dai, X.et al。gydF4y2Ba肝细胞磷酸酶DUSP22减轻针对FAK NASH-HCC进展。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba5945 (2022)。https://doi.org/10.1038/s41467 - 022 - 33493 - 5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467 - 022 - 33493 - 5gydF4y2Ba
本文引用的gydF4y2Ba
研究员的指导临床前鼠标纳什模型gydF4y2Ba
自然的新陈代谢gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba