摘要gydF4y2Ba
野生型转甲状腺素衍生淀粉样蛋白(ATTRwt)是非遗传性转甲状腺素淀粉样变的主要组成部分。它积聚在老年患者的心脏是危及生命的。转甲状腺素的多种遗传变异可导致遗传性转甲状腺素淀粉样变,其表现为不同的临床症状,如发病年龄和器官受累方式。然而,在非遗传性转甲状腺素淀粉样变的情况下,ATTRwt纤维沉积主要位于心脏组织。在这项结构研究中,我们分析了来自非遗传性转甲状腺素淀粉样变患者心脏的ATTRwt淀粉样原纤维。我们使用冷冻电子显微镜展示了这些ATTR原纤维的2.78 Å重建密度图,并将其与先前发表的从不同患者的心脏和眼睛中提取的ATTR原纤维的V30M变体进行了比较。所有结构在其横截面上都表现出非常相似的尖头状形状,由相同的转甲状腺素N端和c端片段形成,只有一些微小的差异。这证明了ATTR原纤维的共同特征,尽管突变和患者不同。gydF4y2Ba
简介gydF4y2Ba
非遗传性ATTR淀粉样变是一种与衰老相关的疾病,由错误折叠的野生型转甲状腺素(TTR)蛋白形成淀粉样原纤维引起。据估计,这种疾病影响了超过25%的80岁以上男性人口gydF4y2Ba1克ydF4y2Ba.疾病的相关性,随着当今老龄化社会的日益加剧和得不到治疗,ATTRwt淀粉样变性是一种致命的疾病gydF4y2Ba2gydF4y2Ba.在ATTRwt淀粉样变中,淀粉样沉积主要发生在男性的心脏组织中,在那里它们会引起严重的心肌病gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.其症状包括心力衰竭、传导障碍和心律失常gydF4y2Ba4gydF4y2Ba.attrt患者通常年龄在60岁以上,通常在生命的第七十或第八十岁gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.大约50%的ATTRwt淀粉样变患者在心脏淀粉样变临床表现前5 - 10年出现腕管综合征,这是由于ATTRwt淀粉样原纤维沉积在屈肌支持带和肌腱滑膜组织gydF4y2Ba2gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
TTR主要表达于肝脏和脉络膜丛gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.该蛋白是一个55 kDa的四聚体,由4个相同的127个残基原聚体组成gydF4y2Ba11gydF4y2Ba.为了形成淀粉样原纤维,四聚体必须解离并展开,以便展开的多肽链能够重新组装成淀粉样。治疗治疗与他非胺葡胺(Fx-1006A)用于稳定TTR四聚物。虽然该物质不能消除现有的淀粉样原纤维沉积,但它减少了原纤维形成的进展,从而防止症状加重gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
编码基因的一些突变,即。gydF4y2Ba竞技场队伍gydF4y2Ba,导致遗传性ATTR (ATTRv)淀粉样变,其中TTR四聚体更容易解离,从而导致疾病早期发病gydF4y2Ba13gydF4y2Ba.常见的点突变是V30M,在葡萄牙、日本、瑞典和其他国家引起遗传性ATTR淀粉样变性的热点gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
遗传性ATTRV30M淀粉样变的症状可始于不同的发病时间。发病年龄早的患者多为周围神经病变或累及自主神经系统和肠道,而发病较晚的患者多为淀粉样心肌病gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.在ATTRv型和ATTRv型淀粉样变病例中可发现心脏内的淀粉样蛋白沉积,但仅在ATTRv型淀粉样变病例中可发现周围神经、肠道、肾脏和眼睛的累及。gydF4y2Ba
在ATTR淀粉样变中存在两种纤维成分表型之一(A型或B型)。一个病人通常只表现出一种表型gydF4y2Ba16gydF4y2Ba.A型ATTR原纤维包含破碎的ATTR单体以及全长单体。B型原纤维仅由全长ATTR单体组成gydF4y2Ba17gydF4y2Ba.例如,在患有ATTRv的瑞典ATTRV30M患者以及ATTRwt淀粉样变患者中发现了A型纤维。这些淀粉样沉积物对刚果红的亲和力较低,当使用电子显微镜(EM)方法成像时,原纤维表现为相对较短,紧密排列,排列杂乱无章gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.gydF4y2Ba
在这里,我们使用低温电子显微镜(cryo- em)来确定人离体ATTRwt淀粉样原纤维的分子结构。我们将野生型原纤维的结构与先前发表的两种来自携带V30M突变患者的体外ATTR淀粉样原纤维的结构进行了比较gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.我们证明这三种原纤维具有相似的结构特征。gydF4y2Ba
结果gydF4y2Ba
attrt淀粉样变的心脏病理gydF4y2Ba
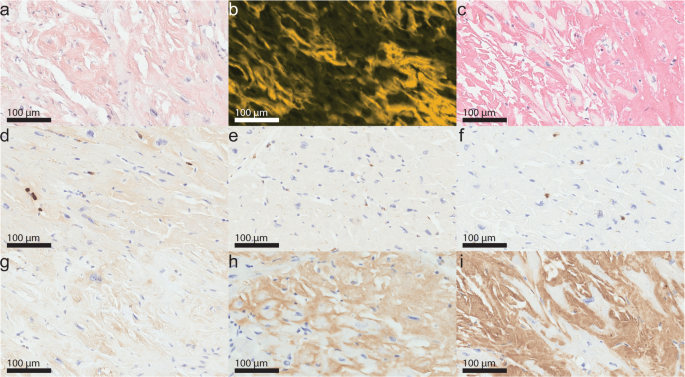
这里展示的心脏样本来自一名attrt男性患者的移植心脏。患者在心脏移植前5年被诊断为ATTRwt淀粉样变性。在心脏移植之前,没有使用特定疾病的药物。福尔马林固定和石蜡包埋的心脏样本免疫组化显示大量间质淀粉样蛋白沉积,不仅包围肌细胞,而且破坏了组织结构。淀粉样沉积物占刚果红染区横切面66%(图2)。gydF4y2Ba1 a, bgydF4y2Ba),显示淀粉样蛋白含量非常高。它们对ATTR具有免疫反应(图。gydF4y2Ba1 cgydF4y2Ba).通过针对T淋巴细胞(抗cd3免疫染色)、巨噬细胞(抗cd68免疫染色)和中性粒细胞(抗髓过氧化物酶免疫染色)的免疫染色评估心肌内膜活检中炎症的存在和数量。然而,心脏组织中炎症细胞的数量没有超过t淋巴细胞的参考值(>7个cd3阳性细胞/mmgydF4y2Ba2gydF4y2Ba)或巨噬细胞(>35 cd68阳性细胞/mm²)(图。gydF4y2Ba1 d, egydF4y2Ba)gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.偶尔可见髓过氧化物酶免疫反应性中性粒细胞,通常在血管内作为正常血细胞的一部分。gydF4y2Ba1 fgydF4y2Ba).此外,我们检测了单细胞死亡的迹象,即凋亡(caspase 3)和单细胞坏死(补体9;制备过程)。Caspase 3-免疫反应性凋亡(图;gydF4y2Ba1克gydF4y2Ba)或未见肌细胞c9阳性单细胞坏死。然而,淀粉样沉积对C9具有强烈的免疫反应性。C9是末端补体通路的一部分,它与其他补体成分一起形成一个溶解孔,称为膜攻击复合体gydF4y2Ba24gydF4y2Ba.因此,我们还对补体通路中心分子补体C3进行了染色,发现淀粉样沉积对C3也具有免疫反应性(图2)。gydF4y2Ba1 h,我gydF4y2Ba).这些数据表明,在我们的病例中,心脏ATTR淀粉样蛋白没有导致局部炎症反应或细胞死亡。然而,我们发现补体级联激活的证据,因为最近显示ATTR淀粉样蛋白影响腕管组织gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
强光下刚果红染色(gydF4y2Ba一个gydF4y2Ba)和荧光(gydF4y2BabgydF4y2Ba)显示心脏内大量淀粉样蛋白沉积,占横截面积的66%。淀粉样沉积物对转甲状腺素有免疫反应(gydF4y2BacgydF4y2Ba)和少量cd3阳性T淋巴细胞(gydF4y2BadgydF4y2Ba)、cd68阳性巨噬细胞(gydF4y2BaegydF4y2Ba)和偶尔出现髓过氧化物酶免疫反应性中性粒细胞(gydF4y2BafgydF4y2Ba).炎症细胞密度未高于参考值。Caspase 3阳性肌细胞(gydF4y2BaggydF4y2Ba),但淀粉样沉积与抗补体C3抗体(gydF4y2BahgydF4y2Ba)和抗补体成分C9抗体(gydF4y2Ba我gydF4y2Ba)在整个组织切片。gydF4y2Ba
纤维提取与分析gydF4y2Ba
按照先前描述的方法提取纤维。它避免了苛刻的化学或变性条件,并允许从病变的心脏组织中分离出大量结构完整的淀粉样原纤维gydF4y2Ba26gydF4y2Ba.变性凝胶电泳显示在大约8至12 kDa的宽波段(补充图。gydF4y2Ba1gydF4y2Ba).这种可变质量与A型ATTR原纤维一致,由碎片化的TTR组成。而全长TTR的分子质量为15.8 kDa。质谱分析证实了碎片化TTR的存在。我们能够在误差(±0.2 Da)内分配7个突出的片段(补充图。gydF4y2Ba2摄氏度gydF4y2Ba).反卷积质谱显示了一个主要的峰,我们可以将其分配给44-127片段。47-127、49-127、50-127、52-127、53-127和58-127片段强度较小。大多数c端片段开始于位置44到58之前已经报道过gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.考虑半胱氨酸氨基甲基化(+57.02 Da)作为可能的修饰,这在以前已经报道过gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,我们发现各种各样的片段完全或部分覆盖n端片段。我们发现了从Pro11延伸到Lys35的c端片段和n端片段的两个峰。单同位素质量为9034.57 Da的n端片段4-86和c端片段46-127。对于质量为9,105.58 Da的片段,我们分配了n端片段1-84和c端片段45-127。gydF4y2Ba2摄氏度gydF4y2Ba).其他n端片段种类繁多。我们发现了不同长度的碎片,比如4-86碎片,它们的起始和结束位置相似。这些单个片段在原始光谱中的强度较低,但不同片段的丰度较高(补充图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
atr -wt淀粉样原纤维的冷冻电镜结构gydF4y2Ba
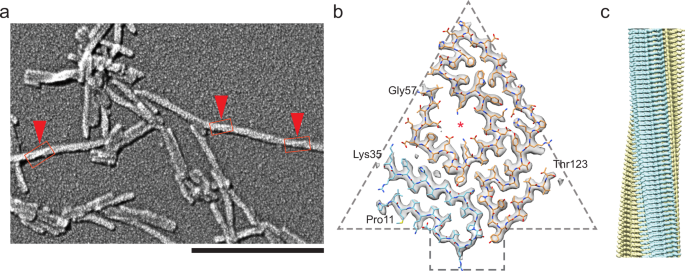
阴性染色或低温电镜未发现纤维交叉(补充图。gydF4y2Ba1 bgydF4y2Ba).对单个原纤维的250次测量显示,原纤维的平均宽度为10.04±0.06 nm。gydF4y2Ba2gydF4y2Ba).铂侧阴影和扫描电子显微镜(SEM)分析显示,相对较短的原纤维显示一些原纤维几乎不可见的交叉(图。gydF4y2Ba2gydF4y2Ba)表示惯用左手。提取的原纤维进行低温电镜处理,并在300 kV电子显微镜下成像。在显微照片中,它们的形态是一致的(补充图。gydF4y2Ba1 bgydF4y2Ba).利用图像选取纤维段进行三维重建。二维(2D)类平均显示清晰的4.8 Å间距,表明淀粉样原纤维的典型交叉β结构(补充图。gydF4y2Ba1 cgydF4y2Ba).分辨率为2.78 Å的三维地图,基于0.143傅里叶壳层相关(FSC)准则(补充图。gydF4y2Ba6gydF4y2Ba),用冷冻电镜图像进行重建(补充图。gydF4y2Ba1 bgydF4y2Ba).原纤维由单根扭曲原纤维组成,原纤维左捻为−1.23°,上升4.82 Å(补充表gydF4y2Ba1克ydF4y2Ba).密度图显示了两个独立的连续密度区域,经过结构建模,分别对应于Pro11 - Lys35残基和Gly57 - Thr123残基。所获得的结构模型的MolProbility评分为1.32,并且没有Cβ、Ramachandran或rotamer轮廓(补充表)gydF4y2Ba2gydF4y2Ba).Gly1-Cys10残基的n端密度较低,而Asn124-Glu127残基的c端密度较低。从位置Ala36到位置His56这两个区域,电子密度图没有被解析,表明结构运动或不均匀。gydF4y2Ba
原纤维形态gydF4y2Ba
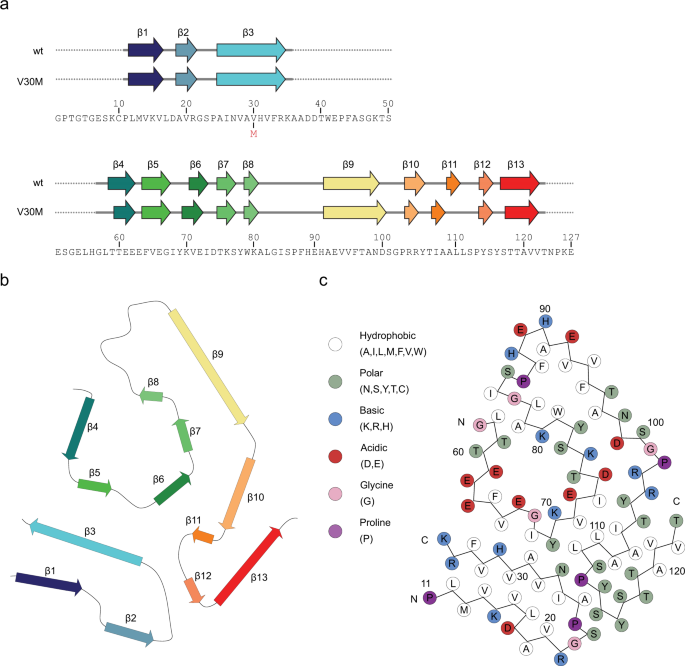
原纤维的横截面呈尖状(图2)。gydF4y2Ba2 bgydF4y2Ba).原纤维肽相对平坦,β-表丰富。有13个β链,分布在Leu12-Val16、Ala19-Arg21、Ala25-Arg34、Thr59-Glu62、Phe64-Gul66、Val71-Ile73、Thr75-Ser77、Trp79-Lys80、Glu92-Asn98、Arg103-Tyr105、Ala109-Leu110、Tyr114-Ser115和Ser117-Val122残基之间。gydF4y2Ba3 bgydF4y2Ba).可检测到两个主要的疏水簇。第一个由6个缬氨酸、2个亮氨酸和1个异亮氨酸残基组成。第二个疏水簇稳定c端区域,由残基Val71、Ile73和Ile107、Leu110和Leu111形成(图2)。gydF4y2Ba3 cgydF4y2Ba).肽的c端区域形成了一个可能是水场的空腔,里面排列着Thr59到Lys80的极性残基和离子残基(图5)。gydF4y2Ba2 bgydF4y2Ba).用电子密度图测量,空腔的直径大约为10 Å。gydF4y2Ba
蛋白质层的堆叠主要由β层的主链-主链氢键稳定。此外,侧链之间存在稳定的相互作用。Lys15与Asp18建立盐桥(补充图。gydF4y2Ba4gydF4y2Ba).Glu63与n + 1层的Lys35建立盐桥,使第一个区域与第二个区域稳定(补充图)。gydF4y2Ba4 bgydF4y2Ba).Thr123与Arg104建立盐桥,稳定c端环(补充图)。gydF4y2Ba4摄氏度gydF4y2Ba).可以发现从核心肽密度中分离出两个不同的额外密度点(补充图)。gydF4y2Ba5gydF4y2Ba).其中一个点可以用n端区域的另一种组氨酸侧链构象来解释。n端弓和c端段之间的另一个点是不可分配的。gydF4y2Ba
讨论gydF4y2Ba
随着人口老龄化,attrt淀粉样变在西方国家几乎成为一种地方病,成为一种重大的健康负担。心脏中ATTR淀粉样原纤维的沉积可能进展缓慢,但它会显著降低预期寿命。我们从一例严重心力衰竭的病例中分离出attrt原纤维。病人的心脏被移植,显示出严重受损的心脏组织。组织学和免疫组化显示大量淀粉样蛋白沉积,破坏了组织结构。对淀粉样蛋白的炎症反应几乎没有观察到,单个肌细胞没有显示出凋亡或坏死的迹象。细胞死亡可能是由淀粉样原纤维的机械应激引起的,其次可能是低聚物的细胞毒性gydF4y2Ba29gydF4y2Ba.gydF4y2Ba
在这里,我们展示了一个2.78 Å的ATTRwt原纤维密度图,与以前的研究中显示的相似gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.质谱分析证实我们的样品是由A型原纤维组成的。在之前对TTR突变患者(患者1)心脏ATTRV30M原纤维的研究中,发现的所有c端片段也是最主要的。gydF4y2Ba20.gydF4y2Ba.遗传性ATTR淀粉样变(患者2)患者眼部ATTRV30M原纤维研究中的显性片段gydF4y2Ba21gydF4y2Ba,质量为8762,26 kDa。我们发现一些n端片段延伸到部分c端区域(补充图。gydF4y2Ba3.gydF4y2Ba)可能来自全长的肽,因为截断的和全长的ATTR通常在ATTRwt患者中作为混合物存在gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.如前所述,在纤维形成之前TTR肽的蛋白水解切割似乎不太可能,特别是考虑到ATTR患者中全长肽的存在gydF4y2Ba3.gydF4y2Ba.否则,这两个片段需要保持在一起以形成包含这两个片段的原纤维,也就是说,TTR肽需要在沉积的位置被局部切割,并且由此产生的两个片段必须在淀粉样蛋白形成之前逃脱空间解离gydF4y2Ba21gydF4y2Ba.总的来说,这支持了淀粉样蛋白的形成开始于完全或部分展开的天然TTR肽,然后是全长ATTR肽的原纤维形成,随后在氨基酸44和58之间的可达区域发生蛋白水解切割的论点,正如之前已经提出的那样gydF4y2Ba20.gydF4y2Ba.gydF4y2Ba
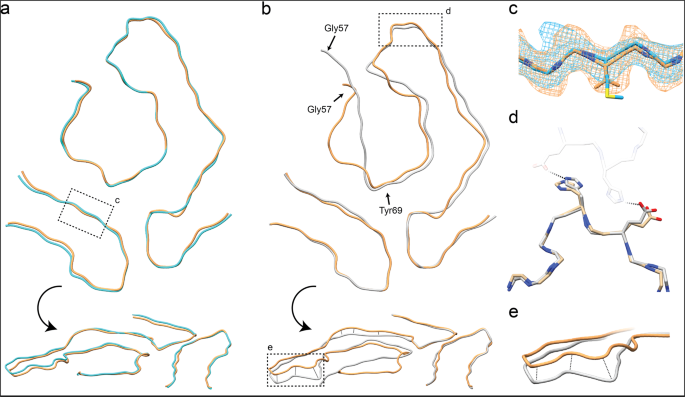
我们将我们的ATTRwt纤维结构与来自两个不同患者的ATTRV30M纤维结构进行比较,分析结构的异同点,我们在本文中称为患者1和患者2。ATTRV30M原纤维也从患者1的心脏组织中提取gydF4y2Ba20.gydF4y2Ba对于2号病人,它们是从眼睛的玻璃体中取出的gydF4y2Ba21gydF4y2Ba.总的来说,对于所有三种纤维结构来说,一个单一的纤维层是由ATTR肽的N端和c端片段形成的,并且在它们的横截面上表现出非常相似的尖头状形状(图2)。gydF4y2Ba4 a、bgydF4y2Ba).所有三次重构的解析部分分别为n端Pro11 - Lys35片段和c端Gly57 - Thr123片段。在这三种情况下,n端片段几乎完全相同。特别是在氨基酸取代的位置30,由于蛋氨酸取代了缬氨酸而没有增加密度(图。gydF4y2Ba4摄氏度gydF4y2Ba).但是考虑到ATTRV30M淀粉样原纤维也可以包含野生型肽,这种对密度的缺乏影响将表明V30M变体对整体结构没有重大影响。gydF4y2Ba
一个gydF4y2Ba黄色为ATTRwt,青色为心脏(患者1)的ATTRV30M和(gydF4y2BabgydF4y2Ba图中ATTRwt为黄色,右侧ATTRV30M(患者2)为灰色。gydF4y2BacgydF4y2Ba近距离比较ATTRwt(橙色)和ATTRV30M(蓝色)在心脏位置30的密度。结构模型显示,ATTRwt为缬氨酸,ATTRV30M为蛋氨酸。gydF4y2BadgydF4y2Ba近距离观察ATTRV30M原纤维二聚体的界面区域。来自眼睛的ATTRV30M原纤维(PFa)的一个原纤维,与ATTRwt原纤维的同一区域相比呈灰色。二聚体的第二原丝(PFb)略透明。gydF4y2BaegydF4y2BaATTRwt和ATTRV30M肽的主干运行高度差异的特写。gydF4y2Ba
对于ATTRwt患者和ATTRV30M患者1的两个心脏源性纤维结构,可以从n端和c端区域之间的两个核心密度分离的密度点中区分出来。对应于另一种组氨酸构象的点显示较弱的密度,这意味着这是一个不太常见的方向(补充图。gydF4y2Ba5gydF4y2Ba).因此,我们怀疑该组氨酸的构象不会与每一纤维层交替,而是有一个首选方向,并不规则地采取交替构象。替代构象的发生可能是患者特有的特征,这可以解释为什么患者1的ATTRV30M心脏重建的密度较小,而患者2的ATTRV30M重建的密度不存在。另一方面,第二个斑点的起源目前尚不清楚。未定义的和不连接的密度可能代表图像处理的人为因素,但也可能是聚集的辅助因素的迹象,正如其他淀粉样蛋白研究所表明的那样gydF4y2Ba30.gydF4y2Ba.gydF4y2Ba
比较两种心脏来源的ATTR原纤维的c端区域,它们几乎完全相同。另一方面,患者2的ATTRV30M原纤维显示了前面所述的蛋白质主干高度差异区域gydF4y2Ba21gydF4y2Ba.尽管侧链结构相同,ATTRV30M患者2的原纤维的Lys76残基到Phe95和Gly101残基到Ala108之间的主干路径与两个心脏源性原纤维的主干路径不同,对应残基的cα原子之间的均方根距离为3.3 Å(图2)。gydF4y2Ba4 egydF4y2Ba).从横切面上看,这些主干路径的差异似乎只影响主干路径的高度,而不影响肽的排列。这些不同的蛋白质主干路径可能是纤维排列的另一种患者特异性变异。三种原纤维c端区域的整体横切面看起来非常相似。主要的例外是从G57到Y69的c端片段路径。ATTRwt患者和ATTRV30M患者1的原纤维与ATTRV30M患者2的原纤维明显不同(图2)。gydF4y2Ba4 bgydF4y2Ba).这减少了ATTRV30M患者2的原纤维中c端和n端区域的相互作用面,可以解释之前提到的ATTRV30M患者2的原纤维重建中缺少密度点(补充图。gydF4y2Ba2gydF4y2Ba).另一个主要区别是,ATTRwt患者和ATTRV30M患者1的心脏源性原纤维仅为单丝原纤维。从ATTRV30M患者2的眼睛玻璃体中提取的淀粉样原纤维的研究中,原纤维以单一原丝原纤维、两种原丝的二聚体和其他多达五种原丝组合的聚合原纤维的形式存在gydF4y2Ba21gydF4y2Ba.扭曲二聚体的原丝通过在其他原丝的His90残基和Glu92残基之间形成氢键相互作用gydF4y2Ba21gydF4y2Ba.在c端残基His90和Glu92之间叠加ATTRwt患者的ATTR纤维结构和患者2的ATTRV30M,可以看出形成氢键的氨基酸没有显著差异(图9)。gydF4y2Ba4 dgydF4y2Ba).目前尚不清楚,为什么心脏来源的原纤维不形成多态性,在原纤维中似乎没有明显的结构原因。但这三位讨论的ATTR原纤维都是从不同的患者身上提取的。因此,微小的结构差异和形成多态性的倾向可能是患者特有的特征。由于两个样本来自心脏组织,一个来自眼睛的玻璃体,我们也不能排除导致这些结构差异的器官特异性特征。gydF4y2Ba
评估所有三种结构,即心脏ATTRwt、心脏ATTRV30M和眼部ATTRV30M,存在的总体差异非常小,这是值得注意的。不同患者的原纤维之间的微小差异表明原纤维结构的某些部分有一定程度的自由度,但大多数氨基酸的整体排列及其相互作用保持完整。因此,纤维形态本身很可能不是淀粉样TTR引起的各种临床症状和表现的原因。相反,合理的假设是各种其他因素在ATTR淀粉样变的发病机制中发挥作用。这是由V30M点突变的事实所支持的gydF4y2Ba竞技场队伍gydF4y2Ba基因降低四聚体的稳定性并促进淀粉样蛋白的形成,因此,与ATTRwt相比,该疾病发病较早gydF4y2Ba31gydF4y2Ba,但对纤维结构无明显影响。环境因素,患者性别,遗传模式gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba以及淀粉样相关成分,如伴侣gydF4y2Ba34gydF4y2Ba可能调节疾病表现gydF4y2Ba
临床症状的变化也见于淀粉样轻链(AL)淀粉样变,在不同的组织器官中均可发现AL淀粉样沉积gydF4y2Ba35gydF4y2Ba.但在AL淀粉样变的情况下,血清游离轻链浓度变化很大,每个患者都有独特的轻链前体蛋白,因此是独特的纤维蛋白gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.另一方面,尽管具有相同的前体蛋白和非常相似的淀粉样纤维结构,但atr诱导的淀粉样变显示出广泛的临床症状。目前,还不完全了解ATTR原纤维与症状之间的关系。免疫组化(IHC)分析表明,防御机制在ATTR淀粉样变中起作用,可能是机械应激下毁灭性心脏组织损伤的原因。但这三个分析病例的ATTR淀粉样变的A型原纤维的共同特征是讨论的矛头状截面,由N端和c端ATTR肽片段形成一个大腔,这可能对靶向药物设计和诊断感兴趣。gydF4y2Ba
方法gydF4y2Ba
病人gydF4y2Ba
男性患者57岁时被诊断为非遗传性ATTR淀粉样变。从患者血液中对转甲状腺素基因的4个外显子进行测序,以确定淀粉样变异体,在我们的患者中没有发现变异体。接下来的几年,心脏衰竭恶化,患者在5年后62岁时接受了心脏移植。在心脏移植之前,患者没有接受针对疾病的药物治疗。诊断时的疾病阶段为1期gydF4y2Ba38gydF4y2Ba对应于纽约心脏协会(NYHA)功能分类I类,移植时为3期/NYHA III级。该研究得到了海德堡大学伦理委员会的批准(S-123/2006)。已获得患者对发表细节的知情同意,并同意将这些样本用于科学研究。gydF4y2Ba
组织学和免疫组化gydF4y2Ba
部分心脏外植体用福尔马林固定,石蜡包埋(FFPE),用于组织学和免疫组化。根据先前发表的方案,使用切片机将FFPE样品切成连续的组织切片,并在55°C下干燥30分钟。组织切片送往Tissue Tek Prisma (Sakura, Umkirch, Deutschland)进行脱蜡、复水、刚果红和苏木精伊红(HE)染色。免疫组化(IHC)使用市售的针对补体C3 (C3;克隆755,1:400,Abcam,柏林,德国),补体组件C9 (C9;克隆64E9, 1:400;CD3(克隆LN10, 1:100, Leica生物系统,Wetzlar,德国),CD68(克隆S-14M12, 1:100, Leica生物系统,Wetzlar,德国),兔多克隆抗人mpo抗体(1:2000;Dako, Carpinteria, CA, USA),一种靶向caspase 3的兔单克隆抗体(克隆5A1E, 1:100;Cell Signaling, Danvers, MA, USA),以及非市售的针对TTR的兔多克隆抗体(1:2000,PinedagydF4y2Ba39gydF4y2Ba).根据制造商说明,FFPE切片用Bond Max Leica (Leica Biosystems, Wetzlar, Germany)免疫染色仪进行免疫染色,使用Bond Polymer Refine Detection Kit (C3, C9, CD3, CD68, MPO, caspase 3)和Bond Polymer Refine Red Detection Kit (TTR;徕卡微系统,Wetzlar,德国)。对于抗原检索,使用徕卡ER1-Bond表位检索液1 (C3, C9, CD3)或徕卡ER2-Bond表位检索液2 (TTR, caspase 3, CD68, MPO)。gydF4y2Ba
数字图像分析gydF4y2Ba
数字图像分析评估了刚果红染色组织切片的淀粉样蛋白负荷,如前所述gydF4y2Ba25gydF4y2Ba.简而言之,Hamamatsu NanoZoomer 2.0 RS扫描仪(Hamamatsu Photonics Deutschland GmbH, Herrsching am Ammersee, Germany)在连续亮场和荧光模式下以400倍放大倍数扫描切片(激发/发射波长560/607 nm分别用于刚刚红荧光检测和485/526 nm用于非特异性背景信号补偿)。ImageJ version 1.52 2p (National Institutes of Health, USA)分别选取亮场图像中的所有组织像素和荧光图像中显示刚果红信号的所有像素(补偿非特定背景)进行计数。两者像素数之比给出淀粉样蛋白负荷。gydF4y2Ba
原纤维提取gydF4y2Ba
原纤维根据最近描述的提取方案从淀粉样组织中提取gydF4y2Ba26gydF4y2Ba.简而言之,用手术刀将125 mg冷冻人类心脏组织切丁,用500µL冰冷Tris-钙缓冲液[20 mM Tris, 138 mM NaCl, 2 mM CaClgydF4y2Ba2gydF4y2Ba, 0.1% (w/v) NaNgydF4y2Ba3.gydF4y2Ba, pH 8.0]。样品在3100 ×下离心5 mingydF4y2BaggydF4y2Ba4°C。去除上清,EM染色阴性,未见淀粉样原纤维。将颗粒重悬于500µL冰冷的tris -钙缓冲液中,用Kontes颗粒杵再次均质。这个过程又重复了四次。在最后一步之后,将颗粒重新悬浮在新鲜制备的5mg /mL的1ml溶液中gydF4y2Bahistolyticum梭状芽胞杆菌gydF4y2Ba胶原酶(Sigma)在Tris钙缓冲液与乙二胺四乙酸(EDTA)无蛋白酶抑制剂(罗氏)。组织材料在37°C摇床上孵育一夜后,以3100 ×离心30分钟gydF4y2BaggydF4y2Ba4°C。去除上清液,发现一些纤维束,看起来类似于EM阴性洗涤步骤中的原纤维。将颗粒重新悬浮在500µL Tris EDTA缓冲液[20 mM Tris, 140 mM NaCl,10 mM EDTA, 0.1% (w/v) NaN]中gydF4y2Ba3.gydF4y2Ba, pH 8.0], 3100 ×离心5 mingydF4y2BaggydF4y2Ba4°C。这个洗涤步骤又重复了两次。将组织颗粒在100µL冰水中均质,3100 ×离心5 mingydF4y2BaggydF4y2Ba4°C。含有水溶性原纤维的上清液被保留。这个提取步骤又重复了五次。gydF4y2Ba
铂侧影和扫描电子显微镜gydF4y2Ba
对于扫描电镜,formvar/Carbon 200目铜栅(电子显微镜科学)在20 mA下发光放电40秒。将3.5 μ L含水溶液的ATTRwt纤维应用于网格中。多余的东西用滤纸吸掉。然后网格在室温下干燥。一层1纳米厚的铂从30°的角度蒸发到网格上,使用开拓者TKR 010。使用日立S-5200扫描电子显微镜(Hitachi)在10 kV加速电压下对栅格进行检查。gydF4y2Ba
低温电镜样品制备和数据收集gydF4y2Ba
在200kv电压下,在2100 F透射电子显微镜(Joel)下定期检查网格的质量。网格是用EM GP2自动冷冻机(徕卡)准备的。为了收集数据,用C-flat 1.2/1.3 400 mash孔碳铜栅格在20 mA下发光放电40秒。将含有水溶液的3 μ L ATTRwt纤维应用于网格中。在温度为21℃、相对湿度为90%的环境条件下,用滤纸吸掉多余的液体4秒。吸干后,网格被浸入液态乙烷中冷冻。电子显微照片在Titan Krios透射电子显微镜(Thermo Fisher)上采集,K2-summit探测器处于计数模式,电压为300 kV,放大倍率为130,000×(进一步详情见补充表)gydF4y2Ba1克ydF4y2Ba).数据采集采用SerialEM v3.9软件。gydF4y2Ba
三维地图的重建gydF4y2Ba
利用IMOD对原始数据进行增益校正gydF4y2Ba40gydF4y2Ba.运动校正是用RELION 3.1自带的实现函数完成的gydF4y2Ba41gydF4y2Ba.使用ctfind 4.1进行CTF估计gydF4y2Ba42gydF4y2Ba.所有后续图像处理步骤均使用RELION中的螺旋重建方法进行gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.人工选取原纤维起始和结束坐标,提取颗粒,盒大小为300pix,盒间距离为盒长10%。一个无引用的二维分类,包含50个类,正则化参数为2。没有可见纤维轮廓线的2D类被丢弃。采用无特征圆柱作为初始模型进行初始三维分类。这就产生了一个用于进一步分类的主要模型。分类分为5类,T值为5。三个类显示了很好的解析结构,并且是手动选择的。利用自细化的方法对所选类别中的粒子进行局部优化重构。后期处理产生了一个估计分辨率为2.94 Å的地图。 CTF-refinement45gydF4y2Ba和贝叶斯抛光gydF4y2Ba41gydF4y2Ba进一步提高了地图的分辨率,最终分辨率为2.78 Å。最后的后期处理使用了软边缘蒙版和估计的地图锐化b因子为−76.54,得到了一个扭曲为−1.234°和螺旋上升4.82 Å的模型。用两张独立精制半图的FSC曲线估计分辨率为0.142 (FSC金标准)。gydF4y2Ba
模型构建和细化gydF4y2Ba
ATTRV30M改进型的模型是用Chimera改变的gydF4y2Ba46gydF4y2Ba.第30位的蛋氨酸变成了缬氨酸。凤凰。dock_in_map function in Phenix47gydF4y2Ba将模型与地图进行叠加,然后在CootgydF4y2Ba48gydF4y2Ba.所得到的模型通过使用凤凰的真实空间细化而得到细化。real_space_refine函数。非晶体对称和二级结构约束。采用Molprobity对模型质量进行评估gydF4y2Ba49gydF4y2Ba.gydF4y2Ba
质谱分析gydF4y2Ba
如前所述,从患者组织中提取样本。将500 μ l水提取物冷冻干燥,然后重悬并在6 M盐酸胍(Gnd-HCl)中孵育过夜。使用0.1% (v/v)三氟乙酸(TFA)将样品调整为15µl。由于样品用TFA稀释,降低了胍浓度,仅用液相色谱就可以脱盐,无需进一步脱盐。样品通过液相色谱分离,使用U3000 RSLCnano(赛默飞世尔科学公司)在线耦合到质谱仪,使用Acclaim®PepMapTM分析柱(75µm × 500 mm, 2µm, 100 Å孔径;赛默飞世尔(Thermo Fisher Scientific)与C18 μ -预柱(0.3 mm × 5 mm;PepMap, Dionex LC填料;赛默飞世尔科学公司)。首先,用0.1% (v/v) TFA以30µL/min的流速洗涤样品5分钟。随后采用流速为250 nL/min的溶剂a [0.1% (v/v)甲酸]和溶剂B [86% (v/v) ACN, 0.1% (v/v)甲酸]组成的梯度进行分离。 The main column was initially equilibrated in a mixture containing 5% (v/v) solvent B and 95% (v/v) solvent A. For elution, the percentage of solvent B was raised from 5 to 15% over a period of 10 min, followed by an increase from 15 to 40% over 20 min. Fractions from the main column directly eluted into the ionization module and were further analyzed by mass spectrometry. Samples were measured using an LTQ Orbitrap Elite system (Thermo Fisher Scientific). The mass spectrometer was equipped with a nanoelectrospray ion source and distal coated SilicaTips (FS360-20-10-D, New Objective). The instrument was externally calibrated using standard compounds (LTQ Velos ESI Positive Ion Calibration Solution, Pierce, Thermo Scientific). The system was operated using the following parameters: spray voltage, 1.5 kV; capillary temperature, 250 °C; S-Lens radio frequency level, 68.9%. The software XCalibur 2.2 SP1.48 (Thermo Fisher Scientific) was used for data-dependent MS/MS analyses. Full scans ranging from mass to charge ratio (m/z) 370 to 1700 were acquired in the Orbitrap at a resolution of 30,000 (at m/z 400) with automatic gain control enabled and set to 106gydF4y2Ba离子和最大填充时间为500毫秒。以正常扫描速度在四极杆进行MS/MS扫描。gydF4y2Ba
原始数据由MASH Explorer 52使用默认设置和“快速反褶积”功能进行反褶积。所有由带有1个或更多电荷的初始m/z峰所计算的单同位素质量得分等于或大于90%的都被认为是正确的,并在本工作的质谱中显示。使用mMass v5.5.0软件手动分配质量gydF4y2Ba50gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
重建的低温电镜图保存在电子显微镜数据库中,并附有登录代码gydF4y2Baemd - 15361gydF4y2Ba.拟合的原子模型坐标存入蛋白质数据库,登录代码为8ADE [gydF4y2Bahttps://doi.org/10.2210/pdb8ADE/pdbgydF4y2Ba].支持本研究结果的数据可根据合理要求从相应作者处获得。补充图下的源数据。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2摄氏度gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba作为源数据文件提供。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Westermark, P., Sletten, K., Johansson, B. & Cornwell, G.老年系统性淀粉样变的纤维来源于正常的转运甲状腺素。gydF4y2Ba国家科学院学报gydF4y2Ba87gydF4y2Ba, 2843-2845(1990)。gydF4y2Ba
平尼,J. H.等。老年性全身性淀粉样变:临床表现特征和结局。gydF4y2Baj。心脏协会gydF4y2Ba.gydF4y2Ba2gydF4y2Ba,(2013)。gydF4y2Ba
Tasaki, M.等。年龄和性别差异对家族性淀粉样多神经病中野生型转甲状腺素淀粉样蛋白形成的影响:蛋白质组学方法。gydF4y2BaInt。j .心功能杂志。gydF4y2Ba170gydF4y2Ba, 69-74(2013)。gydF4y2Ba
上田,等人。老年性系统性淀粉样变的临床病理特征:一项死前和死后研究。gydF4y2Ba国防部,病理学研究。gydF4y2Ba24gydF4y2Ba, 1533-1544(2011)。gydF4y2Ba
吨,V.-K。,Mukherjee, M. & Judge, D. P. Transthyretin cardiac amyloidosis: pathogenesis, treatments, and emerging role in heart failure with preserved ejection fraction.中国。医学。gydF4y2Ba8 s1gydF4y2Ba, CMC。S15719(2014)。gydF4y2Ba
Ueda, M., Yamashita, T., Misumi, Y., Masuda, T. & Ando, Y.日本散发性迟发遗传性ATTR Val30Met淀粉样变性的起源。gydF4y2Ba淀粉样蛋白gydF4y2Ba25gydF4y2Ba, 143-147(2018)。gydF4y2Ba
康纳斯,L. H.等。与野生型转甲状腺素相关的年龄相关心脏淀粉样蛋白病导致的心力衰竭:一项前瞻性、观察性队列研究gydF4y2Ba循环gydF4y2Ba133gydF4y2Ba, 282-290(2016)。gydF4y2Ba
中川,等人。腕管综合征:全身性野生型ATTR (ATTRwt)淀粉样变的常见首发症状。gydF4y2Ba淀粉样蛋白gydF4y2Ba23gydF4y2Ba, 58-63(2016)。gydF4y2Ba
João, M. & Saraiva, M.转运甲状腺素突变在健康和疾病。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba5gydF4y2Ba, 191-196(1995)。gydF4y2Ba
Power, D. M.等。甲状腺激素结合蛋白,转甲状腺素的进化。gydF4y2Ba内分泌素。gydF4y2Ba119gydF4y2Ba, 241-255(2000)。gydF4y2Ba
Blake, c.c.f ., Geisow, m.j, Swan, i.d.a, Rerat, C. & Rerat, B. 2.5 A分辨率下人血浆前白蛋白的结构。gydF4y2BaJ. Mol.生物学。gydF4y2Ba88gydF4y2Ba, 1-12(1974)。gydF4y2Ba
布拉瓦,c.e.等。他法米司,一种有效的选择性转甲状腺素动力学稳定剂,可抑制淀粉样蛋白级联。gydF4y2Ba国家科学院学报gydF4y2Ba109gydF4y2Ba, 9629-9634(2012)。gydF4y2Ba
转甲状腺素淀粉样变的寡核苷酸药物。gydF4y2Ba心血管病。j .地中海gydF4y2Ba.gydF4y2Ba4gydF4y2Ba(2018)。gydF4y2Ba
Suhr, o.b., Lundgren, E. & Westermark, P.一种突变,两种不同的疾病变体:阐明转甲状腺素淀粉样纤维组成的影响。gydF4y2Baj .实习生。地中海。gydF4y2Ba281gydF4y2Ba, 337-347(2017)。gydF4y2Ba
Gustafsson, S.等人。淀粉样纤维组成作为肝移植后遗传性转甲状腺素淀粉样变心肌病发展的预测因子。gydF4y2Ba移植gydF4y2Ba93gydF4y2Ba, 1017-1023(2012)。gydF4y2Ba
Ihse, E.等。淀粉样纤维组成与遗传性转甲状腺素V30M淀粉样变的表型相关。gydF4y2Baj .分册。gydF4y2Ba216gydF4y2Ba, 253-261(2008)。gydF4y2Ba
Ihse, E.等。含有碎片化ATTR的淀粉样纤维可能是ATTR淀粉样变的标准纤维成分。gydF4y2Ba淀粉样蛋白gydF4y2Ba20.gydF4y2Ba, 142-150(2013)。gydF4y2Ba
Bergström, J.等。转甲状腺素衍生淀粉样变性中的淀粉样沉积:裂解的转甲状腺素与独特的淀粉样形态相关。gydF4y2Baj .分册。gydF4y2Ba206gydF4y2Ba, 224-232(2005)。gydF4y2Ba
小池,H.等。早发型和晚发型转甲状腺素Val30Met家族性淀粉样多神经病中淀粉样沉积的独特特征gydF4y2Baj .神经。科学。gydF4y2Ba287gydF4y2Ba, 178-184(2009)。gydF4y2Ba
施密特等人。遗传性ATTR淀粉样变患者经甲状腺素衍生淀粉样纤维的冷冻电镜结构。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 5008(2019)。gydF4y2Ba
Iakovleva等人。眼玻璃体中转甲状腺素淀粉样蛋白形成的结构基础。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 7141(2021)。gydF4y2Ba
Dominguez, F., Kühl, U., Pieske, B., Garcia-Pavia, P. & Tschöpe, C.心肌炎和炎症性心肌病最新进展:心肌内膜活检的重现。gydF4y2BaRev. Esp. Cardiol。心血管病。艾德。gydF4y2Ba69gydF4y2Ba, 178-187(2016)。gydF4y2Ba
埃舍尔,F.等。炎症性心肌病患者心肌内膜活检中存在穿孔素预示预后差:穿孔素是心肌病的预后因素。gydF4y2Ba欧元。心脏衰竭。gydF4y2Ba16gydF4y2Ba, 1066-1072(2014)。gydF4y2Ba
Müller-Eberhard, H. J.补体的杀手分子。gydF4y2Baj .投资。北京医学。gydF4y2Ba85gydF4y2Ba, s47-s52(1985)。gydF4y2Ba
Treitz, C.等人。定量蛋白质组分析提供了补体级联激活ATTR淀粉样变的证据。gydF4y2Ba淀粉样蛋白gydF4y2Ba1 - 8 (2021)gydF4y2Bahttps://doi.org/10.1080/13506129.2021.2015316gydF4y2Ba.gydF4y2Ba
Annamalai, K.等人。体内淀粉样原纤维的多态性。gydF4y2BaAngew。化学。Int。艾德。gydF4y2Ba55gydF4y2Ba, 4822-4825(2016)。gydF4y2Ba
Vilà-Rico, M.等。遗传性ATTR中转甲状腺素(TTR)翻译后修饰(PTMs)的质谱分析:西班牙病例对照经验。gydF4y2Ba欧菲尼特。gydF4y2Ba10gydF4y2Ba, p53(2015)。gydF4y2Ba
金斯伯里,j.s.等。使用一种新的纯化策略和质谱分析淀粉样变野生型转甲状腺素的详细结构分析。gydF4y2Ba分析的化学。gydF4y2Ba79gydF4y2Ba, 1990-1998(2007)。gydF4y2Ba
达萨里,A. K. R.等。转甲状腺素聚集途径形成独特的细胞毒性低聚物。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba, 33(2019)。gydF4y2Ba
猎鹰,B.等人。慢性创伤性脑病中新型tau纤维折叠包围疏水分子。gydF4y2Ba自然gydF4y2Ba568gydF4y2Ba, 420-423(2019)。gydF4y2Ba
关岛,Y.等人。组织选择性淀粉样蛋白病的生物学和化学基础。gydF4y2Ba细胞gydF4y2Ba121gydF4y2Ba, 73-85(2005)。gydF4y2Ba
Misu, K., Hattori, N., Ando, Y., Ikeda, S. & Sobue, G.在日本预测早发性但非晚发性家族性淀粉样蛋白多神经病(TTR Met 30)。gydF4y2Ba神经学gydF4y2Ba55gydF4y2Ba, 451-452(2000)。gydF4y2Ba
Cisneros-Barroso, E.等。马略卡群集遗传性ATTRV30M淀粉样变亲属发病年龄的预测gydF4y2Ba淀粉样蛋白gydF4y2Ba27gydF4y2Ba, 254-258(2020)。gydF4y2Ba
Bezerra, F., Saraiva, M. J. & Almeida, M. R.驱动转甲状腺素淀粉样变的机制调制。gydF4y2Ba前面。摩尔。>。gydF4y2Ba13gydF4y2Ba, 592644(2020)。gydF4y2Ba
Nienhuis, H. L. A. Bijzet, J. & Hazenberg, B. P. C.系统性淀粉样变性在西方国家的患病率和管理。gydF4y2Ba肾脏说。gydF4y2Ba2gydF4y2Ba, 10-19(2016)。gydF4y2Ba
Bellotti, V., Mangione, P. & Merlini, G.综述:免疫球蛋白轻链淀粉样变-结构和致病变异性的原型。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba130gydF4y2Ba, 280-289(2000)。gydF4y2Ba
Radamaker, L.等。低温电镜显示系统性AL淀粉样变患者来源的淀粉样原纤维结构断裂。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 875(2021)。gydF4y2Ba
吉尔莫,J. D.等人。心脏转甲状腺素淀粉样变的一种新的分期系统。gydF4y2Ba欧元。心J。gydF4y2Ba39gydF4y2Ba, 2799-2806(2018)。gydF4y2Ba
Gioeva, Z.等人。腕管韧带中的ATTR淀粉样蛋白通常是野生型转甲状腺素来源。gydF4y2Ba淀粉样蛋白gydF4y2Ba20.gydF4y2Ba, 1-6(2013)。gydF4y2Ba
克雷默,J. R.马斯特罗纳德,D. N. &麦金托什,J. R.三维图像数据的计算机可视化使用IMOD。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba116gydF4y2Ba, 71-76(1996)。gydF4y2Ba
Zivanov, J., Nakane, T. & Scheres, S. H. W.在低温em单粒子分析中光束诱导运动校正的贝叶斯方法。gydF4y2BaIUCrJgydF4y2Ba6gydF4y2Ba, 5-17(2019)。gydF4y2Ba
Rohou, A. & Grigorieff, N. CTFFIND4:快速准确的电子显微图像离焦估计。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba192gydF4y2Ba, 216-221(2015)。gydF4y2Ba
他,S. & Scheres, S. H. W. RELION中的螺旋重建。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba198gydF4y2Ba, 163-176(2017)。gydF4y2Ba
Zivanov, J.等人。在RELION-3中自动高分辨率冷冻- em结构测定的新工具。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e42166(2018)。gydF4y2Ba
Zivanov, J., Nakane, T. & Scheres, S. H. W.从低温电磁数据集的高阶像差和各向异性放大的估计gydF4y2BaRELIONgydF4y2Ba-3.1。gydF4y2BaIUCrJgydF4y2Ba7gydF4y2Ba, 253-267(2020)。gydF4y2Ba
彼得森,E. F.等人。加州大学旧金山分校妄想吗?用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605-1612(2004)。gydF4y2Ba
Liebschner, D.等人。利用x射线、中子和电子测定大分子结构:研究的最新进展gydF4y2Ba凤凰gydF4y2Ba.gydF4y2BaActa Crystallogr。教派。结构。医学杂志。gydF4y2Ba75gydF4y2Ba, 861-877(2019)。gydF4y2Ba
埃姆斯利,P. &考坦,K。gydF4y2Ba傻瓜gydF4y2Ba:分子图形的模型构建工具。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba60gydF4y2Ba, 2126-2132(2004)。gydF4y2Ba
威廉姆斯,C. J.等。MolProbity:改进全原子结构验证的更多更好的参考数据:PROTEIN SCIENCE.ORG。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba, 293-315(2018)。gydF4y2Ba
Niedermeyer, T. H. J. & Strohalm . mMass作为环肽串联质谱注释的软件工具。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Ba, e44913(2012)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Marcus Fändrich对这个项目的支持和主持。我们感谢Alexander Ziemer确定炎症细胞的数量,Hans-Michael Behrens进行数字图像分析,Paul Walther提供铂影技术支持。我们感谢Natalie Scheuermann和Lukas Kuhn的实验室协助,以及乌尔姆大学核心单元质谱和蛋白质组学的Sebastian Wiese的质谱数据收集。所有低温电镜数据均在海德堡的欧洲分子生物学实验室(EMBL)收集。作者感谢Felix Weis (EMBL Heidelberg)的技术支持。研究经费由Deutsche Forschungsgemeinschaft提供。FA 456/28和研究单位FOR 2969,项目HE 8472/1-1和SCHO 1364/2-1)。gydF4y2Ba
资金gydF4y2Ba
由Projekt DEAL启动和组织的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
M.St。,J.G. and J.B. carried out experiments. U.H. and S.S. contributed materials. M.St., J.G., J.B., C.R., and M.S. analyzed the data. M.St., J.G., and M.S. wrote the paper.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Hans Christian Beck、Mineyuki Mizuguchi和其他匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
斯坦布雷,M.,戈特瓦尔德,J.,鲍尔,J.。gydF4y2Baet al。gydF4y2Ba系统性非遗传性转甲状腺素淀粉样变ATTRwt淀粉样原纤维的冷冻电镜结构。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6398(2022)。https://doi.org/10.1038/s41467-022-33591-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33591-4gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba