摘要gydF4y2Ba
Interleukin-9第CD4 (IL-9)gydF4y2Ba+gydF4y2BaT辅助细胞(Th9)与过敏/哮喘和抗肿瘤免疫有关,但它们与由IL-4和转化生长因子-β (TGF-β)驱动的活化T细胞的分化,仍缺乏分子研究。在这里,我们展示了两个转录因子d结合蛋白(DBP)和E2F8在控制Th9分化方面的相反功能。具体来说,TGF-β和IL-4信号通路诱导Smad3 (pSmad3L-Ser)连接区丝氨酸213位点磷酸化gydF4y2Ba213gydF4y2Ba)通过磷酸化的p38,这是必要的和充分的gydF4y2BaIl9gydF4y2Ba基因转录。我们确定DBP和E2F8分别为激活剂和抑制剂gydF4y2BaIl9gydF4y2Ba由pSmad3L-Ser转录gydF4y2Ba213gydF4y2Ba.值得注意的是,sirna介导的敲除的Th9细胞gydF4y2Ba菲律宾gydF4y2Ba或gydF4y2BaE2f8gydF4y2Ba在小鼠肿瘤模型中,分别促进和抑制肿瘤生长。重要的是,DBP和E2F8在体外调节人TH9分化中也表现出相反的功能。因此,我们的数据揭示了Smad3连接子区域介导的、DBP和E2F8在Th9分化中的对立功能的分子机制。gydF4y2Ba
简介gydF4y2Ba
天真的CD4gydF4y2Ba+gydF4y2Ba在不同细胞因子的存在下,TCR刺激T细胞分化成不同的T辅助性(Th)亚群。Th9细胞是最近发现的CD4细胞的一个亚群gydF4y2Ba+gydF4y2Ba体外对TGF-β和IL-4产生IL-9的T细胞gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba并参与过敏性炎症和哮喘的发病机制gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba并在抗肿瘤免疫中发挥作用gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.尽管有报道称有几个转录因子包括PU.1, IRF4, Stat6, Stat5, E2A, GATA-3和NF-κB参与Th9的分化gydF4y2Ba10gydF4y2Ba,它们也参与其他Th细胞亚群的分化。因此,是否有独特的或主要的转录因子控制仍然是未知的gydF4y2BaIl9gydF4y2BaTh9细胞的基因转录gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
TGF-β在调控T细胞(Tregs)的发育和分化中发挥重要作用gydF4y2Ba14gydF4y2Ba, Th17细胞gydF4y2Ba15gydF4y2Ba和Th9细胞gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba3.gydF4y2Ba在IL-2, IL-6和IL-4的存在下近期研究表明IL-2通过抑制PTEN选择性抑制Th17细胞分化gydF4y2Ba16gydF4y2Ba.此外,阻断IL-6信号可极化TGF-β诱导高GARP和LAP表达的treggydF4y2Ba17gydF4y2BaIL-4抑制TGF-β介导的Treg分化,通过hdac9介导的表观遗传调控促进Th9细胞分化gydF4y2Ba18gydF4y2Ba.然而,TGF-β和IL-4信号共同驱动的潜在分子机制gydF4y2BaIl9gydF4y2Ba基因转录而不是gydF4y2Bafoxp3gydF4y2Ba或gydF4y2BaRorγtgydF4y2Ba基因表达还没有被完全理解。TGF-β信号通路下游,smad3依赖性gydF4y2Ba9gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba据报道,道路可以驱动gydF4y2BaIl9gydF4y2Ba基因的表达。然而,Smad3是如何被激活的,以及在TGF-β和IL-4的刺激下需要Smad3的哪一部分仍然是未知的。例如Smad3包含C-terminal (C)和link (L)区域gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,但尚不清楚是需要c端磷酸化还是Smad3的连接区磷酸化gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因转录。gydF4y2Ba
白蛋白启动子(白蛋白D-box)结合蛋白的D位点,也称为DBPgydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,属于PAR bZIP(脯氨酸和富酸性氨基酸碱性亮氨酸拉链)转录因子家族,包括Fos、Jun、CREB和C/EBPgydF4y2Ba26gydF4y2Ba.这种转录激活因子识别并结合在白蛋白等基因启动子中的序列5 ' -RTTAYGTAAY-3 '。从功能上讲,DBP被认为是一种昼夜节律蛋白,但它对昼夜节律的产生并不是必需的,而是调节重要的时钟输出基因,控制哺乳动物的新陈代谢和睡眠-觉醒行为。DBP也被报道调节肝脏发育和造血。然而,DBP是否在T细胞分化或功能中发挥作用尚不清楚。gydF4y2Ba
转录因子E2F家族中的蛋白质在细胞周期调控、细胞分化、DNA应激反应和细胞凋亡等方面具有广泛的功能。E2F家族包括典型E2F (E2F1-6)和非典型E2F (E2F7和E2F8)gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.虽然E2F1-6优先与相关的DP蛋白DP1和DP2作为异质二聚体结合到DNA,“非典型”E2F7和E2F8包含两个不同的蛋白质结合子结构域gydF4y2Ba30.gydF4y2Ba.E2F8被认为是一种抑制因子,因为它缺乏典型E2Fs中发现的口袋蛋白结合域。据报道,E2F8通过促进滋养层巨细胞多倍化而促进胎盘发育gydF4y2Ba31gydF4y2Ba;据报道,E2F8是gydF4y2Ba微rna - 142gydF4y2Ba并参与控制T细胞在TCR刺激下的增殖gydF4y2Ba32gydF4y2Ba.然而,目前尚不清楚E2F8是否在Th9细胞分化中发挥作用。gydF4y2Ba
在本研究中,我们发现CD4细胞中存在TGF-β和IL-4信号通路gydF4y2Ba+gydF4y2BaT细胞诱导丝氨酸213磷酸化位点的Smad3连接子区域(pSMAD3L-SergydF4y2Ba213gydF4y2Ba),并且这种激活依赖于磷酸化p38的激活。Smad3L-Ser的磷酸化gydF4y2Ba213gydF4y2Ba从而促进DBP表达的增加和E2F8表达的减少,以响应TGF-β和IL-4信号。DBP和E2F8都直接绑定在gydF4y2BaIl9gydF4y2Ba基因启动子在其中起促进和抑制作用gydF4y2BaIl9gydF4y2Ba基因表达。重要的是,在收养转移之后gydF4y2Ba菲律宾- - -gydF4y2Ba不足和gydF4y2BaE2f8gydF4y2Ba-缺陷的Th9细胞分别在体内增强和抑制黑色素瘤和纤维肉瘤小鼠模型的肿瘤生长。值得注意的是,DBP和E2F8也在体外差异调节人Th9分化,提示在癌症免疫治疗中具有临床意义。gydF4y2Ba
结果gydF4y2Ba
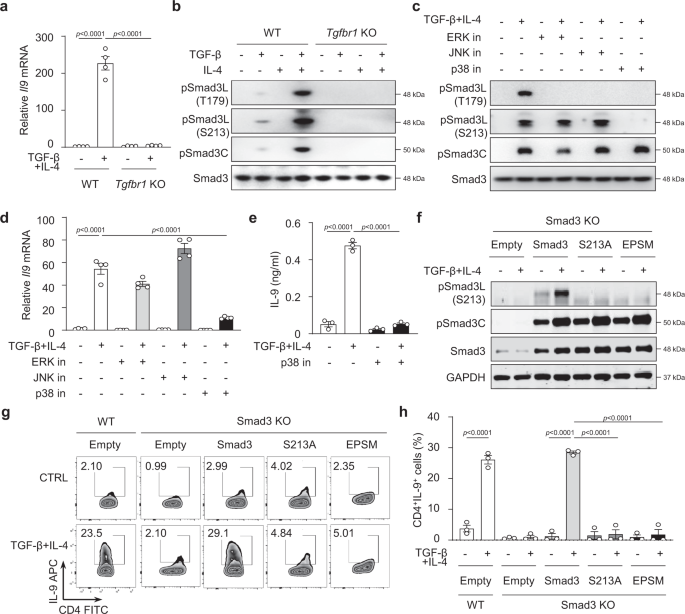
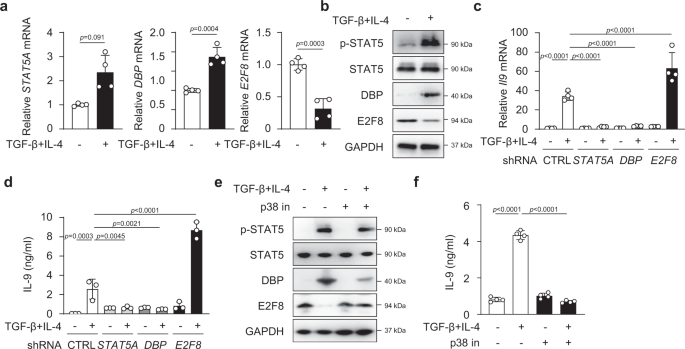
Smad3连接区磷酸化是Th9分化所必需的gydF4y2Ba
TGF-β信号在IL-4的存在下是Th9细胞分化所必需的gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,如TGF-β受体I (gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2Ba)在T细胞中消除gydF4y2BaIl9gydF4y2Ba表达naïve CD4gydF4y2Ba+gydF4y2BaTCR刺激T细胞(抗cd3和抗cd28)(图。gydF4y2Ba1gydF4y2Ba).在TGF-β受体介导的信号通路下游,Smad3已被证实在Th9分化中发挥作用,作为Smad3的基因突变(Smad3gydF4y2Ba−−/gydF4y2Ba)导致T细胞中IL-9的减少gydF4y2Ba6gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.然而,Smad3活性介导的机制gydF4y2BaIl9gydF4y2BaT细胞对TGF-β和IL-4信号响应的转录仍不清楚。Smad3通过磷酸化其C-末端(C)和/或连接子(L)区域获得其中介活性gydF4y2Ba33gydF4y2Ba对不同刺激的反应。Smad3的c端Ser-Ser-X-Ser基序直接被激活的TGF-β受体I磷酸化gydF4y2Ba34gydF4y2Ba;然而,Smad3结构多样的连接子区含有一个苏氨酸(苏氨酸)gydF4y2Ba179gydF4y2Ba)和三个丝氨酸(爵士gydF4y2Ba204gydF4y2Ba先生,gydF4y2Ba208gydF4y2Ba和爵士gydF4y2Ba213gydF4y2Ba)集群站点(补充图gydF4y2Ba1gydF4y2Ba),除了TGF-β信号外,它还可以被丝裂原诱导的通路磷酸化,如细胞外信号调节激酶(ERK)、c-Jun n-末端激酶(JNK)和p38 MAPKgydF4y2Ba33gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.TGF-β和IL-4都不能单独刺激T细胞转录gydF4y2BaIl9gydF4y2Ba我们推测,TGF-β和IL-4信号的联合作用可能激活Smad3的连接子区和/或c端从而诱导gydF4y2BaIl9gydF4y2Ba基因的表达。为了研究这一点,我们刺激了正常的C57BL/6 naïve CD4gydF4y2Ba+gydF4y2Ba在TGF-β和IL-4存在的情况下,检测抗cd3和抗cd28抗体的T细胞c端(pSmad3C)和连接子区Thr的磷酸化情况gydF4y2Ba179gydF4y2Ba和爵士gydF4y2Ba213gydF4y2Ba(pSmad3L-ThrgydF4y2Ba179gydF4y2Ba和pSmad3L-SergydF4y2Ba213gydF4y2Ba).虽然单独TGF-β处理可诱导大量pSmad3C和一定程度的连接子pSmad3L-ThrgydF4y2Ba179gydF4y2Ba以及极少量的链接剂pSmad3L-SergydF4y2Ba213gydF4y2Ba1 h时,TGF-β和IL-4联合作用可降低pSmad3C,而pSmad3L-Thr无变化gydF4y2Ba179gydF4y2Ba,但pSmad3L-Ser增加gydF4y2Ba213gydF4y2Ba与单独TGF-β治疗相比(补充图。gydF4y2Ba1 bgydF4y2Ba).令人惊讶的是,到2小时,pSmad3L-SergydF4y2Ba213gydF4y2Ba在TGF-β和IL-4刺激下Smad3的三个磷酸化位点中,它是最高的。gydF4y2Ba1 bgydF4y2Ba).Smad3蛋白总量在所有处理中没有变化(图。gydF4y2Ba1 bgydF4y2Ba和补充图。gydF4y2Ba1 bgydF4y2Ba).这表明TGF-β和IL-4联合信号通路优化了连接子区域的激活,尤其是Ser的激活gydF4y2Ba213gydF4y2BaSmad3蛋白的位置。值得注意的是,在naïve CD4细胞中,TGF-β和IL-4诱导的Smad3 c -末端和连接子区磷酸化被完全消除gydF4y2Ba+gydF4y2BaT细胞缺乏TGF-β受体I,并伴有完全衰竭gydF4y2BaIl9gydF4y2Ba基因转录gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaT细胞(图gydF4y2Ba1gydF4y2Ba).数据表明gydF4y2BaIl9gydF4y2Ba基因表达可能需要Smad3蛋白的连接区和/或c端磷酸化,以响应TGF-β和IL-4信号。gydF4y2Ba
一个gydF4y2Ba的表达gydF4y2BaIl9gydF4y2BamRNA在naïve CD4gydF4y2Ba+gydF4y2BaT细胞从gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2Ba呃gydF4y2Ba-gydF4y2BacregydF4y2Ba+gydF4y2Ba接受油(WT)或他莫西芬(gydF4y2BaTgfbr1gydF4y2Ba用TGF-β + IL-4刺激24小时,持续5天。结果与对照基因的结果相比较gydF4y2Ba产生HprtgydF4y2Ba.gydF4y2BabgydF4y2Ba蛋白印迹分析磷酸化连接区苏氨酸gydF4y2Ba179gydF4y2Ba(pSmad3L-T179),爵士gydF4y2Ba213gydF4y2Ba(pSmad3L-S213)位点和Smad3的c端(pSmad3C)和总Smad3 (Smad3)gydF4y2BaTgfbr1gydF4y2BaKO CD4gydF4y2Ba+gydF4y2BaT细胞与TGF-β、IL-4或TGF-β + IL-4培养基培养2 h。gydF4y2BacgydF4y2Ba正常CD4细胞中Smad3磷酸化的Western印迹gydF4y2Ba+gydF4y2Ba用指示的抑制剂预处理T细胞,然后用TGF-β + IL-4培养2 h。gydF4y2BadgydF4y2Ba实时RT-PCR分析gydF4y2BaIl9gydF4y2Ba信使rna在CD4gydF4y2Ba+gydF4y2Ba用抑制剂预处理的T细胞gydF4y2BacgydF4y2BaTGF-β + IL-4培养24 h。gydF4y2BaegydF4y2BaELISA法测定细胞培养上清中CD4细胞中IL-9蛋白的含量gydF4y2Ba+gydF4y2BaT细胞与TGF-β + IL-4联合或不联合p38抑制剂培养72 h。gydF4y2BafgydF4y2BaSmad3中指示的连接子区域和c端磷酸化gydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba转染完整WT Smad3和S213A-或EPSM-Smad3突变体的T细胞(方案见补充图。gydF4y2Ba2 a - cgydF4y2Ba),然后用TGF-β + IL-4刺激2 h。gydF4y2BaggydF4y2Ba流式细胞术检测IL-9的细胞内染色gydF4y2BafgydF4y2Ba72年之后,h。gydF4y2BahgydF4y2Ba研究结果摘要gydF4y2BaggydF4y2Ba.gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba这些数据代表了四个独立的实验或gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba汇集了三个实验。这些数据用单因素方差分析和Tukey检验进行分析。图显示均值±SEM。源数据作为源数据文件提供。gydF4y2Ba
接下来,我们试图了解在TGF-β和IL-4刺激下,介导Smad3 c端和连接子区域磷酸化的下游分子机制。众所周知,在TGF-β刺激下,Smad3 c端直接被TβRI激活。gydF4y2Ba1 bgydF4y2Ba)gydF4y2Ba36gydF4y2Ba,而Smad3的连接区除了TGF-β信号通路外,也可以被MAPK磷酸化gydF4y2Ba33gydF4y2Ba,我们假设TGF-β和IL-4信号通路可以通过上述MAP激酶磷酸化Smad3的连接区。为此,我们首先在正常的naïve CD4中检测了这些MAPK的激活gydF4y2Ba+gydF4y2Ba发现TGF-β + IL-4诱导JNK、p38和ERK快速磷酸化;磷酸化在刺激后1小时达到峰值,然后在刺激后2小时下降(补充图。gydF4y2Ba1 cgydF4y2Ba).同样,在naïve中,TGF-β + IL-4对p-JNK, p-ERK和p-p38的增加被完全消除gydF4y2BaTgfbrgydF4y2Ba1克ydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2BaT细胞(补充图;gydF4y2Ba1 dgydF4y2Ba),提示TGF-β信号通路在此过程中发挥重要作用。gydF4y2Ba
然后我们研究了激活的丝裂原激活蛋白激酶(MAPK),即p-ERK, p-JNK或p-p38,负责在Th9分化过程中Smad3的连接区和c端磷酸化。天真的CD4gydF4y2Ba+gydF4y2Ba在单独抑制剂SP600125 (p-JNK抑制剂)、U0126 (p-ERK抑制剂)或SB203580 (p-p38抑制剂)的存在下,用TCR和TGF-β + IL-4刺激T细胞2小时,然后是pSmad3C和pSmad3L-ThrgydF4y2Ba179gydF4y2Ba或pSamd3L-SergydF4y2Ba213gydF4y2Ba蛋白印迹法测定。p-ERK的抑制特异性降低了pSmad3L-ThrgydF4y2Ba179gydF4y2Ba,但不影响pSmad3L-SergydF4y2Ba213gydF4y2Ba网站(图。gydF4y2Ba1 cgydF4y2Ba),与上一份报告一致gydF4y2Ba35gydF4y2Ba.同样,抑制p-JNK抑制pSmad3L-ThrgydF4y2Ba179gydF4y2Ba但不是pSmad3L-SergydF4y2Ba213gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba).相反,p-p38活性的抑制阻断了pSmad3L-SergydF4y2Ba213gydF4y2Ba虽然它也抑制pSmad3L-ThrgydF4y2Ba179gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba).值得注意的是,抑制p-ERK, p-JNK或p-p38并不能改变TGF-β + IL-4诱导的pSmad3C(图1)。gydF4y2Ba1 cgydF4y2Ba).因此,TGF-β + IL-4信号通路激活了磷酸化Smad3L-Ser的p-p38gydF4y2Ba213gydF4y2Ba和Smad3L-ThrgydF4y2Ba179gydF4y2Bap-ERK和p-JNK,它们只磷酸化Smad3L-ThrgydF4y2Ba179gydF4y2Ba.gydF4y2Ba
接下来,我们确定了T细胞中IL-9的产生是否需要Smad3的c端或连接子区域的磷酸化。我们首先确定抑制p-p38会导致Smad3L-Ser的抑制gydF4y2Ba213gydF4y2Ba而p-ERK和p-JNK抑制Smad3L-ThrgydF4y2Ba179gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba),显著降低gydF4y2BaIl9gydF4y2Ba信使rna在CD4gydF4y2Ba+gydF4y2BaT细胞对TGF-β + IL-4的反应(图。gydF4y2Ba1 dgydF4y2Ba).一致地,IL-9蛋白也被p-p38抑制所抑制(图。gydF4y2Ba1 egydF4y2Ba).这些数据共同表明Smad3L-Ser的磷酸化gydF4y2Ba213gydF4y2Ba而不是Smad3L-Thr的磷酸化gydF4y2Ba179gydF4y2Ba或Smad3C的gydF4y2BaIl9gydF4y2BaTh9细胞分化过程中的基因激活。gydF4y2Ba
为了进一步验证pSmad3L-Ser不可或缺的作用gydF4y2Ba213gydF4y2Ba在gydF4y2BaIl9gydF4y2Ba在基因转录过程中,我们生成了Smad3结构,在连接子Ser区编码丝氨酸到丙氨酸突变gydF4y2Ba213gydF4y2Ba网站(Smad3L-SergydF4y2Ba213年,一个gydF4y2Ba)或在连接区T179V、S204A、S208A和S213A (EPSM)所有位点编码的丝氨酸到丙氨酸或苏氨酸到缬氨酸突变。一个连接子区域完整的Smad3结构被用作通配型控制(WT)(方案见补充图。gydF4y2Ba2gydF4y2Ba).我们转染Smad3gydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba携带WT或gfp标记结构的逆转录病毒T细胞突变Smad3连接子区域的相应磷酸化位点(补充图)。gydF4y2Ba2 a - cgydF4y2Ba).CD4gydF4y2Ba+gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2Ba分选T细胞,用TGF-β + IL-4刺激,检测pSmad3L-Ser的功能gydF4y2Ba213gydF4y2Ba在IL-9生产。首先,突变的SergydF4y2Ba213gydF4y2Ba独自一人(Smad3L-SergydF4y2Ba213年,一个gydF4y2Ba)或所有四个站点(EPSM)完全消除了pSmad3L-SergydF4y2Ba213gydF4y2Ba在Smad3gydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2BaTGF-β + IL-4诱导的T细胞。gydF4y2Ba1 fgydF4y2Ba),而同样的突变并没有改变任何pSmad3C或Smad3总蛋白。引人注目的是,SergydF4y2Ba213gydF4y2Ba或EPSM几乎完全消除了IL-9蛋白的产生(图。gydF4y2Ba1 g hgydF4y2Ba),而完整的WT Smad3过表达完全恢复了Smad3中的Th9细胞gydF4y2Ba−−/gydF4y2Ba证实了pSmad3L-Ser的必要作用gydF4y2Ba213gydF4y2Ba在gydF4y2BaIl9gydF4y2Ba基因转录。值得注意的是,Smad3gydF4y2Ba−−/gydF4y2Ba转染Smad3L-Ser突变的T细胞gydF4y2Ba213年,一个gydF4y2Ba或EPSM显示正常数量的pSmad3C(图。gydF4y2Ba1 fgydF4y2Ba),进一步说明pSmad3C在gydF4y2BaIl9gydF4y2Ba基因的表达。相反,我们过表达完整的WT Smad3或突变的Smad3L-SergydF4y2Ba213年,一个gydF4y2Ba或在WT CD4中表达EPSMgydF4y2Ba+gydF4y2BaT细胞(补充图;gydF4y2Ba2比gydF4y2Ba),显示了Ser的突变gydF4y2Ba213gydF4y2Ba或Smad3连接子区域的EPSM未能诱导IL-9的产生。gydF4y2Ba
为了确认pSmad3C的可供性功能,我们在c端生成了没有最后四个氨基酸残基(ΔSSVS)的Smad3结构体(补充图)。gydF4y2Ba二维gydF4y2Ba)并将它们或WT Smad3转染到Smad3中gydF4y2Ba−−/gydF4y2BaT细胞。WT Smad3完全恢复了pSmad3C的水平,但突变体ΔSSVS未能导致Smad3C的磷酸化(补充图。gydF4y2Ba2 hgydF4y2Ba).然而,这些突变体显示出完全相同数量的pSmad3L-SergydF4y2Ba213gydF4y2BaWT Smad3结构也是如此。值得注意的是,WT Smad3结构恢复了gydF4y2BaIl9gydF4y2BaSmad3 mRNA和IL-9蛋白gydF4y2Ba−−/gydF4y2BaTGF-β和IL-4诱导的T细胞,与WT smad3转染的T细胞相比,突变体产生的IL-9数量相当(补充图。gydF4y2Ba2 i, jgydF4y2Ba).这些数据共同排除了pSmad3C在Th9分化中的作用。gydF4y2Ba
除IL-4外,IL-6 + TGF-β也可诱导CD4细胞产生IL-9gydF4y2Ba+gydF4y2BaT细胞gydF4y2Ba37gydF4y2Ba虽然IL-9的含量通常低于TGF-β + IL-4刺激的T细胞(补充图。gydF4y2Ba1 egydF4y2Ba).然而,与TGF-β + IL-4刺激相比,TGF-β + IL-6未能上调pSmad3L-SergydF4y2Ba213gydF4y2Ba(补充图。gydF4y2Ba1 fgydF4y2Ba),表明pSmad3L-SergydF4y2Ba213gydF4y2Ba是可有可无的gydF4y2BaIl9gydF4y2BaTGF-β和IL-6介导的基因表达。Stat6被认为参与了Th9的分化gydF4y2Ba38gydF4y2Ba我们注意到IL-4 + TGF-β信号上调了Stat6的磷酸化(p-Stat6)。然而,p-p38抑制剂未能改变TGFβ和IL-4诱导的p-Stat6(补充图。gydF4y2Ba1克gydF4y2Ba).此外,在th9偏斜条件下,白细胞介素1β (IL-1β)可激活转录因子Stat1和IRF1促进gydF4y2BaIl9gydF4y2Ba39gydF4y2Ba.然而,在我们的研究中,我们没有在我们的培养中添加IL-1β,因此,Stat1不太可能参与我们的系统。总的来说,这些结果提供了令人信服的证据pSmad3L-SergydF4y2Ba213gydF4y2Ba是必要的和充分的gydF4y2BaIl9gydF4y2Ba对TGF-β和IL-4信号的响应。gydF4y2Ba
鉴定DBP和E2F8为关键转录因子gydF4y2BaIl9gydF4y2Ba基因转录gydF4y2Ba
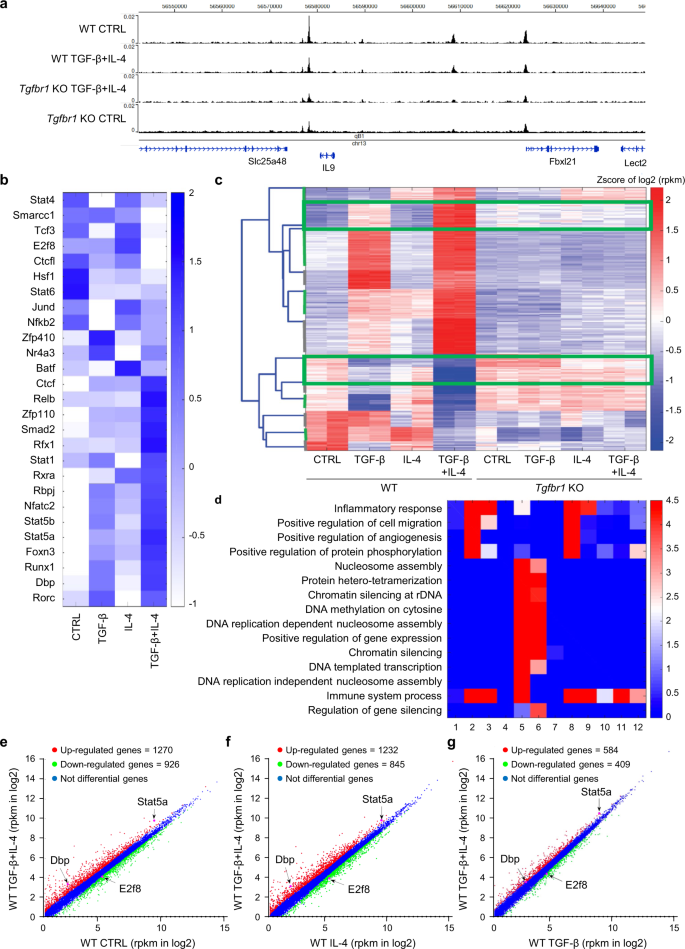
为了更好地了解转录调控元件和调控转录因子gydF4y2BaIl9gydF4y2BaCD4过程中的基因表达gydF4y2Ba+gydF4y2BaT细胞在TGF-β和IL-4信号的作用下向Th9细胞分化,我们决定通过DNase-seq分析全基因组DNase I超敏感位点(DHSs)gydF4y2Ba40gydF4y2Ba对天真的CD4gydF4y2Ba+gydF4y2BaT细胞在野生型(WT)对照、野生型TGF-β + IL-4、gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2Ba(KO)对照和KO TGF-β + IL-4。几个DHSs在gydF4y2BaIl9gydF4y2Ba基因座显示可达性降低gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2Ba细胞(图。gydF4y2Ba2gydF4y2Ba).在全球范围内,DNase-seq分析显示,在WT TGF-β + IL-4与KO TGF-β + IL-4的比较中,DHSs减少了3208个,DHSs增加了7023个。通过Motif富集分析(AME)对差异DHSs进行Motif分析,发现了许多富集的转录因子(TF)基序,包括来自基因表达的STAT蛋白、E2f8、Dbp和JunD的基序。gydF4y2Ba2 bgydF4y2Ba).接下来,我们还研究了周围差分DHSs中存在的TF基序gydF4y2BaIl9gydF4y2Ba使用查找单个Motif事件(FIMO)。通过与之前富集的TF基序进行比较,我们发现在WT TGF-β + IL-4细胞中存在Stat5a、Dbp和E2f8等多个TF基序,这表明Dbp和E2f8是Th9细胞分化的潜在调控因子。gydF4y2Ba
一个gydF4y2Ba基因组浏览器显示了四种条件下DNase-seq数据的全基因组图谱,包括Control WT, WT TGF-β + IL-4,gydF4y2BaTgfbr1gydF4y2BaKO TGF-β + IL-4与对照gydF4y2BaTgfbr1gydF4y2BaKO。gydF4y2BabgydF4y2Ba热图显示了丰富的转录因子基序的基因表达水平gydF4y2BaIl9gydF4y2Ba在WT控制、TGF-β、IL-4和TGF-β + IL4四种条件下均有显著差异。gydF4y2BacgydF4y2Ba热图显示了聚类结果(补充数据中有12个聚类gydF4y2Ba2gydF4y2Ba)的RNA-seq数据在适当的条件。热图表示log2转换后rpkm表达水平的z值。根据WT - TGF-β + IL-4与所有其他条件的显著差异,选择了两个特定的聚类(绿色边界线)。gydF4y2BadgydF4y2Ba热图显示了12个基因簇中每个基因的氧化石墨烯富集项。gydF4y2BaegydF4y2Ba散点图显示WT TGF-β + IL-4基因表达水平与对照的比较。gydF4y2BafgydF4y2Ba散点图显示了WT TGF-β + IL-4与WT IL-4基因表达水平的比较。gydF4y2BaggydF4y2Ba散点图显示了WT TGF-β + IL-4与WT TGF-β基因表达水平的比较。gydF4y2Ba
接下来,我们在CD4细胞中通过RNA-seq分析测定了全基因组基因表达谱gydF4y2Ba+gydF4y2Banaïve WT对照、TGF-β、IL-4、TGF-β + IL-4和KO对照、TGF-β、IL4、TGF-β + IL-4 8种条件下的T细胞(补充资料)gydF4y2Ba1克ydF4y2Ba).RNA-seq分析显示12个基因簇(补充数据gydF4y2Ba2gydF4y2Ba)。gydF4y2Ba2摄氏度gydF4y2Ba)使用K-medoids聚类。重要的是,我们观察到,在WT TGF-β + IL-4条件下,上调基因和下调基因比其他条件下要多得多(图1)。gydF4y2Ba2摄氏度gydF4y2Ba),表明在此条件下基因重编程更为广泛。通过对不同基因簇的基因本体(gene ontology Consortium)进行基因本体(GO)分析(gene ontology Consortium),我们观察到,与其他条件相比,模式增加最多的基因簇中富含与免疫反应相关的GO项(图1)。gydF4y2Ba二维gydF4y2Ba),提示TGF-β + IL-4刺激Th9细胞的免疫作用。gydF4y2Ba
在图中发现的潜在调节因子中。gydF4y2Ba2 bgydF4y2Ba,我们观察到gydF4y2Ba菲律宾gydF4y2Ba与其他培养条件(包括培养基刺激细胞(WT对照)、IL-4 (WT IL-4)和TGF-β (WT TGF-β)相比,在TGF-β + IL-4刺激的WT细胞中,IL-4的表达持续增加(图1)。gydF4y2Ba2比gydF4y2Ba和补充数据gydF4y2Ba3.gydF4y2Ba).此外,gydF4y2BaStat5agydF4y2Ba在TGF-β + IL-4处理的细胞中也增加(图。gydF4y2Ba2比gydF4y2Ba),与前一份报告一致gydF4y2Ba41gydF4y2Ba.另一方面,gydF4y2BaE2f8gydF4y2BaWT的CD4gydF4y2Ba+gydF4y2BaTGF-β + IL-4培养的T细胞与其他培养条件的比较(图1)。gydF4y2Ba2比gydF4y2Ba).这些结果表明,DBP和Stat5a的作用是激活因子,E2F8的作用是抑制因子gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因转录。gydF4y2Ba
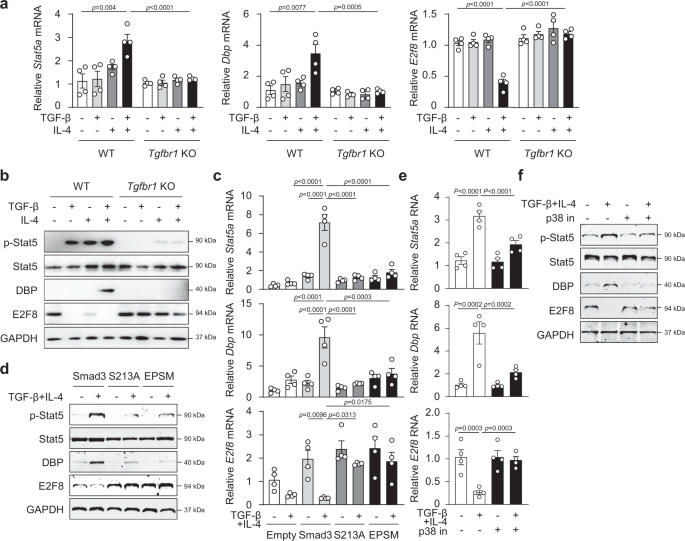
我们接下来通过实时荧光定量PCR验证了TGF-β + IL-4,而不是单独的,显著上调了gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaStat5agydF4y2Ba信使rna,但是表达下调gydF4y2BaE2f8gydF4y2Ba信使rna在CD4gydF4y2Ba+gydF4y2BaT细胞与单独用TCR处理的T细胞在24小时进行实时pcr的比较(图。gydF4y2Ba3gydF4y2Ba).的确,gydF4y2BaStat5agydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaIl9gydF4y2Ba基因表达上调gydF4y2BaE2f8gydF4y2Ba在刺激后72小时下调(补充图。gydF4y2Ba3gydF4y2Ba),相当于甚至优于24小时。重要的是,这些TGF-β + il -4介导的变化gydF4y2Ba菲律宾gydF4y2Bamrna在gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaT细胞(图gydF4y2Ba3gydF4y2Ba),提示TGF-β信号通路在此过程中发挥重要作用。与仅接受TCR刺激的T细胞相比,TGF-β + IL-4增强了DBP蛋白。gydF4y2Ba3 bgydF4y2Ba),但这种DBP的增加在gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaT细胞(图gydF4y2Ba3 bgydF4y2Ba).有趣的是,与tcr处理的细胞相比,pStat5蛋白被TGF-β或IL-4以及TGF-β + IL-4处理上调;然而,增加的pStat5在gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaT细胞(图gydF4y2Ba3 bgydF4y2Ba),提示TGF-β信号通路在pStat5a激活中发挥必要作用。相比之下,单独使用TGF-β、单独使用IL-4和TGF-β + IL-4刺激可显著降低WT CD4中E2F8蛋白的表达gydF4y2Ba+gydF4y2BaT细胞与tcr处理T细胞的比较(图。gydF4y2Ba3 bgydF4y2Ba);然而,这一变化在gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2BaT细胞(图gydF4y2Ba3 bgydF4y2Ba),提示TGF-β信号通路在TGF-β和IL-4介导的E2F8下调中起一定作用。然而,TGF-β信号如何调控il -4介导的E2f8下调还有待进一步研究。我们还比较了Th9和Th1、Th2、Th17、Treg细胞中DBP和E2F8的表达,发现Th9和Treg细胞中DBP的表达增加,而抑制gydF4y2BaE2f8gydF4y2Ba然而,仅在Th9细胞中发现了mRNA及其蛋白(补充图。gydF4y2Ba3 b, cgydF4y2Ba).这些数据共同表明,在Th9细胞分化过程中,TGF-β和IL-4信号通路可增加DBP,但降低E2F8。gydF4y2Ba
一个gydF4y2Bart - pcr分析和gydF4y2BabgydF4y2BaWestern blotting检测WT和gydF4y2BaTgfbr1gydF4y2BaKO CD4gydF4y2Ba+gydF4y2Ba用TGF-β、IL-4或TGF-β + IL-4培养的T细胞。转染CD4的WT、S213A-或EPSM-Smad3突变体在TGF-β和IL-4刺激过程中Stat5a、DBP和E2F8的表达gydF4y2Ba+gydF4y2BaT细胞gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba或p38抑制剂预处理的CD4gydF4y2Ba+gydF4y2BaT细胞gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba就像在gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba数据代表了四个独立的实验或gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba三个实验。数据采用双向方差分析和Tukey 's检验。图显示均值±SEM。源数据作为源数据文件提供。gydF4y2Ba
pSmad3L-SergydF4y2Ba213gydF4y2Ba调节gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba表达式gydF4y2Ba
如Smad3L-Ser的磷酸化gydF4y2Ba213gydF4y2Ba影响gydF4y2BaIl9gydF4y2Ba我们接下来研究了pSmad3L-Ser的作用gydF4y2Ba213gydF4y2Ba在调节gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba以及gydF4y2BaStat5agydF4y2Ba表达式。首先,分析gydF4y2BaStat5,菲律宾gydF4y2Ba,gydF4y2BaE2f8gydF4y2Ba基因启动子(相对于TSS的- 2000到- 1 bp),该软件识别了转录因子结合位点,显示这三个转录因子的启动子包含至少一个smad3结合元素,由一致核苷酸序列GTCTAGAC定义,位于−1864/−1859、−1845/−1840和−1764/−1759 (gydF4y2BaStat5agydF4y2Ba);−1645/−1640和−837/−832 (gydF4y2Ba菲律宾gydF4y2Ba);725−730 /−(gydF4y2BaE2f8gydF4y2Ba)相对于TSS,分别(补充图。gydF4y2Ba4gydF4y2Ba).染色质免疫沉淀(ChIP)实验表明Smad3与gydF4y2BaStat5agydF4y2Ba而且gydF4y2Ba菲律宾gydF4y2BaCD4启动子区明显富集gydF4y2Ba+gydF4y2BaT细胞对TGF-β + IL-4的反应gydF4y2Ba4 b, cgydF4y2Ba).Smad3被限定在gydF4y2BaE2f8gydF4y2Ba但在TGF-β + IL-4的作用下,其表达减少。gydF4y2Ba4 dgydF4y2Ba),提示TGF-β/ il -4介导的gydF4y2BaE2f8gydF4y2Ba可能是由于Smad3在gydF4y2BaE2f8gydF4y2Ba基因。gydF4y2Ba
在TGF-β和IL-4刺激下,CD4gydF4y2Ba+gydF4y2Ba转染完整的Smad3 (WT)的T细胞表现出明显的上调gydF4y2Ba菲律宾gydF4y2BamRNA和DBP蛋白,而CD4gydF4y2Ba+gydF4y2Ba转染突变的SergydF4y2Ba213年,一个gydF4y2Ba或EPSM在SMAD3连接子区域完全取消了增加gydF4y2Ba菲律宾gydF4y2Ba和DBP蛋白(图;gydF4y2Ba3 c, dgydF4y2Ba);另一方面,TGF-β + IL-4刺激显著下调gydF4y2BaE2f8gydF4y2BaCD4细胞中的mRNA和E2F8蛋白gydF4y2Ba+gydF4y2Ba转染WT Smad3的T细胞;然而,在转染突变Ser的T细胞中,这种情况被完全逆转gydF4y2Ba213年,一个gydF4y2Ba和EPSM(无花果。gydF4y2Ba3 c, dgydF4y2Ba).Stat5a的表达和激活的增加也被Ser的突变所抑制gydF4y2Ba213年,一个gydF4y2Ba和EPSM(无花果。gydF4y2Ba3 c, dgydF4y2Ba).数据表明pSmad3L-SergydF4y2Ba213gydF4y2Ba是Th9分化过程中上调DBP表达和Stat5a激活、下调E2F8的关键。gydF4y2Ba
由于MAPK p-p38是促进pSmad3L-Ser的关键因素gydF4y2Ba213gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba),起着不可或缺的作用gydF4y2BaIl9gydF4y2Ba基因转录CD4gydF4y2Ba+gydF4y2BaT细胞对TGF-β和IL-4的反应(图。gydF4y2Ba1 d, egydF4y2Ba),我们假设p-p38活性受到影响gydF4y2BaStat5a,菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba表达式。我们培养了naïve CD4gydF4y2Ba+gydF4y2Ba在Th9分化条件下,在p38特异性抑制剂存在的T细胞,发现封锁p-p38活性确实大幅抑制gydF4y2Ba菲律宾gydF4y2BamRNA和DBP蛋白,但增强gydF4y2BaE2f8gydF4y2BamRNA与E2F8蛋白的表达(图。gydF4y2Ba3 e, fgydF4y2Ba).抑制p-p38也降低了gydF4y2BaStat5agydF4y2BamRNA和pStat5蛋白的数量(图。gydF4y2Ba3 e, fgydF4y2Ba).数据显示pSmad3L-SergydF4y2Ba213gydF4y2Ba差别调节的关键是什么gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba对CD4细胞中TGF-β和IL-4的响应gydF4y2Ba+gydF4y2BaT细胞。gydF4y2Ba
增加DBP和减少E2F8绑定gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因gydF4y2Ba
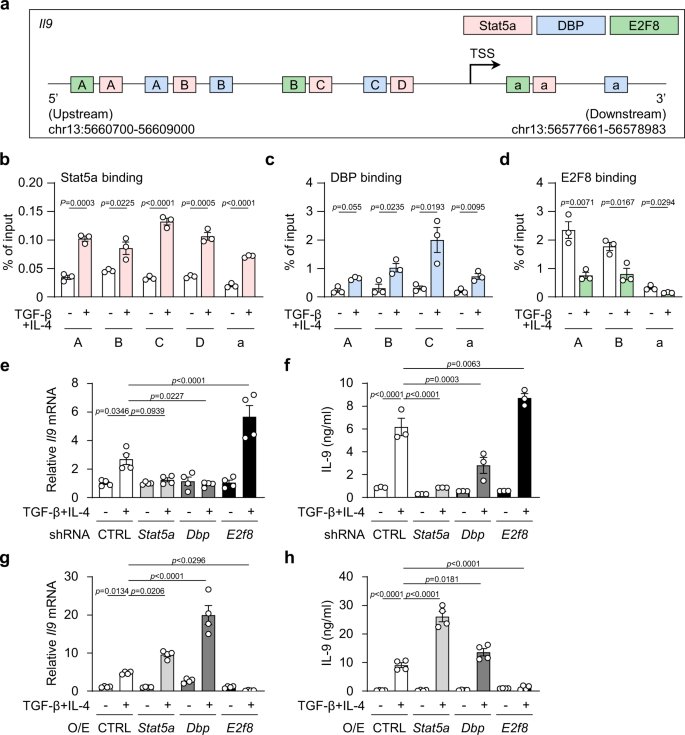
除了评估表达式中更改的影响之外,我们下一步确定DBP、Stat5a和E2F8的绑定到gydF4y2BaIl9gydF4y2Ba在Th9分化过程中,TGF-β和IL-4的刺激对基因也有影响。的分析gydF4y2BaIl9gydF4y2Ba使用PROMO软件(ALGGEN)识别转录因子结合位点的启动子,揭示了gydF4y2BaIl9gydF4y2Ba启动子区域包含至少一个下游(指定为gydF4y2Ba一个gydF4y2Ba)及三个上游(指定为gydF4y2BaA, B, C)gydF4y2BaDBP的绑定位点(位于+965/+1033,−1565/−1555,−1052/−1042和−178/−168),下游一个(指定为gydF4y2Ba一个gydF4y2Ba)和两个上游(指定为gydF4y2BaA、BgydF4y2Ba) E2F8的结合位点(位于+43/+ 61,−1827/−1815和−413/−404)和一个下游(指定为gydF4y2Ba一个gydF4y2Ba)及四个上游(指定为gydF4y2BaA, b, c, dgydF4y2Ba)相对于转录起始位点(TSS), Stat5a的结合位点(位于+113/+160,−1782/−1756,−1421/−1383,−362/−324和−136/−110)。gydF4y2Ba4gydF4y2Ba).ChIP分析表明,所有的DBP和Stat5a绑定到gydF4y2BaIl9gydF4y2BaCD4启动子区明显富集gydF4y2Ba+gydF4y2BaT细胞对TGF-β + IL-4的反应与单独使用TCR刺激的T细胞中它们的结合比较(图1)。gydF4y2Ba4 b, cgydF4y2Ba).相反,E2F8与上游结合基序和下游结合基序的结合gydF4y2BaIl9gydF4y2Ba与单独使用TCR刺激的细胞结合启动子区域相比,在TGF-β + IL-4刺激的T细胞中,启动子区域明显下调。gydF4y2Ba4 dgydF4y2Ba).数据显示,TGF-β + IL-4也增强了Stat5a和DBP的直接结合,但降低了E2F8的结合gydF4y2BaIl9gydF4y2Ba启动子。gydF4y2Ba
一个gydF4y2Ba基因中Stat5a、DBP和E2F8结合元件的鉴定gydF4y2BaIl9gydF4y2Ba基因。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba芯片分析Stat5a, DBP和E2F8结合到的启动子区域gydF4y2BaIl9gydF4y2Ba在Th9分化。gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba的表达gydF4y2BaIl9gydF4y2Ba信使rna和gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2BaIL-9和CD4的ELISA检测gydF4y2Ba+gydF4y2Ba转染的T细胞gydF4y2BaStat5agydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba或gydF4y2BaE2f8gydF4y2Ba具体的成分gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba或overexpressing病毒gydF4y2Bag hgydF4y2Ba随后用TGF-β + IL-4刺激。O / E,过表达。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba这些数据代表了三个独立的实验或gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba四个实验。这些数据由gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba双尾未配对的学生的gydF4y2BatgydF4y2Ba测试或gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba单因素方差分析与Tukey 's检验。图显示均值±SEM。源数据作为源数据文件提供。gydF4y2Ba
DBP促进,E2F8抑制gydF4y2BaIl9gydF4y2Ba基因表达gydF4y2Ba
接下来,我们确定了DBP的激活功能和E2F8的抑制作用gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因转录。为了做到这一点,我们充分敲掉了表达gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba以及gydF4y2BaStat5agydF4y2Ba和它们特定的shrna。引人注目的是,击倒的gydF4y2Ba菲律宾gydF4y2Ba与其特异性shRNA的结合会显著减少gydF4y2BaIl9gydF4y2BaTGF-β + IL-4刺激时,mRNA和IL-9蛋白与对照shrna处理的T细胞比较(图。gydF4y2Ba4 e, fgydF4y2Ba和补充图。gydF4y2Ba4 egydF4y2Ba).与之形成鲜明对比的是,击倒gydF4y2BaE2f8gydF4y2Ba其特异性shRNA显著增加gydF4y2BaIl9gydF4y2BaCD4细胞的mRNA和IL-9蛋白gydF4y2Ba+gydF4y2BaT细胞与对照shRNA处理的T细胞的比较(图。gydF4y2Ba4 e, fgydF4y2Ba和补充图。gydF4y2Ba4 egydF4y2Ba).果然,减少了gydF4y2BaStat5agydF4y2Ba也减少了gydF4y2BaIl9gydF4y2BamRNA和IL-9蛋白(图。gydF4y2Ba4 e, fgydF4y2Ba和补充图。gydF4y2Ba4 egydF4y2Ba).数据表明,DBP增强而E2F8抑制gydF4y2BaIl9gydF4y2Ba基因转录。gydF4y2Ba
为了进一步验证DBP和E2F8在IL-9生产中的调节和抑制功能,我们接下来通过过表达进行了基因功能获得研究gydF4y2Ba菲律宾,E2f8gydF4y2Ba而且gydF4y2BaStat5gydF4y2Ba在T细胞。过度的gydF4y2Ba或类似Stat5gydF4y2Ba显著增强Th9细胞,而过表达gydF4y2BaE2f8gydF4y2BaTGF-β + IL-4诱导Th9细胞减少。(无花果。gydF4y2Ba4 g hgydF4y2Ba和补充图。gydF4y2Ba4 fgydF4y2Ba).TGF-β + IL-4处理后5天,Th9细胞分化进一步增强。gydF4y2Ba4 ggydF4y2Ba).重要的是,被sh击倒gydF4y2BaStat5agydF4y2Ba或上海gydF4y2Ba菲律宾gydF4y2Ba转染T细胞显著减少了产生il -9的T细胞,而shgydF4y2BaE2f8gydF4y2Ba-转染的T细胞在5天培养中增强了Th9细胞,表明转录因子确实影响了Th9极化。这些数据共同表明,Stat5和DBP是关键增强子,E2F8是关键抑制子gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因转录。gydF4y2Ba
TGF-β+IL-4增加CD8 Tc9细胞的DBP,降低E2F8gydF4y2Ba
除了Th9细胞,CD8gydF4y2Ba+gydF4y2Ba在TGF-β和IL-4的刺激下,T细胞也能产生IL-9 (Tc9)。gydF4y2Ba5 a、bgydF4y2Ba)gydF4y2Ba42gydF4y2Ba.我们观察到TGF-β + IL-4也增加了gydF4y2Ba菲律宾gydF4y2BamRNA和DBP蛋白含量均下降gydF4y2BaE2f8gydF4y2BaCD8中mRNA和E2F8蛋白表达gydF4y2Ba+gydF4y2BaT细胞(补充图;gydF4y2Ba5 c, dgydF4y2Ba).gydF4y2BaStat5agydF4y2BaTGF-β和IL-4处理也上调了p-Stat5a(补充图。gydF4y2Ba5 c, dgydF4y2Ba).与Th9细胞一样(图。gydF4y2Ba1 d, egydF4y2Ba),抑制p38gydF4y2BaIl9gydF4y2BaCD8 mRNA和IL-9蛋白gydF4y2Ba+gydF4y2BaTGF-β和IL-4诱导的T细胞。gydF4y2Ba5a, b, e, fgydF4y2Ba).重要的是,抑制p38也分别降低了Tc9细胞中Dbp的表达和增加了E2f8的表达(补充图。gydF4y2Ba5 c, dgydF4y2Ba).的表达gydF4y2BaStat5agydF4y2Ba也被p38抑制剂抑制(补充图。gydF4y2Ba5 c, dgydF4y2Ba).数据表明,这些转录因子在CD8中IL-9的产生中具有类似的作用gydF4y2Ba+gydF4y2BaT细胞。gydF4y2Ba
DBP和E2F8在人TH9细胞分化中的作用gydF4y2Ba
接下来,我们进一步研究了DBP和E2F8在人类TH9细胞分化中的表达和功能。我们分离了naïve CD4gydF4y2Ba+gydF4y2Ba从健康受试者的外周血单个核细胞中提取T细胞,在TGF-β和IL-4存在或不存在的情况下刺激抗cd3和抗cd28抗体的细胞。正如所料,与我们之前的发现一致gydF4y2Ba9gydF4y2Ba, TGF-β + IL-4诱导gydF4y2BaIl9gydF4y2Ba信使rna(补充图。gydF4y2Ba6gydF4y2Ba)和IL-9蛋白(补充图。gydF4y2Ba6 b, cgydF4y2Ba)在人类T细胞中。类似于老鼠的CD4gydF4y2Ba+gydF4y2BaT细胞,TGF-β + IL-4增加的mrnagydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaSTAT5AgydF4y2Ba,但减少了gydF4y2BaE2F8gydF4y2Ba信使rna(无花果。gydF4y2Ba5gydF4y2Ba).Western blot分析显示,人CD4细胞中DBP和pSTAT5蛋白显著上调,E2F8蛋白显著下调gydF4y2Ba+gydF4y2BaTGF-β + IL-4刺激的T细胞与单独TCR刺激的T细胞比较(图1)。gydF4y2Ba5 bgydF4y2Ba).重要的是,廉价的gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2F8gydF4y2Ba人类T细胞中的基因也被抑制和增强gydF4y2BaIl9gydF4y2BaTH9分化过程中IL-9的表达和IL-9的产生(图。gydF4y2Ba5 c, dgydF4y2Ba).不出所料,STAT5A的下调也抑制了TH9细胞(图5)。gydF4y2Ba5 c, dgydF4y2Ba).与小鼠CD4一致gydF4y2Ba+gydF4y2Ba在T细胞中,p-p38与特定抑制剂的阻断也减少了pSTAT5和DBP的数量,但增加了E2F8蛋白的数量。gydF4y2Ba5 egydF4y2Ba),从而导致人类CD4细胞中IL-9的产生下调gydF4y2Ba+gydF4y2BaTGF-β和IL-4处理的T细胞。gydF4y2Ba5 fgydF4y2Ba).数据表明,DBP和E2F8也需要增强和抑制gydF4y2BaIl9gydF4y2Ba在人类T细胞中的基因表达。gydF4y2Ba
一个gydF4y2Bart - pcr分析和gydF4y2BabgydF4y2Ba人CD4细胞中STAT5、DBP和E2F8的Western印迹gydF4y2Ba+gydF4y2BaT细胞与TGF-β + IL-4培养5天。gydF4y2BacgydF4y2Ba的表达gydF4y2BaIl9gydF4y2Ba3天后mRNA和gydF4y2BadgydF4y2Ba人CD4细胞5天后IL-9的ELISA测定gydF4y2Ba+gydF4y2Ba转染的T细胞gydF4y2BaSTAT5AgydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba或gydF4y2BaE2F8gydF4y2Ba然后用TGF-β + IL-4刺激。gydF4y2BaegydF4y2BaSTAT5, DBP, E2F8和gydF4y2BafgydF4y2BaELISA法检测人CD4细胞中IL-9蛋白gydF4y2Ba+gydF4y2BaT细胞与TGF-β + IL-4联合或不联合p38抑制剂培养5天。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba这些数据代表了四个独立的实验或gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba三个实验。这些数据由gydF4y2Ba一个gydF4y2Ba双尾未配对的学生的gydF4y2BatgydF4y2Ba以及或gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba单因素方差分析与Tukey 's检验。图显示均值±SEM。源数据作为源数据文件提供。gydF4y2Ba
DBP和E2F8在th9介导的小鼠抗肿瘤反应中的相反作用gydF4y2Ba
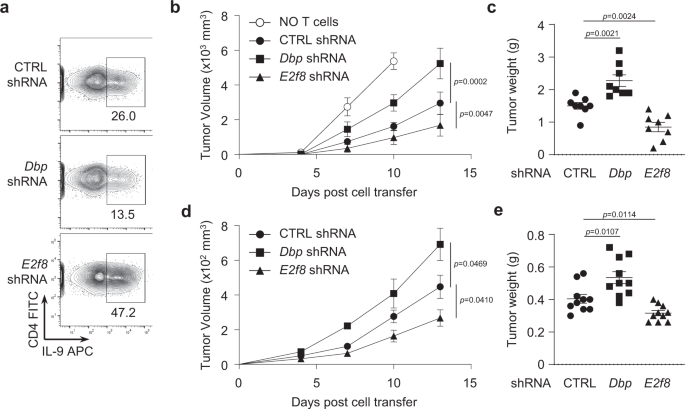
在体外建立了DBP和E2F8在Th9细胞分化中的相反作用后,我们下一步确定了DBP和E2F8在体内Th9细胞介导的抗肿瘤活性中的作用。由于Th9细胞已被充分证明可以抑制肿瘤生长gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,我们首先利用黑色素瘤小鼠实验模型gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba小鼠注射B16F10黑素瘤细胞,Th9细胞过继转移治疗gydF4y2Ba9gydF4y2Ba.天真的CD4gydF4y2Ba+gydF4y2BaT细胞通过基因工程进行敲除gydF4y2Ba菲律宾gydF4y2Ba或gydF4y2BaE2f8gydF4y2Ba逆转录病毒转染其特异性shRNAs;对照组shRNA作为转染对照。这些基因工程T细胞随后被TGF-β和IL-4刺激以诱导Th9细胞(图。gydF4y2Ba6gydF4y2Ba).与我们前面所展示的一致(图。gydF4y2Ba4 gydF4y2Ba),我们找到了击倒gydF4y2Ba菲律宾gydF4y2Ba减少,和减少gydF4y2BaE2f8gydF4y2Ba增加,Th9细胞分化(图;gydF4y2Ba6gydF4y2Ba).然后我们过继地将这些工程T细胞转移到gydF4y2BaRag1gydF4y2Ba- / -gydF4y2Ba先静脉注射受体小鼠,再皮下注射B16黑色素瘤细胞到同一小鼠体内。与我们之前的报告一致gydF4y2Ba9gydF4y2Ba,未转移T细胞的小鼠始终表现出肿瘤的侵袭性生长(图。gydF4y2Ba6 bgydF4y2Ba),而用转染对照shRNA的T细胞治疗小鼠,产生正常的Th9细胞,显著减少肿瘤生长(图。gydF4y2Ba6 bgydF4y2Ba).然而,令人惊讶的是,接受了gydF4y2Ba菲律宾gydF4y2Bashrna工程T细胞降低IL-9(图。gydF4y2Ba6gydF4y2Ba)清除肿瘤的效果低于正常Th9细胞(图。gydF4y2Ba6 bgydF4y2Ba),而接受治疗的小鼠gydF4y2BaE2f8gydF4y2Bashrna工程T细胞增加IL-9(图。gydF4y2Ba6gydF4y2Ba)与接受对照shRNA处理的T细胞的小鼠相比,肿瘤生长明显减慢。gydF4y2Ba6 bgydF4y2Ba).与生长曲线一致,在实验结束时对肿瘤重量的分析表明,治疗T细胞缺乏的荷瘤小鼠gydF4y2Ba菲律宾gydF4y2Ba显著增加了肿瘤的重量,但是T细胞缺乏的荷瘤小鼠治疗gydF4y2BaE2f8gydF4y2Ba肿瘤重量明显降低(图。gydF4y2Ba6摄氏度gydF4y2Ba).从肿瘤组织、引流淋巴结和脾脏分离的T细胞分析显示,产生IFN-γ-和tnf α-的Th1细胞、产生il -4的Th2细胞、产生il -17的Th17细胞或Foxp3的频率没有变化gydF4y2Ba+gydF4y2Ba各组小鼠的treg(补充图。gydF4y2Ba7 a egydF4y2Ba),表明抗肿瘤作用主要是由于注入的Th9细胞,而不是其他T细胞亚群。gydF4y2Ba
一个gydF4y2BaCD4产生的IL-9细胞内染色gydF4y2Ba+gydF4y2Ba转染shRNA后转染T细胞gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba老鼠。8周大的男性和女性肿瘤随时间的增长gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba小鼠静脉注射CTRL,gydF4y2Ba菲律宾gydF4y2Ba或gydF4y2BaE2f8gydF4y2BashRNA CD4细胞治疗gydF4y2Ba+gydF4y2Ba同时皮下注射gydF4y2BabgydF4y2BaB16黑色素瘤细胞(男性:gydF4y2BangydF4y2Ba= 5名女性:gydF4y2BangydF4y2Ba=每组3只老鼠)或gydF4y2BadgydF4y2BaMCA205纤维肉瘤细胞(男性:gydF4y2BangydF4y2Ba= 5名女性:gydF4y2BangydF4y2Ba= 5只/组)。gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba实验结束时肿瘤重量从gydF4y2BabgydF4y2Ba而且gydF4y2BadgydF4y2Ba.这些数据采用双尾未配对Student 's分析gydF4y2BatgydF4y2Ba以及。这些数据代表了两个独立的实验。图显示均值±SEM。源数据作为源数据文件提供。gydF4y2Ba
DBP和E2F8对Th9细胞同样的抗肿瘤和促肿瘤作用在另一个MCA205纤维肉瘤实验模型中得到验证。携带和接受纤维肉瘤的小鼠gydF4y2Ba菲律宾gydF4y2Bashrna工程T细胞在消除肿瘤方面的效果低于正常的Th9细胞注射小鼠。gydF4y2Ba6 dgydF4y2Ba)和更大的肿瘤大小和增加的重量(图。gydF4y2Ba6 egydF4y2Ba),而接受对照shrna处理的T细胞的小鼠gydF4y2BaE2f8gydF4y2Bashrna工程T细胞显示肿瘤生长明显减慢(图。gydF4y2Ba6 dgydF4y2Ba)和减轻体重gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba6 egydF4y2Ba)gydF4y2Ba与接受对照shrna处理的T细胞的小鼠相比。从所有小鼠分离的瘤内T细胞分析显示,Th1、Th17和treg的数量相似(补充图。gydF4y2Ba7 f jgydF4y2Ba),正如在黑色素瘤模型中所见。然而,有趣的是,我们注意到小鼠的肿瘤内T细胞gydF4y2Ba菲律宾gydF4y2Ba-敲除Th9细胞表现出轻微但有统计学意义的IL-4产量下降,但小鼠的肿瘤内T细胞gydF4y2BaE2f8gydF4y2Ba与对照组T细胞处理的小鼠相比,-knockdown Th9细胞显示IL-4分泌增加(补充图gydF4y2Ba7小时gydF4y2Ba),尽管这一观察的机制和功能意义尚不清楚。gydF4y2Ba
从体外观察,接受gydF4y2BaStat5agydF4y2Bashrna工程T细胞也表现出明显更快的肿瘤生长(补充图。gydF4y2Ba8 a、bgydF4y2Ba),表明Stat5确实在th9介导的抗肿瘤活性中也起着重要作用。我们还在MCA205纤维肉瘤模型中研究了IL-9是否影响体内抗肿瘤治疗效果,我们发现IL-9与抗IL-9抗体的中和作用确实取消了抗肿瘤治疗效果gydF4y2BaE2f8gydF4y2Ba-knockdown Th9细胞gydF4y2Ba8 c, dgydF4y2Ba).重要的是,廉价的gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba在CD4基因gydF4y2Ba+gydF4y2BaT细胞抑制和促进gydF4y2BaGranzyme bgydF4y2Ba,分别在体外Th9细胞中(补充图gydF4y2Ba8 egydF4y2Ba)和颗粒酶B中也有gydF4y2Ba+gydF4y2BaT细胞在荷瘤小鼠体内的表达(补充图。gydF4y2Ba8 fgydF4y2Ba).这些数据共同揭示了DBP和E2F8在体内癌症免疫治疗中调节Th9细胞的相反活性。gydF4y2Ba
讨论gydF4y2Ba
Th9细胞是CD4的一个新近发现的亚群gydF4y2Ba+gydF4y2BaT效应细胞参与过敏、哮喘的发病机制,在抗肿瘤免疫中发挥重要作用gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba11gydF4y2Ba.在这篇论文中,我们发现转录因子DBP和E2F8分别是关键的激活因子和抑制因子gydF4y2BaIl9gydF4y2Ba这些转录因子均由磷酸化的Smad3连接区Ser控制gydF4y2Ba213gydF4y2Ba(pSmad3L-SergydF4y2Ba213gydF4y2Ba)在Th9分化过程中TGF-β和IL-4信号的下游。gydF4y2Ba
从这些发现中可以得出几个前所未有的结论。首先,Smad3L-Ser的磷酸化和激活gydF4y2Ba213gydF4y2Ba而不是Smad3 c端gydF4y2BaIl9gydF4y2Ba基因在Th9细胞中的表达。支持这一结论的是几行实验证据。在早期时间点(1 h),只有pSmad3L-SergydF4y2Ba213gydF4y2Ba而pSmad3C和pSmad3L-Thr则没有gydF4y2Ba179gydF4y2Ba,与单独TGF-β相比,TGF-β联合IL-4治疗显著上调;与TGF-β处理的细胞相比,TGF-β + IL-4处理的T细胞中pSmad3C实际上是降低的。通过2 h, pSmad3L-SergydF4y2Ba213gydF4y2Ba持续增加,是Smad3三个磷酸化位点中对TGF-β和IL-4响应最高的。虽然链接器区域(站点SergydF4y2Ba213gydF4y2Ba和刺gydF4y2Ba179gydF4y2Ba), Smad3的c端可被TGF-β + IL-4信号通路磷酸化,仅抑制pSmad3L-SergydF4y2Ba213gydF4y2Ba通过p38抑制剂或Ser突变gydF4y2Ba213年,一个gydF4y2Ba,两者都不影响pSmad3C的水平,阻碍诱导gydF4y2BaIl9gydF4y2BaCD4基因表达gydF4y2Ba+gydF4y2BaT细胞。此外,Smad3连接区其他位点的磷酸化,如Smad3L-ThrgydF4y2Ba179gydF4y2Ba,不需要gydF4y2BaIl9gydF4y2Ba阻断Smad3L-Thr的磷酸化gydF4y2Ba179gydF4y2Ba与ERK和JNK特异性抑制剂,不改变pSmad3L-SergydF4y2Ba213gydF4y2Ba并不能改变Th9细胞的生成。pSmad3L-Ser的关键作用gydF4y2Ba213gydF4y2Ba在gydF4y2BaIl9gydF4y2BaSer突变进一步证实了该基因的诱导作用gydF4y2Ba213年,一个gydF4y2Ba导致几乎完全的废弃gydF4y2BaIl9gydF4y2BaSmad3基因连接区(EPSM)所有位点的突变可以看出基因诱导。此外,pSmad3L-SergydF4y2Ba213gydF4y2Ba对控制DBP和E2F8的表达是必不可少的,它们直接与gydF4y2Ba伊尔gydF4y2Ba9基因,分别激活和抑制gydF4y2BaIl9gydF4y2Ba基因转录,为建立pSmad3L-Ser提供了明确的证据gydF4y2Ba213gydF4y2Ba作为连接TGF-β和IL-4信号转导到Th9生成的关键因素。最后,由于Smad3 c -末端的突变无法消除Smad3C的磷酸化,所以排除了pSmad3C在Th9细胞分化中的作用gydF4y2BaIl9gydF4y2BaCD4基因表达gydF4y2Ba+gydF4y2BaT细胞对TGF-β和IL-4的反应。发现了pSmad3L-Ser的关键作用gydF4y2Ba213gydF4y2Ba而不是pSmad3C ingydF4y2BaIl9gydF4y2Ba基因表达是出乎意料的,因为目前发表的所有研究都只关注Smad3/2的c端(pSmad3C和/或pSmad2C)的激活,可被TGF-β和IL-4信号激活,pSmad3C被认为是Smad3参与Th9细胞分化的证据。因此,目前还没有关于Smad3连接子区域在Th9细胞分化中的作用的文章。这一发现也具有重要意义,因为这是第一个证明Smad3连接子区域而不是pSmad3C在Th9细胞分化中是必要和充分的证据。这一发现与我们观察到的pSmad3C可以通过TGF-β受体I直接被TGF-β信号激活,而TGF-β受体I对Foxp3的产生至关重要的结果是一致的gydF4y2Ba+gydF4y2Ba亚群和RORγtgydF4y2Ba+gydF4y2BaTh17细胞gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,但Smad3的连接区也可以被丝裂原诱导的途径激活,包括炎症细胞因子和因子gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba46gydF4y2Ba除了TGF-β信号,如这里的IL-4和TGF-β。需要注意的是,pSmad3L-Ser的要求gydF4y2Ba213gydF4y2Ba似乎与IL-4 + TGF-β信号通路诱导的IL-9产生有关,如IL-6 + TGF-β信号通路,也可诱导T细胞中的一些IL-9gydF4y2Ba37gydF4y2Ba,不需要pSmad3L-SergydF4y2Ba213gydF4y2Ba参与。这些发现为阐明Smad3连接子区域参与其他T细胞亚群分化的确切分子机制铺平了道路。gydF4y2Ba
其次,MAPK p38是磷酸化和激活pSmad3L-Ser的关键gydF4y2Ba213gydF4y2Ba在介导TGF-β和IL-4刺激下游信号传导中的作用。在寻找能够激发Smad3连接区磷酸化的上游激活因子时,我们将重点放在ERK、JNK和p38上,它们已被充分证明能够调节Smad3连接区磷酸化,以应对TGF-β信号存在或不存在的不同刺激gydF4y2Ba21gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.例如,有报道称EGF诱导Smad3L在苏氨酸磷酸化gydF4y2Ba179gydF4y2Ba先生,gydF4y2Ba204gydF4y2Ba和爵士gydF4y2Ba208gydF4y2Ba通过ERKgydF4y2Ba47gydF4y2Ba,而周期蛋白依赖性激酶(CDK)可以磷酸化Smad3的所有四个连接位点,包括SergydF4y2Ba213gydF4y2Ba,在上皮细胞中gydF4y2Ba48gydF4y2Ba.虽然TGF-β也诱导Smad3L-Thr磷酸化gydF4y2Ba179gydF4y2Ba先生,gydF4y2Ba204gydF4y2Ba先生,gydF4y2Ba208gydF4y2Ba,但爵士没有gydF4y2Ba213gydF4y2Ba, TGF-β诱导的Smad3L磷酸化需要CDK而不是ERK活性gydF4y2Ba35gydF4y2Ba.在这项研究中,我们已经证明了CD4gydF4y2Ba+gydF4y2BaTGF-β和IL-4的联合作用,而不是单独作用,诱导JNK, ERK和p38的快速和最佳磷酸化,早在15-30分钟出现,在刺激后1小时达到峰值。然而,尽管三种mapk都被磷酸化,但只有p-p38被阻断,而p-ERK和p-JNK被其特异性抑制剂抑制gydF4y2BaIl9gydF4y2BaTGF-β和IL-4诱导的基因表达。这是因为抑制p-ERK和p-JNK只抑制了Smad3L-Thr的磷酸化gydF4y2Ba179gydF4y2Ba,但没有Smad3L-SergydF4y2Ba213gydF4y2Ba,从而消除了他们作为关键因素gydF4y2BaIl9gydF4y2Ba基因的表达。相反,用其特异性抑制剂阻断p38磷酸化会抑制pSmad3L-SergydF4y2Ba213gydF4y2Ba虽然它也抑制pSmad3L-ThrgydF4y2Ba179gydF4y2Ba.因此,研究结果确定了p38在促进中的关键作用gydF4y2BaIl9gydF4y2Ba基因通过pSmad3L-Ser转录gydF4y2Ba213gydF4y2Ba在Th9分化。值得注意的是,我们还排除了Stat6在p-p38/Smad3L-Ser级联中的主要作用gydF4y2Ba213gydF4y2Ba在gydF4y2BaIl9gydF4y2Ba因为p-p38的阻断不会显著改变T细胞中pStat6的数量。然而,这一发现并不排除Stat6通过其他途径在IL-9产生中发挥作用gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba41gydF4y2Ba.gydF4y2Ba
显著的是,昼夜DBP激活,E2F家族成员E2F8抑制,gydF4y2BaIl9gydF4y2BaTh9分化过程中的基因转录。最近,有报道称DBP可能参与了黏膜ilc3衍生的IL-22的产生,尽管其潜在的分子机制尚不清楚gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.通过在CD4中使用非偏置和全局DNA-seq和RNA-seq分析gydF4y2Ba+gydF4y2BaTGF-β和IL-4刺激的T细胞与单独TCR刺激的正常T细胞相比gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2BaCD4gydF4y2Ba+gydF4y2BaT细胞,我们已经确定了gydF4y2Ba菲律宾gydF4y2Ba是调节和gydF4y2BaE2f8gydF4y2Ba正常CD4细胞下调gydF4y2Ba+gydF4y2BaTh9细胞分化过程中的T细胞。此外,Stat5a在Th9细胞中也有所增加,这与之前的报道一致gydF4y2Ba41gydF4y2Ba,所以我们在论文中使用Stat5作为阳性对照。此外,Stat5的激活也参与了促进gydF4y2BaFoxp3gydF4y2Ba表达对TGF-β和IL-2的响应gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba因此,Stat5不是Th9分化的特异性诱导因子。的增加gydF4y2Ba菲律宾gydF4y2Ba和减少gydF4y2BaE2f8gydF4y2BaTGF-β和IL-4诱导的mRNA已通过实时定量PCR验证。在蛋白水平上,TGF-β和IL-4刺激T细胞的DBP显著增加,E2F8显著降低。值得注意的是,DBP和E2F8的变化完全依赖于TGF-β信号通路gydF4y2BaTgfbr1gydF4y2Ba−−/gydF4y2Ba在TGF-β + IL-4信号的作用下,T细胞的DBP上调和E2F8下调完全失效。这种TGF-β + IL-4信号介导的DBP增加和E2F8减少也发生在Tc9中IL-9的产生过程中,表明这两个转录因子在Tc9中具有一般功能gydF4y2BaIl9gydF4y2Ba基因的表达。我们发现Th9细胞的舒张压最高,尽管treg细胞的舒张压也有所增加。有趣而重要的是,E2F8的抑制只在Th9细胞中发现,这表明它在Th9细胞分化中更特异性。进一步的机制研究表明,DBP和E2F8之间的变化是由p-p38-pSmad3L-Ser介导的gydF4y2Ba213gydF4y2Ba如p-p38活性的阻断或Smad3L-Ser的突变gydF4y2Ba213年,一个gydF4y2Ba消除了TGF-β和IL-4诱导的T细胞DBP上调和E2F8下调。研究发现Smad3直接与启动子结合gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaStat5agydF4y2BaChIP检测的基因提供了pSmad3L-Ser之间直接相互作用的证据gydF4y2Ba213gydF4y2Ba和两个正转录因子。有趣的是,缺乏Smad3直接绑定到gydF4y2BaE2f8gydF4y2Ba启动子表明Smad3可以结合在其他位点,如增强子gydF4y2BaE2f8gydF4y2Ba基因还是可以调节的gydF4y2BaE2f8gydF4y2Ba间接通过其他转录因子,这是一个有待进一步阐明的迷人问题。gydF4y2Ba
ChIP分析还发现了DBP和E2F8上下游的多个结合域gydF4y2BaIl9gydF4y2Ba这两个转录因子和Stat5a都可以直接与启动子结合。重要的是,TGF-β和IL-4处理增强了DBP和Stat5a的结合,但消除了E2F8在gydF4y2BaIl9gydF4y2Ba启动子。最后,功能缺失法和功能获得法分别证实了DBP和E2F8对Th9分化的激活和抑制作用。直接和急性击倒gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaStat5agydF4y2Ba与它们的特异性shrna显著减少IL-9的产生,而敲除gydF4y2BaE2f8gydF4y2Ba极大地增加gydF4y2BaIl9gydF4y2Ba基因的表达。相反,过度的gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaStat5gydF4y2Ba在T细胞中显著增加,但过表达gydF4y2BaE2f8gydF4y2Ba抑制Th9细胞分化。gydF4y2Ba
最近有报道IL-4联合IL-1β也能在TGF-β信号缺失的情况下激活Th9分化gydF4y2Ba54gydF4y2Ba.本研究提示IL-1β/IL-4诱导IL-9表达需要NF-κB信号,而不需要TGF-β信号。IL-1β可诱导TAK1和NF-κB活化gydF4y2Ba55gydF4y2Ba这对IL-9的表达也是至关重要的gydF4y2Ba9gydF4y2Ba因此,IL-lβ可能跳过TGF-β信号直接激活TAK1-NF-κB通路gydF4y2BaIl9gydF4y2Ba基因的表达。虽然尚待阐明,但不太可能是IL-1β/ il -4诱导的gydF4y2BaIl9gydF4y2Ba基因表达涉及DBP和E2F8通路,因为这两个转录因子都需要TGF-β-pSmad3L-SergydF4y2Ba213gydF4y2Ba信号。gydF4y2Ba
最后重要的是,DBP和E2F8在Th9细胞中相反的调控作用有助于体内肿瘤中Th9介导的抗肿瘤免疫,也在人Th9分化中发挥重要作用。支持这一结论的是在两个独立的小鼠黑素瘤和纤维肉瘤实验模型中得到的结果。减少gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba表达CD4gydF4y2Ba+gydF4y2BaT细胞分别减少和增加IL-9的产生,这种减少和增加分别促进和抑制肿瘤生长时,基因工程CD4gydF4y2Ba+gydF4y2BaT细胞被过继转移到gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba患有黑色素瘤和纤维肉瘤的小鼠。不出所料,Th9细胞中的Stat5在体内也具有抗肿瘤作用。有趣的是,与对照组Th9细胞治疗的肿瘤小鼠相比,Th9细胞抑制p38对肿瘤生长没有显示出显著的影响,尽管有无可争辩的证据表明,体外p38抑制显著抑制了Th9分化。其潜在机制尚不清楚,但这可能是因为p38有许多其他下游靶点,也影响T细胞在体内的其他行为。肿瘤免疫治疗效果的差异归因于Th9细胞的变化gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2Ba基因敲除,因为对肿瘤浸润淋巴细胞(TIL)的分析显示,两组之间的其他T细胞亚群(如Th1、Th2、Th17或Treg细胞)没有差异。正如所料,与以前的报告一致gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba43gydF4y2Ba, IL-9gydF4y2Ba+gydF4y2Ba从注射了Th9细胞的小鼠中获得的til中几乎检测不到T细胞,这表明该亚群具有动态和可能不稳定的特征gydF4y2Ba56gydF4y2Ba.然而,转移的Th9细胞的抗肿瘤作用确实依赖于IL-9,因为IL-9在治疗小鼠体内的中和会废除注射的Th9细胞的抗肿瘤功能gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.有研究表明,Th9细胞通过分泌颗粒酶B和其他因子对癌细胞启动或煽动一个破坏程序gydF4y2Ba11gydF4y2Ba.我们发现,在体外和体内,Th9细胞中的DBP和E2F8分别增强和抑制Granzyme B的表达,但对其他抗肿瘤细胞因子如IL-3、IL-10和IL-21没有显著影响。此外,还发现Th9可能通过激活CD8等其他细胞间接参与抗肿瘤免疫gydF4y2Ba+gydF4y2BaT细胞,肥大细胞,NK细胞,ilc2以及通过招募dcgydF4y2Ba57gydF4y2Ba.肿瘤组织中肥大细胞和树突状细胞未见明显变化gydF4y2Ba菲律宾gydF4y2Ba——或者gydF4y2BaE2f8gydF4y2Ba-敲除Th9细胞治疗肿瘤小鼠。这说明Th9细胞中的DBP和E2F8可能通过调控Granzyme B发挥抗肿瘤功能gydF4y2Ba43gydF4y2Ba,gydF4y2Ba58gydF4y2Ba.Th9细胞是否可以转化为其他效应细胞,或教育和扩大其他免疫效应T细胞,从而具有肿瘤抑制功能,这仍然是一个令人着迷的问题gydF4y2Ba56gydF4y2Ba以及th9细胞介导的抑制和/或杀死肿瘤细胞的确切执行分子机制。需要指出的是,Th9细胞中的DBP和E2F8在其他Th9相关疾病(如过敏和哮喘)的发病机制中所起的作用尚不清楚,有待进一步研究。在TGF-β + IL-4刺激下,人DBP和E2F8也分别上调和下调,并对人TH9分化起到增强和抑制作用,这一发现为研究TH9介导的疾病和人类患者的肿瘤免疫治疗揭示了以前未认识的靶点。gydF4y2Ba
总之,我们发现了pSmad3L-Ser磷酸化之前未被认识的关键作用gydF4y2Ba213gydF4y2Ba在Th9分化过程中控制两个新发现的转录因子DBP和E2F8的表达和功能,特异性地响应TGF-β和IL-4信号。在黑色素瘤和纤维肉瘤的实验模型中,DBP和E2F8在Th9细胞中分别作为增强子和抑制子的相反功能有助于Th9介导的抗肿瘤作用,并提示它们在癌症免疫治疗中的生物学意义。DBP和E2F8的相反功能已经在人类TH9细胞中被复制和证实,为发展TH9细胞介导的人类癌症免疫治疗提供了潜在的临床靶点。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
公、母C57BL/6小鼠(#000664),gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba老鼠(# 034159)gydF4y2BaErt2-cregydF4y2Ba+gydF4y2Ba老鼠(# 008463)gydF4y2BaCd4-cregydF4y2Ba+gydF4y2Ba小鼠(#022071)来自杰克逊实验室。的一代gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2Ba老鼠被描述为gydF4y2Ba59gydF4y2Ba.gydF4y2BaSmad3gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba33gydF4y2Ba,gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2BaCd4gydF4y2Ba-gydF4y2BacregydF4y2Ba+gydF4y2Ba老鼠gydF4y2Ba60gydF4y2Ba而且gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2BaErt2-cregydF4y2Ba+gydF4y2Ba老鼠gydF4y2Ba61gydF4y2Ba(在C57BL/6背景下)在国家口腔和颅面研究所的动物设施中在特定的无病原体条件下繁殖。gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2BaErt2-cregydF4y2Ba+gydF4y2Ba在室内通过杂交产生小鼠gydF4y2BaErt2gydF4y2BacregydF4y2Ba+gydF4y2Ba老鼠gydF4y2BaTgfbr1gydF4y2Ba/ fgydF4y2Ba小鼠每日给予他莫昔芬(1 mg/只),连续5天清除TβRI。所有实验均采用8 ~ 10周龄的雌雄小鼠进行。所有小鼠在相同条件下共育,光照/黑暗循环12小时,温度(23±3℃)和湿度(40-60)控制的房间。所有的动物研究都是根据美国国家卫生研究院活体动物使用和护理指南进行的,并得到了美国国家牙科和颅面研究所动物护理和使用委员会的批准。gydF4y2Ba
抗体,试剂和质粒gydF4y2Ba
以下抗体用于流式细胞术(补充表gydF4y2Ba1克ydF4y2Ba)gydF4y2Ba:荧光标记抗小鼠CD3 (17A2) AF780 APC、抗小鼠CD3 (OKT3) APC-eFluor450、抗小鼠CD4 (RM4-5) PerCP、抗人CD4 (RPA-T4) FITC、抗小鼠CD8a (53-6.7) FITC、抗小鼠IL-10 (JES5-16E3) FITC、抗小鼠IL-13 (eBio13A) PE、抗小鼠IL-17 (eBio17B7) PE/Cyanine7、抗小鼠IFN-γ (XMG1.2) eFluor450、抗小鼠IL-4 (11B11) PE、抗小鼠Foxp3 (fjt -16s)太平洋蓝、抗小鼠颗粒酶B (NGZB) APC和同型匹配对照抗体(大鼠免疫球蛋白G1 (IgG1) κ-chain (R3-34)、大鼠IgG2a (R35-95)和大鼠IgG2b (A95-1))来自eBioscience。荧光标记抗小鼠IL-9 (RM9A4) APC、抗人IL-9 (MH9A4) PE、抗小鼠TNF (MP6-XT22) FITC和抗小鼠IL-4 (11B11) PE/Cyanine7来自BioLegend。活/死可固定死细胞染色试剂盒从Invitrogen公司购买。Western blotting抗体来自以下来源(补充表gydF4y2Ba1克ydF4y2Ba)gydF4y2Ba: Phosphor-Smad3L-ThrgydF4y2Ba179gydF4y2Ba(ab74062) phosphor-Smad3L-SergydF4y2Ba213gydF4y2Ba(ab63403)、phospp -Smad3 C-ter (ab52903)、Smad3 (ab75512)、Dbp (ab227591)和E2f8 (ab109596)均来自Abcam。phospp - jnk (4668), total-JNK (9252), phospp - erk1 /2 (9101), total-ERK (9102), phospp -p38 (9211), total-p38 (9212), phospp - stat5 (9351), total-Stat5 (94205), total-Stat6 (9362), GAPDH(5174),以及辣根过氧化物酶偶联抗兔IgG(7074)和抗小鼠IgG(7076)来自细胞信号技术公司。phospp - stat6来自圣克鲁斯(sc-11762)。重组小鼠IL-4 (404-ML),小鼠IL-12 (419-ML),小鼠IL-6 (406-ML),小鼠IL-2 (402-ML),人IL-4 (204-IL)和人TGF-β1 (240-B)来自研发系统。在指示实验中,MEK/ERK抑制剂U0126 (Promega)、JNK抑制剂II SP600125 (Calbiochem)和p38抑制剂SB203580 (Promega)在10 μM下使用。gydF4y2Ba
小鼠和人原代T细胞的分离和培养gydF4y2Ba
分离小鼠脾脏和淋巴结,用ACK缓冲液去除红细胞。天真的CD4gydF4y2Ba+gydF4y2BaCD62LgydF4y2Ba+gydF4y2Ba细胞或CD8gydF4y2Ba+gydF4y2Ba细胞经MACS磁珠细胞分选(Miltenyi Biotec)纯化,37°C培养,密度为1 × 10gydF4y2Ba6gydF4y2Ba在TGF-β1 (2 ng/ml)和IL-4 (10 ng/ml)的存在下,24孔板内结合抗小鼠CD3 (1 μg/ml)和可溶性抗小鼠CD28 (1 μg/ml)的细胞。由健康志愿者提供的人外周血单个核细胞(pmcs)通过其批准的协议号NCT000001846从美国国立卫生研究院输血医学系(DTM)获得。天真的CD4gydF4y2Ba+gydF4y2Ba按照手册中的说明,使用人类Naïve T细胞分离试剂盒(Miltenyi Biotec)纯化T细胞。分离的细胞用平板结合抗人CD3 (1 μg/ml)和可溶性抗人CD28 (1 μg/ml)培养。3天后,用TGF-β1 (2 ng/ml)和IL-4 (10 ng/ml)联合孵育细胞。gydF4y2Ba
实时rt - pcrgydF4y2Ba
用RNeasy Mini试剂盒(Qiagen)从培养的细胞中提取总RNA,用高容量cDNA逆转录试剂盒(Applied Biosystems)合成cDNA。根据TaqMan基因表达主控mix (Applied Biosystems)的协议,使用QuantStudio 3 real-time PCR Systems (Applied Biosystems)进行实时定量PCR,引物如下:小鼠gydF4y2BaIl9gydF4y2Ba(Mm00434305),鼠标gydF4y2BaStat5agydF4y2Ba(Mm00839861),鼠标gydF4y2Ba菲律宾gydF4y2Ba(Mm00497539),鼠标gydF4y2BaE2f8gydF4y2Ba(Mm01204160),鼠标gydF4y2BaGrzmbgydF4y2Ba(Mm00442837),鼠标gydF4y2Ba产生HprtgydF4y2Ba(Mm00446968)人gydF4y2BaIL9gydF4y2Ba(Hs00914237)人gydF4y2BaSTAT5AgydF4y2Ba(Hs00559643)人gydF4y2Ba菲律宾gydF4y2Ba(Hs00609747)人gydF4y2BaE2F8gydF4y2Ba(Hs00226635)和人类gydF4y2BaACTBgydF4y2Ba(Hs99999903)。结果归一化为gydF4y2Ba产生HprtgydF4y2Ba或gydF4y2BaACTBgydF4y2Ba信使rna。所有数据用2量化gydF4y2Ba−ΔΔCTgydF4y2Ba方法。gydF4y2Ba
rna介导的干扰和过表达gydF4y2Ba
对于sirna介导的敲除,细胞转染人gydF4y2BaSTAT5AgydF4y2Ba-,gydF4y2Ba菲律宾gydF4y2Ba- - -gydF4y2BaE2F8gydF4y2Ba使用Lipofectamine RNAiMAX (Invitrogen)作用24小时。Mouse的构造gydF4y2BaStat5agydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba而且gydF4y2BaE2f8gydF4y2BapGFP-V-RS质粒中的短发夹RNA (shRNA)表达载体购自Origene。超表达,pCMV6 -gydF4y2BaStat5agydF4y2Ba(Origene) pPM-C-HA -gydF4y2Ba菲律宾gydF4y2Ba(Abcam)和Myc-DDK-taggedgydF4y2BaE2f8gydF4y2Ba(Origene)。按照制造商的说明使用QIAGEN质粒试剂盒(QIAGEN)分离所有质粒dna。gydF4y2Ba
SMAD3结构与连接子区域突变gydF4y2Ba
FLAG-tagged Smad3野生型、S213A、EPSM和ΔSSVS的质粒由Ying E. Zhang博士(NCI, NIH)提供。在逆转录病毒pLPCX载体中,这些质粒是由编码FLAG-tagged Smad3的pCMV5B的cDNA片段亚克隆而成gydF4y2Ba62gydF4y2Ba.扩增DNA片段,亚克隆到pMSCV-IRES-GFP逆转录病毒载体中gydF4y2BaXhogydF4y2Ba我和gydF4y2BaEcoRgydF4y2BaI限制酶位点。gydF4y2Ba
转染gydF4y2Ba
人胚胎肾(HEK) 293 T细胞从ATCC购买并作为冷冻库存保存。转染HEK 293 T细胞(2 × 10gydF4y2Ba6gydF4y2Ba)在10厘米的试管中培养gydF4y2Ba2gydF4y2Ba直径细胞培养盘过夜,并使用TurboFect转染试剂(Thermo Scientific)瞬时转染特异性靶载体和pCL-ECO包装载体(Addgene)。转染48 h后,收集含有病毒的培养上清。利用这些病毒上清液,用5 μg/ml的聚苯醚感染T细胞。然后除去转染培养基,T细胞在完全细胞培养基中再培养48小时。gydF4y2Ba
流式细胞术gydF4y2Ba
细胞用不同表面分子特异性的抗体染色,根据制造商的协议(eBioscience),用固定/渗透缓冲溶液固定和渗透。细胞内细胞因子染色:用PMA (phorbol 12-肉豆蔻酸13-acetate;10 ng/ml)、离子霉素(1 μg/ml)、GolgiPlug(1:10 000稀释);BD Pharmingen),然后根据制造商的协议(BD Bioscience)用固定/渗透缓冲溶液染色。细胞在FACS缓冲液(0.5% BSA和0.1% NaN)中培养gydF4y2Ba3.gydF4y2Ba用荧光标记抗体(全部稀释1:100)在冰上浸泡30分钟。染色细胞在FACS Fortessa (BD Bioscience)上分析,FlowJo软件v 10.7.1。gydF4y2Ba
免疫印迹分析gydF4y2Ba
用RIPA裂解缓冲液提取蛋白样品。用SDS-PAGE分离并转移到聚偏二氟乙烯(PVDF)膜(millipore)上。用5%脱脂牛奶在TBST中(0.5 M NaCl, Tris-HCl, pH 7.5和0.5% t吐温-20)在室温下阻塞膜1小时,然后分别与TBST中5% BSA中的一抗(所有抗体的稀释比例为1:1000)孵育一夜,4℃。用TBST缓冲液冲洗膜,然后与辣根过氧化物酶偶联二抗体(1:2000稀释)孵育1 h。根据制造商的协议,使用Amersham Imager 600 (Cytiva)增强化学发光对结果进行可视化。gydF4y2Ba
ELISAgydF4y2Ba
进行IL-9细胞因子测定时,在72小时后收集细胞培养上清。细胞因子的定量使用IL-9 ELISA试剂盒(BioLegend)根据制造商的协议。gydF4y2Ba
DNA-Seq化验gydF4y2Ba
用1%甲醛在室温下交联10分钟。在细胞中加入0.3单位的DNase I (Roche), 37°C孵育5分钟。加入10 mM EDTA后,反应停止。使用Illumina试剂盒制备DNase-seq文库,并优先使用两步法扩增从DNA I超敏位点释放的短DNA片段。片段在E-gel SizeSelect琼脂糖凝胶(Invitrogen)上分离,文库在Illumina HiSeq 2500上测序。gydF4y2Ba
RNA-seq化验gydF4y2Ba
细胞在miRNAeasy Micro Kit (QIAGEN)中直接分选到700 μl的QIAzol裂解试剂中。提取总RNA,用DNase (QIAGEN)进行柱上消化,然后用无rnase水洗脱,然后用SuperScript II (Invitrogen)反转录。cDNA用KAPA HiFi HotStart ReadyMix (KAPA Biosystems, 2602) PCR预扩增,用Ampure XP珠(Beckman Coulter)纯化。通过Smart-seq2方法制备RNA-seq库gydF4y2Ba63gydF4y2Ba.我们对12个不同聚类进行了GO分析(补充数据)gydF4y2Ba2gydF4y2Ba)使用基因本体联盟中的生物过程范畴。颜色等级表示调整后的负对数gydF4y2BapgydF4y2Ba值(gydF4y2BapgydF4y2Ba-值0.05)表示GO术语的显著性。红色的强度代表更重要的GO项,而蓝色代表不太重要的GO项。多次试验的Benjamini和Hochberg校正。gydF4y2Ba
测序数据的处理gydF4y2Ba
使用Bowtie2将dna -seq和RNA-seq数据的读数映射到小鼠基因组(mm9)。删除MAPQ≤10或映射到相同位置和方向的冗余读。DNase-seq数据按照库的总大小进行规范化。来自DNase-seq数据的DHS被MACS称为“窄峰”。使用EdgeR (FDR < 0.01, fold-change > 1.5)计算每个基因的千碱基/百万映射reads归一化reads (rpkm)来测定基因表达水平。gydF4y2Ba
主题发现gydF4y2Ba
FIMO应用于差异dna酶超敏位点,以识别富集的基序(gydF4y2BapgydF4y2Ba值< 0.001)。gydF4y2Ba
染色质免疫沉淀(ChIP)法gydF4y2Ba
采用ChIP检测试剂盒(Diagenode)进行ChIP检测。简单地说,CD4gydF4y2Ba+gydF4y2BaT细胞以5 × 10的密度培养gydF4y2Ba6gydF4y2Ba在TGF-β1 (2ng /ml)和IL-4 (10ng /ml)存在或不存在的情况下,6孔板中每孔细胞均含有抗cd3和抗cd28。收集细胞,用1%甲醛固定,室温裂解缓冲液中裂解10min。裂解物用Bioruptor Standard (Diagenode)超声检测,然后沉淀抗smad3和对照兔IgG。每个染色质样本保留十分之一作为输入DNA对照。用SYBR绿色PCR试剂(Qiagen)实时RT-PCR分析ChIP和总输入dna,使用以下引物gydF4y2BaStat5agydF4y2Ba,gydF4y2Ba菲律宾gydF4y2Ba,gydF4y2BaE2f8gydF4y2Ba而且gydF4y2BaIl9gydF4y2Ba启动子(补充表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
肿瘤模型gydF4y2Ba
CD4gydF4y2Ba+gydF4y2Banaïve从C57BL/6小鼠中分离T细胞,与抗cd3和抗cd28培养过夜,然后对照shRNA,gydF4y2BaStat5gydF4y2Ba成分,gydF4y2Ba菲律宾gydF4y2Ba成分或gydF4y2BaE2f8gydF4y2Ba成分是补充道。48 h后,TGF-β1和IL-4继续培养3天,进行细胞转移。B16F10黑色素瘤或MCA205纤维肉瘤细胞(5 × 10gydF4y2Ba5gydF4y2Ba每只小鼠的细胞)分别在雄性和雌性小鼠的腹部侧皮下注射gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba小鼠建立荷瘤模型。同一天,培养的T细胞被转移到gydF4y2BaRag1gydF4y2Ba−−/gydF4y2Ba小鼠静脉注射(1 × 10gydF4y2Ba7gydF4y2Ba细胞/鼠标)。观察其抗肿瘤治疗效果gydF4y2BaE2f8gydF4y2Ba-敲除Th9细胞后,将注射了IgG2a同型对照或抗il -9抗体的荷瘤小鼠腹腔注射Th9细胞gydF4y2BaE2f8gydF4y2Ba-敲除的T细胞(每只小鼠100 μ g,每3天)。每隔2或3天用卡尺在两个垂直维度上测量肿瘤大小,然后用体积=(肿瘤长度x肿瘤宽度)公式计算肿瘤体积gydF4y2Ba2gydF4y2Ba) / 2。植入肿瘤细胞2周后,任意一组小鼠,当肿瘤大小达到20mm时,处死小鼠,收集组织分析肿瘤组织环境的变化。gydF4y2Ba
统计分析gydF4y2Ba
使用GraphPad软件Prism 8对数据进行分析和图形化表示。所有实验至少计算三个独立实验的均数±均数标准误差(SEM)。没有配对的双尾学生的gydF4y2BatgydF4y2Ba-test用于两独立组间均值的比较;两个或两个以上组之间的平均值比较采用单因素方差分析。如果gydF4y2BapgydF4y2Ba值< 0.05,认为差异有统计学意义。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
所有支持本研究结果的阵列数据已以登录代码保存在NCBI基因表达综合数据库中gydF4y2BaGSE182472gydF4y2Ba.作者声明,支持本研究结果的所有其他数据均可在文章及其补充信息文件中获得。gydF4y2Ba源数据gydF4y2Ba都提供了这张纸。gydF4y2Ba
参考文献gydF4y2Ba
达达尔洪,V.等人。IL-4抑制tgf - β诱导的Foxp3+ T细胞,并与tgf - β一起产生IL-9+ IL-10+ Foxp3(-)效应T细胞。gydF4y2BaImmunol Nat。gydF4y2Ba9gydF4y2Ba, 1347 - 1355(2008)。gydF4y2Ba
施密特等人。幼稚CD4+ T细胞产生IL-9依赖于IL-2,由tgf - β和IL-4联合增强,并被ifn - γ抑制。gydF4y2Baj . Immunol。gydF4y2Ba153gydF4y2Ba, 3989 - 3996(1994)。gydF4y2Ba
Veldhoen等人。转化生长因子- β“重编程”T辅助2细胞的分化,并促进产生白介素9的亚群。gydF4y2BaImmunol Nat。gydF4y2Ba9gydF4y2Ba, 1341 - 1346(2008)。gydF4y2Ba
Gomez-Rodriguez, J.等。通过tcr介导的IL-2和IRF4诱导Th9分化需要Itk。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba10857(2016)。gydF4y2Ba
斯图尔特,V.等人。干扰素调节因子4对T辅助9细胞的发育过程至关重要。gydF4y2Ba免疫力gydF4y2Ba33gydF4y2Ba, 192 - 202(2010)。gydF4y2Ba
田宫,T.等人。Smad2/3和IRF4在产生il -9的T细胞诱导中发挥协同作用。gydF4y2Baj . Immunol。gydF4y2Ba191gydF4y2Ba, 2360 - 2371(2013)。gydF4y2Ba
傅,杨,等。STAT5促进可达性,是batf介导的Il9位点可塑性所必需的。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba4882(2020)。gydF4y2Ba
卢,杨,等。Th9细胞在体内促进抗肿瘤免疫应答。gydF4y2Baj .中国。投资。gydF4y2Ba122gydF4y2Ba, 4160 - 4171(2012)。gydF4y2Ba
Nakatsukasa, H.等。dna结合抑制剂Id3调节CD4+ T细胞中IL-9的产生。gydF4y2BaImmunol Nat。gydF4y2Ba16gydF4y2Ba, 1077 - 1084(2015)。gydF4y2Ba
Th9细胞中的转录因子网络。gydF4y2BaSemin Immunopathol。gydF4y2Ba39gydF4y2Ba11日至20日(2017年)。gydF4y2Ba
产生il -9的T细胞:过敏和癌症的潜在参与者。gydF4y2Ba启Immunol Nat。gydF4y2Ba21gydF4y2Ba37-48(2021)。gydF4y2Ba
卡普兰,m.h.,赫福德,m.m. &奥尔森,m.r. T辅助9细胞的发育和在体内的功能。gydF4y2Ba启Immunol Nat。gydF4y2Ba15gydF4y2Ba, 295 - 307(2015)。gydF4y2Ba
Schmitt, E, Klein, M. & Bopp, T. Th9细胞,适应性免疫的新参与者。gydF4y2BaImmunol趋势。gydF4y2Ba35gydF4y2Ba, 61 - 68(2014)。gydF4y2Ba
陈伟等。tgf - β诱导转录因子Foxp3将外周CD4+CD25-幼稚T细胞转化为CD4+CD25+调节性T细胞gydF4y2Baj . Exp。地中海。gydF4y2Ba198gydF4y2Ba, 1875 - 1886(2003)。gydF4y2Ba
周丽娟,周丽娟。Th17细胞分化的转录调控。gydF4y2BaSemin Immunol。gydF4y2Ba19gydF4y2Ba, 409 - 417(2007)。gydF4y2Ba
金,H. S.等。PTEN通过阻止IL-2的产生来驱动Th17细胞分化。gydF4y2Baj . Exp。地中海。gydF4y2Ba214gydF4y2Ba, 3381 - 3398(2017)。gydF4y2Ba
Kuhn, C., Rezende, R. M., M 'Hamdi, H., da Cunha, A. P. & Weiner, H. L. IL-6抑制CD4+ T细胞上膜结合tgf - β 1的上调,阻断IL-6增强口服耐受性。gydF4y2Baj . Immunol。gydF4y2Ba198gydF4y2Ba, 1202 - 1209(2017)。gydF4y2Ba
崔杰等。IL-4通过hdac9介导的表观遗传调控抑制调节性T细胞分化。gydF4y2Ba细胞死亡说。gydF4y2Ba12gydF4y2Ba501(2021)。gydF4y2Ba
Smad转录因子在tgf - β - 1诱导的小鼠CD4 Th细胞选择素配体表达中的作用。gydF4y2Baj . Immunol。gydF4y2Ba197gydF4y2Ba, 2627 - 2634(2016)。gydF4y2Ba
王,A.等。前沿:Smad2和Smad4通过EZH2置换调节tgf - β介导的Il9基因表达。gydF4y2Baj . Immunol。gydF4y2Ba191gydF4y2Ba, 4908 - 4912(2013)。gydF4y2Ba
tgf β超家族成员的免疫调节。gydF4y2BaNat Immunol牧师。gydF4y2Ba16gydF4y2Ba, 723 - 740(2016)。gydF4y2Ba
Kretzschmar, M.和Massague, J. SMADs: tgf - β信号的中介和调节。gydF4y2BaCurr Opin Genet Dev。gydF4y2Ba8gydF4y2Ba, 103 - 111(1998)。gydF4y2Ba
Smad3磷异构体介导的散在人结直肠癌发生信号通路。gydF4y2BaHistol Histopathol。gydF4y2Ba21gydF4y2Ba, 645 - 662(2006)。gydF4y2Ba
Cadenas, C.等。乳腺癌中生物钟基因表达缺失与肿瘤进展相关。gydF4y2Ba细胞周期。gydF4y2Ba13gydF4y2Ba, 3282 - 3291(2014)。gydF4y2Ba
罗let, D. W.等。TEF是一种在胚胎发生过程中特异性表达于垂体前叶的转录因子,它定义了一类新的亮氨酸拉链蛋白。gydF4y2BaDev的基因。gydF4y2Ba5gydF4y2Ba, 1739 - 1753(1991)。gydF4y2Ba
Mueller, c.r, Maire, P. & Schibler, U. DBP是一种肝脏富集的转录激活因子,在个体发育后期表达,其组织特异性在转录后确定。gydF4y2Ba细胞gydF4y2Ba61gydF4y2Ba, 279 - 291(1990)。gydF4y2Ba
Emanuele, M. J.等。复杂制图:细胞周期蛋白F和泛素对E2F转录因子的调控。gydF4y2Ba细胞生物的趋势。gydF4y2Ba30.gydF4y2Ba, 640 - 652(2020)。gydF4y2Ba
李Lammens, T。j . &里昂,g . & De Veylder l .典型E2F: E2F转录因子家族的新球员。gydF4y2Ba细胞生物的趋势。gydF4y2Ba19gydF4y2Ba, 111 - 118(2009)。gydF4y2Ba
吕艳,肖娟,刘娟,邢飞。E2F8是一种潜在的肝细胞癌治疗靶点。gydF4y2Baj .癌症。gydF4y2Ba8gydF4y2Ba, 1205 - 1213(2017)。gydF4y2Ba
Morgunova, E.等。对E2F家族转录因子dna结合特异性的结构洞察。gydF4y2BaCommun Nat。gydF4y2Ba6gydF4y2Ba10050(2015)。gydF4y2Ba
Mizuno, M.等。E2F8在人类胎盘中的作用。gydF4y2Ba摩尔。地中海,代表。gydF4y2Ba19gydF4y2Ba, 293 - 301(2019)。gydF4y2Ba
孙,Y.等。成熟T细胞的反应由microRNA-142控制。gydF4y2Baj .中国。投资。gydF4y2Ba125gydF4y2Ba, 2825 - 2840(2015)。gydF4y2Ba
Smad磷酸异构体直接环境依赖性tgf - β信号。gydF4y2Ba细胞因子生长因子Rev。gydF4y2Ba24gydF4y2Ba, 385 - 399(2013)。gydF4y2Ba
Derynck, R. & Zhang ye . smad依赖和smad独立的tgf - β家族信号通路。gydF4y2Ba自然gydF4y2Ba425gydF4y2Ba, 577 - 584(2003)。gydF4y2Ba
王刚,松浦毅,何东,刘峰。转化生长因子- β诱导的Smad3磷酸化。gydF4y2Ba生物。化学。gydF4y2Ba284gydF4y2Ba, 9663 - 9673(2009)。gydF4y2Ba
张玉娥。有关tgf - β信号的机制洞察。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba51gydF4y2Ba1 - 7(2018)。gydF4y2Ba
诺瓦克,e.c.等。IL-9作为th17驱动的炎症性疾病的中介gydF4y2Baj . Exp。地中海。gydF4y2Ba206gydF4y2Ba, 1653 - 1660(2009)。gydF4y2Ba
Goswami, R.等人。stat6依赖的Th9发育调控gydF4y2Baj . Immunol。gydF4y2Ba188gydF4y2Ba, 968 - 975(2012)。gydF4y2Ba
维格兰,F.等。转录因子IRF1决定了TH9细胞依赖il -21的抗癌功能。gydF4y2BaImmunol Nat。gydF4y2Ba15gydF4y2Ba, 758 - 766(2014)。gydF4y2Ba
Jin, W.等。单细胞和FFPE组织样本中dna酶I超敏位点的全基因组检测。gydF4y2Ba自然gydF4y2Ba528gydF4y2Ba, 142 - 146(2015)。gydF4y2Ba
廖,W.等。IL-2和IL-21对Th9分化的相反作用与它们对BCL6表达的不同调控有关。gydF4y2BaProc。国家的。学会科学。gydF4y2Ba111gydF4y2Ba, 3508 - 3513(2014)。gydF4y2Ba
吕勇,王强,易强。抗癌Tc9细胞:用于过继治疗的长寿命肿瘤杀伤T细胞。gydF4y2BaOncoimmunologygydF4y2Ba3.gydF4y2Bae28542(2014)。gydF4y2Ba
Purwar, R.等。产生白细胞介素9的T细胞介导的肿瘤对黑色素瘤的强大免疫。gydF4y2BaNat地中海。gydF4y2Ba18gydF4y2Ba, 1248 - 1253(2012)。gydF4y2Ba
利特曼,D. R.和鲁登斯基,A. Y. Th17和调节性T细胞在介导和抑制炎症中的作用。gydF4y2Ba细胞gydF4y2Ba140gydF4y2Ba, 845 - 858(2010)。gydF4y2Ba
Tone, Y.等。Smad3和NFAT通过其增强子协同诱导Foxp3表达。gydF4y2BaNat Immunol。gydF4y2Ba9gydF4y2Ba, 194 - 202(2008)。gydF4y2Ba
Maiti, B.等人。具有阻断细胞增殖功能的哺乳动物E2F家族新成员小鼠E2F8的克隆及特性研究。gydF4y2BaJ临床生物化学。gydF4y2Ba280gydF4y2Ba, 18211 - 18220(2005)。gydF4y2Ba
松浦毅,王刚,何东,刘峰。Smad3中ERK MAP激酶磷酸化位点的鉴定与表征。gydF4y2Ba生物化学gydF4y2Ba44gydF4y2Ba, 12546 - 12553(2005)。gydF4y2Ba
Matsuura, I.等。细胞周期蛋白依赖性激酶调节Smads的抗增殖功能。gydF4y2Ba自然gydF4y2Ba430gydF4y2Ba, 226 - 231(2004)。gydF4y2Ba
Seillet, C.等。神经肽VIP通过调节ILC3活性来提供预期的粘膜免疫。gydF4y2BaNat Immunol。gydF4y2Ba21gydF4y2Ba, 168 - 177(2020)。gydF4y2Ba
王,q,等。分子钟对3型先天淋巴细胞的昼夜节律依赖和昼夜节律独立的影响。gydF4y2BaSci Immunol。gydF4y2Ba4 gydF4y2Baeaay7501(2019)。gydF4y2Ba
Yu, A., Zhu, L., Altman, N. H. & Malek, T. R.低的白细胞介素-2受体信号阈值支持T调节细胞的发育和稳态。gydF4y2Ba免疫力gydF4y2Ba30.gydF4y2Ba, 204 - 217(2009)。gydF4y2Ba
Chen, Q, Kim, Y. C, Laurence, A, Punkosdy, G. A. & Shevach, E. M. IL-2控制tgf - β诱导的Foxp3+ T细胞中Foxp3表达的稳定性。gydF4y2BaJ ImmunolgydF4y2Ba186gydF4y2Ba, 6329 - 6337(2011)。gydF4y2Ba
迪基,S.等。远端Foxp3增强子使白细胞介素-2依赖性胸腺Treg细胞谱系承诺为强大的免疫耐受。gydF4y2Ba免疫力gydF4y2Ba54gydF4y2Ba, 931-946 e911(2021)。gydF4y2Ba
薛刚,金刚,方娇,吕勇。在tgf - β信号缺失的情况下,IL-4联合il -1 β诱导抗肿瘤Th9细胞分化。gydF4y2BaNat Commun。gydF4y2Ba10gydF4y2Ba1376(2019)。gydF4y2Ba
Jurida, L.等。il -1诱导增强子的激活依赖于TAK1激酶活性和NF-kappaB p65。gydF4y2Ba细胞的代表。gydF4y2Ba10gydF4y2Ba, 726 - 739(2015)。gydF4y2Ba
威廉,C.,特纳,J. E.,范·斯尼克,J.和斯托金格,B. IL-9的多条生命:一个生存的问题?gydF4y2BaNat Immunol。gydF4y2Ba13gydF4y2Ba, 637 - 641(2012)。gydF4y2Ba
万杰等。IL-9和IL-9产生细胞在肿瘤免疫中的作用gydF4y2Ba细胞Commun信号。gydF4y2Ba18gydF4y2Ba50(2020)。gydF4y2Ba
卢,杨,等。Th9细胞是CD4(+) T细胞的一个独特子集,具有根除晚期肿瘤的能力。gydF4y2Ba癌症细胞。gydF4y2Ba33gydF4y2Bae1047(2018)。gydF4y2Ba
Larsson, J.等。tgf - β信号缺陷造血干细胞虽然在体外增殖能力增强,但在体内具有正常的自我更新和再生能力。gydF4y2Ba血gydF4y2Ba102gydF4y2Ba, 3129 - 3135(2003)。gydF4y2Ba
Maruyama, T.等。dna结合抑制剂Id3对调节性T细胞和T(H)17细胞分化的控制gydF4y2BaNat ImmunolgydF4y2Ba12gydF4y2Ba, 86 - 95(2011)。gydF4y2Ba
徐杰等。细胞因子tgf - β诱导真皮树突状细胞表达白介素-31激活感觉神经元,刺激伤口瘙痒。gydF4y2Ba免疫力gydF4y2Ba53gydF4y2Ba, 371-383 e375(2020)。gydF4y2Ba
唐丽媛等。Smurf2的消融揭示了通过Smad3的多重单泛素化抑制tgf - β信号。gydF4y2BaEMBO J。gydF4y2Ba30.gydF4y2Ba, 4777 - 4789(2011)。gydF4y2Ba
皮切利,S.等。使用Smart-seq2从单细胞中提取全长RNA-seq。gydF4y2BaNat Protoc。gydF4y2Ba9gydF4y2Ba, 171 - 181(2014)。gydF4y2Ba
确认gydF4y2Ba
本研究得到了美国国立卫生研究院(NIH) NIDCR、NHBLI和NCI的内部研究项目的支持。我们感谢NIDCR联合技术研究核心和兽医资源核心提供的服务和技术援助。本文献给2018年1月22日因车祸去世的s.a.p.。gydF4y2Ba
资金gydF4y2Ba
开放获取基金由美国国立卫生研究院(NIH)提供。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
s - a.p.和y - j.l.设计并执行了大部分实验,分析了数据,起草了手稿。W.L.K, d.z设计并进行了实验,分析了数据,并对手稿的草稿做出了贡献。kc, L-Y.T。,C.C., P.Z., and Z.C. designed and performed experiments. W.J., D.W., J.X., O.L., F.W., A.C., N.G., H.N. performed experiments and/or collected and analyzed data. C.W., Y.E.Z., K.Z. provided crucial scientific input or research materials, designed and supervised experiments, and edit manuscript. W.J.C. conceived of and supervised the research, designed the experiments, and wrote the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Mark Kaplan和其他匿名审稿人对这项工作的同行评议所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
公园,SA。,Lim, YJ., Ku, W.L.et al。gydF4y2Ba昼夜节律蛋白DBP与非典型E2F家族E2F8在抗肿瘤Th9细胞分化中的对立作用gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba6069(2022)。https://doi.org/10.1038/s41467-022-33733-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33733-8gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba