摘要gydF4y2Ba
runt相关转录因子(Runx)家族在软骨稳态中发挥着多种作用。在这里,我们研究了Runx2和Runx3在体内和体外骨关节炎发展中的作用。gydF4y2BaRunx3 -gydF4y2Ba敲除小鼠在手术诱导后表现出骨关节炎加速,并伴有润滑素和聚集蛋白表达降低。与此同时,gydF4y2BaRunx2gydF4y2Ba条件敲除小鼠表现为双相表型:杂合敲除抑制骨关节炎,降低基质金属肽酶13 (Mmp13)表达,而纯合敲除gydF4y2BaRunx2gydF4y2Ba加速骨关节炎和减少II型胶原(Col2a1)表达。综合转录分析显示,润滑蛋白和聚合蛋白是Runx3的转录靶基因,表明Runx2持续存在gydF4y2BaCol2a1gydF4y2Ba当Sox9减少时,通过内含子6增强子表达。关节内注射Runx3腺病毒可改善手术性骨关节炎的发展。正常情况下,Runx3通过细胞外基质蛋白生成来保护成人关节软骨,而在炎症条件下,Runx2同时发挥分解代谢和合成代谢作用。gydF4y2Ba
介绍gydF4y2Ba
骨关节炎(OA)是最常见的以软骨变性为特征的关节疾病。骨性关节炎的进展最终导致老年患者的残疾,这给社会经济带来了巨大的负担gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.骨性关节炎是一种多因素疾病,由衰老、炎症、体重过重、劳累等因素引起gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.在OA早期,关节软骨的浅表区(SFZ)软骨退行性变明显,该浅表区通过产生润滑素对关节润滑有特殊作用,这种润滑素由蛋白聚糖4 (gydF4y2BaPrg4gydF4y2Ba)基因gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba.prg4敲除(KO)小鼠在2个月时出现不规则表面,随后出现非炎性滑膜增生gydF4y2Ba6gydF4y2Ba.关节软骨深层区(DZ)由软骨细胞和细胞外基质组成gydF4y2Ba7gydF4y2Ba.软骨细胞通过产生II型胶原α1 (Col2a1)和聚集蛋白(Acan)等软骨基质蛋白,维持细胞外基质和软骨稳态的平衡。gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.转录的gydF4y2BaCol2a1gydF4y2Ba通过内含子1和6的Sox9共识位点,由性别决定区Y-box 9 (Sox9)强烈诱导gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.值得注意的是,SOX9过表达被证明可以减缓实验性OA的进展gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
与这些合成代谢因子相比,基质金属蛋白酶13 (matrix metalloproteinase 13, Mmp13)通过降解Col2a1在软骨退行性变和骨性关节炎的发展中发挥重要作用gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.MMP13在正常和早期退行性软骨中表达较低,但在晚期OA标本中表达强烈上调gydF4y2Ba20.gydF4y2Ba.在炎症条件下,如受到白细胞介素-1- β (IL-1β)的刺激,软骨细胞中MMP13蛋白升高。gydF4y2Ba14gydF4y2Ba.先前的研究发现Mmp13表达上游有多种转录因子,包括活化B细胞核因子κB轻链增强子(NF-κB)相关因子gydF4y2Ba21gydF4y2Ba缺氧诱导因子2- α (HIF-2α)gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba和runt相关转录因子2 (Runx2)gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.gydF4y2Ba
Runx家族(Runx1/Runx2/Runx3)通过dna识别共识基序TG(T/C)GGT在软骨和骨骼的发育和稳态中发挥核心作用gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.Runx2被认为是软骨细胞成熟和软骨内成骨的主要调控因子gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.Runx2可直接诱导多种与软骨细胞肥大相关的基因,如gydF4y2BaMmp13gydF4y2Ba正向调节软骨细胞的肥大分化和骨化gydF4y2Ba27gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.在gydF4y2BaRunx2gydF4y2Ba杂合子敲除小鼠,OA发育显著降低,MMP13表达降低gydF4y2Ba31gydF4y2Ba.在他莫昔芬诱导的软骨细胞特异性runx2敲除小鼠中观察到类似的结果,其中mRNA水平gydF4y2BaRunx2gydF4y2Ba软骨减少了大约一半gydF4y2Ba32gydF4y2Ba.此外,软骨细胞特异性Runx2过表达导致创伤后OA进展gydF4y2Ba33gydF4y2Ba.这些体内数据和其他实验结果一致表明Runx2在关节软骨中的分解代谢作用gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.先前的研究也表明Runx2与骨骼发育有关。gydF4y2BaRunx2gydF4y2Ba纯合子敲除的胚胎显示出软骨内成骨的显著损伤gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.Runx2在软骨内成骨、软骨细胞肥大分化和成骨细胞生成的后期阶段被认为是不可或缺的gydF4y2Ba35gydF4y2Ba.然而,Kimura等人发现Runx1和Runx2协同诱导Sox5和Sox6,从而在骨骼生长过程中诱导Col2a1gydF4y2Ba36gydF4y2Ba.Liao等人报道了软骨细胞特异性敲除gydF4y2BaRunx2gydF4y2Ba在骨骼生长过程中导致gydF4y2BaCol2a1gydF4y2Ba和gydF4y2BaMmp13gydF4y2Ba在颞下颌关节gydF4y2Ba37gydF4y2Ba.然而,Runx2在软骨细胞中的这些合成代谢作用尚未在成人关节软骨中显示出来。gydF4y2Ba
与Runx2作用的复杂性相反,先前的研究一致表明Runx1具有软骨形成作用gydF4y2Ba38gydF4y2Ba.Runx1促进软骨基质生成,而Runx1缺乏加速OA进展gydF4y2Ba38gydF4y2Ba.尽管Runx3已被证明可以促进聚合蛋白的表达gydF4y2Ba39gydF4y2Ba并参与调节软骨细胞增殖和分化gydF4y2Ba40gydF4y2Ba, Runx3在关节软骨中的作用尚未得到体内实验的证实。综上所述,我们假设Runx2和Runx3可能在成人关节软骨的维持中起重要作用。gydF4y2Ba
在这项研究中,我们使用条件敲除小鼠检测了Runx2和Runx3在OA发育中的作用。我们采用了两种外科骨性关节炎模型,其中炎症反应深入参与,以及一种衰老模型,表现出更自然的疾病进展gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba和gydF4y2BaPrg4-CregydF4y2BaERT2gydF4y2Ba老鼠。我们利用染色质免疫沉淀测序(ChIP-seq)和RNA测序(RNA-seq)进一步分析了Runx2和Runx3调控关节软骨细胞的机制。我们发现Runx3通过诱导细胞外基质参与关节软骨的维持,而Runx2在炎症状态下以双相的方式发挥分解代谢和合成代谢的作用。gydF4y2Ba
结果gydF4y2Ba
Runx2和Runx3在手术诱导OA发生过程中关节软骨的表达gydF4y2Ba
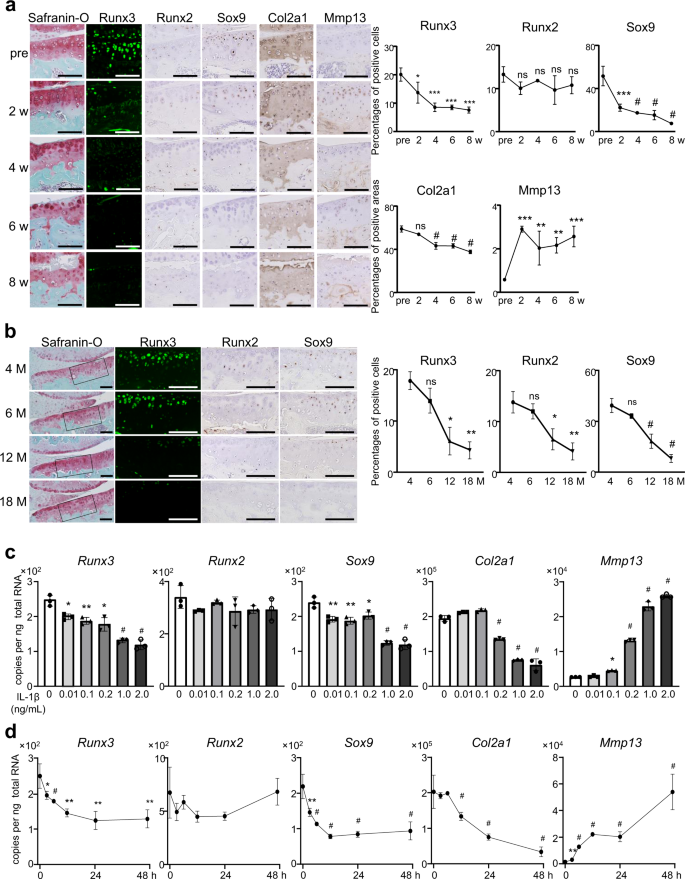
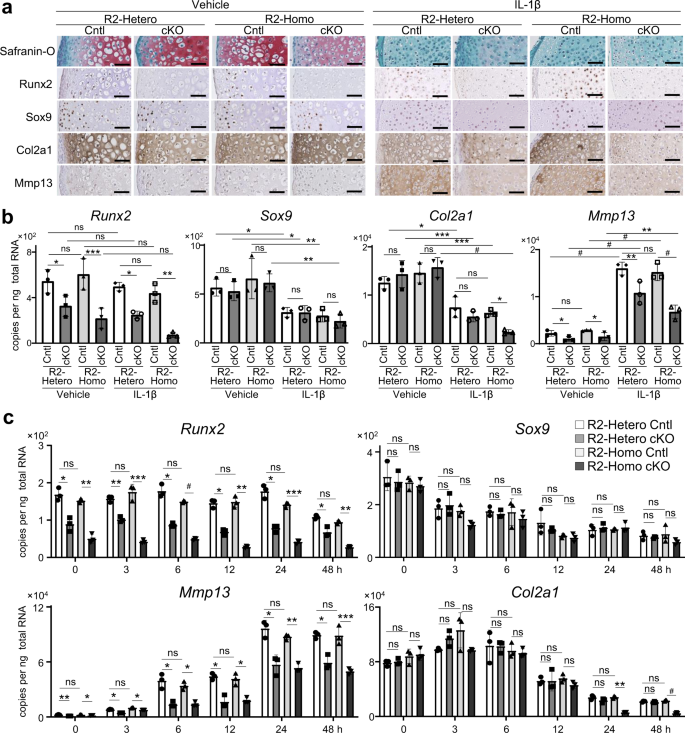
为了检测骨性关节炎发展过程中关节软骨中Runx2、Runx3和Sox9的表达,我们通过手术切除内侧副韧带和内侧半月板制备了8周龄小鼠骨性关节炎模型(内侧模型)。gydF4y2Ba41gydF4y2Ba.正常软骨免疫组化结果显示,Runx2蛋白主要位于术前关节软骨DZ区,而Runx3和Sox9在各层均存在(图2)。gydF4y2Ba1gydF4y2Ba)。手术后,手术治疗的膝关节Runx3和Sox9开始下降,并伴有Col2a1。DZ内连续检测Runx2。免疫组织化学显示Mmp13的表达增强,尤其是在术后2周,并在术后4、6和8周主要在关节软骨的DZ(图2)。gydF4y2Ba1gydF4y2Ba)。我们还检测了随着年龄增长,关节软骨中Runx2、Runx3和Sox9表达的变化。在WT小鼠的膝关节中,它们的表达随着时间的推移而下降,并在12月龄时明显减弱(图2)。gydF4y2Ba1 bgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba在切除内侧半月板和内侧副韧带后小鼠OA发展过程中软骨细胞标记物的免疫荧光。标尺,100 μm。免疫荧光阳性细胞或区域在红花素o阳性区域的百分比显示在右图中。gydF4y2BabgydF4y2Ba4、6、12、18月龄小鼠膝关节Runx3、Runx2和Sox9的免疫组化。标尺,100 μm。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba小鼠原代软骨细胞暴露于浓度为0.01 ~ 2 ng/mL的白细胞介素-1- β (IL-1β)作用24 h后,标记基因mRNA水平(gydF4y2BacgydF4y2Ba),或1 ng/mL IL-1β作用0 ~ 48 h (gydF4y2BadgydF4y2Ba)。数据以三个生物独立小鼠的均值±标准差(SD)表示(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或三个实验(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.0001;n,不显著;Dunnett多重比较检验的普通单因素方差分析(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba),单因素方差分析与土耳其事后检验(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)。gydF4y2Ba
我们使用IL-1β进行了体外分析,以检测Runx2和Runx3在炎症中的作用,IL-1β被广泛用于模拟软骨细胞降解gydF4y2Ba14gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.主要的软骨细胞gydF4y2Ba45gydF4y2Ba暴露于不同浓度的IL-1β 24小时(图2)。gydF4y2Ba1 cgydF4y2Ba);或1 ng/mL IL-1β作用0 ~ 48小时(图2)。gydF4y2Ba1 dgydF4y2Ba)。gydF4y2BaRunx3gydF4y2Ba暴露于IL-1β后,il -1表达下调(图2)。gydF4y2Ba1 cgydF4y2Ba)和时间依赖方式(图2)。gydF4y2Ba1 dgydF4y2Ba),但水平gydF4y2BaRunx2gydF4y2Ba暴露于IL-1β后mRNA不变(图2)。gydF4y2Ba1 c, dgydF4y2Ba)。相反,暴露于IL-1β会引起剂量和时间依赖性的gydF4y2BaMmp13gydF4y2Ba抑制gydF4y2BaSox9gydF4y2Ba,随后下降gydF4y2BaCol2a1gydF4y2Ba(无花果。gydF4y2Ba1 c, dgydF4y2Ba)。这些结果表明,将体外软骨细胞暴露于1 ng/mL IL-1β 24小时,可以再现在体内手术OA模型中观察到的标记基因和蛋白质的表达模式,包括稳定表达gydF4y2BaRunx2gydF4y2Ba,减少gydF4y2BaRunx3 Sox9,gydF4y2Ba和gydF4y2BaCol2a1gydF4y2Ba,并增加gydF4y2BaMmp13gydF4y2Ba.gydF4y2Ba
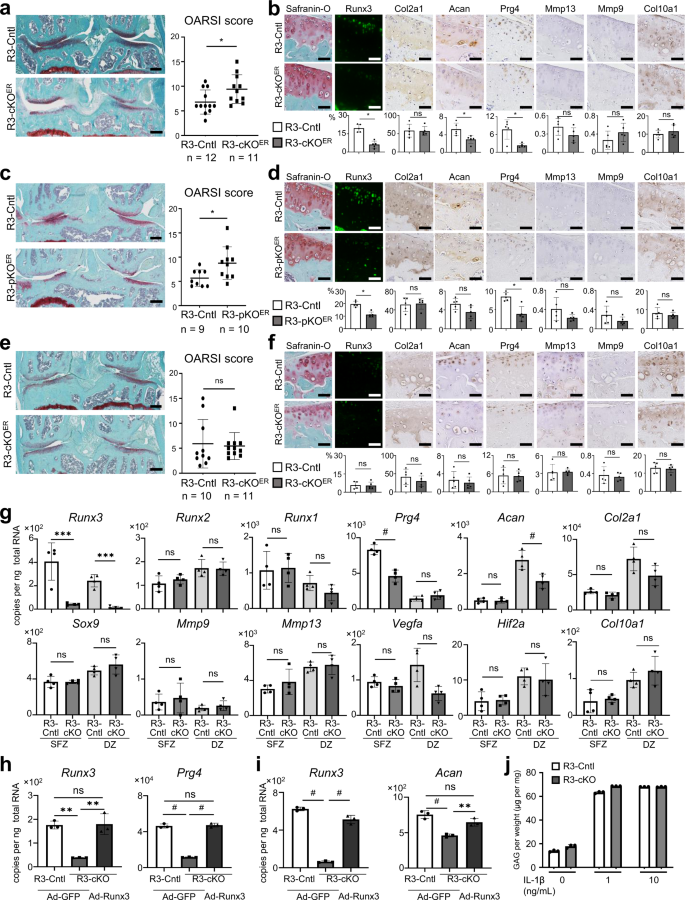
Runx3基因敲除通过抑制Prg4和Acan加速OA的发展gydF4y2Ba
为了揭示Runx3在骨骼生长后整个或SFZ关节软骨中的作用,我们进行了比较gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba同窝出生的gydF4y2Ba46gydF4y2Ba(R3-Cntl)gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-cKOgydF4y2Ba呃gydF4y2Ba)gydF4y2Ba47gydF4y2Ba和gydF4y2BaPrg4-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-pKOgydF4y2Ba呃gydF4y2Ba)gydF4y2Ba48gydF4y2Ba老鼠。我们准备了三种不同的OA模型(补充图2)。gydF4y2Ba1得了gydF4y2Ba)。作为媒介模型的结果gydF4y2Ba41gydF4y2Ba在R3-cKO中,OA的发展明显加快gydF4y2Ba呃gydF4y2Ba膝关节与R3-Cntl关节对比(图2)gydF4y2Ba2gydF4y2Ba)。假手术R3-cKO的关节软骨gydF4y2Ba呃gydF4y2Barunx3阳性细胞减少70%(图2)。gydF4y2Ba2 bgydF4y2Ba)。随着Runx3基因敲除,Acan和Prg4的阳性区域减少(图3)。gydF4y2Ba2 bgydF4y2Ba)。同样,在R3-pKO中,OA的发展明显加快gydF4y2Ba呃gydF4y2Ba关节(图。gydF4y2Ba2摄氏度gydF4y2Ba)。假手术R3-pKO的关节软骨gydF4y2Ba呃gydF4y2Barunx3阳性细胞减少40%,Prg4阳性面积减少(图2)。gydF4y2Ba二维gydF4y2Ba)。此外,内侧半月板(DMM)失稳后8周gydF4y2Ba49gydF4y2Ba作为一种轻微损伤引起的OA模型,24周龄R3-pKO的OA发展也明显加快gydF4y2Ba呃gydF4y2Ba小鼠与R3-Cntl小鼠比较(补充图)。gydF4y2Ba2 gydF4y2Ba)。在老化模型中(补充图2)。gydF4y2Ba1 cgydF4y2Ba), R3-cKO的OA发展没有变化gydF4y2Ba呃gydF4y2Ba与R3-Cntl小鼠相比(图3)。gydF4y2Ba2 e, fgydF4y2Ba)。在18月龄关节的关节软骨中,两种基因型的runx3阳性细胞的比例没有差异(图2)。gydF4y2Ba2 fgydF4y2Ba),可能是因为Runx3的表达随着年龄的增长而减少,如图所示。gydF4y2Ba1 bgydF4y2Ba.标记蛋白在两种小鼠中的表达也相似(图2)。gydF4y2Ba2 fgydF4y2Ba)。通过gydF4y2BaRunx3gydF4y2Ba在全关节软骨敲除后,假侧、手术OA模型或随衰老的软骨细胞凋亡均无明显变化gydF4y2BaRunx3gydF4y2Ba假侧SFZ关节软骨的敲除(补充图)。gydF4y2Ba3模拟gydF4y2Ba)。gydF4y2Ba
办公电子化的发展gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-cKOgydF4y2Ba呃gydF4y2Ba)老鼠(gydF4y2Ba一个gydF4y2Ba),在R3-Cntl和gydF4y2BaPrg4-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-pKOgydF4y2Ba呃gydF4y2Ba)老鼠(gydF4y2BacgydF4y2Ba),在R3-Cntl和R3-cKO中gydF4y2Ba呃gydF4y2Ba衰老模型小鼠(gydF4y2BaegydF4y2Ba)。比例尺,200 μm (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba)。16周龄假手术R3-Cntl和R3-cKO膝关节标记蛋白的免疫荧光分析gydF4y2Ba呃gydF4y2Ba老鼠(gydF4y2BabgydF4y2Ba)和16周龄的R3-Cntl和R3-pKOgydF4y2Ba呃gydF4y2Ba老鼠(gydF4y2BadgydF4y2Ba),在7周龄时注射他莫昔芬。18月龄R3-Cntl和R3-cKO膝关节标记蛋白的免疫荧光分析gydF4y2Ba呃gydF4y2Ba老鼠(gydF4y2BafgydF4y2Ba),在2、6和12个月大时注射他莫昔芬。比例尺,50µm (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)。runx3阳性细胞的比率和safranin - o阳性区域中的3,3 ' -二氨基联苯胺(DAB)阳性区域显示在下图中gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba.gydF4y2BaggydF4y2BaR3-Cntl和R3-Cntl获得的浅表区(SFZ)和DZ软骨细胞中标记基因的mRNA水平gydF4y2BaCol2a1-Cre;Runx3gydF4y2Bafl / flgydF4y2Ba(R3-cKO)老鼠。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2BamRNA水平gydF4y2BaRunx3gydF4y2Ba和gydF4y2BaPrg4gydF4y2Ba或gydF4y2Ba能gydF4y2Ba在R3-Cntl和R3-cKO SFZ软骨细胞(gydF4y2BahgydF4y2Ba)或DZ软骨细胞(gydF4y2Ba我gydF4y2Ba在感染的多重性(MOI)为20时,腺病毒诱导过表达GFP (Ad-GFP)或Runx3 (Ad-Runx3)。gydF4y2BajgydF4y2Ba二甲基亚甲基蓝(DMMB)测定。添加或不添加IL-1β (1,10 ng / mL)培养3天的R3-Cntl和R3-cKO小鼠股骨头中蛋白多糖释放到培养基中的量。数据以生物依赖小鼠的平均值±标准差表示(gydF4y2BangydF4y2Ba= 5 forgydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BangydF4y2Ba= 4 forgydF4y2BaggydF4y2Ba,gydF4y2BangydF4y2Ba= 3 forgydF4y2BahgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.0001, n.s.,不显著;普通单因素方差分析与土耳其事后检验(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)和双尾曼-惠特尼gydF4y2BaUgydF4y2Ba测试(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,gydF4y2BajgydF4y2Ba)。gydF4y2Ba
然后,我们检测了runx3基因敲除小鼠SFZ和DZ细胞中oa相关基因的表达。为了提高敲除效率,我们准备了gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba(R3-Cntl)和gydF4y2BaCol2a1-Cre;Runx3gydF4y2Bafl / flgydF4y2Ba(R3-cKO)小鼠,骨骼发育正常(补充图2)。gydF4y2Ba4 ggydF4y2Ba)。gydF4y2BaPrg4gydF4y2Ba在R3-cKO SFZ细胞和gydF4y2Ba能gydF4y2Ba在R3-cKO DZ细胞中也降低(图2)。gydF4y2Ba2 ggydF4y2Ba)。其他基因在SFZ细胞和DZ细胞中未发生改变(图2)。gydF4y2Ba2 ggydF4y2Ba)。然后我们从R3-pKO中制备SFZ和DZ细胞gydF4y2Ba呃gydF4y2Ba和R3-Cntl幼崽,并用水溶性他莫昔芬处理它们。只有gydF4y2BaPrg4gydF4y2Ba在runx3缺失的SFZ细胞中降低。gydF4y2Ba5克ydF4y2Ba)。我们进一步利用腺病毒转导在Runx3敲除细胞中过表达Runx3。Downregulation的gydF4y2BaPrg4gydF4y2Ba在R3-cKO SFZ细胞和gydF4y2Ba能gydF4y2BaR3-cKO DZ细胞通过过表达Runx3恢复到控制水平(图3)。gydF4y2Ba2 h,我gydF4y2Ba)。此外,我们进行了二甲基亚甲基蓝(DMMB)测定gydF4y2Ba50gydF4y2Ba研究Runx3的分解代谢作用。Runx3基因敲除未显著改变释放的糖胺聚糖(GAG)含量(图3)。gydF4y2Ba2 jgydF4y2Ba)。gydF4y2Ba
杂合抑制手术诱导OA的发展gydF4y2BaRunx2gydF4y2Ba基因敲除,但被纯合基因敲除加速gydF4y2Ba
为了研究体内骨骼生长后Runx2在关节软骨中的功能丧失,我们产生了表达一个floxed的突变小鼠品系gydF4y2BaRunx2gydF4y2Ba等位基因(补充图)gydF4y2Ba6gydF4y2Ba)。对E18.5胚胎进行茜素红和阿利新蓝染色。gydF4y2BaCAG-Cre;Runx2gydF4y2Bafl /低频gydF4y2Ba小鼠在发育的骨骼中表现出完全缺乏矿化基质,类似于全基因敲除小鼠(补充图2)。gydF4y2Ba6 bgydF4y2Ba)gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.锁骨发育不全,囟门打开gydF4y2BaCAG-Cre;Runx2gydF4y2Bafl / +gydF4y2Ba这表明在一般杂合敲除小鼠中报道的锁骨颅发育不良表型(补充图2)。gydF4y2Ba6 bgydF4y2Ba)gydF4y2Ba19gydF4y2Ba.gydF4y2Ba
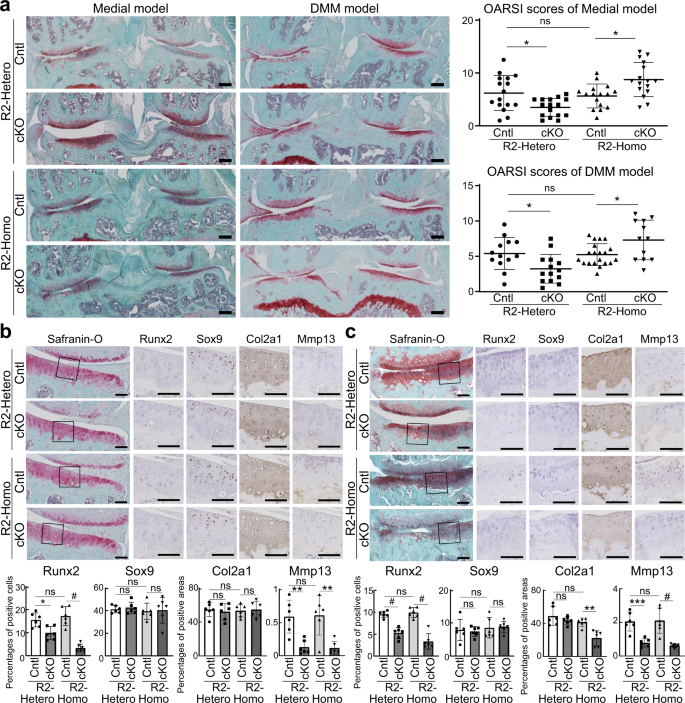
接下来我们交配了gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba老鼠gydF4y2Ba47gydF4y2Ba和生成gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero Cntl)gydF4y2Ba, Col2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero cKO),gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo cKO)雄性幼崽。在中间模型中gydF4y2Ba41gydF4y2Ba结果显示,与各自的对照组相比,R2-Hetero cKO小鼠膝关节骨性关节炎的发展明显受到抑制,R2-Homo cKO小鼠膝关节骨性关节炎的发展加速(图2)。gydF4y2Ba3gydF4y2Ba)。在DMM模型中gydF4y2Ba49gydF4y2Ba, R2-Hetero cKO膝关节骨性关节炎的发展明显受到抑制,与之前的报道相似gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba但与R2-Cntl相比,R2-Homo cKO小鼠的关节加速(图2)。gydF4y2Ba3gydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba红花素- o染色与国际骨关节炎研究协会(OARSI)评分gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero Cntl),gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;Runx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero cKO),gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;Runx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo cKO)小鼠在手术破坏内侧半月板(DMM)后12周或切除内侧半月板和内侧副韧带(内侧模型)后8周。DMM组大鼠于15周、中膜模型组大鼠于7周进行他莫昔芬诱导。实验组由gydF4y2BangydF4y2Ba= 13、14、20、12,和gydF4y2BangydF4y2Ba在中间模型中每个基因型= 16。标尺,200 μm。假手术组织Runx2、Sox9、Col2a1、Mmp13的红花素o染色及免疫组化gydF4y2BabgydF4y2Ba)及外科手术(gydF4y2BacgydF4y2Ba)关节。gydF4y2BangydF4y2Ba= 6个生物独立实验。标尺,100 μm。数据以点图和平均值±SD表示。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.0001;n,不显著;采用土耳其事后检验进行单因素方差分析。gydF4y2Ba
免疫组化显示,假关节和OA关节R2-Hetero cKO软骨中runx2阳性细胞减少约40%,R2-Homo cKO软骨中runx2阳性细胞减少约80%(图2)。gydF4y2Ba3 b, cgydF4y2Ba),分别。在两种基因型的假关节中,Sox9和Col2a1的蛋白水平没有变化(图2)。gydF4y2Ba3 bgydF4y2Ba),但Col2a1在R2-Homo cKO小鼠的OA关节中被显著抑制(图2)。gydF4y2Ba3 cgydF4y2Ba)。在R2-Hetero和R2-Homo cKO小鼠的假关节和OA关节中,Mmp13均显著降低(图2)。gydF4y2Ba3 b, cgydF4y2Ba)。在衰老模型中,我们进一步比较了R2-Homo Cntl和R2-Homo cKO小鼠的OA发育情况。在18个月大时,与R2-Cntl小鼠相比,R2-Homo cKO小鼠随着年龄增长的OA发展没有变化,Runx2、Sox9、Col2a1或Mmp13的免疫组化也没有变化(补充图2)。gydF4y2Ba7 a、bgydF4y2Ba)。gydF4y2Ba
为了检测软骨细胞凋亡,我们对内侧和DMM模型膝关节进行了tdt介导的dUTP镍端标记(TUNEL)染色。TUNEL染色显示R2-Homo KO小鼠假关节软骨细胞凋亡上调(补充图2)。gydF4y2Ba8gydF4y2Ba)。R2-Homo cKO小鼠关节软骨细胞数量减少(补充图)。gydF4y2Ba8gydF4y2Ba)。为了检验Runx2基因敲除的短期效应,我们每天给这4种基因型的7周龄雄性同窝小鼠注射他莫昔芬,持续5天,注射后1周不做任何手术处死小鼠。R2-Homo cKO小鼠关节软骨的软骨细胞凋亡增强,细胞数量减少(补充图2)。gydF4y2Ba8 bgydF4y2Ba)。gydF4y2Ba
纯合子中Col2a1的表达被抑制gydF4y2BaRunx2gydF4y2Ba-敲除炎症下的软骨细胞gydF4y2Ba
手术诱导不同程度地改变了R2-Hetero和Homo cKO小鼠的OA发育,但对衰老模型小鼠没有影响,这表明Runx2可能参与严重炎症的软骨退变,而不是轻度炎症的衰老。为了揭示Runx2在炎症软骨细胞中的作用,我们使用IL-1β进行了离体和体外分析gydF4y2Ba14gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.在含或不含IL-1β培养2周的股骨头中,红花素- o染色显示每种基因型的蛋白聚糖都一致减少(图2)。gydF4y2Ba4gydF4y2Ba)。免疫组织化学证实了R2-Hetero和R2-Homo cKO股骨头中Runx2的有效敲除(图2)。gydF4y2Ba4gydF4y2Ba)。在两种基因型的正常培养物中,Col2a1蛋白水平不变,但在IL-1β暴露后下降,特别是在R2-Homo cKO组(图2)。gydF4y2Ba4gydF4y2Ba)。利用匀浆股骨头mRNA的qRT-PCR证实gydF4y2BaRunx2gydF4y2Ba根据基因型而降低,但IL-1β暴露不变(图2)。gydF4y2Ba4 bgydF4y2Ba)。gydF4y2BaMmp13gydF4y2Ba暴露于IL-1β后,所有基因型的表达量均增加gydF4y2BaMmp13gydF4y2Ba基因型间相似gydF4y2BaRunx2gydF4y2Ba(无花果。gydF4y2Ba4 bgydF4y2Ba)。gydF4y2BaSox9gydF4y2Ba和gydF4y2BaCol2a1gydF4y2BaIL-1β降低,且基因型间无变化,其中gydF4y2BaCol2a1gydF4y2Ba暴露于IL-1β后R2-Homo cKO股骨头(图2)。gydF4y2Ba4 bgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba获得的股骨头Runx2、Sox9、Col2a1和Mmp13的红花素o染色和免疫组化gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero Cntl),gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero cKO),gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo cKO) P1新生儿,添加或不添加1 ng / mL IL-1β培养2周。标尺,100 μm。gydF4y2BabgydF4y2BamRNA水平gydF4y2BaRunx2gydF4y2Ba,gydF4y2BaSox9gydF4y2Ba,gydF4y2BaCol2a1gydF4y2Ba,gydF4y2BaMmp13gydF4y2Ba在股骨头里。gydF4y2BacgydF4y2Ba的时间进程gydF4y2BaRunx2gydF4y2Ba,gydF4y2BaSox9gydF4y2Ba,gydF4y2BaCol2a1gydF4y2Ba,gydF4y2BaMmp13gydF4y2Ba暴露于1 ng / mL IL-1β的R2-Hetero Cntl、R2-Hetero cKO、R2-Homo Cntl和R2-Homo cKO小鼠的原代软骨细胞mRNA水平。gydF4y2BangydF4y2Ba= 3个生物独立实验。数据以点图和平均值±SD *表示gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.0001;n,不显著;采用土耳其事后检验进行单因素方差分析。gydF4y2Ba
接下来,我们检测了暴露于1 ng/mL IL-1β的四种基因型软骨细胞中标记基因mRNA水平从0到8小时的变化。细胞的mRNA水平gydF4y2BaRunx2gydF4y2BaIL-1β在R2-Hetero和R2-Homo cKO软骨细胞中有效降低,并在暴露于IL-1β后在每种基因型中保持稳定。gydF4y2Ba4摄氏度gydF4y2Ba)。gydF4y2BaMmp13gydF4y2Ba随着时间的推移而增加,在R2-Hetero和R2-Homo cKO软骨细胞中与各自的对照组相比,在每个时间点都受到抑制。gydF4y2BaSox9gydF4y2Ba逐渐减少,并且在检测的任何一点上基因型之间没有差异。gydF4y2BaCol2a1gydF4y2Ba暴露于IL-1β超过24小时后,R2-Homo cKO中IL-1β的表达被显著抑制。gydF4y2Ba4摄氏度gydF4y2Ba)。gydF4y2Ba
通过ChIP-seq和RNA-seq检测软骨细胞Runx2和Runx3关联谱的全基因组分析gydF4y2Ba
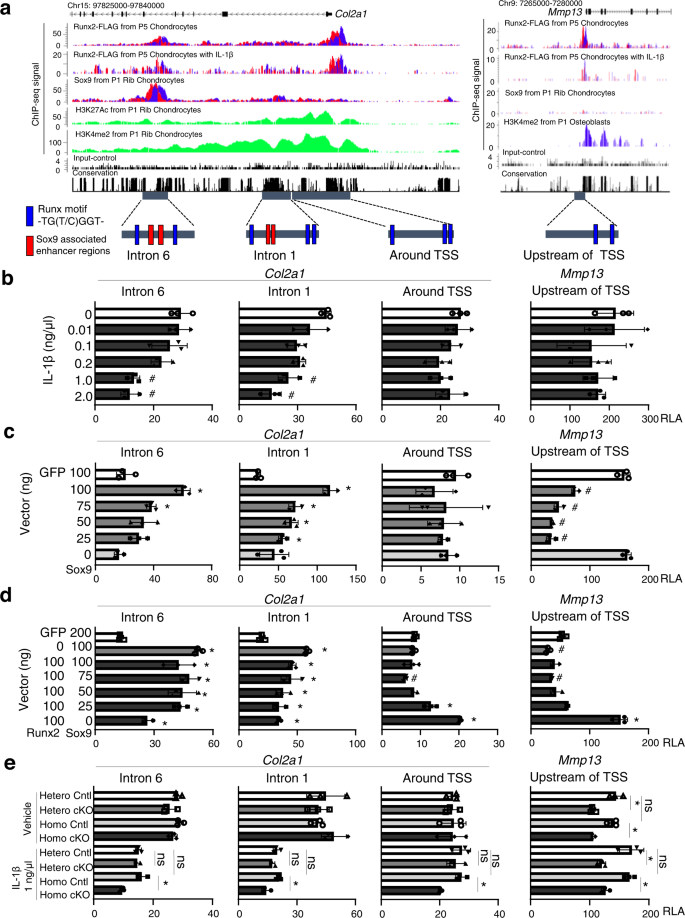
为了研究Runx3和Runx2调控软骨细胞的机制,我们计划了带有抗flag抗体的ChIP-seq。对于Runx3,我们用转染了flag标记的Runx3表达载体的WT小鼠制备SFZ细胞。对于ChIP-seq, 21,730个原始峰符合峰调用标准,并且所有峰的~50%映射到从转录起始位点(TSS)±50到500kb之间的间隔(图5)。gydF4y2Ba5gydF4y2Ba)。基因组区域富集注释工具(GREAT)基因本体(GO)分析gydF4y2Ba51gydF4y2Ba表明细胞外结构组织和胶原纤维组织项在该基因集中富集最为显著(图2)。gydF4y2Ba5gydF4y2Ba)。使用MEME-ChIP对前1000个特定峰进行从头分析gydF4y2Ba52gydF4y2Ba鉴定出先前预测的Runx基序TG(T/C)GG(T/C)(图2)。gydF4y2Ba5 bgydF4y2Ba)。围绕基因编码的ChIP-seq数据gydF4y2BaPrg4gydF4y2Ba和gydF4y2Ba能gydF4y2Ba显示出Runx3结合的几个峰(补充图2)。gydF4y2Ba9模拟gydF4y2Ba)。周围区域的相对荧光素酶活性gydF4y2BaPrg4gydF4y2Ba和gydF4y2Ba能gydF4y2Ba过表达Runx3增加了细胞数量(补充图2)。gydF4y2Ba9 b, dgydF4y2Ba)。为了进一步研究Runx3基因敲除对基因表达谱的改变,我们对来自R3-cKO和R3-Cntl小鼠的SFZ和DZ细胞进行了rna测序(Supplementary Fig. 1)。gydF4y2Ba10模拟gydF4y2Ba及补充表格gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba)。在R3-cKO SFZ细胞中上调或下调2倍以上的18个基因中,有9个是ChIP-seq显示的最靠近前三分之一峰的基因,包括gydF4y2BaPrg4gydF4y2Ba和gydF4y2BaMmp9gydF4y2Ba(无花果。gydF4y2Ba5度gydF4y2Ba)。gydF4y2Ba
一个gydF4y2BaRunx3相关区域相对于转录起始位点(TSS)的全基因组分布与基因组区域富集注释工具(GREAT)基因本体(GO)和Runx3的MGI表达注释峰显示前5个富集项。gydF4y2BabgydF4y2Ba通过Runx3-FLAG ChIP-seq确定富集基序。gydF4y2BacgydF4y2Ba利用Cntl和cKO小鼠SFZ原代细胞进行ChIP-seq和RNA-seq鉴定候选基因示意图gydF4y2Ba.dgydF4y2BaRunx2与tss相关区域的全基因组分布,以及Runx2峰的GREAT GO鉴定出的前5个富集项。左上图:载体处理的原代软骨细胞;左下图,炎症软骨细胞暴露于1 ng / mL IL-1β;右图,Runx2-FLAG ChIP-seq峰在原发软骨细胞和炎症软骨细胞之间重叠。gydF4y2BaegydF4y2BaRunx2-FLAG ChIP-seq检测富集基序。gydF4y2BafgydF4y2Ba从Runx2和Sox9峰区重新恢复了TG(T/C)GGT和poly-A基序的富集。上面的面板显示motif徽标,在每个位置显示核苷酸频率(相对于信息内容缩放)。下图显示了Runx2和Sox9峰上映射的TG(T/C)GGT和poly-A基序的富集水平,其中x轴和y轴分别表示映射基序到峰中心的距离和映射基序的频率。gydF4y2BaggydF4y2BaSox9、H3K4me2、H3K27ac、RNA聚合酶II (polII)和兔免疫球蛋白G (IgG)对照的ChIP-seq数据信号强度图,距离Runx2-FLAG峰±1kb。以下ChIP-seq读数的归一化平均信号强度显示在顶部面板中。TES,转录末端位点。gydF4y2BahgydF4y2Ba在原代软骨细胞中通过纯合子敲除Runx2来鉴定下调基因中抗凋亡相关候选基因的示意图。gydF4y2Ba我gydF4y2Ba炎性软骨细胞中Runx2候选转录靶基因的鉴定示意图。gydF4y2Ba
对于Runx2,我们按照之前的报告进行ChIP-seqgydF4y2Ba12gydF4y2Ba,gydF4y2Ba53gydF4y2Ba使用载体对照处理的软骨细胞(原代软骨细胞)或暴露于1 ng/mL的IL-1β(炎症软骨细胞)gydF4y2BaRunx2-FLAGgydF4y2Ba小鼠(Hojo H. et al.)gydF4y2Ba54gydF4y2Ba)。对于ChIP-seq,原发性软骨细胞中的37163个原始峰和炎症软骨细胞中的14571个原始峰符合峰调用标准(图2)。gydF4y2Ba5 dgydF4y2Ba)。原代软骨细胞和炎性软骨细胞之间的峰值分布相似。在两组中,在TSS周围观察到显著的富集;在两个ChIP-seq数据中,约24%的峰值位于TSS的±500 bp范围内,尽管该区域仅占基因组的0.001%gydF4y2Ba51gydF4y2Ba(无花果。gydF4y2Ba5 dgydF4y2Ba)。伟大的围棋分析gydF4y2Ba51gydF4y2Ba分别将“胶原纤维组织”确定为原发性软骨细胞和炎性软骨细胞基因集中第5和第2个最显著的富集项(图2)。gydF4y2Ba5 dgydF4y2Ba)。我们假设与TSS相关的数据集和不包含TSS±500 bp数据的数据集之间存在功能差异,类似于Sox9gydF4y2Ba12gydF4y2Ba.GREAT GO分析显示,原始软骨细胞和发炎软骨细胞的TSS相关Runx2数据集中存在细胞周期相关术语,数据集中不包括TSS±500 bp的数据,Runx2调节的骨骼程序也存在术语。gydF4y2Ba11 a, bgydF4y2Ba)。GREAT GO分析的维恩图显示,Runx2与有无炎症的软骨细胞中胶原原纤维的组织有关(图2)。gydF4y2Ba5 dgydF4y2Ba)。gydF4y2Ba
接下来,我们使用MEME-ChIP对前1000个特定峰进行从头分析gydF4y2Ba52gydF4y2Ba.正如预期的那样,主要基序与先前预测的Runx基序TG(T/C)GGT相似,即使在排除TSS±500 bp数据的数据集中也是如此。gydF4y2Ba5 egydF4y2Ba)。有趣的是,我们观察到poly-A序列,报道为SOX9共识序列gydF4y2Ba55gydF4y2Ba,在tss相关的Runx2数据集中得到了丰富。为了确定Sox9和Runx2之间的功能关系,我们结合之前的Sox9和相关ChIP-seq数据集进一步分析了我们的数据集gydF4y2Ba12gydF4y2Ba.在原发和炎症软骨细胞的Runx2 ChIP-seq峰的预测中心,TG(T/C)GGT基序高度富集。有趣的是,TG(T/C)GGT基序在Sox9 ChIP-seq峰的预测中心略有富集(图2)。gydF4y2Ba5 fgydF4y2Ba)。还恢复了一个poly-A序列,但在Runx2和Sox9峰内没有居中(图2)。gydF4y2Ba5 fgydF4y2Ba)。因此,poly-A基序不太可能是Runx2或Sox9参与软骨细胞的首选原发位点。gydF4y2Ba
为了通过Runx2和sox9导向增强子模块测试多种调控输入的整合,我们分析了峰值强度关联。Sox9-gydF4y2Ba12gydF4y2Ba和runx2峰区域,在炎症软骨细胞中显著增强(图2)。gydF4y2Ba5克gydF4y2Ba)。runx2峰区域与增强子特征明显相关,特别是:(1)H3K4二甲基化(H3K4me2)峰在runx2峰中心区域的双峰模式,这表明启动子和假定的增强子;gydF4y2Ba56gydF4y2Ba(2) H3K27乙酰化(H3K27Ac)峰位于Runx2峰两侧,表明染色质打开gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba炎性软骨细胞比原代软骨细胞更明显;(3) RNA聚合酶II峰与runx2峰区域相关,与活性增强子一致gydF4y2Ba59gydF4y2Ba(无花果。gydF4y2Ba5 dgydF4y2Ba)。综上所述,这些结果表明Runx2通过结合sox9结合位点附近的TG(T/C)GGT靶序列,在原发性软骨细胞和炎症软骨细胞中增强胶原原纤维的转录。gydF4y2Ba
为了进一步研究Runx2在软骨细胞中的一般功能,我们对有或没有IL-1β暴露的R2-Homo Cntl和cKO软骨细胞进行了RNA-seq分析。gydF4y2Ba12 fgydF4y2Ba及补充表格gydF4y2Ba5克ydF4y2Ba和gydF4y2Ba6gydF4y2Ba)。主成分分析强调了Runx2基因敲除对IL-1β诱导炎症的影响。由于R2-Homo cKO小鼠的软骨细胞凋亡增强(补充图)。gydF4y2Ba8 b, cgydF4y2Ba),我们检测了凋亡相关基因。在前200个下调基因中gydF4y2BaRunx2gydF4y2Ba在原代软骨细胞中敲除11个基因(包括gydF4y2Ba本次事件gydF4y2Ba,gydF4y2BaIgf1gydF4y2Ba,gydF4y2BaWnt11gydF4y2Ba)与“细胞凋亡负调控”相关(图2)。gydF4y2Ba5 hgydF4y2Ba)。在炎症软骨细胞中Runx2基因敲除下调的前200个基因中,有10个(包括gydF4y2BaCol2a1gydF4y2Ba)与ChIP-seq检测到的最接近Runx2峰的前500个基因相匹配(图2)。gydF4y2Ba5我gydF4y2Ba)。gydF4y2Ba
的转录调控gydF4y2BaCol2a1gydF4y2Ba和gydF4y2BaMmp13gydF4y2Ba由Runx2和Sox9gydF4y2Ba
我们映射了Runx2-FLAG, Sox9gydF4y2Ba12gydF4y2Ba软骨细胞中的活性组蛋白标记(H3K4me2或H3K27Ac)gydF4y2Ba12gydF4y2Ba或成骨细胞gydF4y2Ba53gydF4y2Ba使用CisGenome浏览器对ChIP-seq数据进行分析。Sox9和Runx2序列数据显示,基因的内含子1和6具有相似的模式gydF4y2BaCol2a1gydF4y2Ba;具体来说,在内含子1处有不显著的峰,而在内含子6处有显著的峰(图2)。gydF4y2Ba6gydF4y2Ba)。这些峰与的功能增强子相同gydF4y2BaCol2a1gydF4y2Ba含有Sox9基序gydF4y2Ba8gydF4y2Ba.放大后的图像显示,Runx2和Sox9的峰值中心(包含它们的一致基序)相距300 - 400 bp。gydF4y2Ba13gydF4y2Ba)。基于CisGenome浏览器,我们制备了含有Runx2基序的荧光素酶报告载体gydF4y2BaCol2a1gydF4y2Ba和gydF4y2BaMmp13gydF4y2Ba基因如图2所示。gydF4y2Ba6gydF4y2Ba.的相对荧光素酶活性gydF4y2BaCol2a1gydF4y2Ba暴露于≥1 ng/mL IL-1β的软骨细胞中内含子1和6片段减少(图2)。gydF4y2Ba6 bgydF4y2Ba),呈现下降趋势gydF4y2BaSox9gydF4y2BamRNA和gydF4y2BaRunx2gydF4y2Ba保持稳定(图2)gydF4y2Ba1 c, dgydF4y2Ba)。然而,荧光素酶在gydF4y2BaCol2a1gydF4y2BaTSS和上游的gydF4y2BaMmp13gydF4y2Ba与对照组相比,TSS没有变化(图2)。gydF4y2Ba6 bgydF4y2Ba)。接下来,我们检查了Sox9对每个报告基因活动的影响。Sox9过表达增加了基因中含有增强子的报告子的活性gydF4y2BaCol2a1gydF4y2Ba内含子1和6呈剂量依赖性。gydF4y2Ba6摄氏度gydF4y2Ba),但没有影响周围区域的活动gydF4y2BaCol2a1gydF4y2BaTSS和活动下降的上游区域gydF4y2BaMmp13gydF4y2BaTSS(图。gydF4y2Ba6摄氏度gydF4y2Ba)。此外,我们还共转染了Runx2和Sox9(图2)。gydF4y2Ba6 dgydF4y2Ba)。值得注意的是,当Sox9的量减少时,荧光素酶活性降低gydF4y2BaCol2a1gydF4y2Ba内含子6增强子通过Runx2共转染增加(图2)。gydF4y2Ba6 dgydF4y2Ba)。相比之下,当Sox9过表达时gydF4y2BaCol2a1gydF4y2Ba内含子1增强子不受Runx2转染的影响(图2)。gydF4y2Ba6 dgydF4y2Ba)。周围区域的活动gydF4y2BaCol2a1gydF4y2Ba转染Runx2而不转染Sox9, TSS升高(图2)。gydF4y2Ba6 dgydF4y2Ba)。gydF4y2Ba
一个gydF4y2BaCisGenome浏览器截图显示Runx2和参考参与周围gydF4y2BaCol2a1gydF4y2Ba(Chr15: 97,825,000−97,840,000)和gydF4y2BaMmp13gydF4y2Ba(Chr9: 7,265,000−7,280,000)。下图显示克隆到pGL4.10[luc]载体中的基因组区域。gydF4y2BabgydF4y2Ba暴露于不同浓度IL-1β的小鼠软骨细胞中荧光素酶增强区的活性。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba转染不同比例Runx2和Sox9或GFP对照的小鼠软骨细胞中荧光素酶增强区的活性。gydF4y2BaegydF4y2Ba软骨细胞荧光素酶增强区的活性gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero Cntl),gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero cKO),gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo cKO)小鼠有或没有IL-1β暴露。gydF4y2BangydF4y2Ba= 3 (gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba生物学上独立的实验。数据显示平均值±SD。n不显著。gydF4y2Ba#gydF4y2BaPgydF4y2Ba与对照组(白色条)相比< 0.05 (gydF4y2BabgydF4y2Ba), *gydF4y2BaPgydF4y2Ba< 0.05 (gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba);采用土耳其事后检验进行单因素方差分析。RLA相对荧光素酶活性。gydF4y2Ba
我们进一步使用有或没有IL-1β暴露的四种基因型的软骨细胞进行荧光素酶测定。的相对荧光素酶活性gydF4y2BaCol2a1gydF4y2Ba与原代软骨细胞相比,每种基因型的炎症软骨细胞中的内含子1和6增强子减少(图2)。gydF4y2Ba6 egydF4y2Ba),结果如图2所示。gydF4y2Ba6 bgydF4y2Ba.的荧光素酶活性gydF4y2BaCol2a1gydF4y2Ba内含子1和6增强子,以及gydF4y2BaCol2a1gydF4y2Ba与其他基因型相比,TSS在R2-Homo cKO小鼠的炎症软骨细胞中被抑制(图2)。gydF4y2Ba6 egydF4y2Ba)。与对照组相比,gydF4y2BaRunx2gydF4y2Ba杂合子或纯合子敲除会降低含有基因上游区域的报告基因的活性gydF4y2BaMmp13gydF4y2Ba原发性和炎症软骨细胞中的TSS(图2)。gydF4y2Ba6 dgydF4y2Ba)。综上所述,目前的结果表明Runx2可以激活gydF4y2BaCol2a1gydF4y2Ba转录通过内含子6中的增强子,除了内含子1中的增强子和周围的区域gydF4y2BaCol2a1gydF4y2BaTSS。gydF4y2Ba
Runx3表达增强抑制手术诱导的OA发展gydF4y2Ba
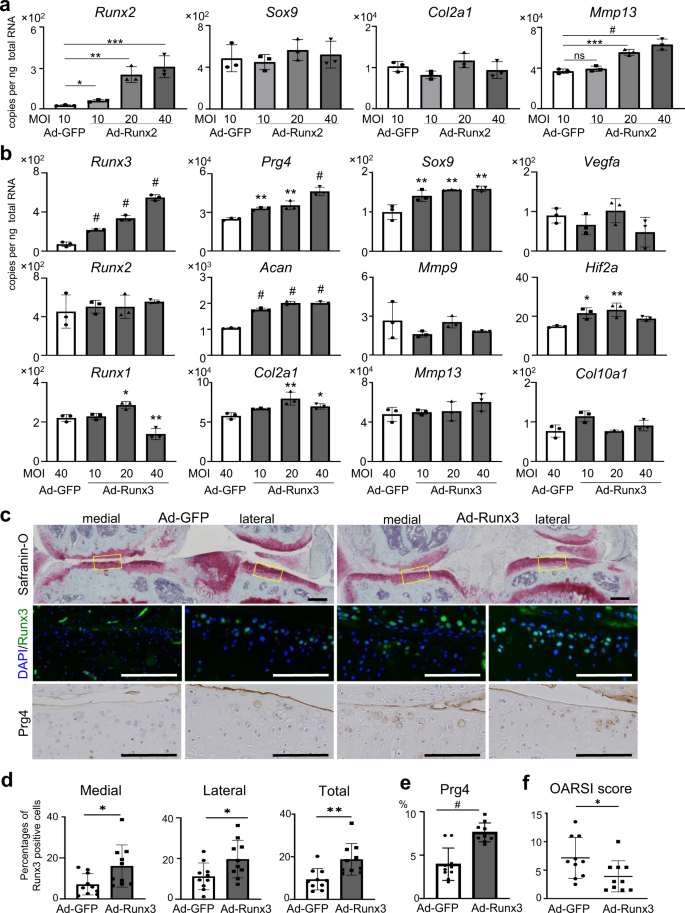
最后,我们在体外和体内研究了腺病毒Runx2或Runx3过表达的影响。不同剂量的Runx2腺病毒(Ad-Runx2)对WT软骨细胞的转导增加gydF4y2BaRunx2gydF4y2Ba以剂量依赖的方式表达(图2)。gydF4y2Ba7一个gydF4y2Ba)。尽管mRNA水平gydF4y2BaSox9gydF4y2Ba和gydF4y2BaCol2a1gydF4y2Ba持平,gydF4y2BaMmp13gydF4y2Ba在Runx2过表达的软骨细胞中表达上调(图2)。gydF4y2Ba7一个gydF4y2Ba)。gydF4y2Ba
一个gydF4y2BamRNA水平gydF4y2BaRunx2gydF4y2Ba,gydF4y2BaSox9gydF4y2Ba,gydF4y2BaCol2a1gydF4y2Ba,gydF4y2BaMmp13gydF4y2Ba在WT原代软骨细胞中,腺病毒诱导过表达GFP (Ad-GFP)或Runx2 (Ad-Runx2)。gydF4y2BabgydF4y2Ba腺病毒载体介导GFP (Ad-GFP)或Runx3 (Ad-Runx3)转导的初代关节软骨细胞中Runx家族成员和标记基因的mRNA水平gydF4y2BacgydF4y2Ba在关节内给药Ad-GFP或Ad-Runx3后,WT膝关节骨性关节炎发生后的红花素- o染色和Runx3/Prg4表达。显示每组10只小鼠的代表性图像。所有小鼠在8周龄时进行内侧造模手术,关节内给药10µL 1 × 10gydF4y2Ba9gydF4y2Ba在术后1、4、7周检测斑块形成单位/ mL Ad-GFP或Ad-Runx3。Safranin-O染色的插图框表示免疫荧光区域。标尺表示200 μm。gydF4y2BadgydF4y2Ba膝关节内侧、外侧和两侧runx3阳性细胞的比例。gydF4y2BaegydF4y2Ba3,3 ' -二氨基联苯胺(DAB)阳性区域占红花素- o阳性区域的百分比。gydF4y2BafgydF4y2BaOARSI评分用于评估两组间OA的发展。数据以点图和生物依赖性小鼠的平均值±SD表示(gydF4y2BangydF4y2Ba= 3 forgydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BangydF4y2Ba= 10gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.0001;Dunnett多重比较检验的普通方差分析gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba和双尾曼-惠特尼gydF4y2BaUgydF4y2Ba测试gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba.gydF4y2Ba
当我们将不同剂量的Runx3腺病毒转导到WT小鼠的原代软骨细胞时,gydF4y2BaPrg4gydF4y2Ba呈剂量依赖性增加(图2)。gydF4y2Ba7 bgydF4y2Ba)。gydF4y2Ba能gydF4y2Ba和gydF4y2BaSox9gydF4y2Ba也因Runx3过表达而增加(图3)。gydF4y2Ba7 bgydF4y2Ba)。分解代谢因子除了略有增加外,没有变化gydF4y2BaHif2agydF4y2Ba(无花果。gydF4y2Ba7 bgydF4y2Ba)。接下来,我们将GFP或Runx3腺病毒载体引入8周龄接受手术诱导的WT小鼠膝关节内侧模型。关节内注射腺病毒可有效增强Runx3的表达,从而显著抑制OA的进展,增强Prg4的表达(图2)。gydF4y2Ba七氟gydF4y2Ba)。gydF4y2Ba
讨论gydF4y2Ba
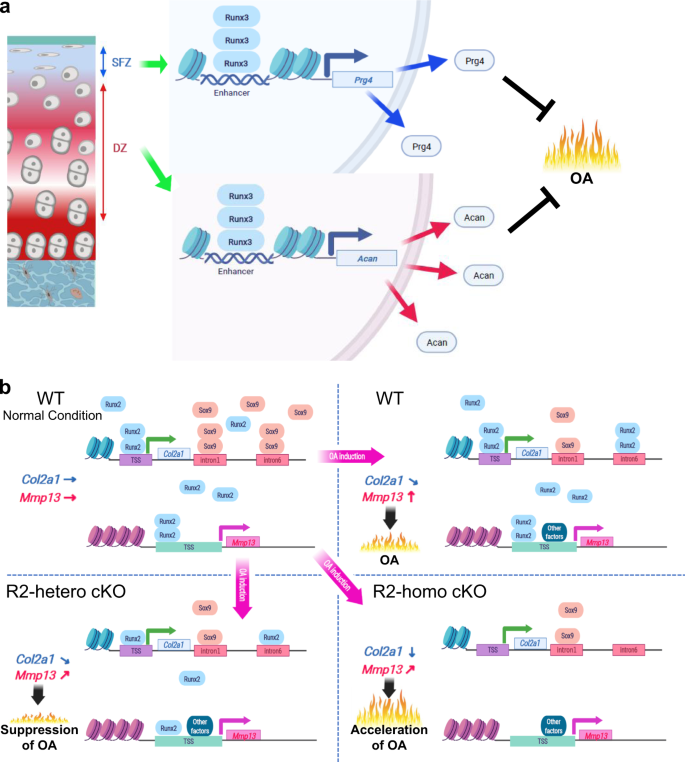
本研究发现,Runx3通过细胞外基质蛋白的产生保护手术诱导小鼠OA模型的关节软骨降解,而Runx2在炎症条件下同时发挥分解代谢和合成代谢作用(图2)。gydF4y2Ba8gydF4y2Ba)。体外综合分析Runx3的转录调控表明其与细胞外基质的组织有关,并得到鉴定gydF4y2BaPrg4gydF4y2Ba在SFZ中作为转录靶基因,而在DZ中作为潜在靶基因的Acan(图2)。gydF4y2Ba2 gydF4y2Ba和gydF4y2Ba5克ydF4y2Ba)。与以往的研究一致,软骨细胞特异性杂合敲除Runx2抑制OA并降低gydF4y2BaMmp13gydF4y2Ba表达式(无花果。gydF4y2Ba3.gydF4y2Ba)。值得注意的是,相比之下,纯合敲除gydF4y2BaRunx2gydF4y2Ba关节软骨细胞明显加速骨性关节炎的发展,并伴有抑制gydF4y2BaCol2a1gydF4y2Ba蛋白质水平。体外Runx2的功能丧失减少gydF4y2BaCol2a1gydF4y2Ba仅在炎症软骨细胞中Sox9降低(图2)。gydF4y2Ba4gydF4y2Ba),而gydF4y2BaMmp13gydF4y2Ba原发软骨细胞和炎症软骨细胞的表达均下调。在IL-1β的存在下,Runx2与已知sox9结合位点周围区域的新生结合增强(图2)。gydF4y2Ba5克ydF4y2Ba)。荧光素酶测定表明Runx2可以补偿gydF4y2BaCol2a1gydF4y2Ba炎症软骨细胞中的转录(图2)。gydF4y2Ba6gydF4y2Ba)。Runx2过表达增加gydF4y2BaMmp13gydF4y2Ba,但不是gydF4y2BaCol2a1gydF4y2Ba.相反,Runx3过表达增加gydF4y2BaPrg4gydF4y2Ba和gydF4y2Ba能gydF4y2Ba,关节内注射Runx3腺病毒可抑制手术诱导的OA(图3)。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
在本研究中,纯合子的OA发育增强gydF4y2BaRunx2gydF4y2Ba基因敲除小鼠。这一发现挑战了先前直接或间接表明Runx2在关节软骨中的分解代谢作用的研究结果gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba.补偿的gydF4y2BaCol2a1gydF4y2Ba在手术诱导的OA模型中,在炎症条件下,使用R2-Homo cKO小鼠观察到Runx2的表达,而不是R2-Hetero cKO小鼠。这种效果在以往对一般杂合敲除小鼠的研究中并不明显gydF4y2Ba31gydF4y2Ba或gydF4y2BaAggrecan-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠在其中的效率gydF4y2BaRunx2gydF4y2Ba击倒率约为50%gydF4y2Ba32gydF4y2Ba.考虑到gydF4y2BaRunx2gydF4y2Ba在R2-Homo cKO小鼠中,Runx2的抑制率约为80%gydF4y2BaMmp13gydF4y2Ba转录)可能能够维持gydF4y2BaCol2a1gydF4y2Ba炎症条件下的转录。尽管Runx2的合成代谢作用不如分解代谢作用突出,但在Sox9表达减少的病理状态下,它可能有助于关节软骨的内稳态。gydF4y2Ba
Col2a1gydF4y2Ba表情没有变化gydF4y2BaRunx2gydF4y2Ba纯合子敲除在原代软骨细胞中,但在炎症软骨细胞中减少(图2)。gydF4y2Ba4gydF4y2Ba)。这些数据也得到了体内实验的支持,表明Col2a1蛋白在R2-Homo cKO小鼠的假关节中没有减少,但在OA关节中明显减少(图2)。gydF4y2Ba3 d, egydF4y2Ba)。许多先前的研究表明,Sox9是主要负责的转录诱导gydF4y2BaCol2a1gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,而Sox9的表达在OA发展早期下降(图2)。gydF4y2Ba1gydF4y2Ba)。这些数据唤起了我们的假设,即Runx2可能会持续下去gydF4y2BaCol2a1gydF4y2Ba炎症条件下Sox9表达减少。ChIP-seq和荧光素酶检测结果表明,该增强子在gydF4y2BaCol2a1gydF4y2Ba内含子6同时包含Sox9和Runx2共识基序,可被两种转录因子激活(图2)。gydF4y2Ba6 c, dgydF4y2Ba)。增强子的荧光素酶活性受到Sox9量的严格调控,并随着Sox9表达的降低而受到抑制(图2)。gydF4y2Ba6摄氏度gydF4y2Ba)。有趣的是,虽然Runx2和Sox9共转染并没有增强内含子6增强子的活性,但当Sox9降低时,Runx2的活性显著上调(图2)。gydF4y2Ba6 dgydF4y2Ba)。因此,内含子6增强子可能在转录调控中更为重要gydF4y2BaCol2a1gydF4y2BaSox9和Runx2比内含子1增强子强。以前的研究也表明,内含子6区域是一个功能增强子gydF4y2BaCol2a1gydF4y2Ba基因gydF4y2Ba8gydF4y2BaSox9与内含子6增强子的交互作用强于与内含子1增强子的交互作用gydF4y2Ba8gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.这些数据与我们的假设一致,但我们无法进一步评估Runx2/Sox9与这些增强子结合的生物学效应大小。考虑到荧光素酶报告基因检测通常与体内数据不匹配,有必要使用基因组编辑的小鼠进行OA模型实验,其中这些增强子发生突变,以进一步了解。gydF4y2Ba
在本研究中,我们无法进一步阐明Runx2蛋白是如何维持的gydF4y2BaCol2a1gydF4y2BaSox9蛋白减少时的转录。先前的报告显示,通过ChIP-seq在肋骨软骨细胞的前2000个Sox9峰中显著富集TG(T/C)GGT基序gydF4y2Ba12gydF4y2Ba这表明(1)Sox9与TG(T/C)GGT序列直接结合,(2)其周围区域结合,或(3)通过与Runx2相互作用间接结合。CisGeonme浏览器放大视图分析支持第二个想法,因为Runx2峰值集中在gydF4y2BaCol2a1gydF4y2Ba内含子1和6距离sox9结合位点约100bpgydF4y2Ba8gydF4y2Ba,gydF4y2Ba12gydF4y2Ba(补充图。gydF4y2Ba13gydF4y2Ba)。在炎症软骨细胞中,新生的Runx2与sox9结合区域的结合增强(图2)。gydF4y2Ba5克gydF4y2Ba)。在炎症条件下,内源性Sox9的表达减少以及随后Sox9与其共识基序的结合减少可能导致Runx2接近位于Sox9基序附近的Runx基序。这一假设也可以解释为什么Runx2过表达不增加mRNA水平gydF4y2BaCol2a1gydF4y2Ba当内源性Sox9充分表达时(图2)。gydF4y2Ba7一个gydF4y2Ba)。与Runx3和Runx1相反,Runx2可能仅在致病性条件下支持软骨合成代谢。gydF4y2Ba
本研究的ChIP-seq和RNA-seq结果显示Runx2和Runx3的不同靶基因。然而,由于Runx家族成员具有共同的共识基序,我们无法确定Runx2和Runx3如何区分各自的靶基因的分子机制。值得注意的是,骨性关节炎发生过程中这两种蛋白在关节软骨中的表达模式是不同的(图2)。gydF4y2Ba1gydF4y2Ba)。Runx3在所有软骨层中表达,在OA发育过程中表达减少,而Runx2在DZ中表达,并在OA发育过程中持续表达(图2)。gydF4y2Ba1gydF4y2Ba)。这些表达差异与我们的假设是一致的,但并不能解释其靶基因特异性的差异。各种因素,如每个Runx蛋白的基因和辅助因子的表观基因组调控,可能定义Runx2-或runx3特异性靶基因的转录激活。gydF4y2Ba
在关节软骨细胞中,Runx3诱导具有代表性的软骨基质基因;gydF4y2BaPrg4gydF4y2Ba.润滑素/Prg4是一种粘蛋白样的o键糖基化蛋白,在关节软骨中起边界润滑剂的作用,以减少磨损和摩擦,润滑素在软骨表面的积累对关节的内稳态很重要gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba63gydF4y2Ba.在本研究中,体内和体外实验均表明,Prg4在Runx3缺乏和Aggrecan/Acan的作用下下调,起到减震器的作用gydF4y2Ba64gydF4y2Ba主要表达于DZgydF4y2Ba65gydF4y2Ba也是Runx3的候选转录靶点(图2)。gydF4y2Ba2 gydF4y2Ba和gydF4y2Ba5克ydF4y2Ba)。与这些合成代谢作用相反,Runx3缺乏并没有改变Mmp13的表达或关节软骨蛋白多糖的释放(图2)。gydF4y2Ba2 gydF4y2Ba)。软骨细胞肥大和细胞凋亡也未见改变gydF4y2BaRunx3gydF4y2Ba(补充图:gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba)这些数据表明Runx3不直接影响软骨降解或软骨细胞存活的调节。ChIP-seq和RNA-seq结果鉴定gydF4y2BaMmp9gydF4y2Ba作为Runx3的靶标(图3)。gydF4y2Ba5度gydF4y2Ba);然而,通过qPCR和免疫组织化学无法获得一致的Mmp9数据(图2)。gydF4y2Ba2 gydF4y2Ba)。虽然我们没有检查其他候选基因,如gydF4y2Ba创新领导力gydF4y2Ba和gydF4y2BaIbspgydF4y2Ba,它们可能作为Runx3的下游分子在关节软骨的调控中发挥一定作用。gydF4y2Ba
Mmp13gydF4y2Ba归纳法似乎更直接。在本研究中,gydF4y2BaMmp13gydF4y2Ba纯合子和杂合子敲除均可抑制诱导gydF4y2BaRunx2gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba),同时,它不受Runx3的影响。这些结果表明Runx2直接调控gydF4y2BaMmp13gydF4y2Ba转录,如以前的报告所示gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba.虽然Runx2激活了上游的荧光素酶活性gydF4y2BaMmp13gydF4y2Ba在TSS中,Runx2峰没有我们预期的那么大(图2)。gydF4y2Ba6gydF4y2Ba)。很明显,gydF4y2BaMmp13gydF4y2Ba转录受多种信号通路和Runx2以外的分子调控。gydF4y2BaMmp13gydF4y2Ba暴露于IL-1β以剂量和时间依赖的方式增加,而不增加内源性gydF4y2BaRunx2gydF4y2Ba表达式(无花果。gydF4y2Ba1 c, dgydF4y2Ba)。我们之前报道过NF-κB、HIF-2α、Notch信号及其下游因子Hes1是Mmp13的有效诱导剂gydF4y2Ba24gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba.Runx2过表达也通过丝裂原激活的蛋白激酶途径间接诱导MMP13gydF4y2Ba17gydF4y2Ba.考虑到Mmp13被抑制gydF4y2BaRunx2gydF4y2Ba部分基因敲除(图2)。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba), Runx2必须与的归纳相关联gydF4y2BaMmp13gydF4y2Ba转录;然而,其效应大小仍然未知。gydF4y2Ba
综上所述,本研究揭示了Runx3对创伤后OA关节软骨具有保护作用,而Runx2在炎症条件下对关节软骨具有合成代谢和分解代谢作用。Prg4和Acan可能是Runx3合成代谢作用的主要介质,而Runx3不影响软骨分解代谢。Runx2诱发gydF4y2BaMmp13gydF4y2Ba,而它补偿减少gydF4y2BaCol2a1gydF4y2Ba炎症条件下关节软骨细胞中Sox9表达减少。我们关于Runx3的合成代谢作用和Runx2对软骨细胞的多种调节的发现可能有助于理解OA的病理生理。gydF4y2Ba
方法gydF4y2Ba
动物gydF4y2Ba
所有动物实验均由东京大学动物保护和使用委员会授权和批准。我们遵守了所有相关的道德规范。在每个实验中,我们比较了维持在C57BL/6J背景下的窝仔的基因型。gydF4y2BaRunx2gydF4y2Ba-floxed小鼠携带条件gydF4y2BaRunx2gydF4y2Ba具有外显子4的等位基因,编码Runt结构域,两侧是loxP位点。外显子4的缺失也引起移码并破坏了外显子5后的Runx2蛋白。gydF4y2BaRunx2gydF4y2Baflox-neogydF4y2Ba将小鼠与翻转酶重组酶靶(FRT)转基因小鼠杂交以消除新霉素盒。将阳性胚胎干细胞注入8细胞期胚胎,生成嵌合小鼠,随后与雌性C57BL/6 J杂交。这一步提供的杂合动物的floxed等位基因gydF4y2BaRunx2gydF4y2Ba(gydF4y2BaRunx2gydF4y2Baflox-neogydF4y2Ba)。这些小鼠与FRT转基因小鼠交配产生杂合子gydF4y2BaRunx2gydF4y2Ba(gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba),消除了frt -frank的新霉素耐药盒。gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba然后与老鼠杂交gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba生成gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba或gydF4y2BaRunx2gydF4y2Bafl / fgydF4y2Ba老鼠。然后,我们通过与CAG-Cre报告小鼠杂交来评估这些小鼠的靶向效率和特异性。gydF4y2Ba
Col2a1-CregydF4y2Ba老鼠gydF4y2Ba70gydF4y2Ba,gydF4y2BaRunx3gydF4y2Bafl / fgydF4y2BalgydF4y2Ba老鼠gydF4y2Ba46gydF4y2Ba,gydF4y2BaPrg4-CregydF4y2BaERT2gydF4y2Ba老鼠gydF4y2Ba48gydF4y2Ba都是从杰克逊实验室购买的gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba老鼠gydF4y2Ba47gydF4y2Ba由陈迪教授(Rush University Medical Center, Chicago, IL, USA)慷慨提供。生成gydF4y2BaCol2a1-Cre;Runx3gydF4y2Bafl / flgydF4y2Ba老鼠,gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba老鼠与gydF4y2BaCol2a1-CregydF4y2Ba获得小鼠gydF4y2BaCol2a1-Cre;Runx3gydF4y2Bafl / +gydF4y2Ba老鼠,然后与gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba老鼠。gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;Runx3gydF4y2Bafl / flgydF4y2Ba老鼠和gydF4y2BaPrg4-CregydF4y2BaERT2gydF4y2Ba;Runx3gydF4y2Bafl / flgydF4y2Ba老鼠也以同样的方式被制造出来。生成gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠,gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠与gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba获得小鼠gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba老鼠,然后与gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠。后生成gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba他们与老鼠交配gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba获得小鼠gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero Cntl)gydF4y2Ba, Col2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / +gydF4y2Ba(R2-Hetero cKO),gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo Cntl)和gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba(R2-Homo cKO)小鼠,用于实验。gydF4y2Ba
Runx2-Biotin-3xFLAGgydF4y2Ba-knockin小鼠(Runx2-FLAG小鼠),其中Biotin-3×FLAG标签插入到gydF4y2BaRunx2gydF4y2Ba产生Runx2-Biotin-3×FLAG融合蛋白,是由其中一位合著者(Hojo, et al.)产生的。gydF4y2Ba54gydF4y2Ba)。引物基因分型序列见补充表gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
OA实验gydF4y2Ba
我们使用三种模型进行OA实验。对于中间模型gydF4y2Ba41gydF4y2Ba7周龄雄性小鼠每天腹腔注射他莫昔芬(100 μg / g体重)5 d, 8周龄手术。然后在8周龄时进行手术。在全身麻醉下,手术显微镜下切除内侧副韧带和内侧半月板gydF4y2Ba41gydF4y2Ba.对于DMM模型gydF4y2Ba45gydF4y2Ba他莫昔芬(每克体重100 μg);Sigma-Aldrich, St Louis, MO, USA)每天向15周龄雄性小鼠腹腔注射5天,并在16周龄时进行手术,根据先前的报告gydF4y2Ba45gydF4y2Ba.小鼠术后8周和12周进行分析gydF4y2BaRunx3gydF4y2Ba-敲除小鼠或gydF4y2BaRunx2gydF4y2Ba-敲除小鼠。衰老模型在小鼠2、6、12月龄时注射他莫昔芬5天,生理条件下饲养至18月龄。所有小鼠在相同条件下饲养(每笼3只)。骨性关节炎严重程度由国际骨关节炎研究学会(OARSI)系统量化gydF4y2Ba71gydF4y2Ba,由两名对实验组不知情的观察者进行评估。gydF4y2Ba
组织学分析gydF4y2Ba
在安乐死后不久进行灌注固定。组织样品用4%多聚甲醛在4°C的磷酸盐缓冲盐水(PBS, pH 7.4)中固定1天。用10%乙二胺四乙酸(EDTA, pH 7.4)在4℃下脱钙2周,石蜡包埋,切成4 μm厚的矢状切片。按照标准方案进行红花素- o染色。免疫组织化学切片用以下抗体孵育:Runx3 (ab135248, Abcam, Cambridge, UK)、Runx2 (ab192256, Abcam)、Runx1 (ab23980, Abcam)、Col2a1 (MAB8887, Merck, Darmstadt, Germany)、Col10a1 (14-9771-80, Invitrogen, Carlsbad, CA, USA)、Acan (13880-1-AP, Proteintech, Rosemont, IL, USA)、Prg4 (ab28484, Abcam)、Mmp13 (18165-1-AP, Proteintech)、Mmp9 (ab38898, Abcam)和Sox9 (ab185230, Abcam)。为了可视化,3,3 ' -二氨基联苯胺(DAB;使用的是日本京都的Nakaraitesk。根据制造商的说明,使用原位细胞死亡检测试剂盒(Roche, Basel, Switzerland)进行tdt介导的dUTP镍端标记(TUNEL)染色。组织学分析至少进行三次,每组或基因型使用3 - 5只小鼠以确认结果。在荧光显微镜下观察图像(BZ-X710, Keyence,大阪,日本)。 Percentages of positive cells and DAB-positive areas were measured by BZ analyzer software (Keyence) and NDPscan (Hamamatsu Photonics, Hamamatsu, Japan), respectively. The following parameters were used in the software: Pixel Area = 4.86E-08, Hue Value = 0.1, Hue Weight = 0.5, and Color Saturation Threshold = 0.04. We defined the strong intensity threshold as 0 − 100, medium as 100−175, and weak as 175−220 in the algorithm input. After margining the Safranin-O-positive articular cartilage area of lateral and medial sides of tibial and femoral joints by referring to the nearest slide, we evaluated areas strongly positive for Col2a1, and medium to strongly positive areas for Mmp13, respectively. We also counted numbers of Runx2/Sox9 medium/strong-positive cells. For quantification, we selected six samples exhibiting average OA development in each group.
细胞培养gydF4y2Ba
用胶原酶D (Roche, Basel, Switzerland)从5日龄C57BL/6J小鼠中分离原代关节软骨细胞。gydF4y2Ba45gydF4y2Ba,在Dulbecco 's Modified Eagle 's Medium (DMEM)中培养;Wako,大阪,日本),含10%胎牛血清。每3天更换一次培养基。SFZ细胞的分离方法如前所述gydF4y2Ba72gydF4y2Ba.简单地说,从5日龄小鼠身上解剖股骨近端和胫骨远端,并切除韧带和肌腱。软骨组织用0.25%胰蛋白酶(Thermo Fisher Scientific, Waltham, MA, USA)孵育1小时,然后用173 U/mL I型胶原酶(Worthington Biochemical Corporation, Lakewood, NJ, USA)消化1.5小时。用43 U/ml I型胶原酶消化残余骺软骨组织5 h分离DZ细胞。分离的细胞接种在纤维连接蛋白包被的培养皿上。细胞用含10%胎牛血清的DMEM培养。在所有实验中,细胞均为单层培养。2 μM -羟基他莫昔芬(Sigma-Aldrich)作用48 h,诱导Cre在培养细胞中重组。开始孵育24小时后加入IL-1β。gydF4y2Ba
外植体的文化gydF4y2Ba
对于离体培养,在出生后第1天从Hetero Cntl、Hetero cKO、Homo Cntl和Homo cKO小鼠身上去除股骨头软骨。然后将股骨头培养在含有10%胎牛血清,含或不含1 ng/μL IL-1β的DMEM中(AF-200-01B, PeproTech, Rocky Hill, NJ, USA)。每3天更换一次培养基,总培养周期为2周。右股颅骨用于组织学分析,左股颅骨使用Trizol试剂(15596-018,Life Technologies, Carlsbad, CA, USA)均质,进行qRT-PCR。gydF4y2Ba
中存在gydF4y2Ba
总RNA用RNeasy Mini Kit (Qiagen, Hilden, Germany)纯化。使用ReverTraAce qPCR RT Master Mix with gDNA Remover (Toyobo, Osaka, Japan)对1微克总RNA进行逆转录。每个PCR反应含有1 × THUNDERBIRD SYBR qPCR Mix (Toyobo), 0.3 mM特异性引物,25 ng cDNA。拷贝数归一化为啮齿动物总RNA (thermofisher Scientific, Waltham, MA, USA),用啮齿动物甘油醛-3-磷酸脱氢酶(gydF4y2BaGapdhgydF4y2Ba),用作内部控制。所有的反应都进行了三次。引物序列见补充表gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
表达载体的构建gydF4y2Ba
用PCR扩增全长cDNA序列,克隆到pCMV-HA或pShuttle载体(Clontech)上。使用Adeno-X表达系统(Clontech)生成腺病毒载体。所有载体均经DNA测序验证。gydF4y2Ba
荧光素酶检测gydF4y2Ba
以小鼠基因组DNA为模板,通过PCR扩增Col2a1增强子位点(TSS上游、内含子1和内含子6)、Mmp13上游的TSS、Prg4和Acan,并将其克隆到PGL4.10 [luc2]载体(Promega, Tokyo, Japan)中。使用原代软骨细胞和双荧光素酶报告分析系统(Promega)进行荧光素酶测定。结果报告为萤火虫与雷尼拉活性的比值。克隆序列的位置见补充表gydF4y2Ba9gydF4y2Ba.gydF4y2Ba
1,9 -二甲基亚甲基蓝(DMMB)测定gydF4y2Ba
采用1,9 -二甲基亚甲基蓝(DMMB)法测定GAG含量gydF4y2Ba50gydF4y2Ba.裂解液(20 μL)与200 μL的DMMB (Sigma-Aldrich)工作液在室温下混合30 min。然后在525 nm处测量吸光度。硫酸软骨素(Sigma-Aldrich)作为标准品。gydF4y2Ba
ChIP-seqgydF4y2Ba
染色质制备和ChIP如前所述进行gydF4y2Ba9gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba73gydF4y2Ba,稍作修改。简而言之,5 × 10gydF4y2Ba7gydF4y2BaRunx2- flag小鼠的原代软骨细胞表达3 × flag标记的Runx2,加入或不加入1 ng/mL IL-1β 24小时,培养48小时。对于Runx3,我们使用来自WT小鼠的SFZ软骨细胞,这些小鼠经过脂肪感染(Lipofectamine 2000;赛默飞世尔科技公司)用表达3xflag标记Runx3的载体。简而言之,5 × 10gydF4y2Ba7gydF4y2Ba收集软骨细胞,用1%甲醛交联,然后用甘氨酸淬火。细胞裂解后,通过超声(Branson Digital Sonifier 250, Branson Ultrasonics Corporation Danbury, CT, USA)将染色质片段化,获得100-600 bp的DNA片段。片段化的DNA裂解液与Dynabeads M-280羊抗小鼠(Thermo Fisher Scientific)和抗体复合物在4°C下孵育过夜[anti-FLAG Clone M2 (Sigma-Aldrich)或抗小鼠IgG (Promega, Madison, WI, USA)]。用放射免疫沉淀测定缓冲液洗涤微球后,用洗脱缓冲液在65℃下洗脱DNA 15 min,并在65℃下孵育过夜进行反交联。使用ChIP DNA Clean和浓缩器(zimo Research, Irvine, CA, USA)纯化DNA。所有缓冲液均含有Complete EDTA-Free蛋白酶抑制剂鸡尾酒(Roche)。ChIP-seq文库的构建使用ThruPLEXFD Prep Kit (Takara Bio, Kusatsu, Japan)。文库在HiSeq2000 (Illumina, San Diego, CA, USA)平台上测序。gydF4y2Ba
超级计算资源由XXX提供。DNA序列信息通过领结比对器与未被掩盖的小鼠基因组参考序列mm9比对gydF4y2Ba74gydF4y2Ba.使用CisGenome软件v2.0(35)进行双样本分析,峰召唤gydF4y2BaPgydF4y2Ba值截断为1 × 10gydF4y2Ba−5gydF4y2Ba与输入控制相比。错误发现率<0.01的峰被纳入进一步分析。使用在线GREAT GO程序进行GREAT GO分析,版本3.0.0gydF4y2Ba52gydF4y2Ba.每个峰类别在全基因组背景下用组装mm9运行。用MEME-ChIP进行从头基序恢复gydF4y2Ba52gydF4y2Ba.从mm9中提取峰中心周围的100 bp区域并用于分析。原始和处理过的数据可在Gene Expression Omnibus数据库中获得,其登录号为“gydF4y2BaGSE157328gydF4y2Ba"和"gydF4y2BaGSE165086gydF4y2Ba”。峰值数据与gydF4y2BaGSM1692996gydF4y2Ba”、“gydF4y2BaGSM1692997gydF4y2Ba”、“gydF4y2BaGSM1693001gydF4y2Ba”、“gydF4y2BaGSM1693003gydF4y2Ba,和gydF4y2BaGSM1693005gydF4y2Ba”gydF4y2Ba11gydF4y2Ba.gydF4y2Ba
RNA-seqgydF4y2Ba
对于Runx3,从5日龄的SFZ/DZ软骨细胞中收集RNA样本gydF4y2BaCol2a1-Cre;Runx3gydF4y2Bafl / flgydF4y2Ba和gydF4y2BaRunx3gydF4y2Bafl / flgydF4y2Ba老鼠(gydF4y2BangydF4y2Ba= 3)。对于Runx2,从5日龄的原代软骨细胞中收集RNA样本gydF4y2BaCol2a1-CregydF4y2BaERT2gydF4y2Ba;gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba和gydF4y2BaRunx2gydF4y2Bafl / flgydF4y2Ba老鼠(gydF4y2BangydF4y2Ba分别= 2),然后用含或不含1 ng/μL IL-1β的4-羟他莫昔芬孵育24h。在BGIseq-500(华大基因,香港,中国)上进行RNA-seq,产生100 bp的成对末端reads,并将其定位到小鼠基因组(mm9)。应用分位数归一化,并将读取计数转换为每百万次log2计数。线性模型用于检测缺陷样本和对照样本之间的表达差异。原始和处理过的数据可在Gene Expression Omnibus数据库中获得,其登录号为“gydF4y2BaGSE157433gydF4y2Ba"和"gydF4y2BaGSE165084gydF4y2Ba”。gydF4y2Ba
关节内给药腺病毒载体gydF4y2Ba
我们在关节内给药含有Runx3或GFP的腺病毒载体。OA术后1、4、7周注射3次。每次给药,我们注射10µL的1 × 10gydF4y2Ba9gydF4y2Ba在PBS中稀释的腺病毒载体溶液的斑块形成单位。gydF4y2Ba
统计和可重复性gydF4y2Ba
使用Prism version 8.4.1 (GraphPad Software, San Diego, CA, USA)分析结果。双尾Mann-WhitneygydF4y2BaUgydF4y2Ba采用检验确定两组间的差异有统计学意义。采用土耳其事后检验的单因素方差分析来确定三个以上组的统计学显著性。多组间的剂量或时间过程比较采用单因素方差分析和Dunnett多重比较检验。gydF4y2BaPgydF4y2Ba低于0.05的值被认为是显著的。生物学上独立的样本数显示在图表和图例中。显微图显示各组的代表性图像。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
原始和处理过的数据可在Gene Expression Omnibus数据库中获得,其登录号为“gydF4y2BaGSE157328gydF4y2Ba"和"gydF4y2BaGSE165086gydF4y2BaChIP-seq。的峰值数据gydF4y2BaGSM1692996gydF4y2Ba”、“gydF4y2BaGSM1692997gydF4y2Ba”、“gydF4y2BaGSM1693001gydF4y2Ba”、“gydF4y2BaGSM1693003gydF4y2Ba,和gydF4y2BaGSM1693005gydF4y2Ba,是前一份报告中使用的gydF4y2Ba12gydF4y2Ba.”gydF4y2BaGSE157433gydF4y2Ba"和"gydF4y2BaGSE165084gydF4y2BaRNA-seq。gydF4y2Ba源数据gydF4y2Ba都提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
埃默里,c.a.等。建立早期膝关节骨关节炎的预后指标。gydF4y2BaNat, Rev. Rheumatol。gydF4y2Ba15gydF4y2Ba, 438-448(2019)。gydF4y2Ba
Gupta, S., Hawker, G. A., Laporte, A., Croxford, R.和Coyte, P. C.:从患有这种疾病的个体的角度来看,致残性髋关节和膝关节骨关节炎(OA)的经济负担。gydF4y2Ba风湿病学gydF4y2Ba44gydF4y2Ba, 1531-1537(2005)。gydF4y2Ba
Yoshimura, N.等。日本男性和女性膝关节骨关节炎、腰椎病和骨质疏松症的患病率:骨关节炎/骨质疏松症对残疾的研究gydF4y2BaJ. Bone Min. Metab。gydF4y2Ba27gydF4y2Ba, 620-628(2009)。gydF4y2Ba
Muraki, S.等。基于人群队列的老年患者的职业活动与膝骨关节炎和腰椎病的相关性:一项大规模的基于人群的研究。gydF4y2Ba关节炎感冒。gydF4y2Ba61gydF4y2Ba; 779-786(2009)。gydF4y2Ba
李,D. K.等。分泌的糖蛋白润滑素保护软骨表面,抑制滑膜细胞过度生长。gydF4y2Baj .中国。Investig。gydF4y2Ba115gydF4y2Ba, 622-631(2005)。gydF4y2Ba
杰,g.d.等。缺乏润滑的腹泻关节的摩擦和磨损之间的关系。gydF4y2Ba关节炎感冒。gydF4y2Ba56gydF4y2Ba, 3662-3669(2007)。gydF4y2Ba
Mokuda, S.等。Wwp2通过调节Adamts5维持软骨稳态。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 2429(2019)。gydF4y2Ba
Yasuda, H, Oh, C. D, Chen, D. de Crombrugghe, B.和Kim, J. H.通过内含子6中sox9依赖性增强子调控II型胶原表达的新机制。gydF4y2Ba生物。化学。gydF4y2Ba292gydF4y2Ba, 528-538(2017)。gydF4y2Ba
高德林,M. B.和Marcu, K. B.软骨内稳态在健康和风湿病中的作用。gydF4y2Ba关节炎。gydF4y2Ba11gydF4y2Ba, 224(2009)。gydF4y2Ba
毕文明,邓建明,张志平,Behringer, R. R.和de Crombrugghe, B.软骨形成需要Sox9。gydF4y2BaNat,麝猫。gydF4y2Ba22gydF4y2Ba, 85-89(1999)。gydF4y2Ba
Akiyama, H., Chaboissier, M. C, Martin, J. F, Schedl, A.和de Crombrugghe, B.转录因子Sox9在软骨细胞分化途径的连续步骤中起重要作用,并且是Sox5和Sox6表达所必需的。gydF4y2BaJ.骨矿工。Res。gydF4y2Ba17gydF4y2Ba, s142-s142(2002)。gydF4y2Ba
霍霍,何,X, H.和McMahon, A. P.哺乳动物软骨细胞中Sox9调控的不同转录程序。gydF4y2Ba细胞的代表。gydF4y2Ba12gydF4y2Ba, 229-243(2015)。gydF4y2Ba
转录因子SOX9和SOX5/SOX6通过超增强子在全基因组范围内合作驱动软骨形成。gydF4y2Ba核酸类。gydF4y2Ba43gydF4y2Ba, 8183-8203(2015)。gydF4y2Ba
欧阳,Y.等。SOX9的过表达在体外和体内均可缓解人类骨关节炎的进展。gydF4y2Ba药物Des, Devel Ther。gydF4y2Ba13gydF4y2Ba, 2833-2842(2019)。gydF4y2Ba
Wang, M.等。MMP13是骨关节炎进展过程中的关键靶基因。gydF4y2Ba关节炎。gydF4y2Ba15gydF4y2Ba, r5(2013)。gydF4y2Ba
利特尔,c.b.等。基质金属蛋白酶13缺陷小鼠对骨关节炎软骨侵蚀有抵抗力,但对软骨细胞肥大或骨赘发育没有抵抗力。gydF4y2Ba关节炎感冒。gydF4y2Ba60gydF4y2Ba, 3723-3733(2009)。gydF4y2Ba
Tetsunaga, T.等。RUNX-2转录因子对SW1353软骨细胞样细胞中机械应力诱导的MMP-13和ADAMTS-5表达的调控gydF4y2BaOsteoarthr。Cartil。gydF4y2Ba19gydF4y2Ba, 222-232(2011)。gydF4y2Ba
Takahashi, A.等。RUNX2 P1启动子的DNA甲基化介导软骨细胞中MMP13的转录。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 7771(2017)。gydF4y2Ba
Hirata, M.等。C/ ebp β和RUNX2在软骨细胞中以MMP-13为靶点,HIF-2alpha为诱导剂协同降解软骨。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba21gydF4y2Ba中文信息学报,1111-1123(2012)。gydF4y2Ba
Bau, B.等。人关节软骨细胞中胶原酶和聚集酶的相对信使RNA表达谱。gydF4y2Ba关节炎感冒。gydF4y2Ba46gydF4y2Ba, 2648-2657(2002)。gydF4y2Ba
Chang S. H.等。过度的机械负荷通过gremlin-1-NF-kappaB途径促进骨关节炎。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1442(2019)。gydF4y2Ba
Saito, T.等人。HIF-2alpha在骨骼生长和骨关节炎发展过程中对软骨内成骨的转录调控。gydF4y2BaNat,地中海。gydF4y2Ba16gydF4y2Ba, 678-686(2010)。gydF4y2Ba
Yang, S.等。缺氧诱导因子-2 α是骨关节炎软骨破坏的分解代谢调节剂。gydF4y2BaNat,地中海。gydF4y2Ba16gydF4y2Ba, 687-693(2010)。gydF4y2Ba
小林,H.等。Rela通过诱导抗凋亡和分解代谢靶基因对软骨细胞的双相调控。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 13336(2016)。gydF4y2Ba
Blyth, K, Cameron, E. r和Neil, J. C. RUNX基因:癌症中功能的获得或丧失。gydF4y2Ba奈特,癌症牧师gydF4y2Ba5克ydF4y2Ba, 376-387(2005)。gydF4y2Ba
福岛nakase, Y.等。急性髓系白血病/矮子相关转录因子分子在小鼠发育中通过c端亚域介导的共同和不同的作用gydF4y2Ba血gydF4y2Ba105gydF4y2Ba中文信息学报(英文版),2005)。gydF4y2Ba
Runx2:成骨细胞和软骨细胞分化的诱导剂。gydF4y2BaHistochem。细胞生物。gydF4y2Ba149gydF4y2Ba, 313-323(2018)。gydF4y2Ba
小森,T.等。由于成骨细胞的成熟阻滞,Cbfa1的靶向破坏导致骨形成完全缺乏。gydF4y2Ba细胞gydF4y2Ba89gydF4y2Ba, 755-764(1997)。gydF4y2Ba
奥托,F.等。Cbfa1是锁骨颅发育不良综合征的候选基因,对成骨细胞分化和骨发育至关重要。gydF4y2Ba细胞gydF4y2Ba89gydF4y2Ba, 765-771(1997)。gydF4y2Ba
王旭,等。RUNX2和FGF2对骨关节炎软骨中MMP-13表达的调控。gydF4y2BaOsteoarthr。Cartil。gydF4y2Ba12gydF4y2Ba, 963-973(2004)。gydF4y2Ba
Kamekura, S.等。侏儒相关转录因子2在诱导小鼠膝关节不稳定后骨关节炎发病中的作用。gydF4y2Ba关节炎感冒。gydF4y2Ba54gydF4y2Ba, 2462-2470(2006)。gydF4y2Ba
廖,等。在成年小鼠中,关节软骨细胞中Runx2的缺失可以减缓dmm诱导的骨关节炎的进展。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 2371(2017)。gydF4y2Ba
凯瑟琳,s.e.等。软骨细胞特异性RUNX2过表达加速成年小鼠创伤后骨关节炎进展。gydF4y2BaJ. Bone Min. Res。gydF4y2Ba34gydF4y2Ba, 1676-1689(2019)。gydF4y2Ba
Chen, D.等。Runx2在骨关节炎的发展中起着核心作用。gydF4y2Baj . .。Transl。gydF4y2Ba23gydF4y2Ba, 132-139(2019)。gydF4y2Ba
runx2依赖性骨发育的分子机制。gydF4y2Ba摩尔。细胞gydF4y2Ba43gydF4y2Ba中文信息学报,168-175(2020)。gydF4y2Ba
Kimura, A.等。Runx1和Runx2在胸骨形态形成过程中相互配合。gydF4y2Ba发展gydF4y2Ba137gydF4y2Ba; 1159-1167(2010)。gydF4y2Ba
廖,等。髁突软骨细胞中Runx2的缺失会破坏TMJ组织的稳态。gydF4y2Ba[j]细胞生理学。gydF4y2Ba234gydF4y2Ba, 3436-3444(2019)。gydF4y2Ba
Yano, F.等。Runx1通过增强软骨基质生成和抑制肥大分化来维持关节软骨。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba, 7666(2019)。gydF4y2Ba
Wigner, N. A, song do, Y., Einhorn, T. A., Drissi, H. & Gerstenfeld, L. C.软骨发育过程中Runx3在聚集蛋白表达调控中的功能作用。gydF4y2Ba[j]细胞生理学。gydF4y2Ba228gydF4y2Ba, 2232-2242(2013)。gydF4y2Ba
周忠,姚,B.和赵丹。Runx3通过控制参与软骨细胞增殖和分化的多个基因调控软骨细胞表型。gydF4y2Ba摩尔。杂志。代表。gydF4y2Ba47gydF4y2Ba, 5773-5792(2020)。gydF4y2Ba
Kamekura, S.等。膝关节不稳定诱导的新型实验性小鼠骨关节炎的发展。gydF4y2BaOsteoarthr。Cartil。gydF4y2Ba13gydF4y2Ba, 632-641(2005)。gydF4y2Ba
Jenei-Lanzl, Z., Meurer, A.和Zaucke, F.骨关节炎软骨细胞中白细胞介素-1 β信号传导的研究。gydF4y2Ba手机信号gydF4y2Ba53gydF4y2Ba, 212-223(2019)。gydF4y2Ba
周忠,杜丹,陈安,朱丽。il -1 β诱导小鼠骨性关节炎模型中关节软骨细胞环状RNA表达谱。gydF4y2Ba基因gydF4y2Ba644gydF4y2Ba, 20-26(2018)。gydF4y2Ba
Arra, M.等。软骨细胞中ldha介导的ROS生成是骨关节炎的潜在治疗靶点。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 3427(2020)。gydF4y2Ba
Gosset, M., Berenbaum, F., Thirion, S.和Jacques, C.小鼠软骨细胞的原代培养和表型。gydF4y2BaProtoc Nat。gydF4y2Ba3.gydF4y2Ba, 1253-1260(2008)。gydF4y2Ba
Naoe, Y.等。Runx/Cbf β结合il -4消音器抑制辅助性T型1细胞中的白细胞介素-4。gydF4y2BaJ.医学实验。gydF4y2Ba204gydF4y2Ba, 1749-1755(2007)。gydF4y2Ba
Chen, M.等。产生具有软骨细胞特异性和他莫昔芬诱导的Cre重组酶的转基因小鼠模型。gydF4y2Ba《创世纪》gydF4y2Ba45gydF4y2Ba, 44-50(2007)。gydF4y2Ba
Kozhemyakina, E.等。表达prg4的小鼠关节软骨祖细胞群的鉴定。gydF4y2Ba关节炎Rheumatol。gydF4y2Ba67gydF4y2Ba, 1261-1273(2015)。gydF4y2Ba
Glasson, S. S. S., Blanchet, T. J. & Morris, E. A.骨关节炎内侧半月板(DMM)模型在129/SvEv小鼠中的手术失稳。gydF4y2BaOsteoarthr。Cartil。gydF4y2Ba15gydF4y2Ba, 1061-1069(2007)。gydF4y2Ba
斯坦顿,H.等。研究adamts介导的小鼠软骨聚集蛋白溶解。gydF4y2BaProtoc Nat。gydF4y2Ba6gydF4y2Ba科学通报,388-404(2011)。gydF4y2Ba
麦克林,c.y.等。GREAT改进了顺式调控区域的功能解释。gydF4y2Ba生物科技Nat。》。gydF4y2Ba28gydF4y2Ba中文信息学报,495-501(2010)。gydF4y2Ba
贝利,t.l.等。模因套件:模因发现和搜索工具。gydF4y2Ba核酸类。gydF4y2Ba37gydF4y2Ba, w202-w208(2009)。gydF4y2Ba
Hojo, H., Ohba, S., He, X., Lai, L. P.和McMahon, a . P. Sp7/Osterix仅限于骨形成的脊椎动物,在那里它作为Dlx辅助因子在成骨细胞规范中起作用。gydF4y2BaDev细胞。gydF4y2Ba37gydF4y2Ba, 238-253(2016)。gydF4y2Ba
何晓明,郭强,李建平,李建平,等。Runx2调节染色质可及性以指导新生儿期成骨细胞程序。gydF4y2Ba细胞代表gydF4y2Ba.gydF4y2Ba40gydF4y2Ba, 111315年gydF4y2Bahttps://doi.org/10.1016/j.celrep.2022.111315gydF4y2Ba(2022)。gydF4y2Ba
Bhandari, R. K, Haque, M. M. & Skinner, M. K.睾丸决定因子SRY和SOX9下游结合靶点的全球基因组分析。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Ba, e43380(2012)。gydF4y2Ba
他,h.h.等等。核小体动力学定义转录增强子。gydF4y2BaNat,麝猫。gydF4y2Ba42gydF4y2Ba, 343-347(2010)。gydF4y2Ba
Zentner, G. E, Tesar, P. J. & Scacheri, P. C.表观遗传特征区分了具有不同细胞功能的多种增强子。gydF4y2Ba基因组Res。gydF4y2Ba21gydF4y2Ba, 1273-1283(2011)。gydF4y2Ba
Rada-Iglesias, A.等。一种独特的染色质特征揭示了人类早期发育增强子。gydF4y2Ba自然gydF4y2Ba470gydF4y2Ba, 279-283(2011)。gydF4y2Ba
Kim, t.k.等人。神经元活动调节增强子的广泛转录。gydF4y2Ba自然gydF4y2Ba465gydF4y2Ba, 182-187(2010)。gydF4y2Ba
刘霞,等。WNT16在小鼠TMJ骨关节炎早期表达上调,并通过调控RUNX2/MMP13级联保护纤维软骨细胞免受IL-1β诱导的炎症反应。gydF4y2Ba骨gydF4y2Ba143gydF4y2Ba, 115792(2021)。gydF4y2Ba
窦鹏,何勇,于斌,段杰。DNMT3B下调microRNA-29b通过PTHLH/CDK4/RUNX2轴减缓软骨细胞凋亡和骨关节炎进展。gydF4y2Ba老化gydF4y2Ba13gydF4y2Ba, 7676-7690(2020)。gydF4y2Ba
Chen, C. G., Thuillier, D., Chin, E. N.和Alliston, T.软骨细胞内在Smad3抑制runx2诱导的基质金属蛋白酶13的表达以维持关节软骨和预防骨关节炎。gydF4y2Ba关节炎感冒。gydF4y2Ba64gydF4y2Ba中文信息学报,3278-3289(2012)。gydF4y2Ba
Ikegawa, S., Sano, M., Koshizuka, Y.和Nakamura, Y.小鼠和人类PRG4(蛋白多糖4)基因的分离,表征和定位。gydF4y2Ba细胞基因。gydF4y2Ba90gydF4y2Ba, 291-297(2000)。gydF4y2Ba
Fraser, A.等。人类炎症性关节炎发病时软骨基质中II型胶原蛋白和聚集蛋白的转换:与全身和局部炎症介质的关系gydF4y2Ba关节炎感冒。gydF4y2Ba48gydF4y2Ba, 3085-3095(2003)。gydF4y2Ba
Mori, Y, Chung, U. I, Tanaka, S.和Saito, T.利用激光显微解剖组织标本的RNA测序测定成熟大鼠关节软骨浅层和深层区域的差异基因表达谱。gydF4y2Ba生物医学。Res。gydF4y2Ba35gydF4y2Ba, 263-270(2014)。gydF4y2Ba
黄,等。microrna miR-204和miR-211维持关节稳态并防止骨关节炎进展。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 2876(2019)。gydF4y2Ba
Nishimura, R.等。在软骨内成骨过程中,Osterix通过基质金属蛋白酶13 (MMP13)与转录因子Runx2的表达调控软骨基质的钙化和降解。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba中文信息学报,33179-33190(2012)。gydF4y2Ba
Hosaka, Y.等。软骨细胞中的Notch信号调节软骨内成骨和骨关节炎的发展。gydF4y2Ba自然科学进展。美国gydF4y2Ba110gydF4y2Ba, 1875-1880(2013)。gydF4y2Ba
Sugita, S.等。转录因子Hes1与钙/钙调素依赖性蛋白激酶2合作调节骨关节炎的发展。gydF4y2Ba自然科学进展。美国gydF4y2Ba112gydF4y2Ba, 3080-3085(2015)。gydF4y2Ba
奥夫奇尼科夫,D. A.,邓,J. M., Ogunrinu, G. & Behringer, R. R. col2a1介导的Cre重组酶在转基因小鼠软骨细胞分化中的表达。gydF4y2Ba《创世纪》gydF4y2Ba26gydF4y2Ba, 145-146(2000)。gydF4y2Ba
Glasson, s.s., Chambers, m.g., Van Den Berg, w.b.和Little, c.b. OARSI组织病理学倡议-小鼠骨关节炎的组织学评估建议。gydF4y2BaOsteoarthr。Cartil。gydF4y2Ba18gydF4y2Ba, s17-s23(2010)。gydF4y2Ba
Yasuhara, R.等。-连环蛋白信号在关节软骨浅带细胞表型表达和增殖中的作用。gydF4y2Ba实验室Investig。gydF4y2Ba91gydF4y2Ba, 1739-1752(2011)。gydF4y2Ba
彼得森,k.a.等人。神经特异性Sox2输入和差异gli结合亲和力为sh定向的神经模式提供了上下文和位置信息。gydF4y2BaDev的基因。gydF4y2Ba26gydF4y2Ba, 2802-2816(2012)。gydF4y2Ba
Langmead, B, Trapnell, C, Pop, M. & Salzberg, S. L.人类基因组短DNA序列的超快速和记忆效率比对。gydF4y2Ba基因组医学杂志。gydF4y2Ba10gydF4y2Ba, r25(2009)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢J. Sugita、R. Homma、A. Ogikubo和K. Kaneko提供的技术援助。我们感谢Edanz大学的Ashleigh Cooper博士。gydF4y2Bahttps://jp.edanz.com/acgydF4y2Ba)来编辑这份手稿的草稿。本工作由JSPS KAKENHI资助号19H05654、19H05565、18KK0254、17H04310、20H03799、20K09428和20K09451支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
研究构思与设计:K.N.、h.h.、s.h.c.、T.S.数据收集:K.N.、s.h.c.、d.m.、Yuma M、m.k.、t.k.、y.i.、h.n.、m.yuji数据分析:K.N.、h.h.、h.o.、r.c.数据解释:K.N.、f.y.、r.c.、y.o.、n.t.、h.i.、j.h.、j.h.、y.t.、U.C.、s.t.、T.S. Runx2-cKO小鼠代:T.S. Runx2-FLAG小鼠代:h.h.、S.O.、U.C.论文起草:K.N.、T.S.所有作者校对并通过论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行评议信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Nagata, K., Hojo, H., Chang, S.H.gydF4y2Baet al。gydF4y2BaRunx2和Runx3在手术诱导的骨关节炎发展过程中对关节软骨细胞的调节存在差异。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6187(2022)。https://doi.org/10.1038/s41467-022-33744-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33744-5gydF4y2Ba
这篇文章是由gydF4y2Ba
骨关节炎:致病信号通路和治疗靶点gydF4y2Ba
信号转导和靶向治疗gydF4y2Ba(2023)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba